Method Article
Memeli Sperm Hücrelerinin Plazma Zarı Boyunca Elektrik Akımlarının Kaydedilmesi
Bu Makalede
Özet
Bu protokol, iyon kanalı aktivitesini doğrudan kaydetmek amacıyla, tüm hücre konfigürasyonunda memeli sperm hücrelerinden elektriksel kayıtların nasıl gerçekleştirileceğini açıklar. Yöntem, çeşitli sperm iyon kanallarının elektrofizyolojik profillerini tanımlamada etkili olmuş ve moleküler kimliklerini ve regülasyonlarını ortaya çıkarmaya yardımcı olmuştur.
Özet
Bir memeli organizmasının en küçük hücrelerinden biri olan bir sperm hücresinden gelen elektriksel aktivitenin kaydedilmesi, elektrofizyologlar için onlarca yıldır zorlu bir görev olmuştur. "Spermatozoan yama klempi" olarak bilinen yöntem 2006 yılında tanıtıldı. Tüm hücre ve hücreye bağlı konfigürasyonlarda iyon kanalı aktivitesinin doğrudan kaydedilmesini sağlamıştır ve sperm hücresi fizyolojisini ve çeşitli kalsiyum, potasyum, sodyum, klorür ve proton iyon kanallarının moleküler kimliğini tanımlamada etkili olmuştur. Bununla birlikte, tek spermatozoadan kayıt yapmak, elektrofizyolojide ileri düzeyde beceri ve eğitim gerektirir. Bu ayrıntılı protokol, adım adım prosedürü özetler ve sperm hücresinin büyüleyici fizyolojisini keşfetmek isteyen herkesin kullanımına sunmak için birkaç 'ticaretin püf noktasını' vurgular. Spesifik olarak, protokol insan ve fare sperm hücrelerinden kaydı tanımlar, ancak esasen herhangi bir türün herhangi bir memeli sperm hücresine uyarlanabilir. Protokol, sperm hücrelerinin izolasyonu, reaktiflerin ve ekipmanların seçimi, yüksek derecede hareketli hücrelerin immobilizasyonu, bir kayıt elektrodu ile sperm hücrelerinin plazma zarı arasında sıkı (Gigaohm) contanın oluşturulması, tam spermatozoan moduna geçiş (zorla girme olarak da bilinir) ve sperm hücresi kalsiyum iyon kanalının örnek kayıtları gibi bu tekniğin uygulanmasının önemli ayrıntılarını kapsar. CatSper, altı memeli türünden. Sperm yama klemp yönteminin avantajları ve sınırlamaları ile en kritik adımlar tartışılmıştır.
Giriş
Erwin Neher ve Bert Sakmann1 tarafından icat edilen geleneksel yama klempine benzer şekilde, sperm hücresi yama klempi, tek tek iyon kanalı aktivitesinin sorgulanmasının yanı sıra, tek hücre 2,3 içindeki tüm iyon kanalı popülasyonunun aktivitesinden kayıt yapılmasını sağlar. Yöntem, enzimatik hücre içi işlemlerden ayrılma dereceleri altında belirli bir iyon kanalı tipinin tanımlanmasına izin verir. Bu yöntem, elektrofizyolojik ve farmakolojik parmak izlerine dayalı olarak iyon kanalı aktivitesinin belirlenmesi için çok önemlidir ve bu nedenle güvenilir bir tanımlama stratejisi sağlar. Yöntemin dezavantajı, elektrojenik olmayan taşıyıcıları tespit edememesidir. Ek olarak, temel elektrofizyolojik eğitim, protokolün nüanslarını anlamaya yardımcı olur. Yama kelepçesi tekniğinde ustalaşmak ve bunu memeli spermatozoasına uygulamak için, temel yama kelepçesi literatürünüincelemenizi öneririz 4,5. Bu yazıda, ayrıntılı bir adım adım prosedür sunuyoruz ve bu tekniği sperm hücresi elektrofizyolojisi uygulamak isteyen herkes için anlaşılır ve erişilebilir kılan benzersiz uygulamaları vurguluyoruz.
İyon homeostazı, fizyolojik olarak önemli iyon gradyanlarını korumak, hücre içi kalsiyumu değiştirmek ve transmembran voltajını değiştirmek için büyük ölçüde iyon kanallarına ve iyon taşıyıcılarına dayanan sperm hücrelerinin temel bir fizyolojik işlevidir. İyon kanalları ve iyon taşıyıcıları, motilite, dişi üreme sisteminde navigasyon, spermatozoan olgunlaşması ve deniz organizmalarında yumurtaya doğru kemotaksis gibi temel sperm hücresi fonksiyonlarını düzenler 6,7,8,9,10,11,12 . Sperm hareketliliği yavaş yavaş edinilen bir süreçtir. Sperm hücreleri esas olarak testiste olgunlaşmaları sırasında ve bunun sonucunda epididimden geçişleri sırasında hareketsizdir. Motiliteleri, sperm hücresinin iç asitleşmesine yol açan asidik bir epididimal ortam tarafından sınırlandırılır. Bu, pH 6.0 13,14'ün altında çalışamadığı için aksonemin işlevini bozar. Bununla birlikte, seminal sıvılara veya daha alkali bir ortama maruz kaldığında, sperm hücre içi iyon konsantrasyonları ve sitoplazmik pH büyük değişikliklere uğrar ve spermatozoon hareketli hale gelir 15,16,17. Sperm kamçısının hareketi, aksonmal mikrotübüllerin18 kaymasını destekleyen ATP hidrolizi tarafından desteklenir ve bu işlem yüksek oranda pH'a bağlıdır14. Ek olarak, kamçı hareketi, intraflagellar kalsiyum ve cAMP 13,19,20,21,22,23,24'ün yükselmesiyle de kontrol edilir. Bu faktörler, yani sperm hücre içi kalsiyum konsantrasyonu [Ca2 +] i, pH, ATP ve cAMP, motilite değişikliklerine izin veren ana düzenleyici mekanizmalardır ve konsantrasyonları sperm iyon kanalları ve taşıyıcıları tarafından sıkı bir şekilde düzenlenir.
Sperm hücreleri, vücudun başka hiçbir yerinde bulunamayan bir dizi proteini ifade etmeleri bakımından benzersizdir. Dikkate değer örnekler, potasyum kanalı, Slo3 25,26,27,28,29 ve Sperm'nin Cat iyonik kanalı, CatSper 2,30,31,32 gibi sperm iyon kanallarıdır. Sonuncusu, memeli spermatozoa31'in ana kalsiyum kanalıdır ve hücre içi alkalizasyon 2,30,31,32,33,34 ile düzenlenir. CatSper ayrıca türe özgü ipuçları 7,35 tarafından düzenlenir ve sperm kamçısı 36,37,38 boyunca dörtgen uzunlamasına nanodomainlerde düzenlenir. Primatlarda CatSper, flagellar alkalinite, membran depolarizasyonu ve progesteron 3,39,40,41'in bir kombinasyonu ile aktive edilirken, murin CatSper aktivasyonu için progesteron gerekli değildir 2,39. Bu kanalın bir başka özelliği de çok parçalı organizasyonudur: CatSper en az 10 farklı alt birimden oluşan bir komplekstir 31,32,34,37,38,42,43,44,45,46,47. Bu tür karmaşık yapısı ve regülasyonunun özellikleri, bilinen herhangi bir heterolog ekspresyon sisteminde CatSper'in rekombinant ekspresyonunu engelledi ve bu nedenle CatSper'in fizyolojik karakterizasyonu, doğal ekspresyon sistemi olan sperm hücresi ile sınırlı kaldı. CatSper proteininin moleküler karakterizasyonu 2000 yılında D. Ren ve diğerleri tarafından seminal bir makalede elde edilmiştir. al.31, CatSper'ın iyi niyetli bir iyon kanalı olduğunun nihai kanıtı ancak 2006 yılında sperm yama kelepçesi yönteminin piyasaya sürülmesinden sonra mümkün olmuştur2. O zamandan beri bu teknik,sperm hücrelerinde 9,28,37,39,40,44,46,48-54 sperm hücrelerinde birçok iyon ileten yolun kesin karakterizasyonuna izin verdi.
İyon kanalı özelliklerini incelemek için kullanılan klasik ve en basit yöntem olan yama klemp tekniğinin, motiliteleri ve spesifik morfolojileri nedeniyle sperm hücrelerine uygulanamayacağına inanılıyordu (Şekil 1A). Spesifik olarak, sperm sitoplazmasının küçük hacmi ve sperm plazma zarının, spermin fibröz kılıfı ve çekirdeği gibi sert hücre içi yapılara sıkı sıkıya bağlanması, ana zorluklardı55. Bu iki yapısal özellik, plazma zarında önemli bir deformasyon veya hasar olmadan, yumurtaların koruyucu giysileri gibi yüksek viskoziteli ortamlardan nüfuz etmek üzere tasarlanmış ince, ok şeklinde bir hücre ile sonuçlanır.
Yama kelepçesi yönteminin ilk adımı, bir kayıt pipeti (bir cam mikropipet) ile hücre plazma zarı arasındaki sıkı sızdırmazlığın sağlanmasıdır. Bunu başarmak için, plazma zarı ile cam arasında mekanik olarak kararlı bir gigaseal oluşması için kayıt pipetinin içine yeterli miktarda plazma zarı çekmek gerekir. Plazma zarı esnek olmalı ve sert olmamalıdır (Şekil 1B). Yukarıda bahsedildiği gibi, sperm plazma zarının tüm yüzeyi, sitoplazmik damlacık olarak bilinen bölge dışında oldukça sıkı bir şekilde yapışıktır (Şekil 1A ve Şekil 2). Bu nedenle, spermin plazma zarının katı doğası, sıkı conta veya 'gigaseal' elde etmede ana engel olarak kabul edildi, çünkü iyi kayıtlar için >109 ohm gereklidir. Bununla birlikte, 2006 yılında sperm yama klemp tekniğinin tanıtılması2 bu engeli ortadan kaldırdı ve bu yöntem çeşitli memeli türlerinin sperm hücrelerine başarıyla uygulanabildi 2,41,51,56. Bu atılım, spermin orta parçası boyunca bulunan küçük bir yapı olan sitoplazmik damlacığa (CD)2,8 odaklanarak başarılmıştır (Şekil 1A ve Şekil 2) ve basitçe, baş ve kuyruğun geliştiği bir sperm hücresi öncüsü olan uzun spermatidin kalıntısıdır. İşlevsel olarak, hücrenin boşalma sırasında hücre dışı ozmolaritedeki değişikliklere uyum sağlamasına yardımcı olabilir. Önemli özellik, CD içindeki plazma zarının, bir gigaohm contası oluşturmak için pipetin içine çekilebilecek kadar esnek olmasıdır. Bu nedenle, sperm CD'si, sperm yüzeyinde başarılı bir gigaseal oluşumu elde edilebilecek ve sonuçta sperm hücresini elektriksel olarak bir yama kelepçe amplifikatörüne 2,8 bağlayan bir tam hücre moduna geçiş yapabileceği en iyi kısımdır. Belirtmek gerekir ki, önceki yayınlar sperm kafasında başarılı bir gigaseal oluşumu bildirmiştir, bu da hücreye bağlı konfigürasyonda 54,57,58,59 kayıt yapılmasını sağlar. Bununla birlikte, tüm hücre konfigürasyonundaki kayıtlar şimdiye kadar sadece CD bölgesinde gigaseal oluşumu gerçekleştirilerek rapor edilmiştir. Bu tam hücre modu, sperm hücrelerinin tüm hacmine elektriksel erişime izin verir ve bu nedenle, sperm kamçısında ve ayrıca sperm kafasında bulunan iyon kanalı aktivitelerinin tespit edilmesine izin verir. Geliştirilmesinden bu yana sadece birkaç yıl boyunca, sperm yama kelepçesi tekniği, sperm iyon kanallarını anlamamızda muazzam bir ilerleme kaydetmiştir ve şimdiye kadar sperm iyon kanallarının işlevselliğini doğrudan araştırmak için en sağlam tekniklerden biridir 9,28,37,39,40,44,46,48,49, 50,51,52,53 (Şekil 1).
Sperm yama kelepçesi, aşağıda belirtildiği gibi klasik yama kelepçesi tekniğinden bazı detaylarda farklılık gösterir. İlk olarak, sperm plazma zarının çoğu sert hücre içi yapıya sıkıca bağlıdır ve bu nedenle spermatozoaların pipete çekilecek neredeyse hiç "yedek" plazma zarı yoktur. Esnek olan tek bölge, birçok somatik hücrenin plazma zarına benzeyen CD zarıdır ve bu nedenle pipete kolayca çekilebilir. CD ile bir gigaohm contası oluşturmak için, sperm plazma zarının küçük bir kısmını mikropipetin ucuna çekmek için pipetin üst kısmında hafif emme ile negatif basınç oluşturulur (Şekil 1B). Zarın bu kısmı, pipetin ucuna Ω şeklinde bir istila oluşturur ve iç duvarları ile sıkı bir sızdırmazlık sağlar.
İkincisi, insan ve fare spermatozoasındaki sitoplazmik damlacık 1 ila 2 μm arasındadır (Şekil 1 ve Şekil 2). Bu nedenle, yama kelepçesi tekniğinin bu kadar küçük bir nesneye uygulanması, yüksek çözünürlüklü optikler gerektirir. Çoğu sperm yama kelepçesi teçhizatı, diferansiyel girişim kontrastı (DIC) veya Nomarski optik bileşenlerine sahip ters çevrilmiş bir mikroskop ile donatılmıştır (Şekil 2 ve Şekil 3). Sperm yama kelepçesi için DIC optiklerle donatılmış bir mikroskop kullanılması, daha geleneksel faz kontrastlı optiklere göre şiddetle tavsiye edilir, çünkü DIC'de görülen uzamsal bilgiler, bir yama pipetini küçük CD'ye yerleştirmede üstün hassasiyet elde etmeye yardımcı olur. Ayrıca, sayısal açıklığı 1,2 olan 60x suya daldırma objektifi veya benzer bir lens kullanmanızı öneririz. Bu objektif, çözelti içinde serbest yüzen sperm hücrelerinin gözlemlenmesine izin veren uzun bir çalışma mesafesine (0.28 mm) sahiptir (Şekil 2). Objektif ayrıca kapak kaymasının kalınlığına uyum sağlamak için bir ayar bileziğine sahiptir (0,13 ila 0,21 mm arasında değişken). Uzun çalışma mesafesi ve ayar bileziğinin bu kombinasyonu, iki adet 0,13 mm'lik kapak kızağı ile gözlem yapılmasını sağlar; Bir kapak fişi, kayıt odasının cam tabanı olarak işlev görür ve birikmiş sperm hücrelerinin bulunduğu 5 mm'lik lamel üstüne yerleştirilir. Aşağıda tartışıldığı gibi, sperm hücrelerini doğrudan kayıt odasının dibine değil, kolayca değiştirilebilen yuvarlak 5 mm'lik lamellere bırakmak, taze sperm hücrelerini kayıt odasına yüklemek için uygun bir yoldur.
Üçüncüsü, sperm yama kelepçesi teçhizatı, küçük (pikoamper aralığı) elektrik akımlarını ve membran potansiyelindeki küçük değişiklikleri kaydetmek için düşük gürültülü bir yama kelepçesi amplifikatörü ve bir sayısallaştırıcı ile donatılmalıdır. Bu ekipman en düşük amplifikatör gürültüsünü sağlamalıdır. Titreşimin olmaması, başarılı bir yama kelepçesi kaydının önemli bir parçasıdır. Sperm yama klemplemesi, bağımsız bir mikromanipülatör standından daha iyi stabilite sağlamak için ters çevrilmiş mikroskoba bir mikromanipülatör platformu ile bağlanabilen, sürüklenmeyen hassas bir mikromanipülatör gerektirir (Şekil 3A). Kurulumu test etmek için, bir kişi titreşim izolasyon masasının yakınında yerde yukarı ve aşağı zıpladığında bile pipet ucunda herhangi bir hareket (60x büyütmenin altında) görülmemelidir.
Protokol
Tüm deneyler, hayvan araştırmaları için NIH yönergelerine uygun olarak gerçekleştirildi ve UC Berkeley Hayvan Bakım ve Kullanım Komitesi (AUP 2015-07-7742) tarafından onaylandı ve hayvanların acı çekmesini en aza indirmek için her türlü çaba gösterildi. Açıklanan tüm yöntemler, Amerikan Veteriner Hekimler Birliği ve IACUC komitesinin Ötenazi Paneli'nin önerileri ile tutarlıdır. İnsan kaynaklı numuneleri kullanan tüm deneysel prosedürler, Kaliforniya Üniversitesi, Berkeley, IRB protokol numarası 2013-06-5395 İnsan Araştırmaları Komitesi tarafından onaylanmıştır.
1. Tam hücreli sperm yama-kelepçe kaydı için cam mikropipetler yapmak.
NOT: Sitoplazmik damlacığın küçük boyutu, ince uçlu cam mikropipetler gerektirir.
- Mikropipet üretimi için, dış çapı 1,5 mm, iç çapı 0,86 mm ve iç filamenti olan borosilikat cam kılcal damarlarla başlayın. Ucu bir mikropipet çekicinin üzerine çekin (Şekil 3B).
- Pipet ucunu şekillendirmek ve parlatmak için, bir an için ucun yakınına sıcak bir tel yerleştirin. Bu ateşle parlatma işlemini bir pipet parlatıcı kullanarak 100x büyütme altında gerçekleştirin (Şekil 3C,D).
- Pipet ucunun iç çapının yangın parlatmadan önce ~2 μm olduğundan ve uygun parlatmadan sonra ~0,5 μm'ye düşürüldüğünden emin olun.
NOT: Yalnızca kayıt gününde yapılan yeni çekilmiş pipetlerin kullanılması önerilir. Bu, pipet ucunda toz parçacıklarının birikmesini önler.
2. Teçhizatın kurulması
- Kayıt odasının montajı
- Laminer akışlı ve nispeten hızlı çözelti değişim oranlarına sahip düşük hacimli elmas şekilli bir perfüzyon odası kullanın (Şekil 4). Odayı bir manifold aracılığıyla yerçekimi beslemeli bir perfüzyon sistemine bağlayın (Şekil 5).
- Bir çözeltiyi kayıt odasından perfüze etmek için, perfüzyon odasını sekiz ayrı perfüzyon hattına bağlayan bir politetrafloroetilen manifoldu ile kendi kendine yapılan basit bir yerçekimi beslemeli perfüzyon sistemini monte edin.
NOT: Boru, plastikleştiricileri çözeltilere sızdırmamalıdır, çünkü bu tür kimyasallar sperm hücrelerinin60 normal işlevini önemli ölçüde etkileyebilir ve iyon kanalı aktivitesini61,62 değiştirebilir. Ana perfüzyon borusu olarak küçük çaplı bir politetrafloroetilen boru şiddetle tavsiye edilir. - Politetrafloroetilen boru oldukça sert olduğundan, politetrafloroetilen borunun üzerine oturan yüksek saflıkta silikon boru ile esnek bağlantılar yapın. Ek olarak, mineral yağ veya diğer yağlayıcı katkı maddeleri iyon kanalı kaydını engelleyebileceğinden, yağlayıcı içermeyen şırıngalar (örneğin, Luer Lock şırınga tipi) kullanın (Şekil 5).
- Bir agar köprüsünün montajı
- Kayıtlar sırasında sıvı bağlantı potansiyeli değişikliklerini önlemek için, bir agar köprüsü kullanarak referans elektrotun etrafındaki ortamı sabit tutun (Şekil 4).
- Bir agar köprüsü yapmak için, küçük bir Bunsen brülör ateşi altında bükerek L şeklinde bir cam kılcal damar yapın ve soğumaya bırakın.
- 1 M KCl'de% 1'lik bir agaroz çözeltisi yapın ve agaroz eriyene ve çözelti şeffaf hale gelene kadar mikrodalgada ısıtın. Hava kabarcıklarını önlemek için L şeklindeki cam kılcal damarı yukarıdaki solüsyonla dikkatlice doldurun ve oda sıcaklığına soğumaya bırakın. Agar köprüleri 1 M KCl'de +4 °C'de ~2 ay saklanabilir.
- Bir agar köprüsü kullanmak için, bir Ag/AgCl pelet referans elektrodunu 1 M KCl ile doldurun ve katılaşmış agarozun cam kılcal damardan dışarı fırlamasını önlemek için agar köprüsünü dikkatlice yerleştirin.
- Ardından, amplifikatör headstage telinin altın pimini (2 mm) referans elektrot 2 mm (altın) yuvasına yerleştirin ve L şeklindeki agar köprüsünün ucunu Şekil 4'te gösterildiği gibi perfüzyon odasına yerleştirin.
- Çözümler ve tarifler
NOT: Tüm reaktifler ve kimyasallar en yüksek saflıkta olmalıdır. Hazırlanan tüm solüsyonlar steril 0,22 μm PES filtreden süzülür ve 4 °C'de bir aya kadar saklanır. Ozmolaritenin tam olarak ayarlanmasının, başarılı yama kenetlemesi için bir ön koşul olduğuna dikkat edilmelidir.- İnsan tübüler sıvı (HTF) çözeltisini Tablo 1'de açıklandığı gibi hazırlayın. NaOH ile pH'ı 7.4'e ayarlayın. Ozmolarite, bir buhar basıncı ozmometresi kullanılarak ölçülen 280 ± 5 mOsm olmalıdır.
- Tablo 2'de verildiği gibi yüksek tuzlu su (HS) "banyosu" veya "hücre dışı" çözelti hazırlayın. NaOH ile pH'ı 7.4'e ayarlayın. Ozmolarite 320 ± 5 mOsm olmalıdır.
- Sezyum metansülfonat "banyosu" veya "hücre dışı" çözeltiyi Tablo 3'te tarif edildiği gibi hazırlayın. CsOH ile pH'ı 7.4'e ve ozmolariteyi 320 ± 5 mOsm'ye ayarlayın.
- Sezyum metansülfonat (CsMeSO3) hücre içi "pipet" çözeltisini hazırlamak için Tablo 4'ü izleyin ve CsOH ile pH'ı 7.4'e ayarlayın. Ozmolarite, HS çözeltisinden 10 mOsm daha yüksek olmalıdır.
3. Memeli spermatozoalarının izolasyonu ve saflaştırılması
NOT: 3-6 aylık C57BL / 6 erkek farelere CO2 soluyarak ve ardından servikal çıkık yaparak ötenazi yapın. Servikal çıkıktan hemen sonra farelerden doku toplama (kauda veya korpus epididim) yapın.
- Epididimal fare spermatozoasının izolasyonu
NOT: 3-6 aylık C57BL / 6 erkek farelere CO2 soluyarak ve ardından servikal çıkık yaparak ötenazi yapın. Servikal çıkıktan hemen sonra farelerden doku toplama (kauda veya korpus epididim) yapın.- Farenin alt karın bölgesini makasla açın ve her iki epididimidi de çıkarın.
- Bunları HS çözeltisi ile doldurulmuş 35 mm'lik bir hücre kültürü kabına yerleştirin (yüksek tuzlu çözelti, bakınız Tablo 2). Sperm hücreleri ile temastan önce HS çözeltisinin bir kısmının oda sıcaklığına önceden ısıtıldığından emin olun.
- Epididimitleri HS çözeltisi içeren yeni bir hücre kültürü kabına aktarın ve kalan tüm yağı iyice çıkarın.
- # 15 neşter bıçağı kullanarak epididimitleri kaput, korpus ve kauda olarak ayırın (Şekil 6).
- Her epididimin korpusunu (veya gerekirse kaudayı) HS çözeltisi içeren yeni bir hücre kültürü kabına aktarın. Sivri bir # 11 neşter bıçağı kullanarak epididimin izole edilmiş kısmında birden fazla kesi yapın.
- Epididimitlerin parçalarını birden fazla insizyonla 1.5 mL HS çözeltisi içeren 1.5 mL'lik bir mikrosantrifüj tüpüne aktarın.
- Süper ince Dumont tip 5a forseps kullanarak sperm hücrelerini epididimden çözeltiye kısaca çalkalayın. Epididimitleri atın ve tüpü 10 dakika oda sıcaklığında bırakın.
- Katı madde (sperm olmayan hücreler) tüpün dibine çökelene kadar bekleyin ve ardından süpernatanı başka bir 1.5 mL mikrosantrifüj tüpüne aktarın.
- Sperm karışımını oda sıcaklığında, 2 saate kadar havaya erişimi olacak şekilde saklayın, bu süre zarfında deneyler yapılabilir. İzole edilen spermler izolasyondan 3 saat sonra performanslarını kaybederler.
- Fare spermatozoasının kapasitasyonu
NOT: Tüm epididimal spermatozoalar yama klempi için uygundur, ancak sadece kauda epididiminden gelen spermatozoalar döllenme konusunda yetkin olacak kadar olgunlaşmıştır. Kaudal spermatozoa kapasitasyona uğrayabileceğinden, kaudal sperm hücrelerini kullanarak deneyler, özellikle sperm kapasitasyonu yapın.- Kaudal veya boşalmış spermatozoa üzerinde sperm toplama işlemi gerçekleştirin (bkz. adım 3.1.1-4).
- Adım 3.1.4'te açıklandığı gibi izole edilmiş kaudae'yi alın. ve adım 3.1.5'te açıklandığı gibi birden fazla kesi uygulayın. Caudae'yi 2 mL kapasitasyon çözeltisi ile 10 mm'lik bir hücre kültürü kabına aktarın.
- Kuyruk dokusunu bu kapasitasyon çözeltisinde başlangıçta 37 ° C ve% 5 CO2'de 10 dakika inkübe edin, daha sonra dokuyu atın ve salınan sperm hücrelerini 50-80 dakika daha inkübe edin.
NOT: Fare kaudal spermatozoasının in vitro kapasitasyonu 60-90 dakikalık inkübasyon ile elde edilir. Kapasitasyonlu sperm hücreleri, hiperaktivasyon olarak bilinen kamçılarının aşırı asimetrik bükülmesine dayanarak görsel olarak tanımlanır. Bu tip hareketlilik, spermatozoanın doğrusal olmayan bir şekilde yüzmesine izin verir.
- İnsan sperminin toplanması ve saflaştırılması
NOT: Bu olguda yaşları 21-38 arasında değişen toplam 21 sağlıklı gönüllüden taze semen örneği alınmış ve spermatozoa 48,63'te detaylı olarak anlatıldığı gibi oda sıcaklığında swim-up tekniği ile saflaştırılmıştır. Kısaca prosedür şu şekildedir:- Saflaştırılmadan önce sıvılaşmaya izin vermek için insan ejakülat örneklerini 60 dakika oda sıcaklığında bırakın (daha uzun süreler sperm kalitesini olumsuz etkileyebilir).
- Yaklaşık 7 mL HTF çözeltisini 50 mL'lik bir santrifüj tüpünde 37 ° C'ye önceden ısıtın. Ejakülatın hacmini görsel olarak değerlendirin - hacim 1 mL'den büyükse, birden fazla HTF çözeltisi tüpü hazırlayın.
- Tamponun yüzeyine meni tellerini kaldırmadan her tüpün dibine 1 mL sıvılaştırılmış ejakülatı dikkatlice yerleştirin. Semen-HTF arayüzü mümkün olduğunca net olmalıdır. Hava kabarcıklarından kaçının.
- Tüpleri, maksimum yüzey alanı için 45 ° 'lik bir açıyla tutan bir standa 1 saat boyunca 37 ° C'lik bir inkübatöre yerleştirin. İnkübatör bir CO2 inkübatörü ise, tamponun asitlenmesini önlemek için kapağı sıkıca kapatın (bu prosedür için CO2 gerekli değildir). Kuluçka sırasında, hareketli sperm yavaş yavaş HTF tamponunun yüzeyine doğru yüzecektir.
- 1 saat sonra, 15 mL'lik bir santrifüj tüpündeki tüm örneklerden en üstteki 1 mL fraksiyonu toplayın, böylece yama klempleme için en yüksek kalitede, oldukça hareketli spermi birleştirin. Kontaminasyonu önlemek için seminal plazmanın üzerinde kalan tüm süpernatan bırakan birkaç mL HTF'yi çıkarmaya çalışmayın. Saflaştırılmış hücre süspansiyonu, oda sıcaklığında birkaç saat saklanabilir.
NOT: Normal bir ejakülat, mL64 başına en az 15 x10 6 sperm hücresi içermelidir, ancak sperm sayıları örnekler arasında büyük farklılıklar gösterir. Düşük hücre sayısının engeli, saflaştırılmış sperm süspansiyonunun yama klemplemeden önce oda sıcaklığında 30-60 dakika bekletilmesiyle aşılabilir. Bu koşul altında, hücreler yavaş yavaş santrifüj tüpünün dibinde birikecek ve hücreleri kayıt odasına pipetleyebileceğiniz görünür bir hücre bulutu oluşturacaktır (aşağıya bakın).
- İnsan spermatozoasının kapasitasyonu
NOT: İnsan spermatozoasının in vitro kapasitasyonu, kapasitasyon çözeltisinde 4 saatlik inkübasyon ile gerçekleştirilebilir:% 20 fetal sığır serumu, HTF veya HS tamponlarında25 mM NaHCO3 48,51. Kapasitasyonlu sperm hücreleri, güçlü motilitelerine ve spermatozoanın doğrusal olmayan bir şekilde yüzmesine izin veren kamçının aşırı asimetrik bükülmesine dayanarak görsel olarak tanımlanabilir.- 2x kapasitasyon solüsyonu hazırlayın ve 1: 1'i sperm süspansiyonu ile karıştırın.
- En az 4 saat boyunca 37 ° C'de ve% 5 CO2'de inkübasyon yapın. Kapasitif hücrelerin yüksek bir yüzdesini sağlamak için, inkübasyon süresi 4 saatten kısa olmamalıdır.
4. Kaplama solüsyonunun hazırlanması (sadece insan sperm yama kelepçesi için gereklidir)
NOT: Önemli bir adım, içeri girmeden önce bağlı spermatozoonu lamel üzerinden kaldırmaktır. Bu adım sadece insan sperm hücreleri için gereklidir ve daha az yapışkan bir cam yüzey oluşturmak için cam lamellerin kaplanmasını gerektirir. Lamel kaplama, sperm hücrelerinin lamel üzerine yapışma olasılığını azaltır ve başarılı bir gigaseal oluşumundan sonra insan spermatozoasının cam lamel üzerinden kaldırılmasını sağlar.
- 200 μL ejakülatı 15 mL santrifüj tüpünde 5 mL HS çözeltisi içinde seyreltin.
- 5 dakika boyunca 300 x g'da döndürün ve süpernatanı çıkarın.
- Peleti 1 mL HS çözeltisi içinde yeniden süspanse edin ve bir mikrosantrifüj tüpüne aktarın.
- Su dolu bir sonikasyon banyosu kullanarak 25 ° C'de 10 dakika boyunca sonikasyon.
- 5 dakika boyunca 10.000 x g'da döndürün.
- Süpernatanı yeni bir mikrosantrifüj tüpüne aktarın ve kaplama için kullanın (talimatlar aşağıdadır).
5. Tüm sperm plazma zarından iyon iletkenliğinin kaydedilmesi.
- Lamel üzerine sperm takmak.
NOT: Yama kelepçesi kaydından önce, spermatozoalar 5 mm'lik yuvarlak kapak kızakları üzerine kaplanır.- İnsan hücreleriyle çalışıyorsanız, lamelleri keskin forseps kullanarak hazırlanan kaplama çözeltisine kısaca batırın.
- Dört kapak fişini 4 oyuklu bir plakanın tek bir kuyucuğuna yerleştirin ve 300 μL HS çözeltisi ile örtün. Kapak fişlerini 4 oyuklu plakanın dibine bantlayarak ve bir pipetörün plastik ucuyla iterek yüzmesini önleyin.
- İnsan (adım 3.3.5) veya fare spermatozoasının (adım 3.1.9) konsantre süspansiyonlarını, lamel üzerindeki 300 μL HS çözeltisi içinde depolama tüpünden (20-50 μL konsantre sperm) nazikçe yeniden süspanse edin.
- Spermatozoaların, başlarının lamel ile bağlanacağı kuyu dibinde biriktiğinden ve kamçılarının, kapak kaymasının hemen üzerindeki çözeltide kuvvetli bir şekilde dövüldüğünden emin olun. Kayıttan önce spermatozoanın oda sıcaklığında yaklaşık 10 dakika lamel üzerine çökelmesine izin vermek önemlidir.
NOT: İnsan spermatozoası zayıf bir şekilde bağlanırsa, adım 5.1.1'e geri dönün ve hazırlanan kaplama solüsyonunu HS solüsyonu ile seyreltin (1:20 ila 1:2'ye kadar). Bu adım, insan sperm preparatlarında yaygın olan değişken sperm motilitesine dayalı olarak farklı insan donörlerinden alınan sperm örneklerine ayarlanmalıdır.
- Kapak fişinin yerleştirilmesi
- Kuyudan hafifçe yapışmış hücrelere sahip bir lamel alın ve HS çözeltisi içeren kayıt odasının elmas şeklindeki bir kuyusuna yerleştirin (Şekil 4).
- Odayı durulamak ve odadaki kalıntıları ve fazla ayrılmış spermatozoaları temizlemek için HS solüsyonu ile doldurulmuş perfüzyon sistemini (Şekil 5) açın. Bu, kayıt pipetinin hücrelere ulaştığında temiz kalma olasılığını artıracaktır. Bu adım, lamel üzerine daha güçlü yapışma eğiliminde olan kapasitesiz hücrelerle çalışırken yararlıdır.
NOT: Kapasitif spermden kayıt yapılıyorsa, hazneye yeni bir örtü astarı yerleştirildikten hemen sonra perfüzyonu açmaktan kaçınılmalıdır. Kapasitasyonlu spermatozoalar kuvvetli motiliteye sahiptir ve sadece lamel üzerine gevşek bir şekilde yapışır. Bu nedenle, en fazla sayıda kapasitif spermin mevcut olduğundan emin olmak için, perfüzyonu açmadan önce ~ 10 dakika beklemek ve kapasitif spermatozoanın lamel üzerine yapışmasına izin vermek önemlidir. Uygun kapasitif hücre seçildikten ve bir gigaseal oluşturulduktan sonra, perfüzyon tekrar açılabilir.
- Yama klemp kaydı için bir sperm hücresinin seçimi.
- 600x büyütme kullanarak sitoplazmik damlacık ile uygun bir sperm hücresi bulun (aşağıya bakın). Bu, 10x büyütmeli mercekli yöntemlerde açıklandığı gibi 60x suya daldırma lengi kullanılarak yapılır. Korpus epididimden izole edilen sperm hücrelerinde, CD genellikle orta parçanın merkezine yakın bir yerde bulunur. Kaudal hücrelerde, CD genellikle halkaya yakın bulunabilir (Şekil 2C). İnsan spermi için CD boyun bölgesinde bulunur (Şekil 2A,B).
NOT: Ek olarak, mikroskobun çekilebilir 1.6x büyütme seçeneği, sperm morfolojisini yakından incelemek için kullanılabilir (büyütme 960x). - Sitoplazmik damlacığın oval olduğundan ve hafifçe uzatılmış (Şekil 2G), mil benzeri bir şekle sahip olduğundan emin olun. Çok yuvarlak ve büyütülmüş görünen CD'ler genellikle kırılgandır ve yama için uygun değildir (Şekil 2D,F).
- Sperm hücresi kısmen sabitlenecek, ancak CD ve kamçının geri kalanı kamçılı çırpma ile hareket etmeye devam edecek şekilde, baş lamel üzerine bağlı olarak hareketli bir spermatozoon seçin. Spermin başının lamele gevşek bir şekilde tutturulduğundan emin olun, böylece kamçı bir yandan diğer yana hareket ederken biraz döner.
NOT: Gigaohm contasının oluşmasından sonra ve tüm hücre moduna geçişten önce, spermatozoonun lamel çözeltisinden çözeltiye kaldırılması gerektiğinden, gevşek bağlanma önemlidir.
- 600x büyütme kullanarak sitoplazmik damlacık ile uygun bir sperm hücresi bulun (aşağıya bakın). Bu, 10x büyütmeli mercekli yöntemlerde açıklandığı gibi 60x suya daldırma lengi kullanılarak yapılır. Korpus epididimden izole edilen sperm hücrelerinde, CD genellikle orta parçanın merkezine yakın bir yerde bulunur. Kaudal hücrelerde, CD genellikle halkaya yakın bulunabilir (Şekil 2C). İnsan spermi için CD boyun bölgesinde bulunur (Şekil 2A,B).
- Bir gigaseal oluşturmak
NOT: Tüm hücre modunda monovalent CatSper akımlarını kaydetmek için, pipetler Cs-metansülfonat (pipet veya hücre içi olarak da adlandırılır) çözeltisi ile doldurulur (Tablo 4) - bu, 11 mV'luk bir pipet direnci verir (Şekil 7A), 0 mV ila 10 mV arasında bir voltaj adımı uygulandığında amplifikatör tarafından otomatik olarak hesaplandığı gibi. Pipetler, uygulamaya bağlı olarak başka solüsyonlarla da doldurulabilir. Pipet direncini azaltmak için çözeltilerin metansülfonat, Cl- , aspartat veya benzeri iyonlar gibi hareketli anyonlarla yapılması önerilir. Pipet çözeltisinin ozmolaritesi, banyo çözeltisinden 10 mOsm daha yüksek olmalıdır. Pipet çözeltisinin biraz daha yüksek tonisitesi, yama kelepçesi kaydı sırasında sperm hücrelerine erişim direncinin mümkün olduğunca düşük tutulmasına yardımcı olur.- Uygun morfolojiye sahip bir sperm hücresinin görsel seçiminden sonra (Şekil 2G), mikropipeti bir pipet solüsyonu ile doldurun (Tablo 4) ve pipet tutucusuna sabitleyin.
- Pipet ucunu kirlerden temiz tutmak için, pipet çözeltisinin, aşağıda "banyo" çözeltisi olarak da adlandırılan hücre dışı çözeltiye daldırıldıktan sonra uçtan dışarı akmasını sağlamak için U-tüp şeklindeki tertibatı kullanarak pipete pozitif basınç uygulayın (bkz. Tablo 2).
NOT: Koşullar izin veriyorsa, contanın sürekli perfüzyon altında oluşturulması şiddetle tavsiye edilir, çünkü bu koşul en temiz pipet ucunu sağlar. - Pipeti aşağı indirin ve ucunu banyo solüsyonuna daldırın (Tablo 2). Bu sırada pipet direnci ölçülebilir (Şekil 7A).
- Hücreyi net bir şekilde görselleştirmek için, pipetin ucunu, ucun açıklığı CD'ye doğru çapraz olarak (yaklaşık 45°) hizalanmış şekilde CD'nin üzerine yerleştirin.
- Pipetin ucunu, CD'nin birkaç μm yakınında aynı odak düzleminde olacak şekilde CD'ye doğru hızla indirin.
- Pipetin ucu CD'ye temas eder etmez, damlacığın bir kısmını uca taşımak ve elektrofizyolojide "emme olayı" olarak da bilinen bir gigaohm contası oluşturmak için "ağızlığı" kullanarak pipete negatif basınç uygulayın. Genellikle, pipet ucuyla ilk temastan sonra, kademeli olarak bir gigaohm sızdırmazlık elde etmek için pipetteki negatif basınç bir dakikaya kadar korunabilir.
- Gigaohm contasının (> 4-20 GΩ) başarılı bir şekilde oluşturulmasından sonra, spermatozoonu lamel den kaldırın (Şekil 7B).
NOT: Bu adım, uzunlukları nedeniyle kemirgen sperm hücreleri için gerekli değildir; Bununla birlikte, sperm kamçısının kısmen ayrılması, potansiyel pipet kaymasını hafifletmek için faydalıdır. İnsan sperm dekolmanı önemli bir adımdır, çünkü CD küçüktür (1 ~ 3 μm); Hücre lamel takılı bırakılırsa, deney sırasında pipetin hafif bir kayması bile CD'yi bozabilir. Spermatozoon kaldırıldıktan sonra, kamçı normalde atmaya devam ederken, hücre sadece mikropipete bağlanır.
- Zorla içeri girin ve tüm hücre moduna geçin.
- Tüm hücre moduna geçmeden önce amplifikatörün telafi modunu kullanarak başıboş kapasitans geçişlerini telafi edin (Şekil 7B). Başlangıçta kapasitans geçişlerini gözlemlemek için, membran potansiyelini 0 mV'de tutun ve "Membran Testi" aracını kullanarak 10 mV darbeler uygulayın (Şekil 7B).
- Çok hafif bir emiş ile birlikte kısa (1 ms) kademeli olarak artan (430 mV, ~650 mV artışlı) voltaj darbeleri uygulayarak bir alıştırma yapın ve tüm hücre moduna geçiş yapın (Şekil 7C).
NOT: Alıştırma darbelerini uygulamak için, yama kelepçesi yazılımında önceden programlanmış alıştırma protokolünü kullanın. Alıştırma voltajı darbeleri, amplifikatörün arkasındaki yüksek voltaj komut girişi (arkadan anahtarlı) kullanılarak spermatozoona uygulanır. - Her bir giriş voltajı darbesinin uygulanmasından sonra, daha büyük kapasitans geçişlerinin görünüp görünmediğini kontrol etmek için Membran Testi aracını başlatın.
NOT: Büyük kapasitans geçişlerinin varlığı (Şekil 7C), içeri girmenin meydana geldiğini ve hücrenin tüm kapasitansının ölçüldüğünü gösterir (insan spermi için ~ 1 pF ve murin spermi için ~ 2.5 pF veya daha fazla). - Tüm hücrenin kapasitansını ve erişim direncini belirlemek için Membran Test Aracını kullanarak büyük kapasitans geçişlerini takın.
NOT: Sperm hücresinin iç kısmının mikropipet solüsyonu ile verimli bir şekilde perfüzyonu ve ayrıca sperm plazma zarının güvenilir voltaj kelepçesi için erişim direnci mümkün olduğunca düşük olmalıdır. Erişim direnci genellikle Cs + /K + - ve NMDG bazlı hücre içi çözeltiler için sırasıyla 25-30 MΩ ve 50-70 MΩ'dur. - Başarılı bir şekilde içeri girdikten sonra, farklı bileşikler içeren çeşitli banyo solüsyonlarının (Şekil 8) uygulanması veya voltaj adımı (Şekil 8, Şekil 9) veya voltaj-rampa protokolleri kullanılarak kanal aktivitelerinin ölçülmesi gibi planlanan tüm hücre yama-kelepçe deneylerine devam edin. Zorla girme başarılı olmadıysa, adım 6.4.1'e geri dönün. Taze bir mikropipet seçerek ve başka bir uygun sperm hücresi seçerek.
Sonuçlar
Sperm yama kelepçesi yöntemi, CatSper kanalının doğrudan kaydedilmesini sağlar.
Yukarıda bahsedildiği gibi, CatSper kayıtları, sitoplazmik damlacığında yama pipeti ile memeli spermatozoonu arasında yüksek dirençli (gigaohm) bir sızdırmazlık sağlanarak gerçekleştirildi. İçeri girilip tüm hücre moduna geçildikten sonra, sperm başı ve kamçı da dahil olmak üzere sperm hücresinin tüm vücuduna ve iç kısmına tam elektriksel erişim sağlanır 2,8,39,51. Bu durum sonuçta sperm plazma zarı üzerinde bulunan herhangi bir aktif iyon kanalından kayıt yapılmasına izin verir. Ana permean iyon olarak sezyum veya sodyum içeren banyo nominal olarak iki değerlikli içermeyen (DVF) çözelti, monovalent CatSper akımlarının 2,8,39,51 kaydedilmesi için tercih edilir. CatSper kanalı, Ca2+ ve Ba2 + gibi iki değerlikli iyonları iletirken, CatSper gözeneğinden çok daha yavaş bir hızda hareket ederler ve bu da birkaç pikoamperin (~ 10-20 pA) zar zor tespit edilebilir iletkenliklerine neden olur.2,8,39,51. Bu nedenle, CatSper kanalı aracılığıyla tek değerlikli ve dolayısıyla daha büyük akımların ölçülmesi, akımı değerlendirmenin daha uygun bir yoludur (Şekil 8). CatSper'ın potasyum geçirgen olduğuna dikkat etmek önemlidir; bu nedenle, CatSper kanalı bloke edilmeli veya CatSper eksikliği olan sperm hücreleri, yalnızca sperm hücresi potasyum kanallarını incelemek istenen durumlarda kullanılmalıdır 2,3,8,28,65. Pipet ve banyo çözeltisinin iyon bileşimini değiştirerek, yalnızca belirli iyon kanalı tip(ler)inden seçici kayıt için koşullar oluşturulurken, belirli iyon kanalları seçici olarak hariç tutulabilir. Örneğin, pipet çözeltisine Cs + eklenmesi, sperm potasyum kanalları yoluyla iyon geçirgenliğinin engellenmesine neden olur.
CatSper kanalı, memeli türleri arasında farklı şekilde düzenlenir.
Farklı türlerin sperm hücreleri, morfolojileri ve iç düzenleyici yolları bakımından çeşitlidir66. İyon kanallarının, erkek ve dişi üreme sistemlerinin özel mikro ortamlarını yansıtacak şekilde benzersiz bir şekilde düzenlenmesi şaşırtıcı değildir. Sperm yama-klemp yöntemi, Şekil 9'da gösterildiği gibi murin2, sıçan56, insan39,51, sığır, yaban domuzu ve makak41 olmak üzere altı memeli türüne başarıyla uygulanmıştır. Bu deneyler için, yetişkin erkek rhesus makaklarından [Macaca mulatta] elde edilen sperm hücreleri, Kaliforniya Ulusal Primat Araştırma Merkezi'nden, Uluslararası Laboratuvar Hayvanları Bakımı Değerlendirme ve Akreditasyon Derneği (AAALAC) standartlarına uygun olarak, Kaliforniya Üniversitesi,Davis tarafından onaylanmış hayvan protokolleri kapsamında elde edildi.; ve tüm çalışmalar ABD Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak yürütülmüştür. Boğa ve yaban domuzu sperması, UCD Hayvan Bilimi Bölümü tesislerinden özel IACUC onayından muaf yan ürün olarak elde edildi ve tüm hayvanlar AAALAC onaylı tesislerde tutuldu. Boğa ve yaban domuzu sperması ticari kaynaklardan da elde edilebilir.
Primat (Rhesus makak) ve insan spermatozoası benzer CatSper kanal özellikleri ve regülasyonu göstermiştir. İlginç bir şekilde, CatSper'in progesteron aktivasyonu, primat spermatozoasına özgü gibi görünmektedir (Şekil 9 ve 41), çünkü yaban domuzu, boğa ve kemirgen spermleri, CatSper akımlarında herhangi bir progesteron ile uyarılmış değişiklik göstermemiştir. Boğa ve yaban domuzu spermatozoalarında, bazal CatSper kanal aktivitesi bile tespit edilebilir sınırların altındaydı (Şekil 9), bu türlerde kalsiyum akışının ve bunun sonucunda hiperaktivasyonun diğer kanallar/taşıyıcılar tarafından yönlendirildiğini veya CatSper kanallarının aktivasyonu için farklı bir doğal stimülatörün gerekli olduğunu düşündürmektedir. Boğa ve yaban domuzu sperm hücreleri de dahil olmak üzere burada bahsedilen tüm sperm türlerinde, sperm hücrelerinin iç kısmına tam elektriksel erişim sağlanmış ve hücreler, içeri girdikten sonra büyük kapasitans artefaktlarının ortaya çıkmasıyla açıkça görüldüğü gibi, tüm hücre modunda kaydedilmiştir (Şekil 7). Bu durum, fonksiyonel CatSper kanalının kolay kaydına izin verir ve yaban domuzu ve sığır spermatozoasında olmaması, bu kanalın ya bu türlerin sperm hücrelerinde bulunan henüz bilinmeyen bir endojen inhibitör tarafından bloke edildiğini ya da aktive edilmesi için spesifik bir modülatör gerektirdiğini gösterir. Bununla birlikte, bunlar ön deneylerdir ve bu türlerde CatSper kanalının fonksiyonel önemini sağlamak için yaban domuzu ve boğa sperm hücreleri için ek deneyler gerekecektir. Türler arasındaki bu geniş sperm iyon kanalı çeşitliliği spektrumu, sperm/yumurta büyüklüğü oranı, sperm büyüklüğü ile yumurta koruyucu giysiler arasındaki ilişki ile ilişkili olabilir veya diğer türler tarafından döllenmeye engel teşkil edebilir66.

Şekil 1: Memeli sperm morfolojik çeşitliliği. (A) Alt panel: bir spermatozoonun şematik gösterimi; hücresel bölmeler etiketlenmiştir. Üst paneller: Farklı türlerden spermatozoanın saat yönünde DIC görüntüleri: sıçan (Rn; Rattus norvegicus); fare (mm; Muş musculus); boğa (Bt; Bos boğa); yaban domuzu (Sd; sus scrofa domesticus); insan (Hs; Homo sapiens) ve rhesus makak (Mmu; Macaca mulatta). Ölçek çubuğu tüm DIC görüntüleri için geçerlidir. Ekler sitoplazmik damlacıkları gösterir. (B) Memeli sperm hücrelerinin yamalanması. Pipet ucu ile plazma zarı arasında başarılı bir sızdırmazlık oluşumu elde etmek için, plazma zarının bir kısmı pipet ucuna nazikçe emilir. Tam hücre moduna geçiş, uç ile hücre arasındaki plazma zarının yırtılmasıyla gerçekleştirilir (bu rakam8'den çoğaltılmıştır). Sağ panel: bir kayıt mikropipetine bağlı insan sperm hücreleri. (C) İnsan spermatozoonunun ve yama kelepçesi yöntemiyle insan sperm hücrelerinde incelenen bazı kamçılı iyon kanallarının yanı sıra ilettikleri iyonların şematik gösterimi. CatSper- kalsiyum iyon kanalı39,51; Hv1- proton kanalı 51,56,67; Slo3 / Slo1- potasyum kanalları 50,53,65,68; TRPV4- geçici reseptör potansiyel katyon kanalı vanilloid tip 448. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
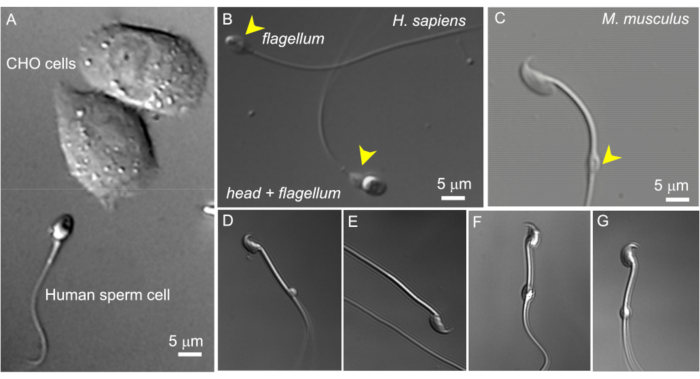
Şekil 2: Sperm boyutu ve sitoplazmik damlacıkların değişken morfolojisi. Bozulmamış canlı sperm hücrelerinin DIC görüntüleri. (A) Bir insan sperm hücresinin (altta) ve iki CHO hücresinin (üstte) boyutunun karşılaştırılması. (B) Bozulmamış insan (Homo sapiens) spermatozoon (altta) ve başsız bir sperm hücresi (flagellum, üstte). Sitoplazmik damlacıklar sarı ok uçları ile gösterilir; Bu rakam8'den yeniden üretilmiştir. (C) Sarı ok ucu ile gösterilen normal şekilli sitoplazmik damlacıklar (CD) ile sağlam murin (Mus musculus) spermatozoonu. (D-G) Epididimal murin sperm hücreleri, farklı boyut ve şekillerde sitoplazmik damlacıklara sahiptir; sadece (C) ve (G) yama kelepçesi için uygundur. (D) CD mikroskobik ve tek taraflıdır; (E) CD eksik; (F) CD'nin içinde kayıt pipetini tıkayabilecek parçacıklar varsa; (G) CD pürüzsüz, homojen ve şişmiş değil. Bu tür bir CD ile bir gigaseal oluşturmak muhtemelen başarılı bir kayıtla sonuçlanacaktır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Sperm yama kelepçesi teçhizat bileşenleri. (A) Temel bileşenlere sahip tipik sperm elektrofizyolojisi teçhizatı: (1) ters mikroskop; (2) düşük gürültülü sayısallaştırıcı; (3) amplifikatör; (4) bir mikromanipülatör platformu ile ters çevrilmiş mikroskoba bağlanan düşük sürüklenmeli mikromanipülatör; (5) PC bilgisayar; (6) titreşim sönümleyici bir hava tablası; (7) Kurulumu ortamdaki elektriksel parazitlerden korumak için Faraday kafesi. Bilgisayar klavyesi ve faresi de dahil olmak üzere teçhizatın elektrikle çalışan tüm bileşenlerinin düşük (50 Hz veya 60 Hz) elektrik gürültüsü üretmesi veya hiç üretmemesi ve teçhizatın tüm bileşenlerinin uygun şekilde topraklanması çok önemlidir. (B) Pipet fabrikasyonunu kaydetmek için kullanılan mikropipet çektirmesi. (C) (1) pipet ateşi parlatma için kullanılan microForge; (2) Dış çapı 1,5 mm, iç çapı 0,86 mm ve iç filamenti olan borosilikat cam kılcal damarlar; (3) pipet toplama kutusu. (D) Başarılı pipet ateşle parlatma aşamaları: (a) İç çapı 2 mm olan cilasız pipet; (b) İç çapı 0,5 mm olan ateşle parlatılmış pipet; (c) Aşırı cilalı sızdırmaz pipet kayıt için uygun değildir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Kayıt odası sisteminin bileşenleri ve montajı. (A) Kayıt odası sisteminin temel bileşenleri: (1) (2) iki aşamalı tutma kelepçeli seri 20 platformlar için mikroskop aşaması adaptörü; (3-4) PM serisi manyetik ısıtmalı platform, perfüzyon odasını tutmak için (3) manyetik kelepçeli; (5) perfüzyon odası; (6) agar köprüsü; (7) manyetik kelepçe, Ag / AgCl peletine 2 mm jaklı referans elektrodu; (8) emme hattı için manyetik tutucu (MAG-1); (9) emme borusu; (10) emme borusu O tutucusu. (B) (A)'da belirtilen bileşenlerle birleştirilmiş kayıt odası sistemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Perfüzyon sisteminin bileşenleri. (A) Monte edilmiş perfüzyon hattı ve (B) temel bileşenleri: (1) 20 mL ve 3 mL şırıngalar; (2) Luer bağlantılı musluk; 4 yönlü; erkek kilit; (3) Dişi Luer Hortum Diken Adaptörü, 1/16 "; (4) Politetrafloroetilen (PTFE) perfüzyon tüpü (Mikro Delikli PTFE Boru, 0.022 "ID × 0.042" OD); (5) Politetrafloroetilen 8 konumlu perfüzyon manifoldu; (6) Silikon konektör borusu (platinle sertleştirilmiş silikon boru, 1/32 "ID × 3/32" OD); (7) Manifold bağlantı borusu (PTFE Boru, 1/32 "ID × 1/16" OD). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Erkek fare diseksiyonu. (A) Murin erkek üreme organları; Hem testis hem de epididim gösterilmiştir. (B) Epididimitler, HS çözeltisi içeren 35 mm'lik bir hücre kültürü kabına aktarılır ve artık yağ ve vas deferens uzaklaştırılır. (C) Her epididim daha sonra bir # 15 neşter bıçağı kullanılarak kaput, korpus ve kauda olarak bölünür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Gigaseal oluşumu ve murin sperm hücresi ile zorla girme. Ticari yama kelepçesi yazılımının "Membran Testi" aracının arayüzü. Sperm yama klemplemesinin üç aşaması: (A) kaydedilen pipet, 14.8 MΩ'luk bir pipet direnci üreten bir banyo HS çözeltisine daldırılır; (B) Bir gigaseal oluşur (direnç 4.7 GΩ'dur), kapasitans geçişleri telafi edilir ve spermatozoon lamelden kaldırılır; (C) Tam hücre moduna geçiş. Alıştırma ve tüm hücre moduna geçiş, solda gösterildiği gibi hafif bir emme ile birlikte kısa (1 ms) kademeli olarak artan (430-650 mV, ~50 mV artışlı) voltaj darbeleri uygulanarak gerçekleştirilir. Alıştırma, hücrenin tüm kapasitansını yansıtan büyük kapasitans geçişlerinin görünümünden de anlaşılacağı gibi meydana gelmiştir (bu sperm hücresi için ~ 2.93 pF). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
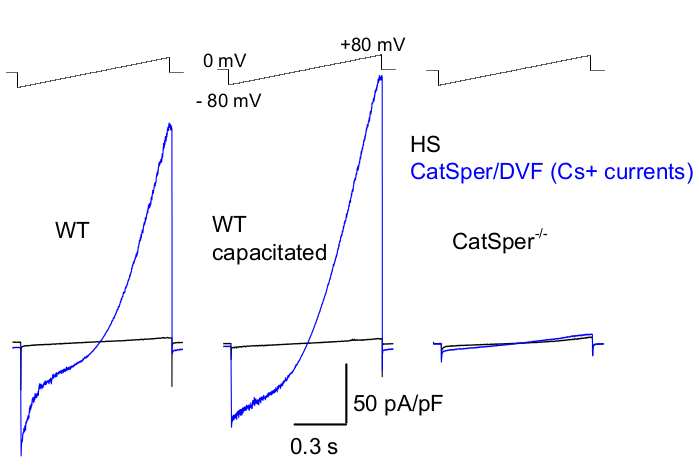
Şekil 8: Yabani tip (WT) kauda epididimal, kapasite ve CatSper nakavt spermatozoasından Murin CatSper kaydı. Tek değerlikli CatSper aktivitesini kaydetmek için, her 5 saniyede bir rampa protokolü uygulanır ve 0 mV 39,51'lik bir tutma potansiyelinden voltaj rampaları tarafından ortaya çıkan CatSper akımları uygulanır. Gerilim rampaları (-80 mV ila 80 mV; 850 ms) HS ve nominal olarak iki değerlikli olmayan çözeltide (DVF) uygulanır. Veriler 2-5 kHz'de örneklendi ve 1 kHz'de filtrelendi. Temel akımlar, yüksek hücre dışı magnezyum39,51 tarafından inhibisyon nedeniyle CatSper akımı üretmeyen HS çözeltisinde kaydedilir. Temel akımlar, sızıntı iletkenliğini (iyon olmayan kanal yolları) tahmin etmek için kullanışlıdır. Temsili, Cs + tam hücre CatSper akım yoğunlukları (pA / pF; mavi) kaudal WT murin sperm hücrelerinden (kapasitif olmayan; sol ve kapasite; orta) ve CatSper eksikliği olan kaudal murin sperm hücrelerinden (sağda) kaydedildi. Akımlar, 0 mV'luk bir tutma potansiyelinden gerilim rampaları ile ortaya çıkarıldı ve -80 mV'dan 80 mV'a kadar olan rampalar, HS ve nominal olarak iki değerlikli olmayan çözeltide uygulandı. HS çözümünde kaydedilen temel akımlar (siyah). Akım yoğunluklarını elde etmek için, CatSper akım genlikleri hücre kapasitansına (pA / pF) normalize edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
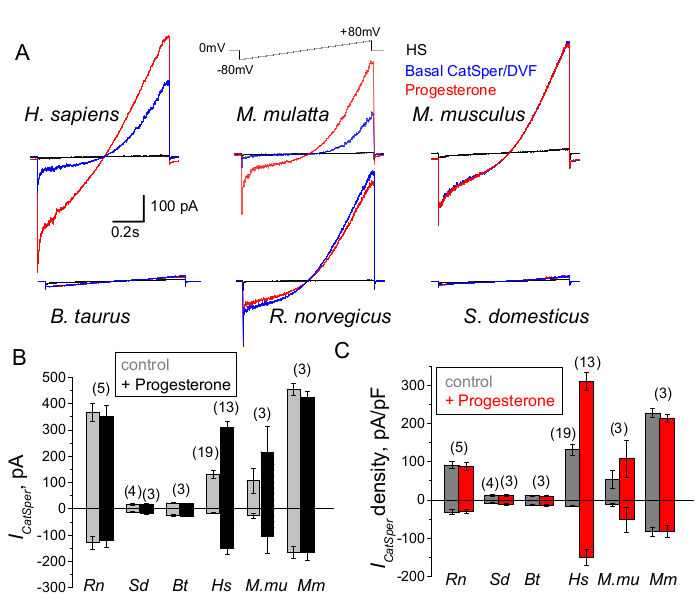
Şekil 9: Farklı memeli türlerinde CatSper'in progesteron regülasyonu. (A) Belirtildiği gibi bir voltaj rampa protokolü ile farklı türlerin sperm hücrelerinden ortaya çıkan temsili CatSper akımı. Tür: insan (Hs; Homo sapiens); rhesus makak (Mmu; M. mulatta), fare (Mm; M. musculus), boğa (Bt; B. boğa); sıçan (Rn; R. norvegicus); yaban domuzu (Sd; S. scrofa domesticus). 1 mM progesteronun yokluğunda (mavi) ve varlığında (kırmızı) CatSper akımları ve ayrıca HS çözeltisindeki (siyah) bazal akımlar kaydedildi. (B) CatSper akım genlikleri (ICatSper, pA) ve (C) Belirtildiği gibi farklı türlerin sperm hücrelerinden ortalama akım yoğunlukları (pA / pF) kayıtları; N, kullanılan bireysel sperm hücrelerinin sayısını gösterir. Veriler Ortalama +/- S.E.M. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 10: Kamçı motilitesindeki fark. Sitoplazmik damlacıklar ve kamçı motilitesinin iki temsili örneği. Aynı sıçan (Rn) ve insan (Hs) sperm hücrelerinin üst üste binen görüntüleri, en distal kamçı sapmasını gösterdikleri iki farklı zaman noktasında çekildi. Noktalı dikdörtgenler, sitoplazmik damlacıkların bulunduğu bölgeyi ve bunlara karşılık gelen uzamsal hareketliliği gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 11: U-tüp düzeneği ve temel bileşenleri. (A) U-tüpünün bileşenleri: (1) 10 mL serolojik pipet; (2) Silikon boru; (3) Silikon konektör borusu; (4) 1 mL şırınga; (5) Dişi luer diken adaptörü; (6) erkek Luer entegre kilit adaptörü 1/8 "; (7) Luer bağlantılı musluk; 4 yönlü; erkek kilit; (8) erkek Luer serisi diken adaptörü, 1/16 ". (B) Faraday kafesine bağlı tamamen monte edilmiş U-tüpü ve (C) U-tüpü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
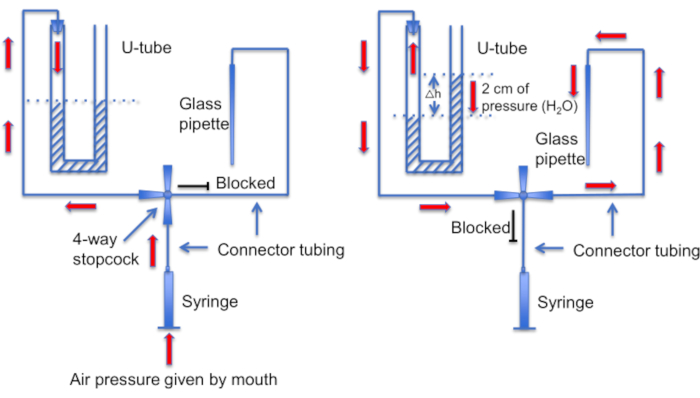
Şekil 12: U-tüp düzeneğinin şematik bir gösterimi. Sol panel: Pozitif hava basıncı, U-tüpündeki sıvı seviyelerinde bir fark yaratmak için ağız tarafından sağlanır. Sağ boynuzdaki sıvı seviyesi 2 cm artar. Bu seviye farkı oluşturulduktan sonra, U-tüpünü bir kayıt pipetine giden hatta bağlamak için musluk döndürülür. Sağ panel: Sağ kornadaki daha yüksek sıvı seviyesi, pipet solüsyonunu sürekli olarak pipet ucundan dışarı iten ve ucu kirlerden temiz tutan pozitif basınç oluşturur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Kimyasal | Molar ağırlık (g/mol) | Mm | 1L için g |
| NaCl (Doğal) | 58.44 | 97.8 | 5.72 gr |
| Kartal | 74.55 | 5 | 0.373 gr |
| KH2PO4 | 136.09 | 0.37 | 50.4 mg |
| MgSO4 x 7.H2O | 246.48 | 0.2 | 49.3 mg |
| CaCl2 x 2.H2O | 147.02 | 2 | 0.294 gr |
| HEPES ÜNİVERSİTESİ | 238.3 | 20 | 4.766 gr |
| Glikoz | 180.2 | 3 | 0.540 gr |
| Sodyum laktat (%60 a/a) | 112.06 | 20 | 3 ml |
| Sodyum piruvat | 110 | 0.4 | 44 mg |
Tablo 1: İnsan tübüler sıvı (HTF) çözeltisi
| Kimyasal | Molar ağırlık (g/mol) | Mm | 1L için g |
| NaCl (Doğal) | 58.44 | 135 | 7.889 gr |
| Kartal | 74.55 | 5 | 0.373 gr |
| CaCl2 x 2. H2O | 147.02 | 2 | 0.294 gr |
| MgSO4 x 7. H2O | 246.48 | 1 | 0.247 gr |
| HEPES ÜNİVERSİTESİ | 238.3 | 20 | 4.766 gr |
| Glikoz | 180.2 | 5 | 0.901 gr |
| Sodyum laktat (%60 a/a) | 112.06 | 10 | 1,5 ml |
| Sodyum piruvat | 110 | 1 | 0.110 gr |
Tablo 2: Yüksek Tuzlu (HS) Çözelti
| Kimyasal | Molar ağırlık (g/mol) | Mm | g (500 ml için) |
| CsMeSO3 | 228.0 | 140 | 15.960 gr |
| HEPES ÜNİVERSİTESİ | 238.3 | 40 | 4.766 gr |
| EDTA | 292.24 | 1 | 0.146 gr |
Tablo 3: CsMeSO3 banyo solüsyonu (İki Değerlikli Serbest banyo solüsyonu: DVF)
| Kimyasal | Molar ağırlık (g/mol) | Mm | mg (25 ml için) |
| CsMeSO3 | 228.0 | 130 | 741 mg |
| HEPES ÜNİVERSİTESİ | 238.3 | 70 | 417 mg |
| EDTA | 292.24 | 2 | 14.6 mg |
| EGTA (EGTA) | 380.35 | 3 | 28.5 mg |
| CsCl (İngilizce) | 1 M çözüm | 1 | 25 μl |
Tablo 4: CsMeSO3 pipet çözeltisi
Tartışmalar
Çeşitli türlerin sperm hücrelerinden elektrofizyolojik kayıtlar yapmak için ayrıntılı bir protokol tarif ediyoruz. Spermatozoa için iyon kanallarının ve elektrojenik taşıyıcıların fizyolojik önemi göz önüne alındığında, bu teknik, sperm hücresi fizyolojisinin yanı sıra erkek infertilitesine yol açan kusurları incelemek için güçlü bir araçtır. Deneyci bu tekniğin uygulanmasını ilk başta zor bulabilir, ancak azim ve dayanıklılıkla başarı gelir.
Memeli spermatozoaları uzun (genellikle >50 μm), dar ve oldukça hareketlidir. Memeli spermatozoasının bazal atım frekansı (BF), ortalama 4 Hz (fare 69), 7-15 Hz (yaban domuzu 70,71), 11 Hz (sıçan 72), 11-20 Hz (boğa 18), 24 Hz (rhesus makak 23) ve 25 Hz'e (insan 3) kadar olan değerlerle büyük ölçüde değişir. Sitoplazmik damlacık (CD), sperm hücrelerinden kayıt için giriş yoludur. Kemirgen spermatozoasında CD genellikle distaldir, ancak kamçı ile birlikte hareket eder (Şekil 10), bu da kayıt için ek bir engel oluşturur. Bununla birlikte, insan sperm hücrelerinde CD daha yaygın olarak başın yakınında bulunur. Bu nedenle, başarılı bir sperm yama kelepçesinin temel bileşenleri, CD'nin net ve keskin bir görünümünü sağlamak için mükemmel optikler ve sürüklenme veya titreşim olmadan son derece hassas bir mikromanipülatör sistemidir. Başlangıçta yüksek bir başarısızlık oranı beklenir ve sperm yama klempinin ilk birkaç günü içinde normaldir. Haftada çok sayıda denemeyi içeren rutin uygulama öneririz. Haftada günde birkaç kayıt elde etmek bir rutin oluşturacak ve motor becerileri geliştirecektir.
Yakın zamana kadar, sperm iyon kanallarının tanımlanması ve farmakolojik karakterizasyonu, doğrudan incelenememesi nedeniyle engelleniyordu. Alan büyük ölçüde, genellikle antikorların spesifik olmamasından ve / veya karşılık gelen genetik modellerin eksikliğinden muzdarip olan immünositokimya çalışmalarına dayanıyordu. Kalsiyum kanallarını incelemek için, kendi avantajları ve sınırlamaları olan klasik kalsiyum görüntüleme yöntemi yaygın olarak kullanılmaktadır 73,74,75,76,77. Kalsiyum görüntüleme, orta-yüksek verimli çalışmalar 78,79,80,81 için geçerli olan ve daha az invaziv olan nispeten kolay bir yöntem olsa da, nispeten sağlam hücreler gerektirir ve bu nedenle, hücre içi sinyal kaskadlarından ayrılmış iyon kanallarının işlevini incelemek veya bunları kalsiyum iyon değiştiricilerinden ayırt etmek için bir engel teşkil eder. Ek olarak, membran potansiyelini kontrol etmek zordur ve bu nedenle voltaj kapılı kalsiyum kanallarının katkısını dışlamak daha zordur. Kalsiyum florometrinin çeşitli avantajları arasında, kalsiyum iyonu konsantrasyonundaki değişikliklerin hassas bir şekilde ölçülmesini sağlayan kalsiyum oranlı boyaların kullanılması yer alır. Aynı zamanda, bu boyaların duyarlılığının hücre içi pH'daki değişikliklere bağlı olarak değişebileceğinin farkında olunmalıdır.
Aşağıda, yöntemin sorun giderme adımları da dahil olmak üzere protokol içindeki kritik adımları açıklıyoruz. İstenmeyen iyonlarla (magnezyum veya ağır metaller gibi) küçük kontaminasyon bile monovalent akımların tespitini bozabileceğinden, deneysel çözeltilerin hazırlanması için sadece saf reaktiflerin kullanılması esastır. Sperm hücrelerinin küçük boyutu göz önüne alındığında, hücre başına nispeten düşük sayıda iyon kanalı beklenebilir. Bu nedenle, net akım birkaç pA ile birkaç yüz pA arasında değişir. Bu nedenle, küçük akımların algılanmasını sağlamak için teçhizatın dahili elektriksel gürültüsü minimum düzeyde olmalıdır ve sapma içermeyen ekipmanların kullanılması şiddetle tavsiye edilir. Belirli bir iletkenliği elektriksel gürültü ve arka plan sızıntısından ayırt etmek için, kayıt cihazı ve topraklama sistemi en üst düzeye çıkarılmalıdır. Bu, herhangi bir elektriksel paraziti önlemek için teçhizatın uygun şekilde topraklanmasıyla elde edilir82. Bina ışıkları ve duvar içi elektrik kabloları gibi çeşitli elektrikli cihazların ürettiği elektriksel parazitlerden korunmak için bir Faraday kafesinin kullanılması şiddetle tavsiye edilir. Bilgisayar klavyesi ve fare de dahil olmak üzere teçhizatın elektrikle çalışan tüm bileşenlerinin çok az (50 Hz veya 60 Hz) elektrik gürültüsü yayması veya hiç yaymaması ve teçhizatın tüm bileşenlerinin uygun şekilde topraklanması önemlidir. Tüm iyon kanalları kapalıyken tüm hücre konfigürasyonundaki elektriksel gürültü < 0.5-1 pA olmalıdır.
Bir diğer önemli nokta, çalışma çözeltilerinin doğru ozmolaritelerinin izlenmesidir. Hücre içi ve hücre dışı çözeltilerin bileşimi kesin olarak belirlenmeli ve ozmolariteleri doğru bir şekilde ölçülmelidir. Hücre dışı çözelti, pipet çözeltisine kıyasla biraz hipotonik olmalıdır, çünkü küçük hücre şişmesine yol açar ve pipetin sperm zarı tarafından tıkanmasını önler. Not: Pipet çözeltisi çok hipertonikse ve banyo çözeltisinden 10 mOsm'den fazla farklıysa, aşırı hücre şişmesi ve conta yırtılması meydana gelir. Sonuç olarak, hücre kırılgan olacak ve gigaseal içeri girdikten sonra saniyeler içinde kaybolacaktır. Deneyimlerimize göre, yanlış çözelti hazırlama, başarılı yama sıkıştırmayı engelleyen en yaygın hatalardan biridir.
Kaçınılması gereken bir diğer potansiyel engel, plastikleştirici/ftalat içeren plastik ve ayrıca mineral yağla yağlanmış şırıngalardır. Çözeltilerle karşılaşan borular, şırıngalar ve tüm plastik ekipmanlar ve dolayısıyla sperm hücreleri, plastikleştiricileri veya diğer çevresel toksinleri veya yağları sızdırmamalıdır, çünkü bu tür kimyasallar iyon kanalı aktivitesini önemli ölçüde değiştirebilir. Ana perfüzyon hattı olarak küçük çaplı Teflon boru kullanıyoruz. Teflon (PTFE) az sayıda sızabilir bileşiğe sahiptir, ancak oldukça serttir. Esnek bağlantılar, Teflon borunun üzerine oturan yüksek saflıkta silikon borudan yapılmıştır. Perfüzyon sistemi için kullanılan tüm şırıngalarda herhangi bir yağlayıcı yoktur, çünkü mineral yağ veya diğer yağlama katkı maddeleri iyon kanalı kaydını engelleyebilir.
Doğru camı kullanmanın ve doğru mikropipet şeklini çekmenin önemini ne kadar abartsak azdır. Bu nedenle, cam mikropipetlerin en uygun şekilde üretilmesi, başarılı yama için bir ön koşuldur. Daha iyi çözelti dolumu için sadece filament içeren borosilikat camdan yapılmış cam mikropipetler kullanıyoruz. Pipetlerin ucu, ideal sıkı sızdırmazlığı sağlamak için ateşle parlatılmalıdır. Çapı 2 μm'yi aşan (ve dolayısıyla 10 MΩ veya daha düşük bir dirence sahip) pipet uçları genellikle sperm hücresi yama kelepçesi için uygun değildir.
Bir diğer önemli adım, conta oluşumundan önce mikropipet ucunun herhangi bir kalıntı veya hava kabarcığından temiz tutulmasını sağlamaktır. Mikropipetin hareketli hücrelerle dolu bir çözeltiye yüklendiği göz önüne alındığında bu zor bir iştir. Pipetin serbest yüzen sperm hücrelerine kazara "çarpmasını" önlemeye yardımcı olan bir faktör, tüm yapışmayan hücreleri yıkamak için sürekli bir perfüzyon kullanmaktır. Başka bir alet, ucu temiz tutmak için pozitif ve negatif basınç modları arasında geçiş yapılmasına izin veren ev yapımı bir "U-tüpüdür" (Şekil 11 ve Şekil 12).
Sperm hücreleri, sitoplazmik damlacıklarının (CD) şekli ve boyutu bakımından büyük farklılıklar gösterdiğinden, uygun morfolojiye sahip bir damlacık seçmek önemlidir. Şekil 2'de gösterildiği gibi, yalnızca küçük (1-3 μm), pürüzsüz, homojen ve aşırı şişmemiş CD'ler yama kelepçesi için uygundur. Küçük, tek taraflı; "şişirilmiş", tamamen şeffaf CD'ler zayıf veya hiç sızdırmazlık sağlamaz. İçinde büyük çözünür parçacıklar bulunan CD'ler kayıt pipetini tıkayabilir. Testis fare spermatozoaları epididimise girdiğinde, CD'leri boyun bölgesinde, başa yakın bir yerde bulunur. Epididimden geçerken, CD'leri orta parça boyunca hareket eder ve sonunda spermatozoa kauda epididimine ulaştığında orta parça ile ana parça (halka) arasındaki bağlantıya ulaşır. Bu nedenle, yukarıda bahsedildiği gibi, korpus epididimden izole edilen sperm hücrelerinde, CD genellikle orta parçanın merkezine yakın bir yerde bulunur. Kaudal hücrelerde, CD genellikle halkaya yakın bulunabilir (Şekil 2C). İnsan spermi için CD boyun bölgesinde bulunur (Şekil 2A,B).
Bu, laboratuvar hayvanlarından izole edilen spermatozoa için bir sorun olmasa da, insan donörleri arasında önemli değişkenlik vardır. Aynı donör içindeki sperm kalitesindeki değişiklik esas olarak sperm plazma zarının kalitesini etkiler ve bazen conta oluşumunu nispeten zorlaştırır. İyon kanalı davranışı ve farmakolojisinde daha az değişkenlik vardır, bu faktörler muhtemelen bireysel genetik veya fizyoloji ile ilişkilidir. Kalıcı olmak ve birden fazla gün boyunca çeşitli bağışlardan alınan örnekleri değerlendirmek ve birden fazla insan bağışçı katılımcısına güvenmek gerekir. İnsan materyali ile çalışmak ekstra sabır gerektirir, çünkü bağışlanan sperm, çeşitli çevresel faktörlere bağlı olarak aynı donör içindeki sperm kalitesinde büyük farklılıklar gösterir. Bağışçı durumu hakkında nihai bir karar vermek için çeşitli bağış günlerinden alınan örnekleri değerlendirmenizi öneririz. Boşalmış saflaştırılmış spermatozoalar genellikle saatler içinde (insan spermi için izolasyondan 12 saat sonrasına kadar) elektrofizyoloji için uygun iken, epididimal murin sperm hücreleri izolasyondan sonra sadece 2 saatlik bir pencere içinde yama için uygundur.
Ve son olarak, ama en az değil, gigaseal oluşumu sperm hücreleri arasında farklılık gösterir. Murin / kemirgen sperm hücreleri için, gigaseal oluşumu neredeyse anında gerçekleşirken, bir insan spermi ile bir gigaseal oluşturmak için birkaç saniye (ve bazen bir dakikaya kadar) gerekir. Genellikle ilk emme, 200 MΩ ila 800 MΩ arasında değişen bir giriş direnci ile sonuçlanır. Tutma potansiyelini -60 mV'a değiştirmek ve 10 mV'a kadar "Membran Testi" kısa darbeleri sağlamak genellikle gigaseal oluşumunun kurtarılmasına yardımcı olur (pipetteki membranın voltaj alanı kaynaklı hareketi yoluyla).
Sperm hücresi yama kelepçesi tekniği, belirli iyon kanallarının doğal ifade sistemlerinde ayrıntılı olarak incelenmesini sağlar. Tekniğin başarısı uygun ekipmana, yüksek kaliteli canlı sperm hücrelerine, saf reaktiflere, temel elektrofizyoloji becerilerine, sabra ve sebata bağlıdır. Yöntem, iyon kanalının evrimsel çeşitliliğini, düzenleme mekanizmalarını ve erkekten dişi üreme sistemine geçerken ve pH ve ligandlar gibi dışsal koşullar tarafından değiştirilirken işlevlerindeki değişiklikleri inceleyerek sperm fizyolojisinde yeni sınırlar açar.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma NIH Grant R01GM111802, Pew Biomedical Scholars Award 00028642, Alfred P. Sloan Award FR-2015-65398 ve Packer Wentz Endowment Will (PVL'ye) tarafından desteklenmiştir. Bu çalışma aynı zamanda Deutsche Forschungsgemeinschaft (Alman Araştırma Vakfı) 368482240/GRK2416 (N.M.'ye) ve Çin Burs Konseyi B.L. Bursu tarafından da desteklenmiştir. Sıçan dokusunu paylaştığı için Dr. Dan Feldman'a, primat sperm hücrelerinin elde edilmesinde yardım için UC Davis'ten Katie Klooster ve Stuart Meyers'e ve yaban domuzu ve boğa sperm hücrelerinden veri toplama analizinde yardım için Steven Mansell'e teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
Referanslar
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. Ion Channels of Excitable Membranes 3rd Edition. , Sinauer Associates - an imprint of Oxford University Press. (2001).
- Molleman, A. An Introductory Guide to Patch Clamp Electrophysiology. , John Wiley & Sons Ltd. (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082(2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130(2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153(2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53(2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853(2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438(2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426(2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5(2019).
- World Health Organization. World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009(2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212(2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır