Method Article
记录穿过哺乳动物精子细胞质膜的电流
摘要
该协议描述了如何在全细胞配置中对哺乳动物精子细胞进行电记录,目的是直接记录离子通道活性。该方法有助于描述几个精子离子通道的电生理特性,并有助于揭示它们的分子身份和调节。
摘要
几十年来,记录哺乳动物生物体中最小的细胞之一 - 精子细胞 - 的电活动一直是电生理学家的一项具有挑战性的任务。被称为“精子膜片钳”的方法于 2006 年推出。它能够直接记录全细胞和细胞附着构型中的离子通道活性,并有助于描述精子细胞生理学以及各种钙、钾、钠、氯和质子离子通道的分子身份。然而,从单个精子进行记录需要高级技能和电生理学培训。这个详细的协议总结了分步程序,并强调了几个“交易技巧”,以便任何希望探索精子细胞迷人生理学的人都可以使用。具体来说,该协议描述了来自人类和小鼠精子细胞的记录,但基本上可以适应任何物种的任何哺乳动物精子细胞。该协议涵盖了该技术应用的重要细节,例如精子细胞的分离、试剂和设备的选择、高度运动细胞的固定、在记录电极和精子细胞质膜之间形成紧密 (Gigaohm) 密封、过渡到全精子模式(也称为磨合),以及精子细胞钙离子通道的示例性记录, CatSper,来自六种哺乳动物。讨论了精子膜片钳方法的优点和局限性,以及最关键的步骤。
引言
与 Erwin Neher 和 Bert Sakmann 发明的传统膜片钳类似1,精子细胞膜片钳能够检测单个离子通道的活性,以及记录单个细胞内整个离子通道群的活性 2,3。该方法允许在与酶促细胞内过程解耦的程度下识别特定的离子通道类型。该方法对于基于其电生理学和药理学指纹图谱测定离子通道活性至关重要,因此提供了一种可靠的鉴定策略。该方法的缺点是无法检测非电原转运蛋白。此外,基本的电生理学训练有助于理解协议的细微差别。要掌握膜片钳技术并将其应用于哺乳动物精子,我们建议学习基本的膜片钳文献 4,5。在本文中,我们提供了一个详细的分步程序,并重点介绍了使该技术易于理解并可供任何希望进行精子细胞电生理学的人使用的独特做法。
离子稳态是精子细胞的一项基本生理功能,它严重依赖离子通道和离子转运蛋白来维持生理上重要的离子梯度、改变细胞内钙和改变跨膜电压。离子通道和离子转运蛋白调节精子细胞的基本功能,例如运动、女性生殖道导航、精子成熟,以及在海洋生物中,向卵子的趋化性 6,7,8,9,10,11,12 .精子活力是一个逐渐获得的过程。精子细胞在睾丸成熟期间和随后通过附睾期间主要处于静止状态。它们的运动受到酸性附睾环境的抑制,导致精子细胞内部酸化。这会损害轴丝的功能,因为它在 pH 值 6.0 以下无法发挥作用13,14。然而,当暴露于或碱性更强的环境中时,精子的细胞内离子浓度和细胞质 pH 值会发生重大变化,精子变得运动 15,16,17。精子鞭毛的运动由 ATP 水解提供动力,ATP 水解支持轴丝微管的滑动18,并且这个过程高度依赖于 pH 值14。此外,鞭毛运动也受鞭毛内钙和 cAMP升高 13、19、20、21、22、23、24 的控制。这些因素,即精子细胞内钙浓度 [Ca2+]i、pH、ATP 和 cAMP 是允许运动变化的主要调节机制,它们的浓度受到精子离子通道和转运蛋白的严格调节。
精子细胞的独特之处在于它们表达许多在身体其他任何地方都找不到的蛋白质。值得注意的例子是精子离子通道,例如钾通道 Slo3 25,26,27,28,29 和 Sperm 的 Cat 离子通道 CatSper 2,30,31,32。后者是哺乳动物精子31 的主要钙通道,受细胞内碱化 2,30,31,32,33,34 的调节。CatSper 还受物种特异性线索 7,35 的调节,并沿精子鞭毛组织在四边形纵向纳米结构域 36,37,38 中。在灵长类动物中,CatSper 被鞭毛碱度、膜去极化和黄体酮的组合激活 3,39,40,41,而对于小鼠 CatSper 激活,不需要黄体酮 2,39。该通道的另一个具体特点是其多亚基组织:CatSper 是至少 10 个不同亚基31、32、34、37、38、42、43、44、45、46、47 的复合物.其调节的这种复杂结构和细节阻碍了 CatSper 在任何已知的异源表达系统中的重组表达,因此 CatSper 的生理特征仅限于其天然表达系统——精子细胞。虽然 CatSper 蛋白的分子表征是由 D. 任 等人在 2000 年的开创性论文中实现的。al.31 中,只有在 2006 年引入精子膜片钳方法后,才有可能证明 CatSper 是真正的离子通道2。从那时起,这项技术允许精确表征精子细胞中的许多离子传导途径 9,28,37,39,40,44,46,48-54。
研究离子通道特性的经典和最直接的方法 - 膜片钳技术 - 被认为不适用于精子细胞,因为它们的运动性和特定形态(图 1A)。具体来说,精子细胞质的微小体积和精子质膜与刚性细胞内结构(如精子的纤维鞘和细胞核)的紧密附着是主要挑战55。这两个结构特征导致纤细的箭头形细胞,旨在穿透高粘度环境,例如鸡蛋的保护衣,而不会对质膜造成明显变形或损伤。
膜片钳方法的第一步是在记录移液管(玻璃微量移液器)和细胞质膜之间建立紧密密封。为了实现这一点,必须在记录移液器内拉动足够的质膜,以便在质膜和玻璃之间形成机械稳定的 gigaseal。质膜必须是柔性的而不是刚性的(图 1B)。如上所述,精子质膜的整个表面都相当紧密地粘附,除了称为细胞质液滴的区域(图 1A 和图 2)。因此,精子质膜的刚性被认为是获得紧密密封或“gigaseal”的主要障碍,之所以这样命名,是因为良好的记录需要 >109 欧姆。然而,2006 年2 年引入精子膜片钳技术消除了这一障碍,这种方法可以成功应用于几种哺乳动物物种的精子细胞 2,41,51,56。这一突破是通过关注细胞质液滴 (CD)2,8 实现的,细胞质液滴是沿着精子中段发现的微小结构(图 1A 和图 2),它只是细长精子细胞的残余物——一种精子细胞前体,头部和尾部从中发育。从功能上讲,它可能有助于细胞适应射精过程中细胞外渗透压的变化。重要特征是 CD 内的质膜足够灵活,可以被吸入移液器中形成千兆级密封。因此,精子 CD 是精子表面最好的部分,通过它可以成功形成 gigaseal 并过渡到全细胞模式,最终将精子细胞电偶联到膜片钳放大器 2,8。值得注意的是,以前的出版物报道了在精子头部成功形成 gigaseal,这使得能够在细胞附着构型 54,57,58,59 中进行记录。然而,到目前为止,仅在 CD 区域进行 gigaseal 形成报道了全细胞配置的记录。这种全细胞模式允许对整个体积的精子细胞进行电访问,因此可以检测位于精子鞭毛和精子头部的离子通道活动。自开发以来的短短几年内,精子膜片钳技术在我们对精子离子通道的理解方面取得了巨大进步,是迄今为止直接研究精子离子通道功能的最强大的技术之一 9,28,37,39,40,44,46,48,49, 50,51,52,53(图 1)。
精子膜片钳在一些细节上与传统的膜片钳技术有所不同,如下所述。首先,大部分精子质膜紧紧地附着在刚性的细胞内结构上,因此,精子几乎没有“备用”质膜可以被吸入移液管中。唯一灵活的区域是 CD 的膜,它类似于许多体细胞的质膜,因此可以很容易地吸入移液器中。为了与 CD 形成千兆级密封,通过在移液器顶部轻吸产生负压,以便将一小部分精子质膜吸入微量移液器的尖端(图 1B)。这部分膜在移液器尖端形成Ω形内陷,并与移液器内壁形成紧密密封。
其次,人和小鼠精子中的细胞质液滴在 1 到 2 μm 之间(图 1 和 图 2)。因此,将膜片钳技术应用于如此小的物体需要高分辨率的光学元件。大多数精子膜片钳装置都配备了带有微分干涉对比 (DIC) 或 Nomarski 光学元件的倒置显微镜(图 2 和 图 3)。强烈建议使用配备 DIC 光学元件的显微镜进行精子膜片钳,而不是更传统的相差光学元件,因为在 DIC 中看到的空间信息有助于在将膜片移液管定位到微小 CD 上时实现卓越的精度。我们还建议使用 60 倍水浸物镜或类似镜头,数值孔径为 1.2。该物镜具有较长的工作距离 (0.28 mm),允许观察溶液中自由游动的精子细胞(图 2)。物镜还有一个调节环,用于调整盖玻片的厚度(从 0.13 到 0.21 mm 不等)。长工作距离和调节环的这种组合可以通过两个 0.13 mm 的盖玻片进行观察;一个盖玻片用作记录室的玻璃底部,带有沉积精子细胞的 5 mm 盖玻片放在顶部。如下所述,将精子细胞沉积在易于更换的圆形 5 mm 盖玻片上,而不是直接存放在记录室的底部,是将新鲜精子细胞加载到记录室中的便捷方法。
第三,精子膜片钳装置必须配备低噪声膜片钳放大器和数字化仪,以记录微小(皮安范围)电流和膜电位的微小变化。该设备必须确保最低的放大器噪声。无振动是膜片钳成功记录的重要组成部分。精子贴片夹钳需要一个无漂移的精密显微作器,该显微作器可以通过显微作器平台连接到倒置显微镜上,以确保比独立的显微作器支架更好的稳定性(图 3A)。为了测试设置,即使有人在隔振台附近的地板上上下跳动,也不应看到移液器吸头的任何移动(放大倍率在 60 倍下)。
研究方案
所有实验均按照 NIH 动物研究指南进行,并经加州大学伯克利分校动物护理和使用委员会 (AUP 2015-07-7742) 批准,尽一切努力减少动物的痛苦。所有描述的方法都与美国兽医协会和 IACUC 委员会的安乐死小组的建议一致。所有利用人类来源样品的实验程序均已获得加州大学伯克利分校人类研究委员会的批准,IRB 协议编号 2013-06-5395。
1. 制作用于全细胞精子膜片钳记录的玻璃微量移液器。
注意:细胞质液滴的小尺寸需要带有细头的玻璃微量移液器。
- 对于微量移液器的制造,从外径为 1.5 mm、内径为 0.86 mm 和内细丝的硼硅酸盐玻璃毛细管开始。拉动微量移液器拉拔器上的尖端(图 3B)。
- 对于移液器吸头的成型和抛光,请将热线放在吸头附近片刻。使用移液器抛光机在 100 倍放大倍率下执行此火焰抛光过程(图 3C,D)。
- 在火抛光之前,确保移液器吸头的内径为 ~2 μm,并在适当抛光后减小到 ~0.5 μm。
注意:仅建议使用记录当天新鲜提取的移液器。这避免了灰尘颗粒在移液器吸头上积聚。
2. 设置钻机
- 记录室的组装
- 使用具有层流和相对较快溶液交换速率的低容量菱形灌注室(图 4)。通过歧管将腔室连接到重力馈送灌注系统(图 5)。
- 要通过记录室灌注溶液,请组装一个简单的自制重力进料灌注系统,该系统带有一个聚四氟乙烯歧管,该歧管将灌注室连接到八条独立的灌注管线。
注意:管子不应将增塑剂浸出到溶液中,因为此类化学物质会显着影响精子细胞60 的正常功能并改变离子通道活性61,62 。强烈建议使用小口径聚四氟乙烯管作为主要灌注管。 - 由于聚四氟乙烯管相当坚硬,因此使用高纯度硅管在聚四氟乙烯管上安装柔性连接。此外,使用不含润滑剂的注射器(例如,Luer Lock 注射器型),因为矿物油或其他润滑剂添加剂会干扰离子通道记录(图 5)。
- 组装琼脂桥
- 为避免记录过程中液接电位变化,请使用琼脂桥保持参比电极周围的环境稳定(图 4)。
- 要制作琼脂桥,请在小本生灯火下弯曲制成 L 形玻璃毛细管,并让它冷却。
- 在 1 M KCl 中制备 1% 琼脂糖的溶液,并在微波炉中加热,直到琼脂糖熔化,溶液变得透明。小心地将上述溶液填充 L 形玻璃毛细管,以避免气泡,并使其冷却至室温。琼脂桥可以在 +4 °C 下在 1 M KCl 中储存 ~2 个月。
- 要使用琼脂桥,请用 1 M KCl 填充 Ag/AgCl 颗粒参比电极,并小心插入琼脂桥,以避免凝固的琼脂糖从玻璃毛细管中弹出。
- 接下来,将放大器头线的金针 (2 mm) 插入参比电极 2 mm(金)槽中,并将 L 形琼脂桥的末端插入灌注室,如图 4 所示。
- 解决方案和配方
注意:所有试剂和化学品必须具有最高纯度。所有制备的溶液通过无菌 0.22 μm PES 过滤器过滤,并在 4 °C 下储存长达一个月。应该注意的是,渗透压的精确调整是成功膜片钳的先决条件。- 如 表 1 所述制备人肾小管液 (HTF) 溶液。用 NaOH 将 pH 值调节至 7.4。渗透压应为 280 ± 5 mOsm,使用蒸气压渗透压计测量。
- 如 表 2 所示,准备高盐水 (HS) “浴”或“细胞外”溶液。用 NaOH 将 pH 值调节至 7.4。渗透压应为 320 ± 5 mOsm。
- 如 表 3 所述,准备甲磺酸铯“浴”或“细胞外”溶液。用 CsOH 将 pH 值调节至 7.4,将渗透压调节至 320 ± 5 mOsm。
- 要制备甲磺酸铯 (CsMeSO3) 细胞内“移液器”溶液,请按照 表 4 作,并用 CsOH 将 pH 调节至 7.4。渗透压应比 HS 溶液高 10 mOsm。
3. 哺乳动物精子的分离和纯化
注意:通过吸入 CO2 然后颈椎脱位对 3-6 个月大的 C57BL/6 雄性小鼠实施安乐死。颈椎脱位后,立即从小鼠身上进行组织收集(尾部或附睾体)。
- 附睾小鼠精子的分离
注意:通过吸入 CO2 然后颈椎脱位对 3-6 个月大的 C57BL/6 雄性小鼠实施安乐死。颈椎脱位后,立即从小鼠身上进行组织收集(尾部或附睾体)。- 用剪刀打开小鼠的下腹部区域,并提取两个附睾。
- 将它们放入装有 HS 溶液(高盐溶液,见 表 2)的 35 mm 细胞培养皿中。确保在与精子细胞接触之前将等分试样的 HS 溶液预热至室温。
- 将附睾转移到含有 HS 溶液的新细胞培养皿中,并彻底去除所有残留脂肪。
- 使用 #15 手术刀刀片将附睾分为 caput、corpus 和 cauda(图 6)。
- 将每个附睾的体(或尾部,如果需要)转移到含有 HS 溶液的新细胞培养皿中。使用尖头的 #11 手术刀刀片在附睾的孤立部分做多个切口。
- 将具有多个切口的附睾部分转移到含有 1.5 mL HS 溶液的 1.5 mL 微量离心管中。
- 使用超细 Dumont 5a 型镊子将附睾中的精子细胞短暂摇晃到溶液中。弃去附睾胺,将试管在室温下放置 10 分钟。
- 等到固体物质(非精子细胞)沉淀到管底部,然后将上清液转移到另一个 1.5 mL 微量离心管中。
- 将精子混合物在室温下储存,可接触空气长达 2 小时,在此期间可以进行实验。分离的精子在分离后 3 小时失去其性能。
- 小鼠精子获能
注意:所有附睾精子都适合膜片钳,但只有来自附睾尾部的精子才足够成熟,可以受精。由于尾部精子可以获能,因此使用尾部精子细胞进行实验,特别是精子获能。- 对尾部或射出的精子进行精子采集(参见步骤 3.1.1-4)。
- 按照步骤 3.1.4 中的说明分离尾部。并按照步骤 3.1.5 中的说明应用多个切口。将尾部转移到装有 2 mL 获能溶液的 10 mm 细胞培养皿中。
- 最初将尾部组织在这种获能溶液中在 37 °C 和 5% CO 2 下孵育 10 分钟,然后丢弃组织并将释放的精子细胞再孵育 50-80 分钟。
注意:小鼠尾部精子的体外获能是通过 60-90 分钟的孵育实现的。获能的精子细胞根据其鞭毛的过度不对称弯曲(称为过度激活)进行视觉识别。这种类型的运动使精子能够以非线性方式游泳。
- 采集和纯化人类精子
注意:在这种情况下,总共从 21 名 21-38 岁的健康志愿者和通过室温游泳技术纯化的精子中获得新鲜精液样本,如48,63 中详细描述的那样。简而言之,程序如下:- 将人射精样品在室温下放置 60 分钟,以便在纯化前液化(较长的时间可能会对精子质量产生负面影响)。
- 在 50 mL 离心管中将约 7 mL 的 HTF 溶液预热至 37 °C。目视评估射精量 - 如果射精量大于 1 mL,请准备多管 HTF 溶液。
- 小心地将 1 mL 液化射精垫在每根管的底部,不要将精液束提升到缓冲液表面。精液到 HTF- 界面应尽可能清晰。避免气泡。
- 将试管置于 37 °C 培养箱中 1 小时,支架将其保持 45° 角以获得最大表面积。如果培养箱是 CO2 培养箱,请盖紧盖子以防止缓冲液酸化(此程序不需要 CO2 )。在孵育过程中,活动精子将逐渐游向 HTF 缓冲液的表面。
- 1 小时后,在 15 mL 离心管中收集所有样品中最高的 1 mL 馏分,从而结合最高质量、高度运动的精子进行膜片钳。不要尝试去除所有上清液 - 在精浆上方留下几 mL 的 HTF,以避免污染。纯化的细胞悬液可在室温下储存数小时。
注意:正常射精应至少含有 15 x 106 个精子细胞/mL64,但样本之间的精子数量差异很大。在膜片钳之前,可以通过将纯化的精子悬液在室温下静置 30-60 分钟来克服低细胞计数的障碍。在这种情况下,细胞将逐渐积聚在离心管底部并形成可见的细胞云,您可以从中将细胞移液到记录室中(见下文)。
- 人类精子获能
注:人精子的体外获能可以通过在获能溶液中孵育 4 小时来完成:20% 胎牛血清,25 mM NaHCO3 在 HTF 或 HS 缓冲液中48,51。获能的精子细胞可以根据其剧烈的运动和鞭毛的过度不对称弯曲来目视识别,这使得精子能够以非线性方式游泳。- 制备 2x 获能溶液,并与精子悬液以 1:1 混合。
- 在 37 °C 和 5% CO 2 下孵育至少 4 小时。为确保高百分比的获能细胞,孵育时间应不短于 4 小时。
4. 准备涂层溶液(仅人类精子膜片钳需要)
注意:一个重要的步骤是在磨合之前从盖玻片中取出附着的精子。此步骤仅对人类精子细胞是必需的,并且需要涂覆玻璃盖玻片以产生粘附性较低的玻璃表面。盖玻片涂层降低了精子细胞粘附在盖玻片上的可能性,并允许在成功形成 gigaseal 后将人类精子从玻璃盖玻片中取出。
- 在 15 mL 离心管中的 5 mL HS 溶液中稀释 200 μL 射。
- 以 300 x g 离心 5 分钟并去除上清液。
- 将沉淀重悬于 1 mL HS 溶液中,并转移到微量离心管中。
- 使用充满水的超声浴在 25 °C 下超声处理 10 分钟。
- 以 10,000 x g 离心 5 分钟。
- 将上清液转移到新鲜的微量离心管中,用于包被(说明如下)。
5. 记录来自整个精子质膜的离子电导。
- 将精子附着在盖玻片上。
注意:在膜片钳记录之前,将精子接种在 5 mm 圆形盖玻片上。- 如果处理人体细胞,请使用锋利的镊子将盖玻片短暂浸入准备好的涂层溶液中。
- 将四个盖玻片放入 4 孔板的单个孔中,并用 300 μL HS 溶液覆盖。将盖玻片贴在 4 孔板的底部,用移液器的塑料尖端推动,防止盖玻片漂浮。
- 将储存管中的人(步骤 3.3.5)或小鼠精子(步骤 3.1.9)的浓缩悬浮液(20-50 μL 浓缩精子)轻轻重悬于盖玻片上方的 300 μL HS 溶液中。
- 确保精子积聚在孔底部,它们的头部将附着在盖玻片上,并且它们的鞭毛将在盖玻片上方的溶液中剧烈跳动。在记录之前,重要的是让精子在室温下沉淀到盖玻片上约 10 分钟。
注:如果人类精子附着不良,请返回步骤 5.1.1 并用 HS 溶液(1:20 至高达 1:2)稀释制备的包被溶液。必须根据人类精子制备中常见的可变精子活力,根据来自不同人类供体的精子样本调整此步骤。
- 放置盖玻片
- 从孔中取出一个带有略微粘附细胞的盖玻片,放入含有 HS 溶液的记录室的菱形孔中(图 4)。
- 打开装满 HS 溶液的灌注系统(图 5)以冲洗腔室并从腔室中清除碎屑和多余的分离精子。这将增加记录移液器在到达细胞时保持清洁的可能性。当使用往往更牢固地粘附在盖玻片上的无容量细胞时,此步骤很有帮助。
注意:如果从有容量的精子中记录,则必须避免在将新的盖玻片放入腔室后立即打开灌注。有容量的精子具有旺盛的运动能力,仅松散地附着在盖玻片上。因此,为确保有最大数量的有能力的精子可用,重要的是等待 ~ 10 分钟,让有能力的精子粘附在盖玻片上,然后再开启灌注。一旦选择合适的获能细胞并形成 gigaseal,就可以重新打开灌注。
- 选择用于膜片钳记录的精子细胞。
- 使用 600 倍放大倍率找到带有细胞质液滴的合适精子细胞(见下文)。这是使用 60 倍水浸透镜完成的,如使用 10 倍放大目镜的方法中所述。在从附睾体分离的精子细胞中,CD 通常位于靠近中段中心的位置。在尾部细胞中,CD 通常可以在环附近找到(图 2C)。对于人类精子,CD 位于颈部区域(图 2A、B)。
注意:此外,显微镜的拉出式 1.6 倍放大选项可用于仔细检查精子形态(放大 960 倍)。 - 确保细胞质液滴是椭圆形的,并且具有略微拉长(图 2G)的纺锤形。看起来非常圆和增大的 CD 通常很脆弱,不适合修补(图 2D,F)。
- 选择头部附着在盖玻片上的运动精子,这样精子细胞部分固定,但 CD 和鞭毛的其余部分继续随着鞭毛跳动而移动。确保精子的头部松散地附着在盖玻片上,以便当鞭毛从一侧移动到另一侧时,它会旋转一点。
注意:松散的附着很重要,因为在形成千兆密封后和过渡到全细胞模式之前,必须将精子从盖玻片上提升到溶液中。
- 使用 600 倍放大倍率找到带有细胞质液滴的合适精子细胞(见下文)。这是使用 60 倍水浸透镜完成的,如使用 10 倍放大目镜的方法中所述。在从附睾体分离的精子细胞中,CD 通常位于靠近中段中心的位置。在尾部细胞中,CD 通常可以在环附近找到(图 2C)。对于人类精子,CD 位于颈部区域(图 2A、B)。
- 形成 gigaseal
注:为了在全细胞模式下记录单价 CatSper 电流,移液器中填充 Cs-甲磺酸盐(也称为移液器或细胞内)溶液(表 4)- 这产生 11-17 MΩ 的移液器电阻(图 7A),由放大器在施加 0 mV 至 10 mV 的电压步长时自动计算。移液器也可以根据应用填充其他溶液。建议使用移动阴离子(如甲磺酸盐、Cl- 、天冬氨酸或类似离子)制备溶液,以降低移液器阻力。移液管溶液的渗透压应比浴液高 10 mOsm。移液器溶液的张力略高有助于在膜片钳记录期间保持尽可能低的进入精子细胞的阻力。- 在目视选择具有适当形态的精子细胞(图 2G)后,用移液器溶液(表 4)填充微量移液器并将其固定到移液器支架中。
- 为了保持移液器吸头清洁,使用 U 型管形状组件对移液器施加正压,以确保移液器溶液浸入细胞外溶液(也称为“浴”溶液)后从吸头流出(见 表 2)。
注意:如果条件允许,强烈建议在持续灌注下形成密封,因为这种情况可以确保移液器吸头最干净。 - 放下移液器并将其尖端浸入浴液中(表 2)。此时,可以测量移液器阻力(图 7A)。
- 为了清楚地观察细胞,将移液器的尖端放在 CD 上方,使尖端开口对角线(约 45°)对准 CD。
- 快速将移液器的尖端朝 CD 方向降低,使其处于同一焦平面上,距离 CD 几微米。
- 一旦移液器的尖端接触到 CD,就使用“吸嘴”对移液器施加负压,使部分液滴进入吸头并形成千兆级密封 - 在电生理学中也称为“吸力事件”。通常,在初次接触移液器吸头后,移液器中的负压可以保持长达一分钟,以逐渐达到千兆级密封。
- 成功形成千兆密封 (> 4-20 GΩ) 后,从盖玻片中取出精子(图 7B)。
注意:由于啮齿动物精子细胞的长度,此步骤不需要;然而,精子鞭毛的部分分离有利于减轻潜在的移液器漂移。人体精子分离是必不可少的步骤,因为 CD 很小 (1~3 μm);如果细胞附着在盖玻片上,则在实验过程中即使移液器的轻微漂移也会破坏 CD。提取精子后,其鞭毛通常会继续跳动,而细胞仅附着在微量移液器上。
- 磨合并过渡到全细胞模式。
- 在过渡到全电池模式之前,使用放大器的补偿模式补偿杂散电容瞬变(图 7B)。要初步观察电容瞬变,请将膜电位保持在 0 mV 并使用“膜测试”工具施加 10 mV 脉冲(图 7B)。
- 通过施加短 (1 ms) 逐渐增加(430-650 mV,~50 mV 增量)的电压脉冲并结合非常轻的吸力(图 7C),执行磨合并过渡到全细胞模式(图 7C)。
注:要应用 磨合 脉冲,请使用膜片钳软件中先前编程的磨合协议。使用放大器背面的高压命令输入(后置开关)将磨合电压脉冲施加到精子上。 - 在施加每个磨合电压脉冲后,启动 Membrane Test 工具以检查是否出现更大的电容瞬变。
注意:大电容瞬变的存在(图 7C)表明已经发生磨合,并且正在测量细胞的整个电容(人类精子为 ~1 pF,小鼠精子为 ~2.5 pF 或更高)。 - 使用 膜测试 工具拟合大电容瞬变,以确定整个电池的电容及其访问电阻。
注意:接触电阻应尽可能低,以便用微量移液器溶液对精子细胞内部进行有效灌注,以及精子质膜的可靠电压夹。对于基于 Cs+ /K+ - 和 NMDG- 的细胞内溶液,访问电阻通常分别为 25-30 MΩ 和 50-70 MΩ。 - 成功磨合后,继续进行计划的全细胞膜片钳实验,例如应用含有不同化合物的各种浴液(图 8)或使用电压步长(图 8、 图 9)或电压斜坡方案测量通道活性。如果闯入不成功,请返回步骤 6.4.1。通过选择新鲜的微量移液器并选择另一个合适的精子细胞。
结果
精子膜片钳方法允许直接记录 CatSper 通道。
如上所述,通过在贴片移液器和哺乳动物精子的细胞质液滴处建立高电阻 (gigaohm) 密封来进行 CatSper 记录。在闯入并过渡到全细胞模式后,获得对精子细胞的整个身体及其内部(包括精子头和鞭毛)的完全电访问2,8,39,51。这种情况最终允许从位于精子质膜上的任何活性离子通道进行记录。含有铯或钠作为主要渗透离子的标称无二价 (DVF) 溶液更适合记录一价 CatSper 电流 2,8,39,51。虽然 CatSper 通道传导 Ca2+ 和 Ba2+ 等二价离子,但它们以更慢的速度通过 CatSper 孔,导致几乎无法检测到几皮安 (~10-20 pA) 的电导2,8,39,51。因此,通过 CatSper 通道测量单价电流,因此测量较大的电流是评估电流的更便捷方法(图 8)。需要注意的是,CatSper 也具有钾渗透性;因此,必须阻断 CatSper 通道,或者在只想研究精子细胞钾通道2、3、8、28、65 的情况下使用 CatSper 缺陷的精子细胞。通过改变移液器和浴液的离子组成,可以选择性地排除某些离子通道,同时为仅从特定离子通道类型中选择记录创造条件。例如,在移液器溶液中添加 Cs + 会导致通过精子钾通道的离子通透性受阻。
CatSper 通道在哺乳动物物种中的调节方式不同。
不同物种的精子细胞的形态和内部调节途径多种多样66。毫不奇怪,它们的离子通道也以反映雄性和雌性生殖道的特殊微环境的独特方式受到调节。精子膜片钳方法已成功应用于六种哺乳动物物种:鼠2、大鼠56、人 39,51、牛、野猪和猕猴41,如图 9 所示。对于这些实验,来自成年雄性恒河猴 [Macaca mulatta] 的精子细胞是从加利福尼亚国家灵长类动物研究中心获得的,符合国际实验动物护理评估和认证协会 (AAALAC) 的标准,根据加利福尼亚大学戴维斯分校批准的动物协议,如41 中所述;所有研究均按照美国国立卫生研究院 (U.S. National Institutes of Health) 的实验动物护理和使用指南进行。公牛和公猪精液作为副产品获得,无需从 UCD 动物科学系设施获得特定 IACUC 批准,所有动物都饲养在 AAALAC 批准的设施中。公牛和公猪精液也可以从商业来源获得。
灵长类动物 (Rhesus macaque) 和人类精子表现出相似的 CatSper 通道特性和调节。有趣的是,CatSper 的黄体酮激活似乎是灵长类精子独有的(图 9 和 41),因为公猪、公牛和啮齿动物的精子没有表现出任何黄体酮刺激的 CatSper 电流改变。在公牛和公猪精子中,甚至基底 CatSper 通道活性也低于可检测限度(图 9),这表明在这些物种中,钙内流和随之而来的过度激活是由其他通道/转运蛋白驱动的,或者需要不同的自然刺激剂来激活它们的 CatSper 通道。在本文提到的所有精子种类中,包括公牛和公猪精子细胞,都获得了对精子细胞内部的完全电访问,并且细胞以全细胞模式记录,这从磨合时出现的大电容伪影中可以明显看出(图 7)。这种情况允许轻松记录功能性 CatSper 通道,并且它在公猪和牛精子中的缺失表明该通道被这些物种精子细胞中存在的未知内源性抑制剂阻断,或者需要激活特定的调节剂。然而,这些是初步实验,需要对公猪和公牛精子细胞进行额外的实验,以确保 CatSper 通道在这些物种中的功能重要性。物种之间这种广泛的精子离子通道多样性可能与精子与卵子大小的比例、精子大小与卵子保护衣之间的关系有关,或者作为其他物种受精的障碍66。

图 1:哺乳动物精子形态多样性。(A) 底板:精子的示意图;蜂窝区室已标记。顶部面板:来自不同物种的精子的 DIC 图像按顺时针方向排列:大鼠 (Rn;Rattus norvegicus);小鼠 (Mm;Mus musculus);公牛 (Bt;Bos taurus);公猪 (Sd;sus scrofa domesticus);人类 (Hs;智人)和恒河猴 (Mmu;Macaca mulatta)。比例尺适用于所有 DIC 图像。插入片段指示细胞质液滴。(B) 哺乳动物精子细胞的修补。为了在移液器吸头和质膜之间成功形成密封,将部分质膜轻轻吸入移液器吸头中。通过破裂尖端和细胞之间的质膜来转移到全细胞模式(此图已从8 中复制)。右图:附着在记录微量移液器上的人类精子细胞。(C) 用膜片钳方法在人类精子细胞中研究的人类精子和一些鞭毛离子通道的示意图,以及它们传导的离子。CatSper- 钙离子通道 39,51;Hv1- 质子通道 51,56,67;Slo3/Slo1- 钾通道 50,53,65,68;TRPV4- 瞬时受体电位阳离子通道香草醛 4 型48。请单击此处查看此图的较大版本。
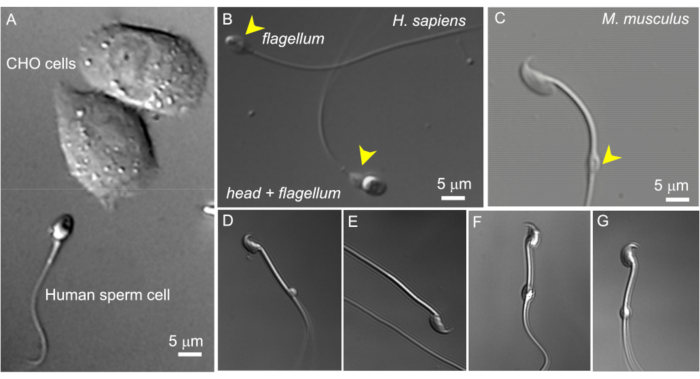
图 2:精子大小和细胞质液滴的可变形态。 完整活精子细胞的 DIC 图像。(A) 人类精子细胞(下)和两个 CHO 细胞(上)的大小比较。(B) 完整的人类(智人)精子(下图)和无头精子细胞(鞭毛,上部)。细胞质液滴用黄色箭头表示;此数字复制自8.(C) 完整的小鼠 (Mus musculus) 精子,黄色箭头指示正常形状的细胞质液滴 (CD)。(D-G)附睾鼠精子细胞具有不同大小和形状的细胞质液滴;只有 (C) 和 (G) 适用于膜片钳。(D) CD 是微观的单侧的;(E) CD 丢失;(F) CD 内部有颗粒,可能会堵塞记录移液器;(G) CD 光滑、均匀且不肿胀。使用这种类型的 CD 形成 gigaseal 可能会导致成功录制。 请单击此处查看此图的较大版本。

图 3:精子膜片钳支架组件。 (A) 具有基本组件的典型精子电生理支架:(1) 倒置显微镜;(2) 低噪声数字化器;(3) 放大器;(4) 低漂移显微纵器,通过显微纵器平台耦合到倒置显微镜;(5) PC 电脑;(6) 减振气台;(7) 法拉第笼,用于保护装置免受环境电气干扰。设备的所有电动组件(包括计算机键盘和鼠标)必须产生低电噪声(50Hz 或 60Hz)或零电噪声,并且设备的所有组件都正确接地。(B) 用于记录移液器制造的微量移液器拉拔器。(C) (1) 用于移液器火焰抛光的 microForge;(2) 外径 1.5 mm、内径 0.86 mm 且内细丝的硼硅酸盐玻璃毛细管;(3) 移液器收集盒。(D) 成功进行移液器火焰抛光的阶段:(a) 内径为 2 mm 的未抛光移液器;(b) 内径为 0.5 mm 的火焰抛光移液器;(c) 过度抛光的密封移液器不适合记录。 请单击此处查看此图的较大版本。

图 4:记录室系统的组件及其组件。 (A) 记录室系统的基本组件:(1) 用于 20 系列平台的显微镜载物台适配器,带有 (2) 两个载物台固定夹;(3-4) PM 系列磁加热平台,带 (3) 个磁夹,用于固定灌注室;(5) 灌注室;(6) 琼脂桥;(7) 磁性夹具,带 2 mm 插孔的参比电极,用于 Ag/AgCl 颗粒;(8) 用于吸入管路的磁性支架 (MAG-1);(9) 吸管;(10) 吸管 O 型支架。(B) 带有 (A) 中指示组件的组装记录室系统。 请单击此处查看此图的较大版本。

图 5:灌注系统的组成部分。 (A) 组装好的灌注管线和 (B) 其基本组件:(1) 20 mL 和 3 mL 注射器;(2) 带鲁尔接头的旋塞阀;4 通;公锁;(3) 母鲁尔软管倒钩适配器,1/16 英寸;(4) 聚四氟乙烯 (PTFE) 灌注管(微孔 PTFE 管,内径 0.022 英寸×外径 0.042 英寸);(5) 聚四氟乙烯 8 位灌注歧管;(6) 硅胶连接器管(铂金固化硅胶管,1/32“ 内径× 3/32” 外径);(7) 歧管接头管(PTFE 管,1/32“ 内径× 1/16” 外径)。 请单击此处查看此图的较大版本。

图 6:雄性小鼠解剖。 (A) 小鼠雄性生殖器官;显示睾丸和附睾。(B) 将附睾转移到含有 HS 溶液的 35 mm 细胞培养皿中,并去除残留的脂肪和输精管。(C) 然后使用 #15 手术刀刀片将每个附睾分为头状、体和尾部。 请单击此处查看此图的较大版本。

图 7:Gigaseal 形成和与小鼠精子细胞的磨合。 商用膜片钳软件的“膜测试”工具的界面。精子膜片钳的三个阶段:(A) 将记录的移液器浸入浴 HS 溶液中,产生 14.8 MΩ 的移液器电阻;(B) 形成 gigaseal(电阻为 4.7 GΩ),补偿电容瞬变,并将精子从盖玻片中取出;(C) 过渡到全细胞模式。通过施加短 (1 ms) 逐渐增加(430-650 mV,~50 mV 增量)电压脉冲并结合轻吸力来执行磨合和过渡到全细胞模式,如左图所示。从反映电池整个电容的大电容瞬变的出现可以明显看出,该电容的发生 (该精子单元为 ~2.93 pF)。 请单击此处查看此图的较大版本。
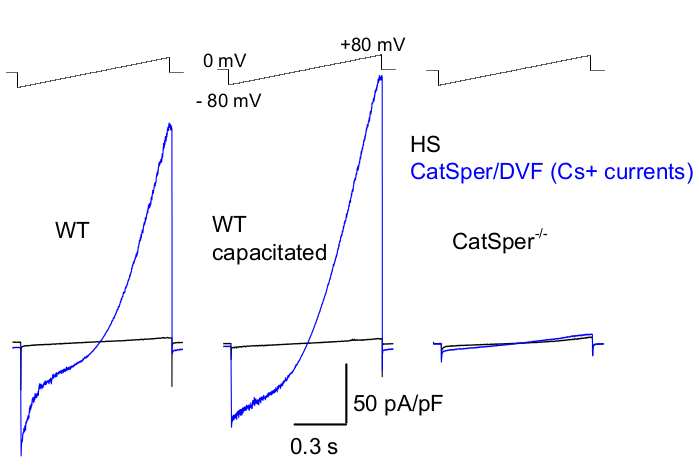
图 8:来自野生型 (WT) 附睾尾部、有能力和 CatSper 敲除精子的小鼠 CatSper 记录。为了记录单价 CatSper 活性,每 5 秒应用一次斜坡协议,并通过 0 mV39.51 保持电位的电压斜坡引发 CatSper 电流。电压斜坡(-80 mV 至 80 mV;850 ms)施加在 HS 和标称无二价溶液 (DVF) 中。数据以 2-5 kHz 采样,并以 1 kHz 过滤。在 HS 溶液中记录基线电流,由于受到高细胞外镁的抑制,HS 溶液不产生 CatSper 电流39,51。基线电流有助于估计泄漏电导率(非离子通道路径)。代表性的 Cs+ 全细胞 CatSper 电流密度 (pA/pF;蓝色) 记录自尾部 WT 鼠精子细胞(无能力;左和有能力;中)和 CatSper 缺陷的尾部鼠精子细胞(右)。电流由电压斜坡从 0 mV 的保持电位引出,并在 HS 和标称无二价溶液中施加从 -80 mV 到 80 mV 的斜坡。在 HS 溶液中记录的基线电流(黑色)。为了获得电流密度,将 CatSper 电流幅度归一化为电池电容 (pA/pF)。请单击此处查看此图的较大版本。
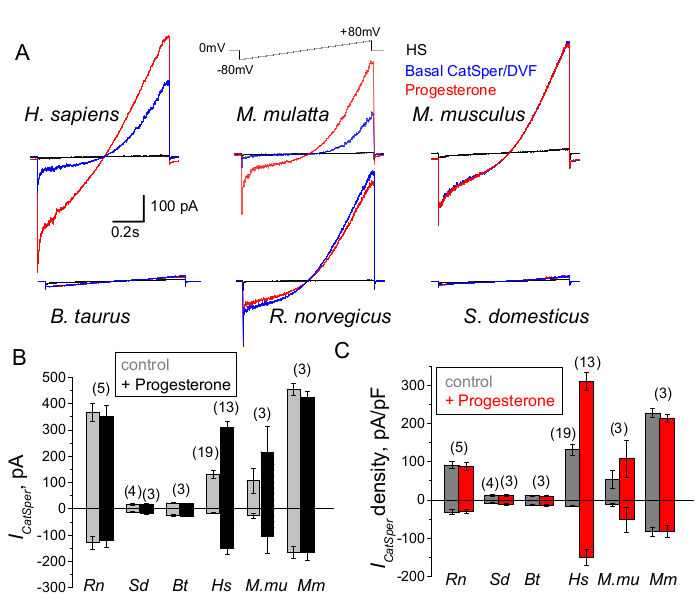
图 9:CatSper 在不同哺乳动物物种中的黄体酮调节。(A) 如图所示,通过电压斜坡方案从不同物种的精子细胞中引出的代表性 CatSper 电流。物种:人类 (Hs;H. sapiens);恒河猴 (Mmu;M. mulatta)、小鼠 (Mm;M. musculus)、公牛 (Bt;B. taurus);大鼠 (Rn;R. norvegicus);公猪 (Sd;S. scrofa domesticus)。记录了不存在(蓝色)和存在(红色)1 mM 孕酮时的 CatSper 电流,以及 HS 溶液(黑色)中的基础电流。(B) 如图所示,来自不同物种精子细胞的平均电流密度 (pA/pF) 记录;n 表示使用的单个精子细胞的数量。数据为平均值 +/- S.E.M. 请单击此处查看此图的较大版本。

图 10:鞭毛运动的差异。 细胞质液滴和鞭毛运动的两个代表性例子。同一大鼠 (Rn) 和人 (Hs) 精子细胞的叠加图像是在两个不同的时间点拍摄的,当它们显示最远端的鞭毛偏转时。虚线矩形表示具有细胞质液滴的区域及其相应的空间迁移率。 请单击此处查看此图的较大版本。

图 11:U 型管组件及其基本组件。 (A) U 型管的组件:(1) 10 mL 血清移液管;(2) 硅胶管;(3) 硅胶连接器管;(4) 1 mL 注射器;(5) 母鲁尔接头;(6) 公鲁尔接头 1/8“;(7) 带鲁尔接头的旋塞阀;4 通;公锁;(8) 公鲁尔系列倒钩适配器,1/16”。(B) 完全组装的 U 型管和 (C) 连接到法拉第笼的 U 型管。 请单击此处查看此图的较大版本。
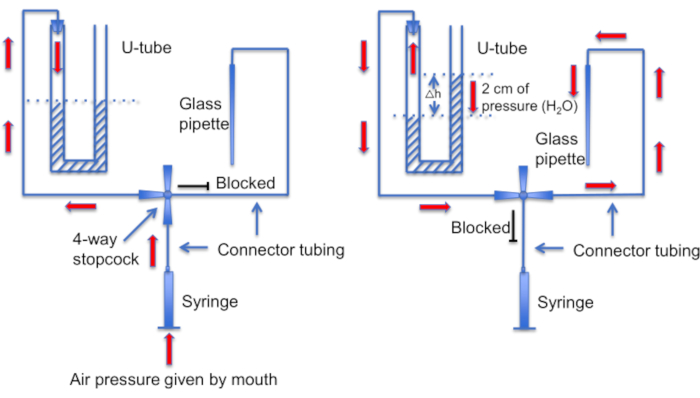
图 12:U 型管组件的示意图。 左图:口腔提供正气压,以在 U 型管中产生液位差异。右角中的液体液位上升 2 厘米。产生此水平差后,转动旋塞阀以将 U 型管连接到通向记录移液器的管路。右图:右针头中较高的液位产生正压,不断将移液器溶液推出移液器吸头,并保持吸头上没有碎屑。 请单击此处查看此图的较大版本。
| 化学药品 | 摩尔重量 (g/mol) | 毫米 | g 1L 分 |
| 氯化钠 | 58.44 | 97.8 | 5.72 克 |
| 氯化钾 | 74.55 | 5 | 0.373 克 |
| KH2PO4 | 136.09 | 0.37 | 50.4 毫克 |
| 硫酸镁4 x 7。端头H 2O | 246.48 | 0.2 | 49.3 毫克 |
| CaCl2 x 2。端头H 2O | 147.02 | 2 | 0.294 克 |
| HEPES 系列 | 238.3 | 20 | 4.766 克 |
| 葡萄糖 | 180.2 | 3 | 0.540 克 |
| 乳酸钠 (60% w/w) | 112.06 | 20 | 3 毫升 |
| 丙酮酸钠 | 110 | 0.4 | 44 毫克 |
表 1: 人输卵管液 (HTF) 溶液
| 化学药品 | 摩尔重量 (g/mol) | 毫米 | g 1L 分 |
| 氯化钠 | 58.44 | 135 | 7.889 克 |
| 氯化钾 | 74.55 | 5 | 0.373 克 |
| CaCl2 x 2。 端头H 2O | 147.02 | 2 | 0.294 克 |
| 硫酸镁4 x 7。 端头H 2O | 246.48 | 1 | 0.247 克 |
| HEPES 系列 | 238.3 | 20 | 4.766 克 |
| 葡萄糖 | 180.2 | 5 | 0.901 克 |
| 乳酸钠 (60% w/w) | 112.06 | 10 | 1.5 毫升 |
| 丙酮酸钠 | 110 | 1 | 0.110 克 |
表 2: 高盐水 (HS) 溶液
| 化学药品 | 摩尔重量 (g/mol) | 毫米 | g (500 毫升) |
| 铈丝化硅3 | 228.0 | 140 | 15.960 克 |
| HEPES 系列 | 238.3 | 40 | 4.766 克 |
| 乙二胺四乙酸 | 292.24 | 1 | 0.146 克 |
表 3: CsMeSO3 浴液(无二价浴液:DVF)
| 化学药品 | 摩尔重量 (g/mol) | 毫米 | 毫克(25 毫升) |
| 铈丝化硅3 | 228.0 | 130 | 741 毫克 |
| HEPES 系列 | 238.3 | 70 | 417 毫克 |
| 乙二胺四乙酸 | 292.24 | 2 | 14.6 毫克 |
| EGTA | 380.35 | 3 | 28.5 毫克 |
| 氯化铑 | 1 M 溶液 | 1 | 25 微升 |
表 4: CsMeSO3 移液器溶液
讨论
我们描述了一个详细的协议,用于从各种物种的精子细胞进行电生理记录。鉴于离子通道和电原转运蛋白对精子的生理意义,该技术是研究精子细胞生理学以及导致男性不育缺陷的有力工具。实验者一开始可能会觉得执行这项技术具有挑战性,但只要有毅力和耐力,成功就会随之而来。
哺乳动物精子很长(通常为 >50 μm),狭窄且高度活动。哺乳动物精子的基础搏动频率 (BF) 变化很大,平均值为 4 Hz(小鼠 69)、7-15 Hz(公猪 70,71)、11 Hz(大鼠 72)、11-20 Hz(公牛 18)、24 Hz(恒河猴 23)和高达 25 Hz(人类 3)。细胞质液滴 (CD) 是记录精子细胞的入口。在啮齿动物精子中,CD 通常是远端的,但会沿着鞭毛移动(图 10),为记录造成额外的障碍。然而,在人类精子细胞中,CD 更常位于头部附近。因此,成功的精子膜片钳的关键组成部分是出色的光学元件,以实现清晰、锐利的 CD 视图,以及没有漂移或振动的高精度显微作系统。最初的失败率预计会很高,并且在精子膜片钳的最初几天内是正常的。我们建议每周进行多次尝试的常规练习。每周每天进行几次记录将建立例行程序并提高运动技能。
直到最近,由于无法直接研究精子离子通道,精子离子通道的鉴定和药理学表征受到阻碍。该领域在很大程度上依赖于免疫细胞化学研究,而免疫细胞化学研究通常存在抗体的非特异性和/或缺乏相应的遗传模型。为了研究钙通道,经典的钙成像方法已被广泛使用,该方法有其自身的优点和局限性 73,74,75,76,77。虽然钙成像是一种相对简单的方法,适用于中高通量研究 78,79,80,81 并且侵入性较小,但它需要相对完整的细胞,因此难以剖析与细胞内信号级联分离的离子通道的功能或将它们与钙离子交换剂区分开来。此外,很难控制膜电位,因此更难排除电压门控钙通道的贡献。钙荧光法的几个优点之一是使用钙比例染料,可以精确测量钙离子浓度的变化。同时,必须意识到这些染料的灵敏度会根据细胞内 pH 值的变化而变化。
下面我们描述了协议中的关键步骤,包括该方法的故障排除步骤。必须仅使用纯试剂来制备实验溶液,因为即使是不需要的离子(如镁或重金属)的少量污染也会损害一价电流的检测。鉴于精子细胞的体积小,可以预期每个细胞的离子通道数量相对较低。因此,净电流范围从几 pA 到几百 pA。因此,钻机的内部电噪声必须最小,以确保检测到小电流,强烈建议使用无漂移设备。为了将特定电导与电噪声和背景泄漏区分开来,必须最大限度地利用记录设备和接地系统。这是通过正确接地钻机以避免任何电气干扰82 来实现的。强烈建议使用法拉第笼,以防止各种电气设备(例如建筑灯和入墙式电线)产生的电气干扰。钻机的所有电动组件(包括计算机键盘和鼠标)必须很少或没有电噪声(50 Hz 或 60 Hz),并且钻机的所有组件都正确接地。当所有离子通道关闭时,全池配置中的电噪声应< 0.5-1 pA。
另一个重要的一点是监测工作溶液的正确渗透压。必须精确测定细胞内和细胞外溶液的组成,并正确测量其渗透压。与移液管溶液相比,细胞外溶液必须略微低渗,因为它会导致微小的细胞肿胀并防止移液器被精子膜堵塞。注意:如果移液管溶液太高渗并且与浴液的差异超过 10 mOsm,则会导致细胞过度膨胀和密封破裂。结果,细胞会很脆弱,gigaseal 在磨合后的几秒钟内就会丢失。根据我们的经验,不准确的溶液制备是阻止膜片钳成功的最常见错误之一。
另一个需要避免的潜在障碍是增塑剂/邻苯二甲酸酯的塑料,以及矿物油润滑的注射器。管道、注射器和所有遇到溶液的塑料设备,以及精子细胞,都不应浸出增塑剂或其他环境毒素或油,因为这些化学物质会显着改变离子通道活性。我们使用小直径 Teflon 管作为主要灌注管路。特氟龙 (PTFE) 几乎没有可浸出化合物,但相当坚硬。柔性连接由高纯度硅管制成,可安装在 Teflon 管上。用于灌注系统的所有注射器都不含任何润滑剂,因为矿物油或其他润滑添加剂会干扰离子通道记录。
使用正确的玻璃杯和拉动正确的微量移液器形状的重要性怎么强调都不为过。因此,玻璃微量移液器的最佳制造是成功修补的先决条件。我们使用仅由含有细丝的硼硅酸盐玻璃制成的玻璃微量移液器,以实现更好的溶液填充。移液器的尖端必须经过火焰抛光,以提供理想的紧密密封。直径超过 2 μm(因此电阻为 10 MΩ 或更低)的移液器吸头通常不适用于精子细胞膜片钳。
另一个重要步骤是确保在形成密封之前,微量移液器吸头保持清洁,没有任何碎屑或气泡。鉴于微量移液器被加载到充满运动细胞的溶液中,这是一项艰巨的任务。有助于避免移液器意外“碰撞”到自由游泳的精子细胞中的一个因素是使用恒定灌注来洗掉所有非粘附细胞。另一个工具是自制的“U 型管”,它允许在正压和负压模式之间切换,以保持尖端清洁(图 11 和 图 12)。
由于精子细胞的细胞质液滴 (CD) 的形状和大小差异很大,因此选择具有合适形态的液滴非常重要。如图 2 所示,只有小 (1-3 μm)、光滑、均匀且不会过度肿胀的 CD 才适合使用膜片钳。小小的,单侧的;“臃肿”、完全透明的 CD 产生较弱的密封或没有密封。内部有大可溶性颗粒的 CD 可能会堵塞记录移液器。当睾丸小鼠精子进入附睾时,它们的 CD 位于靠近头部的颈部区域。当它们穿过附睾时,它们的 CD 沿着附睾中段移动,当精子到达附睾尾部时,最终到达中段和主片(环)之间的连接处。因此,如上所述,在从附睾体分离的精子细胞中,CD 通常位于靠近中间体的中心。在尾部细胞中,CD 通常可以在环附近找到(图 2C)。对于人类精子,CD 位于颈部区域(图 2A、B)。
虽然这对于从实验室动物中分离的精子来说不是问题,但人类供体之间存在显着差异。同一供体体内精子质量的差异主要影响精子质膜的质量,有时使密封形成相对困难。离子通道行为和药理学的变异性较小,这些因素可能与个体遗传学或生理学相关。一个人必须坚持不懈,并在多天内评估来自各种捐献的样本,并依赖多个人类捐献者参与者。使用人体材料需要额外的耐心,因为同一供体体内捐献的精子质量差异很大,具体取决于各种环境因素。我们建议评估不同献血日的样本,以对献血者状态做出最终决定。虽然射出的纯化精子通常适合在数小时内(人类精子分离后长达 12 小时)进行电生理学检查,但附睾鼠精子细胞仅在分离后 2 小时内适合修补。
最后但并非最不重要的一点是,gigaseal 的形成因精子细胞而异。对于小鼠/啮齿动物精子细胞,gigaseal 的形成几乎是瞬间发生的,而与人类精子形成 gigaseal 需要几秒钟(有时长达一分钟)。通常,初始吸力会导致输入电阻范围为 200 MΩ 至 800 MΩ。将保持电位切换到 -60 mV 并提供高达 10 mV 的“膜测试”短脉冲通常有助于挽救 gigaseal 的形成(通过电压场诱导移液器中膜的运动)。
精子细胞膜片钳技术能够详细研究其自然表达系统中的特定离子通道。该技术的成功取决于适当的设备、高质量的活精子细胞、纯试剂、基本的电生理学技能、耐心和毅力。该方法通过研究离子通道进化多样性、其调节机制以及它们在从雄性生殖道移动到女性生殖道时的功能改变,并受到 pH 值和配体等外源性条件的改变,开辟了精子生理学的新领域。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了 NIH Grant R01GM111802、Pew Biomedical Scholars Award 00028642、Alfred P. Sloan Award FR-2015-65398 和 Packer Wentz Endowment Will(对 P.V.L.)的支持。这项工作还得到了 Deutsche Forschungsgemeinschaft(德国研究基金会)368482240/GRK2416(至 N.M.)和中国国家留学基金委 BL 奖学金的支持。我们感谢 Dan Feldman 博士分享大鼠组织,感谢加州大学戴维斯分校的 Katie Klooster 和 Stuart Meyers 帮助采集灵长类动物精子细胞,感谢 Steven Mansell 帮助从公猪和公牛精子细胞采集数据分析。
材料
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
参考文献
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。