Method Article
Registro de correntes elétricas através da membrana plasmática de espermatozóides de mamíferos
Neste Artigo
Resumo
Este protocolo descreve como realizar registros elétricos de espermatozóides de mamíferos em uma configuração de célula inteira, com o objetivo de registrar diretamente a atividade do canal iônico. O método tem sido fundamental na descrição dos perfis eletrofisiológicos de vários canais iônicos do esperma e ajudou a revelar sua identidade e regulação molecular.
Resumo
O registro da atividade elétrica de uma das menores células de um organismo mamífero - um espermatozóide - tem sido uma tarefa desafiadora para os eletrofisiologistas por muitas décadas. O método conhecido como "patch clamp de espermatozóide" foi introduzido em 2006. Ele permitiu o registro direto da atividade do canal iônico em configurações de células inteiras e ligadas à célula e tem sido fundamental na descrição da fisiologia dos espermatozóides e da identidade molecular de vários canais iônicos de cálcio, potássio, sódio, cloreto e prótons. No entanto, o registro de espermatozóides únicos requer habilidades avançadas e treinamento em eletrofisiologia. Este protocolo detalhado resume o procedimento passo a passo e destaca vários 'truques do comércio' para disponibilizá-lo a qualquer pessoa que deseje explorar a fascinante fisiologia do espermatozóide. Especificamente, o protocolo descreve a gravação de espermatozóides humanos e murinos, mas pode ser adaptado a essencialmente qualquer espermatozóide de mamífero de qualquer espécie. O protocolo abrange detalhes importantes da aplicação desta técnica, como isolamento de espermatozóides, seleção de reagentes e equipamentos, imobilização das células altamente móveis, formação do selo hermético (Gigaohm) entre um eletrodo de registro e a membrana plasmática dos espermatozoides, transição para o modo espermatozóide total (também conhecido como invasão) e registros exemplares do canal de íons de cálcio dos espermatozoides, CatSper, de seis espécies de mamíferos. As vantagens e limitações do método de fixação de adesivo de esperma, bem como as etapas mais críticas, são discutidas.
Introdução
Semelhante ao patch clamp tradicional inventado por Erwin Neher e Bert Sakmann1, o patch clamp de células de esperma permite a interrogação da atividade individual do canal iônico, bem como o registro da atividade de toda a população de canais iônicos dentro da célula única 2,3. O método permite a identificação de um tipo específico de canal iônico sob graus de desacoplamento de processos intracelulares enzimáticos. Este método é crucial para a determinação da atividade do canal iônico com base em suas impressões digitais eletrofisiológicas e farmacológicas e, portanto, fornece uma estratégia de identificação confiável. A desvantagem do método é sua incapacidade de detectar transportadores não eletrogênicos. Além disso, o treinamento eletrofisiológico básico é útil para entender as nuances do protocolo. Para dominar a técnica de patch clamp e aplicá-la a espermatozóides de mamíferos, recomendamos estudar a literatura básica de patch clamp 4,5. Neste artigo, fornecemos um procedimento passo a passo detalhado e destacamos práticas exclusivas que tornam essa técnica fácil de entender e disponível para qualquer pessoa que deseje praticar a eletrofisiologia dos espermatozoides.
A homeostase iônica é uma função fisiológica essencial dos espermatozoides que depende fortemente de canais iônicos e transportadores iônicos para manter gradientes iônicos fisiologicamente importantes, variar o cálcio intracelular e alterar a voltagem transmembrana. Os canais iônicos e os transportadores iônicos regulam as funções essenciais dos espermatozoides, como motilidade, navegação no trato reprodutivo feminino, maturação dos espermatozóides e, em organismos marinhos, quimiotaxia em direção ao óvulo 6,7,8,9,10,11,12 . A motilidade espermática é um processo adquirido gradualmente. Os espermatozoides são principalmente quiescentes durante sua maturação no testículo e durante sua conseqüente passagem pelo epidídimo. Sua motilidade é restringida por um ambiente epididimal ácido que leva a uma acidificação interna do espermatozóide. Isso prejudica a função do axonema, uma vez que ele é incapaz de funcionar abaixo de pH 6,013,14. No entanto, após a exposição aos fluidos seminais ou a um ambiente mais alcalino, as concentrações de íons intracelulares e o pH citoplasmático dos espermatozoides sofrem grandes alterações e o espermatozóide torna-se móvel 15,16,17. O movimento do flagelo espermático é alimentado pela hidrólise de ATP que suporta o deslizamento dos microtúbulos axonêmicos18 e esse processo é altamente dependente do pH14. Além disso, o movimento flagelar também é controlado por uma elevação do cálcio intraflagelar e do AMPc 13,19,20,21,22,23,24. Esses fatores, ou seja, a concentração de cálcio intracelular do esperma [Ca2+]i, pH, ATP e cAMP são os principais mecanismos regulatórios que permitem mudanças de motilidade e suas concentrações são rigidamente reguladas pelos canais e transportadores iônicos do esperma.
Os espermatozoides são únicos, pois expressam uma série de proteínas que não podem ser encontradas em nenhum outro lugar do corpo. Exemplos notáveis são os canais iônicos do esperma, como o canal de potássio, Slo3 25,26,27,28,29 e o canal iônico Cat de Sperma, CatSper 2,30,31,32. Este último é o principal canal de cálcio dos espermatozóides de mamíferos31 e é regulado por alcalinização intracelular 2,30,31,32,33,34. CatSper também é regulado por pistas específicas da espécie 7,35 e é organizado em nanodomínios longitudinais quadriláteros ao longo do flagelo do esperma 36,37,38. Em primatas, CatSper é ativado por uma combinação de alcalinidade flagelar, despolarização de membrana e progesterona 3,39,40,41, enquanto para a ativação murina CatSper a progesterona não é necessária 2,39. Outra característica específica deste canal é sua organização de multisubunidades: CatSper é um complexo de pelo menos 10 subunidades diferentes 31,32,34,37,38,42,43,44,45,46,47. Essa estrutura sofisticada e as especificidades de sua regulação impediram a expressão recombinante de CatSper em qualquer sistema de expressão heterólogo conhecido e, portanto, a caracterização fisiológica de CatSper foi restrita ao seu sistema nativo de expressão - o espermatozóide. Embora a caracterização molecular da proteína CatSper tenha sido alcançada em um artigo seminal em 2000 por D. Ren et. al.31, a prova definitiva de que CatSper é um canal iônico genuíno só foi possível após a introdução do método de clamp de adesivo de esperma em 20062. Desde então, essa técnica permitiu a caracterização precisa de muitas vias condutoras de íons em espermatozoides 9,28,37,39,40,44,46,48-54.
Acreditava-se que o método clássico e mais direto para estudar as características do canal iônico - a técnica do patch clamp - era inaplicável aos espermatozoides devido à sua motilidade e morfologia específica (Figura 1A). Especificamente, o volume minúsculo do citoplasma do esperma e a forte ligação da membrana plasmática do esperma às estruturas intracelulares rígidas, como a bainha fibrosa e o núcleo do esperma, foram os principais desafios55. Essas duas características estruturais resultam em uma célula fina em forma de flecha, projetada para penetrar em ambientes altamente viscosos, como vestimentas protetoras dos ovos, sem deformação significativa ou danos à membrana plasmática.
A primeira etapa do método de patch clamp é o estabelecimento da vedação hermética entre uma pipeta de registro (uma micropipeta de vidro) e a membrana plasmática celular. Para conseguir isso, é preciso puxar membrana plasmática suficiente dentro da pipeta de gravação para que um gigaseal mecanicamente estável se forme entre a membrana plasmática e o vidro. A membrana plasmática deve ser flexível e não rígida (Figura 1B). Como mencionado acima, toda a superfície da membrana plasmática do esperma está bastante aderida, exceto pela região conhecida como gotícula citoplasmática (Figura 1A e Figura 2). Assim, a natureza rígida da membrana plasmática do esperma foi considerada o principal obstáculo na obtenção do selo hermético ou 'gigaseal', assim chamado porque >109 ohms são necessários para boas gravações. No entanto, a introdução da técnica de sperm patch clamp em 20062 removeu essa barreira e esse método pôde ser aplicado com sucesso a espermatozóides de várias espécies de mamíferos 2,41,51,56. Esse avanço foi alcançado concentrando-se na gotícula citoplasmática (CD) 2 , 8 , uma pequena estrutura encontrada ao longo da peça intermediária do espermatozóide ( Figura 1A e Figura 2 ) - e é simplesmente o remanescente da espermátide alongada - um precursor de células espermáticas a partir do qual a cabeça e a cauda se desenvolvem. Funcionalmente, pode ajudar a célula a se adaptar às mudanças na osmolaridade extracelular durante a ejaculação. A característica importante é que a membrana plasmática dentro do CD é flexível o suficiente para ser puxada para dentro da pipeta para formar uma vedação de gigaohm. Assim, o CD do esperma é a melhor parte na superfície do esperma através da qual se pode obter uma formação bem-sucedida de gigaseal e transição para um modo de célula inteira que, em última análise, acopla eletricamente o espermatozóide a um amplificador patch-clamp 2,8. Vale a pena notar que publicações anteriores relataram a formação bem-sucedida de gigaseal na cabeça do esperma, o que permite o registro na configuração ligada à célula 54,57,58,59. No entanto, as gravações na configuração de células inteiras até agora só foram relatadas pela realização da formação de gigaseal na região do CD. Este modo de célula inteira permite o acesso elétrico a todo o volume dos espermatozoides e, portanto, permite a detecção de atividades de canais iônicos localizados no flagelo do esperma, bem como na cabeça do esperma. Por apenas alguns anos desde o seu desenvolvimento, a técnica de grampo de remendo de esperma resultou em um tremendo progresso em nossa compreensão dos canais iônicos do esperma e é até agora uma das técnicas mais robustas para investigar diretamente a funcionalidade dos canais iônicos do esperma 9,28,37,39,40,44,46,48,49, 50,51,52,53 (Figura 1).
O grampo de remendo de esperma varia em alguns detalhes da técnica clássica de remendo de remendo, conforme descrito abaixo. Primeiro, a maior parte da membrana plasmática do esperma está firmemente ligada à estrutura intracelular rígida e, portanto, os espermatozóides quase não têm membrana plasmática "sobressalente" para ser puxada para a pipeta. A única região flexível é a membrana do CD que se assemelha à membrana plasmática de muitas células somáticas e, portanto, pode ser facilmente puxada para dentro da pipeta. Para formar uma vedação de gigaohm com o CD, a pressão negativa é criada por uma leve sucção na parte superior da pipeta, a fim de atrair uma pequena porção da membrana plasmática do esperma para a ponta da micropipeta (Figura 1B). Esta porção da membrana forma uma invaginação em forma de Ω na ponta da pipeta e estabelece uma vedação hermética com suas paredes internas.
Em segundo lugar, a gotícula citoplasmática em espermatozóides humanos e de camundongos está entre 1 e 2 μm (Figura 1 e Figura 2). Portanto, a aplicação da técnica patch-clamp a um objeto tão pequeno requer óptica de alta resolução. A maioria dos equipamentos de patch clamp de esperma é equipada com um microscópio invertido com contraste de interferência diferencial (DIC) ou componentes ópticos Nomarski (Figura 2 e Figura 3). O uso de um microscópio equipado com óptica DIC para grampo de remendo de esperma é altamente recomendado em relação à óptica de contraste de fase mais convencional, uma vez que as informações espaciais vistas no DIC ajudam a obter precisão superior no posicionamento de uma pipeta de remendo no minúsculo CD. Sugerimos também o uso de uma objetiva de imersão em água de 60x ou lente similar, com abertura numérica de 1,2. Essa objetiva tem uma longa distância de trabalho (0,28 mm), o que permite a observação de espermatozoides nadando livremente em solução (Figura 2). A objetiva também possui um colar de ajuste para ajustar à espessura da lamínula (variável de 0,13 a 0,21 mm). Esta combinação da longa distância de trabalho e do colar de ajuste permite a observação através de duas lamínulas de 0,13 mm; Uma lamínula serve como fundo de vidro da câmara de gravação e a lamínula de 5 mm com espermatozóides depositados é colocada no topo. Conforme discutido abaixo, depositar espermatozóides em lamínulas redondas de 5 mm facilmente trocáveis, em vez de diretamente no fundo da câmara de registro, é uma maneira conveniente de carregar espermatozóides frescos na câmara de registro.
Terceiro, o equipamento de grampo de remendo de esperma deve ser equipado com um amplificador de grampo de baixo ruído e um digitalizador para registrar correntes elétricas minúsculas (faixa de picoampere) e mudanças minúsculas no potencial de membrana. Este equipamento deve garantir o menor ruído do amplificador. A ausência de vibração é uma parte essencial de uma gravação bem-sucedida de patch clamp. O clampeamento do adesivo de esperma requer um micromanipulador preciso sem desvios que pode ser conectado ao microscópio invertido com uma plataforma de micromanipulador para garantir melhor estabilidade do que um suporte de micromanipulador independente (Figura 3A). Para testar a configuração, não se deve ver nenhum movimento da ponta da pipeta (com ampliação inferior a 60x), mesmo quando uma pessoa pula para cima e para baixo no chão perto da mesa de isolamento de vibração.
Protocolo
Todos os experimentos foram realizados de acordo com as diretrizes do NIH para pesquisa com animais e aprovados pelo Comitê de Cuidados e Uso de Animais da UC Berkeley (AUP 2015-07-7742), com todos os esforços feitos para minimizar o sofrimento dos animais. Todos os métodos descritos são consistentes com as recomendações do Painel de Eutanásia da American Veterinary Medical Association e do comitê da IACUC. Todos os procedimentos experimentais utilizando amostras derivadas de humanos foram aprovados pelo Comitê de Pesquisa em Humanos da Universidade da Califórnia, Berkeley, protocolo IRB número 2013-06-5395.
1. Fabricação de micropipetas de vidro para gravação de patch clamp de esperma de célula inteira.
NOTA: O pequeno tamanho da gotícula citoplasmática requer micropipetas de vidro com pontas finas.
- Para a fabricação de micropipetas, comece com capilares de vidro borossilicato com diâmetro externo de 1,5 mm, diâmetro interno de 0,86 mm e filamento interno. Puxe a ponta em um extrator de micropipeta (Figura 3B).
- Para moldar e polir a ponteira da pipeta, posicione um fio quente próximo à ponteira por um momento. Execute este processo de polimento a fogo com ampliação de 100x usando um polidor de pipeta (Figura 3C, D).
- Certifique-se de que o diâmetro interno da ponta da pipeta seja de ~2 μm antes do polimento a fogo e reduzido para ~0.5 μm após o polimento adequado.
NOTA: Somente pipetas recém-retiradas feitas no dia da gravação são recomendadas para uso. Isso evita o acúmulo de partículas de poeira na ponta da pipeta.
2. Configurando o equipamento
- Montagem da câmara de gravação
- Use uma câmara de perfusão em forma de diamante de baixo volume com fluxo laminar e taxas de troca de solução relativamente rápidas (Figura 4). Conecte a câmara por meio de um coletor a um sistema de perfusão alimentado por gravidade (Figura 5).
- Para perfundir uma solução através da câmara de registro, monte um sistema de perfusão simples alimentado por gravidade com um coletor de politetrafluoretileno que conecta a câmara de perfusão a oito linhas de perfusão separadas.
NOTA: O tubo não deve liberar plastificantes nas soluções, uma vez que tais produtos químicos podem afetar significativamente a função normal dos espermatozóides60 e alterar a atividade do canal iônico 61,62. Um tubo de politetrafluoretileno de pequeno diâmetro é altamente recomendado como o principal tubo de perfusão. - Como a tubulação de politetrafluoretileno é bastante rígida, faça conexões flexíveis com tubulação de silício de alta pureza sobre a tubulação de politetrafluoretileno. Além disso, use seringas (por exemplo, tipo seringa Luer Lock) que não tenham lubrificante, pois o óleo mineral ou outros aditivos lubrificantes podem interferir no registro do canal iônico (Figura 5).
- Montagem de uma ponte de ágar
- Para evitar alterações no potencial de junção do líquido durante as gravações, mantenha o ambiente ao redor do eletrodo de referência estável usando uma ponte de ágar (Figura 4).
- Para fazer uma ponte de ágar, faça um capilar de vidro em forma de L dobrando-o sob um pequeno fogo de bico de Bunsen e deixe esfriar.
- Faça uma solução de agarose a 1% em KCl 1 M e aqueça no microondas até que a agarose derreta e a solução fique transparente. Encha cuidadosamente o capilar de vidro em forma de L com a solução acima para evitar bolhas de ar e deixe esfriar até a temperatura ambiente. As pontes de ágar podem ser armazenadas em KCl 1 M por ~ 2 meses a +4 °C.
- Para usar uma ponte de ágar, encha um eletrodo de referência de grânulos Ag / AgCl com 1 M KCl e insira a ponte de ágar com cuidado para evitar que a agarose solidificada saia do capilar de vidro.
- Em seguida, insira o pino dourado (2 mm) do amplificador headstage fio no eletrodo de referência 2 mm (ouro) slot e insira a extremidade da ponte de ágar em forma de L na câmara de perfusão, conforme mostrado na Figura 4.
- Soluções e receitas
NOTA: Todos os reagentes e produtos químicos devem ser da mais alta pureza. Todas as soluções preparadas são filtradas através de um filtro PES estéril de 0,22 μm e armazenadas a 4 °C por até um mês. Deve-se notar que o ajuste exato da osmolaridade é um pré-requisito para o sucesso do patch clamping.- Prepare a solução de fluido tubular humano (HTF) conforme descrito na Tabela 1. Ajuste o pH para 7,4 com NaOH. A osmolaridade deve ser de 280 ± 5 mOsm, medida usando um osmômetro de pressão de vapor.
- Prepare uma solução salina de alta qualidade (HS) para "banho" ou "extracelular" conforme indicado na Tabela 2. Ajuste o pH para 7,4 com NaOH. A osmolaridade deve ser de 320 ± 5 mOsm.
- Preparar a solução "banho" ou "extracelular" de metanossulfonato de césio conforme descrito no quadro 3. Ajuste o pH para 7,4 com CsOH e a osmolaridade para 320 ± 5 mOsm.
- Para preparar a solução intracelular de "pipeta" de metanossulfonato de césio (CsMeSO3), siga a Tabela 4 e ajuste o pH para 7,4 com CsOH. A osmolaridade deve ser até 10 mOsm maior que a solução de HS.
3. Isolamento e purificação de espermatozóides de mamíferos
NOTA: Eutanasiar camundongos machos C57BL/6 com idade entre 3 e 6 meses por inalação de CO2 seguida de luxação cervical. Após a luxação cervical, realize a coleta de tecido (cauda ou epidídimo do corpo) de camundongos imediatamente.
- Isolamento de espermatozóides epididimais de camundongos
NOTA: Eutanasiar camundongos machos C57BL/6 com idade entre 3 e 6 meses por inalação de CO2 seguida de luxação cervical. Após a luxação cervical, realize a coleta de tecido (cauda ou epidídimo do corpo) de camundongos imediatamente.- Abra a área abdominal inferior do camundongo com uma tesoura e extraia os dois epidídimos.
- Coloque-os em uma placa de cultura de células de 35 mm cheia de solução HS (solução salina alta, consulte a Tabela 2). Certifique-se de que uma alíquota da solução HS seja pré-aquecida à temperatura ambiente antes do contato com os espermatozoides.
- Transferir os epidídimos para uma nova placa de cultura celular contendo solução de HS e remover completamente toda a gordura residual.
- Separe os epidídimos em caput, corpus e cauda usando uma lâmina de bisturi # 15 (Figura 6).
- Transfira o corpo (ou cauda, se necessário) de cada epidídimo para uma nova placa de cultura de células contendo solução de HS. Faça várias incisões na parte isolada do epidídimo usando uma lâmina de bisturi pontiaguda #11.
- Transfira as partes dos epidídimos com múltiplas incisões para um tubo de microcentrífuga de 1,5 mL contendo 1,5 mL de solução HS.
- Agite brevemente os espermatozoides do epidídimo para a solução usando uma pinça Dumont tipo 5a superfina. Descarte os epidídimos e deixe o tubo em temperatura ambiente por 10 min.
- Aguarde até que a matéria sólida (células não espermatozóides) sedimente para o fundo do tubo e, em seguida, transfira o sobrenadante para outro tubo de microcentrífuga de 1,5 mL.
- Armazene a mistura de espermatozóides em temperatura ambiente com acesso ao ar por até 2 h, período durante o qual os experimentos podem ser realizados. Os espermatozoides isolados perdem seu desempenho 3 h após o isolamento.
- Capacitação de espermatozóides de camundongos
NOTA: Todos os espermatozóides epididimais são adequados para patch-clamp, mas apenas os espermatozóides do epidídimo da cauda estão maduros o suficiente para se tornarem competentes em fertilização. Como os espermatozóides caudais podem sofrer capacitação, realize experimentos, principalmente a capacitação espermática, usando espermatozóides caudais.- Realize a coleta de espermatozóides em espermatozóides caudais ou ejaculados (consulte as etapas 3.1.1-4).
- Tome caudae isolado conforme descrito no passo 3.1.4. e aplique várias incisões conforme descrito na etapa 3.1.5. Transferir o caudal para uma placa de cultura celular de 10 mm com 2 ml de solução de capacitação.
- Incube o tecido caudal nesta solução de capacitação inicialmente por 10 min a 37 ° C e 5% de CO2, depois descarte o tecido e incube os espermatozóides liberados por mais 50-80 min.
NOTA: A capacitação in vitro de espermatozóides caudais de camundongos é alcançada por 60-90 minutos de incubação. Os espermatozoides capacitados são identificados visualmente com base na flexão assimétrica excessiva de seus flagelos, conhecida como hiperativação. Esse tipo de motilidade permite que os espermatozóides nadem de maneira não linear.
- Coleta e purificação de esperma humano
NOTA: Neste caso, amostras de sêmen fresco foram obtidas de um total de 21 voluntários saudáveis com idades entre 21 e 38 anos e espermatozóides purificados pela técnica de natação à temperatura ambiente, conforme descrito em detalhes em48,63. Resumidamente, o procedimento é o seguinte:- Deixe as amostras de ejaculação humana em temperatura ambiente por 60 min para permitir a liquefação antes de serem purificadas (durações mais longas podem afetar negativamente a qualidade do esperma).
- Pré-aqueça cerca de 7 ml de solução de HTF a 37 °C num tubo de centrifugação de 50 ml. Avalie visualmente o volume do ejaculado - se o volume for maior que 1 mL, prepare vários tubos de solução de HTF.
- Espalhe cuidadosamente 1 mL de ejaculação liquefeita no fundo de cada tubo, sem levantar os fios de sêmen para a superfície do tampão. A interface sêmen-para-HTF- deve ser o mais clara possível. Evite bolhas de ar.
- Coloque os tubos em uma incubadora a 37 °C por 1 h em um suporte que os mantenha em um ângulo de 45° para obter a máxima área de superfície. Se a incubadora for uma incubadora de CO2 , feche bem a tampa para evitar a acidificação do tampão (CO2 não é necessário para este procedimento). Durante a incubação, os espermatozoides móveis nadarão gradualmente em direção à superfície do tampão HTF.
- Após 1 h, colete a fração superior de 1 mL de todas as amostras em um tubo de centrífuga de 15 mL, combinando assim espermatozoides da mais alta qualidade e altamente móveis para fixação de remendo. Não tente remover todo o sobrenadante - deixe vários mL de HTF restantes acima do plasma seminal para evitar contaminação. A suspensão de células purificadas pode ser armazenada em temperatura ambiente por várias horas.
NOTA: Uma ejaculação normal deve conter pelo menos 15 x 106 espermatozóides por mL64, mas a contagem de espermatozóides varia muito entre as amostras. O obstáculo de uma baixa contagem de células pode ser superado deixando a suspensão de esperma purificada descansar por 30-60 minutos em temperatura ambiente antes do clampeamento do adesivo. Sob esta condição, as células se acumularão gradualmente no fundo do tubo da centrífuga e formarão uma nuvem de células visível a partir da qual você pode pipetar as células para a câmara de registro (veja abaixo).
- Capacitação de espermatozóides humanos
NOTA: A capacitação in vitro de espermatozóides humanos pode ser realizada por 4 h de incubação em solução de capacitação: soro bovino fetal a 20%, NaHCO3 25 mM em tampões HTF ou HS48,51 . Os espermatozoides capacitados podem ser identificados visualmente com base em sua motilidade vigorosa e excessiva curvatura assimétrica dos flagelos que permite que os espermatozóides nadem de maneira não linear.- Prepare uma solução de capacitação 2x e misture 1:1 com a suspensão de esperma.
- Realize a incubação a 37 °C e 5% de CO2 por um mínimo de 4 h. Para garantir uma alta porcentagem de células capacitadas, o tempo de incubação não deve ser inferior a 4 h.
4. Preparando a solução de revestimento (necessária apenas para o remendo de esperma humano)
NOTA: Um passo essencial é levantar o espermatozóide anexado da lamínula antes da invasão. Esta etapa é necessária apenas para espermatozóides humanos e requer o revestimento da lamínula de vidro para criar uma superfície de vidro menos adesiva. O revestimento de lamínula reduz a probabilidade de os espermatozóides aderirem à lamínula e permite que os espermatozóides humanos sejam retirados da lamínula de vidro após a formação bem-sucedida do gigaseal.
- Diluir 200 μL do ejaculado em 5 mL de solução HS em tubo de centrífuga de 15 mL.
- Gire para baixo a 300 x g por 5 min e remova o sobrenadante.
- Ressuspenda o pellet em 1 mL de solução HS e transfira para um tubo de microcentrífuga.
- Sonicar durante 10 min a 25 °C utilizando um banho de sonicação cheio de água.
- Gire para baixo a 10.000 x g por 5 min.
- Transfira o sobrenadante para um novo tubo de microcentrífuga e use-o para revestimento (instruções abaixo).
5. Gravação de condutância iônica de toda a membrana plasmática do esperma.
- Anexando esperma à lamínula.
NOTA: Antes da gravação do patch-clamp, os espermatozóides são plaqueados em lamínulas redondas de 5 mm.- Se estiver trabalhando com células humanas, mergulhe brevemente as lamínulas na solução de revestimento preparada usando uma pinça afiada.
- Coloque quatro lamínulas em um único poço de uma placa de 4 poços e cubra com 300 μL de solução HS. Evite que as lamínulas flutuem prendendo-as na parte inferior da placa de 4 poços, empurrando-as com a ponta de plástico de um pipetador.
- Ressuspenda suavemente as suspensões concentradas de espermatozóides humanos (etapa 3.3.5) ou de camundongo (etapa 3.1.9) do tubo de armazenamento (20-50 μL de esperma concentrado) em 300 μL de solução HS acima da lamínula.
- Certifique-se de que os espermatozóides se acumulem no fundo do poço, onde suas cabeças se prenderão à lamínula e seus flagelos baterão vigorosamente na solução logo acima da lamínula. É importante permitir que os espermatozóides sedimentem na lamínula por cerca de 10 minutos em temperatura ambiente antes de registrar.
NOTA: Se os espermatozóides humanos se fixarem mal, volte para a etapa 5.1.1 e dilua a solução de revestimento preparada com solução HS (1:20 a até 1:2). Esta etapa deve ser ajustada para amostras de esperma de diferentes doadores humanos com base na motilidade espermática variável que é comum em preparações de esperma humano.
- Colocando a lamínula
- Pegue uma lamínula com células ligeiramente aderidas do poço e coloque em um poço em forma de diamante da câmara de registro contendo solução de HS (Figura 4).
- Ligue o sistema de perfusão (Figura 5) preenchido com solução de HS para enxaguar a câmara e remover os detritos e o excesso de espermatozóides destacados da câmara. Isso aumentará a probabilidade de que a pipeta de registro permaneça limpa quando atingir as células. Esta etapa é útil ao trabalhar com células não capacitadas que tendem a aderir mais forte à lamínula.
NOTA: Se estiver gravando a partir de espermatozóides capacitados, deve-se evitar ativar a perfusão imediatamente após a colocação de uma nova lamínula na câmara. Os espermatozóides capacitados têm motilidade vigorosa e se ligam apenas frouxamente à lamínula. Portanto, para garantir que o maior número de espermatozoides capacitados esteja disponível, é importante esperar ~ 10 min e deixar os espermatozóides capacitados aderirem à lamínula antes de ativar a perfusão. Uma vez que a célula capacitada apropriada é escolhida e um gigaseal é formado, a perfusão pode ser ligada novamente.
- Seleção de um espermatozóide para gravação de patch-clamp.
- Encontre um espermatozóide adequado com uma gotícula citoplasmática usando uma ampliação de 600x (veja abaixo). Isso é feito usando uma lente de imersão em água de 60x, conforme descrito nos métodos com uma ocular de ampliação de 10x. Em espermatozoides isolados do corpo do epidídimo, o CD geralmente está localizado próximo ao centro da peça intermediária. Nas células caudais, a DC geralmente pode ser encontrada próxima ao anel (Figura 2C). Para o esperma humano, o CD está localizado na região do pescoço (Figura 2A, B).
NOTA: Além disso, a opção de ampliação de 1,6x do microscópio pode ser usada para examinar de perto a morfologia do esperma (ampliação de 960x). - Certifique-se de que a gotícula citoplasmática seja oval e tenha uma forma fusiforme ligeiramente alongada ( Figura 2G ). Os CDs que parecem muito redondos e aumentados geralmente são frágeis e inadequados para remendos (Figura 2D, F).
- Selecione um espermatozóide que seja móvel com a cabeça presa à lamínula, de modo que o espermatozóide seja parcialmente fixado, mas o CD e o resto do flagelo continuem a se mover com batimentos flagelares. Certifique-se de que a cabeça do esperma esteja frouxamente presa à lamínula para que ela gire um pouco à medida que o flagelo se move de um lado para o outro.
NOTA: A fixação solta é importante, pois após a formação do selo de gigaohm e antes da transição para o modo de célula inteira, o espermatozóide deve ser levantado da lamínula para a solução.
- Encontre um espermatozóide adequado com uma gotícula citoplasmática usando uma ampliação de 600x (veja abaixo). Isso é feito usando uma lente de imersão em água de 60x, conforme descrito nos métodos com uma ocular de ampliação de 10x. Em espermatozoides isolados do corpo do epidídimo, o CD geralmente está localizado próximo ao centro da peça intermediária. Nas células caudais, a DC geralmente pode ser encontrada próxima ao anel (Figura 2C). Para o esperma humano, o CD está localizado na região do pescoço (Figura 2A, B).
- Formando um gigaseal
NOTA: Para registrar correntes CatSper monovalentes no modo de célula inteira, as pipetas são preenchidas com solução de Cs-metanossulfonato (também conhecida como pipeta ou intracelular) (Tabela 4) - isso produz uma resistência de pipeta de 11-17 MΩ (Figura 7A), conforme calculado automaticamente pelo amplificador ao aplicar um passo de tensão de 0 mV a 10 mV. As pipetas também podem ser preenchidas com outras soluções, dependendo da aplicação. Recomenda-se que as soluções sejam feitas com ânions móveis, como metanossulfonato, Cl- , aspartato ou íons semelhantes para reduzir a resistência da pipeta. A osmolaridade da solução da pipeta deve ser até 10 mOsm maior que a solução do banho. A tonicidade ligeiramente mais alta da solução de pipeta ajuda a manter a resistência de acesso aos espermatozoides o mais baixa possível durante a gravação do patch-clamp.- Após a seleção visual de um espermatozóide com morfologia adequada (Figura 2G), encha a micropipeta com uma solução de pipeta (Tabela 4) e fixe-a no porta-pipeta.
- Para manter a ponta da pipeta limpa de detritos, aplique pressão positiva na pipeta usando o conjunto em forma de tubo em U para garantir que a solução da pipeta flua para fora da ponta depois de imersa na solução extracelular, também referida abaixo como solução de "banho" (consulte a Tabela 2).
NOTA: Se as condições permitirem, a formação da vedação sob perfusão constante é altamente recomendada, pois essa condição garante a ponteira da pipeta mais limpa. - Abaixe a pipeta e mergulhe sua ponta na solução do banho (Tabela 2). Neste momento, a resistência da pipeta pode ser medida (Figura 7A).
- Para visualizar claramente a célula, posicione a ponta da pipeta acima do CD com a abertura da ponta alinhada diagonalmente (aproximadamente 45°) em direção ao CD.
- Abaixe rapidamente a ponta da pipeta em direção ao CD para ficar no mesmo plano focal, a poucos μm do CD.
- Assim que a ponta da pipeta tocar o CD, aplique pressão negativa na pipeta usando o "bocal" para mover parte da gota para dentro da ponta e formar uma vedação de gigaohm - também conhecida em eletrofisiologia como "evento de sucção". Normalmente, após o contato inicial com a ponta da pipeta, a pressão negativa na pipeta pode ser mantida por até um minuto para obter gradualmente uma vedação de gigaohm.
- Após a formação bem-sucedida do selo de gigaohm (> 4-20 GΩ), levante o espermatozóide da lamínula (Figura 7B).
NOTA: Esta etapa não é necessária para espermatozóides de roedores devido ao seu comprimento; no entanto, o descolamento parcial do flagelo do esperma é benéfico para aliviar a possível deriva da pipeta. O descolamento do esperma humano é uma etapa essencial, uma vez que o CD é pequeno (1~3 μm); se a célula for deixada presa à lamínula, mesmo um leve desvio da pipeta durante o experimento pode interromper o CD. Depois que o espermatozóide é levantado, seu flagelo normalmente continua a bater, enquanto a célula está ligada apenas à micropipeta.
- Invasão e transição para o modo de célula inteira.
- Compense os transientes de capacitância parasita usando o ampmodo compensatório do amplificador antes de fazer a transição para o modo de célula inteira (Figura 7B). Para observar inicialmente os transientes de capacitância, mantenha o potencial de membrana em 0 mV e aplique pulsos de 10 mV usando a ferramenta "Teste de membrana" (Figura 7B).
- Execute um amaciamento e transição para o modo de célula inteira aplicando pulsos de tensão curtos (1 ms) aumentando gradualmente (430-650 mV, incremento de ~ 50 mV) combinados com uma sucção muito leve (Figura 7C).
NOTA: Para aplicar pulsos de invasão , use o protocolo de amaciamento programado anteriormente no patch clamp software. Os pulsos de tensão de ruptura são aplicados ao espermatozóide usando a entrada de comando de alta tensão (comutada na parte traseira) na parte traseira do amplificador. - Após a aplicação de cada pulso de tensão de interrupção, inicie a ferramenta de teste de membrana para verificar se aparecem transientes de capacitância maiores.
NOTA: A presença de grandes transientes de capacitância (Figura 7C) indica que a invasão ocorreu e toda a capacitância da célula está sendo medida (~ 1 pF para espermatozóides humanos e ~ 2,5 pF ou mais para espermatozóides murinos). - Ajuste os grandes transientes de capacitância usando a Ferramenta de Teste de Membrana para determinar a capacitância de toda a célula, bem como sua resistência de acesso.
NOTA: A resistência de acesso deve ser a mais baixa possível para uma perfusão eficiente do interior do espermatozóide com a solução de micropipeta, bem como para uma voltagem confiável clamp da membrana plasmática do esperma. A resistência de acesso é geralmente de 25-30 MΩ e 50-70 MΩ para soluções intracelulares baseadas em Cs+ /K+ e NMDG, respectivamente. - Após o amaciamento bem-sucedido, prossiga com os experimentos planejados de patch clamp de célula inteira, como a aplicação de várias soluções de banho (Figura 8) contendo diferentes compostos ou atividades do canal de medição usando protocolos de passo de tensão (Figura 8, Figura 9) ou rampa de tensão. Se o arrombamento não for bem-sucedido, retorne à etapa 6.4.1. escolhendo uma micropipeta fresca e selecione outro espermatozóide apropriado.
Resultados
O método de grampo de adesivo de esperma permite a gravação direta do canal CatSper.
Como mencionado acima, as gravações do CatSper foram realizadas estabelecendo uma vedação de alta resistência (gigaohm) entre a pipeta de adesivo e o espermatozóide de mamíferos em sua gotícula citoplasmática. Ao entrar e fazer a transição para o modo de célula inteira, obtém-se acesso elétrico total a todo o corpo do espermatozóide e seu interior, incluindo a cabeça do esperma e o flagelo2,8,39,51. Essa condição, em última análise, permite a gravação de qualquer canal iônico ativo localizado na membrana plasmática do esperma. A solução de banho nominalmente livre de divalente (DVF) contendo césio ou sódio como o principal íon permeável é preferível para o registro de correntes CatSper monovalentes 2,8,39,51. Enquanto o canal CatSper conduz íons divalentes como Ca2+ e Ba2+, eles estão se movendo através do poro CatSper a uma taxa muito mais lenta, resultando em condutâncias quase imperceptíveis de alguns picoamperes (~ 10-20 pA) 2 , 8 , 39 , 51 . Assim, medir correntes monovalentes e, portanto, maiores, através do canal CatSper é uma maneira mais conveniente de avaliar a corrente (Figura 8). É importante notar que o CatSper também é permeável ao potássio; portanto, o canal CatSper deve ser bloqueado, ou espermatozóides deficientes em CatSper usados em situações em que se deseja estudar apenas os canais de potássio dos espermatozóides 2,3,8,28,65. Ao variar a composição iônica da pipeta e da solução do banho, pode-se excluir seletivamente certos canais iônicos, criando condições para o registro seletivo apenas de tipos específicos de canais iônicos. Por exemplo, a adição de Cs+ na solução de pipeta resulta no bloqueio da permeabilidade iônica através dos canais de potássio do esperma.
O canal CatSper é regulado de forma diferente entre as espécies de mamíferos.
Os espermatozoides de diferentes espécies são diversos em sua morfologia e vias regulatórias internas66. Não é surpresa que seus canais iônicos também sejam regulados exclusivamente de maneiras que refletem os microambientes especializados dos tratos reprodutivos masculino e feminino. O método de patch-clamp de esperma foi aplicado com sucesso a seis espécies de mamíferos: murino2, rato56, humano39,51, bovino, javali e macaco41, conforme mostrado na Figura 9. Para esses experimentos, espermatozóides de macacos rhesus machos adultos [Macaca mulatta] foram obtidos do Centro Nacional de Pesquisa de Primatas da Califórnia em conformidade com os padrões da Associação para Avaliação e Acreditação de Cuidados com Animais de Laboratório Internacional (AAALAC) sob protocolos animais aprovados pela Universidade da Califórnia, Davis, conforme descrito em41; e todos os estudos foram conduzidos de acordo com o Guia dos Institutos Nacionais de Saúde dos EUA para o Cuidado e Uso de Animais de Laboratório. O sêmen de touro e javali foi obtido como subprodutos isentos da aprovação específica da IACUC das instalações do Departamento de Ciência Animal da UCD e todos os animais foram mantidos em instalações aprovadas pela AAALAC. O sêmen de touro e javali também pode ser obtido de fontes comerciais.
Primatas (Rhesus macaque) e espermatozóides humanos mostraram propriedades e regulação semelhantes ao canal CatSper. Curiosamente, a ativação da progesterona de CatSper parece ser exclusiva dos espermatozóides de primatas (Figura 9 e 41), já que os espermatozoides de javalis, touros e roedores não exibiram nenhuma alteração estimulada por progesterona de suas correntes CatSper. Nos espermatozóides de touros e javalis, mesmo a atividade basal do canal CatSper estava abaixo dos limites detectáveis (Figura 9), sugerindo que, nessas espécies, o influxo de cálcio e a consequente hiperativação são impulsionados por outros canais / transportadores, ou que um estimulador natural diferente é necessário para a ativação de seus canais CatSper. Em todas as espécies de espermatozóides aqui mencionadas, incluindo espermatozóides de touro e macho, o acesso elétrico total ao interior dos espermatozóides foi obtido e as células foram registradas no modo de célula inteira, como ficou evidente pelo aparecimento dos grandes artefatos de capacitância ao invadir (Figura 7). Essa condição permite o fácil registro do canal CatSper funcional, e sua ausência nos espermatozoides de machos e bovinos indica que esse canal está bloqueado por um inibidor endógeno ainda desconhecido presente nos espermatozoides dessas espécies ou requer um modulador específico para ser ativado. No entanto, esses são experimentos preliminares e experimentos adicionais serão necessários para espermatozóides de machos e touros para garantir a importância funcional do canal CatSper nessas espécies. Esse amplo espectro de diversidade de canais iônicos de espermatozóides entre as espécies pode estar relacionado à proporção de espermatozóides para tamanho de óvulos, a relação entre o tamanho do espermatozóide e as vestimentas protetoras do óvulo ou servir como uma barreira à fertilização por outras espécies66.

Figura 1: Diversidade morfológica de espermatozoides de mamíferos. (A) Painel inferior: representação esquemática de um espermatozóide; compartimentos celulares são rotulados. Painéis superiores: Imagens DIC de espermatozóides de diferentes espécies no sentido horário: rato (Rn; Rattus norvegicus); mouse (Mm; Mus musculus); touro (Bt; Bos taurus); javali (Sd; sus scrofa domesticus); humano (Hs; Homo sapiens) e macaco rhesus (Mmu; Macaca mulatta). A barra de escala se aplica a todas as imagens DIC. As inserções indicam gotículas citoplasmáticas. (B) Remendo dos espermatozóides de mamíferos. Para obter uma formação de vedação bem-sucedida entre a ponta da pipeta e a membrana plasmática, parte da membrana plasmática é sugada suavemente para dentro da ponta da pipeta. A transferência para o modo de célula inteira é realizada rompendo a membrana plasmática entre a ponta e a célula (esta figura foi reproduzida a partir de8). Painel direito: espermatozóides humanos ligados a uma micropipeta de gravação. (C) Representação esquemática do espermatozóide humano e de alguns dos canais iônicos flagelares estudados em espermatozóides humanos com o método de patch clamp, bem como os íons que eles conduzem. CatSper- canal iônico de cálcio39,51; Hv1- canal de prótons 51,56,67; Slo3 / Slo1- canais de potássio 50,53,65,68; TRPV4- potencial receptor transitório canal catiônico vanilóide tipo 448. Clique aqui para ver uma versão maior desta figura.
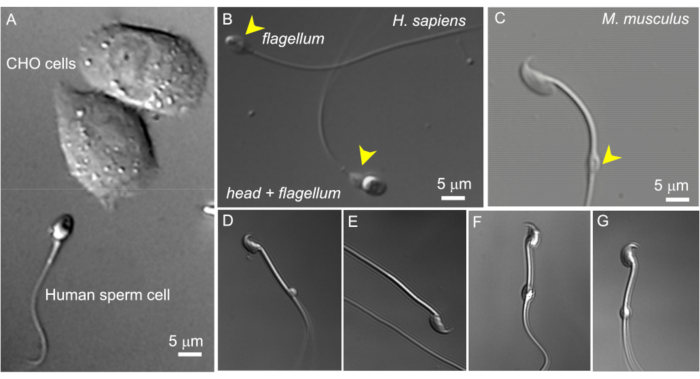
Figura 2: Tamanho do esperma e morfologia variável das gotículas citoplasmáticas. As imagens DIC de espermatozóides vivos intactos. (A) Comparação do tamanho de um espermatozóide humano (inferior) e duas células CHO (superior). (B) Espermatozóide humano intacto (Homo sapiens) (inferior) e um espermatozóide sem cabeça (flagelo, superior). As gotículas citoplasmáticas são indicadas por pontas de setas amarelas; Este número foi reproduzido a partir de8. (C) Espermatozóide murino (Mus musculus) intacto com as gotículas citoplasmáticas (CD) de formato normal indicadas pela ponta da seta amarela. (DG) Os espermatozoides murinos do epidídimo têm gotículas citoplasmáticas de diferentes tamanhos e formas; apenas (C) e (G) são adequados para patch-clamp. (D) CD é microscópico e unilateral; (E) CD está faltando; (F) CD tem partículas dentro que podem entupir a pipeta de gravação; (G) CD é liso, uniforme e não inchado. Formar um gigaseal com esse tipo de CD provavelmente resultará em uma gravação bem-sucedida. Clique aqui para ver uma versão maior desta figura.

Figura 3: Componentes do equipamento de grampo de remendo de esperma. (A) Equipamento típico de eletrofisiologia de esperma com componentes essenciais: (1) microscópio invertido; (2) digitalizador de baixo ruído; (3) amplificador; (4) micromanipulador de baixo desvio que é acoplado ao microscópio invertido com uma plataforma de micromanipulador; (5) computador PC; (6) uma mesa de ar de amortecimento de vibrações; (7) Gaiola de Faraday para proteger a configuração da interferência elétrica do ambiente. É essencial que todos os componentes elétricos do equipamento, incluindo teclado e mouse do computador, produzam baixo ou nenhum ruído elétrico (50 Hz ou 60 Hz) e que todos os componentes do equipamento estejam devidamente aterrados. (B) Extrator de micropipeta usado para registrar a fabricação de pipetas. (C) (1) microForge usado para polimento de pipetas; (2) Capilares de vidro borossilicato com diâmetro externo de 1,5 mm, diâmetro interno de 0,86 mm e um filamento interno; (3) caixa de coleta de pipetas. (D) Estágios de polimento de fogo de pipeta bem-sucedido: (a) Pipeta não polida com diâmetro interno de 2 mm; (b) Pipeta polida a fogo com diâmetro interno de 0,5 mm; (c) Pipeta selada excessivamente polida não adequada para gravação. Clique aqui para ver uma versão maior desta figura.

Figura 4: Componentes do sistema da câmara de registro e sua montagem. (A) Componentes essenciais do sistema da câmara de registro: (1) adaptador de platina de microscópio para plataformas da série 20 com (2) grampos de fixação de dois estágios; (3-4) plataforma aquecida magnética da série PM com (3) grampos magnéticos para segurar a câmara de perfusão; (5) câmara de perfusão; (6) ponte de ágar; (7) braçadeira magnética, eletrodo de referência com conector de 2 mm para pellet Ag / AgCl; (8) suporte magnético (MAG-1) para a linha de sucção; (9) tubo de sucção; (10) suporte O do tubo de sucção. (B) Sistema de câmara de gravação montado com os componentes indicados em (A). Clique aqui para ver uma versão maior desta figura.

Figura 5: Componentes do sistema de perfusão. (A) Linha de perfusão montada e (B) seus componentes essenciais: (1) seringas de 20 mL e 3 mL; (2) torneira com conexões Luer; 4 vias; fechadura masculina; (3) adaptador de farpa de mangueira luer fêmea, 1/16"; (4) Tubo de perfusão de politetrafluoretileno (PTFE) (Tubo Microbore PTFE, 0,022" ID × 0,042" OD); (5) Coletor de perfusão de 8 posições de politetrafluoretileno; (6) Tubo conector de silicone (tubo de silicone curado com platina, 1/32 "ID × 3/32" OD); (7) Tubulação do conector do coletor (tubulação de PTFE, 1/32 "ID × 1/16" OD). Clique aqui para ver uma versão maior desta figura.

Figura 6: Dissecção de camundongos machos. (A) Órgãos reprodutivos masculinos murinos; tanto o testículo quanto o epidídimo são mostrados. (B) Os epidídimos são transferidos para uma placa de cultura de células de 35 mm contendo solução de HS e a gordura residual e o ducto deferente removidos. (C) Cada epidídimo é então dividido em caput, corpo e cauda usando uma lâmina de bisturi # 15. Clique aqui para ver uma versão maior desta figura.

Figura 7: Formação de Gigaseal e invasão com o espermatozóide murino. A interface da ferramenta "Teste de Membrana" do software comercial de patch clamp. Três estágios de clampeamento do adesivo de esperma: (A) a pipeta registrada é imersa em uma solução de banho HS produzindo uma resistência à pipeta de 14,8 MΩ; (B) Um gigaseal é formado (a resistência é de 4,7 GΩ), os transientes de capacitância são compensados e o espermatozóide é retirado da lamínula; (C) Transição para o modo de célula inteira. O amaciamento e a transição para o modo de célula inteira são realizados aplicando pulsos de tensão curtos (1 ms) gradualmente crescentes (430-650 mV, incremento de ~ 50 mV) combinados com uma sucção leve, conforme mostrado à esquerda. A invasão ocorreu, como é evidente pelo aparecimento dos grandes transientes de capacitância que refletem toda a capacitância da célula (~ 2,93 pF para este espermatozóide). Clique aqui para ver uma versão maior desta figura.
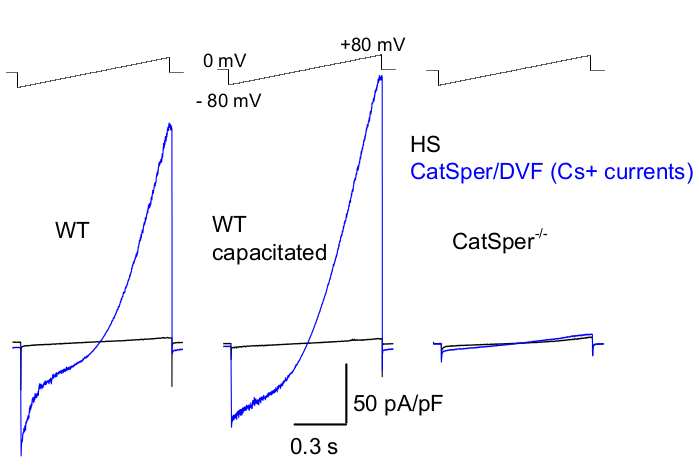
Figura 8: Registro de CatSper murino de espermatozóides do epidídimo da cauda do tipo selvagem (WT), capacitados e knockout para CatSper. Para registrar a atividade monovalente do CatSper, um protocolo de rampa é aplicado a cada 5 s e as correntes do CatSper são eliciadas por rampas de tensão de um potencial de retenção de 0 mV39,51. As rampas de tensão (-80 mV a 80 mV; 850 ms) são aplicadas em HS e solução nominalmente livre de divalente (DVF). Os dados foram amostrados em 2-5 kHz e filtrados em 1 kHz. As correntes basais são registradas em solução HS, que não produz corrente CatSper devido à inibição por alto magnésio extracelular39,51. As correntes de linha de base são úteis para estimar a condutância de fuga (vias de canais não iônicos). Densidades de corrente CatSper representativas de células inteiras Cs + (pA / pF; azul) registradas de espermatozóides murinos WT caudais (não capacitados; esquerdo e capacitado; meio) e espermatozóides murinos caudais deficientes em CatSper (direita). As correntes foram eliciadas por rampas de tensão de um potencial de retenção de 0 mV e rampas foram aplicadas de -80 mV a 80 mV em HS e solução nominalmente livre de divalentes. Correntes de linha de base (preto) registradas na solução HS. Para obter densidades de corrente, as amplitudes de corrente do CatSper foram normalizadas para capacitância celular (pA/pF). Clique aqui para ver uma versão maior desta figura.
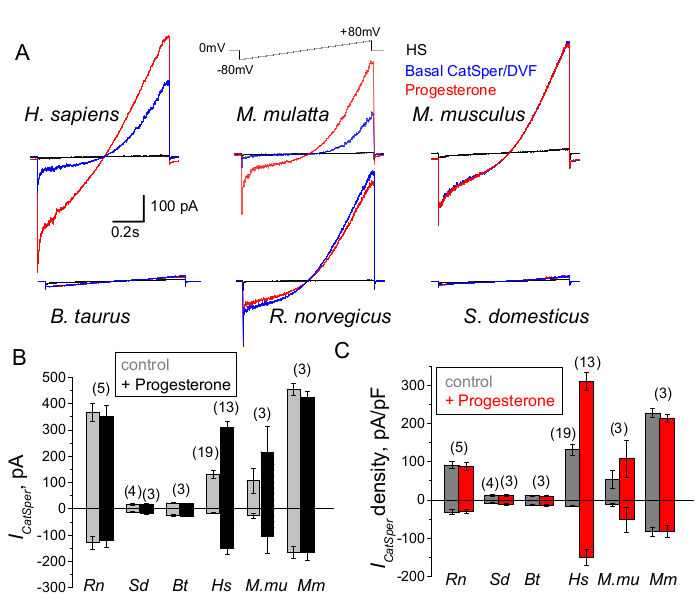
Figura 9: Regulação da progesterona de CatSper em diferentes espécies de mamíferos. (A) Corrente CatSper representativa eliciada de espermatozóides de diferentes espécies por um protocolo de rampa de voltagem, conforme indicado. Espécie: humana (Hs; H. sapiens); macaco rhesus (Mmu; M. mulatta), camundongo (Mm; M. musculus), touro (Bt; B. taurus); rato (Rn; R. norvegicus); javali (Sd; S. scrofa domesticus). Foram registradas as correntes CatSper na ausência (azul) e presença (vermelho) de progesterona 1 mM, bem como as correntes basais em solução de HS (preto). (B) Amplitudes de corrente CatSper (ICatSper, pA) e (C) Registros de densidades médias de corrente (pA/pF) de espermatozóides de diferentes espécies, conforme indicado; n indica o número de espermatozóides individuais usados. Os dados são Mean +/- S.E.M. Clique aqui para ver uma versão maior desta figura.

Figura 10: A diferença na motilidade flagelar. Dois exemplos representativos de gotículas citoplasmáticas e motilidade flagelar. As imagens sobrepostas dos mesmos espermatozóides de rato (Rn) e humanos (Hs) foram tiradas em dois momentos diferentes, quando mostram a deflexão flagelar mais distal. Retângulos pontilhados indicam a região com gotículas citoplasmáticas e sua mobilidade espacial correspondente. Clique aqui para ver uma versão maior desta figura.

Figura 11: Conjunto do tubo em U e seus componentes essenciais. (A) Componentes do tubo em U: (1) pipeta sorológica de 10 mL; (2) Tubulação de silicone; (3) Tubo conector de silicone; (4) seringa de 1 mL; (5) Adaptador de farpa luer fêmea; (6) adaptador de trava integral Luer macho 1/8"; (7) torneira com conexões Luer; 4 vias; fechadura masculina; (8) adaptador de farpa da série Luer macho, 1/16". (B) Tubo em U totalmente montado e (C) Tubo em U preso à gaiola de Faraday. Clique aqui para ver uma versão maior desta figura.
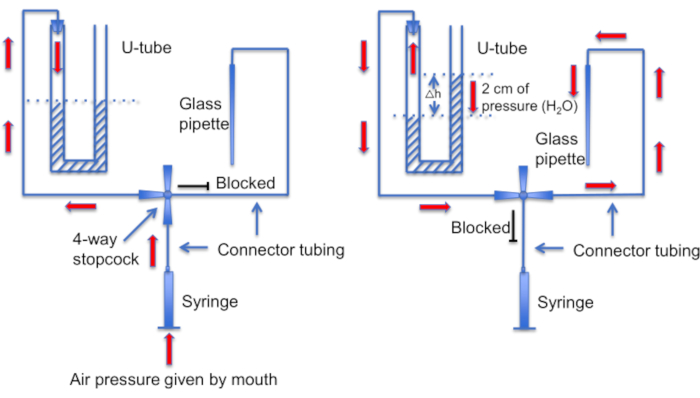
Figura 12: Uma representação esquemática do conjunto do tubo em U. Painel esquerdo: A pressão de ar positiva é fornecida pela boca para criar uma diferença nos níveis de líquido no tubo em U. O nível de líquido no chifre direito aumenta 2 cm. Depois que essa diferença de nível é criada, a torneira é girada para conectar o tubo em U à linha que leva a uma pipeta de registro. Painel direito: o nível de líquido mais alto na buzina direita cria pressão positiva que empurra constantemente a solução da pipeta para fora da ponta da pipeta e mantém a ponta limpa de detritos. Clique aqui para ver uma versão maior desta figura.
| Produtos químicos | Peso molar (g/mol) | milímetro | g para 1L |
| NaCl | 58.44 | 97.8 | 5,72 gramas |
| Kcl | 74.55 | 5 | 0,373 gramas |
| KH2PO4 | 136.09 | 0.37 | 50,4 mg |
| MgSO4 x 7.H2O | 246.48 | 0.2 | 49,3 mg |
| CaCl2 x 2.H2O | 147.02 | 2 | 0,294 gramas |
| HEPES | 238.3 | 20 | 4.766 gramas |
| Glicose | 180.2 | 3 | 0,540 gramas |
| Lactato de sódio (60% p/p) | 112.06 | 20 | 3 ml |
| Piruvato de sódio | 110 | 0.4 | 44 mg |
Tabela 1: Solução de fluido tubular humano (HTF)
| Produtos químicos | Peso molar (g/mol) | milímetro | g para 1L |
| NaCl | 58.44 | 135 | 7.889 gramas |
| Kcl | 74.55 | 5 | 0,373 gramas |
| CaCl2 x 2. H2O | 147.02 | 2 | 0,294 gramas |
| MgSO4 x 7. H2O | 246.48 | 1 | 0,247 gramas |
| HEPES | 238.3 | 20 | 4.766 gramas |
| Glicose | 180.2 | 5 | 0,901 gramas |
| Lactato de sódio (60% p/p) | 112.06 | 10 | 1,5 ml |
| Piruvato de sódio | 110 | 1 | 0,110 gramas |
Tabela 2: Solução de alta solução salina (HS)
| Produtos químicos | Peso molar (g/mol) | milímetro | g (para 500 ml) |
| CsMeSO3 | 228.0 | 140 | 15.960 gramas |
| HEPES | 238.3 | 40 | 4.766 gramas |
| EDTA | 292.24 | 1 | 0,146 gramas |
Tabela 3: Solução de banho CsMeSO3 (solução de banho livre divalente: DVF)
| Produtos químicos | Peso molar (g/mol) | milímetro | mg (para 25 ml) |
| CsMeSO3 | 228.0 | 130 | 741 mg |
| HEPES | 238.3 | 70 | 417 mg |
| EDTA | 292.24 | 2 | 14,6 mg |
| EGTA | 380.35 | 3 | 28,5 mg |
| CsCl | Solução 1 M | 1 | 25 μl |
Tabela 4: Solução de pipeta CsMeSO3
Discussão
Descrevemos um protocolo detalhado para realizar registros eletrofisiológicos de espermatozoides de várias espécies. Dada a importância fisiológica dos canais iônicos e transportadores eletrogênicos para espermatozóides, essa técnica é uma ferramenta poderosa para estudar a fisiologia dos espermatozoides, bem como os defeitos que levam à infertilidade masculina. O experimentador pode achar a execução dessa técnica desafiadora no início, mas com perseverança e resistência, o sucesso segue.
Os espermatozóides de mamíferos são longos (geralmente >50 μm), estreitos e altamente móveis. A frequência basal de batimentos (BF) dos espermatozóides de mamíferos varia muito, com valores médios de 4 Hz (camundongo 69), 7-15 Hz (javali 70,71), 11 Hz (rato 72), 11-20 Hz (touro 18), 24 Hz (macaco rhesus 23) e até 25 Hz (humano 3). A gotícula citoplasmática (CD) é a porta de entrada para o registro dos espermatozoides. Nos espermatozóides de roedores, o CD é frequentemente distal, mas se move ao lado do flagelo (Figura 10), criando um obstáculo adicional ao registro. No entanto, em espermatozóides humanos, a DC está mais comumente localizada perto da cabeça. Os principais componentes de um patch-clamp de esperma bem-sucedido são, portanto, uma excelente óptica para permitir uma visão clara e nítida do CD e um sistema de micromanipulador altamente preciso sem desvio ou vibração. Uma alta taxa inicial de falha é esperada e é normal nos primeiros dias após o clamp do adesivo de esperma. Recomendamos a prática de rotina envolvendo várias tentativas por semana. Conseguir várias gravações por dia por semana estabelecerá uma rotina e melhorará as habilidades motoras.
Até recentemente, a identificação e caracterização farmacológica dos canais iônicos do esperma era dificultada pela incapacidade de estudá-los diretamente. O campo dependia amplamente de estudos de imunocitoquímica, que muitas vezes sofrem de inespecificidade de anticorpos e / ou falta de modelos genéticos correspondentes. Para o estudo dos canais de cálcio, o método clássico de imagem de cálcio tem sido amplamente utilizado, que tem suas próprias vantagens e limitações 73,74,75,76,77. Embora a imagem de cálcio seja um método relativamente fácil que é aplicável para estudos de médio a alto rendimento 78,79,80,81 e seja menos invasivo, ele requer células relativamente intactas e, portanto, representa um obstáculo para dissecar a função dos canais iônicos desacoplados das cascatas de sinalização intracelular ou para distingui-los dos trocadores de íons de cálcio. Além disso, é difícil controlar o potencial de membrana e, portanto, mais difícil excluir a contribuição dos canais de cálcio dependentes de voltagem. Entre as várias vantagens da fluorometria de cálcio está o uso de corantes raciométricos de cálcio que permitem a medição precisa das mudanças na concentração de íons cálcio. Ao mesmo tempo, deve-se estar ciente de que a sensibilidade desses corantes pode variar com base nas alterações do pH intracelular.
Abaixo, descrevemos as etapas críticas dentro do protocolo, incluindo as etapas de solução de problemas do método. É essencial usar apenas reagentes puros para as preparações das soluções experimentais, pois mesmo uma pequena contaminação com íons indesejáveis (como magnésio ou metais pesados) pode prejudicar a detecção de correntes monovalentes. Dado o pequeno tamanho dos espermatozoides, pode-se esperar um número relativamente baixo de canais iônicos por célula. Portanto, a corrente líquida varia de alguns pA a várias centenas de pA. Portanto, o ruído elétrico interno da plataforma deve ser mínimo para garantir a detecção de pequenas correntes, e o uso de equipamentos sem desvios é altamente recomendado. Para distinguir uma condutância específica do ruído elétrico e vazamento de fundo, o aparelho de gravação e o sistema de aterramento devem ser maximizados. Isso é conseguido aterrando adequadamente o equipamento para evitar qualquer interferência elétrica82. O uso de uma gaiola de Faraday é altamente recomendado para proteger contra interferências elétricas produzidas por uma variedade de dispositivos elétricos, como luzes de edifícios e fiação elétrica na parede. É essencial que todos os componentes elétricos do equipamento, incluindo o teclado e o mouse do computador, irradiem pouco ou nenhum ruído elétrico (50 Hz ou 60 Hz) e que todos os componentes do equipamento estejam devidamente aterrados. O ruído elétrico na configuração de toda a célula quando todos os canais iônicos estão fechados deve ser < 0,5-1 pA.
Outro ponto importante é monitorar as osmolaridades corretas das soluções de trabalho. A composição das soluções intra e extracelulares deve ser determinada com precisão e suas osmolaridades medidas corretamente. A solução extracelular deve ser ligeiramente hipotônica em comparação com a solução de pipeta, pois leva a um inchaço celular minúsculo e evita que a pipeta seja obstruída pela membrana espermática. Nota: se a solução da pipeta for muito hipertônica e diferir da solução do banho em mais de 10 mOsm, ocorre inchaço celular excessivo e ruptura da vedação. Como resultado, a célula ficará frágil e o gigaseal será perdido segundos após a invasão. Em nossa experiência, a preparação imprecisa da solução é um dos erros mais comuns que impedem o sucesso do patch-clamping.
Outro obstáculo potencial a ser evitado é o plástico contendo plastificante/ftalato, bem como seringas lubrificadas com óleo mineral. Os tubos, seringas e todos os equipamentos plásticos que encontram soluções e, portanto, espermatozóides, não devem liberar plastificantes ou outras toxinas ou óleos ambientais, uma vez que esses produtos químicos podem alterar significativamente a atividade do canal iônico. Usamos tubos de Teflon de pequeno diâmetro como principal linha de perfusão. O teflon (PTFE) tem poucos compostos lixiviáveis, mas é bastante rígido. As conexões flexíveis são feitas de tubos de silício de alta pureza que se encaixam sobre o tubo de Teflon. Todas as seringas usadas para o sistema de perfusão carecem de lubrificante, pois o óleo mineral ou outros aditivos lubrificantes podem interferir no registro do canal iônico.
Não podemos exagerar a importância de usar o vidro certo e puxar o formato correto da micropipeta. Portanto, a fabricação ideal de micropipetas de vidro é um pré-requisito para um patch bem-sucedido. Usamos micropipetas de vidro feitas apenas de vidro borossilicato contendo um filamento para melhor enchimento da solução. A ponta das pipetas deve ser polida a fogo para fornecer a vedação estanque ideal. As ponteiras de pipeta que excedem 2 μm de diâmetro (e, portanto, têm uma resistência de 10 MΩ ou menos) geralmente não são adequadas para o patch-clamp de espermatozoides.
Outro passo importante é garantir que a ponta da micropipeta seja mantida limpa de quaisquer detritos ou bolhas de ar antes da formação da vedação. Esta é uma tarefa difícil, uma vez que a micropipeta é carregada em uma solução cheia de células móveis. Um fator que ajuda a evitar a "colisão" acidental da pipeta com os espermatozoides que nadam livremente é usar uma perfusão constante para lavar todas as células não aderentes. Outra ferramenta é um "tubo em U" caseiro que permite alternar entre os modos de pressão positiva e negativa para manter a ponta limpa (Figura 11 e Figura 12).
Como os espermatozoides variam muito na forma e no tamanho de suas gotículas citoplasmáticas (DC), é importante escolher uma gotícula com morfologia adequada. Conforme mostrado na Figura 2, apenas CDs pequenos (1-3 μm), lisos, uniformes e não excessivamente inchados são adequados para patch-clamp. Minúsculo, unilateral; CDs "inchados" e totalmente transparentes produzem selos fracos ou inexistentes. CDs que contêm grandes partículas solúveis em seu interior podem entupir a pipeta de gravação. Quando os espermatozóides testiculares de camundongos entram no epidídimo, seus CDs estão localizados na região do pescoço, perto da cabeça. À medida que viajam pelo epidídimo, seus CDs se movem ao longo da peça intermediária e, eventualmente, chegam à conexão entre a peça intermediária e a peça principal (o anel) quando os espermatozóides atingem o epidídimo da cauda. Portanto, como mencionado acima, em espermatozoides isolados do corpo do epidídimo, o CD geralmente está localizado próximo ao centro da peça intermediária. Nas células caudais, a DC geralmente pode ser encontrada próxima ao anel (Figura 2C). Para o esperma humano, o CD está localizado na região do pescoço (Figura 2A, B).
Embora isso não seja um problema para espermatozóides isolados de animais de laboratório, existe uma variabilidade significativa entre doadores humanos. A variação na qualidade do esperma dentro do mesmo doador afeta principalmente a qualidade da membrana plasmática do esperma e, às vezes, torna a formação de selos relativamente difícil. Há menos variabilidade no comportamento e na farmacologia dos canais iônicos, fatores que provavelmente se correlacionam com a genética ou fisiologia individual. É preciso ser persistente e avaliar amostras de várias doações durante vários dias, bem como contar com vários participantes doadores humanos. Trabalhar com material humano requer paciência extra, uma vez que o esperma doado varia muito na qualidade do esperma dentro do mesmo doador, dependendo de vários fatores ambientais. Recomendamos avaliar amostras de vários dias de doação para tomar uma decisão final sobre o status do doador. Enquanto os espermatozóides purificados ejaculados são geralmente adequados para eletrofisiologia em poucas horas (até 12 horas após o isolamento do esperma humano), os espermatozoides murinos do epidídimo são adequados para tamponamento apenas dentro de uma janela de 2 horas após o isolamento.
E por último, mas não menos importante, a formação de gigaselos difere entre os espermatozoides. Para espermatozóides murinos / roedores, a formação de gigaseal acontece quase instantaneamente, enquanto vários segundos (e às vezes até um minuto) são necessários para formar um gigaseal com um esperma humano. Freqüentemente, a sucção inicial resulta em uma resistência de entrada que varia de 200 MΩ a 800 MΩ. Mudar o potencial de retenção para -60 mV e fornecer pulsos curtos de "Teste de Membrana" de até 10 mV geralmente ajuda a resgatar a formação de gigaseal (por meio do movimento induzido pelo campo de tensão da membrana na pipeta).
A técnica de patch clamp de células espermáticas permite o estudo detalhado de canais iônicos específicos em seu sistema de expressão natural. O sucesso da técnica depende de equipamentos adequados, espermatozóides viáveis de alta qualidade, reagentes puros, habilidades básicas de eletrofisiologia, paciência e persistência. O método abre novas fronteiras na fisiologia do esperma ao estudar a diversidade evolutiva dos canais iônicos, os mecanismos de sua regulação e as alterações em sua função à medida que se movem do trato reprodutivo masculino para o feminino e são alterados por condições exógenas, como pH e ligantes.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo NIH Grant R01GM111802, Pew Biomedical Scholars Award 00028642, Alfred P. Sloan Award FR-2015-65398 e Packer Wentz Endowment Will (para P.V.L.). Este trabalho também foi apoiado pela Deutsche Forschungsgemeinschaft (Fundação Alemã de Pesquisa) 368482240/GRK2416 (para NM) e pela China Scholarship Council Fellowship para BL Agradecemos ao Dr. Dan Feldman por compartilhar tecido de rato, Katie Klooster e Stuart Meyers da UC Davis pela ajuda na aquisição de espermatozóides de primatas e Steven Mansell pela ajuda na análise de aquisição de dados de espermatozóides de javali e touro.
Materiais
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
Referências
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados