Method Article
تسجيل التيارات الكهربائية عبر غشاء البلازما لخلايا المنوية من الثدييات
In This Article
Summary
يصف هذا البروتوكول كيفية إجراء التسجيلات الكهربائية من خلايا المنوية للثدييات في تكوين خلية كاملة ، بهدف تسجيل نشاط القناة الأيونية مباشرة. كانت هذه الطريقة مفيدة في وصف الملامح الفيزيولوجية الكهربية للعديد من قنوات أيونات المنوية وساعدت في الكشف عن هويتها الجزيئية وتنظيمها.
Abstract
كان تسجيل النشاط الكهربائي من واحدة من أصغر خلايا كائن الثدييات - خلية المنوية - مهمة صعبة لعلماء الفيزيولوجيا الكهربية لعدة عقود. تم تقديم الطريقة المعروفة باسم "مشبك رقعة المنوية" في عام 2006. لقد مكن من التسجيل المباشر لنشاط القناة الأيونية في التكوينات الكاملة للخلية والخلايا وكان له دور فعال في وصف فسيولوجيا خلايا المنوية والهوية الجزيئية لقنوات أيون الكالسيوم والبوتاسيوم والصوديوم والكلوريد والبروتون. ومع ذلك ، فإن التسجيل من المنوية المفردة يتطلب مهارات متقدمة وتدريبا في الفيزيولوجيا الكهربية. يلخص هذا البروتوكول التفصيلي الإجراء خطوة بخطوة ويسلط الضوء على العديد من "حيل التجارة" من أجل إتاحته لأي شخص يرغب في استكشاف فسيولوجيا خلية المنوية الرائعة. على وجه التحديد ، يصف البروتوكول التسجيل من خلايا المنوية البشرية والفئران ولكن يمكن تكييفه بشكل أساسي مع أي خلية منوية من الثدييات من أي نوع. يغطي البروتوكول تفاصيل مهمة لتطبيق هذه التقنية ، مثل عزل خلايا المنوية ، واختيار الكواشف والمعدات ، وتثبيت الخلايا شديدة الحركة ، وتشكيل الختم المحكم (جيجاأوم) بين قطب التسجيل وغشاء البلازما لخلايا المنوية ، والانتقال إلى وضع المنوية الكاملة (المعروف أيضا باسم الاقتحام) ، والتسجيلات النموذجية لقناة أيون الكالسيوم لخلية المنوية ، CatSper ، من ستة أنواع من الثدييات. تتم مناقشة مزايا وقيود طريقة مشبك رقعة المنوية ، بالإضافة إلى الخطوات الأكثر أهمية.
Introduction
على غرار مشبك التصحيح التقليدي الذي اخترعه إروين نيهر وبيرت ساكمان1 ، يتيح مشبك تصحيح خلايا المنوية استجواب نشاط القناة الأيونية الفردية ، بالإضافة إلى التسجيل من نشاط مجموعة القنوات الأيونية بأكملها داخل الخلية المفردة2،3. تسمح الطريقة بتحديد نوع معين من القنوات الأيونية تحت درجات الانفصال عن العمليات الأنزيمية داخل الخلايا. هذه الطريقة ضرورية لتحديد نشاط القناة الأيونية بناء على بصمات الأصابع الفيزيولوجية الكهربية والدوائية ، وبالتالي توفر استراتيجية تحديد موثوقة. الجانب السلبي للطريقة هو عدم قدرتها على اكتشاف الناقلات غير الكهربائية. بالإضافة إلى ذلك ، فإن التدريب الفيزيولوجي الكهربي الأساسي مفيد لفهم الفروق الدقيقة في البروتوكول. لإتقان تقنية مشبك التصحيح وتطبيقها على المنوية للثدييات ، نوصي بدراسة أدبيات مشبك التصحيح الأساسية4،5. في هذه الورقة ، نقدم إجراء مفصلا خطوة بخطوة ونسلط الضوء على الممارسات الفريدة التي تجعل هذه التقنية سهلة الفهم ومتاحة لأي شخص يرغب في ممارسة الفيزيولوجيا الكهربية لخلايا المنوية.
التوازن الأيوني هو وظيفة فسيولوجية أساسية لخلايا المنوية التي تعتمد بشكل كبير على القنوات الأيونية والناقلات الأيونية للحفاظ على التدرجات الأيونية المهمة من الناحية الفسيولوجية ، وتغيير الكالسيوم داخل الخلايا ، وتغيير جهد الغشاء. تنظم القنوات الأيونية وناقلات الأيونات وظائف خلايا المنوية الأساسية مثل الحركة ، والملاحة في الجهاز التناسلي الأنثوي ، ونضوج المنوية ، وفي الكائنات البحرية ، الانجذاب الكيميائي نحو البويضة6،7،8،9،10،11،12. حركة المنوية هي عملية مكتسبة تدريجيا. تكون خلايا المنوية هادئة بشكل أساسي أثناء نضجها في الخصية وأثناء مرورها اللاحق عبر البربخ. يتم تقييد حركتها من خلال بيئة البربخ الحمضية التي تؤدي إلى تحمض داخلي لخلية المنوية. هذا يضعف وظيفة المحور العصبي لأنه غير قادر على العمل تحت الرقم الهيدروجيني 6.013،14. ومع ذلك ، عند التعرض للسوائل المنوية أو بيئة أكثر قلوية ، تخضع تركيزات أيونات المنوية داخل الخلايا ودرجة الحموضة السيتوبلازمية لتغييرات كبيرة وتصبح المنوية متحركة15،16،17. يتم تشغيل حركة سوط المنوية عن طريق التحلل المائي ATP الذي يدعم انزلاق الأنابيب الدقيقة المحورية18 وهذه العملية تعتمد بشكل كبير على درجة الحموضة14. بالإضافة إلى ذلك ، يتم التحكم في حركة السوط أيضا عن طريق ارتفاع الكالسيوم داخل السوط و cAMP13،19،20،21،22،23،24. هذه العوامل ، أي تركيز الكالسيوم داخل الخلايا للحيوانات المنوية [Ca2 +] i و pH و ATP و cAMP هي الآليات التنظيمية الرئيسية التي تسمح بتغييرات الحركة ويتم تنظيم تركيزاتها بإحكام بواسطة قنوات أيون المنوية والناقلات.
خلايا المنوية فريدة من نوعها من حيث أنها تعبر عن عدد من البروتينات التي لا يمكن العثور عليها في أي مكان آخر في الجسم. ومن الأمثلة البارزة قنوات أيون المنوية ، مثل قناة البوتاسيوم ، Slo325،26،27،28،29 وقناة Catالأيونية ل Sperm ، CatSper2،30،31،32. هذا الأخير هو قناة الكالسيوم الرئيسية للحيوانات المنوية للثدييات31 ، ويتم تنظيمه عن طريق القلوية داخل الخلايا2،30،31،32،33،34. يتم تنظيم CatSper أيضا من خلال الإشارات الخاصة بالأنواع7،35 ويتم تنظيمها في مجالات نانوية طولية رباعية الأضلاع على طول سوط المنوية36،37،38. في الرئيسيات ، يتم تنشيط CatSper عن طريق مزيج من القلوية السوطية ، وإزالة الاستقطاب الغشائي والبروجسترون3،39،40،41 ، بينما بالنسبة للفئران CatSper ، لا يلزم تنشيط هرمون البروجسترون2،39. ميزة أخرى محددة لهذه القناة هي تنظيمها متعدد الوحدات الفرعية: CatSper عبارة عن مجمع من 10 وحدات فرعية مختلفةعلى الأقل 31،32،34،37،38،42،43،44،45،46،47. أعاقت هذه البنية المتطورة وخصائص تنظيمها التعبير المؤتلف ل CatSper في أي نظام تعبير غير متجانس معروف ، وبالتالي اقتصر التوصيف الفسيولوجي ل CatSper على نظامه الأصلي للتعبير - خلية المنوية. بينما تم تحقيق التوصيف الجزيئي لبروتين CatSper في الورق المنوي في عام 2000 بواسطة D. Ren et. al.31 ، الدليل النهائي على أن CatSper هي قناة أيونية حسنة النية لم يكن ممكنا إلا بعد إدخال طريقة مشبك رقعة المنوية في عام 20062. منذ ذلك الحين ، سمحت هذه التقنية بالتوصيف الدقيق للعديد من مسارات توصيل الأيونات في خلايا المنوية9،28،37،39،40،44،46،48-54.
يعتقد أن الطريقة الكلاسيكية والأكثر مباشرة لدراسة خصائص القناة الأيونية - تقنية مشبك التصحيح - غير قابلة للتطبيق على خلايا المنوية بسبب حركتها ومورفولوجيتها المحددة (الشكل 1 أ). على وجه التحديد ، كان الحجم الصغير لسيتوبلازم المنوية والارتباط الضيق لغشاء بلازما المنوية بالهياكل الصلبة داخل الخلايا مثل غمد المنوية الليفية والنواة هي التحديات الرئيسية55. تؤدي هاتان الميزتان الهيكليتان إلى خلية رفيعة على شكل سهم مصممة لاختراق البيئات شديدة اللزوجة مثل الملابس الواقية للبيض ، دون تشوه كبير أو تلف غشاء البلازما.
تتمثل الخطوة الأولى في طريقة مشبك التصحيح في إنشاء مانع التسرب المحكم بين ماصة التسجيل (ماصة زجاجية دقيقة) وغشاء بلازما الخلية. من أجل تحقيق ذلك ، يتعين على المرء سحب ما يكفي من غشاء البلازما داخل ماصة التسجيل لتشكيل جيجا مستقر ميكانيكيا بين غشاء البلازما والزجاج. يجب أن يكون غشاء البلازما مرنا وغير صلب (الشكل 1 ب). كما ذكرنا أعلاه ، فإن سطح غشاء بلازما المنوية بالكامل ملتصق بإحكام إلى حد ما ، باستثناء المنطقة المعروفة باسم القطرة السيتوبلازمية (الشكل 1 أ والشكل 2). ومن ثم ، اعتبرت الطبيعة الصلبة لغشاء بلازما المنوية عقبة رئيسية في الحصول على الختم المحكم أو "gigaseal" ، والذي سمي بهذا الاسم لأن >109 أوم مطلوبة للتسجيلات الجيدة. ومع ذلك ، فإن إدخال تقنية مشبك رقعة المنوية في عام 20062 أزال هذا الحاجز ويمكن تطبيق هذه الطريقة بنجاح على خلايا المنوية من العديد من أنواع الثدييات2،41،51،56. تم تحقيق هذا الاختراق من خلال التركيز على القطرة السيتوبلازمية (CD) 2،8 ، وهي بنية صغيرة موجودة على طول منتصف المنوية (الشكل 1 أ والشكل 2) ، وهي ببساطة بقايا المنوية الممدودة - وهي مقدمة لخلايا المنوية يتطور منها الرأس والذيل. من الناحية الوظيفية ، قد يساعد الخلية على التكيف مع التغيرات في الأسمولية خارج الخلية أثناء القذف. الميزة المهمة هي أن غشاء البلازما داخل القرص المضغوط مرن بما يكفي ليتم سحبه إلى الماصة لتشكيل مانع تسرب جيجا أوم. وبالتالي ، فإن قرص المنوية هو أفضل جزء على سطح المنوية يمكن للمرء من خلاله تحقيق تكوين جيجاسيل ناجح والانتقال إلى وضع الخلية الكاملة الذي يقرن في النهاية خلية المنوية كهربائيا بمضخم مشبكالتصحيح 2،8. تجدر الإشارة إلى أن المنشورات السابقة أبلغت عن تكوين جيجاسيل ناجح في رأس المنوية ، مما يتيح التسجيل في التكوين المرتبط بالخلية54،57،58،59. ومع ذلك ، لم يتم الإبلاغ عن التسجيلات في تكوين الخلية الكاملة حتى الآن إلا عن طريق إجراء تكوين جيجاسيل في منطقة القرص المضغوط. يسمح وضع الخلية الكاملة هذا بالوصول الكهربائي إلى الحجم الكامل لخلايا المنوية ، وبالتالي يسمح باكتشاف أنشطة القناة الأيونية الموجودة على سوط المنوية ، وكذلك على رأس المنوية. لبضع سنوات فقط منذ تطويرها ، أدت تقنية مشبك رقعة المنوية إلى تقدم هائل في فهمنا لقنوات أيون المنوية وهي حتى الآن واحدة من أقوى التقنيات للتحقيق المباشر في وظائف قنوات أيون المنوية9،28،37،39،40،44،46،48،49 ،50،51،52،53 (الشكل 1).
يختلف مشبك رقعة المنوية في بعض التفاصيل عن تقنية مشبك التصحيح الكلاسيكية كما هو موضح أدناه. أولا ، يرتبط معظم غشاء بلازما المنوية بإحكام بالبنية الصلبة داخل الخلايا ، وبالتالي ، لا تحتوي المنوية على غشاء بلازما "احتياطي" تقريبا ليتم سحبه إلى الماصة. المنطقة الوحيدة المرنة هي غشاء القرص المضغوط الذي يشبه غشاء البلازما للعديد من الخلايا الجسدية ، وبالتالي ، يمكن سحبه بسهولة إلى الماصة. لتشكيل ختم جيجا أوم باستخدام القرص المضغوط ، يتم إنشاء الضغط السالب عن طريق الشفط الضوئي في الجزء العلوي من الماصة من أجل سحب جزء صغير من غشاء بلازما المنوية إلى طرف الماصة الدقيقة (الشكل 1 ب). يشكل هذا الجزء من الغشاء غزوا على شكل Ω في طرف الماصة ويثبت ختما محكما بجدرانه الداخلية.
ثانيا ، تتراوح القطرة السيتوبلازمية في المنوية البشرية والفئران بين 1 و 2 ميكرومتر (الشكل 1 والشكل 2). ومن ثم ، فإن تطبيق تقنية مشبك التصحيح على مثل هذا الكائن الصغير يتطلب بصريات عالية الدقة. تم تجهيز معظم منصات مشبك التصحيح للحيوانات المنوية بمجهر مقلوب مع تباين تداخل تفاضلي (DIC) أو مكونات بصرية Nomarski (الشكل 2 والشكل 3). يوصى بشدة باستخدام مجهر مزود ببصريات DIC لمشبك تصحيح المنوية على بصريات تباين الطور التقليدية ، نظرا لأن المعلومات المكانية التي تظهر في DIC تساعد على تحقيق دقة فائقة في وضع ماصة التصحيح على القرص المضغوط الصغير. نقترح أيضا استخدام هدف الغمر في الماء 60x أو عدسة مماثلة ، بفتحة عددية تبلغ 1.2. هذا الهدف له مسافة عمل طويلة (0.28 مم) ، مما يسمح بمراقبة خلايا المنوية التي تسبح بحرية في المحلول (الشكل 2). يحتوي الهدف أيضا على طوق ضبط للتكيف مع سمك زلة الغطاء (متغير من 0.13 إلى 0.21 مم). يتيح هذا المزيج من مسافة العمل الطويلة وطوق الضبط المراقبة من خلال زلتين للغطاء 0.13 مم. تعمل زلة الغطاء الواحدة كقاع زجاجي لغرفة التسجيل ، ويتم وضع زلة الغطاء مقاس 5 مم مع خلايا المنوية المترسبة في الأعلى. كما هو موضح أدناه ، فإن ترسيب خلايا المنوية على أغطية مستديرة قابلة للتبديل بسهولة مقاس 5 مم ، بدلا من الجزء السفلي من غرفة التسجيل مباشرة ، هو طريقة ملائمة لتحميل خلايا المنوية الجديدة في غرفة التسجيل.
ثالثا ، يجب أن يكون جهاز مشبك رقعة المنوية مزودا بمكبر صوت منخفض الضوضاء ومحول رقمي لتسجيل التيارات الكهربائية الصغيرة (نطاق بيكوأمبيري) والتغيرات الضئيلة في إمكانات الغشاء. يجب أن يضمن هذا الجهاز أقل ضوضاء مكبر للصوت. يعد غياب الاهتزاز جزءا أساسيا من تسجيل مشبك التصحيح الناجح. يتطلب تثبيت رقعة المنوية مناور دقيق خال من الانجراف يمكن توصيله بالمجهر المقلوب باستخدام منصة مناور دقيق لضمان استقرار أفضل من حامل المعالجة الدقيقة المستقل (الشكل 3 أ). لاختبار الإعداد، لا ينبغي للمرء أن يرى أي حركة لطرف الماصة (أقل من 60 ضعفا من التكبير) حتى عندما يقفز الشخص لأعلى ولأسفل على الأرض بالقرب من طاولة عزل الاهتزاز.
Protocol
تم إجراء جميع التجارب وفقا لإرشادات المعاهد الوطنية للصحة للأبحاث على وتمت الموافقة عليها من قبل لجنة رعاية واستخدام بجامعة كاليفورنيا في بيركلي (AUP 2015-07-7742) ، مع بذل كل جهد ممكن لتقليل معاناة. تتوافق جميع الطرق الموصوفة مع توصيات الفريق المعني بالقتل الرحيم التابع للجمعية الطبية البيطرية الأمريكية ولجنة IACUC. تمت الموافقة على جميع الإجراءات التجريبية التي تستخدم عينات مشتقة من الإنسان من قبل لجنة البحوث البشرية في جامعة كاليفورنيا ، بيركلي ، رقم بروتوكول IRB 2013-06-5395.
1. صنع ماصات زجاجية دقيقة لتسجيل مشبك تصحيح المنوية في الخلية الكاملة.
ملاحظة: يتطلب الحجم الصغير للقطرة السيتوبلازمية ماصات زجاجية دقيقة ذات أطراف دقيقة.
- لتصنيع الماصات الدقيقة ، ابدأ بالشعيرات الدموية الزجاجية البورسليكات بقطر خارجي 1.5 مم وقطر داخلي 0.86 مم وخيوط داخلية. اسحب الطرف الموجود على مجتذب ماصة دقيقة (الشكل 3 ب).
- لتشكيل وتلميع طرف الماصة ، ضع سلكا ساخنا على مقربة من الطرف للحظة. قم بإجراء عملية تلميع الحريق هذه تحت تكبير 100x باستخدام ملمع ماصة (الشكل 3C,D).
- تأكد من أن القطر الداخلي لطرف الماصة هو ~2 ميكرومتر قبل تلميع الحريق ويتم تقليله إلى ~0.5 ميكرومتر بعد التلميع المناسب.
ملاحظة: يوصى فقط باستخدام الماصات المسحوبة حديثا المصنوعة في يوم التسجيل. هذا يتجنب تراكم جزيئات الغبار على طرف الماصة.
2. إعداد الحفارة
- تجميع غرفة التسجيل
- استخدم غرفة نضح منخفضة الحجم على شكل ماسي مع تدفق رقائقي وأسعار صرف محلول سريعة نسبيا (الشكل 4). قم بتوصيل الغرفة عبر مشعب بنظام التروية الذي يتغذى بالجاذبية (الشكل 5).
- لنشر محلول من خلال غرفة التسجيل ، قم بتجميع نظام نضح بسيط عصامي التغذية بالجاذبية مع مشعب بولي تترافلورو إيثيلين يربط غرفة التروية بثمانية خطوط نضح منفصلة.
ملاحظة: يجب ألا تتسرب الأنابيب الملدنات إلى المحاليل ، لأن هذه المواد الكيميائية يمكن أن تؤثر بشكل كبير على الوظيفة الطبيعية لخلايا المنوية60 وتغير نشاط القناة الأيونية61،62 . يوصى بشدة باستخدام أنابيب بولي تترافلورو إيثيلين ذات قطر صغير كأنبوب التروية الرئيسي. - نظرا لأن أنابيب البولي تترافلورو إيثيلين صلبة إلى حد ما ، فقم بإجراء وصلات مرنة مع أنابيب سيليكون عالية النقاء تتناسب مع أنابيب البولي تترافلورو إيثيلين. بالإضافة إلى ذلك ، استخدم المحاقن (على سبيل المثال ، نوع حقنة Luer Lock) التي تفتقر إلى مواد التشحيم ، لأن الزيوت المعدنية أو إضافات زيوت التشحيم الأخرى يمكن أن تتداخل مع تسجيل القناة الأيونية (الشكل 5).
- تجميع جسر أجار
- لتجنب التغييرات المحتملة في تقاطع السائل أثناء التسجيلات ، حافظ على استقرار البيئة المحيطة بالقطب المرجعي باستخدام جسر أجار (الشكل 4).
- لإنشاء جسر أجار ، اصنع شعيرات دموية زجاجية على شكل حرف L عن طريق ثنيها تحت نار موقد بنسن صغيرة واتركها تبرد.
- اصنع محلول 1٪ agarose في 1 M KCl وقم بتسخينه في الميكروويف حتى يذوب الاغاروز ويصبح المحلول شفافا. املأ الشعيرات الدموية الزجاجية على شكل حرف L بعناية بالمحلول أعلاه لتجنب فقاعات الهواء واتركها تبرد إلى درجة حرارة الغرفة. يمكن تخزين جسور الأجار في 1 M KCl لمدة ~ 2 أشهر عند +4 درجة مئوية.
- لاستخدام جسر أجار ، املأ القطب المرجعي للحبيبات Ag / AgCl ب 1 M KCl وأدخل جسر الأجار بعناية لتجنب خروج الاغاروز المتصلب من الشعيرات الدموية الزجاجية.
- بعد ذلك ، أدخل الدبوس الذهبي (2 مم) لسلك واجهة مكبر الصوت في فتحة القطب المرجعي 2 مم (ذهبي) وأدخل نهاية جسر أجار على شكل حرف L في غرفة التروية كما هو موضح في الشكل 4.
- الحلول والوصفات
ملاحظة: يجب أن تكون جميع الكواشف والمواد الكيميائية ذات درجة نقاء عالية. يتم ترشيح جميع المحاليل المحضرة من خلال مرشح PES معقم 0.22 ميكرومتر وتخزينها عند 4 درجات مئوية لمدة تصل إلى شهر واحد. وتجدر الإشارة إلى أن الضبط الدقيق للأوسمولية هو شرط أساسي لتثبيت التصحيح الناجح.- تحضير محلول السائل الأنبوبي البشري (HTF) كما هو موضح في الجدول 1. اضبط الرقم الهيدروجيني إلى 7.4 باستخدام هيدروكسيد الصوديوم. يجب أن تكون الأسمولية 280 ± 5 مللي أسم ، ويتم قياسها باستخدام مقياس التناضح لضغط البخار.
- قم بإعداد محلول "حمام" أو "خارج الخلية" عالي الملوحة (HS) كما هو موضح في الجدول 2. اضبط الرقم الهيدروجيني إلى 7.4 باستخدام هيدروكسيد الصوديوم. يجب أن تكون الأسمولية 320 ± 5 مللي أسم.
- تحضير "حمام" سيزيوم ميثان سولفونات أو محلول "خارج الخلية" كما هو موضح في الجدول 3. اضبط الرقم الهيدروجيني إلى 7.4 باستخدام CsOH والأسمولية إلى 320 ± 5 مللي أسم.
- لتحضير محلول "ماصة" السيزيوم ميثان سلفونات (CsMeSO3) داخل الخلايا ، اتبع الجدول 4 واضبط الرقم الهيدروجيني على 7.4 باستخدام CsOH. يجب أن تكون الأسمولية أعلى بمقدار 10 مللي أسم من محلول HS.
3. عزل وتنقية المنوية للثدييات
ملاحظة: القتل الرحيم للفئران الذكور C57BL / 6 الذين تتراوح أعمارهم بين 3-6 أشهر عن طريق استنشاق ثاني أكسيد الكربون2 متبوعا بخلع عنق الرحم. بعد خلع عنق الرحم ، قم بإجراء جمع الأنسجة (الذيل أو الجسم البربخي) من الفئران على الفور.
- عزل المنوية الفئرانية البربخية
ملاحظة: القتل الرحيم للفئران الذكور C57BL / 6 الذين تتراوح أعمارهم بين 3-6 أشهر عن طريق استنشاق ثاني أكسيد الكربون2 متبوعا بخلع عنق الرحم. بعد خلع عنق الرحم ، قم بإجراء جمع الأنسجة (الذيل أو الجسم البربخي) من الفئران على الفور.- افتح منطقة أسفل البطن من الفأر بالمقص واستخرج كلا البربخ.
- ضعها في طبق ثقافة خلية 35 مم مملوء بمحلول HS (محلول عالي الملوحة ، انظر الجدول 2). تأكد من تسخين كمية من محلول HS مسبقا إلى درجة حرارة الغرفة قبل ملامسة خلايا المنوية.
- انقل البربخ إلى طبق ثقافة خلوي جديد يحتوي على محلول HS وقم بإزالة جميع الدهون المتبقية تماما.
- افصل البربخ إلى كابوت وجسد وذيل باستخدام شفرة مشرط # 15 (الشكل 6).
- انقل الجسم (أو الذيل إذا لزم الأمر) لكل بربخ إلى طبق ثقافة خلوي جديد يحتوي على محلول HS. قم بعمل شقوق متعددة في الجزء المعزول من البربخ باستخدام شفرة مشرط مدببة # 11.
- نقل أجزاء البربخ ذات الشقوق المتعددة إلى أنبوب طرد مركزي دقيق سعة 1.5 مل يحتوي على محلول HS سعة 1.5 مل.
- رج خلايا المنوية لفترة وجيزة من البربخ إلى المحلول باستخدام ملقط دومون من النوع 5 أ فائق الدقة. تخلص من البربخ واترك الأنبوب في درجة حرارة الغرفة لمدة 10 دقائق.
- انتظر حتى ترسبات المادة الصلبة (الخلايا غير المنوية) إلى قاع الأنبوب، ثم انقل المادة الطافية إلى أنبوب طرد مركزي دقيق آخر سعة 1.5 مل.
- قم بتخزين خليط المنوية في درجة حرارة الغرفة مع إمكانية الوصول إلى الهواء لمدة تصل إلى ساعتين ، وخلال هذه الفترة يمكن إجراء التجارب. تفقد المنوية المعزولة أدائها بعد 3 ساعات من العزلة.
- سعة المنوية للفأر
ملاحظة: جميع المنوية البربخية مناسبة لمشبك الرقعة ، ولكن المنوية من الذيل البربخ فقط هي الناضجة بما يكفي لتصبح مؤهلة للإخصاب. نظرا لأن المنوية الذيلية يمكن أن تخضع للسعة ، فقم بإجراء تجارب ، وخاصة سعة المنوية ، باستخدام خلايا المنوية الذيلية.- قم بجمع المنوية على المنوية الذيلية أو المنوية (انظر الخطوات 3.1.1-4).
- خذ caudae معزولا كما هو موضح في الخطوة 3.1.4. وتطبيق شقوق متعددة كما هو موضح في الخطوة 3.1.5. انقل الكادة إلى طبق ثقافة خلية مقاس 10 مم مع 2 مل من محلول السعة.
- احتضان النسيج الذيلي في محلول السعة هذا في البداية لمدة 10 دقائق عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 ، ثم تخلص من الأنسجة واحتضان خلايا المنوية المنبعثة لمدة 50-80 دقيقة أخرى.
ملاحظة: يتم تحقيق السعة في المختبر للحيوانات المنوية الذيلية للفأر عن طريق الحضانة لمدة 60-90 دقيقة. يتم التعرف على خلايا المنوية السعوية بصريا بناء على الانحناء غير المتماثل المفرط لسوطها المعروف باسم فرط النشاط. يسمح هذا النوع من الحركة للحيوانات المنوية بالسباحة بطريقة غير خطية.
- جمع وتنقية المنوية البشرية
ملاحظة: في هذه الحالة ، تم الحصول على عينات من السائل المنوي الطازج من إجمالي 21 متطوعا أصحاء تتراوح أعمارهم بين 21 و 38 عاما وتم تنقية الحيوانات المنوية بتقنية السباحة في درجة حرارة الغرفة كما هو موضح بالتفصيل في48،63 . باختصار ، الإجراء هو كما يلي:- اترك عينات القذف البشرية في درجة حرارة الغرفة لمدة 60 دقيقة للسماح بالتسييل قبل تنقيتها (قد تؤثر الفترات الأطول سلبا على جودة المنوية).
- سخن حوالي 7 مل من محلول HTF إلى 37 درجة مئوية في أنبوب طرد مركزي سعة 50 مل. قم بتقييم حجم القذف بصريا - إذا كان الحجم أكبر من 1 مل ، فقم بإعداد أنابيب متعددة من محلول HTF.
- ضع بعناية 1 مل من القذف المسال في قاع كل أنبوب دون رفع خيوط السائل المنوي إلى سطح العازلة. يجب أن تكون واجهة السائل المنوي إلى HTF واضحة قدر الإمكان. تجنب فقاعات الهواء.
- ضع الأنابيب في حاضنة 37 درجة مئوية لمدة ساعة واحدة في حامل يحملها بزاوية 45 درجة للحصول على أقصى مساحة سطح. إذا كانت الحاضنة عبارة عن حاضنة ثاني أكسيد الكربون2 ، فأغلق الغطاء بإحكام لمنع تحمض المخزن المؤقت (ثاني أكسيد الكربون2 غير مطلوب لهذا الإجراء). أثناء الحضانة ، سوف تسبح المنوية المتحركة تدريجيا نحو سطح عازلة HTF.
- بعد ساعة واحدة ، اجمع الجزء العلوي 1 مل من جميع العينات في أنبوب طرد مركزي سعة 15 مل ، وبالتالي الجمع بين المنوية عالية الجودة وعالية الحركة لتثبيت التصحيح. لا تحاول إزالة كل المادة الطافية - تترك عدة مل من HTF المتبقية فوق البلازما المنوية لتجنب التلوث. يمكن تخزين تعليق الخلية المنقى في درجة حرارة الغرفة لعدة ساعات.
ملاحظة: يجب أن يحتوي القذف الطبيعي على ما لا يقل عن 15 × 106 خلايا منوية لكل مل64 ، لكن عدد المنوية يختلف اختلافا كبيرا بين العينات. يمكن التغلب على عقبة انخفاض عدد الخلايا عن طريق ترك تعليق المنوية المنقى لمدة 30-60 دقيقة في درجة حرارة الغرفة قبل تثبيت الرقعة. في ظل هذه الحالة ، ستتراكم الخلايا تدريجيا في الجزء السفلي من أنبوب الطرد المركزي وتشكل سحابة خلوية مرئية يمكنك من خلالها ماصة الخلايا في غرفة التسجيل (انظر أدناه).
- سعة المنوية البشرية
ملاحظة: يمكن تحقيق السعة في المختبر للحيوانات المنوية البشرية عن طريق الحضانة لمدة 4 ساعات في محلول السعة: 20٪ مصل بقري للجنين ، 25 ملي مولار NaHCO3 في مخازن HTF أو HS48،51 . يمكن التعرف على خلايا المنوية ذات السعة بصريا بناء على حركتها القوية والانحناء غير المتماثل المفرط للسوط الذي يسمح للحيوانات المنوية بالسباحة بطريقة غير خطية.- قم بإعداد محلول سعة 2x واخلط 1: 1 مع تعليق المنوية.
- قم بإجراء الحضانة عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 4 ساعات على الأقل. لضمان نسبة عالية من الخلايا ذات السعة ، يجب ألا يقل وقت الحضانة عن 4 ساعات.
4. تحضير محلول الطلاء (مطلوب فقط لمشبك تصحيح المنوية البشرية)
ملاحظة: تتمثل إحدى الخطوات الأساسية في رفع المنوية المرفقة من الغطاء قبل اقتحامها. هذه الخطوة ضرورية فقط لخلايا المنوية البشرية وتتطلب طلاء الغطاء الزجاجي لإنشاء سطح زجاجي أقل لزوجة. يقلل طلاء الغطاء من احتمالية التصاق خلايا المنوية بالغطاء ويسمح برفع المنوية البشرية من الغطاء الزجاجي بعد تكوين الجيجاسيل بنجاح.
- تمييع 200 ميكرولتر من القذف في 5 مل من محلول HS في أنبوب طرد مركزي سعة 15 مل.
- قم بالدوران لأسفل على حرارة 300 × جم لمدة 5 دقائق وقم بإزالة المادة الطافية.
- أعد تعليق الحبيبات في 1 مل من محلول HS وانقلها إلى أنبوب الطرد المركزي الدقيق.
- سونيكات لمدة 10 دقائق عند 25 درجة مئوية باستخدام حمام صوتنة مملوء بالماء.
- تدور لأسفل عند 10,000 × جم لمدة 5 دقائق.
- انقل المادة الطافية إلى أنبوب طرد مركزي دقيق جديد واستخدمه للطلاء (التعليمات أدناه).
5. تسجيل التوصيل الأيوني من غشاء بلازما المنوية بالكامل.
- ربط المنوية بالغطاء.
ملاحظة: قبل تسجيل مشبك التصحيح ، يتم طلاء المنوية على زلات غطاء دائرية مقاس 5 مم.- إذا كنت تعمل مع الخلايا البشرية ، فقم بغمس الأغطية لفترة وجيزة في محلول الطلاء المحضر باستخدام ملقط حاد.
- ضع أربعة شرائح غطاء في بئر واحد من صفيحة 4 آبار وقم بتغطيتها ب 300 ميكرولتر من محلول HS. امنع انزلاق الغطاء من الطفو عن طريق لصقه في قاع اللوحة المكونة من 4 آبار، ودفعها بالطرف البلاستيكي لجهاز ماصة.
- قم بتعليق المعلقات المركزة للحيوانات المنوية البشرية (الخطوة 3.3.5) أو الفأر برفق (الخطوة 3.1.9) من أنبوب التخزين (20-50 ميكرولتر من المنوية المركزة) في 300 ميكرولتر من محلول HS فوق الغطاء.
- تأكد من تراكم المنوية في قاع البئر حيث تلتصق رؤوسها بالغطاء وسوف تنبض سوطها بقوة في المحلول الموجود فوق زلة الغطاء مباشرة. من المهم السماح للحيوانات المنوية بالترسيب على الغطاء لمدة 10 دقائق تقريبا في درجة حرارة الغرفة قبل التسجيل.
ملاحظة: إذا كانت المنوية البشرية ملتصقة بشكل سيئ ، فارجع إلى الخطوة 5.1.1 وقم بتخفيف محلول الطلاء المحضر بمحلول HS (1: 20 إلى 1: 2). يجب تعديل هذه الخطوة وفقا لعينات المنوية من متبرعين بشريين مختلفين بناء على حركة المنوية المتغيرة الشائعة في مستحضرات المنوية البشرية.
- وضع زلة الغطاء
- خذ غطاء واحدا به خلايا ملتصقة قليلا من البئر وضعه في بئر على شكل ماسي لغرفة التسجيل التي تحتوي على محلول HS (الشكل 4).
- قم بتشغيل نظام التروية (الشكل 5) المملوء بمحلول HS لشطف الغرفة وإزالة الحطام المنوية الزائدة المنفصلة من الغرفة. سيؤدي ذلك إلى زيادة احتمالية بقاء الماصة المسجلة نظيفة عند وصولها إلى الخلايا. هذه الخطوة مفيدة عند العمل مع الخلايا غير السعوية التي تميل إلى الالتصاق بالغطاء بشكل أقوى.
ملاحظة: في حالة التسجيل من المنوية السعوية ، يجب على المرء تجنب تشغيل التروية فور وضع زلة غطاء جديدة في الغرفة. المنوية بالسعة لها حركة قوية ولا ترتبط إلا بشكل فضفاض بالغطاء. لذلك ، لضمان توفر أكبر عدد من المنوية ذات السعة ، من المهم الانتظار ~ 10 دقائق وترك المنوية السعوية تلتصق بالغطاء قبل تشغيل التروية. بمجرد اختيار الخلية السعوية المناسبة وتشكيل gigaseal ، يمكن إعادة تشغيل التروية.
- اختيار خلية المنوية لتسجيل المشبك بالتصحيح.
- ابحث عن خلية منوي مناسبة بقطرة سيتوبلازمية باستخدام تكبير 600x (انظر أدناه). يتم ذلك باستخدام لين الغمر في الماء 60x كما هو موضح في الطرق ذات العدسة المكبرة 10x. في خلايا المنوية المعزولة من الجسم البربخي ، عادة ما يكون القرص المضغوط بالقرب من مركز القطعة الوسطى. في الخلايا الذيلية ، يمكن العثور على القرص المضغوط عادة بالقرب من الحلقة (الشكل 2 ج). بالنسبة للحيوانات المنوية البشرية ، يقع القرص المضغوط في منطقة الرقبة (الشكل 2 أ ، ب).
ملاحظة: بالإضافة إلى ذلك ، يمكن استخدام خيار التكبير القابل للسحب بمقدار 1.6x للمجهر لفحص مورفولوجيا المنوية عن كثب (التكبير 960x). - تأكد من أن القطرة السيتوبلازمية بيضاوية الشكل ولها شكل ممدود قليلا (الشكل 2G) يشبه المغزل. غالبا ما تكون الأقراص المضغوطة التي تبدو مستديرة جدا ومكبرة هشة وغير مناسبة للترقيع (الشكل 2D ، F).
- حدد منويا متحركا مع توصيل الرأس بالغطاء ، بحيث تكون خلية المنوية ثابتة جزئيا ، لكن القرص المضغوط وبقية السوط يستمر في التحرك مع ضرب السوط. تأكد من أن رأس المنوية متصل بشكل فضفاض بالغطاء بحيث يدور قليلا أثناء تحرك السوط من جانب إلى آخر.
ملاحظة: يعد التثبيت الفضفاض مهما لأنه بعد تكوين ختم الجيجاأوم وقبل الانتقال إلى وضع الخلية الكاملة ، يجب رفع المنوية من الغطاء إلى المحلول.
- ابحث عن خلية منوي مناسبة بقطرة سيتوبلازمية باستخدام تكبير 600x (انظر أدناه). يتم ذلك باستخدام لين الغمر في الماء 60x كما هو موضح في الطرق ذات العدسة المكبرة 10x. في خلايا المنوية المعزولة من الجسم البربخي ، عادة ما يكون القرص المضغوط بالقرب من مركز القطعة الوسطى. في الخلايا الذيلية ، يمكن العثور على القرص المضغوط عادة بالقرب من الحلقة (الشكل 2 ج). بالنسبة للحيوانات المنوية البشرية ، يقع القرص المضغوط في منطقة الرقبة (الشكل 2 أ ، ب).
- تشكيل gigaseal
ملاحظة: لتسجيل تيارات CatSper أحادية التكافؤ في وضع الخلية الكاملة، تمتلئ الماصات بمحلول Cs-methanesulfonate (يشار إليه أيضا باسم الماصة أو داخل الخلية) (الجدول 4) - ينتج عن ذلك مقاومة للماصة تتراوح من 11 إلى 17 MΩ (الشكل 7A)، كما يتم حسابها تلقائيا بواسطة مكبر الصوت عند تطبيق خطوة جهد من 0 مللي فولت إلى 10 مللي فولت. يمكن أيضا ملء الماصات بحلول أخرى حسب التطبيق. يوصى بصنع المحاليل باستخدام الأنيونات المتنقلة مثل ميثان سلفونات أو Cl- أو الأسبارتات أو أيونات مماثلة لتقليل مقاومة الماصة. يجب أن تكون أسمولية محلول الماصة أعلى بمقدار 10 مللي أسم من محلول الحمام. يساعد التوتر المرتفع قليلا لمحلول الماصة على الحفاظ على مقاومة الوصول إلى خلايا المنوية منخفضة قدر الإمكان أثناء تسجيل المشبك بالترقع.- بعد الاختيار البصري لخلية المنوية ذات التشكل المناسب (الشكل 2G)، املأ الماصة الدقيقة بمحلول ماصة (الجدول 4) وثبته في حامل الماصة.
- للحفاظ على نظافة طرف الماصة من الحطام، قم بالضغط الإيجابي على الماصة باستخدام مجموعة على شكل أنبوب U لضمان تدفق محلول الماصة من الطرف بعد غمره في المحلول خارج الخلية، والذي يشار إليه أيضا باسم محلول "الحمام" (انظر الجدول 2).
ملاحظة: إذا سمحت الظروف بذلك، ينصح بشدة بتكوين مانع التسرب تحت التروية المستمرة، لأن هذه الحالة تضمن أنظف طرف ماصة. - اخفض الماصة لأسفل واغمر طرفها في محلول الحمام (الجدول 2). في هذا الوقت، يمكن قياس مقاومة الماصة (الشكل 7 أ).
- من أجل تصور الخلية بوضوح، ضع طرف الماصة فوق القرص المضغوط مع محاذاة فتحة الطرف قطريا (حوالي 45 درجة) باتجاه القرص المضغوط.
- اخفض طرف الماصة بسرعة باتجاه القرص المضغوط ليكون في نفس المستوى البؤري، في نطاق بضعة ميكرومترات من القرص المضغوط.
- بمجرد أن يلمس طرف الماصة القرص المضغوط ، قم بالضغط السلبي على الماصة باستخدام "لسان حال" لتحريك جزء من القطرة إلى الطرف وتشكيل ختم جيجاأوم - المعروف أيضا في الفيزيولوجيا الكهربية باسم "حدث الشفط". عادة، بعد التلامس الأولي مع طرف الماصة، يمكن الحفاظ على الضغط السلبي في الماصة لمدة تصل إلى دقيقة لتحقيق مانع تسرب جيجا أوم تدريجيا.
- بعد التكوين الناجح لختم الجيجاأوم (> 4-20 GΩ) ، ارفع المنوية من الغطاء (الشكل 7 ب).
ملاحظة: هذه الخطوة غير مطلوبة لخلايا المنوية للقوارض بسبب طولها. ومع ذلك ، فإن الانفصال الجزئي لسوط المنوية مفيد للتخفيف من انجراف الماصة المحتمل. انفصال المنوية البشرية هو خطوة أساسية ، لأن القرص المضغوط صغير (1 ~ 3 ميكرومتر) ؛ إذا تركت الخلية متصلة بالغطاء ، فحتى الانجراف الطفيف للماصة أثناء التجربة يمكن أن يعطل القرص المضغوط. بعد رفع المنوية ، يستمر السوط عادة في النبض ، بينما ترتبط الخلية فقط بالماصة الدقيقة.
- اقتحام والانتقال إلى وضع الخلية بأكملها.
- قم بتعويض عابرات السعة الشاردة باستخدام الوضع التعويضي لمكبر الصوت قبل الانتقال إلى وضع الخلية بأكملها (الشكل 7 ب). لمراقبة عابرات السعة في البداية ، احتفظ بجهد الغشاء عند 0 مللي فولت وقم بتطبيق نبضات 10 مللي فولت باستخدام أداة "اختبار الغشاء" (الشكل 7 ب).
- قم بإجراء اقتحام والانتقال إلى وضع الخلية بأكملها عن طريق تطبيق نبضات جهد قصيرة (1 مللي ثانية) متزايدة تدريجيا (430-650 مللي فولت ، ~ 50 مللي فولت) جنبا إلى جنب مع شفط خفيف جدا (الشكل 7C).
ملاحظة: لتطبيق نبضات الاقتحام ، استخدم بروتوكول الاقتحام المبرمج مسبقا داخل برنامج مشبك التصحيح. يتم تطبيق نبضات جهد الاختراق على المنوية باستخدام مدخلات أمر الجهد العالي (التبديل الخلفي) في الجزء الخلفي من مكبر الصوت. - بعد تطبيق كل نبضة جهد اقتحام ، قم بتشغيل أداة اختبار الغشاء للتحقق مما إذا كانت عابرات السعة أكبر تظهر.
ملاحظة: يشير وجود عابرات سعة كبيرة (الشكل 7 ج) إلى حدوث الاقتحام ، ويتم قياس السعة الكاملة للخلية (~ 1 pF للحيوانات المنوية البشرية و ~ 2.5 pF أو أكثر للحيوانات المنوية من الفئران). - قم بتركيب عابرات السعة الكبيرة باستخدام أداة اختبار الغشاء لتحديد سعة الخلية بأكملها بالإضافة إلى مقاومة الوصول إليها.
ملاحظة: يجب أن تكون مقاومة الوصول منخفضة قدر الإمكان من أجل التروية الفعالة للجزء الداخلي من خلية المنوية بمحلول الماصة الدقيقة ، وكذلك لمشبك الجهد الموثوق به لغشاء بلازما المنوية. عادة ما تكون مقاومة الوصول 25-30 MΩ و 50-70 MΩ للحلول داخل الخلايا القائمة على Cs + / K + و NMDG ، على التوالي. - بعد الاقتحام الناجح ، تابع تجارب مشبك التصحيح للخلية بأكملها المخطط لها ، مثل تطبيق حلول الحمام المختلفة (الشكل 8) التي تحتوي على مركبات مختلفة أو قياس أنشطة القناة باستخدام خطوة الجهد (الشكل 8 ، الشكل 9) أو بروتوكولات منحدر الجهد. إذا لم ينجح الاختراق، فارجع إلى الخطوة 6.4.1. عن طريق اختيار ماصة دقيقة جديدة واختيار خلية منوية أخرى مناسبة.
النتائج
تسمح طريقة مشبك رقعة المنوية بالتسجيل المباشر لقناة CatSper.
كما ذكرنا أعلاه ، تم إجراء تسجيلات CatSper عن طريق إنشاء ختم عالي المقاومة (جيجا أوم) بين ماصة التصحيح المنوية للثدييات عند قطرتها السيتوبلازمية. عند اقتحام وضع الخلية بأكملها والانتقال إليه ، يتم الحصول على وصول كهربائي كامل إلى جسم خلية المنوية بالكامل وداخلها ، بما في ذلك رأس المنوية والسوط2،8،39،51. تسمح هذه الحالة في النهاية بالتسجيل من أي قناة أيونية نشطة موجودة على غشاء بلازما المنوية. يفضل محلول الحمام الخالي من ثنائي التكافؤ اسميا (DVF) الذي يحتوي على السيزيوم أو الصوديوم كأيون رئيسي لتسجيل تيارات CatSper أحادية التكافؤ 2،8،39،51. بينما تقوم قناة CatSper بتوصيل أيونات ثنائية التكافؤ مثل Ca2+ و Ba2+ ، فإنها تتحرك عبر مسام CatSper بمعدل أبطأ بكثير ، مما يؤدي إلى موصليات بالكاد يمكن اكتشافها لعدد قليل من بيكوأمبير (~ 10-20 باسكال باسكال) 2،8،39،51. ومن ثم ، فإن قياس التيارات أحادية التكافؤ ، وبالتالي التيارات الأكبر ، من خلال قناة CatSper هو طريقة أكثر ملاءمة لتقييم التيار (الشكل 8). من المهم ملاحظة أن CatSper أيضا قابل للاختراق للبوتاسيوم. لذلك ، يجب حظر قناة CatSper ، أو استخدام خلايا المنوية التي تعاني من نقص CatSper في المواقف التي يريد فيها المرء دراسة قنوات البوتاسيوم لخلايا المنويةفقط 2،3،8،28،65. من خلال تغيير التركيب الأيوني للماصة ومحلول الحمام، يمكن للمرء استبعاد قنوات أيونية معينة بشكل انتقائي، مع تهيئة الظروف للتسجيل الانتقائي من نوع (أنواع) قناة أيونية محددة فقط. على سبيل المثال ، تؤدي إضافة Cs + إلى محلول الماصة إلى منع نفاذية الأيونات من خلال قنوات بوتاسيوم المنوية.
يتم تنظيم قناة CatSper بشكل مختلف بين أنواع الثدييات.
تتنوع خلايا المنوية من الأنواع المختلفة في مورفولوجيتها ومساراتها التنظيميةالداخلية 66. ليس من المستغرب أن يتم تنظيم قنواتها الأيونية أيضا بشكل فريد بطرق تعكس البيئات الدقيقة المتخصصة للأجهزة التناسلية للذكور والإناث. تم تطبيق طريقة مشبك رقعة المنوية بنجاح على ستة أنواع من الثدييات: الفئران2 ، والجرذان56 ، والإنسان39،51 ، والأبقار ، والخنزير ، المكاك41 كما هو موضح في الشكل 9. بالنسبة لهذه التجارب ، تم الحصول على خلايا المنوية من المكاك الريسوسية الذكور البالغين [Macaca mulatta] من المركز الوطني لأبحاث الرئيسيات في كاليفورنيا وفقا لمعايير جمعية تقييم واعتماد منظمة رعاية المختبر الدولية (AAALAC) بموجب بروتوكولات المعتمدة من قبل جامعة كاليفورنيا ، ديفيس كما هو موضح في41; وأجريت جميع الدراسات وفقا لدليل المعاهد الوطنية الأمريكية للصحة لرعاية واستخدام المختبر. تم الحصول على السائل المنوي للثور والخنازير كمنتجات ثانوية معفاة من موافقة IACUC المحددة من مرافق قسم علوم الحيوان في UCD وتم الاحتفاظ بجميع الحيوانات في مرافق معتمدة من AAALAC. يمكن أيضا الحصول على السائل المنوي للثور والخنازير من مصادر تجارية.
أظهرت الرئيسيات (المكاك ريسوس) المنوية البشرية خصائص وتنظيم قناة CatSper مماثلة. ومن المثير للاهتمام ، أن تنشيط هرمون البروجسترون ل CatSper يبدو أنه فريد من نوعه بالنسبة للحيوانات المنوية للرئيسيات (الشكل 9 و 41) ، حيث لم تظهر المنوية من الخنازير والثور والقوارض أي تغيير يحفز هرمون البروجسترون في تيارات CatSper الخاصة بهم. في المنوية للثيران والخنازير ، حتى نشاط قناة CatSper القاعدية كان أقل من الحدود التي يمكن اكتشافها (الشكل 9) ، مما يشير إلى أنه في هذه الأنواع ، يكون تدفق الكالسيوم وما يترتب على ذلك من فرط النشاط مدفوعا بقنوات / ناقلات أخرى ، أو أن هناك حاجة إلى محفز طبيعي مختلف لتنشيط قنوات CatSper الخاصة بهم. في جميع أنواع المنوية المذكورة هنا ، بما في ذلك خلايا المنوية للثور والخنازير ، تم الحصول على الوصول الكهربائي الكامل إلى الجزء الداخلي من خلايا المنوية وتم تسجيل الخلايا في وضع الخلية بأكملها ، كما يتضح من ظهور القطع الأثرية ذات السعة الكبيرة عند الاقتحام (الشكل 7). تسمح هذه الحالة بالتسجيل السهل لقناة CatSper الوظيفية ، ويشير غيابها عن المنوية للخنازير والأبقار إلى أن هذه القناة إما محظورة بواسطة مثبط داخلي غير معروف حتى الآن موجود في خلايا المنوية لهذه الأنواع أو تتطلب تنشيط معدل معين. ومع ذلك ، فهذه تجارب أولية وستكون هناك حاجة إلى تجارب إضافية لخلايا المنوية للخنازير والثور لضمان الأهمية الوظيفية لقناة CatSper في هذه الأنواع. يمكن أن يكون هذا الطيف الواسع لتنوع قنوات أيون المنوية بين الأنواع مرتبطا بنسبة حجم المنوية إلى البويضة ، أو العلاقة بين حجم المنوية والثياب الواقية للبويضة ، أو يكون بمثابة حاجز أمام الإخصاب بواسطة الأنواع الأخرى66.

الشكل 1: التنوع المورفولوجي للحيوانات المنوية من الثدييات. (أ) اللوحة السفلية: تمثيل تخطيطي للحيوانات المنوية. يتم تصنيف المقصورات الخلوية. الألواح العلوية: صور DIC للحيوانات المنوية من أنواع مختلفة في اتجاه عقارب الساعة: الفئران (Rn; Rattus norvegicus) ؛ الماوس (مم ؛ Mus musculus) ؛ الثور (Bt; بوس الثور) ؛ خنزير (Sd; سوس سكروفا دومستيكوس) ؛ الإنسان (Hs; الإنسان العاقل) ، والمكاك الريسوس (Mmu ؛ Macaca mulatta). ينطبق شريط المقياس على جميع صور DIC. تشير الإدخالات إلى قطرات السيتوبلازم. (ب) ترقيع خلايا المنوية للثدييات. لتحقيق تكوين مانع تسرب ناجح بين طرف الماصة وغشاء البلازما، يتم امتصاص جزء من غشاء البلازما برفق في طرف الماصة. يتم النقل إلى وضع الخلية الكاملة عن طريق تمزيق غشاء البلازما بين الطرف والخلية (تم استنساخ هذا الشكل من8). اللوحة اليمنى: خلايا المنوية البشرية متصلة بماصة دقيقة مسجلة. (ج) التمثيل التخطيطي للحيوانات المنوية البشرية وبعض القنوات الأيونية السوطية التي تمت دراستها في خلايا المنوية البشرية باستخدام طريقة مشبك التصحيح ، بالإضافة إلى الأيونات التي تجريها. قناة أيون الكالسيومCatSper- 39،51 ؛ Hv1- قناة البروتون51،56،67 ؛ Slo3 / Slo1- قنوات البوتاسيوم50،53،65،68 ؛ TRPV4- المستقبلات العابرة المحتملة قناة الفانيليويد من النوع 448. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
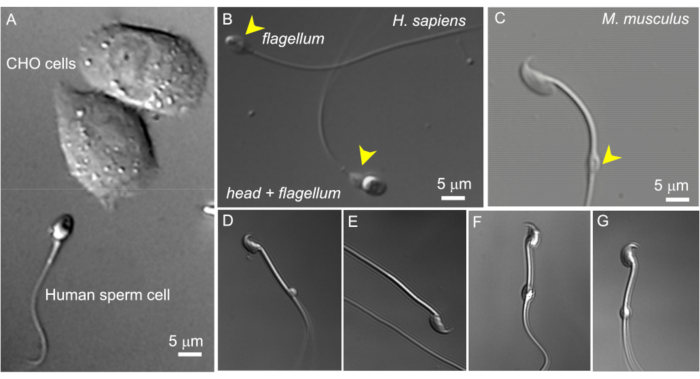
الشكل 2: حجم المنوية والتشكل المتغير للقطرات السيتوبلازمية. صور DIC لخلايا المنوية الحية السليمة. (أ) مقارنة بين حجم خلية المنوية البشرية (الأسفل) وخليتين من خلايا CHO (العليا). (ب) المنوية البشرية السليمة (الإنسان العاقل) (أسفل) وخلية منوية مقطوعة الرأس (سوط ، علوي). يشار إلى قطرات السيتوبلازمية برؤوس سهام صفراء. تم استنساخ هذا الرقم من8. (ج) المنوية السليمة من الفئران (Mus musculus) مع قطرات السيتوبلازم ذات الشكل الطبيعي (CD) المشار إليها برأس السهم الأصفر. (D-G) تحتوي خلايا المنوية الفئرانية البربخية على قطرات سيتوبلازمية بأحجام وأشكال مختلفة. فقط (C) و (G) مناسبان لمشبك التصحيح. (د) القرص المضغوط مجهري وأحادي الجانب؛ (ه) عدم وجود قرص مدمج؛ (و) يحتوي القرص المضغوط على جزيئات بداخله قد تسد ماصة التسجيل؛ (ز) القرص المضغوط ناعم وموحد وغير منتفخ. من المحتمل أن يؤدي تكوين جيجاسيل باستخدام هذا النوع من الأقراص المضغوطة إلى تسجيل ناجح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مكونات جهاز الفيزيولوجيا الكهربية للحيوانات المنوية مع المكونات الأساسية: (1) مجهر مقلوب. (2) محول رقمي منخفض الضجيج ؛ (3) مكبر للصوت. (4) مناور دقيق منخفض الانجراف مقترن بالمجهر المقلوب بمنصة مناور دقيق ؛ (5) كمبيوتر شخصي؛ (6) طاولة هواء مثبطة للاهتزاز ؛ (7) قفص فاراداي لحماية الإعداد من التداخل الكهربائي المحيط. من الضروري أن تنتج جميع مكونات الحفارة التي تعمل بالكهرباء ، بما في ذلك لوحة مفاتيح الكمبيوتر والماوس ، ضوضاء كهربائية منخفضة أو معدومة (50 هرتز أو 60 هرتز) وأن تكون جميع مكونات الحفارة مؤرضة بشكل صحيح. (ب) مجتذب الماصات الدقيقة المستخدمة لتسجيل تصنيع الماصة. (ج) (1) microForge المستخدم في تلميع حريق الماصة ؛ (2) الشعيرات الدموية الزجاجية البورسليكات بقطر خارجي 1.5 مم ، وقطر داخلي 0.86 مم وخيوط داخلية ؛ (3) صندوق جمع الماصة. (د) مراحل التلميع الناجح للحريق بالماصة: (أ) ماصة غير مصقولة بقطر داخلي يبلغ 2 مم؛ (ب) ماصة مصقولة بالحريق بقطر داخلي يبلغ 0.5 مم؛ (ج) ماصة محكمة الغلق مصقولة بشكل مفرط غير مناسبة للتسجيل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: مكونات نظام غرفة التسجيل وتجميعه. (أ) المكونات الأساسية لنظام غرفة التسجيل: (1) محول مرحلة المجهر لمنصات السلسلة 20 مع (2) مشابك تثبيت على مرحلتين. (3-4) منصة تسخين مغناطيسية من سلسلة PM مع (3) مشابك مغناطيسية لعقد غرفة التروية ؛ (5) غرفة التروية. (6) جسر أجار. (7) المشبك المغناطيسي ، القطب المرجعي مع مقبس 2 مم إلى بيليه Ag / AgCl ؛ (8) حامل مغناطيسي (MAG-1) لخط الشفط ؛ (9) أنبوب الشفط. (10) أنبوب الشفط O-حامل. (ب) نظام غرفة التسجيل المجمعة مع المكونات المشار إليها من (أ). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: مكونات نظام التروية. (أ) خط التروية المجمعة و (ب) مكوناته الأساسية: (1) محاقن سعة 20 مل و 3 مل؛ (2) محبس مع وصلات لور ؛ 4 اتجاه. قفل الذكور (3) أنثى محول خرطوم لوير بارب ، 1/16 بوصة ؛ (4) أنابيب نضح البولي تترافلورو إيثيلين (PTFE) (أنابيب PTFE Microbore ، 0.022 "معرف × 0.042" OD) ؛ (5) مشعب التروية من البولي تترافلورو إيثيلين 8 مواضع ؛ (6) أنابيب موصل السيليكون (أنابيب سيليكون معالجة بالبلاتين ، معرف 1/32 بوصة × 3/32 بوصة OD) ؛ (7) أنابيب موصل مشعب (أنابيب PTFE ، معرف 1/32 بوصة × 1/16 بوصة OD). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تشريح ذكور الفأر. (أ) الأعضاء التناسلية الذكرية للفئران. يتم عرض كل من الخصية والبربخ. (ب) يتم نقل البربخ إلى طبق مزرعة خلية 35 مم يحتوي على محلول HS وإزالة الدهون المتبقية والأسهر. (ج) ثم يتم تقسيم كل بربخ إلى كابوت وجسم وذيل باستخدام شفرة مشرط # 15. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: تكوين Gigaseal واقتحام خلية المنوية الفئرانية. واجهة أداة "اختبار الغشاء" لبرنامج مشبك التصحيح التجاري. ثلاث مراحل من لقط رقعة المنوية: (أ) مغمورة الماصة المسجلة في محلول HS للحمام مما ينتج عنه مقاومة ماصة تبلغ 14.8 MΩ ؛ (ب) يتم تشكيل جيجاسيل (المقاومة 4.7 GΩ) ، ويتم تعويض عابرات السعة ، ويتم رفع المنوية من الغطاء ؛ (ج) الانتقال إلى وضع الخلية الكاملة. يتم إجراء الاقتحام والانتقال إلى وضع الخلية بأكملها عن طريق تطبيق نبضات جهد قصيرة (1 مللي ثانية) متزايدة تدريجيا (430-650 مللي فولت ، ~ 50 مللي فولت) جنبا إلى جنب مع شفط الضوء ، كما هو موضح على اليسار. حدث الاقتحام كما يتضح من ظهور عابرات السعة الكبيرة التي تعكس السعة الكاملة للخلية (~ 2.93 pF لخلية المنوية هذه). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
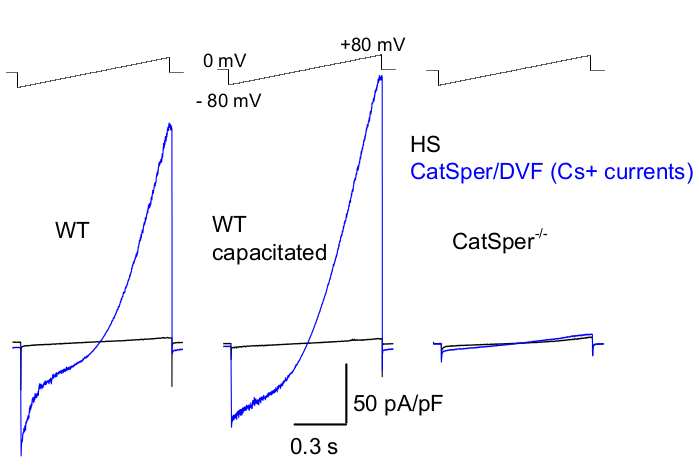
الشكل 8: تسجيل Murine CatSper من النوع البري (WT) الذيل البربخي ، السعوي و CatSper بالضربة القاضية. لتسجيل نشاط CatSper أحادي التكافؤ ، يتم تطبيق بروتوكول منحدر كل 5 ثوان وتيارات CatSper المستبثقة عن منحدرات الجهد من إمكانات الاحتفاظ 0 mV39,51. يتم تطبيق منحدرات الجهد (-80 مللي فولت إلى 80 مللي فولت ؛ 850 مللي ثانية) في النظام المنسق والمحلول الخالي من ثنائي التكافؤ اسميا (DVF). تم أخذ عينات من البيانات عند 2-5 كيلو هرتز وتصفيتها عند 1 كيلو هرتز. يتم تسجيل التيارات الأساسية في محلول HS ، والذي لا ينتج عنه تيار CatSper بسبب تثبيط المغنيسيوم خارج الخلية العالي39،51. تعد التيارات الأساسية مفيدة لتقدير موصلية التسرب (مسارات القنوات غير الأيونية). ممثل ، Cs + كثافات تيار CatSper كاملة الخلية (pA / pF ؛ أزرق) مسجلة من خلايا المنوية الفئرانية الذيلية WT (غير سعوية ؛ يسار وسعة ؛ وسط) وخلايا المنوية الذيلية الفئرانية الذيلية التي تعاني من نقص CatSper (يمين). تم استنباط التيارات بواسطة منحدرات الجهد من إمكانات الاحتفاظ البالغة 0 مللي فولت وتم تطبيق المنحدرات من -80 مللي فولت إلى 80 مللي فولت في النظام المنسق والمحلول الخالي من ثنائي التكافؤ اسميا. التيارات الأساسية (السوداء) المسجلة في محلول HS. للحصول على الكثافات الحالية ، تم تطبيع اتساع تيار CatSper إلى سعة الخلية (pA / pF). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
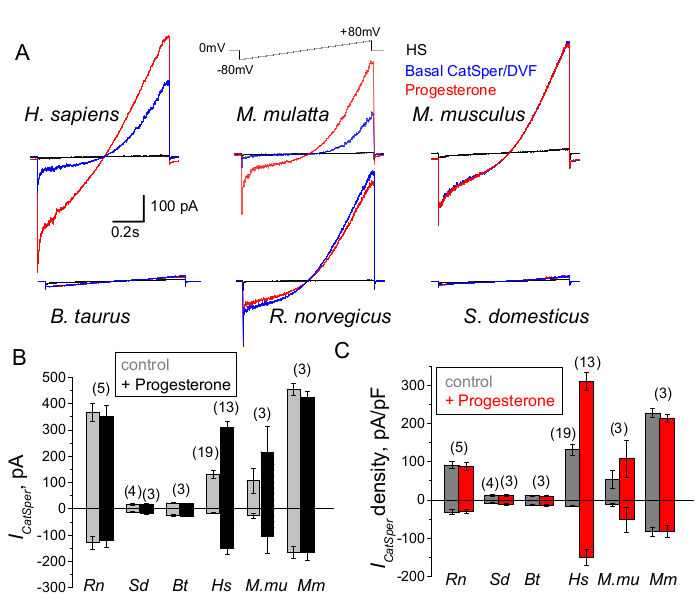
الشكل 9: تنظيم هرمون البروجسترون ل CatSper في أنواع الثدييات المختلفة. (أ) تيار CatSper التمثيلي المستخرج من خلايا المنوية من الأنواع المختلفة بواسطة بروتوكول منحدر الجهد كما هو موضح. الأنواع: الإنسان (Hs; H. العاقل) ؛ المكاك الريسوس (Mmu; M. mulatta) ، فأر (مم ؛ M. musculus) ، ثور (Bt ؛ ب. الثور); الجرذ (Rn; R. norvegicus) ؛ خنزير (Sd; S. scrofa domesticus). تم تسجيل تيارات CatSper في غياب (أزرق) ووجود (أحمر) لهرمون البروجسترون 1 ملي مولار ، بالإضافة إلى التيارات القاعدية في محلول HS (أسود). (ب) السعة الحالية ل CatSper (ICatSper ، pA) و (ج) متوسط كثافة التيار (pA / pF) تسجيلات من خلايا المنوية من أنواع مختلفة كما هو مبين ؛ يشير n إلى عدد خلايا المنوية الفردية المستخدمة. البيانات متوسطة +/- S.E.M . الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: الفرق في حركة السوط. مثالان تمثيليان على القطرات السيتوبلازمية والحركة السوطية. تم التقاط الصور المتراكبة لنفس خلايا المنوية الفئران (Rn) والبشرية (Hs) في نقطتين زمنيتين مختلفتين عندما تظهر الانحراف السوطي الأبعد. تشير المستطيلات المنقطة إلى المنطقة التي تحتوي على قطرات سيتوبلازمية وحركتها المكانية المقابلة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 11: تجميع أنبوب U ومكوناته الأساسية. (أ) مكونات أنبوب U: (1) ماصة مصلية سعة 10 مل ؛ (2) أنابيب السيليكون. (3) أنابيب موصل السيليكون. (4) حقنة 1 مل ؛ (5) أنثى محول شوكة لور. (6) ذكر محول قفل لا يتجزأ من لور 1/8 "؛ (7) محبس مع وصلات لوير ؛ 4 اتجاه. قفل الذكور (8) محول شوكة سلسلة Luer ذكر ، 1/16 ". (ب) أنبوب U مجمع بالكامل و (ج) أنبوب U متصل بقفص فاراداي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
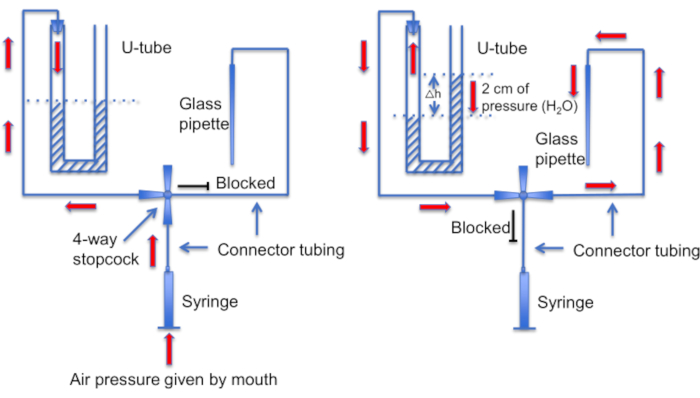
الشكل 12: تمثيل تخطيطي لمجموعة أنبوب U. اللوحة اليسرى: يتم توفير ضغط الهواء الإيجابي عن طريق الفم لإحداث فرق في مستويات السائل في أنبوب U. يرتفع مستوى السائل في القرن الأيمن بمقدار 2 سم. بعد إنشاء فرق المستوى هذا ، يتم تشغيل محبس المحطة لتوصيل أنبوب U بالخط المؤدي إلى ماصة التسجيل. اللوحة اليمنى: يخلق مستوى السائل الأعلى في البوق الأيمن ضغطا إيجابيا يدفع محلول الماصة باستمرار خارج طرف الماصة ويحافظ على نظافة الطرف من الحطام. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المواد الكيميائيه | الوزن المولي (جم / مول) | المليمتر | ز مقابل 1 لتر |
| كلوريد الصوديوم | 58.44 | 97.8 | 5.72 جرام |
| كيه سي إل | 74.55 | 5 | 0.373 جرام |
| KH2PO4 | 136.09 | 0.37 | 50.4 مجم |
| MgSO4 × 7.ح2س | 246.48 | 0.2 | 49.3 مجم |
| كلوريد الهواء2 × 2.ح2س | 147.02 | 2 | 0.294 جرام |
| هيبس | 238.3 | 20 | 4.766 غ |
| الجلوكوز | 180.2 | 3 | 0.540 جرام |
| لاكتات الصوديوم (60٪ وزن / وزن) | 112.06 | 20 | 3 مل |
| بيروفات الصوديوم | 110 | 0.4 | 44 مجم |
الجدول 1: محلول السائل الأنبوبي البشري (HTF)
| المواد الكيميائيه | الوزن المولي (جم / مول) | المليمتر | ز مقابل 1 لتر |
| كلوريد الصوديوم | 58.44 | 135 | 7.889 جرام |
| كيه سي إل | 74.55 | 5 | 0.373 جرام |
| كلوريد الهواء2 × 2. ح2س | 147.02 | 2 | 0.294 جرام |
| MgSO4 × 7. ح2س | 246.48 | 1 | 0.247 غ |
| هيبس | 238.3 | 20 | 4.766 غ |
| الجلوكوز | 180.2 | 5 | 0.901 جرام |
| لاكتات الصوديوم (60٪ وزن / وزن) | 112.06 | 10 | 1.5 مل |
| بيروفات الصوديوم | 110 | 1 | 0.110 جرام |
الجدول 2: محلول عالي الملوحة (HS)
| المواد الكيميائيه | الوزن المولي (جم / مول) | المليمتر | ز (500 مل) |
| سي إس ميسو3 | 228.0 | 140 | 15.960 غ |
| هيبس | 238.3 | 40 | 4.766 غ |
| EDTA | 292.24 | 1 | 0.146 جرام |
الجدول 3: محلول حمام CsMeSO3 (حل حمام خال من التكافؤ: DVF)
| المواد الكيميائيه | الوزن المولي (جم / مول) | المليمتر | ملغ (25 مل) |
| سي إس ميسو3 | 228.0 | 130 | 741 مجم |
| هيبس | 238.3 | 70 | 417 مجم |
| EDTA | 292.24 | 2 | 14.6 مجم |
| EGTA | 380.35 | 3 | 28.5 مجم |
| سي إس إل | حل 1 م | 1 | 25 ميكرولتر |
الجدول 4: محلول ماصة CsMeSO3
Discussion
نصف بروتوكولا مفصلا لإجراء تسجيلات الفيزيولوجيا الكهربية من خلايا المنوية من مختلف الأنواع. نظرا للأهمية الفسيولوجية للقنوات الأيونية والناقلات الكهربائية للحيوانات المنوية ، فإن هذه التقنية هي أداة قوية لدراسة فسيولوجيا خلايا المنوية وكذلك العيوب التي تؤدي إلى العقم عند الذكور. قد يجد المجرب أن تنفيذ هذه التقنية يمثل تحديا في البداية ، ولكن مع المثابرة والتحمل ، يتبع ذلك النجاح.
المنوية للثدييات طويلة (عادة >50 ميكرومتر) وضيقة وشديدة الحركة. يختلف تردد النبض القاعدي (BF) للحيوانات المنوية للثدييات اختلافا كبيرا بمتوسط قيم تتراوح من 4 هرتز (فأر 69) ، 7-15 هرتز (خنزير 70,71) ، 11 هرتز (فأر 72) ، 11-20 هرتز (الثور 18) ، 24 هرتز (المكاك الريسوس 23) ، وما يصل إلى 25 هرتز (الإنسان 3). القطرة السيتوبلازمية (CD) هي مدخل للتسجيل من خلايا المنوية. في المنوية للقوارض ، غالبا ما يكون القرص المضغوط بعيدا ولكنه يتحرك بجانب السوط (الشكل 10) ، مما يخلق عقبة إضافية أمام التسجيل. ومع ذلك ، في خلايا المنوية البشرية ، يكون القرص المضغوط أكثر شيوعا بالقرب من الرأس. وبالتالي ، فإن المكونات الرئيسية لمشبك تصحيح المنوية الناجح هي بصريات ممتازة لتمكين رؤية واضحة وحادة للقرص المضغوط ونظام معالج دقيق عالي الدقة دون انجراف أو اهتزاز. من المتوقع حدوث معدل مرتفع أولي من الفشل وهو أمر طبيعي خلال الأيام العديدة الأولى من مشبك رقعة المنوية. نوصي بالممارسة الروتينية التي تتضمن محاولات عديدة في الأسبوع. سيؤدي تحقيق العديد من التسجيلات يوميا في الأسبوع إلى إنشاء روتين وتحسين المهارات الحركية.
حتى وقت قريب ، كان تحديد القنوات الأيونية المنوية وتوصيفها الدوائي يعوقه عدم القدرة على دراستها مباشرة. اعتمد المجال إلى حد كبير على دراسات الكيمياء المناعية ، والتي غالبا ما تعاني من عدم خصوصية الأجسام المضادة و / أو عدم وجود نماذج وراثية مقابلة. لدراسة قنوات الكالسيوم ، تم استخدام طريقة تصوير الكالسيوم الكلاسيكية على نطاق واسع ، والتي لها مزاياها وقيودهاالخاصة 73،74،75،76،77. في حين أن تصوير الكالسيوم هو طريقة سهلة نسبيا قابلة للتطبيق على دراسات الإنتاجية المتوسطة إلى العالية78،79،80،81 وهي أقل توغلا ، إلا أنها تتطلب خلايا سليمة نسبيا ، وبالتالي تشكل عقبة لتشريح وظيفة القنوات الأيونية المنفصلة عن شلالات الإشارات داخل الخلايا أو لتمييزها عن مبادلات أيونات الكالسيوم. بالإضافة إلى ذلك ، من الصعب التحكم في إمكانات الغشاء ، وبالتالي ، من الصعب استبعاد مساهمة قنوات الكالسيوم ذات الجهد الكهربائي. من بين المزايا العديدة لقياس فلور الكالسيوم استخدام الأصباغ النسبية الكالسيوم التي تسمح بالقياس الدقيق للتغيرات في تركيز أيونات الكالسيوم. في الوقت نفسه ، يجب على المرء أن يدرك أن حساسية هذه الأصباغ يمكن أن تختلف بناء على تغيرات درجة الحموضة داخل الخلايا.
نصف أدناه الخطوات الحاسمة داخل البروتوكول ، بما في ذلك خطوات استكشاف الأخطاء وإصلاحها للطريقة. من الضروري استخدام الكواشف النقية فقط لتحضير المحاليل التجريبية ، حيث يمكن أن يؤدي التلوث الصغير بالأيونات غير المرغوب فيها (مثل المغنيسيوم أو المعادن الثقيلة) إلى إضعاف الكشف عن التيارات أحادية التكافؤ. نظرا لصغر حجم خلايا المنوية ، يمكن للمرء أن يتوقع عددا منخفضا نسبيا من القنوات الأيونية لكل خلية. ومن ثم ، يتراوح صافي التيار من بضعة pA إلى عدة مئات من pA. لذلك ، يجب أن تكون الضوضاء الكهربائية الداخلية للجهاز ضئيلة لضمان اكتشاف التيارات الصغيرة ، ويوصى بشدة باستخدام معدات خالية من الانجراف. من أجل تمييز موصلية معينة عن الضوضاء الكهربائية وتسرب الخلفية ، يجب تعظيم جهاز التسجيل ونظام التأريض. يتم تحقيق ذلك عن طريق تأريض الحفارة بشكل صحيح لتجنب أي تداخل كهربائي82. يوصى بشدة باستخدام قفص فاراداي للحماية من التداخل الكهربائي الناتج عن مجموعة متنوعة من الأجهزة الكهربائية ، مثل مصابيح البناء والأسلاك الكهربائية في الحائط. من الضروري أن تشع جميع مكونات الحفارة التي تعمل بالطاقة الكهربائية ، بما في ذلك لوحة مفاتيح الكمبيوتر والماوس ، ضوضاء كهربائية قليلة أو معدومة (50 هرتز أو 60 هرتز) وأن تكون جميع مكونات الحفارة مؤرضة بشكل صحيح. يجب أن تكون الضوضاء الكهربائية في تكوين الخلية بأكملها عند إغلاق جميع القنوات الأيونية < 0.5-1 باسكال
نقطة أخرى مهمة هي مراقبة الأسمولية الصحيحة لحلول العمل. يجب تحديد تكوين المحاليل داخل وخارج الخلية بدقة وقياس الأسمولية بشكل صحيح. يجب أن يكون المحلول خارج الخلية منخفض التوتر قليلا مقارنة بمحلول الماصة لأنه يؤدي إلى تورم صغير للخلايا ويمنع انسداد الماصة بواسطة غشاء المنوية. ملاحظة: إذا كان محلول الماصة مفرط التوتر ويختلف عن محلول الحمام أكثر من 10 مللي أسميل، فسينتج عن ذلك تورم مفرط في الخلايا وتمزق مانع السداد. نتيجة لذلك ، ستكون الخلية هشة وتضيع الجيجاسيل في غضون ثوان بعد الاقتحام. من خلال تجربتنا ، يعد إعداد المحلول غير الدقيق أحد أكثر الأخطاء شيوعا التي تمنع نجاح تثبيت الترقيع.
عقبة أخرى محتملة يجب تجنبها هي البلاستيك المحتوي على الملدنات / الفثالات ، وكذلك المحاقن المشحمة بالزيوت المعدنية. يجب ألا تتسرب الأنابيب والمحاقن وجميع المعدات البلاستيكية التي تواجه المحاليل ، وبالتالي خلايا المنوية ، الملدنات أو السموم أو الزيوت البيئية الأخرى ، لأن هذه المواد الكيميائية يمكن أن تغير بشكل كبير نشاط القناة الأيونية. نستخدم أنابيب تفلون ذات قطر صغير كخط نضح رئيسي. يحتوي التفلون (PTFE) على عدد قليل من المركبات القابلة للترشيح ولكنه قاسي إلى حد ما. تصنع الوصلات المرنة من أنابيب السيليكون عالية النقاء التي تتناسب مع أنابيب التفلون. تفتقر جميع المحاقن المستخدمة في نظام التروية إلى أي مواد تشحيم ، لأن الزيوت المعدنية أو إضافات التشحيم الأخرى يمكن أن تتداخل مع تسجيل القناة الأيونية.
لا يمكننا المبالغة في أهمية استخدام الزجاج المناسب وسحب شكل الماصة الدقيقة الصحيح. وبالتالي، فإن التصنيع الأمثل للماصات الدقيقة الزجاجية هو شرط أساسي للترقيع الناجح. نستخدم ماصات زجاجية دقيقة مصنوعة فقط من زجاج البورسليكات الذي يحتوي على خيوط لملء المحلول بشكل أفضل. يجب أن يكون طرف الماصات مصقولا بالحريق لتوفير مانع التسرب المثالي. أطراف الماصات التي يتجاوز قطرها 2 ميكرومتر (وبالتالي لها مقاومة 10 MΩ أو أقل) ليست مناسبة بشكل عام لمشبك رقعة خلايا المنوية.
خطوة أخرى مهمة هي التأكد من الحفاظ على نظافة طرف الماصة الدقيقة من أي حطام أو فقاعات هواء قبل تكوين مانع التسرب. هذه مهمة صعبة نظرا لأن الماصة الدقيقة يتم تحميلها في محلول مليء بالخلايا المتحركة. أحد العوامل التي تساعد على تجنب "الاصطدام" العرضي للماصة بخلايا المنوية التي تسبح بحرية ، هو استخدام نضح مستمر لغسل جميع الخلايا غير الملتصقة. أداة أخرى هي "أنبوب U" محلي الصنع يسمح للمرء بالتبديل بين وضعي الضغط الإيجابي والسلبي للحفاظ على نظافة الطرف (الشكل 11 والشكل 12).
نظرا لأن خلايا المنوية تختلف اختلافا كبيرا في شكل وحجم قطراتها السيتوبلازمية (CD) ، فمن المهم اختيار قطرة ذات مورفولوجيا مناسبة. كما هو موضح في الشكل 2 ، فإن الأقراص المضغوطة الصغيرة (1-3 ميكرومتر) ، والناعمة ، والموحدة ، وغير المنتفخة بشكل مفرط هي فقط مناسبة لمشبك التصحيح. صغير ، من جانب واحد. تنتج الأقراص المضغوطة "المنتفخة" والشفافة تماما أختام ضعيفة أو معدومة. قد تسد الأقراص المضغوطة التي تحتوي على جزيئات كبيرة قابلة للذوبان في الداخل ماصة التسجيل. عندما تدخل المنوية من فأر الخصية إلى البربخ ، توجد الأقراص المدمجة الخاصة بها في منطقة الرقبة ، بالقرب من الرأس. أثناء سفرهم عبر البربخ ، تتحرك الأقراص المضغوطة الخاصة بهم على طول القطعة الوسطى وتصل في النهاية إلى العلاقة بين القطعة الوسطى والقطعة الرئيسية (الحلقة) عندما تصل المنوية إلى الذيل البربخي. لذلك ، كما ذكرنا أعلاه في خلايا المنوية المعزولة من الجسم البربخي ، عادة ما يكون القرص المضغوط قريبا من مركز القطعة الوسطية. في الخلايا الذيلية ، يمكن العثور على القرص المضغوط عادة بالقرب من الحلقة (الشكل 2 ج). بالنسبة للحيوانات المنوية البشرية ، يقع القرص المضغوط في منطقة الرقبة (الشكل 2 أ ، ب).
في حين أن هذه ليست مشكلة بالنسبة للحيوانات المنوية المعزولة من المختبر ، إلا أن هناك تباينا كبيرا بين المتبرعين البشريين. يؤثر الاختلاف في جودة المنوية داخل نفس المتبرع بشكل أساسي على جودة غشاء بلازما المنوية وأحيانا يجعل تكوين الفقمة صعبا نسبيا. هناك تباين أقل في سلوك القناة الأيونية وعلم الأدوية ، وهي عوامل ربما ترتبط بعلم الوراثة الفردية أو علم وظائف الأعضاء. يجب على المرء أن يكون مثابرا وأن يقيم عينات من التبرعات المختلفة خلال أيام متعددة ، بالإضافة إلى الاعتماد على العديد من المشاركين من المتبرعين البشريين. يتطلب العمل مع المواد البشرية مزيدا من الصبر ، لأن المنوية المتبرع بها تختلف اختلافا كبيرا في جودة المنوية داخل نفس المتبرع ، اعتمادا على العوامل البيئية المختلفة. نوصي بتقييم عينات من أيام التبرع المختلفة لاتخاذ قرار نهائي بشأن حالة المتبرع. في حين أن المنوية المنقاة المنقاة مناسبة بشكل عام للفيزيولوجيا الكهربية في غضون ساعات (حتى 12 ساعة بعد عزل المنوية البشرية) ، فإن خلايا المنوية الفئرانية البربخية مناسبة للترقيع فقط في غضون ساعتين بعد العزلة.
وأخيرا وليس آخرا ، يختلف تكوين الجيجاسيل بين خلايا المنوية. بالنسبة لخلايا المنوية / القوارض ، يحدث تكوين الجيجاسيل على الفور تقريبا ، بينما يلزم عدة ثوان (وأحيانا تصل إلى دقيقة) لتشكيل جيجاسيل مع منوي بشري. غالبا ما ينتج عن الشفط الأولي مقاومة إدخال تتراوح من 200 MΩ إلى 800 MΩ. غالبا ما يساعد تبديل إمكانات التثبيت إلى -60 مللي فولت وتوفير نبضات قصيرة "اختبار الغشاء" تصل إلى 10 مللي فولت في إنقاذ تكوين الجيجاسيل (من خلال الحركة المستحثة لمجال الجهد للغشاء في الماصة).
تتيح تقنية مشبك رقعة خلايا المنوية الدراسة التفصيلية لقنوات أيونية معينة في نظام التعبير الطبيعي الخاص بها. يعتمد نجاح هذه التقنية على المعدات المناسبة ، وخلايا المنوية القابلة للحياة عالية الجودة ، والكواشف النقية ، ومهارات الفيزيولوجيا الكهربية الأساسية ، والصبر ، والمثابرة. تفتح الطريقة آفاقا جديدة في فسيولوجيا المنوية من خلال دراسة التنوع التطوري للقنوات الأيونية ، وآليات تنظيمها ، والتغيرات في وظيفتها أثناء انتقالها من الذكور إلى الجهاز التناسلي الأنثوي وتتغير بسبب الظروف الخارجية ، مثل الأس الهيدروجيني والروابط.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل R01GM111802 منحة المعاهد الوطنية للصحة ، وجائزة بيو للعلماء الطبيين الحيويين 00028642 ، وجائزة ألفريد ب. سلون FR-2015-65398 ، ووصية باكر وينتز (إلى PVL). تم دعم هذا العمل أيضا من قبل Deutsche Forschungsgemeinschaft (مؤسسة الأبحاث الألمانية) 368482240 / GRK2416 (إلى NM) وزمالة مجلس المنح الدراسية الصيني ل B.L. نشكر الدكتور دان فيلدمان على مشاركة أنسجة الفئران ، وكاتي كلوستر وستيوارت مايرز من جامعة كاليفورنيا في ديفيس للمساعدة في اكتساب خلايا المنوية من الرئيسيات ، وستيفن مانسيل للمساعدة في تحليل الحصول على البيانات من خلايا المنوية للخنازير والثور.
Materials
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
References
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved