Method Article
Aufzeichnung elektrischer Ströme durch die Plasmamembran von Säugetiersamenzellen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie elektrische Aufzeichnungen von Säugetierspermien in einer Ganzzellkonfiguration durchgeführt werden, mit dem Ziel, die Aktivität der Ionenkanäle direkt aufzuzeichnen. Die Methode hat maßgeblich dazu beigetragen, die elektrophysiologischen Profile mehrerer Ionenkanäle der Spermien zu beschreiben und ihre molekulare Identität und Regulation aufzudecken.
Zusammenfassung
Die Erfassung der elektrischen Aktivität einer der kleinsten Zellen eines Säugetierorganismus - einer Samenzelle - ist seit vielen Jahrzehnten eine herausfordernde Aufgabe für Elektrophysiologen. Die Methode, die als "Spermatozoen-Patch-Clamp" bekannt ist, wurde 2006 eingeführt. Es hat die direkte Aufzeichnung der Ionenkanalaktivität in Ganzzell- und zellgebundenen Konfigurationen ermöglicht und war maßgeblich an der Beschreibung der Physiologie der Spermien und der molekularen Identität verschiedener Kalzium-, Kalium-, Natrium-, Chlorid- und Protonenionenkanäle beteiligt. Die Aufzeichnung von einzelnen Spermien erfordert jedoch fortgeschrittene Fähigkeiten und eine Ausbildung in Elektrophysiologie. Dieses detaillierte Protokoll fasst das Schritt-für-Schritt-Verfahren zusammen und zeigt einige "Tricks auf", um es jedem zugänglich zu machen, der die faszinierende Physiologie der Samenzelle erforschen möchte. Insbesondere beschreibt das Protokoll die Aufzeichnung von menschlichen und murinen Samenzellen, kann aber im Wesentlichen an jede Säugetiersamenzelle jeder Spezies angepasst werden. Das Protokoll behandelt wichtige Details der Anwendung dieser Technik, wie z.B. die Isolierung von Samenzellen, die Auswahl von Reagenzien und Geräten, die Immobilisierung der hochbeweglichen Zellen, die Bildung der dichten (Gigaohm) Dichtung zwischen einer Aufzeichnungselektrode und der Plasmamembran der Samenzellen, den Übergang in den Ganzspermienmodus (auch bekannt als Break-in) und beispielhafte Aufzeichnungen des Kalziumionenkanals der Spermienzelle. CatSper, von sechs Säugetierarten. Die Vorteile und Grenzen der Spermien-Patch-Clamp-Methode sowie die wichtigsten Schritte werden besprochen.
Einleitung
Ähnlich wie die traditionelle Patch-Klemme, die von Erwin Neher und Bert Sakmannerfunden wurde 1, ermöglicht die Spermien-Patch-Klemme die Abfrage der Aktivität einzelner Ionenkanäle sowie die Aufzeichnung der Aktivität der gesamten Ionenkanalpopulation innerhalb der einzelnen Zelle 2,3. Die Methode ermöglicht die Identifizierung eines spezifischen Ionenkanaltyps unter Abkopplungsgraden von enzymatischen intrazellulären Prozessen. Diese Methode ist entscheidend für die Bestimmung der Ionenkanalaktivität auf der Grundlage ihrer elektrophysiologischen und pharmakologischen Fingerabdrücke und bietet daher eine zuverlässige Identifizierungsstrategie. Der Nachteil der Methode ist, dass sie nicht in der Lage ist, nicht-elektrogene Transporter nachzuweisen. Darüber hinaus ist ein grundlegendes elektrophysiologisches Training hilfreich, um die Feinheiten des Protokolls zu verstehen. Um die Patch-Clamp-Technik zu beherrschen und sie auf Säugetierspermien anzuwenden, empfehlen wir das Studium der grundlegenden Patch-Clamp-Literatur 4,5. In diesem Artikel bieten wir eine detaillierte Schritt-für-Schritt-Anleitung und heben einzigartige Praktiken hervor, die diese Technik leicht verständlich und für jeden zugänglich machen, der die Elektrophysiologie der Spermien praktizieren möchte.
Die Ionenhomöostase ist eine wesentliche physiologische Funktion von Spermien, die stark auf Ionenkanäle und Ionentransporter angewiesen ist, um physiologisch wichtige Ionengradienten aufrechtzuerhalten, intrazelluläres Kalzium zu variieren und die Transmembranspannung zu ändern. Ionenkanäle und Ionentransporter regulieren essentielle Funktionen der Spermien wie Beweglichkeit, Navigation im weiblichen Fortpflanzungstrakt, Spermienreifung und in Meeresorganismen die Chemotaxis zur Eizelle 6,7,8,9,10,11,12 . Die Beweglichkeit der Spermien ist ein allmählich erworbener Prozess. Die Samenzellen sind während ihrer Reifung im Hoden und während ihrer anschließenden Passage durch den Nebenhoden hauptsächlich ruhig. Ihre Beweglichkeit wird durch ein saures Nebenhodenmilieu gehemmt, was zu einer inneren Übersäuerung der Samenzelle führt. Dies beeinträchtigt die Funktion des Axonems, da es unterhalb eines pH-Werts von 6,013,14 nicht mehr funktionieren kann. Bei Exposition gegenüber der Samenflüssigkeit oder einer alkalischeren Umgebung ändern sich jedoch die intrazellulären Ionenkonzentrationen der Spermien und der zytoplasmatische pH-Wert erheblich, und das Spermium wird beweglich 15,16,17. Die Bewegung des Spermienflagellums wird durch die ATP-Hydrolyse angetrieben, die das Gleiten der axonemalen Mikrotubuliunterstützt 18, und dieser Prozess ist stark pH-abhängig14. Zusätzlich wird die Flagellenbewegung auch durch eine Erhöhung von intraflagellärem Calcium und cAMP 13,19,20,21,22,23,24 gesteuert. Diese Faktoren, d.h. die intrazelluläre Kalziumkonzentration der Spermien [Ca2+]i, pH, ATP und cAMP, sind die wichtigsten Regulationsmechanismen, die Änderungen der Motilität ermöglichen, und ihre Konzentrationen werden durch die Ionenkanäle und Transporter der Spermien streng reguliert.
Samenzellen sind insofern einzigartig, als sie eine Reihe von Proteinen exprimieren, die nirgendwo sonst im Körper zu finden sind. Bemerkenswerte Beispiele sind Spermienionenkanäle, wie der Kaliumkanal, Slo3 25,26,27,28,29 und der Cat-Ionenkanalvon Sperm, CatSper 2,30,31,32. Letzteres ist der Hauptkalziumkanal der Säugetierspermien31 und wird durch die intrazelluläre Alkalisierung 2,30,31,32,33,34 reguliert. CatSper wird auch durch speziesspezifische Signale reguliert 7,35 und ist in vierseitigen longitudinalen Nanodomänen entlang des Spermienflagellumsorganisiert 36,37,38. Bei Primaten wird CatSper durch eine Kombination aus flagellärer Alkalinität, Membrandepolarisation und Progesteronaktiviert 3,39,40,41, während für die Aktivierung von CatSper bei Mäusen kein Progesteron erforderlich ist 2,39. Eine weitere Besonderheit dieses Kanals ist seine Organisation mit mehreren Untereinheiten: CatSper ist ein Komplex aus mindestens 10 verschiedenen Untereinheiten 31,32,34,37,38,42,43,44,45,46,47 . Solch eine ausgeklügelte Struktur und Spezifika seiner Regulation behinderten die rekombinante Expression von CatSper in jedem bekannten heterologen Expressionssystem, und daher war die physiologische Charakterisierung von CatSper auf sein natives Expressionssystem - die Spermzelle - beschränkt. Während die molekulare Charakterisierung des CatSper-Proteins im Jahr 2000 von D. Ren et. al.31, der endgültige Beweis, dass CatSper ein echter Ionenkanal ist, war erst nach der Einführung der Spermien-Patch-Clamp-Methode im Jahr 2006 möglich2. Seitdem ermöglichte diese Technik eine präzise Charakterisierung vieler ionenleitender Signalwege in den Spermien 9,28,37,39,40,44,46,48-54.
Die klassische und einfachste Methode zur Untersuchung der Eigenschaften von Ionenkanälen - die Patch-Clamp-Technik - galt aufgrund ihrer Beweglichkeit und spezifischen Morphologie als nicht anwendbar auf Spermien (Abbildung 1A). Insbesondere das winzige Volumen des Zytoplasmas der Spermien und die enge Bindung der Plasmamembran der Spermien an die starren intrazellulären Strukturen wie die fibröse Scheide und den Zellkern der Spermien waren die größten Herausforderungen55. Diese beiden strukturellen Merkmale führen zu einer schlanken, pfeilförmigen Zelle, die so konzipiert ist, dass sie hochviskose Umgebungen wie die schützenden Gewänder von Eiern durchdringt, ohne die Plasmamembran signifikant zu verformen oder zu beschädigen.
Der erste Schritt der Patch-Clamp-Methode ist die Herstellung der dichten Versiegelung zwischen einer Aufzeichnungspipette (einer Glasmikropipette) und der Zellplasmamembran. Um dies zu erreichen, muss man so viel Plasmamembran in die Aufzeichnungspipette ziehen, dass sich zwischen der Plasmamembran und dem Glas ein mechanisch stabiler Gigaseal bildet. Die Plasmamembran muss flexibel und nicht starr sein (Abbildung 1B). Wie oben erwähnt, ist die gesamte Oberfläche der Plasmamembran der Spermien ziemlich fest verklebt, mit Ausnahme der Region, die als zytoplasmatisches Tröpfchen bekannt ist (Abbildung 1A und Abbildung 2). Daher wurde die starre Beschaffenheit der Plasmamembran der Spermien als Haupthindernis für die Erlangung der dichten Versiegelung oder des "Gigaseals" angesehen, der so genannt wird, weil >109 Ohm für gute Aufnahmen erforderlich sind. Mit der Einführung der Spermien-Patch-Clamp-Technik im Jahr 20062 wurde diese Barriere jedoch beseitigt, und diese Methode konnte erfolgreich auf Samenzellen mehrerer Säugetierarten angewendet werden 2,41,51,56. Dieser Durchbruch wurde durch die Fokussierung auf das zytoplasmatische Tröpfchen (CD)2,8 erreicht, eine winzige Struktur, die sich entlang des Mittelstücks des Spermiums befindet (Abbildung 1A und Abbildung 2) und einfach der Überrest der länglichen Spermatide ist - ein Vorläufer von Samenzellen, aus dem sich der Kopf und der Schwanz entwickeln. Funktionell kann es der Zelle helfen, sich an Veränderungen der extrazellulären Osmolarität während der Ejakulation anzupassen. Das wichtige Merkmal ist, dass die Plasmamembran innerhalb der CD flexibel genug ist, um in die Pipette gezogen zu werden, um eine Gigaohm-Dichtung zu bilden. Somit ist die Spermien-CD der beste Teil auf der Spermienoberfläche, durch den man eine erfolgreiche Gigaseal-Bildung und einen Übergang in einen Ganzzellmodus erreichen kann, der die Samenzelle schließlich elektrisch an einen Patch-Clamp-Verstärker koppelt 2,8. Es ist erwähnenswert, dass frühere Veröffentlichungen über eine erfolgreiche Gigasealbildung am Spermienkopf berichteten, was die Aufzeichnung in der zellgebundenen Konfiguration 54,57,58,59 ermöglicht. Die Aufzeichnungen in Ganzzellkonfiguration wurden bisher jedoch nur durch die Durchführung von Gigaseal-Bildung in der CD-Region berichtet. Dieser Ganzzellmodus ermöglicht den elektrischen Zugang zum gesamten Volumen der Spermien und ermöglicht somit die Detektion von Ionenkanalaktivitäten, die sich auf dem Spermienflagellum sowie auf dem Spermienkopf befinden. In den letzten Jahren seit ihrer Entwicklung hat die Spermien-Patch-Clamp-Technik zu enormen Fortschritten in unserem Verständnis der Spermien-Ionenkanäle geführt und ist bisher eine der robustesten Techniken, um die Funktionalität der Spermien-Ionenkanäle direkt zu untersuchen 9,28,37,39,40,44,46,48,49, 50,51,52,53 (Abbildung 1).
Die Spermien-Patch-Klemme unterscheidet sich in einigen Details von der klassischen Patch-Clamp-Technik, wie unten beschrieben. Erstens ist der größte Teil der Plasmamembran der Spermien fest mit der starren intrazellulären Struktur verbunden, und daher haben Spermien fast keine "überschüssige" Plasmamembran, die in die Pipette gezogen werden kann. Die einzige Region, die flexibel ist, ist die Membran der Zöliakie, die der Plasmamembran vieler Körperzellen ähnelt und daher leicht in die Pipette gezogen werden kann. Um eine Gigaohm-Dichtung mit der CD zu bilden, wird durch leichten Sog an der Oberseite der Pipette ein Unterdruck erzeugt, um einen kleinen Teil der Spermienplasmamembran in die Spitze der Mikropipette zu ziehen (Abbildung 1B). Dieser Teil der Membran bildet eine Ω-förmige Einstülpung in die Spitze der Pipette und sorgt für einen dichten Verschluss mit seinen Innenwänden.
Zweitens liegt die Größe des zytoplasmatischen Tröpfchens in menschlichen und Maus-Spermien zwischen 1 und 2 μm (Abbildung 1 und Abbildung 2). Daher erfordert die Anwendung der Patch-Clamp-Technik auf ein so kleines Objekt eine hochauflösende Optik. Die meisten Spermien-Patch-Clamp-Rigs sind mit einem inversen Mikroskop mit differentiellem Interferenzkontrast (DIC) oder optischen Nomarski-Komponenten ausgestattet (Abbildung 2 und Abbildung 3). Die Verwendung eines Mikroskops, das mit einer DIC-Optik für die Spermien-Patch-Klemme ausgestattet ist, wird gegenüber herkömmlichen Phasenkontrastoptiken dringend empfohlen, da die räumlichen Informationen, die in DIC zu sehen sind, dazu beitragen, eine überlegene Präzision bei der Positionierung einer Patch-Pipette auf der winzigen CD zu erreichen. Wir empfehlen auch die Verwendung eines 60-fachen Wasserimmersionsobjektivs oder eines ähnlichen Objektivs mit einer numerischen Apertur von 1,2. Dieses Objektiv hat einen großen Arbeitsabstand (0,28 mm), der die Beobachtung von frei schwimmenden Spermien in Lösung ermöglicht (Abbildung 2). Das Objektiv verfügt außerdem über einen Einstellkragen zur Anpassung an die Dicke des Deckglases (variabel von 0,13 bis 0,21 mm). Diese Kombination aus dem großen Arbeitsabstand und dem Einstellkragen ermöglicht die Beobachtung durch zwei 0,13 mm Abdeckgläser; Ein Deckglas dient als Glasboden der Aufnahmekammer, und das 5 mm Deckglas mit den abgelagerten Spermien wird darauf gelegt. Wie weiter unten diskutiert, ist das Ablegen von Samenzellen auf leicht austauschbaren runden 5-mm-Deckgläsern und nicht direkt auf dem Boden der Aufnahmekammer eine bequeme Möglichkeit, frische Samenzellen in die Aufnahmekammer zu laden.
Drittens muss das Spermien-Patch-Clamp-Rig mit einem rauscharmen Patch-Clamp-Verstärker und einem Digitizer ausgestattet sein, um winzige elektrische Ströme (Picoampere-Bereich) und winzige Änderungen des Membranpotentials aufzuzeichnen. Dieses Gerät muss das geringste Verstärkerrauschen gewährleisten. Die Abwesenheit von Vibrationen ist ein wesentlicher Bestandteil einer erfolgreichen Patch-Clamp-Aufnahme. Für die Klemmung von Spermienpflastern ist ein driftfreier, präziser Mikromanipulator erforderlich, der mit einer Mikromanipulatorplattform am inversen Mikroskop befestigt werden kann, um eine bessere Stabilität als ein unabhängiges Mikromanipulatorstativ zu gewährleisten (Abbildung 3A). Um den Aufbau zu testen, sollte man keine Bewegung der Pipettenspitze (unter 60-facher Vergrößerung) sehen, selbst wenn eine Person in der Nähe des Schwingungsisolationstisches auf dem Boden auf und ab springt.
Protokoll
Alle Versuche wurden in Übereinstimmung mit den NIH-Richtlinien für Tierversuche durchgeführt und vom UC Berkeley Animal Care and Use Committee (AUP 2015-07-7742) genehmigt, wobei alle Anstrengungen unternommen wurden, um das Leiden der Tiere zu minimieren. Alle beschriebenen Methoden stehen im Einklang mit den Empfehlungen des Gremiums für Euthanasie der American Veterinary Medical Association und des IACUC-Ausschusses. Alle experimentellen Verfahren mit menschlichen Proben wurden vom Committee on Human Research an der University of California, Berkeley, unter der IRB-Protokollnummer 2013-06-5395 genehmigt.
1. Herstellung von Mikropipetten aus Glas für die Aufzeichnung von Ganzzellspermien mit Patch-Clamp.
HINWEIS: Die geringe Größe des zytoplasmatischen Tröpfchens erfordert Mikropipetten aus Glas mit feinen Spitzen.
- Beginnen Sie für die Herstellung von Mikropipetten mit Borosilikatglaskapillaren mit einem Außendurchmesser von 1,5 mm, einem Innendurchmesser von 0,86 mm und einem internen Filament. Ziehen Sie an der Spitze eines Mikropipettenabziehers (Abbildung 3B).
- Positionieren Sie zum Formen und Polieren der Pipettenspitze einen heißen Draht für einen Moment in unmittelbarer Nähe der Spitze. Führen Sie diesen Vorgang des Feuerpolierens unter 100-facher Vergrößerung mit einem Pipettenpolierer durch (Abbildung 3C,D).
- Stellen Sie sicher, dass der Innendurchmesser der Pipettenspitze vor dem Feuerpolieren ~2 μm beträgt und nach dem ordnungsgemäßen Polieren auf ~0,5 μm reduziert wird.
HINWEIS: Es wird empfohlen, nur frisch gezogene Pipetten zu verwenden, die am Tag der Aufnahme hergestellt wurden. Dadurch wird die Ansammlung von Staubpartikeln auf der Pipettenspitze vermieden.
2. Einrichten des Rigs
- Montage der Aufnahmekammer
- Verwenden Sie eine rautenförmige Perfusionskammer mit geringem Volumen und laminarer Strömung und relativ schnellen Lösungswechselraten (Abbildung 4). Verbinden Sie die Kammer über einen Verteiler mit einem schwerkraftgespeisten Perfusionssystem (Abbildung 5).
- Um eine Lösung durch die Aufnahmekammer zu perfundierten, bauen Sie ein einfaches, selbstgebautes Schwerkraft-Perfusionssystem mit einem Polytetrafluorethylen-Verteiler zusammen, der die Perfusionskammer mit acht separaten Perfusionsleitungen verbindet.
HINWEIS: Die Schläuche sollten keine Weichmacher in die Lösungen auslaugen, da solche Chemikalien die normale Funktion der Spermien60 erheblich beeinträchtigen und die Aktivität der Ionenkanäle61, 62 verändern können. Ein Polytetrafluorethylen-Schlauch mit kleinem Durchmesser wird als Hauptperfusionsschlauch dringend empfohlen. - Da Polytetrafluorethylen-Schläuche ziemlich steif sind, stellen Sie flexible Verbindungen mit hochreinen Silikonschläuchen her, die über den Polytetrafluorethylen-Schlauch passen. Verwenden Sie außerdem Spritzen (z. B. Luer-Lock-Spritzen), die nicht geschmiert sind, da Mineralöl oder andere Schmiermittelzusätze die Ionenkanalaufzeichnung beeinträchtigen können (Abbildung 5).
- Montage einer Agarbrücke
- Um Änderungen des Flüssigkeitsübergangspotentials während der Aufzeichnung zu vermeiden, halten Sie die Umgebung der Referenzelektrode durch die Verwendung einer Agarbrücke stabil (Abbildung 4).
- Um eine Agarbrücke herzustellen, stellen Sie eine L-förmige Glaskapillare her, indem Sie sie unter einem kleinen Bunsenbrennerfeuer biegen und abkühlen lassen.
- Machen Sie eine Lösung aus 1% Agarose in 1 M KCl und erhitzen Sie sie in der Mikrowelle, bis die Agarose schmilzt und die Lösung transparent wird. Füllen Sie die L-förmige Glaskapillare vorsichtig mit der obigen Lösung, um Luftblasen zu vermeiden, und lassen Sie sie auf Raumtemperatur abkühlen. Die Agarbrücken können in 1 M KCl für ~2 Monate bei +4 °C gelagert werden.
- Um eine Agarbrücke zu verwenden, füllen Sie eine Ag/AgCl-Pellet-Referenzelektrode mit 1 M KCl und führen Sie die Agarbrücke vorsichtig ein, um zu vermeiden, dass erstarrte Agarose aus der Glaskapillare herausspringt.
- Führen Sie dann den Goldstift (2 mm) des Drahtes des Verstärkerkopftisches in den 2-mm-Schlitz der Referenzelektrode (Gold) ein und führen Sie das Ende der L-förmigen Agarbrücke in die Perfusionskammer ein, wie in Abbildung 4 gezeigt.
- Lösungen und Rezepte
HINWEIS: Alle Reagenzien und Chemikalien müssen von höchster Reinheit sein. Alle vorbereiteten Lösungen werden durch einen sterilen 0,22 μm PES-Filter filtriert und bis zu einem Monat bei 4 °C gelagert. Zu beachten ist, dass die exakte Einstellung der Osmolarität Voraussetzung für ein erfolgreiches Patch-Clamping ist.- Bereiten Sie die Lösung für humane Schlauchflüssigkeit (HTF) wie in Tabelle 1 beschrieben vor. Stellen Sie den pH-Wert mit NaOH auf 7,4 ein. Die Osmolarität sollte 280 ± 5 mOsm betragen und mit einem Dampfdruckosmometer gemessen werden.
- Bereiten Sie eine "Bade"- oder "extrazelluläre" Lösung mit hohem Kochsalzgehalt (HS) vor, wie in Tabelle 2 angegeben. Stellen Sie den pH-Wert mit NaOH auf 7,4 ein. Die Osmolarität sollte 320 ± 5 mOsm betragen.
- Die Cäsiummethansulfonat-"Bade"- oder "extrazelluläre" Lösung wird wie in Tabelle 3 beschrieben hergestellt. Stellen Sie den pH-Wert mit CsOH auf 7,4 und die Osmolarität auf 320 ± 5 mOsm ein.
- Zur Herstellung der intrazellulären "Pipettenlösung" von Cäsiummethansulfonat (CsMeSO3) befolgen Sie Tabelle 4 und stellen Sie den pH-Wert mit CsOH auf 7,4 ein. Die Osmolarität sollte bis zu 10 mOsm höher sein als bei der HS-Lösung.
3. Isolierung und Reinigung von Säugetierspermien
HINWEIS: Ethanasieren Sie C57BL/6 männliche Mäuse im Alter von 3-6 Monaten durch Einatmen von CO2, gefolgt von einer Gebärmutterhalsluxation. Nach einer Zervixluxation ist sofort eine Gewebeentnahme (Cauda oder Corpus Epididymis) von Mäusen durchzuführen.
- Isolierung von Nebenhodenspermien von Mäusen
HINWEIS: Ethanasieren Sie C57BL/6 männliche Mäuse im Alter von 3-6 Monaten durch Einatmen von CO2, gefolgt von einer Gebärmutterhalsluxation. Nach einer Zervixluxation ist sofort eine Gewebeentnahme (Cauda oder Corpus Epididymis) von Mäusen durchzuführen.- Öffnen Sie mit einer Schere den unteren Bauchbereich der Maus und extrahieren Sie beide Nebenhoden.
- Legen Sie sie in eine 35-mm-Zellkulturschale, die mit HS-Lösung (hohe Kochsalzlösung, siehe Tabelle 2) gefüllt ist. Stellen Sie sicher, dass ein Aliquot der HS-Lösung vor dem Kontakt mit den Samenzellen auf Raumtemperatur vorgewärmt wird.
- Übertragen Sie die Nebenhoden in eine neue Zellkulturschale mit HS-Lösung und entfernen Sie gründlich alle Fettreste.
- Trennen Sie die Nebenhoden mit einer #15 Skalpellklinge in Caput, Corpus und Cauda (Abbildung 6).
- Übertragen Sie den Korpus (oder bei Bedarf die Cauda) jedes Nebenhodens in eine neue Zellkulturschale, die HS-Lösung enthält. Machen Sie mehrere Schnitte in den isolierten Teil des Nebenhodens mit einer spitzen #11 Skalpellklinge.
- Übertragen Sie die Teile der Nebenhoden mit mehreren Schnitten in ein 1,5-ml-Mikrozentrifugenröhrchen mit 1,5 mL HS-Lösung.
- Schütteln Sie die Samenzellen aus den Nebenhoden mit einer superfeinen Dumont Typ 5a-Pinzette kurz in die Lösung. Nebenhoden entsorgen und das Röhrchen 10 Minuten bei Raumtemperatur stehen lassen.
- Warten Sie, bis die Feststoffe (Nicht-Samenzellen) am Boden des Röhrchens sedimentieren, und übertragen Sie dann den Überstand in ein weiteres 1,5-ml-Mikrozentrifugenröhrchen.
- Lagern Sie die Spermienmischung bei Raumtemperatur mit Zugang zu Luft bis zu 2 Stunden, während dieser Zeit können die Experimente durchgeführt werden. Isolierte Spermien verlieren 3 h nach der Isolierung ihre Leistungsfähigkeit.
- Kapazitation von Mausspermien
HINWEIS: Alle Nebenhodenspermien sind für Patch-Clamp geeignet, aber nur Spermien aus den Cauda epididymis sind reif genug, um befruchtungsfähig zu werden. Da kaudale Spermien kapazitiert werden können, führen Sie Experimente, insbesondere die Spermienkapazitation, mit kaudalen Samenzellen durch.- Führen Sie die Spermienentnahme an kaudalen oder ejakulierten Spermien durch (siehe Schritte 3.1.1-4).
- Caudae isoliert wie in Schritt 3.1.4 beschrieben einnehmen. und nehmen Sie mehrere Schnitte vor, wie in Schritt 3.1.5 beschrieben. Übertragen Sie die Caudae in eine 10-mm-Zellkulturschale mit 2 mL Kapazitationslösung.
- Inkubieren Sie das Schwanzgewebe zunächst 10 Minuten lang bei 37 °C und 5 % CO2, dann entsorgen Sie das Gewebe und inkubieren Sie die freigesetzten Samenzellen für weitere 50-80 Minuten.
HINWEIS: Die In-vitro-Kapazitation von kaudalen Spermien der Maus wird durch eine Inkubation von 60-90 min erreicht. Kapazitierte Spermien werden visuell anhand einer übermäßigen asymmetrischen Biegung ihrer Flagellen identifiziert, die als Hyperaktivierung bezeichnet wird. Diese Art der Motilität ermöglicht es den Spermien, auf nichtlineare Weise zu schwimmen.
- Entnahme und Reinigung von menschlichem Sperma
HINWEIS: In diesem Fall wurden frische Samenproben von insgesamt 21 gesunden Probanden im Alter von 21 bis 38 Jahren und Spermien entnommen, die durch die Swim-up-Technik bei Raumtemperatur gereinigt wurden, wie in48,63 ausführlich beschrieben. Kurz gesagt, das Verfahren ist wie folgt:- Lassen Sie die menschlichen Ejakulatproben 60 Minuten lang bei Raumtemperatur, damit sie sich vor der Reinigung verflüssigen können (längere Zeiträume können sich negativ auf die Spermienqualität auswirken).
- Etwa 7 ml HTF-Lösung in einem 50-ml-Zentrifugenröhrchen auf 37 °C erhitzen. Beurteilen Sie das Volumen des Ejakulats visuell - wenn das Volumen größer als 1 ml ist, bereiten Sie mehrere Röhrchen HTF-Lösung vor.
- Legen Sie vorsichtig 1 ml verflüssigtes Ejakulat auf den Boden jedes Röhrchens, ohne Samenstränge an die Oberfläche des Puffers zu heben. Die Samen-zu-HTF-Schnittstelle sollte so klar wie möglich sein. Vermeiden Sie Luftblasen.
- Legen Sie die Röhrchen für 1 h in einen 37 °C heißen Inkubator in einen Ständer, der sie in einem Winkel von 45° hält, um eine maximale Oberfläche zu gewährleisten. Wenn es sich bei dem Inkubator um einen CO2 -Inkubator handelt, schließen Sie die Kappe fest, um eine Ansäuerung des Puffers zu verhindern (CO2 ist für dieses Verfahren nicht erforderlich). Während der Inkubation schwimmen bewegliche Spermien allmählich in Richtung der Oberfläche des HTF-Puffers.
- Nach 1 h entnehmen Sie die oberste 1 mL-Fraktion aller Proben in einem 15 mL Zentrifugenröhrchen und kombinieren so die hochwertigsten, hochbeweglichen Spermien für das Patch-Clamping. Versuchen Sie nicht, alle Überstände zu entfernen, sondern lassen Sie mehrere ml HTF über dem Samenplasma zurück, um eine Kontamination zu vermeiden. Die gereinigte Zellsuspension kann mehrere Stunden bei Raumtemperatur gelagert werden.
HINWEIS: Ein normales Ejakulat sollte mindestens 15 x 106 Samenzellen pro ml64 enthalten, aber die Spermienzahl variiert stark zwischen den Proben. Das Hindernis einer niedrigen Zellzahl kann überwunden werden, indem die gereinigte Spermiensuspension 30-60 Minuten bei Raumtemperatur gelagert wird, bevor das Pflaster geklemmt wird. Unter dieser Bedingung sammeln sich die Zellen nach und nach am Boden des Zentrifugenröhrchens an und bilden eine sichtbare Zellwolke, aus der Sie Zellen in die Aufnahmekammer pipettieren können (siehe unten).
- Kapazitation menschlicher Spermien
HINWEIS: Die In-vitro-Kapazitation von humanen Spermien kann durch 4-stündige Inkubation in Affazitivlösung erfolgen: 20 % fötales Rinderserum, 25 mM NaHCO3 in HTF- oder HS-Puffern48,51 . Kapazitierte Spermien können visuell anhand ihrer kräftigen Beweglichkeit und ihrer übermäßigen asymmetrischen Biegung der Flagellen identifiziert werden, die es den Spermien ermöglicht, auf nichtlineare Weise zu schwimmen.- Bereiten Sie eine 2x Kapazitationslösung vor und mischen Sie sie 1:1 mit der Spermiensuspension.
- Die Inkubation bei 37 °C und 5 % CO2 für mindestens 4 Stunden durchführen. Um einen hohen Anteil an kapazitiven Zellen zu gewährleisten, sollte die Inkubationszeit nicht kürzer als 4 Stunden sein.
4. Herstellung der Beschichtungslösung (nur für die Patch-Klemme für menschliche Spermien erforderlich)
HINWEIS: Ein wesentlicher Schritt besteht darin, das anhaftende Spermium vor dem Einlaufen vom Deckglas zu heben. Dieser Schritt ist nur für menschliche Samenzellen notwendig und erfordert eine Beschichtung des Glasdeckglases, um eine weniger klebende Glasoberfläche zu erzeugen. Die Deckglasbeschichtung verringert die Wahrscheinlichkeit, dass die Spermien am Deckglas haften bleiben, und ermöglicht es, dass menschliche Spermien nach erfolgreicher Gigaseal-Bildung vom Glasdeckglas abgehoben werden.
- Verdünnen Sie 200 μl des Ejakulats in 5 ml HS-Lösung in einem 15-ml-Zentrifugenröhrchen.
- Bei 300 x g 5 min runterschleudern und den Überstand entfernen.
- Das Pellet in 1 mL HS-Lösung resuspendieren und in ein Mikrozentrifugenröhrchen umfüllen.
- 10 min bei 25 °C mit einem wassergefüllten Beschallungsbad beschallen.
- Bei 10.000 x g 5 min runterschleudern.
- Übertragen Sie den Überstand in ein frisches Mikrozentrifugenröhrchen und verwenden Sie es zum Beschichten (Anleitung unten).
5. Aufzeichnung der Ionenleitfähigkeit aus der gesamten Plasmamembran der Spermien.
- Anbringen von Sperma an dem Deckglas.
HINWEIS: Vor der Patch-Clamp-Aufnahme werden die Spermien auf 5 mm runde Deckgläser plattiert.- Bei der Arbeit mit menschlichen Zellen tauchen Sie die Deckgläser mit einer scharfen Pinzette kurz in die vorbereitete Beschichtungslösung.
- Legen Sie vier Deckgläser in eine einzelne Vertiefung einer 4-Well-Platte und bedecken Sie sie mit 300 μl HS-Lösung. Verhindern Sie, dass die Deckgläser schwimmen, indem Sie sie an die Unterseite der 4-Well-Platte kleben und mit der Kunststoffspitze einer Pipette drücken.
- Die konzentrierten Suspensionen von menschlichen (Schritt 3.3.5) oder Mausspermien (Schritt 3.1.9) aus dem Aufbewahrungsröhrchen (20-50 μl konzentrierte Spermien) in 300 μl HS-Lösung über dem Deckglas vorsichtig resuspendieren.
- Stellen Sie sicher, dass sich die Spermien am Boden der Vertiefung ansammeln, wo ihre Köpfe am Deckglas haften und ihre Geißeln die Lösung direkt über dem Deckglas kräftig einschlagen. Es ist wichtig, die Spermien vor der Aufnahme etwa 10 Minuten lang bei Raumtemperatur auf dem Deckglas sedimentieren zu lassen.
HINWEIS: Wenn sich menschliche Spermien schlecht anheften, gehen Sie zurück zu Schritt 5.1.1 und verdünnen Sie die vorbereitete Beschichtungslösung mit HS-Lösung (1:20 bis 1:2). Dieser Schritt muss auf Samenproben von verschiedenen menschlichen Spendern abgestimmt werden, basierend auf der variablen Spermienmotilität, die bei menschlichen Spermienpräparaten üblich ist.
- Anbringen des Deckglases
- Nehmen Sie ein Deckglas mit leicht anhaftenden Zellen aus der Vertiefung und legen Sie es in eine rautenförmige Vertiefung der Aufnahmekammer mit der HS-Lösung (Abbildung 4).
- Schalten Sie das mit HS-Lösung gefüllte Perfusionssystem (Abbildung 5) ein, um die Kammer zu spülen und Ablagerungen und überschüssige abgelöste Spermien aus der Kammer zu entfernen. Dadurch erhöht sich die Wahrscheinlichkeit, dass die Aufzeichnungspipette sauber bleibt, wenn sie die Zellen erreicht. Dieser Schritt ist hilfreich, wenn Sie mit nicht kapazitiven Zellen arbeiten, die dazu neigen, stärker am Deckglas zu haften.
HINWEIS: Bei der Aufnahme von kapazitiven Spermien muss es vermieden werden, die Perfusion sofort nach dem Einsetzen eines frischen Deckglases in die Kammer einzuschalten. Kapazitierte Spermien haben eine kräftige Beweglichkeit und haften nur lose am Deckglas. Um sicherzustellen, dass die größte Anzahl an kapazitiven Spermien verfügbar ist, ist es daher wichtig, ~ 10 Minuten zu warten und die kapazitiven Spermien am Deckglas haften zu lassen, bevor die Perfusion eingeschaltet wird. Sobald die geeignete kapazitive Zelle ausgewählt und ein Gigaseal gebildet wurde, kann die Perfusion wieder eingeschaltet werden.
- Auswahl einer Samenzelle für die Patch-Clamp-Aufnahme.
- Finden Sie eine geeignete Samenzelle mit einem zytoplasmatischen Tröpfchen mit 600-facher Vergrößerung (siehe unten). Dies geschieht mit einer 60-fachen Wasserimmersionslinse, wie in den Methoden mit einem Okular mit 10-facher Vergrößerung beschrieben. In Samenzellen, die aus dem Corpus Epididymis isoliert wurden, befindet sich die CD normalerweise nahe der Mitte des Mittelstücks. In kaudalen Zellen befindet sich die Zöliakie in der Regel in der Nähe des Anulus (Abbildung 2C). Bei menschlichen Spermien befindet sich die Zöliakie im Halsbereich (Abbildung 2A,B).
HINWEIS: Zusätzlich kann die ausziehbare 1,6-fache Vergrößerungsoption des Mikroskops verwendet werden, um die Spermienmorphologie genau zu untersuchen (960-fache Vergrößerung). - Stellen Sie sicher, dass das zytoplasmatische Tröpfchen oval ist und eine leicht längliche (Abbildung 2G), spindelartige Form hat. CDs, die sehr rund und vergrößert erscheinen, sind oft zerbrechlich und für das Patchen ungeeignet (Abbildung 2D,F).
- Wählen Sie ein bewegliches Spermium, bei dem der Kopf am Deckglas befestigt ist, so dass die Samenzelle teilweise fixiert ist, aber die Zöliakie und der Rest des Flagellums sich mit Flagellenschlag weiter bewegen. Achte darauf, dass der Kopf des Spermas locker mit dem Deckglas verbunden ist, so dass er sich ein wenig dreht, wenn sich das Flagellum von einer Seite zur anderen bewegt.
HINWEIS: Eine lockere Bindung ist wichtig, da nach der Bildung des Gigaohm-Siegels und vor dem Übergang in den Ganzzellmodus das Spermium aus dem Deckglas in die Lösung gehoben werden muss.
- Finden Sie eine geeignete Samenzelle mit einem zytoplasmatischen Tröpfchen mit 600-facher Vergrößerung (siehe unten). Dies geschieht mit einer 60-fachen Wasserimmersionslinse, wie in den Methoden mit einem Okular mit 10-facher Vergrößerung beschrieben. In Samenzellen, die aus dem Corpus Epididymis isoliert wurden, befindet sich die CD normalerweise nahe der Mitte des Mittelstücks. In kaudalen Zellen befindet sich die Zöliakie in der Regel in der Nähe des Anulus (Abbildung 2C). Bei menschlichen Spermien befindet sich die Zöliakie im Halsbereich (Abbildung 2A,B).
- Bildung eines Gigasiegels
HINWEIS: Um monovalente CatSper-Ströme im Ganzzellmodus aufzuzeichnen, werden die Pipetten mit Cs-Methansulfonat-Lösung (auch als Pipette oder intrazellulär bezeichnet) gefüllt (Tabelle 4) - dies ergibt einen Pipettenwiderstand von 11-17 MΩ (Abbildung 7A), der vom Verstärker automatisch berechnet wird, wenn ein Spannungsschritt von 0 mV bis 10 mV angelegt wird. Je nach Anwendung können Pipetten auch mit anderen Lösungen befüllt werden. Es wird empfohlen, Lösungen mit mobilen Anionen wie Methansulfonat, Cl- , Aspartat oder ähnlichen Ionen herzustellen, um den Pipettenwiderstand zu verringern. Die Osmolarität der Pipettenlösung sollte bis zu 10 mOsm höher sein als die der Badlösung. Eine etwas höhere Tonizität der Pipettenlösung trägt dazu bei, den Zugangswiderstand in die Spermien bei der Patch-Clamp-Aufzeichnung so gering wie möglich zu halten.- Nach der visuellen Selektion einer Samenzelle mit der richtigen Morphologie (Abbildung 2G) füllen Sie die Mikropipette mit einer Pipettenlösung (Tabelle 4) und befestigen Sie sie in der Pipettenhalterung.
- Um die Pipettenspitze frei von Schmutz zu halten, üben Sie mit der U-rohrförmigen Anordnung Überdruck auf die Pipette aus, um sicherzustellen, dass die Pipettenlösung nach dem Eintauchen in die extrazelluläre Lösung, die im Folgenden auch als "Badlösung" bezeichnet wird, aus der Spitze fließt (siehe Tabelle 2).
HINWEIS: Wenn die Bedingungen es zulassen, wird dringend empfohlen, die Dichtung unter konstanter Perfusion zu bilden, da dieser Zustand die sauberste Pipettenspitze gewährleistet. - Senken Sie die Pipette ab und tauchen Sie die Spitze in die Badlösung (Tabelle 2). Zu diesem Zeitpunkt kann der Pipettenwiderstand gemessen werden (Abbildung 7A).
- Um die Zelle deutlich sichtbar zu machen, positionieren Sie die Spitze der Pipette über der CD, wobei die Öffnung der Spitze diagonal (ca. 45°) zur CD ausgerichtet ist.
- Senken Sie die Spitze der Pipette schnell in Richtung CD, so dass sie sich in der gleichen Fokusebene befindet, innerhalb weniger μm von der CD.
- Sobald die Spitze der Pipette die CD berührt, übt man mit dem "Mundstück" einen Unterdruck auf die Pipette aus, um einen Teil des Tröpfchens in die Spitze zu schieben und eine Gigaohm-Dichtung zu bilden – in der Elektrophysiologie auch als "Saugereignis" bekannt. In der Regel kann nach dem ersten Kontakt mit der Pipettenspitze der Unterdruck in der Pipette bis zu einer Minute aufrechterhalten werden, um nach und nach eine Gigaohm-Abdichtung zu erreichen.
- Nach erfolgreicher Bildung des Gigaohm-Siegels (> 4-20 GΩ) heben Sie das Spermium vom Deckglas ab (Abbildung 7B).
HINWEIS: Dieser Schritt ist für Samenzellen von Nagetieren aufgrund ihrer Länge nicht erforderlich. Eine teilweise Ablösung des Spermienflagellums ist jedoch von Vorteil, um eine mögliche Pipettenabdrift zu verringern. Die Ablösung der menschlichen Spermien ist ein wesentlicher Schritt, da die Zöliakie klein ist (1~3 μm); Wenn die Zelle am Deckglas befestigt bleibt, kann selbst eine leichte Drift der Pipette während des Experiments die CD stören. Nachdem das Spermium angehoben wurde, schlägt sein Flagellum normalerweise weiter, während die Zelle nur an der Mikropipette befestigt ist.
- Einbruch und Übergang in den Ganzzellmodus.
- Kompensieren Sie Kapazitätstransienten mit dem Kompensatormodus des Verstärkers, bevor Sie in den Ganzzellenmodus übergehen (Abbildung 7B). Um zunächst Kapazitätstransienten zu beobachten, halten Sie das Membranpotential bei 0 mV und legen Sie 10 mV-Impulse mit dem Werkzeug "Membrantest" an (Abbildung 7B).
- Führen Sie einen Einbruch und Übergang in den Ganzzellenmodus durch, indem Sie kurze (1 ms) allmählich ansteigende (430-650 mV, ~50 mV Schritte) Spannungsimpulse in Kombination mit einem sehr leichten Sog anlegen (Abbildung 7C).
HINWEIS: Um Einbruchimpulse anzuwenden, verwenden Sie das zuvor programmierte Einbruchprotokoll in der Patch-Clamp-Software. Die Einbruchspannungsimpulse werden über den Hochspannungs-Befehlseingang (rückseitig geschaltet) auf der Rückseite des Verstärkers an das Spermatozoon angelegt. - Starten Sie nach dem Anlegen jedes Einbruchspannungsimpulses das Membrantest-Tool , um zu überprüfen, ob größere Kapazitätstransienten auftreten.
HINWEIS: Das Vorhandensein von Transienten mit großer Kapazität (Abbildung 7C) deutet darauf hin, dass der Einbruch stattgefunden hat und die gesamte Kapazität der Zelle gemessen wird (~1 pF für menschliche Spermien und ~2,5 pF oder mehr für murine Spermien). - Passen Sie die großen Kapazitätstransienten mit dem Membrantestwerkzeug an, um die Kapazität der gesamten Zelle sowie ihren Zugangswiderstand zu bestimmen.
HINWEIS: Der Zugangswiderstand sollte so gering wie möglich sein, um eine effiziente Perfusion des Inneren der Samenzelle mit der Mikropipettenlösung zu gewährleisten, sowie für eine zuverlässige Spannungsklemmung der Plasmamembran der Spermien. Der Zugangswiderstand beträgt in der Regel 25-30 MΩ und 50-70 MΩ für Cs+ /K+ - bzw. NMDG-basierte intrazelluläre Lösungen. - Nach erfolgreichem Einbruch fahren Sie mit den geplanten Ganzzell-Patch-Clamp-Experimenten fort, wie z. B. dem Auftragen verschiedener Badlösungen (Abbildung 8) mit unterschiedlichen Verbindungen oder dem Messen von Kanalaktivitäten unter Verwendung von Spannungsschritt- (Abbildung 8, Abbildung 9) oder Spannungsrampenprotokollen. Wenn der Einbruch nicht erfolgreich war, kehren Sie zu Schritt 6.4.1 zurück. indem Sie eine frische Mikropipette auswählen und eine andere geeignete Samenzelle auswählen.
Ergebnisse
Die Spermien-Patch-Clamp-Methode ermöglicht die direkte Aufzeichnung des CatSper-Kanals.
Wie oben erwähnt, wurden CatSper-Aufzeichnungen durchgeführt, indem eine hochohmige Dichtung (Gigaohm) zwischen der Patch-Pipette und dem Säugetierspermium an ihrem zytoplasmatischen Tröpfchen hergestellt wurde. Beim Einbruch und Übergang in den Ganzzellmodus wird der volle elektrische Zugang zum gesamten Körper der Samenzelle und ihrem Inneren, einschließlich des Spermienkopfes und des Flagellums, erhalten 2,8,39,51. Dieser Zustand ermöglicht letztendlich die Aufzeichnung von jedem aktiven Ionenkanal, der sich auf der Plasmamembran der Spermien befindet. Eine nominell zweiwertige (DVF) Badlösung, die entweder Cäsium oder Natrium als Hauptpermeation enthält, ist für die Aufzeichnung von monovalenten CatSper-Strömen 2,8,39,51 vorzuziehen. Während der CatSper-Kanal zweiwertige Ionen wie Ca2+ und Ba2+ leitet, bewegen sie sich viel langsamer durch die CatSper-Pore, was zu kaum nachweisbaren Leitwerten von wenigen Picoampere (~10-20 pA)2,8,39,51 führt. Daher ist die Messung monovalenter und damit größerer Ströme über den CatSper-Kanal eine bequemere Methode zur Beurteilung des Stroms (Abbildung 8). Es ist wichtig zu beachten, dass CatSper auch durchlässig für Kalium ist; Daher muss der CatSper-Kanal blockiert werden, oder CatSper-defiziente Spermien müssen in Situationen verwendet werden, in denen man nur die Kaliumkanäle der Spermien untersuchen möchte 2,3,8,28,65. Durch Variation der Ionenzusammensetzung der Pipette und der Badlösung kann man bestimmte Ionenkanäle selektiv ausschließen und gleichzeitig Bedingungen für die selektive Aufzeichnung nur von bestimmten Ionenkanaltypen schaffen. Zum Beispiel führt die Zugabe von Cs+ in die Pipettenlösung zu einer Blockierung der Ionenpermeabilität durch die Kaliumkanäle der Spermien.
Der CatSper-Kanal ist bei Säugetieren unterschiedlich reguliert.
Spermien verschiedener Arten sind in ihrer Morphologie und ihren internen Regulationswegen unterschiedlich66. Es ist keine Überraschung, dass ihre Ionenkanäle auch auf einzigartige Weise reguliert werden, die die spezialisierten Mikroumgebungen des männlichen und weiblichen Fortpflanzungstrakts widerspiegelt. Die Spermien-Patch-Clamp-Methode wurde erfolgreich bei sechs Säugetierarten angewendet: Maus2, Ratte56, Mensch39,51, Rind, Wildschwein und Makake41, wie in Abbildung 9 gezeigt. Für diese Experimente wurden Samenzellen von adulten männlichen Rhesusaffen [Macaca mulatta] vom California National Primate Research Center in Übereinstimmung mit den Standards der Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC) unter Verwendung von genehmigten Tierprotokollen der University of California, Davis, gewonnen, wie in41 beschrieben; und alle Studien wurden in Übereinstimmung mit dem U.S. National Institutes of Health Guide for the Care and Useof Laboratory Animals durchgeführt. Bullen- und Wildschweinsperma wurden als Nebenprodukte gewonnen, die von der spezifischen IACUC-Zulassung durch die Einrichtungen des UCD Department of Animal Science ausgenommen waren, und alle Tiere wurden in von der AAALAC zugelassenen Einrichtungen gehalten. Bullen- und Wildschweinsamen kann auch aus kommerziellen Quellen gewonnen werden.
Primaten (Rhesusaffen) und menschliche Spermien zeigten ähnliche Eigenschaften und Regulation des CatSper-Kanals. Interessanterweise scheint die Progesteronaktivierung von CatSper nur bei Primatenspermien zu sein (Abbildung 9 und 41), da die Spermien von Wildschweinen, Bullen und Nagetieren keine Progesteron-stimulierte Veränderung ihrer CatSper-Ströme zeigten. Bei Bullen und Wildschweinen lag die Aktivität des CatSper-Kanals sogar unterhalb der nachweisbaren Grenzen (Abbildung 9), was darauf hindeutet, dass bei diesen Spezies der Kalziumeinstrom und die daraus resultierende Hyperaktivierung durch andere Kanäle/Transporter gesteuert wird oder dass ein anderer natürlicher Stimulator für die Aktivierung ihrer CatSper-Kanäle erforderlich ist. Bei allen hier genannten Spermienarten, einschließlich Bullen- und Eberspermien, wurde der volle elektrische Zugang zum Inneren der Samenzellen erreicht und die Zellen wurden im Ganzzellmodus aufgezeichnet, wie das Auftreten der großen Kapazitätsartefakte beim Einbruch deutlich machte (Abbildung 7). Dieser Zustand ermöglicht eine einfache Aufzeichnung des funktionellen CatSper-Kanals, und sein Fehlen in den Spermien von Ebern und Rindern deutet darauf hin, dass dieser Kanal entweder durch einen noch unbekannten endogenen Inhibitor blockiert ist, der in den Spermien dieser Spezies vorhanden ist, oder dass ein spezifischer Modulator aktiviert werden muss. Es handelt sich jedoch um vorläufige Experimente, und es sind zusätzliche Experimente für Spermien von Wildschweinen und Bullen erforderlich, um die funktionelle Bedeutung des CatSper-Kanals bei diesen Spezies sicherzustellen. Dieses breite Spektrum der Spermienionenkanaldiversität zwischen den Spezies könnte mit dem Verhältnis von Spermien zu Eizellengröße, dem Verhältnis zwischen Spermiengröße und den schützenden Gewändern der Eizelle zusammenhängen oder als Barriere für die Befruchtung durch andere Spezies dienen66.

Abbildung 1: Morphologische Diversität der Spermien von Säugetieren. (A) Unteres Bild: schematische Darstellung eines Spermatozoons; Zelluläre Kompartimente sind markiert. Obere Paneele: DIC-Bilder von Spermien verschiedener Arten im Uhrzeigersinn: Ratte (Rn; Rattus norvegicus); Maus (Mm; Mus musculus); Bulle (Bt; Bos taurus); Wildschwein (Sd; sus scrofa domesticus); Mensch (Hs; Homo sapiens) und Rhesusaffen (Mmu; Macaca mulatta). Die Maßstabsleiste gilt für alle DIC-Bilder. Die Einsätze weisen auf zytoplasmatische Tröpfchen hin. (B) Flicken der Samenzellen von Säugetieren. Um eine erfolgreiche Dichtungsbildung zwischen Pipettenspitze und Plasmamembran zu erreichen, wird ein Teil der Plasmamembran schonend in die Pipettenspitze eingesaugt. Der Übergang in den Ganzzellmodus erfolgt durch Aufbrechen der Plasmamembran zwischen der Spitze und der Zelle (diese Abbildung wurde aus8 reproduziert). Rechtes Bild: Menschliche Samenzellen, die an eine Mikropipette befestigt sind. (C) Schematische Darstellung des menschlichen Spermatozoons und einiger der flagellären Ionenkanäle, die in menschlichen Samenzellen mit der Patch-Clamp-Methode untersucht wurden, sowie der von ihnen geleiteten Ionen. CatSper- Calcium-Ionenkanal 39,51; Hv1- Protonenkanal 51,56,67; Slo3/Slo1-Kaliumkanäle 50,53,65,68; TRPV4- transienter Rezeptorpotential-Kationenkanal Vanilloid Typ 448. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
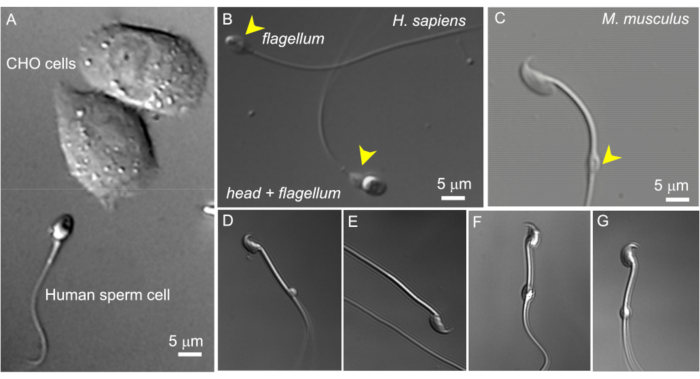
Abbildung 2: Spermiengröße und variable Morphologie von zytoplasmatischen Tröpfchen. Die DIC-Bilder von intakten lebenden Samenzellen. (A) Vergleich der Größe einer menschlichen Samenzelle (unten) und zweier CHO-Zellen (oben). (B) Intaktes menschliches (Homo sapiens) Spermium (unten) und eine kopflose Samenzelle (Flagellum, oben). Zytoplasmatische Tröpfchen sind durch gelbe Pfeilspitzen gekennzeichnet; Diese Figur wurde von8. (C) Intaktes murines Spermium (Mus musculus) mit den normal geformten zytoplasmatischen Tröpfchen (CD), die durch die gelbe Pfeilspitze angezeigt werden. (D-G) Nebenhodenhafte murine Spermien haben zytoplasmatische Tröpfchen unterschiedlicher Größe und Form; Nur (C) und (G) sind für Patch-Clamp geeignet. (D) CD ist mikroskopisch klein und einseitig; (E) CD fehlt; (F) Die CD enthält Partikel, die die Aufnahmepipette verstopfen können; (G) Zöliakie ist glatt, gleichmäßig und nicht aufgequollen. Wenn Sie mit dieser Art von CD ein Gigasiegel bilden, wird dies wahrscheinlich zu einer erfolgreichen Aufnahme führen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Komponenten des Spermien-Patch-Clamp-Rigs. (A) Typisches Spermien-Elektrophysiologie-Rig mit wesentlichen Komponenten: (1) inverses Mikroskop; (2) rauscharmer Digitalisierer; (3) Verstärker; (4) Mikromanipulator mit geringer Drift, der mit einer Mikromanipulatorplattform an das inverse Mikroskop gekoppelt ist; (5) PC-Computer; (6) einen schwingungsdämpfenden Lufttisch; (7) Faradayscher Käfig zum Schutz des Setups vor elektrischen Störungen durch die Umgebung. Es ist wichtig, dass alle elektrisch betriebenen Komponenten des Rigs, einschließlich Computertastatur und -maus, ein geringes oder kein elektrisches Rauschen (50 Hz oder 60 Hz) erzeugen und dass alle Komponenten des Rigs ordnungsgemäß geerdet sind. (B) Mikropipettenabzieher zur Aufzeichnung der Pipettenherstellung. (C) (1) microForge zum Brennpolieren von Pipetten; (2) Kapillaren aus Borosilikatglas mit einem Außendurchmesser von 1,5 mm, einem Innendurchmesser von 0,86 mm und einem inneren Filament; (3) Pipetten-Auffangbox. (D) Phasen des erfolgreichen Feuerpolierens der Pipette: (a) Unpolierte Pipette mit einem Innendurchmesser von 2 mm; b) feuerpolierte Pipette mit einem Innendurchmesser von 0,5 mm; c) Überpolierte, versiegelte Pipette, die nicht für die Aufzeichnung geeignet ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Komponenten des Aufnahmekammersystems und dessen Montage. (A) Wesentliche Bestandteile des Aufnahmekammersystems: (1) Mikroskoptischadapter für Plattformen der Serie 20 mit (2) zwei Tischhalteklemmen; (3-4) magnetisch beheizte Plattform der PM-Serie mit (3) Magnetklemmen zur Aufnahme der Perfusionskammer; (5) Perfusionskammer; (6) Agar-Brücke; (7) Magnetklemme, Referenzelektrode mit 2 mm Buchse zum Ag/AgCl-Pellet; (8) magnetische Halterung (MAG-1) für die Saugleitung; (9) Saugrohr; (10) O-Halter des Saugrohrs. (B) Zusammengebautes Aufzeichnungskammersystem mit den unter (A) angegebenen Komponenten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Komponenten des Perfusionssystems. (A) zusammengesetzte Perfusionsleitung und (B) ihre wesentlichen Bestandteile: (1) 20-ml- und 3-ml-Spritzen; (2) Absperrhahn mit Luer-Anschlüssen; 4-Wege; männliches Schloss; (3) weiblicher Luer-Schlauchtülle-Adapter, 1/16"; (4) Perfusionsschlauch aus Polytetrafluorethylen (PTFE) (Microbore PTFE-Schlauch, 0,022" ID × 0,042" AD); (5) Perfusionsverteiler aus Polytetrafluorethylen mit 8 Positionen; (6) Silikon-Verbindungsschlauch (platingehärteter Silikonschlauch, 1/32" ID × 3/32" AD); (7) Verteileranschlussschlauch (PTFE-Schlauch, 1/32" ID × 1/16" AD). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Sektion männlicher Mäuse. (A) Männliche Fortpflanzungsorgane von Mausen; Sowohl Hoden als auch Nebenhoden sind dargestellt. (B) Die Nebenhoden werden in eine 35-mm-Zellkulturschale mit HS-Lösung überführt und das restliche Fett und die Samenleiter entfernt. (C) Jeder Nebenhoden wird dann mit einer #15 Skalpellklinge in Caput, Corpus und Cauda unterteilt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Bildung und Einbruch von Gigasealen in die Spermien der Maus. Die Schnittstelle des Tools "Membrane Test" der kommerziellen Patchklemmen-Software. Drei Stufen des Spermien-Patch-Klemmens: (A) Die aufgezeichnete Pipette wird in eine Bad-HS-Lösung getaucht, wodurch ein Pipettenwiderstand von 14,8 MΩ erzeugt wird; (B) Es bildet sich ein Gigaseal (der Widerstand beträgt 4,7 GΩ), Kapazitätstransienten werden kompensiert und das Spermium wird vom Deckglas abgehoben; (C) Übergang in den Ganzzellmodus. Das Einfahren und der Übergang in den Ganzzellenmodus erfolgt durch Anlegen kurzer (1 ms) allmählich ansteigender (430-650 mV, ~50 mV Schritte) Spannungsimpulse in Kombination mit einem Lichtsog, wie links gezeigt. Der Einbruch ist eingetreten, wie aus dem Erscheinungsbild der großen Kapazitätstransienten hervorgeht, die die gesamte Kapazität der Zelle widerspiegeln (~2,93 pF für diese Samenzelle). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
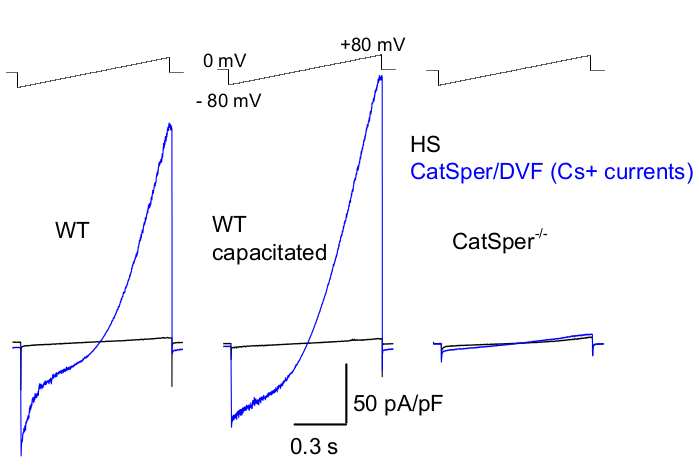
Abbildung 8: Murine CatSper-Aufzeichnung von Wildtyp-Cauda epididymal, kapazitiven und CatSper-Knockout-Spermien. Zur Aufzeichnung der monovalenten CatSper-Aktivität wird alle 5 s ein Rampenprotokoll angewendet und CatSper-Ströme aus einem Haltepotential von 0 mV39,51 durch Spannungsrampen erzeugt. Spannungsrampen (-80 mV bis 80 mV; 850 ms) werden in HS und nominell zweiwertfreier Lösung (DVF) verwendet. Die Daten wurden bei 2-5 kHz abgetastet und bei 1 kHz gefiltert. Die Ausgangsströme werden in HS-Lösung aufgezeichnet, die aufgrund der Hemmung durch hohes extrazelluläres Magnesium39,51 keinen CatSper-Strom erzeugt. Basisströme sind nützlich, um die Leckleitfähigkeit (Nicht-Ionenkanalwege) abzuschätzen. Repräsentative Cs+-Ganzzell-CatSper-Stromdichten (pA/pF; blau), die von kaudalen WT-Spermien von Mäusen (nicht kapazitiv; links und kapazitiv; Mitte) und CatSper-defizienten kaudalen murinen Spermien (rechts) aufgezeichnet wurden. Die Ströme wurden durch Spannungsrampen ab einem Haltepotential von 0 mV und Rampen von -80 mV bis 80 mV in HS und nominell zweiwertfreier Lösung erzeugt. Ausgangsströme (schwarz), aufgezeichnet in HS-Lösung. Um die Stromdichten zu erhalten, wurden die CatSper-Stromamplituden auf die Zellkapazität (pA/pF) normiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
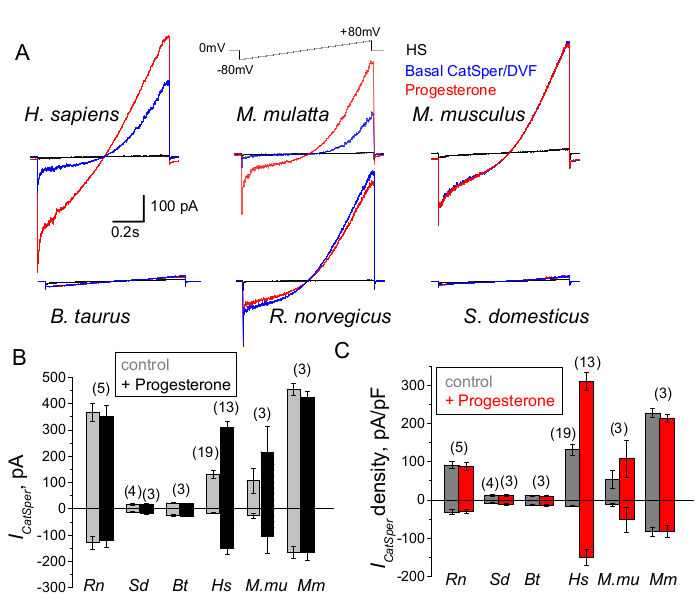
Abbildung 9: Progesteronregulation von CatSper bei verschiedenen Säugetierarten. (A) Repräsentativer CatSper-Strom, der von Spermien verschiedener Spezies durch ein Spannungsrampenprotokoll ausgelöst wird, wie angegeben. Spezies: Mensch (Hs; H. sapiens); Rhesusaffen (Mmu; M. mulatta), Maus (Mm; M. musculus), Bulle (Bt; B. taurus); Ratte (Rn; R. norvegicus); Wildschwein (Sd; S. scrofa domesticus). Es wurden CatSper-Ströme in Abwesenheit (blau) und Anwesenheit (rot) von 1 mM Progesteron sowie die Basalströme in HS-Lösung (schwarz) aufgezeichnet. (B) CatSper-Stromamplituden (ICatSper, pA) und (C) Aufzeichnungen der durchschnittlichen Stromdichten (pA/pF) von Spermien verschiedener Spezies, wie angegeben; n gibt die Anzahl der verwendeten einzelnen Samenzellen an. Die Daten beziehen sich auf den Mittelwert +/- S.E.M. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 10: Der Unterschied in der Flagellenmotilität. Zwei repräsentative Beispiele für zytoplasmatische Tröpfchen und flagellare Motilität. Die überlagerten Bilder derselben Spermien von Ratten (Rn) und Menschen (Hs) wurden zu zwei verschiedenen Zeitpunkten aufgenommen, zu denen sie die distalste Flagellenablenkung aufweisen. Gestrichelte Rechtecke zeigen die Region mit zytoplasmatischen Tröpfchen und ihrer entsprechenden räumlichen Mobilität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 11: Anordnung des U-Rohrs und seine wesentlichen Komponenten. (A) Bestandteile des U-Rohrs: (1) 10 mL serologische Pipette; (2) Silikonschlauch; (3) Verbindungsschlauch aus Silikon; (4) 1 ml Spritze; (5) Weiblicher Luer-Widerhaken-Adapter; (6) männlicher Luer-Integral-Lock-Adapter 1/8"; (7) Absperrhahn mit Luer-Anschlüssen; 4-Wege; männliches Schloss; (8) männlicher Widerhakenadapter der Luer-Serie, 1/16". (B) Vollständig montiertes U-Rohr und (C) U-Rohr, das am Faradayschen Käfig befestigt ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
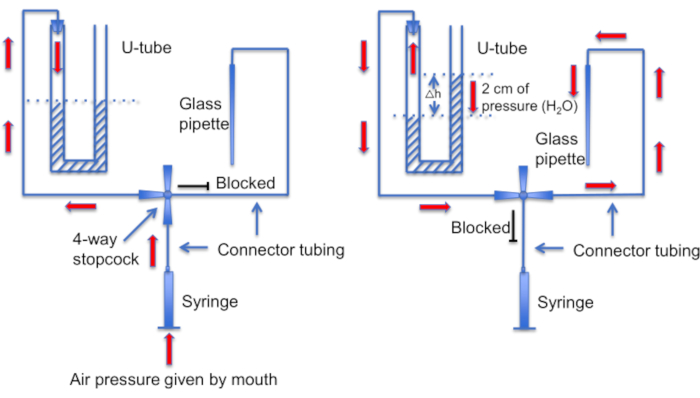
Abbildung 12: Eine schematische Darstellung der U-Rohr-Baugruppe. Linkes Panel: Der Überdruck wird durch den Mund bereitgestellt, um einen Unterschied im Flüssigkeitsstand im U-Rohr zu erzeugen. Der Flüssigkeitsstand im rechten Horn steigt um 2 cm. Nachdem diese Pegeldifferenz erzeugt wurde, wird der Absperrhahn gedreht, um das U-Rohr mit der Leitung zu verbinden, die zu einer Aufnahmepipette führt. Rechte Platte: Der höhere Flüssigkeitsstand im rechten Horn erzeugt einen Überdruck, der die Pipettenlösung ständig aus der Pipettenspitze drückt und die Spitze frei von Schmutz hält. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Chemikalien | Molgewicht (g/mol) | Mm | g für 1L |
| NaCl | 58.44 | 97.8 | 5,72 Gramm |
| Kcl | 74.55 | 5 | 0,373 Gramm |
| KH2PO4 | 136.09 | 0.37 | 50,4 mg |
| MgSO4 x 7.H2Ω | 246.48 | 0.2 | 49,3 mg |
| CaCl2 x 2.H2Ω | 147.02 | 2 | 0,294 Gramm |
| HEPES | 238.3 | 20 | 4.766 Gramm |
| Traubenzucker | 180.2 | 3 | 0,540 Gramm |
| Natriumlactat (60 % w/w) | 112.06 | 20 | 3 ml |
| Natriumpyruvat | 110 | 0.4 | 44 mg |
Tabelle 1: Lösung für humane Schlauchflüssigkeit (HTF)
| Chemikalien | Molgewicht (g/mol) | Mm | g für 1L |
| NaCl | 58.44 | 135 | 7.889 Gramm |
| Kcl | 74.55 | 5 | 0,373 Gramm |
| CaCl2 x 2. H2Ω | 147.02 | 2 | 0,294 Gramm |
| MgSO4 x 7. H2Ω | 246.48 | 1 | 0,247 Gramm |
| HEPES | 238.3 | 20 | 4.766 Gramm |
| Traubenzucker | 180.2 | 5 | 0,901 g |
| Natriumlactat (60 % w/w) | 112.06 | 10 | 1,5 ml |
| Natriumpyruvat | 110 | 1 | 0,110 g |
Tabelle 2: Lösung mit hohem Salzgehalt (HS)
| Chemikalien | Molgewicht (g/mol) | Mm | g (für 500 ml) |
| CsMeSO3 | 228.0 | 140 | ca. 15.960 Gramm |
| HEPES | 238.3 | 40 | 4.766 Gramm |
| EDTA | 292.24 | 1 | 0,146 Gramm |
Tabelle 3: CsMeSO3 Badlösung (Divalente freie Badlösung: DVF)
| Chemikalien | Molgewicht (g/mol) | Mm | mg (für 25 ml) |
| CsMeSO3 | 228.0 | 130 | 741 mg |
| HEPES | 238.3 | 70 | 417 mg |
| EDTA | 292.24 | 2 | 14,6 mg |
| EGTA (EGTA) | 380.35 | 3 | 28,5 mg |
| CsCl | 1 M Lösung | 1 | ca. 25 μl |
Tabelle 4: CsMeSO3 Pipettenlösung
Diskussion
Wir beschreiben ein detailliertes Protokoll zur Durchführung elektrophysiologischer Ableitungen von Samenzellen verschiedener Spezies. Angesichts der physiologischen Bedeutung von Ionenkanälen und elektrogenen Transportern für Spermien ist diese Technik ein leistungsfähiges Werkzeug, um die Physiologie der Spermien sowie Defekte zu untersuchen, die zur männlichen Unfruchtbarkeit führen. Der Experimentator mag die Ausführung dieser Technik anfangs als herausfordernd empfinden, aber mit Ausdauer und Ausdauer folgt der Erfolg.
Die Spermien von Säugetieren sind lang (normalerweise >50 μm), schmal und sehr beweglich. Die basale Schlagfrequenz (BF) von Säugetierspermien variiert stark mit Werten von durchschnittlich 4 Hz (Maus 69), 7-15 Hz (Wildschwein 70,71), 11 Hz (Ratte 72), 11-20 Hz (Bulle 18), 24 Hz (Rhesusaffen 23) und bis zu 25 Hz (Mensch 3). Das zytoplasmatische Tröpfchen (CD) ist der Eingang für die Aufzeichnung von Samenzellen. Bei Nagetierspermien ist die CD oft distal, bewegt sich aber entlang des Flagellums (Abbildung 10), was ein zusätzliches Hindernis für die Aufnahme darstellt. In menschlichen Samenzellen befindet sich die Zöliakie jedoch häufiger in der Nähe des Kopfes. Die Schlüsselkomponenten eines erfolgreichen Spermien-Patch-Clamps sind daher eine hervorragende Optik, um eine klare, scharfe Sicht auf die CD zu ermöglichen, und ein hochpräzises Mikromanipulatorsystem ohne Drift oder Vibrationen. Eine anfänglich hohe Ausfallrate ist zu erwarten und ist innerhalb der ersten Tage nach der Spermien-Patch-Klemme normal. Wir empfehlen eine routinemäßige Praxis mit mehreren Versuchen pro Woche. Mehrere Aufnahmen pro Tag und Woche etablieren eine Routine und verbessern die motorischen Fähigkeiten.
Bis vor kurzem wurde die Identifizierung und pharmakologische Charakterisierung von Ionenkanälen der Spermien dadurch behindert, dass sie nicht direkt untersucht werden konnten. Das Feld stützte sich weitgehend auf immunzytochemische Studien, die oft unter der Unspezifität der Antikörper und/oder dem Fehlen entsprechender genetischer Modelle leiden. Zur Untersuchung von Kalziumkanälen ist das klassische Kalziumbildgebungsverfahren weit verbreitet, das seine eigenen Vorteile und Grenzen hat 73,74,75,76,77. Während die Calcium-Bildgebung eine relativ einfache Methode ist, die für Studien mit mittlerem bis hohem Durchsatz anwendbar ist 78,79,80,81 und weniger invasiv ist, erfordert sie relativ intakte Zellen und stellt daher eine Hürde dar, um die Funktion von Ionenkanälen zu entschlüsseln, die von intrazellulären Signalkaskaden entkoppelt sind, oder um sie von Kalzium-Ionenaustauschern zu unterscheiden. Darüber hinaus ist es schwierig, das Membranpotential zu kontrollieren und daher den Beitrag der spannungsgesteuerten Kalziumkanäle auszuschließen. Zu den Vorteilen der Calciumfluorometrie gehört die Verwendung von Calcium-Ratiometric-Farbstoffen, die eine genaue Messung der Änderungen der Calciumionenkonzentration ermöglichen. Gleichzeitig muss man sich darüber im Klaren sein, dass die Empfindlichkeit dieser Farbstoffe je nach Änderung des intrazellulären pH-Werts variieren kann.
Im Folgenden beschreiben wir die kritischen Schritte innerhalb des Protokolls, einschließlich der Schritte zur Fehlerbehebung der Methode. Für die Herstellung der Versuchslösungen ist es unerlässlich, nur reine Reagenzien zu verwenden, da bereits geringe Verunreinigungen mit unerwünschten Ionen (wie Magnesium oder Schwermetallen) die Detektion von einwertigen Strömen beeinträchtigen können. Angesichts der geringen Größe der Samenzellen kann man mit einer relativ geringen Anzahl von Ionenkanälen pro Zelle rechnen. Daher reicht der Nettostrom von wenigen pA bis zu mehreren hundert pA. Daher muss das interne elektrische Rauschen des Bohrgeräts minimal sein, um die Erkennung kleiner Ströme zu gewährleisten, und die Verwendung von driftfreien Geräten wird dringend empfohlen. Um einen bestimmten Leitwert von elektrischem Rauschen und Hintergrundleck zu unterscheiden, müssen das Aufzeichnungsgerät und das Erdungssystem maximiert werden. Dies wird erreicht, indem das Bohrgerät ordnungsgemäß geerdet wird, um elektrische Störungen82 zu vermeiden. Die Verwendung eines Faradayschen Käfigs wird dringend empfohlen, um sich vor elektrischen Störungen zu schützen, die von einer Vielzahl elektrischer Geräte wie Gebäudeleuchten und elektrischen Wandleitungen verursacht werden. Es ist wichtig, dass alle elektrisch betriebenen Komponenten des Rigs, einschließlich der Computertastatur und der Maus, wenig oder gar kein elektrisches Rauschen (50 Hz oder 60 Hz) abstrahlen und dass alle Komponenten des Rigs ordnungsgemäß geerdet sind. Das elektrische Rauschen in der Ganzzellenkonfiguration sollte bei geschlossenen Ionenkanälen < 0,5 bis 1 pA betragen.
Ein weiterer wichtiger Punkt ist die Überwachung der korrekten Osmolaritäten der Arbeitslösungen. Die Zusammensetzung der intra- und extrazellulären Lösungen muss genau bestimmt und ihre Osmolaritäten korrekt gemessen werden. Die extrazelluläre Lösung muss im Vergleich zur Pipettenlösung leicht hypoton sein, da sie zu einer winzigen Zellschwellung führt und verhindert, dass die Pipette durch die Spermienmembran verstopft wird. Hinweis: Wenn die Pipettenlösung zu hyperton ist und sich von der Badlösung um mehr als 10 mOsm unterscheidet, kommt es zu einer übermäßigen Zellschwellung und einem Siegelbruch. Das hat zur Folge, dass die Zelle zerbrechlich ist und das Gigasiegel innerhalb von Sekunden nach dem Einbruch verloren geht. Unserer Erfahrung nach ist eine ungenaue Lösungsvorbereitung einer der häufigsten Fehler, der ein erfolgreiches Patch-Clamping verhindert.
Ein weiteres potenzielles Hindernis, das es zu vermeiden gilt, sind weichmacher-/phthalathaltige Kunststoffe sowie mineralölgeschmierte Spritzen. Die Schläuche, Spritzen und alle Kunststoffgeräte, die mit Lösungen und damit mit Samenzellen in Berührung kommen, sollten keine Weichmacher oder andere Umweltgifte oder Öle auslaugen, da solche Chemikalien die Aktivität der Ionenkanäle erheblich verändern können. Wir verwenden Teflonschläuche mit kleinem Durchmesser als Hauptperfusionsleitung. Teflon (PTFE) hat wenig auslaugbare Verbindungen, ist aber ziemlich steif. Flexible Verbindungen bestehen aus hochreinen Silikonschläuchen, die über den Teflonschlauch passen. Alle Spritzen, die für das Perfusionssystem verwendet werden, verzichten auf jegliches Schmiermittel, da das Mineralöl oder andere Schmierzusätze die Ionenkanalaufzeichnung stören können.
Wir können nicht genug betonen, wie wichtig es ist, das richtige Glas zu verwenden und die richtige Mikropipettenform zu ziehen. Daher ist die optimale Herstellung von Glasmikropipetten eine Voraussetzung für ein erfolgreiches Patchen. Wir verwenden Mikropipetten aus Glas, die nur aus Borosilikatglas hergestellt werden, das ein Filament enthält, um die Lösungsfüllung zu verbessern. Die Spitze der Pipetten muss feuerpoliert werden, um den idealen dichten Verschluss zu gewährleisten. Pipettenspitzen mit einem Durchmesser von mehr als 2 μm (und damit einem Widerstand von 10 MΩ oder darunter) sind in der Regel nicht für Spermien-Patch-Clamp geeignet.
Ein weiterer wichtiger Schritt besteht darin, sicherzustellen, dass die Mikropipettenspitze vor der Dichtungsbildung frei von Schmutz oder Luftblasen gehalten wird. Dies ist eine schwierige Aufgabe, da die Mikropipette in eine Lösung voller beweglicher Zellen geladen wird. Ein Faktor, der hilft, ein versehentliches "Anstoßen" der Pipette in frei schwimmende Samenzellen zu vermeiden, ist die Verwendung einer konstanten Perfusion, um alle nicht anhaftenden Zellen wegzuspülen. Ein weiteres Werkzeug ist ein selbstgebautes "U-Rohr", mit dem zwischen Über- und Unterdruckmodus gewechselt werden kann, um die Spitze sauber zu halten (Abbildung 11 und Abbildung 12).
Da Samenzellen in der Form und Größe ihrer zytoplasmatischen Tröpfchen (CD) sehr unterschiedlich sind, ist es wichtig, ein Tröpfchen mit geeigneter Morphologie auszuwählen. Wie in Abbildung 2 gezeigt, eignen sich nur CDs, die klein (1-3 μm), glatt, gleichmäßig und nicht übermäßig aufgequollen sind, für Patch-Clamp. Winzig, einseitig; "aufgeblähte", volltransparente CDs erzeugen schwache oder keine Dichtungen. CDs mit großen löslichen Partikeln können die Aufnahmepipette verstopfen. Wenn Hodenspermien von Mäusen in den Nebenhoden gelangen, befinden sich ihre Zöliakie im Halsbereich, in der Nähe des Kopfes. Auf ihrem Weg durch den Nebenhoden bewegen sich ihre Zöliakie entlang des Mittelstücks und erreichen schließlich die Verbindung zwischen dem Mittelstück und dem Hauptstück (dem Anulus), wenn die Spermien den Nebenhoden der Cauda erreichen. Daher befindet sich die Zöliakie, wie oben erwähnt, bei Samenzellen, die aus dem Corpus Epididymis isoliert wurden, normalerweise nahe der Mitte des Mittelstücks. In kaudalen Zellen befindet sich die Zöliakie in der Regel in der Nähe des Anulus (Abbildung 2C). Bei menschlichen Spermien befindet sich die Zöliakie im Halsbereich (Abbildung 2A,B).
Während dies für Spermien, die aus Labortieren isoliert wurden, kein Problem darstellt, besteht eine erhebliche Variabilität zwischen menschlichen Spendern. Schwankungen in der Spermienqualität innerhalb desselben Spenders wirken sich hauptsächlich auf die Qualität der Plasmamembran der Spermien aus und erschweren manchmal die Bildung von Dichtungen. Es gibt eine geringere Variabilität im Verhalten der Ionenkanäle und in der Pharmakologie, Faktoren, die wahrscheinlich mit der individuellen Genetik oder Physiologie korrelieren. Man muss hartnäckig sein und Proben aus verschiedenen Spenden über mehrere Tage hinweg auswerten und sich auf mehrere menschliche Spender verlassen. Die Arbeit mit menschlichem Material erfordert zusätzliche Geduld, da die Qualität der gespendeten Samen innerhalb desselben Spenders stark variiert, abhängig von verschiedenen Umweltfaktoren. Wir empfehlen, Proben von verschiedenen Spendetagen auszuwerten, um eine endgültige Entscheidung über den Spenderstatus zu treffen. Während ejakulierte, gereinigte Spermien in der Regel innerhalb von Stunden (bis zu 12 Stunden nach der Isolierung für menschliche Spermien) für die Elektrophysiologie geeignet sind, eignen sich Nebenhodenspermien von Mäusen nur innerhalb eines 2-Stunden-Fensters nach der Isolierung zum Patchen.
Und zu guter Letzt unterscheidet sich die Bildung von Gigasiegeln zwischen den Samenzellen. Bei Maus-/Nagetier-Spermien erfolgt die Gigaseal-Bildung fast augenblicklich, während mehrere Sekunden (und manchmal bis zu einer Minute) erforderlich sind, um einen Gigaseal mit einem menschlichen Sperma zu bilden. Oft ergibt sich bei der anfänglichen Absaugung ein Eingangswiderstand von 200 MΩ bis 800 MΩ. Das Umschalten des Haltepotentials auf -60 mV und das Bereitstellen von "Membrantest"-Kurzimpulsen auf bis zu 10 mV hilft oft, die Bildung von Gigasealen zu verhindern (durch Spannungsfeld-induzierte Bewegung der Membran in der Pipette).
Die Spermienzell-Patch-Clamp-Technik ermöglicht die detaillierte Untersuchung spezifischer Ionenkanäle in ihrem natürlichen Expressionssystem. Der Erfolg der Technik hängt von der richtigen Ausrüstung, hochwertigen lebensfähigen Samenzellen, reinen Reagenzien, grundlegenden elektrophysiologischen Fähigkeiten, Geduld und Ausdauer ab. Die Methode eröffnet neue Grenzen in der Physiologie der Spermien, indem sie die evolutionäre Vielfalt der Ionenkanäle, die Mechanismen ihrer Regulation und die Veränderungen ihrer Funktion untersucht, wenn sie vom männlichen in den weiblichen Fortpflanzungstrakt übergehen und durch exogene Bedingungen wie pH-Wert und Liganden verändert werden.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt durch NIH Grant R01GM111802, Pew Biomedical Scholars Award 00028642, Alfred P. Sloan Award FR-2015-65398 und Packer Wentz Endowment Will (to P.V.L.). Diese Arbeit wurde auch von der Deutschen Forschungsgemeinschaft 368482240/GRK2416 (an N.M.) und vom China Scholarship Council Fellowship an B.L. unterstützt. Wir danken Dr. Dan Feldman für die Bereitstellung von Rattengewebe, Katie Klooster und Stuart Meyers von der UC Davis für die Hilfe bei der Gewinnung von Primatensamenzellen und Steven Mansell für die Hilfe bei der Datenerfassung von Samenzellen von Wildschweinen und Bullen.
Materialien
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
Referenzen
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten