Method Article
포유류 정자 세포의 원형질막을 가로지르는 전기 전류 기록
요약
이 프로토콜은 이온 채널 활동을 직접 기록하는 것을 목표로 전체 세포 구성에서 포유류 정자 세포의 전기 기록을 수행하는 방법을 설명합니다. 이 방법은 여러 정자 이온 채널의 전기 생리학적 프로파일을 설명하는 데 중요한 역할을 했으며 분자 정체성과 조절을 밝히는 데 도움이 되었습니다.
초록
포유류 유기체의 가장 작은 세포 중 하나인 정자 세포의 전기 활동을 기록하는 것은 수십 년 동안 전기생리학자들에게 어려운 작업이었습니다. "정자 패치 클램프"로 알려진 방법은 2006년에 도입되었습니다. 이를 통해 전체 세포 및 세포 부착 구성에서 이온 채널 활성을 직접 기록할 수 있었으며 정자 세포 생리학과 다양한 칼슘, 칼륨, 나트륨, 염화물 및 양성자 이온 채널의 분자 정체성을 설명하는 데 중요한 역할을 했습니다. 그러나 단일 정자에서 기록하려면 전기 생리학에 대한 고급 기술과 교육이 필요합니다. 이 상세한 프로토콜은 단계별 절차를 요약하고 정자 세포의 매혹적인 생리학을 탐구하고자 하는 모든 사람이 사용할 수 있도록 몇 가지 '거래 요령'을 강조합니다. 구체적으로 말하자면, 이 프로토콜은 인간과 쥐의 정자 세포에서 기록하는 것을 설명하지만, 기본적으로 모든 종의 모든 포유류 정자 세포에 적용할 수 있습니다. 이 프로토콜은 정자 세포의 분리, 시약 및 장비 선택, 운동성이 높은 세포의 고정화, 기록 전극과 정자 세포의 원형질막 사이의 단단한(기가옴) 밀봉 형성, 전체 정자 모드로의 전환(침입이라고도 함) 및 정자 세포 칼슘 이온 채널의 예시적인 기록과 같은 이 기술의 적용에 대한 중요한 세부 사항을 다룹니다. CatSper, 6 종의 포유류에서. 정자 패치 클램프 방법의 장점과 한계, 그리고 가장 중요한 단계에 대해 논의합니다.
서문
Erwin Neher와 Bert Sakmann1이 발명한 전통적인 패치 클램프와 유사하게 정자 세포 패치 클램프는 개별 이온 채널 활성을 조사할 수 있을 뿐만 아니라 단일 세포 내 전체 이온 채널 집단의 활성을 기록할 수 있습니다 2,3. 이 방법을 사용하면 효소 세포 내 과정의 디커플링 정도에 따라 특정 이온 채널 유형을 식별할 수 있습니다. 이 방법은 전기생리학적 및 약리학적 지문을 기반으로 이온 채널 활성을 측정하는 데 중요하므로 신뢰할 수 있는 식별 전략을 제공합니다. 이 방법의 단점은 비전기성 수송체를 감지할 수 없다는 것입니다. 또한 기본 전기생리학 교육은 프로토콜의 뉘앙스를 이해하는 데 도움이 됩니다. 패치 클램프 기술을 마스터하고 포유류 정자에 적용하려면 기본 패치 클램프 문헌 4,5를 공부하는 것이 좋습니다. 이 백서에서는 상세한 단계별 절차를 제공하고 이 기술을 쉽게 이해하고 정자 세포 전기생리학을 실습하고자 하는 모든 사람이 사용할 수 있도록 하는 고유한 방법을 강조합니다.
이온 항상성은 생리학적으로 중요한 이온 구배를 유지하고, 세포 내 칼슘을 변화시키고, 막관통 전압을 변화시키기 위해 이온 채널과 이온 수송체에 크게 의존하는 정자 세포의 필수적인 생리학적 기능입니다. 이온 채널과 이온 수송체는 운동성, 여성 생식관의 탐색, 정자 동물 성숙 및 해양 생물의 난자를 향한 화학 주성과 같은 필수 정자 세포 기능을 조절합니다 6,7,8,9,10,11,12 . 정자 운동성은 점진적으로 획득되는 과정입니다. 정자 세포는 주로 고환에서 성숙하는 동안과 결과적으로 부고환을 통과하는 동안 정지 상태입니다. 그들의 운동성은 정자 세포의 내부 산성화로 이어지는 산성 부고환 환경에 의해 억제됩니다. 이는 pH 6.0 이하에서는 기능할 수 없기 때문에 축삭의 기능을 손상시킵니다13,14. 그러나 정액 또는 알칼리성 환경에 노출되면 정자 세포 내 이온 농도와 세포질 pH가 크게 변화하고 정자가 운동성이 됩니다 15,16,17. 정자 편모의 움직임은 축삭 미세소관의 미끄러짐을 지원하는 ATP 가수분해에 의해 동력을 얻으며(18) 이 과정은 pH 의존성이 매우 높습니다14. 또한, 편모 운동은 편모 내 칼슘과 cAMP 13,19,20,21,22,23,24의 고도에 의해 제어됩니다. 이러한 요인, 즉 정자 세포 내 칼슘 농도[Ca2+]i, pH, ATP 및 cAMP는 운동성 변화를 허용하는 주요 조절 메커니즘이며 그 농도는 정자 이온 채널과 수송체에 의해 엄격하게 조절됩니다.
정자 세포는 신체의 다른 곳에서는 찾을 수 없는 많은 단백질을 발현한다는 점에서 독특합니다. 주목할만한 예로는 칼륨 채널 Slo3 25,26,27,28,29 및 Sperm, CatSper 2,30,31,32의 Cat 이온 채널과 같은 정자 이온 채널이 있습니다. 후자는 포유류 정자31의 주요 칼슘 채널이며, 세포 내 알칼리화 2,30,31,32,33,34에 의해 조절됩니다. CatSper는 또한 종 특이적 단서 7,35에 의해 조절되며 정자 편모 36,37,38을 따라 사변형 세로 나노 도메인으로 구성됩니다. 영장류에서 CatSper는 편모 알칼리성, 막 탈분극 및 프로게스테론의 조합에 의해 활성화되는 반면 쥐의 경우 CatSper 활성화 프로게스테론이 필요하지 않습니다 2,39. 이 채널의 또 다른 특징은 다중 하위 단위 조직입니다 : CatSper는 적어도 10 개의 서로 다른 하위 단위 31,32,34,37,38,42,43,44,45,46,47의 복합체입니다. 이러한 정교한 구조와 조절의 특성으로 인해 알려진 이종 발현 시스템에서 CatSper의 재조합 발현이 방해를 받았기 때문에 CatSper의 생리학적 특성화는 본래의 발현 시스템인 정자 세포로 제한되었습니다. CatSper 단백질의 분자 규명은 2000년 D. Ren 등에 의해 정액 논문에서 달성되었습니다. al.31, CatSper가 진정한 이온 채널이라는 궁극적인 증거는 2006년 정자 패치 클램프 방법이 도입된 후에만 가능했습니다2. 그 이후로 이 기술은 정자 세포 9,28,37,39,40,44,46,48-54에서 많은 이온 전도 경로를 정확하게 특성화할 수 있었습니다.
이온 채널 특성을 연구하는 고전적이고 가장 간단한 방법인 패치 클램프 기법은 정자 세포의 운동성과 특정 형태로 인해 정자 세포에 적용할 수 없는 것으로 여겨졌습니다(그림 1A). 특히, 정자 세포질과 정자 원형질막의 미세한 부피가 정자의 섬유상 수막 및 핵과 같은 단단한 세포 내 구조에 단단히 부착되는 것이 주요 과제였습니다55. 이 두 가지 구조적 특징은 원형질막에 대한 심각한 변형이나 손상 없이 난자의 보호 조끼와 같은 고점도 환경을 관통하도록 설계된 얇은 화살표 모양의 셀을 만듭니다.
패치 클램프 방법의 첫 번째 단계는 기록 피펫(유리 마이크로피펫)과 세포 원형질막 사이에 단단한 밀봉을 설정하는 것입니다. 이를 위해서는 기록 피펫 내부에 충분한 원형질막을 당겨 원형질막과 유리 사이에 기계적으로 안정적인 기가씰이 형성될 수 있도록 해야 합니다. 원형질막은 유연해야 하며 단단하지 않아야 합니다(그림 1B). 위에서 언급했듯이 정자 원형질막의 전체 표면은 세포질 방울로 알려진 영역을 제외하고는 다소 단단히 부착되어 있습니다(그림 1A 및 그림 2). 따라서 정자의 원형질막의 경직된 특성은 단단한 밀봉 또는 '기가씰'을 얻는 데 주요 장애물로 간주되었으며, 이는 좋은 녹음을 위해 >109옴이 필요하기 때문에 그렇게 명명되었습니다. 그러나 20062 년에 정자 패치 클램프 기술이 도입되면서이 장벽이 제거되었으며이 방법은 여러 포유류 종의 정자 세포에 성공적으로 적용될 수 있습니다 2,41,51,56. 이 돌파구는 정자의 중간 부분을 따라 발견되는 작은 구조인 세포질 방울(CD)2,8에 초점을 맞춤으로써 달성되었으며(그림 1A 및 그림 2), 단순히 머리와 꼬리가 발달하는 정자 세포 전구체인 길쭉한 정자의 잔해입니다. 기능적으로, 그것은 세포가 사정 중 세포 외 삼투압의 변화에 적응하는 데 도움이 될 수 있습니다. 중요한 특징은 CD 내의 원형질막이 기가옴 밀봉을 형성하기 위해 피펫으로 유입될 수 있을 만큼 충분히 유연하다는 것입니다. 따라서, 정자 CD는 정자 표면에서 가장 좋은 부분으로, 이를 통해 성공적인 기가씰(gigaseal) 형성을 달성하고 궁극적으로 정자 세포를 패치 클램프 증폭기(patch-clamp amplifier) 2,8에 전기적으로 결합하는 전체 세포 모드(whole-cell mode)로 전이할 수 있습니다. 이전 간행물에서는 정자 머리에서 성공적인 기가씰(gigaseal) 형성이 보고되었으며, 이를 통해 세포 부착 구성 54,57,58,59로 기록할 수 있다고 보고했습니다. 그러나, 전체 셀 구성에서의 기록은 지금까지 CD 영역에서 기가씰 형성을 수행함으로써만 보고되었습니다. 이 전체 세포 모드는 정자 세포의 전체 부피에 전기적 접근을 허용하므로 정자 머리뿐만 아니라 정자 편모에 위치한 이온 채널 활동을 감지할 수 있습니다. 개발 이후 불과 몇 년 동안 정자 패치 클램프 기술은 정자 이온 채널에 대한 우리의 이해에 엄청난 진전을 이루었으며 지금까지 정자 이온 채널의 기능을 직접 조사하는 가장 강력한 기술 중 하나입니다 9,28,37,39,40,44,46,48,49, 50,51,52,53 (그림 1).
정자 패치 클램프는 아래에 설명된 대로 고전적인 패치 클램프 기술과 일부 세부 사항이 다릅니다. 첫째, 대부분의 정자 원형질막은 단단한 세포 내 구조에 단단히 부착되어 있기 때문에 정자는 피펫으로 빨아들일 수 있는 "여분" 원형질막이 거의 없습니다. 유연한 유일한 영역은 많은 체세포의 원형질막과 유사한 CD의 막이므로 피펫으로 쉽게 빨려 들어갈 수 있습니다. CD와 함께 기가옴 밀봉을 형성하기 위해 정자 원형질막의 작은 부분을 마이크로피펫 끝으로 끌어들이기 위해 파이펫 상단에서 광 흡입에 의해 음압이 생성됩니다(그림 1B). 멤브레인의 이 부분은 피펫 끝으로 Ω 모양의 침입을 형성하고 내부 벽과 단단한 밀봉을 형성합니다.
둘째, 인간과 쥐의 정자에서 세포질 방울은 1 - 2 μm 사이입니다(그림 1 및 그림 2). 따라서 이러한 작은 물체에 패치 클램프 기술을 적용하려면 고해상도 광학 장치가 필요합니다. 대부분의 정자 패치 클램프 리그에는 미분 간섭 대비(DIC) 또는 Nomarski 광학 구성 요소가 있는 도립 현미경이 장착되어 있습니다(그림 2 및 그림 3). DIC에서 볼 수 있는 공간 정보가 작은 CD에 패치 피펫을 배치하는 데 탁월한 정밀도를 달성하는 데 도움이 되기 때문에 정자 패치 클램프에 DIC 광학 장치가 장착된 현미경을 사용하는 것이 기존의 위상차 광학 장치보다 적극 권장됩니다. 또한 개구수가 1.2인 60x 침수 대물렌즈 또는 이와 유사한 렌즈를 사용하는 것이 좋습니다. 이 대물렌즈는 작동 거리(0.28mm)가 길어 용액 내에서 자유롭게 헤엄치는 정자 세포를 관찰할 수 있습니다(그림 2). 대물렌즈에는 커버 슬립의 두께에 맞게 조정할 수 있는 조정 칼라도 있습니다(0.13mm에서 0.21mm까지 가변). 긴 작동 거리와 조정 칼라의 이러한 조합으로 두 개의 0.13mm 커버 슬립을 통해 관찰할 수 있습니다. 하나의 커버 슬립은 기록실의 유리 바닥 역할을 하고, 침전된 정자 세포가 있는 5mm 커버슬립은 상단에 배치됩니다. 아래에서 논의된 바와 같이, 기록실의 바닥에 직접 복사하는 것보다 쉽게 교환할 수 있는 원형 5mm 커버슬립에 정자 세포를 증착하는 것은 새로운 정자 세포를 기록 챔버에 로드하는 편리한 방법입니다.
셋째, 정자 패치 클램프 리그에는 저잡음 패치 클램프 증폭기와 디지타이저가 장착되어 미세한(피코암페어 범위) 전류와 막 전위의 미세한 변화를 기록해야 합니다. 이 장비는 가장 낮은 증폭기 소음을 보장해야 합니다. 진동이 없는 것은 성공적인 패치 클램프 기록의 필수적인 부분입니다. 정자 패치 클램핑에는 독립적인 미세 매니퓰레이터 스탠드보다 더 나은 안정성을 보장하기 위해 마이크로 매니퓰레이터 플랫폼이 있는 도립 현미경에 부착할 수 있는 드리프트가 없는 정밀 미세 매니퓰레이터가 필요합니다(그림 3A). 설정을 테스트하려면 사람이 진동 차단 테이블 근처의 바닥에서 위아래로 점프할 때에도 피펫 팁의 움직임(60배 배율 미만)을 볼 수 없어야 합니다.
프로토콜
모든 실험은 동물 연구에 대한 NIH 지침에 따라 수행되었으며 UC 버클리 동물 관리 및 사용 위원회(AUP 2015-07-7742)의 승인을 받았으며 동물의 고통을 최소화하기 위해 모든 노력을 기울였습니다. 설명된 모든 방법은 미국 수의학 협회 및 IACUC 위원회의 안락사에 관한 패널의 권장 사항과 일치합니다. 인간 유래 샘플을 활용한 모든 실험 절차는 University of California, Berkeley의 인간 연구 위원회(Committee on Human Research, IRB 프로토콜 번호 2013-06-5395)의 승인을 받았습니다.
1. 전체 세포 정자 패치 클램프 기록을 위한 유리 마이크로피펫 만들기.
참고: 세포질 방울의 크기가 작기 때문에 팁이 미세한 유리 마이크로피펫이 필요합니다.
- 마이크로피펫 제작의 경우 외경이 1.5mm, 내경이 0.86mm이고 내부 필라멘트가 있는 붕규산 유리 모세관으로 시작합니다. 마이크로피펫 풀러의 팁을 당깁니다(그림 3B).
- 피펫 팁의 모양과 연마를 위해 잠시 동안 팁에 가까운 곳에 핫 와이어를 배치하십시오. 피펫 폴리셔를 사용하여 100배 배율로 이 파이어폴리싱 프로세스를 수행합니다(그림 3C, D).
- 피펫 팁의 내경이 화재 연마 전에 ~2 μm이고 적절한 연마 후 ~0.5 μm로 감소하는지 확인하십시오.
참고: 기록 당일에 만든 갓 뽑은 피펫만 사용하는 것이 좋습니다. 이렇게 하면 피펫 팁에 먼지 입자가 쌓이는 것을 방지할 수 있습니다.
2. 리그 설정
- 녹음실의 조립
- 층류 흐름과 상대적으로 빠른 용액 교환 속도를 가진 저용량 다이아몬드 모양의 관류 챔버를 사용합니다(그림 4). 매니폴드를 통해 챔버를 중력 공급 관류 시스템에 연결합니다(그림 5).
- 기록 챔버를 통해 용액을 관류하려면 관류 챔버를 8개의 개별 관류 라인에 연결하는 폴리테트라플루오로에틸렌 매니폴드를 사용하여 간단한 자체 제작 중력 공급 관류 시스템을 조립합니다.
참고: 튜브는 가소제를 용액에 침출시켜서는 안 되는데, 이러한 화학 물질은 정자 세포(60)의 정상적인 기능에 상당한 영향을 미치고 이온 채널 활성을 변경할 수 있기 때문입니다(61,62). 작은 직경의 폴리테트라플루오로에틸렌 튜빙은 주요 관류 튜빙으로 적극 권장됩니다. - 폴리테트라플루오로에틸렌 튜빙은 다소 뻣뻣하므로 폴리테트라플루오로에틸렌 튜빙 위에 맞는 고순도 실리콘 튜빙으로 유연하게 연결하십시오. 또한 미네랄 오일 또는 기타 윤활 첨가제가 이온 채널 기록을 방해할 수 있으므로 윤활제가 없는 주사기(예: Luer Lock 주사기 유형)를 사용하십시오(그림 5).
- 한천 다리 조립
- 기록 중 액체 접합 전위 변화를 방지하려면 한천 브리지를 사용하여 기준 전극 주변 환경을 안정적으로 유지하십시오(그림 4).
- 한천 다리를 만들려면 작은 분젠 버너 불에서 구부려 L 자형 유리 모세관을 만들고 식히십시오.
- 1M KCl에 1% 아가로스 용액을 만들고 아가로스가 녹고 용액이 투명해질 때까지 전자레인지에서 가열합니다. 기포를 피하기 위해 L자형 유리 모세관에 위의 용액을 조심스럽게 채우고 실온으로 식히십시오. 한천 브리지는 +4 °C에서 ~2개월 동안 1M KCl에 보관할 수 있습니다.
- 한천 브리지를 사용하려면 Ag/AgCl 펠릿 기준 전극에 1M KCl을 채우고 유리 모세관에서 응고된 아가로스가 튀어나오지 않도록 한천 브리지를 조심스럽게 삽입합니다.
- 다음으로, 증폭기 헤드의 금색 핀(2mm)을 삽입합니다.tage 와이어를 기준 전극 2mm(금색) 슬롯에 삽입하고 그림 4와 같이 L자형 한천 브리지의 끝을 관류 챔버에 삽입합니다.
- 해결책과 조리법
알림: 모든 시약과 화학 물질은 순도가 가장 높아야 합니다. 모든 준비된 용액은 멸균 0.22μm PES 필터를 통해 여과되고 최대 1개월 동안 4°C에서 보관됩니다. 삼투압의 정확한 조정은 성공적인 패치 클램핑을 위한 전제 조건이라는 점에 유의해야 합니다.- 표 1에 설명된 대로 HTF(Human Tubular Fluid) 용액을 준비합니다. NaOH로 pH를 7.4로 조정합니다. 삼투압은 증기압 삼투압계를 사용하여 측정한 280 ± 5mOsm이어야 합니다.
- 표 2와 같이 고염수(HS) "bath" 또는 "extracellular" 용액을 준비합니다. NaOH로 pH를 7.4로 조정합니다. 삼투압은 320 ± 5mOsm이어야 합니다.
- 표 3에 설명된 대로 세슘 메탄설포네이트 "수조" 또는 "세포외" 용액을 준비합니다. CsOH로 pH를 7.4로 조정하고 삼투압을 320 ± 5mOsm으로 조정합니다.
- 세슘 메탄설포네이트(CsMeSO3) 세포 내 "피펫" 용액을 준비하려면 표 4 를 따르고 CsOH로 pH를 7.4로 조정합니다. 삼투압은 HS 솔루션보다 최대 10mOsm 높아야 합니다.
3. 포유류 정자의 분리 및 정화
참고: 3-6개월 된 C57BL/6 수컷 마우스를 CO2 흡입 후 경부 탈구로 안락사시킵니다. 경추 탈구 후 즉시 마우스에서 조직 채취(꼬리 또는 말뭉치 부고환)를 수행합니다.
- 부고환 마우스 정자동물의 분리
참고: 3-6개월 된 C57BL/6 수컷 마우스를 CO2 흡입 후 경부 탈구로 안락사시킵니다. 경추 탈구 후 즉시 마우스에서 조직 채취(꼬리 또는 말뭉치 부고환)를 수행합니다.- 마우스의 하복부를 가위로 열고 두 부고환을 모두 추출합니다.
- HS 용액(고염수, 표 2 참조)으로 채워진 35mm 세포 배양 접시에 놓습니다. HS 용액의 분취액이 정자 세포와 접촉하기 전에 실온으로 예열되었는지 확인하십시오.
- 부고환을 HS 용액이 함유된 새로운 세포 배양 접시에 옮기고 모든 잔여 지방을 철저히 제거합니다.
- #15 메스 블레이드를 사용하여 부고환을 caput, corpus 및 cauda로 분리합니다(그림 6).
- 각 부고환의 말뭉치(또는 필요한 경우 꼬리뼈)를 HS 용액을 포함하는 새로운 세포 배양 접시로 옮깁니다. 뾰족한 #11 메스 날을 사용하여 부고환의 분리된 부분을 여러 번 절개합니다.
- 여러 번 절개된 부고환 부분을 1.5mL HS 용액이 들어 있는 1.5mL 마이크로 원심분리 튜브로 옮깁니다.
- 부고환의 정자 세포를 초극세 Dumont type 5a 겸자를 사용하여 용액으로 짧게 흔듭니다. 부고환은 버리고 튜브를 실온에서 10분 동안 그대로 둡니다.
- 고형물(비정자 세포)이 튜브 바닥으로 침전될 때까지 기다린 다음 상등액을 다른 1.5mL 마이크로 원심분리 튜브로 옮깁니다.
- 정자 혼합물을 최대 2시간 동안 공기에 접근할 수 있는 실온에 보관하며, 이 시간 동안 실험을 수행할 수 있습니다. 분리된 정자는 분리 후 3시간이 지나면 기능을 잃습니다.
- mouse spermatozoa의 용량
참고: 모든 부고환 정자는 패치 클램프에 적합하지만 꼬리 부고환의 정자만이 수정 능력이 있을 만큼 충분히 성숙합니다. 꼬리 정자는 capacitation을 겪을 수 있으므로 꼬리 정자 세포를 사용하여 실험, 특히 정자 capacitation을 수행합니다.- 꼬리 또는 사정된 정자에 정자 채취를 수행합니다(3.1.1-4단계 참조).
- 3.1.4 단계에서 설명한대로 꼬리를 분리하십시오. 3.1.5 단계에 설명 된대로 여러 절개를 적용하십시오. 카우다에를 2mL의 용량 용액이 있는 10mm 세포 배양 접시에 옮깁니다.
- 이 용량 용액에서 꼬리 조직을 처음에는 37 ° C 및 5 % CO2에서 10 분 동안 배양 한 다음 조직을 버리고 방출 된 정자 세포를 다시 50-80 분 동안 배양합니다.
참고: 마우스 꼬리 정자의 체외 용량화는 60-90분 배양으로 이루어집니다. 용량이 있는 정자 세포는 과활성화(hyperactivation)로 알려진 편모의 과도한 비대칭 굽힘을 기반으로 시각적으로 식별됩니다. 이러한 유형의 운동성은 정자가 비선형 방식으로 수영할 수 있도록 합니다.
- 인간 정자의 수집 및 정제
참고: 이 경우, 21-38세의 총 21명의 건강한 지원자와 정자로부터 신선한 정액 샘플을 얻었으며,48,63에 자세히 설명된 바와 같이 실온 수영 기술로 정제된 정자를 얻었습니다. 간단히 말해서 절차는 다음과 같습니다.- 정제하기 전에 액화가 가능하도록 인체 사정 샘플을 실온에서 60분 동안 그대로 둡니다(더 오래 지속되면 정자의 질에 부정적인 영향을 미칠 수 있음).
- 50mL 원심분리 튜브에서 약 7mL의 HTF 용액을 37°C로 예열합니다. 사정의 부피를 육안으로 평가합니다 - 부피가 1mL보다 크면 HTF 용액의 여러 튜브를 준비합니다.
- 정액 가닥을 완충액 표면으로 들어 올리지 않고 각 튜브의 바닥에 액화 사정 1mL를 조심스럽게 밑에 깔아줍니다. 정액-HTF- 인터페이스는 가능한 한 명확해야 합니다. 기포를 피하십시오.
- 튜브를 37°C 인큐베이터에 1시간 동안 놓고 최대 표면적을 위해 45° 각도로 튜브를 고정합니다. 인큐베이터가 CO2 인큐베이터인 경우 버퍼의 산성화를 방지하기 위해 캡을 단단히 닫으십시오(이 절차에는 CO2 가 필요하지 않음). 배양 중에 운동성 정자는 점차적으로 HTF 완충액의 표면을 향해 헤엄칠 것입니다.
- 1시간 후 15mL 원심분리 튜브의 모든 샘플에서 최상부 1mL 분획을 수집하여 패치 클램핑을 위해 최고 품질의 운동성이 높은 정자를 결합합니다. 오염을 방지하기 위해 정액 혈장 위에 남아 있는 몇 mL의 HTF를 모두 제거하려고 시도하지 마십시오. 정제된 세포 현탁액은 실온에서 몇 시간 동안 보관할 수 있습니다.
참고: 정상적인 사정은 mL64당 최소 15 x 106개의 정자 세포를 포함해야 하지만 정자 수는 샘플마다 크게 다릅니다. 낮은 세포 수라는 장애물은 패치 클램핑 전에 정제된 정자 현탁액을 실온에서 30-60분 동안 방치함으로써 극복할 수 있습니다. 이 조건에서 세포는 원심분리 튜브의 바닥에 점차적으로 축적되어 세포를 기록 챔버로 피펫팅할 수 있는 눈에 보이는 세포 구름을 형성합니다(아래 참조).
- 인간 정자의 용량
참고 : 인간 정자의 시험관 내 용량화는 용량 용액에서 4 시간 배양으로 수행 할 수 있습니다 : 20 % 소 태아 혈청, HTF 또는 HS 완충액48,51에서 25mM NaHCO3. 용량화된 정자 세포는 활발한 운동성과 편모의 과도한 비대칭 굽힘을 기반으로 시각적으로 식별할 수 있으며, 이를 통해 정자가 비선형 방식으로 헤엄칠 수 있습니다.- 2x capacitation 용액을 준비하고 정자 현탁액과 1:1로 혼합합니다.
- 37°C 및 5% CO2에서 최소 4시간 동안 배양을 수행합니다. 용량이 있는 세포의 높은 비율을 보장하려면 배양 시간이 4시간 이상이어야 합니다.
4. 코팅 용액 준비 (인간 정자 패치 클램프에만 필요)
참고: 필수 단계는 침입하기 전에 커버슬립에서 부착된 정자를 들어 올리는 것입니다. 이 단계는 인간 정자 세포에만 필요하며 접착력이 적은 유리 표면을 만들기 위해 유리 커버슬립을 코팅해야 합니다. 커버슬립 코팅은 정자 세포가 커버슬립에 달라붙을 확률을 줄이고 성공적인 기가씰 형성 후 유리 커버슬립에서 인간 정자를 들어 올릴 수 있도록 합니다.
- 15mL 원심분리 튜브에 5mL의 HS 용액으로 사정액 200μL를 희석합니다.
- 300 x g 에서 5분 동안 스핀다운하고 상층액을 제거합니다.
- 펠릿을 1mL의 HS 용액에 재현탁시키고 마이크로 원심분리 튜브로 옮깁니다.
- 물이 채워진 초음파 처리 수조를 사용하여 25°C에서 10분 동안 초음파 처리합니다.
- 10,000 x g 에서 5분 동안 스핀다운합니다.
- 상층액을 새 마이크로 원심분리기 튜브에 옮기고 코팅에 사용합니다(아래 지침 참조).
5. 전체 정자 원형질막에서 이온 전도도를 기록합니다.
- 커버슬립에 정자를 부착합니다.
참고: 패치 클램프 기록 전에 정자는 5mm 원형 커버 슬립에 도금됩니다.- 인간 세포로 작업하는 경우 날카로운 집게를 사용하여 준비된 코팅 용액에 커버슬립을 잠시 담그십시오.
- 4웰 플레이트의 단일 웰에 4개의 커버 슬립을 놓고 300μL의 HS 용액으로 덮습니다. 커버 슬립을 4웰 플레이트의 바닥에 테이프로 붙이고 피펫터의 플라스틱 팁으로 밀어 커버 슬립이 뜨는 것을 방지합니다.
- 인간(3.3.5단계) 또는 마우스 정자동물(3.1.9단계)의 농축된 현탁액을 커버슬립 위의 HS 용액 300μL에 저장 튜브(20-50μL)에서 부드럽게 재현탁합니다.
- 정자가 우물 바닥에 축적되어 머리가 커버 슬립에 부착되고 편모가 커버 슬립 바로 위의 용액에서 격렬하게 박동하는지 확인하십시오. 기록하기 전에 정자가 실온에서 약 10분 동안 커버슬립에 침전되도록 하는 것이 중요합니다.
참고: 인간 정자가 제대로 부착되지 않으면 5.1.1단계로 돌아가서 준비된 코팅 용액을 HS 용액(1:20에서 최대 1:2)으로 희석합니다. 이 단계는 인간 정자 제제에서 흔히 볼 수 있는 다양한 정자 운동성에 따라 다양한 인간 기증자의 정자 샘플에 맞게 조정해야 합니다.
- 커버 슬립 배치
- 웰에서 세포가 약간 부착된 커버슬립 하나를 취하여 HS 용액이 들어 있는 기록 챔버의 다이아몬드 모양 웰에 넣습니다(그림 4).
- HS 용액으로 채워진 관류 시스템(그림 5)을 켜서 챔버를 헹구고 챔버에서 파편과 과도하게 분리된 정자를 제거합니다. 이렇게 하면 기록 피펫이 세포에 도달할 때 깨끗하게 유지될 확률이 높아집니다. 이 단계는 커버슬립에 더 강하게 달라붙는 경향이 있는 비용량 세포로 작업할 때 유용합니다.
참고: 용량이 있는 정자에서 녹음하는 경우, 새로운 커버 슬립을 챔버에 넣은 직후 관류를 켜는 것을 피해야 합니다. 용량성 정자는 활발한 운동성을 가지고 있으며 커버슬립에 느슨하게만 부착됩니다. 따라서 최대한의 용량화된 정자를 사용할 수 있도록 하려면 관류를 켜기 전에 ~10분을 기다렸다가 용량성 정자가 커버슬립에 부착되도록 하는 것이 중요합니다. 적절한 용량성 셀이 선택되고 기가씰이 형성되면 관류를 다시 켤 수 있습니다.
- patch-clamp 기록을 위한 정자 세포 선택.
- 600배 배율을 사용하여 세포질 방울이 있는 적합한 정자 세포를 찾습니다(아래 참조). 이것은 10배 배율 접안렌즈를 사용하는 방법에 설명된 대로 60x 침수 렌즈를 사용하여 수행됩니다. 말뭉치 부고환에서 분리된 정자 세포에서 CD는 일반적으로 중간 조각의 중심 가까이에 위치합니다. 꼬리 세포에서 CD는 일반적으로 고리 근처에서 발견될 수 있습니다(그림 2C). 인간 정자의 경우, CD는 목 부위에 위치합니다(그림 2A,B).
참고: 또한 현미경의 풀아웃 1.6배 배율 옵션을 사용하여 정자 형태를 면밀히 검사할 수 있습니다(배율 960x). - 세포질 액적이 타원형이고 약간 길쭉한(그림 2G) 방추형 모양인지 확인합니다. 매우 둥글고 확대되어 보이는 CD는 손상되기 쉬워 패치에 적합하지 않은 경우가 많습니다(그림 2D,F).
- 머리가 커버슬립에 부착되어 운동성이 있는 정자를 선택하여 정자 세포는 부분적으로 고정되어 있지만 CD와 편모의 나머지 부분은 편모 박동으로 계속 움직입니다. 정자의 머리가 커버슬립에 느슨하게 부착되어 편모가 좌우로 움직일 때 약간 회전하도록 합니다.
참고: 기가옴 씰(gigaohm seal)이 형성된 후 전체 세포 모드로 전환하기 전에 정자를 커버슬립에서 용액으로 들어 올려야 하기 때문에 느슨한 부착이 중요합니다.
- 600배 배율을 사용하여 세포질 방울이 있는 적합한 정자 세포를 찾습니다(아래 참조). 이것은 10배 배율 접안렌즈를 사용하는 방법에 설명된 대로 60x 침수 렌즈를 사용하여 수행됩니다. 말뭉치 부고환에서 분리된 정자 세포에서 CD는 일반적으로 중간 조각의 중심 가까이에 위치합니다. 꼬리 세포에서 CD는 일반적으로 고리 근처에서 발견될 수 있습니다(그림 2C). 인간 정자의 경우, CD는 목 부위에 위치합니다(그림 2A,B).
- 기가씰(gigaseal) 형성
참고: 전체 셀 모드에서 1가 CatSper 전류를 기록하기 위해 피펫은 Cs-메탄설포네이트(피펫 또는 세포 내라고도 함) 용액으로 채워지며(표 4) - 이는 0mV에서 10mV의 전압 단계를 적용할 때 증폭기에 의해 자동으로 계산되는 11-17MΩ(그림 7A)의 피펫 저항을 생성합니다. 피펫은 Application에 따라 다른 용액으로 충진할 수도 있습니다. 피펫 저항을 줄이기 위해 메탄설포네이트, Cl- , 아스파르테이트 또는 이와 유사한 이온과 같은 이동식 음이온으로 용액을 만드는 것이 좋습니다. 피펫 용액의 삼투압은 수조 용액보다 최대 10mOsm 높아야 합니다. 피펫 용액의 약간 더 높은 긴장도는 패치 클램프 기록 중에 정자 세포로의 접근 저항을 가능한 한 낮게 유지하는 데 도움이 됩니다.- 적절한 형태를 가진 정자 세포를 육안으로 선택한 후(그림 2G), 마이크로피펫에 피펫 용액(표 4)을 채우고 피펫 홀더에 고정합니다.
- 피펫 팁을 이물질로부터 깨끗하게 유지하려면 U-튜브 모양의 어셈블리를 사용하여 피펫에 양압을 가하여 피펫 용액이 아래에서 "수조" 용액이라고도 하는 세포 외 용액에 잠긴 후 팁에서 흘러나오도록 합니다( 표 2 참조).
참고: 조건이 허락하는 경우, 가장 깨끗한 피펫 팁을 보장하므로 지속적인 관류 상태에서 씰을 형성하는 것이 좋습니다. - 피펫을 아래로 내리고 팁을 수조 용액에 담그십시오(표 2). 이때 피펫 저항을 측정할 수 있습니다(그림 7A).
- 세포를 명확하게 시각화하려면 팁 개구부가 CD를 향해 대각선으로(약 45°) 정렬되도록 피펫 팁을 CD 위에 놓습니다.
- 피펫의 끝을 CD 쪽으로 빠르게 내려 CD의 몇 μm 이내의 동일한 초점면에 있게 합니다.
- 피펫의 끝이 CD에 닿자마자 "마우스피스"를 사용하여 피펫에 음압을 가하여 액적의 일부를 팁으로 이동하고 전기생리학에서 "흡입 이벤트"라고도 하는 기가옴 밀봉을 형성합니다. 일반적으로 피펫 팁과 처음 접촉한 후 피펫의 음압을 최대 1분까지 유지하여 점차적으로 기가옴 밀봉을 달성할 수 있습니다.
- 기가옴 씰(> 4-20GΩ)이 성공적으로 형성된 후 커버슬립에서 정자를 들어 올립니다(그림 7B).
참고: 설치류 정자 세포에는 길이 때문에 이 단계가 필요하지 않습니다. 그러나 정자 편모의 부분적 박리는 잠재적인 피펫 드리프트를 완화하는 데 도움이 됩니다. 인간의 정자 분리는 CD가 작기 때문에(1~3μm) 필수적인 단계입니다. 세포가 커버슬립에 부착된 상태로 남아 있는 경우 실험 중 피펫이 조금만 움직여도 CD가 중단될 수 있습니다. 정자가 들어올려진 후에도 편모는 일반적으로 계속 박동하는 반면 세포는 마이크로피펫에만 붙어 있습니다.
- 침입 및 전체 셀 모드로 전환.
- 전체 셀 모드로 전환하기 전에 증폭기의 보상 모드를 사용하여 표유 정전 용량 과도 상태를 보상합니다(그림 7B). 커패시턴스 과도 현상을 초기에 관찰하려면 멤브레인 전위를 0mV로 유지하고 "멤브레인 테스트" 도구를 사용하여 10mV 펄스를 적용합니다(그림 7B).
- 매우 가벼운 흡입과 결합된 짧은(1ms) 점차적으로 증가하는(430-650mV, ~50mV 증가) 전압 펄스를 적용하여 길들이기 및 전체 셀 모드로 전환합니다(그림 7C).
알림: 길들이기 펄스를 적용하려면 패치 cl 내에서 이전에 프로그래밍된 길들이기 프로토콜을 사용하십시오.amp 소프트웨어. 길들이기 전압 펄스는 증폭기 뒷면의 고전압 명령 입력(후면 전환)을 사용하여 정자에 적용됩니다. - 각 길단 전압 펄스를 적용한 후 멤브레인 테스트 도구를 시작하여 더 큰 커패시턴스 과도 현상이 나타나는지 확인합니다.
참고: 큰 정전용량 과도 현상(그림 7C)이 존재한다는 것은 침입이 발생했으며 세포의 전체 정전 용량이 측정되고 있음을 나타냅니다(인간 정자의 경우 ~1pF, 쥐 정자의 경우 ~2.5pF 이상). - Membrane Test Tool을 사용하여 큰 커패시턴스 과도 현상을 장착하여 전체 셀의 커패시턴스와 액세스 저항을 결정합니다.
참고: 접근 저항은 마이크로피펫 용액으로 정자 세포 내부를 효율적으로 관류하고 정자 원형질막의 안정적인 전압 클램프를 위해 가능한 한 낮아야 합니다. 접근 저항은 일반적으로 Cs+ /K+ - 및 NMDG- 기반 세포 내 솔루션에 대해 각각 25-30MΩ 및 50-70MΩ입니다. - 성공적인 침입 후 다양한 화합물을 포함하는 다양한 수조 용액(그림 8)을 적용하거나 전압 단계(그림 8, 그림 9) 또는 전압 램프 프로토콜을 사용하여 채널 활성을 측정하는 등 계획된 전체 세포 패치 클램프 실험을 진행합니다. 침입에 실패한 경우 6.4.1 단계로 돌아갑니다. 새로운 마이크로피펫을 선택하고 다른 적절한 정자 세포를 선택합니다.
결과
정자 패치 클램프 방법을 사용하면 CatSper 채널을 직접 기록할 수 있습니다.
위에서 언급한 바와 같이, CatSper 기록은 세포질 방울에서 패치 피펫과 포유류 정자 사이에 고저항(기가옴) 밀봉을 설정하여 수행되었습니다. 침입하여 전체 세포 모드로 전환하면 정자 머리와 편모를 포함한 정자 세포의 몸 전체와 내부에 대한 완전한 전기적 접근이 얻어집니다 2,8,39,51. 이 상태는 궁극적으로 정자 원형질막에 위치한 모든 활성 이온 채널에서 기록을 가능하게 합니다. 세슘 또는 나트륨을 주요 투과 이온으로 포함하는 수조 공칭 2가 없음(DVF) 용액은 1가 CatSper 전류 2,8,39,51을 기록하는 데 바람직합니다. CatSper 채널은 Ca2+ 및 Ba2+와 같은 2가 이온을 전도하지만 훨씬 느린 속도로 CatSper 공극을 통해 이동하므로 몇 피코 암페어 (~ 10-20 pA)의 전도도를 거의 감지 할 수 없습니다 2 , 8 , 39 , 51. 따라서 CatSper 채널을 통해 1가 전류, 따라서 더 큰 전류를 측정하는 것이 전류를 평가하는 더 편리한 방법입니다(그림 8). CatSper는 칼륨도 투과성이 있다는 점에 유의하는 것이 중요합니다. 따라서 CatSper 채널을 차단하거나 정자 세포 칼륨 채널 만 연구하려는 상황에서 CatSper 결핍 정자 세포를 사용해야합니다 2,3,8,28,65. 피펫과 수조 용액의 이온 조성을 변화시킴으로써, 특정 이온 채널을 선택적으로 제외할 수 있으며, 특정 이온 채널 유형에서만 선택적으로 기록하기 위한 조건을 생성할 수 있습니다. 예를 들어, 피펫 용액에 Cs+를 첨가하면 정자 칼륨 채널을 통한 이온 투과성이 차단됩니다.
CatSper 채널은 포유류 종에 따라 다르게 조절됩니다.
서로 다른 종의 정자 세포는 형태와 내부 조절 경로가 다양하다66. 그들의 이온 채널이 남성과 여성의 생식관의 전문화된 미세환경을 반영하는 방식으로 독특하게 조절된다는 것은 놀라운 일이 아닙니다. 정자 패치 클램프 방법은 그림 9와 같이 murine2, rat56, human39,51, bovine, boar, macaque41 등 6종의 포유류에 성공적으로 적용되었습니다. 이러한 실험을 위해 다 자란 수컷 붉은털원숭이[Macaca mulatta]의 정자 세포를 캘리포니아 국립 영장류 연구 센터(California National Primate Research Center)에서 얻어냈으며, 이는 캘리포니아 대학교 데이비스(University of California, Davis)가 승인한 동물 프로토콜에 따라 AAALAC(Association for Assessment and Accreditation of Laboratory Animal Care International)의 기준에 따라 이루어졌습니다.; 모든 연구는 미국 국립보건원(National Institutes of Health)의 실험실 동물 관리 및 사용에 대한 가이드(U.S. National Institutes of Health Guide for the Care and Use of Laboratory Animals)에 따라 수행되었습니다. 황소와 멧돼지 정액은 UCD 동물과학부 시설에서 특정 IACUC 승인을 받지 않은 부산물로 획득되었으며 모든 동물은 AAALAC 승인 시설에서 사육되었습니다. 황소와 멧돼지 정액은 상업적인 출처에서도 얻을 수 있습니다.
영장류(Rhesus macaque)와 인간 정자는 유사한 CatSper 채널 특성과 조절을 보여주었습니다. 흥미롭게도, CatSper의 프로게스테론 활성화는 수퇘지, 황소, 설치류 정자가 CatSper 전류의 프로게스테론 자극 변화를 나타내지 않았기 때문에 영장류 정자에만 고유한 것으로 보입니다(그림 9 및 41). 황소와 멧돼지 정자에서는 기저 CatSper 채널 활동조차도 검출 가능한 한계 미만이었으며(그림 9), 이는 이러한 종에서 칼슘 유입 및 그에 따른 과잉 활성화가 다른 채널/수송체에 의해 주도되거나 CatSper 채널의 활성화를 위해 다른 자연 자극제가 필요함을 시사합니다. 황소 및 멧돼지 정자 세포를 포함하여 여기에 언급된 모든 정자 종에서 정자 세포의 내부에 대한 완전한 전기적 접근이 얻어졌으며 침입 시 큰 정전 용량 아티팩트의 출현에서 알 수 있듯이 세포는 전체 세포 모드에서 기록되었습니다(그림 7). 이 상태는 기능적인 CatSper 채널을 쉽게 기록할 수 있으며, 멧돼지 및 소 정자동물이 없다는 것은 이 채널이 이들 종의 정자 세포에 존재하는 아직 알려지지 않은 내인성 억제제에 의해 차단되었거나 특정 조절제가 활성화되어야 함을 나타냅니다. 그러나 이는 예비 실험이며 수퇘지 및 황소 정자 세포에 대한 추가 실험이 이러한 종에서 CatSper 채널의 기능적 중요성을 보장하기 위해 필요할 것입니다. 종 간의 이러한 광범위한 정자 이온 채널 다양성은 정자 대 난자 크기 비율, 정자 크기와 난자 보호 의복 사이의 관계와 관련이 있거나 다른 종에 의한 수정을 막는 장벽으로 작용할 수 있습니다66.

그림 1: 포유류 정자의 형태학적 다양성.(A) 하단 패널: 정자의 개략적 표현; 세포 구획에는 레이블이 표시되어 있습니다. 상단 패널: 시계 방향으로 다른 종의 정자의 DIC 이미지: 쥐(Rn; Rattus norvegicus); 마우스(mm; Mus musculus); 황소 (Bt; 보스 황소 자리); 멧돼지 (Sd; sus scrofa domesticus); 인간(Hs; 호모 사피엔스), 붉은털 원숭이(Mmu; Macaca mulatta)에 있습니다. 배율 막대는 모든 DIC 이미지에 적용됩니다. 삽입물은 세포질 방울을 나타냅니다. (B) 포유류 정자 세포의 패치. 피펫 팁과 원형질막 사이에 성공적인 밀봉 형성을 달성하기 위해 원형질막의 일부를 피펫 팁으로 부드럽게 흡입합니다. 전체 세포 모드로의 전환은 팁과 세포 사이의 원형질막을 파열하여 수행됩니다(이 그림은8에서 재현됨). 오른쪽 패널: 기록 마이크로피펫에 부착된 인간 정자 세포. (C) 패치 클램프 방법으로 인간 정자 세포에서 연구된 인간 정자 및 일부 편모 이온 채널과 이들이 수행하는 이온의 개략적인 표현. CatSper- 칼슘 이온 채널 39,51; Hv1- 양성자 채널 51,56,67; Slo3 / Slo1- 칼륨 채널 50,53,65,68; TRPV4- 일시적인 수용체 전위 양이온 채널 바닐로이드 유형 448. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
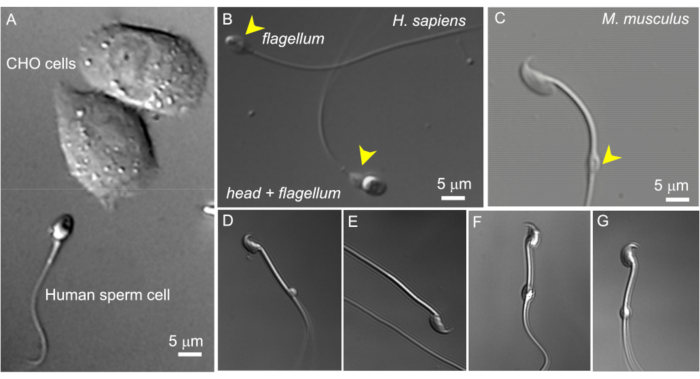
그림 2: 세포질 방울의 정자 크기 및 다양한 형태. 손상되지 않은 살아있는 정자 세포의 DIC 이미지. (A) 인간 정자 세포(아래)와 두 개의 CHO 세포(위)의 크기 비교. (B) 온전한 인간(Homo sapiens), 정자(아래) 및 머리가 없는 정자 세포(편모, 위). 세포질 방울은 노란색 화살촉으로 표시됩니다. 이 그림은8에서 재현되었습니다. (C) 노란색 화살촉으로 표시된 정상적인 모양의 세포질 방울(CD)이 있는 온전한 쥐(Mus musculus) 정자. (민주당) 부고환 쥐 정자 세포는 다양한 크기와 모양의 세포질 방울을 가지고 있습니다. (C)와 (G)만 패치 클램프에 적합합니다. (D) CD는 미세하고 일방적입니다. (E) CD가 없습니다. (F) CD 내부에는 기록 피펫을 막을 수 있는 입자가 있습니다. (G) CD는 매끄럽고 균일하며 부풀어 오르지 않습니다. 이러한 유형의 CD로 기가씰을 형성하면 성공적인 녹음이 가능할 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 정자 패치 클램프 리그 구성 요소. (A) 필수 구성 요소가 있는 일반적인 정자 전기생리학 리그: (1) 도립 현미경; (2) 저소음 디지타이저; (3) 증폭기; (4) micromanipulator 플랫폼이 있는 도립 현미경에 연결된 저드리프트 micromanipulator; (5) PC 컴퓨터; (6) 진동 감쇠 공기 테이블; (7) 주변 전기 간섭으로부터 설정을 보호하기 위한 패러데이 케이지. 컴퓨터 키보드 및 마우스를 포함하여 장비의 모든 전기 구동 구성 요소는 전기(50Hz 또는 60Hz) 소음이 적거나 전혀 발생하지 않도록 하고 장비의 모든 구성 요소가 적절하게 접지되어야 합니다. (B) 피펫 제작을 기록하는 데 사용되는 마이크로피펫 풀러. (C) (1) 피펫 화재 연마에 사용되는 microForge; (2) 외경 1.5mm, 내경 0.86mm 및 내부 필라멘트를 가진 붕규산 유리 모세관; (3) 피펫 수집 상자. (D) 성공적인 피펫 소방 단계: (a) 내경이 2mm인 연마되지 않은 피펫; (b) 내경이 0.5 mm인 파이어 폴리싱 피펫; (c) 과도하게 연마된 밀봉된 피펫은 기록에 적합하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 기록 챔버 시스템의 구성 요소 및 그 어셈블리. (A) 기록 챔버 시스템의 필수 구성 요소: (1) (2) 2단계 고정 클램프가 있는 시리즈 20 플랫폼용 현미경 스테이지 어댑터; (3-4) PM 시리즈 자기 가열 플랫폼, (3) 관류 챔버를 고정하기 위한 자기 클램프; (5) 관류 챔버; (6) 한천 다리; (7) 마그네틱 클램프, Ag/AgCl 펠릿에 대한 2mm 잭이 있는 기준 전극; (8) 흡입 라인용 마그네틱 홀더(MAG-1); (9) 흡입 튜브; (10) 흡입관 O-홀더. (B) (A)에 표시된 구성 요소로 조립된 녹음 챔버 시스템. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 관류 시스템의 구성 요소. (A) 조립된 관류 라인 및 (B) 필수 구성 요소: (1) 20mL 및 3mL 주사기; (2) Luer 연결부가 있는 마개; 4방향; 남성 자물쇠; (3) 암 루어 호스 미늘 어댑터, 1/16"; (4) 폴리테트라플루오로에틸렌(PTFE) 관류 튜브(마이크로보어 PTFE 튜브, 0.022" ID × 0.042" OD); (5) 폴리테트라플루오로에틸렌 8위치 관류 매니폴드; (6) 실리콘 커넥터 튜브(백금 경화 실리콘 튜브, 1/32" ID × 3/32" OD); (7) 매니폴드 커넥터 튜빙(PTFE 튜빙, 1/32" ID × 1/16" OD). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 수컷 마우스 해부. (A) 쥐 남성 생식 기관; 고환과 부고환이 모두 표시됩니다. (B) 부고환은 HS 용액을 함유한 35mm 세포 배양 접시로 옮기고 잔류 지방과 정관을 제거합니다. (C) 그런 다음 각 부고환은 #15 메스 칼날을 사용하여 caput, corpus 및 cauda로 나뉩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 기가씰(Gigaseal)의 형성과 쥐 정자 세포와의 침입. 상용 패치 클램프 소프트웨어의 "멤브레인 테스트" 도구의 인터페이스. 정자 패치 클램핑의 3단계: (A) 기록된 피펫을 14.8MΩ의 피펫 저항을 생성하는 수조 HS 용액에 담그십시오. (B) 기가씰이 형성되고(저항은 4.7GΩ입니다), 커패시턴스 과도 현상이 보상되고, 정자가 커버슬립에서 들어 올려집니다. (C) 전체 셀 모드로 전환. 길들이기 및 전체 셀 모드로의 전환은 왼쪽과 같이 광 흡입과 결합된 짧은(1ms) 점차적으로 증가하는(430-650mV, ~50mV 증가) 전압 펄스를 적용하여 수행됩니다. 길들이기는 세포의 전체 커패시턴스(이 정자 세포의 경우 ~2.93pF)를 반영하는 큰 커패시턴스 과도 현상의 출현에서 명백히 드러납니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
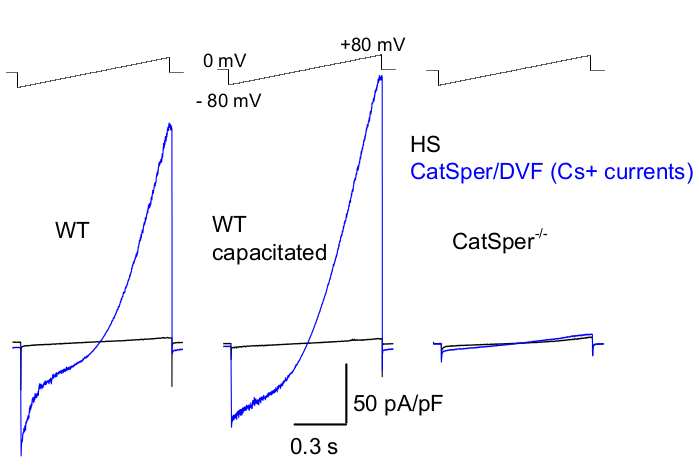
그림 8: 야생형(WT) 꼬리뼈 부고환, 정전 용량 및 CatSper 녹아웃 정자에서 Murine CatSper 기록. 1가 CatSper 활성을 기록하기 위해 램프 프로토콜이 5초마다 적용되고 0mV39,51의 유지 전위에서 전압 램프에 의해 유도된 CatSper 전류가 적용됩니다. 전압 램프(-80 mV - 80 mV, 850 ms)는 HS 및 공칭 2가 없는 솔루션(DVF)에 적용됩니다. 데이터는 2-5kHz로 샘플링되고 1kHz로 필터링되었습니다. 기준선 전류는 HS 용액에 기록되며, 이는 높은 세포 외 마그네슘39,51에 의한 억제로 인해 CatSper 전류를 생성하지 않습니다. 베이스라인 전류는 누출 전도도(비이온 채널 경로)를 추정하는 데 유용합니다. 대표, 꼬리 WT 쥐 정자 세포(무능력, 왼쪽 및 수용 가능, 가운데) 및 CatSper 결핍 꼬리 쥐 정자 세포(오른쪽)에서 기록된 Cs+ 전체 세포 CatSper 전류 밀도(pA/pF, 파란색). 전류는 0mV의 유지 전위에서 전압 램프에 의해 유도되었으며 램프는 HS에서 -80mV에서 80mV까지 적용되었으며 명목상 2가가 없는 솔루션이었습니다. HS 용액에 기록된 기준선 전류(검은색). 전류 밀도를 얻기 위해 CatSper 전류 진폭을 셀 커패시턴스(pA/pF)로 정규화했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
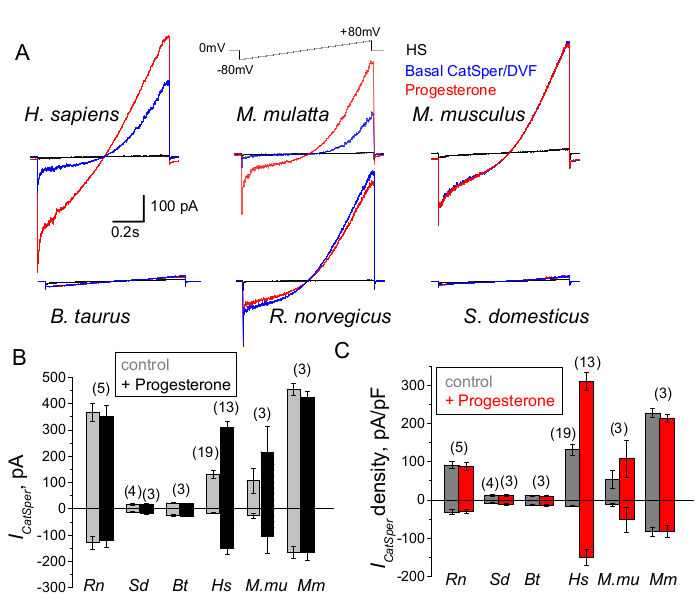
그림 9: 다양한 포유류 종에서 CatSper의 프로게스테론 조절. (A) 표시된 전압 램프 프로토콜에 의해 다른 종의 정자 세포에서 추출된 대표적인 CatSper 전류. 종(種): 인간(Hs; H. 사피엔스); 붉은털 원숭이 (Mmu; M. mulatta), 생쥐 (Mm; M. musculus), 황소 (Bt; B. 황소자리); 쥐 (Rn; R. 노르베기쿠스); 멧돼지 (Sd; S. scrofa domesticus). 1mM 프로게스테론의 부재(파란색) 및 존재(빨간색)에서의 CatSper 전류와 HS 용액(검은색)의 기저 전류가 기록되었습니다. (B) 표시된 바와 같이 다른 종의 정자 세포로부터의 CatSper 전류 진폭(I,CatSper, pA) 및 (C) 평균 전류 밀도(pA/pF) 기록; n은 사용된 개별 정자 세포의 수를 나타냅니다. 데이터는 평균 +/- S.E.M . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 10: 편모 운동성의 차이. 세포질 방울과 편모 운동성의 두 가지 대표적인 예. 동일한 랫드(Rn)와 인간(Hs) 정자 세포의 중첩된 이미지는 가장 원위부 편모 편향을 보이는 두 개의 다른 시점에서 촬영되었습니다. 점선 사각형은 세포질 방울이 있는 영역과 해당 공간 이동성을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 11: U-tube 어셈블리 및 필수 구성 요소. (A) U-튜브의 구성 요소: (1) 10mL 혈청학적 피펫; (2) 실리콘 튜브; (3) 실리콘 커넥터 튜브; (4) 1mL 주사기; (5) 여성 luer 미늘 어댑터; (6) 수 Luer 일체형 잠금 어댑터 1/8"; (7) Luer 연결부가 있는 마개; 4방향; 남성 자물쇠; (8) 수 Luer 시리즈 미늘 어댑터, 1/16". (B) 완전히 조립된 U-튜브 및 (C) 패러데이 케이지에 부착된 U-튜브. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
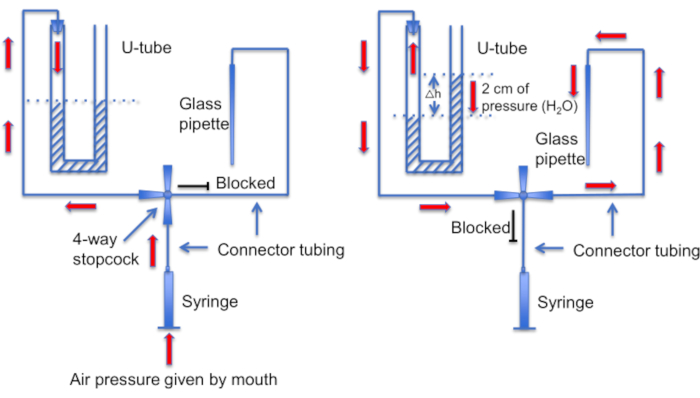
그림 12: U-튜브 어셈블리의 개략도. 왼쪽 패널: 양압은 U-튜브의 액체 레벨에 차이를 만들기 위해 입으로 제공됩니다. 오른쪽 뿔의 액체 수준이 2cm 상승합니다. 이 레벨 차이가 생성된 후 스톱콕을 돌려 U-튜브를 기록 파이펫으로 이어지는 라인에 연결합니다. 오른쪽 패널: 오른쪽 혼의 액체 레벨이 높을수록 양압이 생성되어 피펫 용액이 피펫 팁 밖으로 지속적으로 밀려나고 팁에 이물질이 없도록 유지합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 화학 물질 | 몰 무게 (g/mol) | 밀리미터 | 1L의 경우 g |
| 염화나트륨 | 58.44 | 97.8 | 5.72 지 |
| 케이클 | 74.55 | 5 | 0.373 지 |
| KH2사서함4 | 136.09 | 0.37 | 50.4의 mg의 |
| 마그네슘4 x 7.H2O | 246.48 | 0.2 | 49.3의 mg의 |
| CaCl2 x 2.H2O | 147.02 | 2 | 0.294 지 |
| 헤페스 | 238.3 | 20 | 4.766 지 |
| 포도당 | 180.2 | 3 | 0.540 지 |
| 젖산 나트륨 (60 % w / w) | 112.06 | 20 | 3 밀리리터 |
| 나트륨 피루브산 | 110 | 0.4 | 44의 mg의 |
표 1: 인간 관형 유체(HTF) 용액
| 화학 물질 | 몰 무게 (g/mol) | 밀리미터 | 1L의 경우 g |
| 염화나트륨 | 58.44 | 135 | 7.889 지 |
| 케이클 | 74.55 | 5 | 0.373 지 |
| CaCl2 x 2. H2O | 147.02 | 2 | 0.294 지 |
| 마그네슘4 x 7. H2O | 246.48 | 1 | 0.247 지 |
| 헤페스 | 238.3 | 20 | 4.766 지 |
| 포도당 | 180.2 | 5 | 0.901 지 |
| 젖산 나트륨 (60 % w / w) | 112.06 | 10 | 1.5 밀리리터 |
| 나트륨 피루브산 | 110 | 1 | 0.110 지 |
표 2: 고염수(HS) 용액
| 화학 물질 | 몰 무게 (g/mol) | 밀리미터 | g(500ml분) |
| CSM메소3 | 228.0 | 140 | 15.960 지 |
| 헤페스 | 238.3 | 40 | 4.766 지 |
| 에디타 | 292.24 | 1 | 0.146 지 |
표 3: CsMeSO3 수조 용액(2가 무료 수조 용액: DVF)
| 화학 물질 | 몰 무게 (g/mol) | 밀리미터 | mg (25ml의 경우) |
| CSM메소3 | 228.0 | 130 | 741의 mg의 |
| 헤페스 | 238.3 | 70 | 417의 mg의 |
| 에디타 | 292.24 | 2 | 14.6의 mg의 |
| 에그타 | 380.35 | 3 | 28.5의 mg의 |
| 증권 시세 표시기 | 1M 용액 | 1 | 25 μl |
표 4: CsMeSO3 피펫 용액
토론
우리는 다양한 종의 정자 세포에서 전기 생리학적 기록을 수행하기 위한 자세한 프로토콜을 설명합니다. 정자에 대한 이온 채널과 전기 수송체의 생리학적 중요성을 감안할 때 이 기술은 정자 세포 생리학뿐만 아니라 남성 불임으로 이어지는 결함을 연구하는 강력한 도구입니다. 실험자는 처음에는 이 기술을 실행하는 것이 어렵다는 것을 알게 될 수 있지만 인내와 인내로 성공이 따릅니다.
포유류의 정자는 길고(보통 >50μm) 좁으며 운동성이 높습니다. 포유류 정자의 기저 박동 주파수(BF)는 평균 4Hz(마우스 69), 7-15Hz(멧돼지 70,71), 11Hz(랫트 72), 11-20Hz(수컷 18), 24Hz(붉은털 원숭이 23) 및 최대 25Hz(인간 3)의 값으로 크게 다릅니다. 세포질 방울(CD)은 정자 세포에서 기록하기 위한 입구입니다. 설치류의 정자에서 CD는 종종 원위부에 있지만 편모를 따라 이동하며(그림 10), 기록에 추가적인 장애물을 만듭니다. 그러나 인간의 정자 세포에서 CD는 머리 근처에 더 일반적으로 위치합니다. 따라서 성공적인 정자 패치 클램프의 핵심 구성 요소는 CD를 명확하고 선명하게 볼 수 있는 우수한 광학 장치와 드리프트나 진동이 없는 고정밀 미세 조작기 시스템입니다. 초기에는 높은 실패율이 예상되며 정자 패치 클램프 후 처음 며칠 이내에 정상입니다. 일주일에 여러 번 시도하는 일상적인 연습을 권장합니다. 일주일에 하루에 여러 번 녹음을 하면 루틴이 확립되고 운동 능력이 향상됩니다.
최근까지만 해도 정자 이온 채널의 식별 및 약리학적 특성화는 정자 이온 채널을 직접 연구할 수 없기 때문에 방해를 받았습니다. 이 분야는 주로 면역세포화학 연구에 의존했는데, 이는 종종 항체의 비특이성 및/또는 해당 유전자 모델의 부족으로 어려움을 겪었습니다. 칼슘 채널을 연구하기 위해 고전적인 칼슘 이미징 방법이 널리 사용되어 왔으며 이는 고유 한 장점과 한계가있습니다 73 , 74 , 75 , 76 , 77 . 칼슘 이미징은 중간에서 높은 처리량 연구 78,79,80,81에 적용할 수 있는 비교적 쉬운 방법이고 덜 침습적이지만, 상대적으로 온전한 세포가 필요하기 때문에 세포 내 신호 캐스케이드에서 분리된 이온 채널의 기능을 해부하거나 칼슘 이온 교환체와 구별하는 데 장애물이 됩니다. 또한, 막 전위를 제어하기 어렵기 때문에 전위의존성 칼슘 채널의 기여를 배제하기가 더 어렵습니다. 칼슘 형광 분석법의 몇 가지 장점 중 하나는 칼슘 이온 농도의 변화를 정확하게 측정할 수 있는 칼슘 비율 측정 염료를 사용한다는 것입니다. 동시에 이러한 염료의 감도는 세포 내 pH의 변화에 따라 달라질 수 있음을 알고 있어야 합니다.
아래에서는 방법의 문제 해결 단계를 포함하여 프로토콜 내의 중요한 단계에 대해 설명합니다. 바람직하지 않은 이온(예: 마그네슘 또는 중금속)으로 인한 작은 오염도 1가 전류의 검출을 손상시킬 수 있으므로 실험 용액의 준비를 위해 순수한 시약만 사용하는 것이 필수적입니다. 정자 세포의 크기가 작기 때문에 세포당 이온 채널 수가 상대적으로 적을 것으로 예상할 수 있습니다. 따라서 순 전류 범위는 몇 pA에서 수백 pA입니다. 따라서 작은 전류를 감지할 수 있도록 리그의 내부 전기 노이즈가 최소화되어야 하며 드리프트가 없는 장비를 사용하는 것이 좋습니다. 특정 전도도를 전기 노이즈 및 배경 누출과 구별하려면 기록 장치와 접지 시스템을 최대화해야 합니다. 이것은 전기 간섭을 피하기 위해 리그를 적절하게 접지함으로써 달성됩니다82. 패러데이 케이지의 사용은 건물 조명 및 벽면 전기 배선과 같은 다양한 전기 장치에서 생성되는 전기 간섭으로부터 보호하기 위해 적극 권장됩니다. 컴퓨터 키보드 및 마우스를 포함하여 장비의 모든 전기 구동 구성 요소는 전기적(50Hz 또는 60Hz) 소음을 거의 또는 전혀 방출하지 않고 장비의 모든 구성 요소가 적절하게 접지되어야 합니다. 모든 이온 채널이 닫혀 있을 때 전체 셀 구성의 전기 노이즈는 0.5-1pA< 되어야 합니다.
또 다른 중요한 점은 작업 용액의 올바른 삼투압을 모니터링하는 것입니다. 세포 내 및 세포 외 용액의 조성은 정확하게 결정되어야 하며 삼투압은 올바르게 측정되어야 합니다. 세포외 용액은 피펫 용액에 비해 약간 저긴장성이어야 하는데, 이는 미세한 세포 팽창을 유발하고 피펫이 정자막에 의해 막히는 것을 방지하기 때문입니다. 참고: 피펫 용액이 너무 긴장되어 수조 용액과 10mOsm 이상 차이가 나면 과도한 세포 팽창 및 밀봉 파열이 발생합니다. 결과적으로 셀은 깨지기 쉽고 침입 후 몇 초 이내에 기가씰을 잃어버릴 수 있습니다. 경험에 비추어 볼 때, 부정확한 용액 준비는 성공적인 패치 클램핑을 방해하는 가장 흔한 실수 중 하나입니다.
피해야 할 또 다른 잠재적인 장애물은 가소제/프탈레이트 함유 플라스틱과 미네랄 오일 윤활 주사기입니다. 용액과 만나는 튜브, 주사기 및 모든 플라스틱 장비, 그리고 그에 따른 정자 세포는 가소제나 기타 환경 독소 또는 오일을 침출해서는 안 되는데, 이러한 화학 물질은 이온 채널 활성을 크게 변화시킬 수 있기 때문입니다. 우리는 작은 직경의 테프론 튜브를 주요 관류 라인으로 사용합니다. 테프론(PTFE)은 침출성 화합물이 거의 없지만 다소 뻣뻣합니다. 유연한 연결은 테프론 튜브에 맞는 고순도 실리콘 튜브로 만들어집니다. 관류 시스템에 사용되는 모든 주사기에는 미네랄 오일 또는 기타 윤활 첨가제가 이온 채널 기록을 방해할 수 있기 때문에 윤활제가 없습니다.
올바른 유리를 사용하고 올바른 마이크로피펫 모양을 당기는 것의 중요성은 아무리 강조해도 지나치지 않습니다. 따라서 유리 마이크로피펫의 최적 제작은 성공적인 패치를 위한 전제 조건입니다. 우리는 더 나은 용액 충전을 위해 필라멘트가 포함된 붕규산 유리로만 만든 유리 마이크로피펫을 사용합니다. 피펫의 끝은 이상적이고 단단한 밀봉을 제공하기 위해 화염 광택 처리되어야 합니다. 직경이 2 μm를 초과하는 피펫 팁(따라서 저항이 10 MΩ 이하)은 일반적으로 정자 세포 패치 클램프에 적합하지 않습니다.
또 다른 중요한 단계는 밀봉을 형성하기 전에 마이크로피펫 팁에 이물질이나 기포가 없는지 확인하는 것입니다. 이것은 마이크로피펫이 운동성 세포로 가득 찬 용액에 로드된다는 점을 감안할 때 어려운 작업입니다. 피펫이 자유롭게 헤엄치는 정자 세포에 우발적으로 "부딪히는" 것을 방지하는 데 도움이 되는 한 가지 요인은 지속적인 관류를 사용하여 모든 비부착 세포를 씻어내는 것입니다. 또 다른 도구는 팁을 깨끗하게 유지하기 위해 양압 모드와 음압 모드 사이를 전환할 수 있는 집에서 만든 "U-튜브"입니다(그림 11 및 그림 12).
정자 세포는 세포질 방울(CD)의 모양과 크기가 매우 다양하기 때문에 적절한 형태를 가진 방울을 선택하는 것이 중요합니다. 그림 2에서 볼 수 있듯이 작고(1-3μm) 매끄럽고 균일하며 과도하게 팽창하지 않은 CD만 패치 클램프에 적합합니다. 작고 일방적이다. "부풀어 오른" 완전히 투명한 CD는 씰이 약하거나 전혀 생성되지 않습니다. 내부에 큰 용해성 입자가 있는 CD는 기록 피펫을 막을 수 있습니다. 고환 쥐 정자가 부고환에 들어가면 CD는 머리에 가까운 목 부위에 위치합니다. 그들이 부고환을 통과할 때, 그들의 CD는 중간 부분을 따라 이동하고, 결국 정자가 꼬리 부고환에 도달할 때 중간 조각과 주요 조각(고리) 사이의 연결에 도달합니다. 그러므로, 위에서 언급한 바와 같이, 말뭉치(corpus epididymis)로부터 분리된 정자 세포에서, CD는 보통 중간 조각의 중심에 가깝게 위치한다. 꼬리 세포에서 CD는 일반적으로 고리 근처에서 발견될 수 있습니다(그림 2C). 인간 정자의 경우, CD는 목 부위에 위치합니다(그림 2A,B).
이것은 실험실 동물에서 분리된 정자에 대해서는 문제가 되지 않지만, 인간 기증자 사이에는 상당한 차이가 존재합니다. 동일한 기증자 내에서 정자 품질의 변화는 주로 정자 원형질의 품질에 영향을 미치며 때로는 밀봉 형성을 상대적으로 어렵게 만듭니다. 이온 채널 거동과 약리학의 변동성이 적으며, 이는 개별 유전학 또는 생리학과 관련이 있을 수 있는 요인입니다. 인내심을 갖고 며칠 동안 다양한 기증의 샘플을 평가해야 할 뿐만 아니라 여러 인간 기증자 참가자에게 의존해야 합니다. 인체 물질로 작업하려면 더 많은 인내가 필요한데, 기증된 정자는 다양한 환경 요인에 따라 동일한 기증자 내에서 정자의 질이 크게 다르기 때문입니다. 기증자 상태에 대한 최종 결정을 내리기 위해 다양한 기증일의 샘플을 평가하는 것이 좋습니다. 사정된 정제된 정자는 일반적으로 몇 시간 이내(인간 정자의 경우 분리 후 최대 12시간) 이내에 전기생리학에 적합하지만, 부고환 쥐 정자 세포는 분리 후 2시간 이내에만 패치를 붙이는 데 적합합니다.
마지막으로 중요한 것은 기가씰 형성이 정자 세포에 따라 다르다는 것입니다. 쥐/설치류 정자 세포의 경우, 기가씰(gigaseal) 형성은 거의 즉각적으로 일어나며, 인간의 정자와 함께 기가씰을 형성하는 데 몇 초(때로는 최대 1분)가 필요합니다. 종종 초기 흡입으로 인해 입력 저항이 200MΩ에서 800MΩ 사이가 됩니다. 유지 전위를 -60mV로 전환하고 최대 10mV의 "멤브레인 테스트" 짧은 펄스를 제공하면 종종 기가씰 형성을 복구하는 데 도움이 됩니다(피펫 내 멤브레인의 전압 필드 유도 이동을 통해).
정자 세포 패치 클램프 기술을 사용하면 자연 발현 시스템에서 특정 이온 채널을 자세히 연구할 수 있습니다. 이 기술의 성공 여부는 적절한 장비, 고품질의 생존 가능한 정자 세포, 순수 시약, 기본 전기 생리학 기술, 인내심 및 끈기에 달려 있습니다. 이 방법은 이온 채널 진화 다양성, 조절 메커니즘, 남성에서 여성의 생식관으로 이동하고 pH 및 리간드와 같은 외인성 조건에 의해 변경됨에 따라 기능의 변화를 연구함으로써 정자 생리학의 새로운 지평을 엽니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 NIH Grant R01GM111802, Pew Biomedical Scholars Award 00028642, Alfred P. Sloan Award FR-2015-65398 및 Packer Wentz Endowment Will(P.V.L.에게)의 지원을 받았습니다. 이 연구는 또한 Deutsche Forschungsgemeinschaft(독일 연구 재단) 368482240/GRK2416(뉴멕시코로)와 B.L.의 중국 장학 위원회 펠로우십의 지원을 받았습니다. 쥐 조직을 공유해 주신 Dan Feldman 박사님, 영장류 정자 세포 획득에 도움을 주신 UC Davis의 Katie Klooster와 Stuart Meyers님, 멧돼지 및 황소 정자 세포의 데이터 수집 분석을 도와주신 Steven Mansell에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
참고문헌
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. Ion Channels of Excitable Membranes 3rd Edition. , Sinauer Associates - an imprint of Oxford University Press. (2001).
- Molleman, A. An Introductory Guide to Patch Clamp Electrophysiology. , John Wiley & Sons Ltd. (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082(2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130(2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153(2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53(2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853(2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438(2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426(2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5(2019).
- World Health Organization. World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009(2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212(2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유