Method Article
Registro de corrientes eléctricas a través de la membrana plasmática de espermatozoides de mamíferos
En este artículo
Resumen
Este protocolo describe cómo realizar registros eléctricos de espermatozoides de mamíferos en una configuración de célula completa, con el objetivo de registrar directamente la actividad de los canales iónicos. El método ha sido fundamental para describir los perfiles electrofisiológicos de varios canales iónicos de espermatozoides y ha ayudado a revelar su identidad molecular y regulación.
Resumen
El registro de la actividad eléctrica de una de las células más pequeñas de un organismo mamífero, un espermatozoide, ha sido una tarea desafiante para los electrofisiólogos durante muchas décadas. El método conocido como "pinza de parche para espermatozoides" se introdujo en 2006. Ha permitido el registro directo de la actividad de los canales iónicos en configuraciones de células enteras y adheridas a células y ha sido fundamental para describir la fisiología de los espermatozoides y la identidad molecular de varios canales iónicos de calcio, potasio, sodio, cloruro y protones. Sin embargo, el registro de espermatozoides individuales requiere habilidades avanzadas y capacitación en electrofisiología. Este protocolo detallado resume el procedimiento paso a paso y destaca varios "trucos del oficio" para ponerlo a disposición de cualquier persona que desee explorar la fascinante fisiología del espermatozoide. Específicamente, el protocolo describe el registro de espermatozoides humanos y murinos, pero se puede adaptar esencialmente a cualquier espermatozoide de mamífero de cualquier especie. El protocolo cubre detalles importantes de la aplicación de esta técnica, como el aislamiento de los espermatozoides, la selección de reactivos y equipos, la inmovilización de las células altamente móviles, la formación del sello hermético (Gigaohm) entre un electrodo de registro y la membrana plasmática de los espermatozoides, la transición al modo de espermatozoides completos (también conocido como break-in) y registros ejemplares del canal de iones de calcio de los espermatozoides. CatSper, de seis especies de mamíferos. Se discuten las ventajas y limitaciones del método de pinzamiento con parche de espermatozoide, así como los pasos más críticos.
Introducción
Similar a la pinza de parche tradicional inventada por Erwin Neher y Bert Sakmann1, la pinza de parche de espermatozoides permite interrogar la actividad de los canales iónicos individuales, así como registrar la actividad de toda la población de canales iónicos dentro de la célula individual 2,3. El método permite la identificación de un tipo específico de canal iónico bajo grados de desacoplamiento de los procesos enzimáticos intracelulares. Este método es crucial para la determinación de la actividad de los canales iónicos en función de sus huellas electrofisiológicas y farmacológicas y, por lo tanto, proporciona una estrategia de identificación fiable. La desventaja del método es su incapacidad para detectar transportadores no electrogénicos. Además, la formación electrofisiológica básica es útil para comprender los matices del protocolo. Para dominar la técnica de pinzamiento de parche y aplicarla a los espermatozoides de mamíferos, recomendamos estudiar la literatura básica sobre pinzas de parche 4,5. En este artículo, proporcionamos un procedimiento detallado paso a paso y destacamos prácticas únicas que hacen que esta técnica sea fácil de entender y esté disponible para cualquier persona que desee practicar la electrofisiología de los espermatozoides.
La homeostasis iónica es una función fisiológica esencial de los espermatozoides que depende en gran medida de los canales iónicos y los transportadores iónicos para mantener gradientes iónicos fisiológicamente importantes, variar el calcio intracelular y cambiar el voltaje transmembrana. Los canales iónicos y los transportadores de iones regulan las funciones esenciales de los espermatozoides, como la motilidad, la navegación en el tracto reproductivo femenino, la maduración de los espermatozoides y, en los organismos marinos, la quimiotaxis hacia el óvulo 6,7,8,9,10,11,12 . La motilidad de los espermatozoides es un proceso que se adquiere gradualmente. Los espermatozoides están principalmente inactivos durante su maduración en los testículos y durante su posterior paso a través del epidídimo. Su motilidad está restringida por un ambiente epididimario ácido que conduce a una acidificación interna del espermatozoide. Esto perjudica la función del axonema, ya que no puede funcionar por debajo de pH 6,0 13,14. Sin embargo, tras la exposición a los fluidos seminales o a un ambiente más alcalino, las concentraciones de iones intracelulares de los espermatozoides y el pH citoplasmático sufren cambios importantes y el espermatozoide se vuelve móvil 15,16,17. El movimiento del flagelo espermático está impulsado por la hidrólisis de ATP que apoya el deslizamiento de los microtúbulos axonémicos18 y este proceso es altamente dependiente del pH14. Además, el movimiento flagelar también está controlado por una elevación del calcio intraflagelar y del AMPc 13,19,20,21,22,23,24. Estos factores, es decir, la concentración de calcio intracelular en los espermatozoides [Ca2+]i, el pH, el ATP y el AMPc son los principales mecanismos reguladores que permiten cambios en la motilidad y sus concentraciones están estrechamente reguladas por los canales iónicos y transportadores de los espermatozoides.
Los espermatozoides son únicos en el sentido de que expresan una serie de proteínas que no se pueden encontrar en ninguna otra parte del cuerpo. Ejemplos notables son los canales iónicos de los espermatozoides, como el canal de potasio, Slo3 25,26,27,28,29 y el canal iónico Cat de Sperm, CatSper 2,30,31,32. Este último es el principal canal de calcio de los espermatozoides de mamíferos31, y está regulado por alcalinización intracelular 2,30,31,32,33,34. CatSper también está regulado por señales específicas de la especie 7,35 y se organiza en nanodominios longitudinales cuadriláteros a lo largo del flagelo de espermatozoides 36,37,38. En los primates, CatSper se activa por una combinación de alcalinidad flagelar, despolarización de la membrana y progesterona 3,39,40,41, mientras que para la activación murina de CatSper no se requiere progesterona 2,39. Otra característica específica de este canal es su organización de múltiples subunidades: CatSper es un complejo de al menos 10 subunidades diferentes 31,32,34,37,38,42,43,44,45,46,47. Esta estructura sofisticada y las características específicas de su regulación dificultaron la expresión recombinante de CatSper en cualquier sistema de expresión heterólogo conocido y, por lo tanto, la caracterización fisiológica de CatSper se ha restringido a su sistema nativo de expresión: el espermatozoide. Mientras que la caracterización molecular de la proteína CatSper se logró en un artículo seminal en el año 2000 por D. Ren et. al.31, la prueba definitiva de que CatSper es un canal iónico de buena fe solo fue posible después de la introducción del método de pinza de parche de esperma en 20062. Desde entonces, esta técnica permitió la caracterización precisa de muchas vías conductoras de iones en los espermatozoides 9,28,37,39,40,44,46,48-54.
Se creía que el método clásico y más sencillo para estudiar las características de los canales iónicos, la técnica de pinzamiento por parche, no era aplicable a los espermatozoides debido a su motilidad y morfología específica (Figura 1A). Específicamente, el minúsculo volumen del citoplasma de los espermatozoides y la estrecha unión de la membrana plasmática de los espermatozoides a las estructuras intracelulares rígidas, como la vaina fibrosa y el núcleo de los espermatozoides, fueron los principales desafíos55. Estas dos características estructurales dan como resultado una célula delgada en forma de flecha que está diseñada para penetrar a través de entornos altamente viscosos, como las vestiduras protectoras de los huevos, sin deformación significativa ni daños en la membrana plasmática.
El primer paso del método de pinza de parche es el establecimiento de un sello hermético entre una pipeta de registro (una micropipeta de vidrio) y la membrana plasmática celular. Para lograr esto, hay que tirar de suficiente membrana plasmática dentro de la pipeta de registro para que se forme un gigaseal mecánicamente estable entre la membrana plasmática y el vidrio. La membrana plasmática debe ser flexible y no rígida (Figura 1B). Como se mencionó anteriormente, toda la superficie de la membrana plasmática de los espermatozoides está bastante adherida, a excepción de la región conocida como gota citoplasmática (Figura 1A y Figura 2). Por lo tanto, la naturaleza rígida de la membrana plasmática de los espermatozoides se consideró un obstáculo principal para obtener el sello hermético o 'gigaseal', llamado así porque se requieren >109 ohmios para buenas grabaciones. Sin embargo, la introducción de la técnica de pinzamiento de parche espermático en 20062 eliminó esta barrera y este método pudo aplicarse con éxito a espermatozoides de varias especies de mamíferos 2,41,51,56. Este avance se ha logrado centrándose en la gota citoplasmática (CD)2,8, una estructura diminuta que se encuentra a lo largo de la pieza media del espermatozoide (Figura 1A y Figura 2), y que es simplemente el remanente de la espermátida alargada, un precursor de los espermatozoides a partir del cual se desarrollan la cabeza y la cola. Funcionalmente, puede ayudar a la célula a adaptarse a los cambios en la osmolaridad extracelular durante la eyaculación. La característica importante es que la membrana plasmática dentro del CD es lo suficientemente flexible como para ser introducida en la pipeta y formar un sello de gigaohmios. Por lo tanto, el CD de espermatozoides es la mejor parte de la superficie del esperma a través de la cual se puede lograr una formación exitosa de gigasellos y una transición a un modo de célula completa que, en última instancia, acopla eléctricamente el espermatozoide a un amplificador de pinza de parche 2,8. Vale la pena señalar que publicaciones anteriores informaron sobre la formación exitosa de gigasellos en la cabeza del espermatozoide, lo que permite el registro en la configuración adjunta a la célula 54,57,58,59. Sin embargo, hasta ahora solo se han reportado las grabaciones en configuración de celda completa realizando la formación de gigasellos en la región de CD. Este modo de célula completa permite el acceso eléctrico a todo el volumen de los espermatozoides y, por lo tanto, permite la detección de actividades de canales iónicos ubicados en el flagelo de los espermatozoides, así como en la cabeza de los espermatozoides. Durante solo unos pocos años desde su desarrollo, la técnica de pinza de parche de esperma ha resultado en un tremendo progreso en nuestra comprensión de los canales iónicos de los espermatozoides y es hasta ahora una de las técnicas más sólidas para investigar directamente la funcionalidad de los canales iónicos de los espermatozoides 9,28,37,39,40,44,46,48,49, 50,51,52,53 (Figura 1).
La pinza de parche de esperma varía en algunos detalles de la técnica clásica de pinza de parche, como se describe a continuación. En primer lugar, la mayor parte de la membrana plasmática de los espermatozoides está estrechamente unida a la estructura intracelular rígida y, por lo tanto, los espermatozoides casi no tienen membrana plasmática "de repuesto" para ser introducida en la pipeta. La única región que es flexible es la membrana del CD que se asemeja a la membrana plasmática de muchas células somáticas y, por lo tanto, se puede introducir fácilmente en la pipeta. Para formar un sello de gigaohmios con el CD, se crea una presión negativa mediante una ligera succión en la parte superior de la pipeta para atraer una pequeña porción de la membrana plasmática de los espermatozoides hacia la punta de la micropipeta (Figura 1B). Esta porción de la membrana forma una invaginación en forma de Ω en la punta de la pipeta y establece un sello hermético con sus paredes internas.
En segundo lugar, la gota citoplasmática en los espermatozoides humanos y de ratón está entre 1 y 2 μm (Figura 1 y Figura 2). Por lo tanto, la aplicación de la técnica de fijación de parche a un objeto tan pequeño requiere una óptica de alta resolución. La mayoría de los equipos de fijación de parches para espermatozoides están equipados con un microscopio invertido con un contraste de interferencia diferencial (DIC) o componentes ópticos Nomarski (Figura 2 y Figura 3). Se recomienda encarecidamente el uso de un microscopio equipado con óptica DIC para la pinza de parche de esperma en lugar de una óptica de contraste de fase más convencional, ya que la información espacial que se ve en DIC ayuda a lograr una precisión superior en el posicionamiento de una pipeta de parche en el pequeño CD. También sugerimos usar un objetivo de inmersión en agua de 60x o una lente similar, con apertura numérica de 1.2. Este objetivo tiene una larga distancia de trabajo (0,28 mm), lo que permite observar espermatozoides nadando libremente en solución (Figura 2). El objetivo también tiene un collar de ajuste para ajustar al grosor del cubreobjetos (variable de 0,13 a 0,21 mm). Esta combinación de la larga distancia de trabajo y el collar de ajuste permite la observación a través de dos cubreobjetos de 0,13 mm; Un cubreobjetos sirve como fondo de cristal de la cámara de registro, y el cubreobjetos de 5 mm con espermatozoides depositados se coloca en la parte superior. Como se explica a continuación, depositar los espermatozoides en cubreobjetos redondos de 5 mm fácilmente intercambiables, en lugar de en el fondo de la cámara de registro directamente, es una forma conveniente de cargar espermatozoides frescos en la cámara de registro.
En tercer lugar, el equipo de pinza de parche de esperma debe estar equipado con un amplificador de abrazadera de parche de bajo ruido y un digitalizador para registrar corrientes eléctricas diminutas (rango de picoamperios) y cambios minúsculos en el potencial de membrana. Este equipo debe garantizar el menor ruido del amplificador. La ausencia de vibración es una parte esencial del éxito de la grabación de una pinza de parche. La fijación del parche de esperma requiere un micromanipulador preciso y sin deriva que se pueda conectar al microscopio invertido con una plataforma de micromanipulador para garantizar una mejor estabilidad que un soporte de micromanipulador independiente (Figura 3A). Para probar la configuración, no se debe ver ningún movimiento de la punta de la pipeta (con un aumento de 60x) incluso cuando una persona salta arriba y abajo en el suelo cerca de la mesa de aislamiento de vibraciones.
Protocolo
Todos los experimentos se realizaron de acuerdo con las pautas de los NIH para la investigación con animales y fueron aprobados por el Comité de Cuidado y Uso de Animales de UC Berkeley (AUP 2015-07-7742), con todo lo posible para minimizar el sufrimiento animal. Todos los métodos descritos son consistentes con las recomendaciones del Panel de Eutanasia de la Asociación Americana de Medicina Veterinaria y el comité de la IACUC. Todos los procedimientos experimentales que utilizan muestras derivadas de humanos fueron aprobados por el Comité de Investigación Humana de la Universidad de California, Berkeley, número de protocolo IRB 2013-06-5395.
1. Fabricación de micropipetas de vidrio para el registro de parches de esperma de células completas.
NOTA: El pequeño tamaño de la gota citoplasmática requiere micropipetas de vidrio con puntas finas.
- Para la fabricación de micropipetas, comience con capilares de vidrio de borosilicato con un diámetro exterior de 1,5 mm, un diámetro interior de 0,86 mm y un filamento interno. Tire de la punta de un extractor de micropipetas (Figura 3B).
- Para dar forma y pulir la punta de la pipeta, coloque un cable caliente cerca de la punta durante un momento. Realice este proceso de pulido al fuego con un aumento de 100x utilizando un pulidor de pipetas (Figura 3C, D).
- Asegúrese de que el diámetro interior de la punta de la pipeta sea de ~2 μm antes del pulido al fuego y se reduzca a ~0,5 μm después del pulido adecuado.
NOTA: Solo se recomienda el uso de pipetas recién extraídas el día de la grabación. Esto evita la acumulación de partículas de polvo en la punta de la pipeta.
2. Configuración de la plataforma
- Montaje de la cámara de registro
- Utilice una cámara de perfusión en forma de diamante de bajo volumen con flujo laminar y tasas de intercambio de solución relativamente rápidas (Figura 4). Conecte la cámara a través de un colector a un sistema de perfusión alimentado por gravedad (Figura 5).
- Para perfundir una solución a través de la cámara de registro, ensamble un sistema de perfusión simple alimentado por gravedad con un colector de politetrafluoroetileno que conecta la cámara de perfusión a ocho líneas de perfusión separadas.
NOTA: El tubo no debe lixiviar plastificantes en las soluciones, ya que dichos productos químicos pueden afectar significativamente la función normal de los espermatozoides60 y alterar la actividad de los canales iónicos 61,62 . Se recomienda encarecidamente un tubo de politetrafluoroetileno de diámetro pequeño como tubo de perfusión principal. - Como la tubería de politetrafluoroetileno es bastante rígida, haga conexiones flexibles con tubería de silicona de alta pureza que se ajuste sobre la tubería de politetrafluoroetileno. Además, use jeringas (por ejemplo, del tipo jeringa Luer Lock) que carezcan de lubricante, ya que el aceite mineral u otros aditivos lubricantes pueden interferir con el registro de los canales iónicos (Figura 5).
- Montaje de un puente de agar
- Para evitar cambios en el potencial de unión líquida durante los registros, mantenga estable el entorno alrededor del electrodo de referencia mediante el uso de un puente de agar (Figura 4).
- Para hacer un puente de agar, haz un capilar de vidrio en forma de L doblándolo bajo un pequeño fuego de mechero Bunsen y deja que se enfríe.
- Prepare una solución de agarosa al 1% en 1 M de KCl y caliéntela en un microondas hasta que la agarosa se derrita y la solución se vuelva transparente. Llene con cuidado el capilar de vidrio en forma de L con la solución anterior para evitar burbujas de aire y deje que se enfríe a temperatura ambiente. Los puentes de agar se pueden almacenar en 1 M KCl durante ~2 meses a +4 °C.
- Para utilizar un puente de agar, llene un electrodo de referencia de pellets de Ag/AgCl con 1 M KCl e inserte el puente de agar con cuidado para evitar que la agarosa solidificada se salga del capilar de vidrio.
- A continuación, inserte el pin de oro (2 mm) del cable de la etapa principal del amplificador en la ranura del electrodo de referencia de 2 mm (oro) e inserte el extremo del puente de agar en forma de L en la cámara de perfusión como se muestra en la Figura 4.
- Soluciones y recetas
NOTA: Todos los reactivos y productos químicos deben ser de la más alta pureza. Todas las soluciones preparadas se filtran a través de un filtro PES estéril de 0,22 μm y se almacenan a 4 °C durante un máximo de un mes. Debe tenerse en cuenta que el ajuste exacto de la osmolaridad es un requisito previo para el éxito del pinzamiento del parche.- Prepare la solución de fluido tubular humano (HTF) como se describe en la Tabla 1. Ajusta el pH a 7,4 con NaOH. La osmolaridad debe ser de 280 ± 5 mOsm, medida con un osmómetro de presión de vapor.
- Prepare una solución salina alta (HS) en "baño" o "extracelular" como se indica en la Tabla 2. Ajusta el pH a 7,4 con NaOH. La osmolaridad debe ser de 320 ± 5 mOsm.
- Prepare el "baño" o la solución "extracelular" de metanosulfonato de cesio como se describe en la Tabla 3. Ajustar el pH a 7,4 con CsOH y la osmolaridad a 320 ± 5 mOsm.
- Para preparar la solución de "pipeta" intracelular de metanosulfonato de cesio (CsMeSO3), siga la Tabla 4 y ajuste el pH a 7,4 con CsOH. La osmolaridad debe ser hasta 10 mOsm más alta que la solución HS.
3. Aislamiento y purificación de espermatozoides de mamíferos
NOTA: Eutanasiar ratones machos C57BL/6 de 3-6 meses de edad mediante inhalación de CO2 seguida de luxación cervical. Después de la luxación cervical, realice la recolección de tejido (cauda o cuerpo epidídimo) de ratones inmediatamente.
- Aislamiento de espermatozoides de ratón epididimarios
NOTA: Eutanasiar ratones machos C57BL/6 de 3-6 meses de edad mediante inhalación de CO2 seguida de luxación cervical. Después de la luxación cervical, realice la recolección de tejido (cauda o cuerpo epidídimo) de ratones inmediatamente.- Abra el área abdominal inferior del ratón con unas tijeras y extraiga ambos epidídimos.
- Colocarlos en una placa de cultivo celular de 35 mm llena de solución HS (solución salina alta, ver Tabla 2). Asegúrese de que una alícuota de la solución HS esté precalentada a temperatura ambiente antes de entrar en contacto con los espermatozoides.
- Transfiera los epidídidos a una nueva placa de cultivo celular que contenga una solución de HS y elimine completamente toda la grasa residual.
- Separe los epidídimos en caput, cuerpo y cauda con una hoja de bisturí #15 (Figura 6).
- Transfiera el cuerpo (o cauda si es necesario) de cada epidídimo a una nueva placa de cultivo celular que contenga una solución de HS. Haga múltiples incisiones en la parte aislada del epidídimo con una hoja de bisturí puntiaguda #11.
- Transfiera las partes de los epidídimos con múltiples incisiones a un tubo de microcentrífuga de 1,5 mL que contenga 1,5 mL de solución HS.
- Agite brevemente los espermatozoides del epidídimo y colóquelos en la solución con pinzas superfinas de Dumont tipo 5a. Deseche los epidídidos y deje el tubo a temperatura ambiente durante 10 min.
- Espere hasta que la materia sólida (no espermatozoides) se sedimente en el fondo del tubo y luego transfiera el sobrenadante a otro tubo de microcentrífuga de 1,5 mL.
- Almacene la mezcla de esperma a temperatura ambiente con acceso al aire durante un máximo de 2 horas, tiempo durante el cual se pueden realizar los experimentos. Los espermatozoides aislados pierden su rendimiento 3 h después del aislamiento.
- Capacitación de espermatozoides de ratón
NOTA: Todos los espermatozoides del epidídimo son adecuados para la pinzamiento de parches, pero solo los espermatozoides del epidídimo de la cola son lo suficientemente maduros como para ser competentes para la fertilización. Dado que los espermatozoides caudales pueden someterse a capacitación, realice experimentos, en particular la capacitación de los espermatozoides, utilizando espermatozoides caudales.- Realizar la recolección de espermatozoides en espermatozoides caudales o eyaculados (ver pasos 3.1.1-4).
- Tome caudas aisladas como se describe en el paso 3.1.4. y aplique múltiples incisiones como se describe en el paso 3.1.5. Transfiera las caudas a una placa de cultivo celular de 10 mm con 2 mL de solución de capacitación.
- Incubar el tejido caudal en esta solución de capacitación inicialmente durante 10 minutos a 37 °C y 5% de CO2, luego desechar el tejido e incubar los espermatozoides liberados durante otros 50-80 minutos.
NOTA: La capacitación in vitro de los espermatozoides caudales de ratón se logra mediante una incubación de 60-90 min. Los espermatozoides capacitados se identifican visualmente en función de la flexión asimétrica excesiva de sus flagelos, conocida como hiperactivación. Este tipo de motilidad permite a los espermatozoides nadar de manera no lineal.
- Recolección y purificación de esperma humano
NOTA: En este caso, se obtuvieron muestras de semen fresco de un total de 21 voluntarios sanos de 21 a 38 años y espermatozoides purificados mediante la técnica de swim-up a temperatura ambiente, como se describe en detalle en48,63. Brevemente, el procedimiento es el siguiente:- Deje las muestras de eyaculación humana a temperatura ambiente durante 60 minutos para permitir la licuefacción antes de purificarlas (las duraciones más largas pueden afectar negativamente la calidad del esperma).
- Precaliente unos 7 mL de solución HTF a 37 °C en un tubo de centrífuga de 50 mL. Evalúe visualmente el volumen del eyaculado: si el volumen es superior a 1 mL, prepare varios tubos de solución HTF.
- Aplique cuidadosamente 1 ml de eyaculado licuado en el fondo de cada tubo sin levantar las hebras de semen a la superficie del tampón. La interfaz entre el semen y el HTF debe ser lo más clara posible. Evite las burbujas de aire.
- Coloque los tubos en una incubadora a 37 °C durante 1 h en un soporte que los mantenga en un ángulo de 45° para obtener la máxima superficie. Si la incubadora es una incubadora de CO2 , cierre bien la tapa para evitar la acidificación del tampón (no se requiere CO2 para este procedimiento). Durante la incubación, los espermatozoides móviles nadarán gradualmente hacia la superficie del tampón HTF.
- Después de 1 hora, recoja la fracción superior de 1 mL de todas las muestras en un tubo de centrífuga de 15 mL, combinando así los espermatozoides altamente móviles y de la más alta calidad para el pinzamiento del parche. No intente eliminar todo el sobrenadante, deje varios mL de HTF por encima del plasma seminal para evitar la contaminación. La suspensión celular purificada se puede almacenar a temperatura ambiente durante varias horas.
NOTA: Un eyaculado normal debe contener al menos 15 x 106 espermatozoides por mL64, pero los recuentos de espermatozoides varían ampliamente entre las muestras. El obstáculo de un recuento bajo de células puede superarse dejando reposar la suspensión de esperma purificada durante 30-60 minutos a temperatura ambiente antes de la pinzación del parche. En esta condición, las células se acumularán gradualmente en el fondo del tubo de centrífuga y formarán una nube de células visible desde la que se pueden pipetear las células en la cámara de registro (ver más abajo).
- Capacitación de espermatozoides humanos
NOTA: La capacitación in vitro de espermatozoides humanos puede lograrse mediante una incubación de 4 h en solución de capacitación: 20% de suero fetal bovino, 25 mM de NaHCO3 en tampones HTF o HS 48,51 . Los espermatozoides capacitados se pueden identificar visualmente en función de su motilidad vigorosa y la flexión asimétrica excesiva de los flagelos que permite a los espermatozoides nadar de manera no lineal.- Prepare una solución de capacitación 2x y mezcle 1:1 con la suspensión de espermatozoides.
- Realizar la incubación a 37 °C y 5% de CO2 durante un mínimo de 4 h. Para garantizar un alto porcentaje de células capacitadas, el tiempo de incubación no debe ser inferior a 4 h.
4. Preparación de la solución de recubrimiento (solo necesaria para la pinza de parche de esperma humano)
NOTA: Un paso esencial es levantar el espermatozoide adjunto del cubreobjetos antes del rodaje. Este paso solo es necesario para los espermatozoides humanos y requiere un recubrimiento del cubreobjetos de vidrio para crear una superficie de vidrio menos adhesiva. El recubrimiento de cubreobjetos reduce la probabilidad de que los espermatozoides se adhieran al cubreobjetos y permite que los espermatozoides humanos se levanten del cubreobjetos de vidrio después de la formación exitosa de gigasellos.
- Diluir 200 μL del eyaculado en 5 mL de solución HS en un tubo de centrífuga de 15 mL.
- Girar a 300 x g durante 5 min y eliminar el sobrenadante.
- Vuelva a suspender el pellet en 1 mL de solución HS y transfiéralo a un tubo de microcentrífuga.
- Sonicar durante 10 min a 25 °C utilizando un baño de sonicación lleno de agua.
- Girar a 10.000 x g durante 5 min.
- Transfiera el sobrenadante a un tubo de microcentrífuga nuevo y utilícelo para el recubrimiento (instrucciones a continuación).
5. Registro de la conductancia iónica de toda la membrana plasmática de los espermatozoides.
- Adherir esperma al cubreobjetos.
NOTA: Antes del registro del parche-pinzamiento, los espermatozoides se colocan en cubreobjetos redondos de 5 mm.- Si trabaja con células humanas, sumerja brevemente los cubreobjetos en la solución de recubrimiento preparada con pinzas afiladas.
- Coloque cuatro cubreobjetos en un solo pocillo de una placa de 4 pocillos y cúbralos con 300 μL de solución HS. Evite que los deslizamientos de la cubierta floten pegándolos con cinta adhesiva a la parte inferior de la placa de 4 pocillos, empujándolos con la punta de plástico de una pipeta.
- Vuelva a suspender suavemente las suspensiones concentradas de espermatozoides humanos (paso 3.3.5) o de ratón (paso 3.1.9) del tubo de almacenamiento (20-50 μL de esperma concentrado) en 300 μL de solución HS por encima del cubreobjetos.
- Asegúrese de que los espermatozoides se acumulen en el fondo del pocillo, donde sus cabezas se unirán al cubreobjetos y sus flagelos latirán vigorosamente en la solución justo por encima del cubreobjetos. Es importante dejar que los espermatozoides se sedimenten en el cubreobjetos durante unos 10 minutos a temperatura ambiente antes de registrar.
NOTA: Si los espermatozoides humanos se adhieren mal, vuelva al paso 5.1.1 y diluya la solución de recubrimiento preparada con una solución HS (1:20 hasta 1:2). Este paso debe ajustarse a muestras de esperma de diferentes donantes humanos en función de la motilidad variable de los espermatozoides que es común en las preparaciones de esperma humano.
- Colocación de la cubierta
- Tome un cubreobjetos con celdas ligeramente adheridas del pocillo y colóquelo en un pocillo en forma de diamante de la cámara de registro que contenga la solución de HS (Figura 4).
- Encienda el sistema de perfusión (Figura 5) lleno de solución HS para enjuagar la cámara y eliminar los residuos y el exceso de espermatozoides desprendidos de la cámara. Esto aumentará la probabilidad de que la pipeta registradora permanezca limpia cuando llegue a las células. Este paso es útil cuando se trabaja con celdas no capacitadas que tienden a adherirse más fuerte al cubreobjetos.
NOTA: Si se graba con esperma capacitado, se debe evitar encender la perfusión inmediatamente después de colocar un cubreobjetos nuevo en la cámara. Los espermatozoides capacitados tienen una motilidad vigorosa y solo se adhieren débilmente al cubreobjetos. Por lo tanto, para garantizar que haya el mayor número de espermatozoides capacitados disponibles, es importante esperar ~ 10 minutos y dejar que los espermatozoides capacitados se adhieran al cubreobjetos antes de activar la perfusión. Una vez que se elige la célula capacitada adecuada y se forma un gigasello, se puede volver a activar la perfusión.
- Selección de un espermatozoide para el registro del patch-clamp.
- Encuentre un espermatozoide adecuado con una gota citoplasmática utilizando un aumento de 600x (ver más abajo). Esto se hace utilizando una len de inmersión en agua de 60x como se describe en los métodos con un ocular de aumento de 10x. En los espermatozoides aislados del cuerpo epidídimo, el CD suele localizarse cerca del centro de la pieza media. En las células caudales, el CD generalmente se puede encontrar cerca del anillo (Figura 2C). En el caso de los espermatozoides humanos, el CD se encuentra en la región del cuello (Figura 2A, B).
NOTA: Además, la opción de aumento extraíble de 1,6x del microscopio se puede utilizar para examinar de cerca la morfología de los espermatozoides (aumento de 960x). - Asegúrese de que la gota citoplasmática sea ovalada y tenga una forma ligeramente alargada (Figura 2G), similar a un huso. Los CD que parecen muy redondos y agrandados suelen ser frágiles y poco adecuados para parchear (Figura 2D, F).
- Seleccione un espermatozoide que sea móvil con la cabeza unida al cubreobjetos, de modo que el espermatozoide quede parcialmente fijado, pero el CD y el resto del flagelo continúen moviéndose con el latido flagelar. Asegúrese de que la cabeza del espermatozoide esté unida sin apretar al cubreobjetos para que gire un poco a medida que el flagelo se mueve de un lado a otro.
NOTA: La fijación suelta es importante ya que después de la formación del sello de gigaohmios y antes de la transición al modo de célula completa, el espermatozoide debe levantarse del cubreobjetos a la solución.
- Encuentre un espermatozoide adecuado con una gota citoplasmática utilizando un aumento de 600x (ver más abajo). Esto se hace utilizando una len de inmersión en agua de 60x como se describe en los métodos con un ocular de aumento de 10x. En los espermatozoides aislados del cuerpo epidídimo, el CD suele localizarse cerca del centro de la pieza media. En las células caudales, el CD generalmente se puede encontrar cerca del anillo (Figura 2C). En el caso de los espermatozoides humanos, el CD se encuentra en la región del cuello (Figura 2A, B).
- Formando un gigaseal
NOTA: Para registrar las corrientes monovalentes de CatSper en el modo de celda completa, las pipetas se llenan con una solución de Cs-metanosulfonato (también conocida como pipeta o intracelular) (Tabla 4), lo que produce una resistencia de pipeta de 11-17 MΩ (Figura 7A), calculada automáticamente por el amplificador al aplicar un paso de voltaje de 0 mV a 10 mV. Las pipetas también se pueden llenar con otras soluciones dependiendo de la aplicación. Se recomienda que las soluciones se fabriquen con aniones móviles como el metanosulfonato, el Cl- , el aspartato o iones similares para reducir la resistencia de la pipeta. La osmolaridad de la solución de pipeta debe ser hasta 10 mOsm más alta que la solución de baño. Una tonicidad ligeramente mayor de la solución de pipeta ayuda a mantener la resistencia de acceso a los espermatozoides lo más baja posible durante el registro de patch-clamp.- Después de seleccionar visualmente un espermatozoide con una morfología adecuada (Figura 2G), llene la micropipeta con una solución de pipeta (Tabla 4) y asegúrela en el soporte de pipetas.
- Para mantener la punta de la pipeta limpia de residuos, aplique presión positiva a la pipeta utilizando el conjunto en forma de tubo en U para asegurarse de que la solución de pipeta fluya fuera de la punta después de sumergirla en la solución extracelular, también denominada a continuación solución de "baño" (consulte la Tabla 2).
NOTA: Si las condiciones lo permiten, se recomienda encarecidamente la formación del sello bajo perfusión constante, ya que esta condición garantiza la punta de pipeta más limpia. - Baje la pipeta y sumerja su punta en la solución de baño (Tabla 2). En este momento, se puede medir la resistencia de la pipeta (Figura 7A).
- Para visualizar claramente la célula, coloque la punta de la pipeta sobre el CD con la abertura de la punta alineada en diagonal (aproximadamente 45°) hacia el CD.
- Baje rápidamente la punta de la pipeta hacia el CD para que quede en el mismo plano focal, a unos pocos μm del CD.
- Tan pronto como la punta de la pipeta toque el CD, aplique presión negativa a la pipeta usando la "boquilla" para mover parte de la gota hacia la punta y formar un sello de gigaohmios, también conocido en electrofisiología como "evento de succión". Por lo general, después del contacto inicial con la punta de la pipeta, la presión negativa en la pipeta se puede mantener hasta un minuto para lograr gradualmente un sellado de gigaohmios.
- Después de la formación exitosa del sello de gigaohmios (> 4-20 GΩ), levante el espermatozoide del cubreobjetos (Figura 7B).
NOTA: Este paso no es necesario para los espermatozoides de roedores debido a su longitud; Sin embargo, el desprendimiento parcial del flagelo espermático es beneficioso para aliviar la posible deriva de la pipeta. El desprendimiento de esperma humano es un paso esencial, ya que el CD es pequeño (1 ~ 3 μm); si la célula se deja unida al cubreobjetos, incluso una ligera deriva de la pipeta durante el experimento puede interrumpir el CD. Después de que se levanta el espermatozoide, su flagelo normalmente continúa latiendo, mientras que la célula está unida solo a la micropipeta.
- Adaptación y transición al modo de célula completa.
- Compense los transitorios de capacitancia parásita utilizando el modo compensatorio del amplificador antes de pasar al modo de celda completa (Figura 7B). Para observar inicialmente los transitorios de capacitancia, mantenga el potencial de membrana a 0 mV y aplique pulsos de 10 mV utilizando la herramienta "Prueba de membrana" (Figura 7B).
- Realice un rodaje y una transición al modo de celda completa aplicando pulsos de voltaje cortos (1 ms) que aumentan gradualmente (430-650 mV, incremento de ~50 mV) combinados con una succión muy ligera (Figura 7C).
NOTA: Para aplicar pulsos de rodaje , utilice el protocolo de rodaje previamente programado dentro del software de la abrazadera de parche. Los pulsos de voltaje de rodaje se aplican al espermatozoide utilizando la entrada de comando de alto voltaje (conmutada traseramente) en la parte posterior del amplificador. - Después de la aplicación de cada pulso de voltaje de rodaje, inicie la herramienta de prueba de membrana para verificar si aparecen transitorios de capacitancia más grandes.
NOTA: La presencia de transitorios de capacitancia grandes (Figura 7C) indica que se ha producido el rodaje y se está midiendo toda la capacitancia de la célula (~1 pF para el esperma humano y ~2,5 pF o más para el esperma murino). - Ajuste los transitorios de capacitancia grandes utilizando la herramienta de prueba de membrana para determinar la capacitancia de toda la celda, así como su resistencia de acceso.
NOTA: La resistencia de acceso debe ser lo más baja posible para una perfusión eficiente del interior del espermatozoide con la solución de micropipeta, así como para una pinza de voltaje confiable de la membrana plasmática de espermatozoides. La resistencia de acceso suele ser de 25-30 MΩ y 50-70 MΩ para soluciones intracelulares basadas en Cs+ /K+ y NMDG, respectivamente. - Después de un rodaje exitoso, proceda con los experimentos planificados de fijación de parche de celda completa, como la aplicación de varias soluciones de baño (Figura 8) que contienen diferentes compuestos o la medición de las actividades del canal utilizando protocolos de paso de voltaje (Figura 8, Figura 9) o de rampa de voltaje. Si el robo no se ha realizado correctamente, vuelva al paso 6.4.1. eligiendo una micropipeta nueva y seleccionando otro espermatozoide adecuado.
Resultados
El método de pinza de parche de esperma permite el registro directo del canal CatSper.
Como se mencionó anteriormente, los registros de CatSper se realizaron estableciendo un sello de alta resistencia (gigaohmios) entre la pipeta de parche y el espermatozoide de mamífero en su gota citoplasmática. Al entrar y pasar al modo de célula completa, se obtiene un acceso eléctrico completo a todo el cuerpo del espermatozoide y su interior, incluida la cabeza del espermatozoide y el flagelo 2,8,39,51. En última instancia, esta condición permite el registro de cualquier canal iónico activo ubicado en la membrana plasmática de los espermatozoides. Es preferible una solución de baño nominalmente libre de divalente (DVF) que contenga cesio o sodio como ion permeado principal para el registro de corrientes CatSper monovalentes 2,8,39,51. Si bien el canal CatSper conduce iones divalentes como Ca2+ y Ba2+, se mueven a través del poro CatSper a un ritmo mucho más lento, lo que resulta en conductancias apenas detectables de unos pocos picoamperios (~10-20 pA)2,8,39,51. Por lo tanto, la medición de corrientes monovalentes y, por lo tanto, más grandes, a través del canal CatSper es una forma más conveniente de evaluar la corriente (Figura 8). Es importante tener en cuenta que CatSper también es permeable al potasio; por lo tanto, se debe bloquear el canal CatSper, o se deben usar espermatozoides deficientes en CatSper en situaciones en las que se desea estudiar solo los canales de potasio de los espermatozoides 2,3,8,28,65. Al variar la composición iónica de la pipeta y la solución de baño, se pueden excluir selectivamente ciertos canales iónicos, al tiempo que se crean condiciones para el registro selectivo de solo tipos específicos de canales iónicos. Por ejemplo, la adición de Cs+ a la solución de pipeta da como resultado el bloqueo de la permeabilidad iónica a través de los canales de potasio de los espermatozoides.
El canal CatSper está regulado de manera diferente entre las especies de mamíferos.
Los espermatozoides de diferentes especies son diversos en su morfología y vías reguladoras internas66. No es de extrañar que sus canales iónicos también estén regulados de manera única de manera que reflejan los microambientes especializados de los tractos reproductivos masculinos y femeninos. El método de patch-clamp de esperma se ha aplicado con éxito a seis especies de mamíferos: murino2, rata56, humano39,51, bovino, jabalí y macaco41 como se muestra en la Figura 9. Para estos experimentos, se obtuvieron espermatozoides de macacos rhesus machos adultos [Macaca mulatta] del Centro Nacional de Investigación de Primates de California de acuerdo con los estándares de la Asociación para la Evaluación y Acreditación de Cuidado de Animales de Laboratorio Internacional (AAALAC) bajo protocolos animales aprobados por la Universidad de California, Davis, como se describe en41; y todos los estudios se llevaron a cabo de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud de EE. UU. El semen de toro y verraco se obtuvo como subproductos exentos de la aprobación específica de la IACUC por parte de las instalaciones del Departamento de Ciencia Animal de la UCD, y todos los animales se mantuvieron en instalaciones aprobadas por la AAALAC. El semen de toro y verraco también se puede obtener de fuentes comerciales.
Los espermatozoides de primates (macacos Rhesus) y humanos mostraron propiedades y regulación similares del canal CatSper. Curiosamente, la activación de la progesterona de CatSper parece ser exclusiva de los espermatozoides de primates (Figura 9 y 41), ya que los espermatozoides de verracos, toros y roedores no mostraron ninguna alteración estimulada por la progesterona de sus corrientes de CatSper. En los espermatozoides de toros y verracos, incluso la actividad basal de los canales CatSper estuvo por debajo de los límites detectables (Figura 9), lo que sugiere que en estas especies, la afluencia de calcio y la consiguiente hiperactivación es impulsada por otros canales/transportadores, o que se necesita un estimulador natural diferente para la activación de sus canales CatSper. En todas las especies de espermatozoides mencionadas aquí, incluidos los espermatozoides de toro y jabalí, se obtuvo el acceso eléctrico completo al interior de los espermatozoides y las células se registraron en el modo de célula completa, como fue evidente por la aparición de los grandes artefactos de capacitancia al rodar (Figura 7). Esta condición permite un fácil registro del canal CatSper funcional, y su ausencia en los espermatozoides de verracos y bovinos indica que, o bien este canal está bloqueado por un inhibidor endógeno aún desconocido presente en los espermatozoides de estas especies o bien requiere un modulador específico para ser activado. Sin embargo, estos son experimentos preliminares y se requerirán experimentos adicionales con espermatozoides de verraco y toro para garantizar la importancia funcional del canal CatSper en estas especies. Este amplio espectro de diversidad de canales iónicos espermáticos entre especies podría estar relacionado con la proporción de espermatozoides a tamaño de óvulo, la relación entre el tamaño de los espermatozoides y las vestiduras protectoras de óvulos, o servir como barrera para la fertilización por otras especies66.

Figura 1: Diversidad morfológica de los espermatozoides de mamíferos. (A) Panel inferior: representación esquemática de un espermatozoide; Los compartimentos celulares están etiquetados. Paneles superiores: Imágenes DIC de espermatozoides de diferentes especies en el sentido de las agujas del reloj: rata (Rn; Rattus norvegicus); ratón (mm; Mus musculus); toro (Bt; Bos tauro); jabalí (Sd; sus scrofa domesticus); humano (Hs; Homo sapiens) y macaco rhesus (Mmu; Macaca mulata). La barra de escala se aplica a todas las imágenes DIC. Los insertos indican gotitas citoplasmáticas. (B) Parche de los espermatozoides de mamíferos. Para lograr una formación exitosa de sellado entre la punta de la pipeta y la membrana plasmática, parte de la membrana plasmática se aspira suavemente en la punta de la pipeta. La transferencia al modo de célula completa se realiza rompiendo la membrana plasmática entre la punta y la célula (esta figura se ha reproducido a partir de la8). Panel derecho: espermatozoides humanos conectados a una micropipeta de grabación. (C) Representación esquemática de los espermatozoides humanos y algunos de los canales iónicos flagelares estudiados en espermatozoides humanos con el método de patch clamp, así como los iones que conducen. CatSper- canal iónico de calcio39,51; Hv1- canal de protones 51,56,67; Slo3/Slo1- canales de potasio 50,53,65,68; TRPV4- Receptor de potencial transitorio canal catiónico vaniloide tipo 448. Haga clic aquí para ver una versión más grande de esta figura.
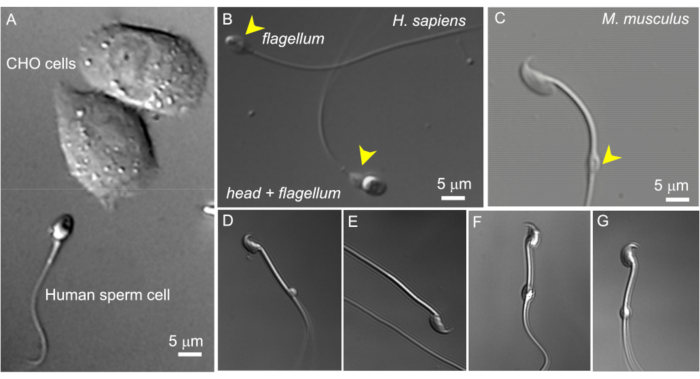
Figura 2: Tamaño de los espermatozoides y morfología variable de las gotas citoplasmáticas. Las imágenes DIC de espermatozoides vivos intactos. (A) Comparación del tamaño de un espermatozoide humano (abajo) y dos células CHO (arriba). (B) Espermatozoide humano (Homo sapiens) intacto (abajo) y un espermatozoide sin cabeza (flagelo, arriba). Las gotitas citoplasmáticas se indican con puntas de flecha amarillas; Esta cifra se ha reproducido de8. (C) Espermatozoide murino (Mus musculus) intacto con las gotas citoplasmáticas (CD) de forma normal indicadas por la punta de flecha amarilla. (D-G) Los espermatozoides murinos del epidídimo tienen gotitas citoplasmáticas de diferentes tamaños y formas; solo (C) y (G) son adecuados para la abrazadera de parche. (D) La CD es microscópica y unilateral; (E) Falta el CD; (F) El CD tiene partículas en su interior que pueden obstruir la pipeta de grabación; (G) La CD es lisa, uniforme y no está hinchada. Formar un gigaseal con este tipo de CD probablemente resultará en una grabación exitosa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Componentes del equipo de sujeción de parche de espermatozoide. (A) Equipo típico de electrofisiología de esperma con componentes esenciales: (1) microscopio invertido; (2) digitalizador de bajo ruido; (3) amplificador; (4) micromanipulador de baja deriva que se acopla al microscopio invertido con una plataforma de micromanipulador; (5) computadora PC; (6) una mesa de aire que amortigua las vibraciones; (7) Jaula de Faraday para proteger la configuración de interferencias eléctricas ambientales. Es esencial que todos los componentes eléctricos del equipo, incluidos el teclado y el mouse de la computadora, produzcan poco o ningún ruido eléctrico (50 Hz o 60 Hz) y que todos los componentes del equipo estén correctamente conectados a tierra. (B) Extractor de micropipetas utilizado para registrar la fabricación de pipetas. (C) (1) microForge utilizado para el pulido al fuego de pipetas; (2) Capilares de vidrio de borosilicato con diámetro exterior de 1,5 mm, diámetro interior de 0,86 mm y un filamento interno; (3) Caja de recogida de pipetas. (D) Etapas del pulido al fuego de la pipeta: (a) Pipeta sin pulir con un diámetro interior de 2 mm; b) Pipeta pulida al fuego con un diámetro interior de 0,5 mm; (c) Pipeta sellada demasiado pulida que no es adecuada para la grabación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Componentes del sistema de cámara de registro y su montaje. (A) Componentes esenciales del sistema de cámara de registro: (1) adaptador de platina de microscopio para plataformas de la serie 20 con (2) dos pinzas de sujeción de etapa; (3-4) plataforma térmica magnética de la serie PM con (3) abrazaderas magnéticas para sujetar la cámara de perfusión; (5) cámara de perfusión; (6) puente de agar; (7) pinza magnética, electrodo de referencia con conector de 2 mm a pellet de Ag / AgCl; (8) soporte magnético (MAG-1) para la línea de succión; (9) tubo de succión; (10) Soporte tórico del tubo de succión. (B) Sistema de cámara de registro ensamblado con los componentes indicados de (A). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Componentes del sistema de perfusión. (A) Línea de perfusión ensamblada y (B) sus componentes esenciales: (1) jeringas de 20 mL y 3 mL; (2) llave de paso con conexiones Luer; 4 vías; cerradura macho; (3) adaptador de lengüeta de manguera Luer hembra, 1/16"; (4) Tubo de perfusión de politetrafluoroetileno (PTFE) (tubo de PTFE de microdiámetro, 0,022" de diámetro interno × 0,042" de diámetro exterior); (5) Colector de perfusión de politetrafluoroetileno de 8 posiciones; (6) Tubo conector de silicona (tubo de silicona curado con platino, 1/32" de diámetro interno × 3/32" de diámetro exterior); (7) Tubo del conector del colector (tubo de PTFE, 1/32" de diámetro interno × 1/16" de diámetro exterior). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Disección de ratones machos. (A) Órganos reproductores masculinos murinos; Se muestran tanto el testículo como el epidídimo. (B) Los epidídimos se transfieren a una placa de cultivo celular de 35 mm que contiene solución de HS y se eliminan la grasa residual y los conductos deferentes. (C) A continuación, cada epidídimo se divide en caput, cuerpo y cola utilizando una hoja de bisturí #15. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Formación de gigasellos y rodaje con el espermatozoide murino. La interfaz de la herramienta "Prueba de membrana" del software comercial de fijación de parches. Tres etapas de pinzamiento del parche espermatozoide: (A) la pipeta registrada se sumerge en una solución HS de baño que produce una resistencia a la pipeta de 14,8 MΩ; (B) Se forma un gigasello (la resistencia es de 4,7 GΩ), se compensan los transitorios de capacitancia y se levanta el espermatozoide del cubreobjetos; (C) Transición al modo de célula completa. El rodaje y la transición al modo de celda completa se realizan aplicando pulsos de voltaje cortos (1 ms) que aumentan gradualmente (430-650 mV, ~50 mV en incrementos) combinados con una succión ligera, como se muestra a la izquierda. El rodaje se ha producido, como es evidente por la aparición de los grandes transitorios de capacitancia que reflejan toda la capacitancia de la célula (~2,93 pF para este espermatozoide). Haga clic aquí para ver una versión más grande de esta figura.
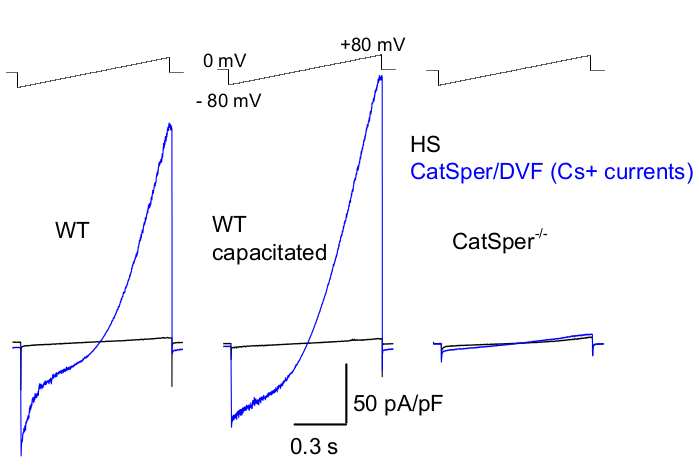
Figura 8: Registro murino de CatSper de espermatozoides cauda epididimarios, capacitados y CatSper knockout de tipo salvaje (WT). Para registrar la actividad monovalente de CatSper, se aplica un protocolo de rampa cada 5 s y las corrientes de CatSper provocadas por rampas de voltaje a partir de un potencial de retención de 0 mV39,51. Las rampas de voltaje (-80 mV a 80 mV; 850 ms) se aplican en HS y en solución nominalmente libre de divalente (DVF). Los datos se muestrearon a 2-5 kHz y se filtraron a 1 kHz. Las corrientes de referencia se registran en la solución HS, que no produce corriente CatSper debido a la inhibición por magnesio extracelular39,51 con alto contenido de magnesio. Las corrientes de referencia son útiles para estimar la conductancia de fuga (vías de canal no iónico). Densidades representativas de corriente CatSper de células enteras Cs+ (pA/pF; azul) registradas a partir de espermatozoides murinos caudales WT (no capacitados; izquierda y capacitados; centro) y espermatozoides murinos caudales deficientes en CatSper (derecha). Las corrientes fueron provocadas por rampas de voltaje desde un potencial de retención de 0 mV y las rampas se aplicaron de -80 mV a 80 mV en HS y solución nominalmente libre de divalente. Corrientes de referencia (negras) registradas en la solución HS. Para obtener las densidades de corriente, las amplitudes de corriente de CatSper se normalizaron a la capacitancia de la celda (pA/pF). Haga clic aquí para ver una versión más grande de esta figura.
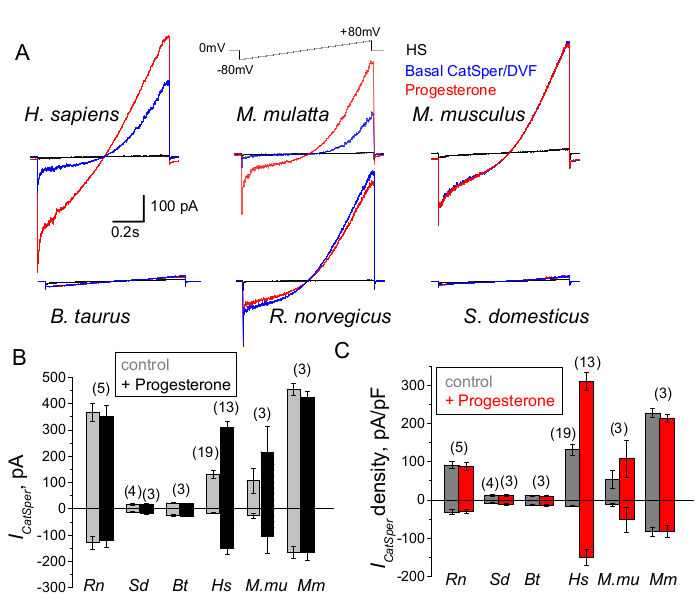
Figura 9: Regulación de la progesterona de CatSper en diferentes especies de mamíferos. (A) Corriente representativa de CatSper provocada por espermatozoides de diferentes especies mediante un protocolo de rampa de voltaje como se indica. Especie: humana (Hs; H. sapiens); Macaco rhesus (Mmu; M. mulatta), ratón (Mm; M. musculus), toro (Bt; B. tauro); rata (Rn; R. norvegicus); jabalí (Sd; S. scrofa domesticus). Se registraron las corrientes de CatSper en ausencia (azul) y presencia (rojo) de 1 mM de progesterona, así como las corrientes basales en solución HS (negro). (B) Amplitudes de corriente CatSper (ICatSper, pA) y (C) Densidades de corriente promedio (pA/pF) registros de espermatozoides de diferentes especies, según se indique; n indica el número de espermatozoides individuales utilizados. Los datos son Mean +/- S.E.M. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Diferencia en la motilidad flagelar. Dos ejemplos representativos de gotitas citoplasmáticas y motilidad flagelar. Las imágenes superpuestas de los mismos espermatozoides de rata (Rn) y humanos (Hs) se tomaron en dos momentos diferentes cuando muestran la deflexión flagelar más distal. Los rectángulos punteados indican la región con gotas citoplasmáticas y su correspondiente movilidad espacial. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Conjunto del tubo en U y sus componentes esenciales. (A) Componentes del tubo en U: (1) pipeta serológica de 10 mL; (2) Tubo de silicona; (3) Tubo conector de silicona; (4) jeringa de 1 ml; (5) Adaptador de lengüeta luer hembra; (6) adaptador de bloqueo integral Luer macho de 1/8"; (7) llave de paso con conexiones Luer; 4 vías; cerradura macho; (8) adaptador de lengüeta macho de la serie Luer, 1/16". (B) Tubo en U completamente ensamblado y (C) Tubo en U unido a la jaula de Faraday. Haga clic aquí para ver una versión más grande de esta figura.
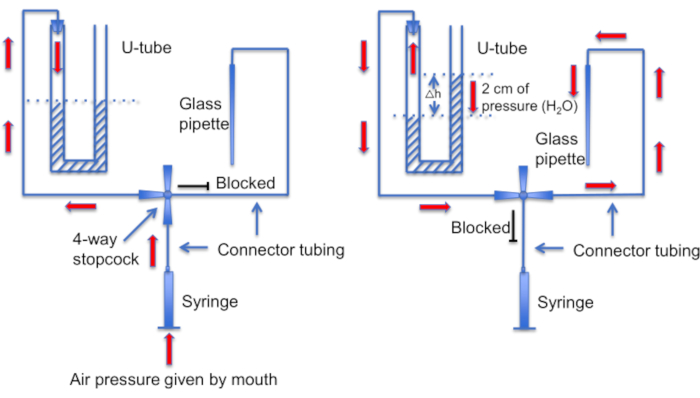
Figura 12: Una representación esquemática del conjunto del tubo en U. Panel izquierdo: La presión de aire positiva es proporcionada por la boca para crear una diferencia en los niveles de líquido en el tubo en U. El nivel de líquido en el cuerno derecho aumenta en 2 cm. Una vez creada esta diferencia de nivel, se gira la llave de paso para conectar el tubo en U a la línea que conduce a una pipeta de grabación. Panel derecho: el nivel de líquido más alto en la bocina derecha crea una presión positiva que empuja constantemente la solución de pipeta fuera de la punta de la pipeta y mantiene la punta limpia de residuos. Haga clic aquí para ver una versión más grande de esta figura.
| Productos químicos | Peso molar (g/mol) | milímetro | g para 1L |
| NaCl | 58.44 | 97.8 | 5,72 g |
| Kcl | 74.55 | 5 | 0,373 g |
| KH2PO4 | 136.09 | 0.37 | 50,4 mg |
| MgSO4 x 7.H2O | 246.48 | 0.2 | 49,3 mg |
| CaCl2 x 2.H2O | 147.02 | 2 | 0,294 g |
| HEPES | 238.3 | 20 | 4.766 g |
| Glucosa | 180.2 | 3 | 0,540 g |
| Lactato de sodio (60% p/p) | 112.06 | 20 | 3 ml |
| Piruvato de sodio | 110 | 0.4 | 44 mg |
Tabla 1: Solución de fluido tubular humano (HTF)
| Productos químicos | Peso molar (g/mol) | milímetro | g para 1L |
| NaCl | 58.44 | 135 | 7.889 g |
| Kcl | 74.55 | 5 | 0,373 g |
| CaCl2 x 2. H2O | 147.02 | 2 | 0,294 g |
| MgSO4 x 7. H2O | 246.48 | 1 | 0,247 g |
| HEPES | 238.3 | 20 | 4.766 g |
| Glucosa | 180.2 | 5 | 0,901 g |
| Lactato de sodio (60% p/p) | 112.06 | 10 | 1,5 ml |
| Piruvato de sodio | 110 | 1 | 0,110 g |
Tabla 2: Solución altamente salina (HS)
| Productos químicos | Peso molar (g/mol) | milímetro | g (para 500 ml) |
| CsMeSO3 | 228.0 | 140 | 15.960 g |
| HEPES | 238.3 | 40 | 4.766 g |
| EDTA | 292.24 | 1 | 0,146 g |
Tabla 3: Solución de 3 baños CsMeSO (solución de baño libre divalente: DVF)
| Productos químicos | Peso molar (g/mol) | milímetro | mg (para 25 ml) |
| CsMeSO3 | 228.0 | 130 | 741 mg |
| HEPES | 238.3 | 70 | 417 mg |
| EDTA | 292.24 | 2 | 14,6 mg |
| EGTA | 380.35 | 3 | 28,5 mg |
| CsCl | Solución 1 M | 1 | 25 μl |
Tabla 4: Solución de pipeta CsMeSO3
Discusión
Describimos un protocolo detallado para realizar registros electrofisiológicos de espermatozoides de diversas especies. Dada la importancia fisiológica de los canales iónicos y los transportadores electrogénicos para los espermatozoides, esta técnica es una herramienta poderosa para estudiar la fisiología de los espermatozoides, así como los defectos que conducen a la infertilidad masculina. El experimentador puede encontrar la ejecución de esta técnica desafiante al principio, pero con perseverancia y resistencia, el éxito sigue.
Los espermatozoides de los mamíferos son largos (generalmente >50 μm), estrechos y muy móviles. La frecuencia basal de latidos (BF) de los espermatozoides de mamíferos varía mucho, con valores promedio de 4 Hz (ratón 69), 7-15 Hz (verraco 70,71), 11 Hz (rata 72), 11-20 Hz (toro 18), 24 Hz (macaco rhesus 23) y hasta 25 Hz (humano 3). La gota citoplasmática (CD) es la entrada para el registro de los espermatozoides. En los espermatozoides de roedores, el CD suele ser distal, pero se desplaza junto al flagelo (Figura 10), lo que crea un obstáculo adicional para el registro. Sin embargo, en los espermatozoides humanos, el CD se encuentra más comúnmente cerca de la cabeza. Por lo tanto, los componentes clave de una pinza de parche de esperma exitosa son una óptica excelente para permitir una visión clara y nítida del CD y un sistema de micromanipulación de alta precisión sin derivas ni vibraciones. Se espera una alta tasa inicial de fracaso y es normal dentro de los primeros días de pinzamiento del parche de espermatozoides. Recomendamos una práctica rutinaria que implique numerosos intentos por semana. Lograr varias grabaciones al día a la semana establecerá una rutina y mejorará las habilidades motoras.
Hasta hace poco, la identificación y caracterización farmacológica de los canales iónicos de los espermatozoides se veía obstaculizada por la imposibilidad de estudiarlos directamente. El campo se basó en gran medida en estudios de inmunocitoquímica, que a menudo adolecen de la falta de especificidad de los anticuerpos y/o de la falta de modelos genéticos correspondientes. Para el estudio de los canales de calcio se ha utilizado ampliamente el método clásico de imagen del calcio, que tiene sus propias ventajas y limitaciones 73,74,75,76,77. Si bien las imágenes de calcio son un método relativamente fácil que es aplicable para estudios de rendimiento medio a alto 78,79,80,81 y es menos invasivo, requiere células relativamente intactas y, por lo tanto, plantea un obstáculo para diseccionar la función de los canales iónicos desacoplados de las cascadas de señalización intracelular o para distinguirlos de los intercambiadores de iones de calcio. Además, es difícil controlar el potencial de membrana y, por lo tanto, es más difícil excluir la contribución de los canales de calcio dependientes de voltaje. Entre las varias ventajas de la fluorometría de calcio se encuentra el uso de colorantes ratiométricos de calcio que permiten la medición precisa de los cambios en la concentración de iones de calcio. Al mismo tiempo, hay que tener en cuenta que la sensibilidad de estos tintes puede variar en función de los cambios del pH intracelular.
A continuación, describimos los pasos críticos dentro del protocolo, incluidos los pasos de solución de problemas del método. Es esencial utilizar solo reactivos puros para las preparaciones de las soluciones experimentales, ya que incluso una pequeña contaminación con iones indeseables (como magnesio o metales pesados) puede perjudicar la detección de corrientes monovalentes. Dado el pequeño tamaño de los espermatozoides, se puede esperar un número relativamente bajo de canales iónicos por célula. Por lo tanto, la corriente neta oscila entre unos pocos pA y varios cientos de pA. Por lo tanto, el ruido eléctrico interno del equipo debe ser mínimo para garantizar la detección de pequeñas corrientes, y se recomienda encarecidamente el uso de equipos sin deriva. Para distinguir una conductancia específica del ruido eléctrico y la fuga de fondo, se deben maximizar el aparato de registro y el sistema de puesta a tierra. Esto se logra conectando correctamente a tierra el equipo para evitar cualquier interferencia eléctrica82. Se recomienda encarecidamente el uso de una jaula de Faraday para protegerse de las interferencias eléctricas producidas por una variedad de dispositivos eléctricos, como las luces del edificio y el cableado eléctrico en la pared. Es esencial que todos los componentes eléctricos del equipo, incluidos el teclado y el mouse de la computadora, emitan poco o ningún ruido eléctrico (50 Hz o 60 Hz) y que todos los componentes del equipo estén correctamente conectados a tierra. El ruido eléctrico en la configuración de celda completa cuando todos los canales iónicos están cerrados debe ser < 0,5-1 pA.
Otro punto importante es monitorear las osmolaridades correctas de las soluciones de trabajo. La composición de las soluciones intracelulares y extracelulares debe determinarse con precisión y sus osmolaridades deben medirse correctamente. La solución extracelular debe ser ligeramente hipotónica en comparación con la solución de pipeta, ya que provoca una inflamación celular minúscula y evita que la pipeta se obstruya por la membrana de los espermatozoides. Nota: si la solución de pipeta es demasiado hipertónica y difiere de la solución de baño en más de 10 mOsm, se produce una hinchazón celular excesiva y la ruptura del sello. Como resultado, la célula será frágil y el gigaseal se perderá en cuestión de segundos después del rodaje. En nuestra experiencia, la preparación inexacta de la solución es uno de los errores más comunes que impide el éxito de la fijación del parche.
Otro obstáculo potencial a evitar es el plástico que contiene plastificantes/ftalatos, así como las jeringas lubricadas con aceite mineral. Los tubos, jeringas y todos los equipos de plástico que se encuentran con soluciones, y por lo tanto con los espermatozoides, no deben lixiviar plastificantes u otras toxinas o aceites ambientales, ya que dichos productos químicos pueden alterar significativamente la actividad de los canales iónicos. Utilizamos tubos de teflón de diámetro pequeño como línea de perfusión principal. El teflón (PTFE) tiene pocos compuestos lixiviables, pero es bastante rígido. Las conexiones flexibles están hechas de tubos de silicona de alta pureza que se ajustan sobre los tubos de teflón. Todas las jeringas utilizadas para el sistema de perfusión carecen de lubricante, ya que el aceite mineral u otros aditivos lubricantes pueden interferir con el registro de canales iónicos.
No podemos exagerar la importancia de utilizar el vidrio adecuado y extraer la forma correcta de micropipeta. Por lo tanto, la fabricación óptima de micropipetas de vidrio es un requisito previo para el éxito de la aplicación de parches. Utilizamos micropipetas de vidrio hechas únicamente de vidrio de borosilicato que contiene un filamento para un mejor llenado de la solución. La punta de las pipetas debe estar pulida al fuego para proporcionar el sellado hermético ideal. Las puntas de pipeta que superan los 2 μm de diámetro (y, por lo tanto, tienen una resistencia de 10 MΩ o menos) generalmente no son adecuadas para la pinza de parches de espermatozoides.
Otro paso importante es asegurarse de que la punta de la micropipeta se mantenga limpia de residuos o burbujas de aire antes de la formación del sello. Se trata de una tarea difícil dado que la micropipeta se carga en una solución llena de células móviles. Un factor que ayuda a evitar el "choque" accidental de la pipeta con los espermatozoides que nadan libremente, es utilizar una perfusión constante para lavar todas las células no adherentes. Otra herramienta es un "tubo en U" casero que permite cambiar entre los modos de presión positiva y negativa para mantener la punta limpia (Figura 11 y Figura 12).
Dado que los espermatozoides varían mucho en la forma y el tamaño de sus gotitas citoplasmáticas (CD), es importante elegir una gota con una morfología adecuada. Como se muestra en la Figura 2, solo los CD que son pequeños (1-3 μm), lisos, uniformes y no demasiado hinchados son adecuados para la pinza de parche. Pequeño, unilateral; Los CD "hinchados", totalmente transparentes, producen sellos débiles o nulos. Los CD que tienen partículas solubles grandes en su interior pueden obstruir la pipeta de grabación. Cuando los espermatozoides testiculares de ratón entran en el epidídimo, sus CD se encuentran en la región del cuello, cerca de la cabeza. A medida que viajan a través del epidídimo, sus CD se mueven a lo largo de la pieza media y finalmente llegan a la conexión entre la pieza media y la pieza principal (el anillo) cuando los espermatozoides alcanzan la cola del epidídimo. Por lo tanto, como se mencionó anteriormente, en los espermatozoides aislados del cuerpo epidídimo, el CD generalmente se encuentra cerca del centro de la pieza media. En las células caudales, el CD generalmente se puede encontrar cerca del anillo (Figura 2C). En el caso de los espermatozoides humanos, el CD se encuentra en la región del cuello (Figura 2A, B).
Si bien esto no es un problema para los espermatozoides aislados de animales de laboratorio, existe una variabilidad significativa entre los donantes humanos. La variación en la calidad del esperma dentro del mismo donante afecta principalmente a la calidad de la membrana plasmática del esperma y, a veces, dificulta relativamente la formación de sellos. Hay menos variabilidad en el comportamiento de los canales iónicos y la farmacología, factores que probablemente se correlacionan con la genética o la fisiología individual. Uno tiene que ser persistente y evaluar muestras de varias donaciones durante varios días, así como confiar en múltiples participantes donantes humanos. Trabajar con material humano requiere mucha paciencia, ya que el esperma donado varía mucho en la calidad del esperma dentro de un mismo donante, dependiendo de diversos factores ambientales. Recomendamos evaluar las muestras de varios días de donación para tomar una decisión final sobre el estado del donante. Mientras que los espermatozoides purificados eyaculados son generalmente adecuados para la electrofisiología en cuestión de horas (hasta 12 horas después del aislamiento para el esperma humano), los espermatozoides murinos del epidídimo son adecuados para el parche solo dentro de una ventana de 2 horas después del aislamiento.
Y por último, pero no menos importante, la formación de gigasellos difiere entre los espermatozoides. En el caso de los espermatozoides murinos/roedores, la formación de gigasellos se produce casi instantáneamente, mientras que se necesitan varios segundos (y a veces hasta un minuto) para formar un gigaseal con un espermatozoide humano. A menudo, la succión inicial da como resultado una resistencia de entrada que oscila entre 200 MΩ y 800 MΩ. Cambiar el potencial de retención a -60 mV y proporcionar pulsos cortos de "prueba de membrana" de hasta 10 mV a menudo ayuda a rescatar la formación de gigasellos (a través del movimiento inducido por el campo de voltaje de la membrana en la pipeta).
La técnica de pinzamiento de parche de espermatozoides permite el estudio detallado de canales iónicos específicos en su sistema de expresión natural. El éxito de la técnica depende del equipo adecuado, espermatozoides viables de alta calidad, reactivos puros, habilidades básicas de electrofisiología, paciencia y persistencia. El método abre nuevas fronteras en la fisiología de los espermatozoides al estudiar la diversidad evolutiva de los canales iónicos, los mecanismos de su regulación y las alteraciones en su función a medida que pasan del tracto reproductivo masculino al femenino y se ven alterados por condiciones exógenas, como el pH y los ligandos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Subvención de los NIH R01GM111802, el Premio Pew Biomedical Scholars 00028642, el Premio Alfred P. Sloan FR-2015-65398 y el Testamento de Dotación Packer Wentz (a P.V.L.). Este trabajo también fue apoyado por la Deutsche Forschungsgemeinschaft (Fundación Alemana de Investigación) 368482240/GRK2416 (a N.M.) y por la beca del Consejo de Becas de China a B.L. Agradecemos al Dr. Dan Feldman por compartir tejido de rata, a Katie Klooster y Stuart Meyers de UC Davis por su ayuda con la adquisición de espermatozoides de primates, y a Steven Mansell por la ayuda con el análisis de adquisición de datos de espermatozoides de jabalíes y toros.
Materiales
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
Referencias
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados