Method Article
Enregistrement des courants électriques à travers la membrane plasmique des spermatozoïdes de mammifères
Dans cet article
Résumé
Ce protocole décrit comment effectuer des enregistrements électriques à partir de spermatozoïdes de mammifères dans une configuration de cellule entière, dans le but d’enregistrer directement l’activité des canaux ioniques. La méthode a joué un rôle déterminant dans la description des profils électrophysiologiques de plusieurs canaux ioniques des spermatozoïdes et a permis de révéler leur identité moléculaire et leur régulation.
Résumé
L’enregistrement de l’activité électrique de l’une des plus petites cellules d’un organisme mammifère - un spermatozoïde - est une tâche difficile pour les électrophysiologistes depuis de nombreuses décennies. La méthode connue sous le nom de « pince à spermatozoïdes » a été introduite en 2006. Il a permis d’enregistrer directement l’activité des canaux ioniques dans des configurations de cellules entières et attachées à des cellules et a joué un rôle déterminant dans la description de la physiologie des spermatozoïdes et de l’identité moléculaire de divers canaux ioniques de calcium, de potassium, de sodium, de chlorure et de protons. Cependant, l’enregistrement à partir de spermatozoïdes uniques nécessite des compétences avancées et une formation en électrophysiologie. Ce protocole détaillé résume la procédure étape par étape et met en évidence plusieurs « astuces » afin de le mettre à la disposition de tous ceux qui souhaitent explorer la physiologie fascinante de la cellule spermatozoïde. Plus précisément, le protocole décrit l’enregistrement à partir de spermatozoïdes humains et murins, mais peut être adapté à pratiquement n’importe quel spermatozoïde de mammifère de n’importe quelle espèce. Le protocole couvre des détails importants de l’application de cette technique, tels que l’isolement des spermatozoïdes, la sélection des réactifs et de l’équipement, l’immobilisation des cellules très mobiles, la formation du joint étanche (Gigaohm) entre une électrode d’enregistrement et la membrane plasmique des spermatozoïdes, la transition vers le mode spermatozoïde entier (également connu sous le nom de rodage) et des enregistrements exemplaires du canal ionique calcique des spermatozoïdes, CatSper, de six espèces de mammifères. Les avantages et les limites de la méthode de clampage de spermatozoïdes, ainsi que les étapes les plus critiques, sont discutés.
Introduction
Semblable à la pince de patch traditionnelle inventée par Erwin Neher et Bert Sakmann1, la pince de patch pour cellules de spermatozoïdes permet d’interroger l’activité individuelle des canaux ioniques, ainsi que d’enregistrer l’activité de l’ensemble de la population de canaux ioniques au sein de la cellule unique 2,3. La méthode permet d’identifier un type de canal ionique spécifique sous des degrés de découplage des processus intracellulaires enzymatiques. Cette méthode est cruciale pour la détermination de l’activité des canaux ioniques sur la base de ses empreintes électrophysiologiques et pharmacologiques, et fournit donc une stratégie d’identification fiable. L’inconvénient de la méthode est son incapacité à détecter les transporteurs non électrogènes. De plus, une formation électrophysiologique de base est utile pour comprendre les nuances du protocole. Pour maîtriser la technique du patch clamp et l’appliquer aux spermatozoïdes de mammifères, nous vous recommandons d’étudier la littérature de base 4,5. Dans cet article, nous fournissons une procédure détaillée, étape par étape, et mettons en évidence des pratiques uniques qui rendent cette technique facile à comprendre et accessible à tous ceux qui souhaitent pratiquer l’électrophysiologie des spermatozoïdes.
L’homéostasie ionique est une fonction physiologique essentielle des spermatozoïdes qui dépend fortement des canaux ioniques et des transporteurs d’ions pour maintenir les gradients ioniques physiologiquement importants, faire varier le calcium intracellulaire et modifier la tension transmembranaire. Les canaux ioniques et les transporteurs d’ions régulent les fonctions essentielles des spermatozoïdes telles que la motilité, la navigation dans l’appareil reproducteur féminin, la maturation des spermatozoïdes et, chez les organismes marins, la chimiotaxie vers l’ovule6,7,8,9,10,11,12 . La motilité des spermatozoïdes est un processus qui s’acquiert progressivement. Les spermatozoïdes sont principalement au repos pendant leur maturation dans les testicules et lors de leur passage ultérieur dans l’épididyme. Leur motilité est limitée par un environnement épididymaire acide qui conduit à une acidification interne de la cellule spermatozoïde. Cela altère la fonction de l’axonème car il est incapable de fonctionner en dessous de pH 6,013,14. Cependant, lors de l’exposition aux fluides séminales ou à un environnement plus alcalin, les concentrations intracellulaires en ions des spermatozoïdes et le pH cytoplasmique subissent des changements majeurs et le spermatozoïde devient mobile 15,16,17. Le mouvement du flagelle du spermatozoïde est alimenté par l’hydrolyse de l’ATP qui favorise le glissement des microtubules axonèmes18 et ce processus est fortement dépendant du pH14. De plus, le mouvement flagellaire est également contrôlé par une élévation du calcium intraflagellaire et de l’AMPc 13,19,20,21,22,23,24. Ces facteurs, c’est-à-dire la concentration intracellulaire de calcium des spermatozoïdes [Ca, 2+]i, le pH, l’ATP et l’AMPc, sont les principaux mécanismes de régulation permettant les changements de motilité, et leurs concentrations sont étroitement régulées par les canaux ioniques et les transporteurs des spermatozoïdes.
Les spermatozoïdes sont uniques en ce sens qu’ils expriment un certain nombre de protéines que l’on ne trouve nulle part ailleurs dans le corps. Des exemples notables sont les canaux ioniques des spermatozoïdes, tels que le canal potassique, Slo3 25,26,27,28,29 et le canal ionique Catde Sperm, CatSper 2,30,31,32. Ce dernier est le principal canal calcique des spermatozoïdes de mammifères31, et est régulé par l’alcalinisation intracellulaire 2,30,31,32,33,34. CatSper est également régulé par des signaux spécifiques à l’espèce 7,35 et est organisé en nanodomaines longitudinaux quadrilatéraux le long du flagelle du spermatozoïde 36,37,38. Chez les primates, CatSper est activé par une combinaison d’alcalinité flagellaire, de dépolarisation membranaire et de progestérone 3,39,40,41, tandis que pour l’activation murine de CatSper, la progestérone n’est pas nécessaire 2,39. Une autre spécificité de ce canal est son organisation multi-sous-unités : CatSper est un complexe d’au moins 10 sous-unités différentes 31,32,34,37,38,42,43,44,45,46,47. Une structure aussi sophistiquée et des spécificités de sa régulation ont entravé l’expression recombinante de CatSper dans tout système d’expression hétérologue connu, et la caractérisation physiologique de CatSper a donc été limitée à son système d’expression natif - le spermatozoïde. Bien que la caractérisation moléculaire de la protéine CatSper ait été réalisée dans un article fondateur en 2000 par D. Ren et. al.31, la preuve ultime que CatSper est un véritable canal ionique n’a été possible qu’après l’introduction de la méthode de clampage de sperme en 20062. Depuis lors, cette technique a permis de caractériser avec précision de nombreuses voies conductrices d’ions dans les spermatozoïdes 9,28,37,39,40,44,46,48-54.
La méthode classique et la plus simple pour étudier les caractéristiques des canaux ioniques - la technique du patch clamp - était considérée comme inapplicable aux spermatozoïdes en raison de leur motilité et de leur morphologie spécifique (Figure 1A). Plus précisément, le volume minuscule du cytoplasme du spermatozoïde et l’attachement serré de la membrane plasmique des spermatozoïdes aux structures intracellulaires rigides telles que la gaine fibreuse et le noyau du spermatozoïde étaient les principaux défis55. Ces deux caractéristiques structurelles se traduisent par une cellule mince en forme de flèche conçue pour pénétrer dans des environnements très visqueux tels que les vêtements protecteurs des œufs, sans déformation significative ni dommage à la membrane plasmique.
La première étape de la méthode du patch clamp est l’établissement de l’étanchéité entre une pipette d’enregistrement (une micropipette en verre) et la membrane plasmique cellulaire. Pour y parvenir, il faut tirer suffisamment de membrane plasmique à l’intérieur de la pipette d’enregistrement pour qu’un gigaseal mécaniquement stable se forme entre la membrane plasmique et le verre. La membrane plasmique doit être souple et non rigide (Figure 1B). Comme mentionné ci-dessus, toute la surface de la membrane plasmique du spermatozoïde est assez étroitement collée, à l’exception de la région connue sous le nom de gouttelette cytoplasmique (Figure 1A et Figure 2). Par conséquent, la nature rigide de la membrane plasmique des spermatozoïdes a été considérée comme un obstacle majeur à l’obtention du joint étanche ou « gigaseal », ainsi nommé parce que >109 ohms sont nécessaires pour de bons enregistrements. Cependant, l’introduction de la technique de clamp de patch de sperme en 20062 a supprimé cette barrière et cette méthode a pu être appliquée avec succès aux spermatozoïdes de plusieurs espèces de mammifères 2,41,51,56. Cette percée a été réalisée en se concentrant sur la gouttelette cytoplasmique (CD)2,8, une minuscule structure située le long de la pièce médiane du spermatozoïde (Figure 1A et Figure 2), et qui est simplement le reste de la spermatide allongée - un précurseur de la cellule spermatozoïde à partir de laquelle la tête et la queue se développent. Fonctionnellement, il peut aider la cellule à s’adapter aux changements d’osmolarité extracellulaire pendant l’éjaculation. La caractéristique importante est que la membrane plasmique à l’intérieur du CD est suffisamment flexible pour être aspirée dans la pipette pour former un joint gigaohm. Ainsi, le CD de spermatozoïdes est la meilleure partie de la surface du spermatozoïde à travers laquelle on peut obtenir une formation gigaseal réussie et passer à un mode de cellule entière qui couple finalement électriquement la cellule de spermatozoïde à un amplificateur patch-clamp 2,8. Il convient de noter que des publications antérieures ont signalé une formation réussie de gigaseal au niveau de la tête du spermatozoïde, ce qui permet d’enregistrer dans la configuration attachée à la cellule 54,57,58,59. Cependant, les enregistrements en configuration de cellules entières n’ont jusqu’à présent été rapportés qu’en effectuant une formation gigaseal dans la région CD. Ce mode de cellule entière permet l’accès électrique à tout le volume des spermatozoïdes, et permet donc de détecter les activités des canaux ioniques situés sur le flagelle du spermatozoïde, ainsi que sur la tête du spermatozoïde. Depuis son développement, la technique du patch de sperme a permis de réaliser d’énormes progrès dans notre compréhension des canaux ioniques des spermatozoïdes et est jusqu’à présent l’une des techniques les plus robustes pour étudier directement la fonctionnalité des canaux ioniques des spermatozoïdes 9,28,37,39,40,44,46,48,49, 50,51,52,53 (Figure 1).
La pince à spermatozoïdes diffère dans certains détails de la technique classique de la pince à spermatozoïde, comme indiqué ci-dessous. Tout d’abord, la majeure partie de la membrane plasmique des spermatozoïdes est étroitement attachée à la structure intracellulaire rigide et, par conséquent, les spermatozoïdes n’ont presque pas de membrane plasmique « de rechange » à aspirer dans la pipette. La seule région flexible est la membrane du CD qui ressemble à la membrane plasmique de nombreuses cellules somatiques et, par conséquent, peut être facilement aspirée dans la pipette. Pour former un joint gigaohm avec le CD, une pression négative est créée par une légère aspiration au sommet de la pipette afin d’aspirer une petite partie de la membrane plasmique du spermatozoïde dans l’extrémité de la micropipette (Figure 1B). Cette partie de la membrane forme une invagination en forme de Ω dans l’extrémité de la pipette et établit un joint étanche avec ses parois internes.
Deuxièmement, la gouttelette cytoplasmique dans les spermatozoïdes humains et de souris est comprise entre 1 et 2 μm (Figure 1 et Figure 2). Par conséquent, l’application de la technique du patch-clamp à un objet aussi petit nécessite une optique à haute résolution. La plupart des appareils sont équipés d’un microscope inversé avec un contraste interférentiel différentiel (DIC) ou de composants optiques Nomarski (Figure 2 et Figure 3). L’utilisation d’un microscope équipé d’une optique DIC pour le patch clamp de sperme est fortement recommandée par rapport aux optiques à contraste de phase plus conventionnelles, car les informations spatiales observées dans la DIC permettent d’obtenir une précision supérieure dans le positionnement d’une pipette patch sur le minuscule CD. Nous vous suggérons également d’utiliser un objectif à immersion dans l’eau 60x ou un objectif similaire, avec une ouverture numérique de 1,2. Cet objectif a une longue distance de travail (0,28 mm), ce qui permet d’observer les spermatozoïdes nageant librement en solution (Figure 2). L’objectif dispose également d’un collier de réglage pour s’adapter à l’épaisseur de la lamelle (variable de 0,13 à 0,21 mm). Cette combinaison de la longue distance de travail et de la bague de réglage permet l’observation à travers deux lamelles de recouvrement de 0,13 mm ; Une lamelle sert de fond en verre à la chambre d’enregistrement, et la lamelle de 5 mm avec les spermatozoïdes déposés est placée sur le dessus. Comme nous le verrons ci-dessous, le dépôt de spermatozoïdes sur des lamelles rondes de 5 mm facilement interchangeables, plutôt que directement au fond de la chambre d’enregistrement, est un moyen pratique de charger des spermatozoïdes frais dans la chambre d’enregistrement.
Troisièmement, le dispositif de patch à spermatozoïdes doit être équipé d’un amplificateur à faible bruit et d’un numériseur pour enregistrer de minuscules courants électriques (gamme de l’ordre de l’ampère) et de minuscules changements de potentiel membranaire. Cet équipement doit assurer le bruit d’amplificateur le plus faible. L’absence de vibration est un élément essentiel de la réussite d’un enregistrement par patch clamp. Le serrage des patchs de spermatozoïdes nécessite un micromanipulateur précis sans dérive qui peut être fixé au microscope inversé à l’aide d’une plate-forme de micromanipulateur pour assurer une meilleure stabilité qu’un support de micromanipulateur indépendant (Figure 3A). Pour tester la configuration, il ne faut pas voir de mouvement de la pointe de la pipette (sous un grossissement de 60x), même lorsqu’une personne saute de haut en bas sur le sol près de la table d’isolation des vibrations.
Protocole
Toutes les expériences ont été réalisées conformément aux directives du NIH pour la recherche sur les animaux et approuvées par le comité de protection et d’utilisation des animaux de l’UC Berkeley (AUP 2015-07-7742), tous les efforts étant faits pour minimiser la souffrance animale. Toutes les méthodes décrites sont conformes aux recommandations du groupe d’experts sur l’euthanasie de l’American Veterinary Medical Association et du comité de l’IACUC. Toutes les procédures expérimentales utilisant des échantillons d’origine humaine ont été approuvées par le Comité de recherche humaine de l’Université de Californie à Berkeley, numéro de protocole IRB 2013-06-5395.
1. Fabrication de micropipettes en verre pour l’enregistrement de spermatozoïdes entiers.
REMARQUE : La petite taille de la gouttelette cytoplasmique nécessite des micropipettes en verre avec des pointes fines.
- Pour la fabrication de micropipettes, commencez par des capillaires en verre borosilicate d’un diamètre extérieur de 1,5 mm, d’un diamètre intérieur de 0,86 mm et d’un filament interne. Tirez l’extrémité sur un extracteur de micropipette (Figure 3B).
- Pour façonner et polir la pointe de la pipette, placez un fil chaud à proximité de la pointe pendant un moment. Effectuez ce processus de polissage au feu sous un grossissement de 100x à l’aide d’une polisseuse à pipette (Figure 3C,D).
- Assurez-vous que le diamètre intérieur de la pointe de la pipette est de ~2 μm avant le polissage au feu et qu’il est réduit à ~0,5 μm après un polissage approprié.
REMARQUE : Seules les pipettes fraîchement tirées fabriquées le jour de l’enregistrement sont recommandées. Cela permet d’éviter l’accumulation de particules de poussière sur la pointe de la pipette.
2. Mise en place de l’appareil
- Montage de la chambre d’enregistrement
- Utilisez une chambre de perfusion en forme de diamant de faible volume avec un flux laminaire et des taux d’échange de solution relativement rapides (Figure 4). Connectez la chambre via un collecteur à un système de perfusion alimenté par gravité (Figure 5).
- Pour perfuser une solution à travers la chambre d’enregistrement, assemblez un système de perfusion par gravité simple fabriqué par vous-même avec un collecteur de polytétrafluoroéthylène qui relie la chambre de perfusion à huit lignes de perfusion distinctes.
REMARQUE : Le tube ne doit pas lessiver des plastifiants dans les solutions, car ces produits chimiques peuvent avoir un impact significatif sur le fonctionnement normal des spermatozoïdes60 et modifier l’activité des canaux ioniques 61,62 . Un tube en polytétrafluoroéthylène de petit diamètre est fortement recommandé comme tube de perfusion principal. - Comme les tubes en polytétrafluoroéthylène sont plutôt rigides, établissez des connexions flexibles avec des tubes en silicone de haute pureté qui s’adaptent aux tubes en polytétrafluoroéthylène. De plus, utilisez des seringues (par exemple, de type seringue Luer Lock) qui manquent de lubrifiant, car l’huile minérale ou d’autres additifs lubrifiants peuvent interférer avec l’enregistrement des canaux ioniques (Figure 5).
- Assemblage d’un pont en agar
- Pour éviter les changements de potentiel de jonction liquide pendant les enregistrements, maintenez l’environnement autour de l’électrode de référence stable à l’aide d’un pont gélosé (Figure 4).
- Pour faire un pont en agar, faites un capillaire en verre en forme de L en le pliant sous un petit feu de bec Bunsen et laissez-le refroidir.
- Préparez une solution d’agarose à 1 % dans 1 M de KCl et faites-la chauffer au micro-ondes jusqu’à ce que l’agarose fonde et que la solution devienne transparente. Remplissez soigneusement le capillaire en verre en forme de L avec la solution ci-dessus pour éviter les bulles d’air et laissez-le refroidir à température ambiante. Les ponts en gélose peuvent être stockés dans 1 M KCl pendant ~2 mois à +4 °C.
- Pour utiliser un pont d’agar-agar, remplissez une électrode de référence de granulés Ag/AgCl avec 1 M de KCl et insérez soigneusement le pont d’agar pour éviter que l’agarose solidifiée ne sorte du capillaire en verre.
- Ensuite, insérez la broche dorée (2 mm) du fil de la tête de l’amplificateur dans la fente de l’électrode de référence de 2 mm (or) et insérez l’extrémité du pont de gélose en forme de L dans la chambre de perfusion comme illustré à la figure 4.
- Solutions et recettes
REMARQUE : Tous les réactifs et produits chimiques doivent être de la plus haute pureté. Toutes les solutions préparées sont filtrées à travers un filtre PES stérile de 0,22 μm et stockées à 4 °C pendant un mois maximum. Il convient de noter que le réglage exact de l’osmolarité est une condition préalable à la réussite du serrage par patch.- Préparez une solution de liquide tubulaire humain (FAS) comme décrit dans le tableau 1. Ajustez le pH à 7,4 avec du NaOH. L’osmolarité doit être de 280 ± 5 mOsm, mesurée à l’aide d’un osmomètre à pression de vapeur.
- Préparez un « bain » à haute teneur en sel (HS) ou une solution « extracellulaire » comme indiqué dans le tableau 2. Ajustez le pH à 7,4 avec du NaOH. L’osmolarité doit être de 320 ± 5 mOsm.
- Préparez le « bain » ou la solution « extracellulaire » de méthanesulfonate de césium comme décrit dans le tableau 3. Ajustez le pH à 7,4 avec CsOH et l’osmolarité à 320 ± 5 mOsm.
- Pour préparer la solution de « pipette » intracellulaire de méthanesulfonate de césium (CsMeSO3), suivez le tableau 4 et ajustez le pH à 7,4 avec du CsOH. L’osmolarité doit être jusqu’à 10 mOsm supérieure à celle de la solution HS.
3. Isolement et purification des spermatozoïdes de mammifères
REMARQUE : Euthanasier des souris mâles C57BL/6 âgées de 3 à 6 mois par inhalation de CO2 suivie d’une luxation cervicale. Après une luxation cervicale, effectuez immédiatement un prélèvement de tissu (queue de corps ou corps épididyme) sur des souris.
- Isolement des spermatozoïdes épididymaux de souris
REMARQUE : Euthanasier des souris mâles C57BL/6 âgées de 3 à 6 mois par inhalation de CO2 suivie d’une luxation cervicale. Après une luxation cervicale, effectuez immédiatement un prélèvement de tissu (queue de corps ou corps épididyme) sur des souris.- Ouvrez la partie inférieure de l’abdomen de la souris avec des ciseaux et extrayez les deux épididymes.
- Placez-les dans une boîte de culture cellulaire de 35 mm remplie de solution HS (solution hautement saline, voir tableau 2). Assurez-vous qu’une partie aliquote de la solution HS est préchauffée à température ambiante avant d’entrer en contact avec les spermatozoïdes.
- Transférez les épididymes dans une nouvelle boîte de culture cellulaire contenant une solution de HS et éliminez soigneusement toute graisse résiduelle.
- Séparez les épididymes en caput, corps et cauda à l’aide d’une lame de scalpel #15 (Figure 6).
- Transférez le corps (ou la queue de l’épididyme si nécessaire) dans une nouvelle boîte de culture cellulaire contenant une solution de HS. Faites plusieurs incisions dans la partie isolée de l’épididyme à l’aide d’une lame de scalpel pointue #11.
- Transférez les parties des épididymes avec plusieurs incisions dans un tube de microcentrifugation de 1,5 mL contenant 1,5 mL de solution HS.
- Secouez brièvement les spermatozoïdes de l’épididyme dans la solution à l’aide d’une pince Dumont de type 5a très fine. Jeter les épididymes et laisser le tube à température ambiante pendant 10 min.
- Attendez que la matière solide (autres que les spermatozoïdes) se sédimente au fond du tube, puis transférez le surnageant dans un autre tube de microcentrifugation de 1,5 ml.
- Conservez le mélange de spermatozoïdes à température ambiante avec accès à l’air jusqu’à 2 h, période pendant laquelle les expériences peuvent être effectuées. Les spermatozoïdes isolés perdent leurs performances 3 h après l’isolement.
- Capacité des spermatozoïdes de souris
REMARQUE : Tous les spermatozoïdes de l’épididyme conviennent au patch-clamp, mais seuls les spermatozoïdes de la queue de l’épididyme sont suffisamment matures pour devenir compétents en matière de fécondation. Étant donné que les spermatozoïdes caudaux peuvent subir une capacitation, effectuez des expériences, en particulier la capacitation des spermatozoïdes, en utilisant des spermatozoïdes caudal.- Effectuez le prélèvement de spermatozoïdes sur des spermatozoïdes caudales ou éjaculés (voir étapes 3.1.1-4).
- Prenez des caudales-isolées comme décrit à l’étape 3.1.4. et appliquez plusieurs incisions comme décrit à l’étape 3.1.5. Transférez les caudales-du-feu dans une boîte de culture cellulaire de 10 mm avec 2 mL de solution capacitaire.
- Incuber le tissu caudal dans cette solution de capacitation pendant 10 minutes à 37 °C et 5 % de CO2, puis jeter le tissu et incuber les spermatozoïdes libérés pendant 50 à 80 minutes supplémentaires.
REMARQUE : La capacitation in vitro des spermatozoïdes caudaux de souris est obtenue par une incubation de 60 à 90 minutes. Les spermatozoïdes capacités sont identifiés visuellement sur la base d’une flexion asymétrique excessive de leurs flagelles, connue sous le nom d’hyperactivation. Ce type de motilité permet aux spermatozoïdes de nager de manière non linéaire.
- Collecte et purification de spermatozoïdes humains
REMARQUE : Dans ce cas, des échantillons de sperme frais ont été obtenus sur un total de 21 volontaires sains âgés de 21 à 38 ans et des spermatozoïdes purifiés par la technique de remontée à température ambiante décrite en détail dans48,63 . En bref, la procédure est la suivante :- Laissez les échantillons d’éjaculat humain à température ambiante pendant 60 minutes pour permettre la liquéfaction avant d’être purifiés (des durées plus longues peuvent affecter négativement la qualité du sperme).
- Préchauffer environ 7 mL de solution de FASS à 37 °C dans un tube à centrifuger de 50 mL. Évaluez visuellement le volume de l’éjaculat - si le volume est supérieur à 1 ml, préparez plusieurs tubes de solution de HTF.
- Sous-couche soigneusement 1 ml d’éjaculat liquéfié au fond de chaque tube sans soulever les brins de sperme à la surface du tampon. L’interface entre le sperme et le HTF doit être aussi claire que possible. Évitez les bulles d’air.
- Placez les tubes dans un incubateur à 37 °C pendant 1 h dans un support qui les maintient à un angle de 45° pour une surface maximale. S’il s’agit d’un incubateur àCO2 , fermez bien le capuchon pour éviter l’acidification du tampon (le CO2 n’est pas nécessaire pour cette procédure). Au cours de l’incubation, les spermatozoïdes mobiles vont progressivement nager vers la surface du tampon HTF.
- Après 1 h, prélever la fraction supérieure de 1 mL de tous les échantillons dans un tube à centrifuger de 15 mL, combinant ainsi les spermatozoïdes de la plus haute qualité et très mobiles pour le clampage par patch. N’essayez pas d’enlever tout le surnageant, laissez plusieurs ml de HTF au-dessus du plasma séminal pour éviter la contamination. La suspension cellulaire purifiée peut être conservée à température ambiante pendant plusieurs heures.
REMARQUE : Un éjaculat normal doit contenir au moins 15 x 106 cellules de spermatozoïdes par ml64, mais le nombre de spermatozoïdes varie considérablement d’un échantillon à l’autre. L’obstacle d’un faible nombre de cellules peut être surmonté en laissant la suspension de spermatozoïdes purifiés reposer pendant 30 à 60 minutes à température ambiante avant le clampage par patch. Dans ces conditions, les cellules s’accumulent progressivement au fond du tube de centrifugation et forment un nuage de cellules visible à partir duquel vous pouvez pipeter des cellules dans la chambre d’enregistrement (voir ci-dessous).
- capacitation des spermatozoïdes humains
REMARQUE : La capacitation in vitro des spermatozoïdes humains peut être réalisée par une incubation de 4 h dans une solution de capacitation : 20 % de sérum de veau fœtal, 25 mM de NaHCO3 dans des tampons HTF ou HS48,51 . Les spermatozoïdes capacités peuvent être identifiés visuellement en fonction de leur motilité vigoureuse et de leur courbure asymétrique excessive des flagelles qui permet aux spermatozoïdes de nager de manière non linéaire.- Préparez une solution de capacitation 2x et mélangez 1:1 avec la suspension de spermatozoïdes.
- Effectuer l’incubation à 37 °C et 5 % de CO2 pendant au moins 4 h. Pour garantir un pourcentage élevé de cellules capacitaires, le temps d’incubation ne doit pas être inférieur à 4 h.
4. Préparation de la solution de revêtement (nécessaire uniquement pour le patch-clamp de sperme humain)
REMARQUE : Une étape essentielle consiste à soulever le spermatozoïde attaché de la lamelle avant le rodage. Cette étape n’est nécessaire que pour les spermatozoïdes humains et nécessite un revêtement de la lamelle en verre pour créer une surface en verre moins adhésive. Le revêtement de la lamelle réduit la probabilité que les spermatozoïdes adhèrent à la lamelle et permet aux spermatozoïdes humains d’être retirés de la lamelle en verre après la formation réussie du gigaseal.
- Diluer 200 μL de l’éjaculat dans 5 mL de solution HS dans un tube à centrifuger de 15 mL.
- Essorer à 300 x g pendant 5 min et retirer le surnageant.
- Remettre la pastille en suspension dans 1 mL de solution HS et transférer dans un tube de microcentrifugation.
- Sonicate pendant 10 min à 25 °C à l’aide d’un bain de sonication rempli d’eau.
- Essorez à 10 000 x g pendant 5 min.
- Transférez le surnageant dans un nouveau tube de microcentrifugation et utilisez-le pour l’enrobage (instructions ci-dessous).
5. Enregistrement de la conductance ionique de l’ensemble de la membrane plasmique du spermatozoïde.
- Fixation des spermatozoïdes à la lamelle.
REMARQUE : Avant l’enregistrement par patch-clamp, les spermatozoïdes sont plaqués sur des lamelles rondes de 5 mm.- Si vous travaillez avec des cellules humaines, trempez brièvement les lamelles dans la solution de revêtement préparée à l’aide d’une pince tranchante.
- Placez quatre lamelles dans un seul puits d’une plaque à 4 puits et recouvrez avec 300 μL de solution HS. Empêchez les lamelles de flotter en les collant au fond de la plaque à 4 puits, en les poussant avec la pointe en plastique d’un pipeteur.
- Remettre doucement en suspension les suspensions concentrées de spermatozoïdes humains (étape 3.3.5) ou de souris (étape 3.1.9) du tube de stockage (20 à 50 μL de spermatozoïdes concentrés) dans 300 μL de solution HS au-dessus de la lamelle.
- Assurez-vous que les spermatozoïdes s’accumulent au fond du puits où leur tête se fixera à la lamelle et que leurs flagelles battront vigoureusement dans la solution juste au-dessus de la lamelle. Il est important de laisser les spermatozoïdes sédimenter sur la lamelle pendant environ 10 minutes à température ambiante avant l’enregistrement.
REMARQUE : Si les spermatozoïdes humains se fixent mal, revenir à l’étape 5.1.1 et diluer la solution d’enrobage préparée avec une solution HS (1:20 à 1:2 jusqu’à 1:2). Cette étape doit être adaptée aux échantillons de sperme provenant de différents donneurs humains en fonction de la motilité variable des spermatozoïdes qui est courante dans les préparations de spermatozoïdes humains.
- Pose de la lamelle de recouvrement
- Prélever une lamelle avec des cellules légèrement adhérentes dans le puits et la placer dans un puits en forme de losange de la chambre d’enregistrement contenant une solution d’HS (figure 4).
- Allumez le système de perfusion (Figure 5) rempli de solution HS pour rincer la chambre et enlever les débris et les spermatozoïdes détachés en excès de la chambre. Cela augmentera la probabilité que la pipette d’enregistrement reste propre lorsqu’elle atteint les cellules. Cette étape est utile lorsque vous travaillez avec des cellules non capacitaires qui ont tendance à adhérer plus fort à la lamelle.
REMARQUE : Si vous enregistrez à partir de spermatozoïdes capacités, il faut éviter d’allumer la perfusion immédiatement après qu’une nouvelle lamelle de couverture ait été placée dans la chambre. Les spermatozoïdes capacités ont une motilité vigoureuse et ne se fixent que faiblement à la lamelle. Par conséquent, pour s’assurer que le plus grand nombre de spermatozoïdes capacités sont disponibles, il est important d’attendre ~ 10 min et de laisser les spermatozoïdes capacités adhérer à la lamelle avant d’activer la perfusion. Une fois que la cellule de capacité appropriée est choisie et qu’un gigaseal est formé, la perfusion peut être réactivée.
- Sélection d’un spermatozoïde pour l’enregistrement par patch-clamp.
- Trouvez un spermatozoïde approprié avec une gouttelette cytoplasmique en utilisant un grossissement de 600x (voir ci-dessous). Cela se fait à l’aide d’un capteur d’immersion dans l’eau 60x comme décrit dans les méthodes avec un oculaire à grossissement 10x. Dans les spermatozoïdes isolés du corps épididyme, le CD est généralement situé près du centre de la pièce médiane. Dans les cellules caudales, le CD se trouve généralement près de l’anneau (Figure 2C). Pour les spermatozoïdes humains, la CD est située dans la région du cou (Figure 2A,B).
REMARQUE : De plus, l’option de grossissement 1,6x du microscope peut être utilisée pour examiner de près la morphologie des spermatozoïdes (grossissement 960x). - Assurez-vous que la gouttelette cytoplasmique est ovale et qu’elle a une forme légèrement allongée (figure 2G) et en forme de fuseau. Les CD qui semblent très ronds et agrandis sont souvent fragiles et impropres au rafistolage (Figure 2D,F).
- Sélectionnez un spermatozoïde mobile avec la tête attachée à la lamelle, de sorte que le spermatozoïde soit partiellement fixé, mais que le CD et le reste du flagelle continuent de se déplacer avec un battement flagellaire. Assurez-vous que la tête du spermatozoïde est fixée de manière lâche à la lamelle afin qu’elle tourne un peu lorsque le flagelle se déplace d’un côté à l’autre.
REMARQUE : Une fixation lâche est importante car après la formation du joint gigaohm et avant le passage au mode à cellules entières, le spermatozoïde doit être soulevé de la lamelle dans la solution.
- Trouvez un spermatozoïde approprié avec une gouttelette cytoplasmique en utilisant un grossissement de 600x (voir ci-dessous). Cela se fait à l’aide d’un capteur d’immersion dans l’eau 60x comme décrit dans les méthodes avec un oculaire à grossissement 10x. Dans les spermatozoïdes isolés du corps épididyme, le CD est généralement situé près du centre de la pièce médiane. Dans les cellules caudales, le CD se trouve généralement près de l’anneau (Figure 2C). Pour les spermatozoïdes humains, la CD est située dans la région du cou (Figure 2A,B).
- Formation d’un gigaseal
REMARQUE : Pour enregistrer les courants CatSper monovalents en mode cellule entière, les pipettes sont remplies d’une solution de méthanesulfonate de Cs (également appelée pipette ou intracellulaire) (Tableau 4) - cela donne une résistance de pipette de 11 à 17 MΩ (Figure 7A), calculée automatiquement par l’amplificateur lors de l’application d’un pas de tension de 0 mV à 10 mV. Les pipettes peuvent également être remplies avec d’autres solutions en fonction de l’application. Il est recommandé de fabriquer des solutions avec des anions mobiles tels que le méthanesulfonate, le Cl- , l’aspartate ou des ions similaires pour réduire la résistance des pipettes. L’osmolarité de la solution de pipette doit être jusqu’à 10 mOsm supérieure à celle de la solution de bain. La tonicité légèrement plus élevée de la solution de pipette permet de maintenir la résistance d’accès aux spermatozoïdes aussi faible que possible lors de l’enregistrement par patch-clamp.- Après la sélection visuelle d’un spermatozoïde ayant une morphologie appropriée (Figure 2G), remplissez la micropipette avec une solution de pipette (Tableau 4) et fixez-la dans le porte-pipette.
- Afin de garder la pointe de la pipette exempte de débris, appliquez une pression positive sur la pipette à l’aide de l’ensemble en forme de tube en U pour vous assurer que la solution de la pipette s’écoule de la pointe après avoir été immergée dans la solution extracellulaire, également appelée ci-dessous la solution « bain » (voir tableau 2).
REMARQUE : Si les conditions le permettent, la formation du joint sous perfusion constante est fortement conseillée, car cette condition garantit la pointe de pipette la plus propre. - Abaissez la pipette et plongez son extrémité dans la solution du bain (tableau 2). À ce stade, la résistance de la pipette peut être mesurée (Figure 7A).
- Afin de visualiser clairement la cellule, positionnez la pointe de la pipette au-dessus du CD avec l’ouverture de la pointe alignée en diagonale (environ 45°) vers le CD.
- Abaissez rapidement l’extrémité de la pipette vers le CD pour qu’elle soit dans le même plan focal, à quelques μm du CD.
- Dès que la pointe de la pipette touche le CD, appliquez une pression négative sur la pipette à l’aide de l'"embout buccal » pour déplacer une partie de la gouttelette dans la pointe et former un joint gigaohm - également connu en électrophysiologie sous le nom d'"événement d’aspiration ». Habituellement, après le premier contact avec la pointe de la pipette, la pression négative dans la pipette peut être maintenue jusqu’à une minute pour obtenir progressivement une étanchéité gigaohm.
- Après la formation réussie du joint gigaohm (> 4-20 GΩ), soulevez le spermatozoïde de la lamelle (Figure 7B).
REMARQUE : Cette étape n’est pas nécessaire pour les spermatozoïdes de rongeurs en raison de leur longueur ; Cependant, le détachement partiel du flagelle du spermatozoïde est bénéfique pour atténuer la dérive potentielle de la pipette. Le détachement des spermatozoïdes humains est une étape essentielle, car le CD est petit (1 ~ 3 μm) ; si la cellule est laissée attachée à la lamelle, même une légère dérive de la pipette pendant l’expérience peut perturber le CD. Une fois que le spermatozoïde est soulevé, son flagelle continue normalement à battre, tandis que la cellule n’est attachée qu’à la micropipette.
- Rodage et passage en mode cellule entière.
- Compensez les transitoires de capacité parasites à l’aide du mode compensatoire de l’amplificateur avant de passer au mode de cellule entière (Figure 7B). Pour observer initialement les transitoires de capacité, maintenez le potentiel de membrane à 0 mV et appliquez des impulsions de 10 mV à l’aide de l’outil « Membrane Test » (Figure 7B).
- Effectuez un rodage et passez en mode cellule entière en appliquant des impulsions de tension courtes (1 ms) augmentant progressivement (430-650 mV, incrément de ~50 mV) combinées à une aspiration très légère (Figure 7C).
REMARQUE : Pour appliquer des impulsions de rodage , utilisez le protocole de rodage précédemment programmé dans le logiciel de serrage de patch. Les impulsions de tension de rodage sont appliquées au spermatozoïde à l’aide de l’entrée de commande haute tension (commutée à l’arrière) à l’arrière de l’amplificateur. - Après l’application de chaque impulsion de tension de rodage, lancez l’outil de test de membrane pour vérifier si des transitoires de capacité plus importants apparaissent.
REMARQUE : La présence de transitoires de grande capacité (Figure 7C) indique que l’effraction s’est produite et que toute la capacité de la cellule est mesurée (~1 pF pour les spermatozoïdes humains et ~2,5 pF ou plus pour les spermatozoïdes murins). - Ajustez les transitoires de grande capacité à l’aide de l’outil de test de membrane pour déterminer la capacité de l’ensemble de la cellule ainsi que sa résistance d’accès.
REMARQUE : La résistance d’accès doit être aussi faible que possible pour une perfusion efficace de l’intérieur du spermatozoïde avec la solution de micropipette, ainsi que pour une pince de tension fiable de la membrane plasmique du spermatozoïde. La résistance d’accès est généralement de 25 à 30 MΩ et de 50 à 70 MΩ pour les solutions intracellulaires à base de Cs+ /K+ et NMDG, respectivement. - Une fois l’effraction réussie, procéder aux expériences de patch-clamp de cellules entières prévues, telles que l’application de diverses solutions de bain (Figure 8) contenant différents composés ou la mesure des activités des canaux à l’aide de protocoles de pas de tension (Figure 8, Figure 9) ou de rampe de tension. Si l’effraction n’a pas réussi, revenez à l’étape 6.4.1. en choisissant une micropipette fraîche et en sélectionnant un autre spermatozoïde approprié.
Résultats
La méthode de clamp de patch à spermatozoïdes permet d’enregistrer directement le canal CatSper.
Comme mentionné ci-dessus, les enregistrements CatSper ont été réalisés en établissant un joint à haute résistance (gigaohm) entre la pipette patch et le spermatozoïde de mammifère au niveau de sa gouttelette cytoplasmique. Lors de l’effraction et de la transition vers le mode cellule entière, un accès électrique complet à l’ensemble du corps du spermatozoïde et à son intérieur, y compris la tête et le flagelle du spermatozoïde, est obtenu 2,8,39,51. Cette condition permet finalement l’enregistrement à partir de n’importe quel canal ionique actif situé sur la membrane plasmique du spermatozoïde. Une solution sans divalent nominal (DVF) contenant du césium ou du sodium comme ion principal est préférable pour l’enregistrement des courants CatSper monovalents 2,8,39,51. Alors que le canal CatSper conduit des ions divalents tels que Ca2+ et Ba2+, ils se déplacent à travers le pore CatSper à un rythme beaucoup plus lent, ce qui entraîne des conductances à peine détectables de quelques picoampères (~10-20 pA)2,8,39,51. Par conséquent, la mesure de courants monovalents et, par conséquent, plus importants, à travers le canal CatSper est un moyen plus pratique d’évaluer le courant (Figure 8). Il est important de noter que CatSper est également perméable au potassium ; par conséquent, le canal CatSper doit être bloqué, ou les spermatozoïdes déficients en CatSper doivent être utilisés dans des situations où l’on souhaite étudier uniquement les canaux potassiquesdes spermatozoïdes 2,3,8,28,65. En faisant varier la composition ionique de la pipette et de la solution de bain, on peut exclure sélectivement certains canaux ioniques, tout en créant des conditions pour l’enregistrement sélectif à partir de certains types de canaux ioniques spécifiques. Par exemple, l’ajout de Cs+ dans la solution de pipette entraîne le blocage de la perméabilité ionique par les canaux potassiques des spermatozoïdes.
Le canal CatSper est régulé différemment entre les espèces de mammifères.
Les spermatozoïdes de différentes espèces sont divers dans leur morphologie et leurs voies de régulation internes66. Il n’est pas surprenant que leurs canaux ioniques soient également régulés de manière unique de manière à refléter les microenvironnements spécialisés des voies reproductrices masculines et féminines. La méthode du patch-clamp de sperme a été appliquée avec succès à six espèces de mammifères : murine2, rat56, humain39,51, bovin, verrat et macaque41, comme le montre la figure 9. Pour ces expériences, des spermatozoïdes de macaques rhésus mâles adultes [Macaca mulatta] ont été obtenus du Centre national de recherche sur les primates de Californie conformément aux normes de l’Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC) selon des protocoles animaux approuvés par l’Université de Californie à Davis, comme décrit dans41; et toutes les études ont été menées conformément au Guide for the Care and Useof Laboratory Animals des National Institutes of Health des États-Unis. La semence de taureau et de verrat a été obtenue en tant que sous-produits exemptés de l’approbation spécifique de l’IACUC par les installations du département des sciences animales de l’UCD et tous les animaux ont été maintenus dans des installations approuvées par l’AAALAC. Le sperme de taureau et de verrat peut également être obtenu auprès de sources commerciales.
Les primates (Rhesus macaque) et les spermatozoïdes humains ont montré des propriétés et une régulation similaires du canal CatSper. Il est intéressant de noter que l’activation de CatSper par la progestérone semble être unique aux spermatozoïdes de primates (figures 9 et 41), car les spermatozoïdes de verrat, de taureau et de rongeur n’ont montré aucune altération de leurs courants CatSper stimulée par la progestérone. Chez les spermatozoïdes de taureau et de verrat, même l’activité basale des canaux CatSper était inférieure aux limites détectables (Figure 9), ce qui suggère que chez ces espèces, l’afflux de calcium et l’hyperactivation qui en résulte sont provoqués par d’autres canaux/transporteurs, ou qu’un stimulateur naturel différent est nécessaire pour l’activation de leurs canaux CatSper. Chez toutes les espèces de spermatozoïdes mentionnées ici, y compris les spermatozoïdes de taureau et de sanglier, l’accès électrique complet à l’intérieur des spermatozoïdes a été obtenu et les cellules ont été enregistrées en mode cellule entière, comme en témoigne l’apparition de grands artefacts de capacité lors de l’effraction (Figure 7). Cette condition permet d’enregistrer facilement le canal CatSper fonctionnel, et son absence chez les spermatozoïdes de verrats et de bovins indique que ce canal est soit bloqué par un inhibiteur endogène encore inconnu présent dans les spermatozoïdes de ces espèces, soit nécessite l’activation d’un modulateur spécifique. Cependant, il s’agit d’expériences préliminaires et des expériences supplémentaires seront nécessaires pour les spermatozoïdes de verrat et de taureau afin de garantir l’importance fonctionnelle du canal CatSper chez ces espèces. Ce large spectre de diversité des canaux ioniques des spermatozoïdes entre les espèces pourrait être lié au rapport entre la taille des spermatozoïdes et la taille des œufs, à la relation entre la taille des spermatozoïdes et les vêtements protecteurs des œufs, ou servir d’obstacle à la fécondation par d’autres espèces66.

Figure 1 : Diversité morphologique des spermatozoïdes de mammifères. (A) Panneau inférieur : représentation schématique d’un spermatozoïde ; Les compartiments cellulaires sont étiquetés. Panneaux supérieurs : Images CID de spermatozoïdes de différentes espèces dans le sens des aiguilles d’une montre : rat (Rn ; Rattus norvegicus) ; souris (Mm ; Mus musculus) ; taureau (Bt ; Bos taurus) ; verrat (Sd ; sus scrofa domesticus) ; humain (Hs ; Homo sapiens) et le macaque rhésus (Mmu ; Macaca mulatta). La barre d’échelle s’applique à toutes les images DIC. Les inserts indiquent les gouttelettes cytoplasmiques. (B) Patchage des spermatozoïdes de mammifères. Pour obtenir une formation d’étanchéité réussie entre la pointe de la pipette et la membrane plasmique, une partie de la membrane plasmique est doucement aspirée dans la pointe de la pipette. Le passage en mode cellule entière s’effectue par rupture de la membrane plasmique entre l’extrémité et la cellule (cette figure a été reproduite à partir de8). Panneau de droite : spermatozoïdes humains attachés à une micropipette enregistreuse. (C) Représentation schématique des spermatozoïdes humains et de certains des canaux ioniques flagellaires étudiés dans les spermatozoïdes humains avec la méthode du patch clamp, ainsi que des ions qu’ils conduisent. CatSper- canal ionique calcique39,51 ; Hv1- canal de protons 51,56,67 ; Slo3/Slo1- canaux potassiques 50,53,65,68 ; TRPV4- récepteur transitoire potentiel canal cationique vanilloïde de type 448. Veuillez cliquer ici pour voir une version agrandie de cette figure.
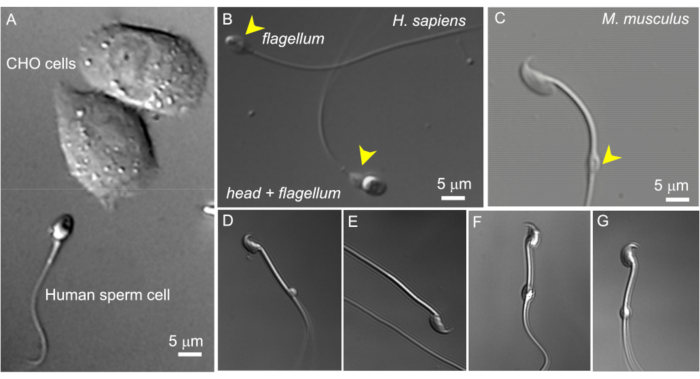
Figure 2 : Taille des spermatozoïdes et morphologie variable des gouttelettes cytoplasmiques. Les images DIC de spermatozoïdes vivants intacts. (A) Comparaison de la taille d’un spermatozoïde humain (en bas) et de deux cellules CHO (en haut). (B) Spermatozoïde humain (Homo sapiens) intact (en bas) et un spermatozoïde sans tête (flagelle, en haut). Les gouttelettes cytoplasmiques sont indiquées par des pointes de flèches jaunes ; Cette figure est reproduite à partir dela figure 8. (C) Spermatozoïde murin intact (Mus musculus) avec les gouttelettes cytoplasmiques (CD) de forme normale indiquées par la pointe de flèche jaune. (D-G) Les spermatozoïdes murins de l’épididyme ont des gouttelettes cytoplasmiques de différentes tailles et formes ; seuls (C) et (G) conviennent pour le patch-clamp. (D) Le CD est microscopique et unilatéral ; (E) CD manquant ; (F) le CD contient des particules qui peuvent obstruer la pipette d’enregistrement ; (G) Le CD est lisse, uniforme et non gonflé. Former un gigaseal avec ce type de CD se traduira probablement par un enregistrement réussi. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Composants du dispositif de serrage du sperme. (A) Banc d’électrophysiologie typique des spermatozoïdes avec composants essentiels : (1) microscope inversé ; (2) numériseur à faible bruit ; (3) amplificateur ; (4) micromanipulateur à faible dérive couplé au microscope inversé avec une plate-forme de micromanipulateur ; (5) ordinateur PC ; (6) une table d’air amortissant les vibrations ; (7) Cage de Faraday pour protéger l’installation des interférences électriques ambiantes. Il est essentiel que tous les composants électriques de la plate-forme, y compris le clavier et la souris de l’ordinateur, produisent un bruit électrique faible ou nul (50 Hz ou 60 Hz) et que tous les composants de la plate-forme soient correctement mis à la terre. (B) Extracteur de micropipette utilisé pour l’enregistrement de la fabrication des pipettes. (C) (1) microForge utilisé pour le polissage au feu des pipettes ; (2) Capillaires en verre borosilicaté d’un diamètre extérieur de 1,5 mm, d’un diamètre intérieur de 0,86 mm et d’un filament interne ; (3) Boîte de collecte de pipettes. (D) Etapes de réussite du polissage au feu des pipettes : (a) Pipette non polie d’un diamètre intérieur de 2 mm ; b) Pipette polie au feu d’un diamètre intérieur de 0,5 mm ; c) Pipette scellée trop polie qui ne convient pas à l’enregistrement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Composants du système de la chambre d’enregistrement et de son assemblage. (A) Composants essentiels du système de la chambre d’enregistrement : (1) adaptateur de platine de microscope pour plates-formes de la série 20 avec (2) pinces de maintien à deux étages ; (3-4) plate-forme chauffante magnétique de la série PM avec (3) pinces magnétiques pour maintenir la chambre de perfusion ; (5) chambre de perfusion ; (6) Pont d’Agar ; (7) pince magnétique, électrode de référence avec jack 2 mm vers pastille Ag/AgCl ; (8) support magnétique (MAG-1) pour la conduite d’aspiration ; (9) tube d’aspiration ; (10) support torique du tube d’aspiration. (B) Système de chambre d’enregistrement assemblé avec les composants indiqués de (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Composants du système de perfusion. (A) la ligne de perfusion assemblée et (B) ses composants essentiels : (1) des seringues de 20 mL et de 3 mL ; (2) robinet d’arrêt avec raccords Luer ; 4 voies ; serrure mâle ; (3) adaptateur cannelé de tuyau Luer femelle, 1/16" ; (4) Tubulure de perfusion en polytétrafluoroéthylène (PTFE Microbore, 0,022 » ID × 0,042 » OD) ; (5) Collecteur de perfusion à 8 positions en polytétrafluoroéthylène ; (6) Tube de connecteur en silicone (tube en silicone durci au platine, 1/32 » ID × 3/32 » OD) ; (7) Tube de connecteur de collecteur (tube PTFE, 1/32 » ID × 1/16 » OD). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Dissection de souris mâles. (A) Organes reproducteurs mâles murins ; Les testicules et l’épididyme sont montrés. (B) Les épididymes sont transférés dans une boîte de culture cellulaire de 35 mm contenant une solution de HS et la graisse résiduelle et le canal déférent sont éliminés. (C) Chaque épididyme est ensuite divisé en caput, corps et cauda à l’aide d’une lame de scalpel #15. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Formation gigaseal et effraction avec le spermatozoïde murin. L’interface de l’outil « Membrane Test » du logiciel commercial de patch clamp. Trois étapes de serrage du patch spermatozoïde : (A) la pipette enregistrée est immergée dans une solution HS à bain produisant une résistance de pipette de 14,8 MΩ ; (B) Un gigaseal se forme (la résistance est de 4,7 GΩ), les transitoires de capacité sont compensés et le spermatozoïde est soulevé de la lamelle ; (C) Passage en mode cellule entière. L’effraction et la transition vers le mode cellule entière sont effectuées en appliquant des impulsions de tension courtes (1 ms) augmentant progressivement (430-650 mV, incrément de ~50 mV) combinées à une légère aspiration, comme indiqué à gauche. L’effraction s’est produite, comme en témoigne l’apparition des grands transitoires de capacité qui reflètent la capacité totale de la cellule (~2,93 pF pour ce spermatozoïde). Veuillez cliquer ici pour voir une version agrandie de cette figure.
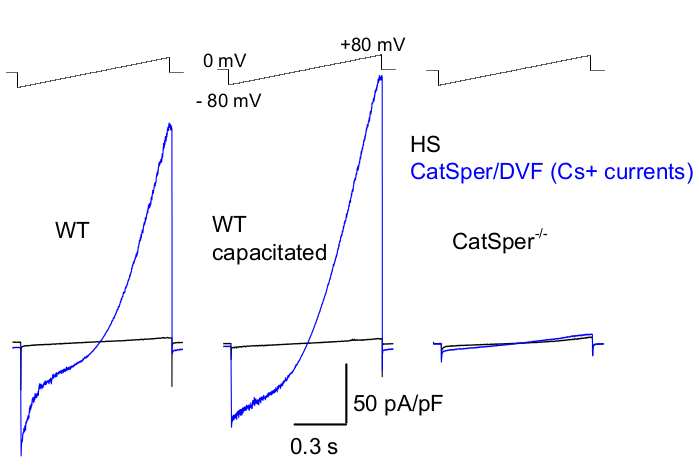
Figure 8 : Enregistrement murin de CatSper à partir de spermatozoïdes caudales épididymaires, capacités et CatSper de type sauvage (WT). Pour enregistrer l’activité monovalente de CatSper, un protocole de rampe est appliqué toutes les 5 s et les courants CatSper sont déclenchés par des rampes de tension à partir d’un potentiel de maintien de 0 mV39,51. Les rampes de tension (-80 mV à 80 mV ; 850 ms) sont appliquées en HS et en solution nominalement sans divalent (DVF). Les données ont été échantillonnées à 2-5 kHz et filtrées à 1 kHz. Les courants de base sont enregistrés dans la solution HS, qui ne produit pas de courant CatSper en raison de l’inhibition par un magnésium extracellulaire élevé39,51. Les courants de référence sont utiles pour estimer la conductance de la fuite (voies des canaux non ioniques). Densités de courant CatSper représentatives de cellules entières Cs+ (pA/pF ; bleu) enregistrées à partir de spermatozoïdes murins caudales WT (non capacitaires ; à gauche et capacitaires ; au milieu) et de spermatozoïdes murins caudaux déficients en CatSper (à droite). Des courants ont été provoqués par des rampes de tension à partir d’un potentiel de maintien de 0 mV et des rampes ont été appliquées de -80 mV à 80 mV en solution HS et nominalement sans divalent. Courants de référence (noirs) enregistrés dans la solution HS. Pour obtenir les densités de courant, les amplitudes de courant CatSper ont été normalisées en fonction de la capacité de la cellule (pA/pF). Veuillez cliquer ici pour voir une version agrandie de cette figure.
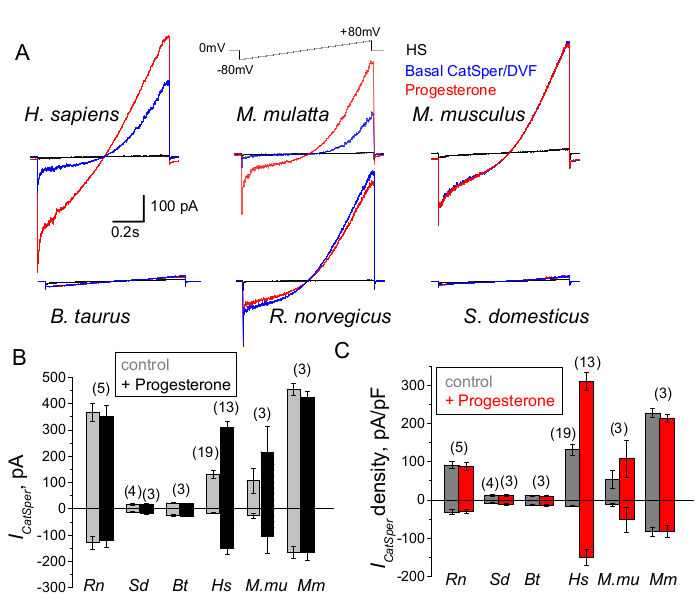
Figure 9 : Régulation de la progestérone de CatSper chez différentes espèces de mammifères. (A) Courant CatSper représentatif induit à partir de spermatozoïdes de différentes espèces par un protocole de rampe de tension comme indiqué. Espèce : humaine (Hs ; H. sapiens) ; macaque rhésus (Mmu ; M. mulatta), souris (Mm ; M. musculus), taureau (Bt ; B. taurus) ; rat (Rn ; R. norvegicus) ; verrat (Sd ; S. scrofa domesticus). Les courants CatSper en l’absence (bleu) et la présence (rouge) de 1 mM de progestérone ont été enregistrés, ainsi que les courants basaux en solution HS (noir). (B) Amplitudes de courant CatSper (ICatSper, pA) et (C) Enregistrements des densités de courant moyennes (pA/pF) à partir de spermatozoïdes de différentes espèces, comme indiqué ; n indique le nombre de spermatozoïdes individuels utilisés. Les données sont moyennes +/- S.E.M. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 10 : La différence de motilité flagellaire. Deux exemples représentatifs de gouttelettes cytoplasmiques et de motilité flagellaire. Les images superposées des mêmes spermatozoïdes de rat (Rn) et d’homme (Hs) ont été prises à deux moments différents lorsqu’elles montrent la déviation flagellaire la plus distale. Les rectangles pointillés indiquent la région avec les gouttelettes cytoplasmiques et leur mobilité spatiale correspondante. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 11 : Ensemble du tube en U et ses composants essentiels. (A) Composants du tube en U : (1) pipette sérologique de 10 mL ; (2) Tube en silicone ; (3) Tube de connecteur en silicone ; (4) seringue de 1 ml ; (5) Adaptateur de barbe Luer femelle ; (6) adaptateur de verrouillage intégral Luer mâle 1/8" ; (7) robinet d’arrêt avec raccords Luer ; 4 voies ; serrure mâle ; (8) adaptateur cannelé mâle de la série Luer, 1/16". (B) Tube en U entièrement assemblé et (C) Tube en U fixé à la cage de Faraday. Veuillez cliquer ici pour voir une version agrandie de cette figure.
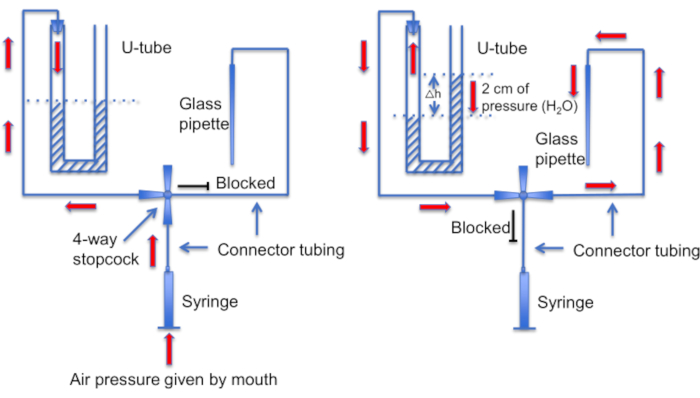
Figure 12 : Représentation schématique de l’ensemble du tube en U. Panneau gauche : Une pression d’air positive est fournie par la bouche pour créer une différence dans les niveaux de liquide dans le tube en U. Le niveau de liquide dans la corne droite augmente de 2 cm. Une fois cette différence de niveau créée, le robinet d’arrêt est tourné pour relier le tube en U à la ligne menant à une pipette enregistreuse. Panneau droit : le niveau de liquide plus élevé dans la corne droite crée une pression positive qui pousse constamment la solution de la pipette hors de la pointe de la pipette et maintient la pointe exempte de débris. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Produits chimiques | Poids molaire (g/mol) | mm | g pour 1L |
| NaCl | 58.44 | 97.8 | 5,72 grammes |
| Kcl | 74.55 | 5 | 0,373 g |
| KH2PO4 | 136.09 | 0.37 | 50,4 mg |
| MgSO4 x 7.H2O | 246.48 | 0.2 | 49,3 mg |
| CaCl2 x 2.H2O | 147.02 | 2 | 0,294 gramme |
| HEPES | 238.3 | 20 | 4,766 grammes |
| Glucose | 180.2 | 3 | 0,540 g |
| Lactate de sodium (60 % p/p) | 112.06 | 20 | 3 ml |
| Pyruvate de sodium | 110 | 0.4 | 44 mg |
Tableau 1 : Solution de liquide tubulaire humain (HTF)
| Produits chimiques | Poids molaire (g/mol) | mm | g pour 1L |
| NaCl | 58.44 | 135 | 7,889 grammes |
| Kcl | 74.55 | 5 | 0,373 g |
| CaCl2 x 2. H2O | 147.02 | 2 | 0,294 gramme |
| MgSO4 x 7. H2O | 246.48 | 1 | 0,247 g |
| HEPES | 238.3 | 20 | 4,766 grammes |
| Glucose | 180.2 | 5 | 0,901 gramme |
| Lactate de sodium (60 % p/p) | 112.06 | 10 | 1,5 ml |
| Pyruvate de sodium | 110 | 1 | 0,110 g |
Tableau 2 : Solution à haute salinité (HS)
| Produits chimiques | Poids molaire (g/mol) | mm | g (pour 500 ml) |
| CsMeSO3 | 228.0 | 140 | 15.960 grammes |
| HEPES | 238.3 | 40 | 4,766 grammes |
| EDTA | 292.24 | 1 | 0,146 g |
Tableau 3 : Solution de bain CsMeSO3 (solution de bain sans divalent : DVF)
| Produits chimiques | Poids molaire (g/mol) | mm | mg (pour 25 ml) |
| CsMeSO3 | 228.0 | 130 | 741 mg |
| HEPES | 238.3 | 70 | 417 mg |
| EDTA | 292.24 | 2 | 14,6 mg |
| EGTA | 380.35 | 3 | 28,5 mg |
| CsCl | Solution de 1 M | 1 | 25 μl |
Tableau 4 : Solution de pipette CsMeSO3
Discussion
Nous décrivons un protocole détaillé pour effectuer des enregistrements électrophysiologiques à partir de spermatozoïdes de différentes espèces. Compte tenu de l’importance physiologique des canaux ioniques et des transporteurs électrogènes pour les spermatozoïdes, cette technique est un outil puissant pour étudier la physiologie des spermatozoïdes ainsi que les défauts qui conduisent à l’infertilité masculine. L’expérimentateur peut trouver l’exécution de cette technique difficile au début, mais avec de la persévérance et de l’endurance, le succès suit.
Les spermatozoïdes de mammifères sont longs (généralement >50 μm), étroits et très mobiles. La fréquence de battement basal (BF) des spermatozoïdes de mammifères varie considérablement, avec des valeurs moyennes de 4 Hz (souris 69), 7-15 Hz (verrat 70,71), 11 Hz (rat 72), 11-20 Hz (taureau 18), 24 Hz (macaque rhésus 23) et jusqu’à 25 Hz (humain 3). La gouttelette cytoplasmique (CD) est la porte d’entrée pour l’enregistrement des spermatozoïdes. Chez les spermatozoïdes de rongeurs, le CD est souvent distal mais se déplace le long du flagelle (Figure 10), créant un obstacle supplémentaire à l’enregistrement. Cependant, dans les spermatozoïdes humains, le CD est plus souvent situé près de la tête. Les composants clés d’un patch-clamp à spermatozoïdes réussi sont donc une excellente optique permettant une vue claire et nette du CD et un système de micromanipulateur très précis sans dérive ni vibration. Un taux initial élevé d’échec est attendu et est normal dans les premiers jours suivant la clamp du patch spermatozoïdal. Nous recommandons une pratique de routine impliquant de nombreuses tentatives par semaine. Réaliser plusieurs enregistrements par jour et par semaine permettra d’établir une routine et d’améliorer la motricité.
Jusqu’à récemment, l’identification et la caractérisation pharmacologique des canaux ioniques des spermatozoïdes étaient entravées par l’incapacité de les étudier directement. Le domaine s’est largement appuyé sur des études d’immunocytochimie, qui souffrent souvent de la non-spécificité des anticorps et/ou de l’absence de modèles génétiques correspondants. Pour étudier les canaux calciques, la méthode classique d’imagerie calcique a été largement utilisée, ce qui a ses propres avantages et limites 73,74,75,76,77. Bien que l’imagerie calcique soit une méthode relativement facile qui est applicable aux études à moyen et haut débit 78,79,80,81 et qui est moins invasive, elle nécessite des cellules relativement intactes et constitue donc un obstacle pour disséquer la fonction des canaux ioniques découplés des cascades de signalisation intracellulaire ou pour les distinguer des échangeurs d’ions calcium. De plus, il est difficile de contrôler le potentiel membranaire et, par conséquent, d’exclure la contribution des canaux calciques voltage-dépendants. Parmi les nombreux avantages de la fluorométrie calcique, il y a l’utilisation de colorants ratiométriques de calcium qui permettent une mesure précise des changements de concentration en ions calcium. Dans le même temps, il faut être conscient que la sensibilité de ces colorants peut varier en fonction des changements de pH intracellulaires.
Nous décrivons ci-dessous les étapes critiques du protocole, y compris les étapes de dépannage de la méthode. Il est essentiel de n’utiliser que des réactifs purs pour la préparation des solutions expérimentales, car même une petite contamination par des ions indésirables (tels que le magnésium ou les métaux lourds) peut nuire à la détection des courants monovalents. Compte tenu de la petite taille des spermatozoïdes, on peut s’attendre à un nombre relativement faible de canaux ioniques par cellule. Par conséquent, le courant net varie de quelques pA à plusieurs centaines de pA. Par conséquent, le bruit électrique interne de la plate-forme doit être minimal pour assurer la détection de petits courants, et l’utilisation d’un équipement sans dérive est fortement recommandée. Afin de distinguer une conductance spécifique du bruit électrique et de la fuite de fond, l’appareil d’enregistrement et le système de mise à la terre doivent être maximisés. Ceci est réalisé en mettant correctement à la terre la plate-forme pour éviter toute interférence électrique82. L’utilisation d’une cage de Faraday est fortement recommandée pour se protéger des interférences électriques produites par une variété d’appareils électriques, tels que les lumières de bâtiment et le câblage électrique mural. Il est essentiel que tous les composants électriques de la plate-forme, y compris le clavier et la souris de l’ordinateur, émettent peu ou pas de bruit électrique (50 Hz ou 60 Hz) et que tous les composants de la plate-forme soient correctement mis à la terre. Le bruit électrique dans la configuration de la cellule entière lorsque tous les canaux ioniques sont fermés doit être < 0,5-1 pA.
Un autre point important est de surveiller les osmolarités correctes des solutions de travail. La composition des solutions intra- et extracellulaires doit être déterminée avec précision et leurs osmolarités mesurées correctement. La solution extracellulaire doit être légèrement hypotonique par rapport à la solution de pipette car elle entraîne un gonflement minuscule des cellules et empêche la pipette d’être obstruée par la membrane du spermatozoïde. Remarque : si la solution de pipette est trop hypertonique et diffère de la solution de bain de plus de 10 mOsm, il s’ensuit un gonflement excessif des cellules et une rupture du joint. En conséquence, la cellule sera fragile et le gigaseal perdu dans les secondes qui suivent l’effraction. D’après notre expérience, une préparation inexacte de la solution est l’une des erreurs les plus courantes qui empêchent un patch-clamping réussi.
Un autre obstacle potentiel à éviter est le plastique contenant des plastifiants/phtalates, ainsi que les seringues lubrifiées à l’huile minérale. Les tubes, les seringues et tout l’équipement en plastique qui rencontre des solutions, et donc des spermatozoïdes, ne doivent pas lessiver des plastifiants ou d’autres toxines ou huiles environnementales, car ces produits chimiques peuvent modifier considérablement l’activité des canaux ioniques. Nous utilisons des tubes en téflon de petit diamètre comme ligne de perfusion principale. Le téflon (PTFE) a peu de composés lixiviables mais est plutôt rigide. Les raccords flexibles sont faits d’un tube en silicone de haute pureté qui s’adapte sur le tube en téflon. Toutes les seringues utilisées pour le système de perfusion manquent de lubrifiant, car l’huile minérale ou d’autres additifs lubrifiants peuvent interférer avec l’enregistrement des canaux ioniques.
Nous ne saurions trop insister sur l’importance d’utiliser le bon verre et de tirer la bonne forme de micropipette. Par conséquent, la fabrication optimale de micropipettes en verre est une condition préalable à la réussite du patchage. Nous utilisons des micropipettes en verre fabriqué uniquement à partir de verre borosilicaté contenant un filament pour un meilleur remplissage de la solution. L’extrémité des pipettes doit être polie au feu pour assurer l’étanchéité idéale. Les pointes de pipette de plus de 2 m de diamètre (et donc d’une résistance de 10 MΩ ou moins) ne conviennent généralement pas au patch-clamp pour spermatozoïdes.
Une autre étape importante consiste à s’assurer que la pointe de la micropipette est exempte de débris ou de bulles d’air avant la formation du joint. Il s’agit d’une tâche difficile étant donné que la micropipette est chargée dans une solution remplie de cellules mobiles. Un facteur qui permet d’éviter de « cogner » accidentellement la pipette dans des spermatozoïdes nageant librement, est d’utiliser une perfusion constante pour éliminer toutes les cellules non adhérentes. Un autre outil est un « tube en U » fait maison qui permet de basculer entre les modes de pression positive et négative pour garder la pointe propre (Figure 11 et Figure 12).
Comme les spermatozoïdes varient considérablement dans la forme et la taille de leurs gouttelettes cytoplasmiques (CD), il est important de choisir une gouttelette avec une morphologie appropriée. Comme le montre la figure 2, seuls les CD de petite taille (1-3 μm), lisses, uniformes et pas trop gonflés conviennent au patch-clamp. Minuscule, unilatéral ; Les CD « gonflés », entièrement transparents, produisent des joints faibles ou inexistants. Les CD contenant de grosses particules solubles peuvent obstruer la pipette d’enregistrement. Lorsque les spermatozoïdes testiculaires de souris pénètrent dans l’épididyme, leurs CD sont situés dans la région du cou, près de la tête. Au fur et à mesure qu’ils voyagent à travers l’épididyme, leurs CD se déplacent le long de la pièce médiane et finissent par arriver à la connexion entre la pièce médiane et la pièce principale (l’anneau) lorsque les spermatozoïdes atteignent la queue de l’épididyme. Par conséquent, comme mentionné ci-dessus dans les spermatozoïdes isolés du corps épididyme, le CD est généralement situé près du centre de la pièce médiane. Dans les cellules caudales, le CD se trouve généralement près de l’anneau (Figure 2C). Pour les spermatozoïdes humains, la CD est située dans la région du cou (Figure 2A,B).
Bien que ce ne soit pas un problème pour les spermatozoïdes isolés d’animaux de laboratoire, il existe une variabilité significative entre les donneurs humains. La variation de la qualité du sperme au sein d’un même donneur affecte principalement la qualité de la membrane plasmique du spermatozoïde et rend parfois la formation du joint relativement difficile. Il y a moins de variabilité dans le comportement des canaux ioniques et la pharmacologie, facteurs qui sont probablement en corrélation avec la génétique ou la physiologie individuelle. Il faut être persévérant et évaluer des échantillons de divers dons pendant plusieurs jours, ainsi que s’appuyer sur plusieurs participants de donneurs humains. Travailler avec du matériel humain nécessite une patience supplémentaire, car la qualité du sperme donné varie considérablement au sein d’un même donneur, en fonction de divers facteurs environnementaux. Nous vous recommandons d’évaluer les échantillons des différents jours de don afin de prendre une décision finale sur le statut du donneur. Alors que les spermatozoïdes purifiés éjaculés conviennent généralement à l’électrophysiologie dans les heures qui suivent (jusqu’à 12 heures après l’isolement pour les spermatozoïdes humains), les spermatozoïdes murins épididymaires ne conviennent au patchage que dans une fenêtre de 2 heures après l’isolement.
Et enfin, mais non des moindres, la formation du gigaseal diffère entre les spermatozoïdes. Pour les spermatozoïdes murins/rongeurs, la formation de gigaseal se produit presque instantanément, tandis que plusieurs secondes (et parfois jusqu’à une minute) sont nécessaires pour former un gigaseal avec un spermatozoïde humain. Souvent, l’aspiration initiale aboutit à une résistance d’entrée allant de 200 MΩ à 800 MΩ. La commutation du potentiel de maintien à -60 mV et la fourniture d’impulsions courtes jusqu’à 10 mV aident souvent à sauver la formation de gigaseal (par le mouvement de la membrane dans la pipette induit par le champ de tension).
La technique de patch clamp de spermatozoïdes permet l’étude détaillée de canaux ioniques spécifiques dans leur système d’expression naturel. Le succès de la technique dépend d’un équipement approprié, de spermatozoïdes viables de haute qualité, de réactifs purs, de compétences de base en électrophysiologie, de patience et de persévérance. La méthode ouvre de nouvelles frontières dans la physiologie des spermatozoïdes en étudiant la diversité évolutive des canaux ioniques, les mécanismes de leur régulation et les altérations de leur fonction lorsqu’ils se déplacent de l’appareil reproducteur masculin à l’appareil reproducteur féminin et sont modifiés par des conditions exogènes, telles que le pH et les ligands.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le NIH Grant R01GM111802, le Pew Biomedical Scholars Award 00028642, le Alfred P. Sloan Award FR-2015-65398 et le Packer Wentz Endowment Will (à P.V.L.). Ce travail a également été soutenu par la Deutsche Forschungsgemeinschaft (Fondation allemande pour la recherche) 368482240/GRK2416 (à N.M.) et par la bourse du China Scholarship Council à B.L. Nous remercions le Dr Dan Feldman pour le partage de tissus de rats, Katie Klooster et Stuart Meyers de l’UC Davis pour leur aide dans l’acquisition de spermatozoïdes de primates, et Steven Mansell pour l’aide dans l’analyse de l’acquisition de données à partir de spermatozoïdes de verrats et de taureaux.
matériels
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
Références
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon