Method Article
Запись электрических токов через плазматическую мембрану сперматозоидов млекопитающих
В этой статье
Резюме
Этот протокол описывает, как выполнять электрические записи сперматозоидов млекопитающих в конфигурации целых клеток с целью непосредственной регистрации активности ионных каналов. Этот метод сыграл важную роль в описании электрофизиологических профилей нескольких ионных каналов сперматозоидов и помог выявить их молекулярную идентичность и регуляцию.
Аннотация
Регистрация электрической активности одной из самых маленьких клеток организма млекопитающих – сперматозоида – была сложной задачей для электрофизиологов на протяжении многих десятилетий. Метод, известный как «зажим сперматозоидного пластыря», был представлен в 2006 году. Он позволил напрямую регистрировать активность ионных каналов в конфигурациях целых клеток и присоединенных к клеткам и сыграл важную роль в описании физиологии сперматозоидов и молекулярной идентичности различных ионных каналов кальция, калия, натрия, хлорида и протона. Однако запись из одиночных сперматозоидов требует продвинутых навыков и подготовки в области электрофизиологии. Этот подробный протокол обобщает пошаговую процедуру и выделяет несколько «хитростей торговли», чтобы сделать его доступным для всех, кто хочет изучить увлекательную физиологию сперматозоида. В частности, протокол описывает запись из сперматозоидов человека и мыши, но может быть адаптирован практически к любому сперматозоиду млекопитающих любого вида. Протокол охватывает важные детали применения этого метода, такие как выделение сперматозоидов, выбор реагентов и оборудования, иммобилизация высокоподвижных клеток, формирование плотного (гигаомного) уплотнения между регистрирующим электродом и плазматической мембраной сперматозоидов, переход в режим цельного сперматозоида (также известный как обкатка) и примерная запись кальциевого ионного канала сперматозоидов. CatSper, из шести видов млекопитающих. Обсуждаются преимущества и ограничения метода зажима сперматозоидного пластыря, а также наиболее важные этапы.
Введение
Подобно традиционному патч-зажиму, изобретенному Эрвином Неером и Бертом Сакманном1, патч-хомут сперматозоидов позволяет исследовать активность отдельных ионных каналов, а также записывать активность всей популяции ионных каналов в пределах одной клетки 2,3. Метод позволяет идентифицировать конкретный тип ионного канала по степени развязки от ферментативных внутриклеточных процессов. Этот метод имеет решающее значение для определения активности ионного канала на основе его электрофизиологических и фармакологических отпечатков и, следовательно, обеспечивает надежную стратегию идентификации. Недостатком метода является его неспособность обнаруживать неэлектрогенные транспортеры. Кроме того, базовая электрофизиологическая подготовка полезна для понимания нюансов протокола. Чтобы освоить технику патч-хомпа и применить ее к сперматозоидам млекопитающих, мы рекомендуем изучить базовую литературу по патч-хопу 4,5. В этой статье мы подробно описываем пошаговую процедуру и выделяем уникальные практики, которые делают эту технику простой для понимания и доступной для всех, кто хочет заниматься электрофизиологией сперматозоидов.
Ионный гомеостаз является важной физиологической функцией сперматозоидов, которая в значительной степени зависит от ионных каналов и транспортеров ионов для поддержания физиологически важных ионных градиентов, изменения внутриклеточного кальция и изменения трансмембранного напряжения. Ионные каналы и транспортеры ионов регулируют основные функции сперматозоидов, такие как подвижность, навигация в женском репродуктивном тракте, созревание сперматозоидов, а в морских организмах хемотаксис по отношению к яйцеклетке 6,7,8,9,10,11,12 . Подвижность сперматозоидов – это постепенно приобретаемый процесс. Сперматозоиды в основном находятся в состоянии покоя во время их созревания в яичках и во время их последующего прохождения через придаток яичка. Их подвижность сдерживается кислой средой придатка яичка, что приводит к внутреннему закислению сперматозоида. Это ухудшает функцию аксонемы, поскольку она не может функционировать ниже pH 6,013,14. Однако при воздействии семенных жидкостей или более щелочной среды концентрация внутриклеточных ионов сперматозоидов и рН цитоплазмы претерпевают значительные изменения, и сперматозоид становится подвижным 15,16,17. Движение жгутика сперматозоида обеспечивается гидролизом АТФ, который поддерживает скольжение аксонемных микротрубочек18, и этот процесс сильно зависит отpH14. Кроме того, движение жгутиков также контролируется повышением внутрижгутикового кальция и цАМФ 13,19,20,21,22,23,24. Эти факторы, т.е. внутриклеточная концентрация кальция в сперматозоидах [Ca2+]i, pH, АТФ и цАМФ, являются основными регуляторными механизмами, позволяющими изменять подвижность, и их концентрации жестко регулируются ионными каналами и транспортерами сперматозоидов.
Сперматозоиды уникальны тем, что они экспрессируют ряд белков, которые не могут быть найдены больше нигде в организме. Яркими примерами являются ионные каналы сперматозоидов, такие как калиевой канал, Slo3 25,26,27,28,29 и ионный канал Cat Sperm, CatSper 2,30,31,32. Последний является основным кальциевым каналом сперматозоидов млекопитающих31 и регулируется внутриклеточным ощелачиванием 2,30,31,32,33,34. CatSper также регулируется видоспецифичными сигналами 7,35 и организован в четырехугольных продольных нанодоменах вдоль жгутика сперматозоида 36,37,38. У приматов CatSper активируется комбинацией жгутиковой щелочности, мембранной деполяризации и прогестерона 3,39,40,41, в то время как для мышиной активации CatSper прогестерон не требуется 2,39. Еще одной особенностью этого канала является его многокомпонентная организация: CatSper представляет собой комплекс, состоящий не менее чем из 10 различных субъединиц 31,32,34,37,38,42,43,44,45,46,47. Такая сложная структура и особенности ее регуляции препятствовали рекомбинантной экспрессии CatSper в любой известной гетерологичной системе экспрессии, и, следовательно, физиологическая характеристика CatSper была ограничена его родной системой экспрессии - сперматозоидом. В то время как молекулярная характеристика белка CatSper была достигнута в основополагающей статье в 2000 году D. Ren et. al.31, окончательное доказательство того, что CatSper является добросовестным ионным каналом, стало возможным только после внедрения метода зажима сперматозоидного пластыря в 2006году2. С тех пор этот метод позволил точно охарактеризовать многие ионные проводящие пути в сперматозоидах 9,28,37,39,40,44,46,48-54.
Считалось, что классический и наиболее простой метод изучения характеристик ионных каналов – метод патч-зажима – неприменим к сперматозоидам из-за их подвижности и специфической морфологии (рис. 1А). В частности,основными проблемами были крошечный объем цитоплазмы сперматозоида и плотное прикрепление плазматической мембраны сперматозоида к жестким внутриклеточным структурам, таким как фиброзная оболочка и ядро сперматозоида. Эти две структурные особенности приводят к созданию тонкой стреловидной клетки, которая предназначена для проникновения через высоковязкие среды, такие как защитные одежды яиц, без значительной деформации или повреждения плазматической мембраны.
Первым этапом метода патч-зажима является установление плотного прилегания между записывающей пипеткой (стеклянной микропипеткой) и клеточной плазматической мембраной. Для этого необходимо протянуть достаточное количество плазматической мембраны внутри записывающей пипетки, чтобы между плазматической мембраной и стеклом образовался механически стабильный гигаseal. Плазматическая мембрана должна быть гибкой и не жесткой (рис. 1B). Как упоминалось выше, вся поверхность плазматической мембраны сперматозоида довольно плотно прилегает, за исключением области, известной как цитоплазматическая капля (рис. 1А и рис. 2). Следовательно, жесткая природа плазматической мембраны сперматозоидов считалась основным препятствием в получении плотного уплотнения или «гигасила», названного так потому, что для хорошей записи требуется >109 Ом. Тем не менее, внедрение в 2006 году техники зажима сперматозоидного пластыря2 устранило этот барьер, и этот метод может быть успешно применен к сперматозоидам нескольких видов млекопитающих 2,41,51,56. Этот прорыв был достигнут путем сосредоточения внимания на цитоплазматической капле (CD)2,8, крошечной структуре, расположенной вдоль средней части сперматозоида (Рисунок 1А и Рисунок 2), и которая является просто остатком удлиненной сперматиды – предшественника сперматозоидов, из которого развиваются голова и хвост. Функционально это может помочь клетке адаптироваться к изменениям внеклеточной осмолярности во время эякуляции. Важной особенностью является то, что плазматическая мембрана внутри CD достаточно гибкая, чтобы ее можно было втянуть в пипетку с образованием гигаомного уплотнения. Таким образом, CD сперматозоида является лучшей частью на поверхности сперматозоида, с помощью которой можно добиться успешного формирования гигаобласти и перехода в режим цельной клетки, который в конечном итоге электрически связывает сперматозоид с усилителем 2,8. Стоит отметить, что в предыдущих публикациях сообщалось об успешном образовании гигасил на головке сперматозоида, что позволяет производить запись в конфигурации, прикрепленной к клетке, 54,57,58,59. Тем не менее, до сих пор сообщалось о записях в цельноклеточной конфигурации только путем выполнения гигапечатного формирования в области CD. Этот полноклеточный режим обеспечивает электрический доступ ко всему объему сперматозоидов и, следовательно, позволяет регистрировать активность ионных каналов, расположенных на жгутике сперматозоида, а также на головке сперматозоида. Всего за несколько лет с момента своего развития метод зажима сперматозоидного пластыря привел к огромному прогрессу в нашем понимании ионных каналов сперматозоидов и до сих пор является одним из наиболее надежных методов для непосредственного исследования функциональности ионных каналов сперматозоидов 9,28,37,39,40,44,46,48,49. 50,51,52,53 (Рисунок 1).
Зажим для сперматозоидов в некоторых деталях отличается от классической техники зажима пластыря, описанной ниже. Во-первых, большая часть плазматической мембраны сперматозоидов плотно прикреплена к жесткой внутриклеточной структуре, и, следовательно, сперматозоиды почти не имеют «запасной» плазматической мембраны, которую можно было бы втянуть в пипетку. Единственной областью, которая является гибкой, является мембрана CD, которая напоминает плазматическую мембрану многих соматических клеток, и поэтому может быть легко втянута в пипетку. Для формирования гигаомного уплотнения с CD создается отрицательное давление за счет легкого всасывания в верхней части пипетки, чтобы втянуть небольшую часть плазматической мембраны сперматозоида в кончик микропипетки (рис. 1B). Этот участок мембраны образует Ω-образную инвагинацию в кончик пипетки и устанавливает плотное уплотнение с ее внутренними стенками.
Во-вторых, цитоплазматическая капля в сперматозоидах человека и мыши составляет от 1 до 2 мкм (рис. 1 и рис. 2). Следовательно, применение техники патч-хомута к такому маленькому объекту требует оптики с высоким разрешением. Большинство установок для установки патч-зажимов для сперматозоидов оснащены инвертированным микроскопом с дифференциальным интерференционным контрастом (DIC) или оптическими компонентами Номарского (рис. 2 и рис. 3). Использование микроскопа, оснащенного оптикой DIC для зажима сперматозоидного пластыря, настоятельно рекомендуется по сравнению с более традиционной фазово-контрастной оптикой, поскольку пространственная информация, видимая в DIC, помогает достичь превосходной точности при размещении патч-пипетки на крошечном компакт-диске. Мы также рекомендуем использовать 60-кратный объектив с погружением в воду или аналогичный объектив с числовой апертурой 1,2. Этот объектив имеет большое рабочее расстояние (0,28 мм), что позволяет наблюдать за свободно плавающими сперматозоидами в растворе (рис. 2). Объектив также имеет регулировочное кольцо для регулировки толщины покровного стекла (варьируется от 0,13 до 0,21 мм). Эта комбинация большого рабочего расстояния и регулировочной муфты позволяет вести наблюдение через два защитных накладки 0,13 мм; Один покровный лист служит стеклянным дном записывающей камеры, а сверху размещается 5-миллиметровый покровный лист с осажденными сперматозоидами. Как обсуждалось ниже, размещение сперматозоидов на легко заменяемых круглых 5-миллиметровых покровных стеклах, а не непосредственно на дне записывающей камеры, является удобным способом загрузки свежих сперматозоидов в записывающую камеру.
В-третьих, установка для зажима сперматозоидного патча должна быть оснащена усилителем с низким уровнем шума и дигитайзером для регистрации крошечных (в диапазоне пикоампер) электрических токов и мельчайших изменений мембранного потенциала. Это оборудование должно обеспечивать наименьший уровень шума усилителя. Отсутствие вибрации является неотъемлемой частью успешной записи с помощью патч-хомута. Для зажима пластыря сперматозоида требуется прецизионный микроманипулятор без дрейфа, который можно прикрепить к инвертированному микроскопу с помощью платформы микроманипулятора для обеспечения лучшей стабильности по сравнению с независимой стойкой для микроманипулятора (Рисунок 3A). Чтобы проверить установку, не нужно заметить никаких движений наконечника пипетки (при увеличении менее 60-кратного увеличения) даже когда человек прыгает вверх и вниз по полу возле виброизоляционного стола.
протокол
Все эксперименты были проведены в соответствии с рекомендациями NIH по исследованиям на животных и одобрены Комитетом по уходу за животными и их использованию Калифорнийского университета в Беркли (AUP 2015-07-7742), при этом были приложены все усилия, чтобы свести к минимуму страдания животных. Все описанные методы согласуются с рекомендациями Комиссии по эвтаназии Американской ветеринарной медицинской ассоциации и комитета IACUC. Все экспериментальные процедуры с использованием образцов, полученных от человека, были одобрены Комитетом по исследованиям человека при Калифорнийском университете в Беркли, номер протокола IRB 2013-06-5395.
1. Изготовление стеклянных микропипеток для записи цельноклеточного патча сперматозоида с помощью зажима.
ПРИМЕЧАНИЕ: Небольшой размер цитоплазматической капли требует стеклянных микропипеток с тонкими наконечниками.
- Для изготовления микропипеток начните с капилляров из боросиликатного стекла с наружным диаметром 1,5 мм, внутренним диаметром 0,86 мм и внутренней нитью. Потяните за наконечник съемника микропипетки (рисунок 3B).
- Для придания формы и полировки наконечника пипетки на мгновение расположите горячую проволоку в непосредственной близости от наконечника. Выполните этот процесс огневой полировки при 100-кратном увеличении с помощью полировальной машины для пипеток (Рисунок 3C, D).
- Убедитесь, что внутренний диаметр наконечника пипетки составляет ~2 мкм перед огневой полировкой и уменьшается до ~0,5 мкм после надлежащей полировки.
ПРИМЕЧАНИЕ: К использованию рекомендуется использовать только свежевынутые пипетки, изготовленные в день записи. Это позволяет избежать скопления частиц пыли на наконечнике пипетки.
2. Настройка буровой установки
- Монтаж регистрирующей камеры
- Используйте малообъемную ромбовидную перфузионную камеру с ламинарным потоком и относительно быстрыми курсами обмена раствора (рис. 4). Подключите камеру через коллектор к перфузионной системе с гравитационной подачей (рис. 5).
- Чтобы перфузировать раствор через записывающую камеру, соберите простую самодельную гравитационную перфузионную систему с политетрафторэтиленовым коллектором, который соединяет перфузионную камеру с восемью отдельными перфузионными линиями.
Трубки не должны выщелачивать пластификаторы в растворы, так как такие химические вещества могут существенно влиять на нормальную функцию сперматозоидов60 и изменять активность ионных каналов61,62. В качестве основной перфузионной трубки настоятельно рекомендуется использовать политетрафторэтиленовую трубку малого диаметра. - Поскольку политетрафторэтиленовая трубка довольно жесткая, сделайте гибкие соединения с силиконовой трубкой высокой чистоты поверх политетрафторэтиленовой трубки. Кроме того, используйте шприцы (например, типа шприца Luer Lock), в которых отсутствует смазка, так как минеральное масло или другие присадки к смазке могут мешать записи ионных каналов (Рисунок 5).
- Сборка агарового моста
- Чтобы избежать изменения потенциала жидкостного перехода во время записи, поддерживайте стабильность окружающей среды вокруг электрода сравнения с помощью агарового моста (рис. 4).
- Чтобы сделать мост из агара, сделайте Г-образный стеклянный капилляр, согнув его под огнем небольшой горелки Бунзена, и дайте ему остыть.
- Сделайте раствор 1% агарозы в 1 М KCl и нагрейте его в микроволновой печи до тех пор, пока агароза не расплавится и раствор не станет прозрачным. Тщательно заполните L-образный стеклянный капилляр вышеуказанным раствором, чтобы избежать образования пузырьков воздуха, и дайте ему остыть до комнатной температуры. Агаровые мосты могут храниться в 1 М KCl в течение ~2 месяцев при температуре +4 °C.
- Чтобы использовать агаровый мост, заполните электрод сравнения для гранул Ag/AgCl 1 М KCl и осторожно вставьте агаровый мостик, чтобы избежать выпадения затвердевшей агарозы из стеклянного капилляра.
- Далее вставьте золотой штифт (2 мм) провода головки усилителя в паз электрода сравнения диаметром 2 мм (золото) и вставьте конец Г-образного агарового моста в перфузионную камеру, как показано на рисунке 4.
- Решения и рецепты
ПРИМЕЧАНИЕ: Все реактивы и химикаты должны быть высочайшей чистоты. Все приготовленные растворы фильтруются через стерильный фильтр PES 0,22 мкм и хранятся при температуре 4 °C до одного месяца. Следует отметить, что точная регулировка осмолярности является обязательным условием успешного зажима пластыря.- Приготовьте раствор жидкости для трубчатой жидкости человека (HTF), как описано в таблице 1. Отрегулируйте pH до 7,4 с помощью NaOH. Осмолярность должна составлять 280 ± 5 мОсм, измеряемая с помощью осмометра давления пара.
- Приготовьте высокосолевой раствор (HS) «ванна» или «внеклеточный» раствор, как указано в таблице 2. Отрегулируйте pH до 7,4 с помощью NaOH. Осмолярность должна составлять 320 ± 5 мОсм.
- Приготовьте «ванну» или «внеклеточный» раствор метаносульфоната цезия, как описано в таблице 3. Отрегулируйте pH до 7,4 с помощью CsOH и осмолярность до 320 ± 5 мОсм.
- Для приготовления внутриклеточного раствора цезиумметансульфоната (CsMeSO3) следует таблице 4 и отрегулируйте pH до 7,4 с помощью CsOH. Осмолярность должна быть на 10 мОм выше, чем у раствора HS.
3. Выделение и очистка сперматозоидов млекопитающих
ПРИМЕЧАНИЕ: Усыпьте самцов мышей C57BL/6 в возрасте 3-6 месяцев путем вдыхания CO2 с последующим вывихом шейки матки. После вывиха шейки матки немедленно выполнить забор тканей (хвоста или придатка яичка) у мышей.
- Выделение сперматозоидов придатка яичка и яичка мышей
ПРИМЕЧАНИЕ: Усыпьте самцов мышей C57BL/6 в возрасте 3-6 месяцев путем вдыхания CO2 с последующим вывихом шейки матки. После вывиха шейки матки немедленно выполнить забор тканей (хвоста или придатка яичка) у мышей.- Откройте ножницами нижнюю часть живота мыши и извлеките оба придатка яичка.
- Поместите их в 35-миллиметровую чашку для клеточных культур, наполненную раствором HS (высокосолевой раствор, см. Таблицу 2). Убедитесь, что аликвота раствора HS предварительно подогрета до комнатной температуры перед контактом со сперматозоидами.
- Перенесите эпидидимиды в новую чашку для клеточной культуры, содержащую раствор HS, и тщательно удалите весь остаточный жир.
- Разделите придатки яичек на капут, тело и хвост с помощью лезвия скальпеля #15 (Рисунок 6).
- Перенесите тело (или хвост, если необходимо) каждого придатка яичка в новую чашку для клеточной культуры, содержащую раствор HS. Сделайте множественные разрезы в изолированной части придатка яичка с помощью заостренного лезвия скальпеля #11.
- Перенесите части придатков яичек с множественными разрезами в микроцентрифужную пробирку объемом 1,5 мл, содержащую 1,5 мл раствора HS.
- Кратковременно встряхните сперматозоиды из придатка яичка в раствор с помощью сверхтонких щипцов Dumont типа 5a. Выбросьте эпидидимиды и оставьте пробирку при комнатной температуре на 10 минут.
- Подождите, пока твердое вещество (не сперматозоиды) оседает на дно пробирки, а затем перенесите надосадочную жидкость в другую микроцентрифужную пробирку объемом 1,5 мл.
- Смесь сперматозоидов хранят при комнатной температуре с доступом воздуха до 2 ч, в течение этого времени можно проводить эксперименты. Выделенные сперматозоиды теряют свою работоспособность через 3 ч после выделения.
- Емкость сперматозоидов мышей
ПРИМЕЧАНИЕ: Все сперматозоиды придатка яичка подходят для патч-хомута, но только сперматозоиды из придатка яичка достаточно зрелые, чтобы стать способными к оплодотворению. Поскольку каудальные сперматозоиды могут подвергаться какацитации, проводите эксперименты, в частности капацитацию сперматозоидов, с использованием каудальных сперматозоидов.- Выполните сбор спермы на каудальных или эякулированных сперматозоидах (см. шаги 3.1.1-4).
- Принимайте кауды изолированно, как описано в шаге 3.1.4. и наложите несколько разрезов, как описано в шаге 3.1.5. Переложите хвосты в 10-миллиметровую чашку для клеточных культур с 2 мл емкостного раствора.
- Инкубируйте каудальную ткань в этом емкостном растворе первоначально в течение 10 минут при 37 °C и 5% CO2, затем выбросьте ткань и инкубируйте высвободившиеся сперматозоиды в течение еще 50-80 минут.
ПРИМЕЧАНИЕ: Экстракорпоральная емкость каудальных сперматозоидов мышей достигается путем инкубации в течение 60-90 минут. Емкостные сперматозоиды визуально идентифицируются на основе чрезмерного асимметричного изгиба их жгутиков, известного как гиперактивация. Этот тип подвижности позволяет сперматозоидам плавать нелинейным образом.
- Сбор и очистка спермы человека
Примечание: В данном случае были получены образцы свежей спермы от 21 здорового добровольца в возрасте от 21 до 38 лет, а сперматозоиды были очищены с помощью метода «Комнатная температура», как подробно описано впунктах 48,63. Вкратце порядок действий выглядит следующим образом:- Оставьте образцы эякулята человека при комнатной температуре на 60 минут, чтобы дать возможность разжижению перед очисткой (более длительная продолжительность может негативно сказаться на качестве спермы).
- Нагрейте около 7 мл раствора HTF до 37 °C в центрифужной пробирке объемом 50 мл. Визуально оцените объем эякулята – если объем больше 1 мл, приготовьте несколько тюбиков раствора HTF.
- Аккуратно подложите 1 мл сжиженного эякулята на дно каждой пробирки, не поднимая нити спермы на поверхность буфера. Интерфейс спермы и HTF- должен быть максимально четким. Избегайте образования пузырьков воздуха.
- Поместите пробирки в инкубатор с температурой 37 °C на 1 час в подставку, которая удерживает их под углом 45° для максимальной площади поверхности. Если инкубатор является инкубатором сСО2 , плотно закройте крышку, чтобы предотвратить закисление буфера (СО2 для этой процедуры не требуется). Во время инкубации подвижные сперматозоиды будут постепенно подплывать к поверхности буфера HTF.
- Через 1 ч соберите самую верхнюю фракцию 1 мл из всех образцов в центрифужную пробирку объемом 15 мл, таким образом объединив высококачественные, высокоподвижные сперматозоиды для зажима пластыря. Не пытайтесь удалить всю надосадочную жидкость - оставьте несколько мл HTF, оставшихся над семенной плазмой, чтобы избежать загрязнения. Очищенную клеточную суспензию можно хранить при комнатной температуре в течение нескольких часов.
Примечание: Нормальный эякулят должен содержать, по крайней мере, 15 x 106 сперматозоидов на мл64, но количество сперматозоидов сильно варьируется в зависимости от образца. Препятствие в виде низкого количества клеток можно преодолеть, дав очищенной сперматозоидной суспензии постоять 30-60 минут при комнатной температуре перед зажимом пластыря. При этом условии клетки будут постепенно накапливаться на дне центрифужной пробирки и образовывать видимое клеточное облако, из которого можно пипетировать клетки в записывающую камеру (см. ниже).
- Емкость сперматозоидов человека
Примечание: Экстракорпоральная инкапсуляция сперматозоидов человека может быть достигнута путем 4-часовой инкубации в емкостном растворе: 20% фетальной бычьей сыворотки, 25 мМ NaHCO3 в буферах HTF или HS48,51. Емкостные сперматозоиды могут быть визуально идентифицированы на основе их активной подвижности и чрезмерного асимметричного изгиба жгутиков, что позволяет сперматозоидам плавать нелинейным образом.- Приготовьте емкостный раствор 2x и смешайте 1:1 с суспензией сперматозоидов.
- Проводите инкубацию при 37 °C и 5% CO2 в течение не менее 4 часов. Чтобы обеспечить высокий процент емкостных ячеек, время инкубации должно быть не короче 4 ч.
4. Приготовление лакирующего раствора (нужен только для пластыря-зажима для спермы человека)
ПРИМЕЧАНИЕ: Важным шагом является снятие прикрепленного сперматозоида с покровного стекла перед обкаткой. Этот шаг необходим только для сперматозоидов человека и требует нанесения покрытия на стеклянную покровную крышку для создания менее клейкой стеклянной поверхности. Покровное покрытие снижает вероятность прилипания сперматозоидов к покровному стеклу и позволяет поднять сперматозоиды человека из стеклянного покровного стекла после успешного формирования гигауплотнения.
- Разведите 200 мкл эякулята в 5 мл раствора HS в центрифужной пробирке объемом 15 мл.
- Уменьшите давление при 300 x g в течение 5 минут и удалите надосадочную жидкость.
- Повторно суспендируйте гранулу в 1 мл раствора HS и переложите в микроцентрифужную пробирку.
- Обрабатывайте ультразвуком в течение 10 минут при температуре 25 °C в ванне, наполненной водой.
- Вращайте при 10 000 x g в течение 5 минут.
- Перенесите надосадочную жидкость в свежую микроцентрифужную пробирку и используйте ее для нанесения покрытия (инструкция ниже).
5. Регистрация ионной проводимости от всей плазматической мембраны сперматозоида.
- Прикрепление сперматозоида к покровному листу.
ПРИМЕЧАНИЕ: Перед записью патч-зажима сперматозоиды наклеиваются на круглые покровные листы толщиной 5 мм.- При работе с клетками человека кратковременно окуните покровные стекла в приготовленный раствор покрытия с помощью острых щипцов.
- Поместите четыре крышки в одну лунку 4-луночного планшета и залейте 300 мкл раствора HS. Предотвратите всплытие защитных стекол, прикрепив их скотчем к нижней части 4-луночной пластины, надавливая на них пластиковым наконечником пипеттора.
- Осторожно ресуспендировать концентрированные суспензии сперматозоидов человека (шаг 3.3.5) или мыши (шаг 3.1.9) из пробирки для хранения (20-50 μл концентрированной спермы) в 300 μл раствора HS над покровным стеклом.
- Убедитесь, что сперматозоиды скапливаются на дне лунки, где их головки будут прикрепляться к покровному стеблю, а их жгутики будут энергично бить в растворе прямо над покровным стеклом. Важно дать сперматозоидам оседать на покровном стекле в течение примерно 10 минут при комнатной температуре перед регистрацией.
ПРИМЕЧАНИЕ: Если сперматозоиды человека плохо прикрепляются, вернитесь к пункту 5.1.1 и разбавьте приготовленный раствор для покрытия раствором HS (от 1:20 до 1:2). Этот этап должен быть скорректирован для образцов спермы от разных доноров на основе переменной подвижности сперматозоидов, которая обычно используется в препаратах спермы человека.
- Установка крышки
- Возьмите из лунки одну покровную крышку со слегка прилипшими клетками и поместите в ромбовидную лунку записывающей камеры, содержащей раствор ГС (рис. 4).
- Включите перфузионную систему (рисунок 5), заполненную раствором ГС, чтобы промыть камеру и удалить мусор и излишки отделившихся сперматозоидов из камеры. Это повысит вероятность того, что записывающая пипетка останется чистой, когда достигнет клеток. Этот шаг полезен при работе с неемкостными ячейками, которые имеют тенденцию сильнее прилипать к покровному стеклу.
ПРИМЕЧАНИЕ: При записи с емкостного сперматозоида следует избегать включения перфузии сразу после того, как в камеру будет помещена свежая защитная пленка. Емкостные сперматозоиды обладают энергичной подвижностью и лишь неплотно прикрепляются к покровному стеклу. Поэтому, чтобы обеспечить наличие наибольшего количества емких сперматозоидов, важно подождать ~ 10 минут и дать емким сперматозоидам прилипнуть к покровному стеклу перед включением перфузии. После выбора подходящей емкостной ячейки и формирования гигауплотнения перфузия может быть снова включена.
- Подбор сперматозоида для патч-фиксации.
- Найдите подходящий сперматозоид с цитоплазматической каплей с использованием 600-кратного увеличения (см. ниже). Это делается с помощью линзы с 60-кратным погружением в воду, как описано в методах, с окуляром с 10-кратным увеличением. В сперматозоидах, выделенных из придатка яичка, CD обычно расположен близко к центру промежуточного тела. В каудальных клетках CD обычно может быть обнаружен близко к кольцу (рис. 2C). Для сперматозоидов человека CD расположен в области шеи (рис. 2A, B).
ПРИМЕЧАНИЕ: Кроме того, опция выдвижения микроскопа с 1,6-кратным увеличением может быть использована для тщательного изучения морфологии сперматозоидов (увеличение 960x). - Убедитесь, что цитоплазматическая капля имеет овальную форму и слегка вытянутую (рисунок 2G), веретенообразную форму. Компакт-диски, которые кажутся очень круглыми и увеличенными, часто хрупкие и непригодны для наложения компенсаций (Рисунок 2D,F).
- Выберите сперматозоид, который является подвижным с головкой, прикрепленной к покровному стеблю, таким образом, чтобы сперматозоид был частично зафиксирован, но CD и остальная часть жгутика продолжали двигаться с биением жгутиков. Убедитесь, что головка сперматозоида слабо прикреплена к покровному листу, чтобы он немного вращался, когда жгутик перемещается из стороны в сторону.
ПРИМЕЧАНИЕ: Неплотное прикрепление важно, так как после формирования гигаомного уплотнения и перед переходом в полноклеточный режим сперматозоид должен быть поднят из покровного стекла в раствор.
- Найдите подходящий сперматозоид с цитоплазматической каплей с использованием 600-кратного увеличения (см. ниже). Это делается с помощью линзы с 60-кратным погружением в воду, как описано в методах, с окуляром с 10-кратным увеличением. В сперматозоидах, выделенных из придатка яичка, CD обычно расположен близко к центру промежуточного тела. В каудальных клетках CD обычно может быть обнаружен близко к кольцу (рис. 2C). Для сперматозоидов человека CD расположен в области шеи (рис. 2A, B).
- Формирование гигауплотнения
ПРИМЕЧАНИЕ: Для регистрации моновалентных токов CatSper в режиме полноэлементного питания пипетки заполняются раствором Cs-метансульфоната (также называемого пипеткой или внутриклеточным) (Таблица 4) - это дает сопротивление пипетки 11-17 МОм (Рисунок 7A), которое автоматически рассчитывается усилителем при подаче шага напряжения от 0 мВ до 10 мВ. Пипетки также могут быть заполнены другими растворами в зависимости от области применения. Рекомендуется изготавливать растворы с мобильными анионами, такими как метансульфонат, Cl- , аспартат или аналогичные ионы для снижения сопротивления пипетке. Осмолярность раствора пипетки должна быть на 10 мОм выше, чем раствора для ванны. Несколько более высокая тонус раствора для пипетки помогает свести к минимуму сопротивление доступу к сперматозоидам при записи патч-зажимом.- После визуального выбора сперматозоида с соответствующей морфологией (рис. 2G) заполните микропипетку раствором для пипетки (табл. 4) и закрепите его в держателе пипетки.
- Чтобы сохранить наконечник пипетки чистым от загрязнения, надавите на пипетку с помощью узла в форме U-образной трубки, чтобы раствор для пипетки вытекал из наконечника после его погружения во внеклеточный раствор, также называемый ниже «раствором для ванны» (см. Таблицу 2).
ПРИМЕЧАНИЕ: Если позволяют условия, настоятельно рекомендуется формировать уплотнение при постоянной перфузии, так как это условие обеспечивает максимальную чистоту наконечника пипетки. - Опустите пипетку вниз и погрузите ее кончик в раствор для ванны (табл. 2). В это время можно измерить сопротивление пипетки (Рисунок 7A).
- Чтобы наглядно визуализировать ячейку, расположите кончик пипетки над компакт-диском так, чтобы отверстие наконечника было выровнено по диагонали (приблизительно 45°) по направлению к компакт-диску.
- Быстро опустите кончик пипетки по направлению к компакт-диску, чтобы он находился в той же фокальной плоскости, в пределах нескольких мкм от компакт-диска.
- Как только кончик пипетки коснется компакт-диска, надавите на пипетку с помощью «мундштука», чтобы переместить часть капли внутрь наконечника и сформировать гигаомное уплотнение, также известное в электрофизиологии как «всасывающее событие». Как правило, после первоначального контакта с наконечником пипетки отрицательное давление в пипетке можно поддерживать в течение минуты, чтобы постепенно достичь гигаомного уплотнения.
- После успешного формирования гигаомного уплотнения (> 4-20 ГОм) поднимите сперматозоид из покровного стекла (рис. 7В).
ПРИМЕЧАНИЕ: Этот шаг не требуется для сперматозоидов грызунов из-за их длины; Тем не менее, частичная отслойка жгутика сперматозоида полезна для уменьшения потенциального дрейфа пипетки. Отслоение сперматозоидов человека является важным этапом, так как CD небольшой (1~3 мкм); Если клетка остается прикрепленной к покровному стеблю, даже небольшой дрейф пипетки во время эксперимента может нарушить работу компакт-диска. После того, как сперматозоид поднят, его жгутик в норме продолжает биться, при этом клетка прикрепляется только к микропипетке.
- Обкатка и переход в режим работы с целыми ячейками.
- Компенсация переходных процессов блуждающей емкости с помощью компенсаторного режима усилителя перед переходом в режим работы с целыми ячейками (рисунок 7B). Чтобы первоначально наблюдать емкостные переходные процессы, удерживайте потенциал мембраны на уровне 0 мВ и подавайте импульсы 10 мВ с помощью инструмента "Membrane Test" (рис. 7B).
- Выполните обкатку и переход в режим работы всей ячейки путем подачи коротких (1 мс) постепенно увеличивающихся (430-650 мВ, ~50 мВ) импульсов напряжения в сочетании с очень легким всасыванием (рис. 7C).
ПРИМЕЧАНИЕ: Для применения импульсов обкатки используйте ранее запрограммированный протокол обкатки в программном обеспечении патч-зажима. Импульсы напряжения обкатки подаются на сперматозоид с помощью высоковольтного командного входа (с обратной коммутацией) на задней панели усилителя. - После подачи каждого импульса напряжения обкатки запустите инструмент Membrane Test , чтобы проверить, появляются ли переходные процессы большей емкости.
ПРИМЕЧАНИЕ: Наличие переходных процессов большой емкости (Рисунок 7C) указывает на то, что взлом произошел, и измеряется вся емкость клетки (~1 пФ для человеческой спермы и ~2,5 пФ или более для мышиной спермы). - Подгонка переходных процессов большой емкости с помощью инструмента для тестирования мембран для определения емкости всей ячейки, а также ее сопротивления доступа.
ПРИМЕЧАНИЕ: Сопротивление доступа должно быть как можно ниже для эффективной перфузии внутренней части сперматозоида с помощью раствора микропипетки, а также для надежного зажима напряжения плазматической мембраны сперматозоида. Сопротивление доступа обычно составляет 25-30 МОм и 50-70 МОм для внутриклеточных растворов на основе Cs+ /K+ и NMDG соответственно. - После успешной обкатки приступайте к запланированным экспериментам с патч-зажимом для всей клетки, таким как применение различных растворов для ванн (рис. 8), содержащих различные соединения, или измерение активности канала с помощью протоколов шага напряжения (рис. 8, рис. 9) или нарастания напряжения. Если обкатка не удалась, вернитесь к пункту 6.4.1. выбрав свежую микропипетку и выбрав другой подходящий сперматозоид.
Результаты
Метод зажима сперматозоидного пластыря позволяет напрямую записывать канал CatSper.
Как упоминалось выше, запись CatSper была выполнена путем создания уплотнения с высоким сопротивлением (гигаом) между патч-пипеткой и сперматозоидом млекопитающих в его цитоплазматической капле. При взломе и переходе в режим полноклеточного сперматозоида достигается полный электрический доступ ко всему телу сперматозоида и его внутренностям, включая головку сперматозоида и жгутик 2,8,39,51. Это условие в конечном итоге позволяет вести запись из любого активного ионного канала, расположенного на плазматической мембране сперматозоида. Для регистрации одновалентных токов CatSper 2,8,39,51 предпочтительно использовать ванну номинально безвалентным (DVF) раствором, содержащим в качестве основного проникающего иона. В то время как канал CatSper проводит двухвалентные ионы, такие как Ca2+ и Ba2+, они движутся через поры CatSper с гораздо меньшей скоростью, что приводит к едва заметной проводимости нескольких пикоамперов (~10-20 пА)2,8,39,51. Следовательно, измерение моновалентных и, следовательно, больших токов через канал CatSper является более удобным способом оценки тока (рис. 8). Важно отметить, что CatSper также проницаем для калия; следовательно, канал CatSper должен быть заблокирован, или сперматозоиды с дефицитом CatSper должны использоваться в ситуациях, когда нужно изучить только калиевые каналы сперматозоидов 2,3,8,28,65. Варьируя ионный состав пипетки и раствора для ванны, можно избирательно исключать определенные ионные каналы, создавая при этом условия для избирательной регистрации только из определенного типа ионного канала. Например, добавление Cs+ в раствор пипетки приводит к блокированию ионной проницаемости через калиевые каналы сперматозоидов.
Канал CatSper регулируется по-разному у разных видов млекопитающих.
Сперматозоиды разных видов разнообразны по своей морфологии и внутренним регуляторным путям66. Неудивительно, что их ионные каналы также регулируются уникальным образом, отражающим специализированное микроокружение мужских и женских репродуктивных путей. Метод заплатки сперматозоида был успешно применен к шести видам млекопитающих: мышь2, крыса56, человек39,51, крупный рогатый скот, кабан и макака41, как показано на рисунке 9. Для этих экспериментов сперматозоиды взрослых самцов макак-резусов [Macaca mulatta] были получены из Калифорнийского национального исследовательского центра приматов в соответствии со стандартами Международной ассоциации по оценке и аккредитации лабораторных животных (AAALAC) в соответствии с утвержденными протоколами для животных Калифорнийского университета в Дэвисе, как описано в41; и все исследования проводились в соответствии с Руководством Национальных институтов здравоохранения США по уходу и использованию лабораторных животных. Сперма быков и кабанов была получена в качестве побочных продуктов, освобожденных от специального одобрения IACUC от Департамента животноводства UCD, и все животные содержались в помещениях, одобренных AAALAC. Сперму быков и кабанов также можно получить из коммерческих источников.
Сперматозоиды приматов (макак-резус) и человека продемонстрировали схожие свойства канала CatSper и его регуляцию. Интересно, что активация прогестерона CatSper, по-видимому, уникальна для сперматозоидов приматов (рис. 9 и 41), поскольку сперма кабана, быка и грызуна не проявляла никакого стимулированного прогестероном изменения своих токов CatSper. У сперматозоидов быков и кабанов даже базальная активность канала CatSper была ниже обнаруживаемых пределов (рис. 9), что позволяет предположить, что у этих видов приток кальция и последующая гиперактивация управляются другими каналами/транспортерами, или что для активации их каналов CatSper необходим другой естественный стимулятор. У всех упомянутых здесь видов сперматозоидов, включая сперматозоиды быков и кабанов, был получен полный электрический доступ к внутренней части сперматозоидов, и клетки были зарегистрированы в режиме полноклеточного анализа, о чем свидетельствует появление артефактов большой емкости при взломе (рис. 7). Это состояние позволяет легко регистрировать функциональный канал CatSper, а его отсутствие у сперматозоидов хряка и крупного рогатого скота указывает на то, что либо этот канал заблокирован еще неизвестным эндогенным ингибитором, присутствующим в сперматозоидах этих видов, либо требует активации специфического модулятора. Тем не менее, это предварительные эксперименты, и потребуются дополнительные эксперименты со сперматозоидами хряка и быка, чтобы убедиться в функциональной значимости канала CatSper у этих видов. Этот широкий спектр разнообразия ионных каналов сперматозоидов у разных видов может быть связан с соотношением сперматозоидов к размеру яйцеклетки, отношением между размером сперматозоидов и защитным одеянием яйцеклетки или служить барьером для оплодотворения другими видами66.

Рисунок 1: Морфологическое разнообразие сперматозоидов млекопитающих. (A) Нижняя панель: схематическое изображение сперматозоида; Клеточные компартменты маркируются. Верхние панели: ДВС-изображения сперматозоидов разных видов по часовой стрелке: крысы (Rn; Rattus norvegicus); мышь (мм; Mus musculus); бык (Bt; Bos taurus); кабан (Sd; sus scrofa domesticus); человек (Hs; Homo sapiens) и макак-резус (Mmu; Macaca mulatta). Масштабная линейка применяется ко всем изображениям DIC. Вставки указывают на цитоплазматические капли. (Б) Заплатка сперматозоидов млекопитающих. Для успешного формирования уплотнения между наконечником пипетки и плазматической мембраной часть плазматической мембраны аккуратно всасывается в наконечник пипетки. Переход в цельноклеточный режим осуществляется путем разрыва плазматической мембраны между кончиком и клеткой (этот рисунок воспроизведен из8). Правая панель: сперматозоиды человека, прикрепленные к записывающей микропипетке. (C) Схематическое изображение сперматозоидов человека и некоторых жгутиковых ионных каналов, изученных в сперматозоидах человека методом патч-зажима, а также проводящих ими ионов. CatSper- ионный канал кальция39,51; Hv1- протонный канал 51,56,67; Slo3/Slo1- калиевые каналы 50,53,65,68; TRPV4- переходный рецепторный потенциал катионного канала ваниллоидного типа 448. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
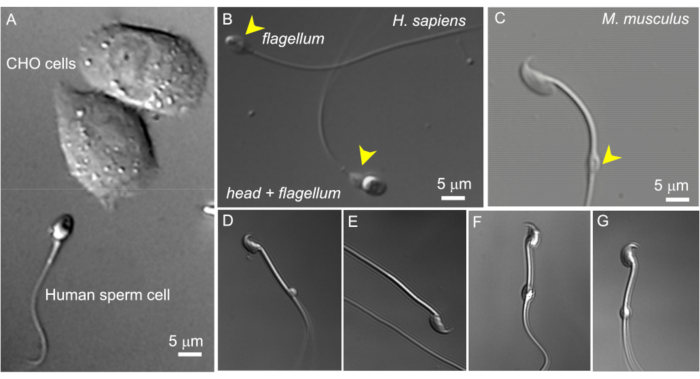
Рисунок 2: Размер сперматозоидов и изменчивая морфология цитоплазматических капель. ДВС-изображения интактных живых сперматозоидов. (А) Сравнение размера человеческой сперматозоидной клетки (снизу) и двух СНО-клеток (верхней). (Б) Неповрежденный сперматозоид человека (Homo sapiens) (внизу) и обезглавленный сперматозоид (жгутик, верхний). Цитоплазматические капли обозначаются желтыми стрелками; Эта цифра была воспроизведена из8. (C) Интактный сперматозоид мыши (Mus musculus) с цитоплазматическими каплями (CD) нормальной формы, обозначенными желтым наконечником стрелки. (Д-Г) Сперматозоиды придатка яичка мышей имеют цитоплазматические капли разного размера и формы; только (C) и (G) подходят для патч-хомута. (D) CD является микроскопическим и односторонним; (E) CD отсутствует; (F) CD содержит частицы, которые могут засорить записывающую пипетку; (G) БК гладкая, однородная и не вздутая. Формирование гигапечати с помощью этого типа компакт-диска, скорее всего, приведет к успешной записи. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Компоненты установки для зажима сперматозоидного пластыря. (A) Типичная электрофизиологическая установка для спермы с основными компонентами: (1) инвертированный микроскоп; (2) малошумящий дигитайзер; (3) усилитель; (4) микроманипулятор с низким дрейфом, который соединен с инвертированным микроскопом с платформой микроманипулятора; (5) ПКЭВ; (6) виброгасящий воздушный стол; (7) Клетка Фарадея для защиты установки от внешних электрических помех. Важно, чтобы все компоненты установки с электрическим приводом, включая компьютерную клавиатуру и мышь, производили низкий уровень электрического шума или его отсутствие (50 Гц или 60 Гц) и чтобы все компоненты установки были правильно заземлены. (B) Съемник микропипеток, используемый для регистрации изготовления пипеток. (C) (1) микрокузнечный станок, используемый для огневой полировки пипетками; (2) капилляры из боросиликатного стекла с наружным диаметром 1,5 мм, внутренним диаметром 0,86 мм и внутренней нитью; (3) Коробка для сбора пипеток. (D) Этапы успешной огневой полировки пипетки: (a) Неполированная пипетка с внутренним диаметром 2 мм; b) дозатор с огнеупорной полировкой и внутренним диаметром 0,5 мм; (c) Чрезмерно отполированная герметичная пипетка, не пригодная для записи. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Компоненты системы регистрирующей камеры и ее сборка. (A) Основные компоненты системы регистрирующей камеры: (1) адаптер для микроскопа для платформ серии 20 с (2) двумя зажимами для удержания предметного стекла; (3-4) магнитная нагреваемая платформа серии PM с (3) магнитными зажимами для удержания перфузионной камеры; (5) перфузионная камера; (6) мост Агар; (7) магнитный зажим, электрод сравнения с гнездом 2 мм для гранулы Ag/AgCl; (8) магнитный держатель (MAG-1) для всасывающей линии; (9) всасывающая трубка; (10) Уплотнительный держатель всасывающей трубки. (B) Собранная система регистрирующей камеры с указанными компонентами из пункта (A). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Компоненты перфузионной системы. (А) собранная перфузионная линия и (Б) ее основные компоненты: (1) шприцы объемом 20 мл и 3 мл; (2) запорный кран с соединениями Люэра; 4-сторонняя; мужской замок; (3) переходник для шланга Luer с внутренней резьбой, 1/16"; (4) Перфузионные трубки из политетрафторэтилена (ПТФЭ) (трубки из микроотверстия из ПТФЭ, внутренний диаметр 0,022 дюйма × внешний диаметр 0,042 дюйма); (5) Политетрафторэтилен 8-позиционный перфузионный коллектор; (6) Силиконовая соединительная трубка (силиконовая трубка платинового отверждения, внутренний диаметр 1/32 дюйма × внешний диаметр 3/32 дюйма); (7) Трубка соединительного коллектора (трубка из ПТФЭ, внутренний диаметр 1/32 дюйма × внешний диаметр 1/16 дюйма). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Вскрытие самцов мышей. (A) Мужские репродуктивные органы мышей; Показаны как яички, так и придатки яичка. (B) Придатки яичек переносят в 35-миллиметровую чашку для клеточной культуры, содержащую раствор HS, и удаляют остаточный жир и семявыносящие протоки. (C) Затем каждый придаток яичка делится на капут, тело и кауду с помощью лезвия скальпеля #15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Образование Gigaseal и взлом со сперматозоидом мыши. Интерфейс инструмента "Membrane Test" коммерческого программного обеспечения для патч-фиксаторов. Три этапа зажима пластыря сперматозоида: (A) зарегистрированная пипетка погружается в раствор HS для ванны, что дает сопротивление пипетки 14,8 МОм; (B) Формируется гигауплотнение (сопротивление 4,7 ГОм), компенсируются переходные процессы емкости, и сперматозоид поднимается с покровного стекла; (В) Переход в полноклеточный режим. Обкатка и переход в общеэлементный режим осуществляется путем подачи коротких (1 мс) постепенно увеличивающихся (430-650 мВ, ~50 мВ) импульсов напряжения в сочетании со световым всасыванием, как показано слева. Взлом произошел, о чем свидетельствует внешний вид переходных процессов большой емкости, которые отражают всю емкость клетки (~2,93 пФ для этого сперматозоида). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
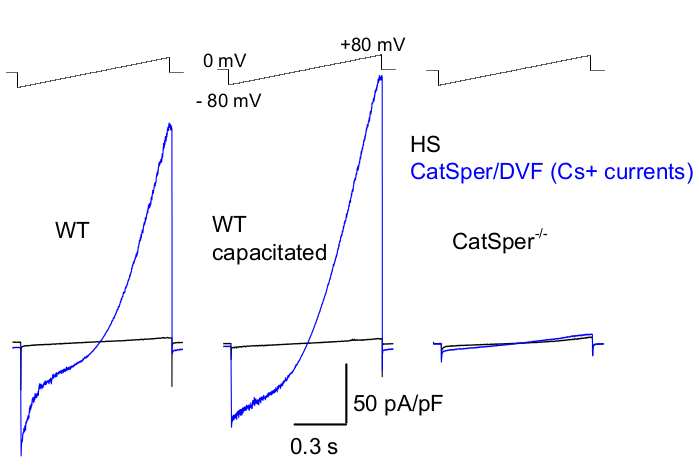
Рисунок 8: Запись Murine CatSper из сперматозоидов дикого типа (WT) cauda epididymal, capacitated и CatSper knockout. Для регистрации моновалентной активности CatSper каждые 5 с применяется протокол линейного изменения напряжения, и токи CatSper вызываются линейными изменениями напряжения от потенциала удержания 0 мВ39,51. Линейные изменения напряжения (от -80 мВ до 80 мВ; 850 мс) применяются в HS и номинально безвалентном растворе (DVF). Дискретизация данных проводилась с частотой 2-5 кГц и фильтрацией с частотой 1 кГц. Исходные токи регистрируются в растворе HS, который не производит ток CatSper из-за ингибирования высоким содержанием внеклеточного магния39,51. Базовые токи полезны для оценки проводимости утечек (пути без ионных каналов). Репрезентативные, цельноклеточные плотности тока CatSper (pA/pF; синий) Cs+, зарегистрированные из каудальных сперматозоидов мыши WT (неемкие; левые и емкие; средние) и каудальных сперматозоидов мышей с дефицитом CatSper (справа). Токи вызывали за счет нарастания напряжения от удерживающего потенциала 0 мВ, а нарастание напряжения применялось от -80 мВ до 80 мВ в HS и номинально бездвухвалентном растворе. Исходные токи (черные) регистрируются в растворе HS. Для получения плотностей тока амплитуды тока CatSper были нормализованы до емкости ячейки (pA/pF). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
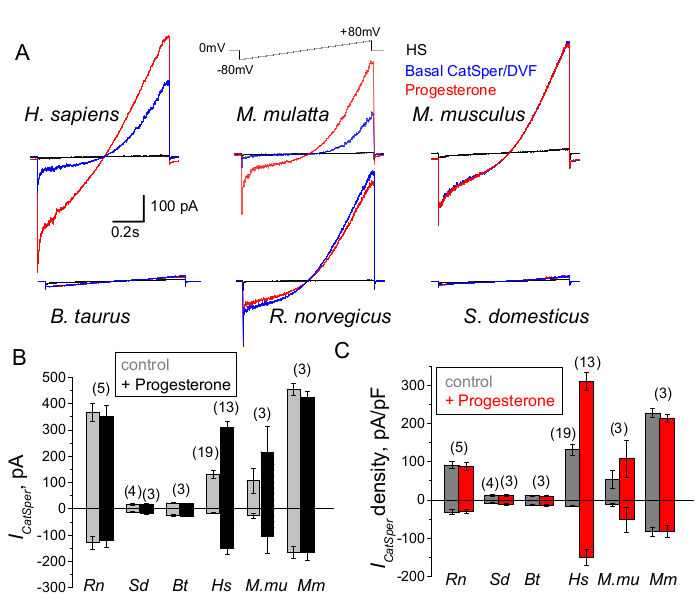
Рисунок 9: Прогестероновая регуляция CatSper у различных видов млекопитающих. (A) Репрезентативный ток CatSper, полученный от сперматозоидов различных видов с помощью протокола нарастания напряжения, как показано. Виды: человек (Hs; H. sapiens); Макак-резус (Mmu; M. mulatta), мышь (Mm; M. musculus), бык (Bt; B. taurus); крыса (Rn; R. norvegicus); кабан (Sd; S. scrofa domesticus). Регистрировались токи CatSper при отсутствии (синий) и наличии (красный) 1 мМ прогестерона, а также базальные токи в растворе HS (черные). (B) Амплитуды тока CatSper (ICatSper, pA) и (C) Средние плотности тока (pA/pF) от сперматозоидов различных видов, как указано; n обозначает количество используемых отдельных сперматозоидов. Данные являются средним значением +/- S.E.M. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 10: Разница в подвижности жгутиков. Два типичных примера цитоплазматических капель и жгутиковой подвижности. Наложенные изображения одних и тех же сперматозоидов крысы (Rn) и человека (Hs) были сделаны в два разных временных момента, когда они демонстрируют наиболее дистальное отклонение жгутиков. Пунктирными прямоугольниками обозначен участок с цитоплазматическими каплями и их соответствующая пространственная подвижность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 11: U-образная трубка в сборе и ее основные компоненты. (A) Компоненты U-образной трубки: (1) серологическая пипетка объемом 10 мл; (2) Силиконовые трубки; (3) Силиконовая соединительная трубка; (4) 1 мл шприца; (5) Адаптер с внутренней заусеницей люэра; (6) адаптер со встроенной блокировкой Luer с наружной резьбой 1/8 дюйма; (7) запорный кран с соединениями Люэра; 4-сторонняя; мужской замок; (8) адаптер с наружной резьбой серии Luer, 1/16 дюйма. (B) Полностью собранная U-образная труба и (C) U-образная труба, прикрепленные к клетке Фарадея. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
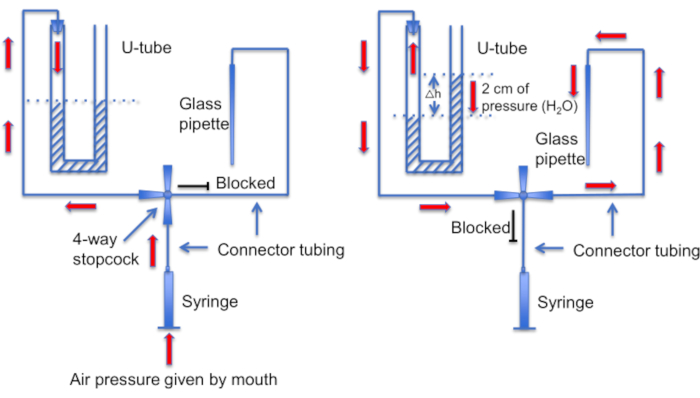
Рисунок 12: Схематическое изображение узла U-образной трубы. Левая панель: Положительное давление воздуха создается ртом для создания разницы в уровнях жидкости в U-образной трубке. Уровень жидкости в правом роге повышается на 2 см. После создания этой разницы уровней запорный кран поворачивается для подключения U-образной трубки к линии, ведущей к записывающей пипетке. Правая панель: более высокий уровень жидкости в правом роге создает положительное давление, которое постоянно выталкивает раствор пипетки из наконечника пипетки и сохраняет наконечник чистым от мусора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Химикалии | Молярная масса (г/моль) | миллиметр | g для 1л |
| NaCl | 58.44 | 97.8 | 5,72 г |
| KCl | 74.55 | 5 | 0,373 г |
| КХ2ГО4 | 136.09 | 0.37 | 50,4 мг |
| MgSO4 x 7.Н2О | 246.48 | 0.2 | 49,3 мг |
| CaCl2 х 2.Н2О | 147.02 | 2 | 0,294 г |
| ХЕПЕС | 238.3 | 20 | 4.766 г |
| Глюкоза | 180.2 | 3 | 0,540 г |
| Лактат натрия (60% по массе) | 112.06 | 20 | 3 мл |
| Пируват натрия | 110 | 0.4 | 44 мг |
Таблица 1: Раствор для жидкости в канальцах человека (HTF)
| Химикалии | Молярная масса (г/моль) | миллиметр | g для 1л |
| NaCl | 58.44 | 135 | 7.889 г |
| KCl | 74.55 | 5 | 0,373 г |
| CaCl2 х 2. Н2О | 147.02 | 2 | 0,294 г |
| MgSO4 x 7. Н2О | 246.48 | 1 | 0,247 г |
| ХЕПЕС | 238.3 | 20 | 4.766 г |
| Глюкоза | 180.2 | 5 | 0,901 г |
| Лактат натрия (60% по массе) | 112.06 | 10 | 1,5 мл |
| Пируват натрия | 110 | 1 | 0,110 г |
Таблица 2: Высокосолевой раствор (HS)
| Химикалии | Молярная масса (г/моль) | миллиметр | г (для 500 мл) |
| CsMeSO3 | 228.0 | 140 | 15.960 г |
| ХЕПЕС | 238.3 | 40 | 4.766 г |
| ЭДТА | 292.24 | 1 | 0,146 г |
Таблица 3: Раствор для ванны CsMeSO3 (раствор для ванны без двухвалентных веществ: DVF)
| Химикалии | Молярная масса (г/моль) | миллиметр | мг (по 25 мл) |
| CsMeSO3 | 228.0 | 130 | 741 мг |
| ХЕПЕС | 238.3 | 70 | 417 мг |
| ЭДТА | 292.24 | 2 | 14,6 мг |
| ЭГТА | 380.35 | 3 | 28,5 мг |
| CsCl | Решение 1 М | 1 | 25 μл |
Таблица 4: Раствор для дозатора CsMeSO3
Обсуждение
Мы опишем подробный протокол для выполнения электрофизиологических записей сперматозоидов различных видов. Учитывая физиологическое значение ионных каналов и электрогенных транспортеров для сперматозоидов, этот метод является мощным инструментом для изучения физиологии сперматозоидов, а также дефектов, которые приводят к мужскому бесплодию. Поначалу экспериментатору может показаться сложным выполнение этой техники, но с упорством и выносливостью успех последует за ним.
Сперматозоиды млекопитающих длинные (обычно >50 мкм), узкие и очень подвижные. Частота базального биения (БЧ) сперматозоидов млекопитающих сильно варьирует со значениями от 4 Гц (мышь 69), 7-15 Гц (хряк 70,71), 11 Гц (крыса 72), 11-20 Гц (бык 18), 24 Гц (макака-резус 23) и до 25 Гц (человек 3). Цитоплазматическая капля (CD) является входом для записи из сперматозоидов. У сперматозоидов грызунов CD часто находится дистально, но движется вдоль жгутика (рис. 10), создавая дополнительное препятствие для записи. Однако в сперматозоидах человека CD чаще всего располагается рядом с головой. Таким образом, ключевыми компонентами успешного патч-зажима для сперматозоидов являются превосходная оптика, обеспечивающая четкий и четкий обзор CD, и высокоточная система микроманипуляторов без дрейфа и вибрации. Первоначально ожидается высокий уровень неудач, который является нормальным в течение первых нескольких дней после зажима сперматозоидного пластыря. Мы рекомендуем рутинную практику с большим количеством попыток в неделю. Достижение нескольких записей в день в неделю установит распорядок дня и улучшит моторику.
До недавнего времени идентификация и фармакологическая характеристика ионных каналов сперматозоидов затруднялась невозможностью их непосредственного изучения. Эта область в значительной степени опиралась на иммуноцитохимические исследования, которые часто страдают от неспецифичности антител и/или отсутствия соответствующих генетических моделей. Для исследования кальциевых каналов широко используется классический метод визуализации кальция, который имеет свои преимущества и ограничения 73,74,75,76,77. В то время как визуализация кальция является относительно простым методом, применимым для исследований со средней и высокой пропускной способностью 78,79,80,81 и является менее инвазивным, она требует относительно интактных клеток и, следовательно, создает препятствие для анализа функции ионных каналов, отделенных от внутриклеточных сигнальных каскадов, или для их отличия от ионитов кальция. Кроме того, трудно контролировать мембранный потенциал и, следовательно, труднее исключить вклад потенциал-зависимых кальциевых каналов. Среди нескольких преимуществ фторометрии кальция можно выделить использование кальциевых ратиометрических красителей, которые позволяют точно измерять изменения концентрации ионов кальция. В то же время необходимо отдавать себе отчет в том, что чувствительность этих красителей может варьироваться в зависимости от изменения внутриклеточного pH.
Ниже мы опишем критические шаги в рамках протокола, включая шаги по устранению неполадок метода. Для приготовления экспериментальных растворов важно использовать только чистые реагенты, так как даже небольшое загрязнение нежелательными ионами (такими как магний или тяжелые металлы) может ухудшить обнаружение моновалентных токов. Учитывая небольшой размер сперматозоидов, можно ожидать относительно небольшого количества ионных каналов на клетку. Таким образом, суммарный ток колеблется от нескольких пА до нескольких сотен пА. Поэтому внутренний электрический шум буровой установки должен быть минимальным, чтобы обеспечить обнаружение небольших токов, и настоятельно рекомендуется использовать оборудование без дрейфа. Чтобы отличить конкретную проводимость от электрического шума и фоновой утечки, необходимо максимально использовать записывающее устройство и систему заземления. Это достигается за счет надлежащего заземления буровой установки во избежание любых электрических помех82. Использование клетки Фарадея настоятельно рекомендуется для защиты от электрических помех, создаваемых различными электрическими устройствами, такими как освещение здания и настенная электропроводка. Важно, чтобы все компоненты установки с электрическим приводом, включая компьютерную клавиатуру и мышь, излучали мало или вообще не излучали электрического шума (50 Гц или 60 Гц) и чтобы все компоненты установки были правильно заземлены. Электрический шум в конфигурации с целой ячейкой при закрытии всех ионных каналов должен составлять < 0,5-1 пА.
Еще одним важным моментом является контроль за правильными осмолярностями рабочих растворов. Необходимо точно определить состав внутри- и внеклеточных растворов и правильно измерить их осмолярность. Внеклеточный раствор должен быть слегка гипотоническим по сравнению с раствором для пипетки, так как он приводит к незначительному отеку клеток и предотвращает закупорку пипетки мембраной сперматозоида. Примечание: если раствор пипетки слишком гипертонический и отличается от раствора для ванны более чем на 10 мОсм, происходит чрезмерное набухание клеток и разрыв уплотнения. В результате клетка будет хрупкой, а гигапечать будет потеряна в течение нескольких секунд после взлома. По нашему опыту, неаккуратная подготовка раствора является одной из самых распространенных ошибок, препятствующих успешному заплаточному зажиму.
Еще одним потенциальным препятствием, которого следует избегать, является пластик, содержащий пластификатор/фталат, а также шприцы, смазываемые минеральным маслом. Трубки, шприцы и все пластиковое оборудование, которое контактирует с растворами, а следовательно, и сперматозоиды, не должны выщелачивать пластификаторы или другие токсины или масла окружающей среды, поскольку такие химические вещества могут значительно изменить активность ионных каналов. В качестве основной перфузионной линии мы используем тефлоновые трубки малого диаметра. Тефлон (ПТФЭ) содержит мало выщелачиваемых соединений, но довольно жесткий. Гибкие соединения изготовлены из силиконовой трубки высокой чистоты, которая надевается на тефлоновую трубку. Во всех шприцах, используемых для системы перфузии, отсутствует смазка, так как минеральное масло или другие смазывающие присадки могут мешать записи ионных каналов.
Мы не можем переоценить важность использования правильного стекла и правильной формы микропипетки. Следовательно, оптимальное изготовление стеклянных микропипеток является предпосылкой для успешного патчинга. Для лучшего наполнения раствора мы используем стеклянные микропипетки, изготовленные только из боросиликатного стекла, содержащего филамент. Кончик пипеток должен быть отполирован огнем, чтобы обеспечить идеальную плотную прилегательность. Наконечники для пипеток, диаметр которых превышает 2 мкм (и, следовательно, имеют сопротивление 10 МОм или ниже), как правило, не подходят для патч-зажима сперматозоидов.
Еще одним важным шагом является обеспечение чистоты наконечника микропипетки от любого мусора или пузырьков воздуха до формирования уплотнения. Это сложная задача, учитывая, что микропипетка загружается в раствор, полный подвижных клеток. Одним из факторов, который помогает избежать случайного «удара» пипетки по свободно плавающим сперматозоидам, является использование постоянной перфузии для смывания всех неадгезивных клеток. Еще одним инструментом является самодельная «U-образная трубка», которая позволяет переключаться между режимами положительного и отрицательного давления, чтобы сохранить наконечник чистым (Рисунок 11 и Рисунок 12).
Поскольку сперматозоиды сильно различаются по форме и размеру цитоплазматических капель (CD), важно выбрать каплю с подходящей морфологией. Как показано на рисунке 2, для патч-хомута подходят только компактные (1-3 мкм), гладкие, однородные и не чрезмерно набухшие компакт-диски. Крошечный, односторонний; «раздутые», полностью прозрачные компакт-диски имеют слабые уплотнения или вообще не имеют их. Компакт-диски, содержащие крупные растворимые частицы внутри, могут засорять записывающую пипетку. Когда сперматозоиды мышей из яичек попадают в придаток яичка, их CD располагаются в области шеи, близко к голове. Проходя через придаток яичка, их компакт-диски движутся вдоль средней части и в конечном итоге достигают соединения между средней частью и основной частью (кольцом), когда сперматозоиды достигают хвоста придатка яичка. Поэтому, как уже упоминалось выше, у сперматозоидов, выделенных из придатка яичка, КД обычно располагается близко к центру миштука. В каудальных клетках CD обычно может быть обнаружен близко к кольцу (рис. 2C). Для сперматозоидов человека CD расположен в области шеи (рис. 2A, B).
Хотя это не является проблемой для сперматозоидов, выделенных от лабораторных животных, существует значительная вариабельность между донорами-людьми. Различия в качестве спермы у одного и того же донора в основном влияют на качество плазматической мембраны сперматозоидов и иногда делают формирование уплотнения относительно сложным. Существует меньшая изменчивость в поведении ионных каналов и фармакологии, факторы, которые, вероятно, коррелируют с индивидуальной генетикой или физиологией. Нужно быть настойчивым и оценивать образцы от различных доноров в течение нескольких дней, а также полагаться на нескольких доноров-людей. Работа с человеческим материалом требует особого терпения, так как качество донорской спермы у одного и того же донора сильно различается в зависимости от различных факторов окружающей среды. Мы рекомендуем оценить образцы из разных дней донорства, чтобы принять окончательное решение о статусе донора. В то время как эякулированные очищенные сперматозоиды обычно пригодны для электрофизиологии в течение нескольких часов (до 12 часов после выделения для спермы человека), сперматозоиды придатка яичка мышей пригодны для патчинга только в течение 2 часов после выделения.
И последнее, но не менее важное: образование гигасил различается у сперматозоидов. Для сперматозоидов мыши/грызунов образование гигасил происходит практически мгновенно, в то время как для формирования гигаseal с человеческим сперматозоидом требуется несколько секунд (а иногда и до минуты). Часто первоначальное всасывание приводит к входному сопротивлению в диапазоне от 200 МОм до 800 МОм. Переключение удерживающего потенциала на -60 мВ и обеспечение "Membrane Test" коротких импульсов до 10 мВ часто помогает предотвратить образование гигауплотнения (за счет индуцированного полем напряжения движения мембраны в пипетке).
Технология зажима пластыря сперматозоидных клеток позволяет детально изучить специфические ионные каналы в их естественной системе экспрессии. Успех методики зависит от надлежащего оборудования, высококачественных жизнеспособных сперматозоидов, чистых реагентов, базовых навыков электрофизиологии, терпения и настойчивости. Этот метод открывает новые горизонты в физиологии сперматозоидов, изучая эволюционное разнообразие ионных каналов, механизмы их регуляции и изменения в их функции по мере их перемещения из мужского репродуктивного тракта в женский и изменения под воздействием экзогенных условий, таких как pH и лиганды.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом NIH R01GM111802, премией Pew Biomedical Scholars Award 00028642, премией Альфреда. Слоуна FR-2015-65398 и завещанием Packer Wentz Endowment (P.V.L.). Эта работа также была поддержана Deutsche Forschungsgemeinschaft (Немецкое научно-исследовательское общество) 368482240/GRK2416 (to N.M.) и China Scholarship Council Fellowship to B.L. Мы благодарим доктора Дэна Фельдмана за обмен тканями крыс, Кэти Клустер и Стюарта Майерса из Калифорнийского университета в Дэвисе за помощь в получении сперматозоидов приматов, а также Стивена Мэнселла за помощь в сборе данных из сперматозоидов кабана и быка.
Материалы
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
Ссылки
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. Ion Channels of Excitable Membranes 3rd Edition. , Sinauer Associates - an imprint of Oxford University Press. (2001).
- Molleman, A. An Introductory Guide to Patch Clamp Electrophysiology. , John Wiley & Sons Ltd. (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082(2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130(2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153(2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53(2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853(2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438(2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426(2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5(2019).
- World Health Organization. World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009(2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212(2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены