Method Article
Registrazione delle correnti elettriche attraverso la membrana plasmatica degli spermatozoi dei mammiferi
In questo articolo
Riepilogo
Questo protocollo descrive come eseguire registrazioni elettriche da spermatozoi di mammifero in una configurazione a cellula intera, con l'obiettivo di registrare direttamente l'attività dei canali ionici. Il metodo è stato determinante per descrivere i profili elettrofisiologici di diversi canali ionici degli spermatozoi e ha contribuito a rivelare la loro identità molecolare e regolazione.
Abstract
La registrazione dell'attività elettrica di una delle cellule più piccole di un organismo mammifero, uno spermatozoo, è stata un compito impegnativo per gli elettrofisiologi per molti decenni. Il metodo noto come "patch clamp per spermatozoi" è stato introdotto nel 2006. Ha permesso la registrazione diretta dell'attività dei canali ionici in configurazioni di cellule intere e attaccate alla cellula ed è stato determinante nel descrivere la fisiologia delle cellule spermatiche e l'identità molecolare di vari canali ionici di calcio, potassio, sodio, cloruro e protoni. Tuttavia, la registrazione da singoli spermatozoi richiede competenze avanzate e formazione in elettrofisiologia. Questo protocollo dettagliato riassume la procedura passo dopo passo e mette in evidenza diversi "trucchi del mestiere" per renderlo disponibile a chiunque desideri esplorare l'affascinante fisiologia della cellula spermatica. In particolare, il protocollo descrive la registrazione da spermatozoi umani e murini, ma può essere adattato essenzialmente a qualsiasi cellula spermatica di mammifero di qualsiasi specie. Il protocollo copre dettagli importanti dell'applicazione di questa tecnica, come l'isolamento degli spermatozoi, la selezione dei reagenti e delle apparecchiature, l'immobilizzazione delle cellule altamente mobili, la formazione del sigillo ermetico (Gigaohm) tra un elettrodo di registrazione e la membrana plasmatica degli spermatozoi, il passaggio alla modalità dell'intero spermatozoo (nota anche come rodaggio) e registrazioni esemplari del canale ionico del calcio degli spermatozoi, CatSper, da sei specie di mammiferi. Vengono discussi i vantaggi e i limiti del metodo di patch clamp per lo sperma, nonché i passaggi più critici.
Introduzione
Simile al tradizionale patch clamp inventato da Erwin Neher e Bert Sakmann1, il patch clamp per spermatozoi consente di interrogare l'attività dei singoli canali ionici, nonché di registrare l'attività dell'intera popolazione di canali ionici all'interno della singola cellula 2,3. Il metodo consente l'identificazione di uno specifico tipo di canale ionico in grado di disaccoppiamento dai processi intracellulari enzimatici. Questo metodo è fondamentale per la determinazione dell'attività dei canali ionici in base alle sue impronte elettrofisiologiche e farmacologiche e, quindi, fornisce una strategia di identificazione affidabile. Lo svantaggio del metodo è la sua incapacità di rilevare trasportatori non elettrogenici. Inoltre, l'allenamento elettrofisiologico di base è utile per comprendere le sfumature del protocollo. Per padroneggiare la tecnica del patch clamp e applicarla agli spermatozoi dei mammiferi, si consiglia di studiare la letteratura di base sul patch clamp 4,5. In questo articolo forniamo una procedura dettagliata passo dopo passo ed evidenziamo pratiche uniche che rendono questa tecnica facile da capire e disponibile per chiunque desideri praticare l'elettrofisiologia delle cellule spermatiche.
L'omeostasi ionica è una funzione fisiologica essenziale degli spermatozoi che si basa fortemente sui canali ionici e sui trasportatori ionici per mantenere gradienti ionici fisiologicamente importanti, variare il calcio intracellulare e modificare il voltaggio transmembrana. I canali ionici e i trasportatori ionici regolano le funzioni essenziali degli spermatozoi come la motilità, la navigazione nel tratto riproduttivo femminile, la maturazione degli spermatozoi e, negli organismi marini, la chemiotassi verso l'uovo 6,7,8,9,10,11,12 . La motilità degli spermatozoi è un processo acquisito gradualmente. Gli spermatozoi sono prevalentemente quiescenti durante la loro maturazione nel testicolo e durante il loro conseguente passaggio attraverso l'epididimo. La loro motilità è limitata da un ambiente acido dell'epididimo che porta ad un'acidificazione interna degli spermatozoi. Ciò compromette la funzione dell'assonema poiché non è in grado di funzionare al di sotto del pH 6,013,14. Tuttavia, in seguito all'esposizione ai liquidi seminali o a un ambiente più alcalino, le concentrazioni di ioni intracellulari degli spermatozoi e il pH citoplasmatico subiscono importanti cambiamenti e lo spermatozoo diventa mobile 15,16,17. Il movimento del flagello spermatico è alimentato dall'idrolisi dell'ATP che supporta lo scorrimento dei microtubuli assonomici18 e questo processo è altamente dipendente dal pH14. Inoltre, il movimento flagellare è controllato anche da un aumento del calcio intraflagellare e del cAMP 13,19,20,21,22,23,24. Questi fattori, cioè la concentrazione intracellulare di calcio [Ca2+]i degli spermatozoi, il pH, l'ATP e il cAMP, sono i principali meccanismi di regolazione che consentono i cambiamenti di motilità e le loro concentrazioni sono strettamente regolate dai canali ionici e dai trasportatori degli spermatozoi.
Gli spermatozoi sono unici in quanto esprimono una serie di proteine che non possono essere trovate in nessun'altra parte del corpo. Esempi notevoli sono i canali ionici degli spermatozoi, come il canale del potassio, Slo3 25,26,27,28,29 e il canale ionico Cat di Sperm, CatSper 2,30,31,32. Quest'ultimo è il principale canale del calcio degli spermatozoi dei mammiferi31, ed è regolato dall'alcalinizzazione intracellulare 2,30,31,32,33,34. CatSper è anche regolato da segnali specie-specifici 7,35 ed è organizzato in nanodomini longitudinali quadrilateri lungo il flagello spermatico 36,37,38. Nei primati, CatSper è attivato da una combinazione di alcalinità flagellare, depolarizzazione di membrana e progesterone 3,39,40,41, mentre per l'attivazione di CatSper murino non è richiesto progesterone 2,39. Un'altra caratteristica specifica di questo canale è la sua organizzazione multisubunità: CatSper è un complesso di almeno 10 diverse subunità 31,32,34,37,38,42,43,44,45,46,47 . Tale struttura sofisticata e le specifiche della sua regolazione hanno ostacolato l'espressione ricombinante di CatSper in qualsiasi sistema di espressione eterologo conosciuto, e quindi la caratterizzazione fisiologica di CatSper è stata limitata al suo sistema nativo di espressione: la cellula spermatica. Mentre la caratterizzazione molecolare della proteina CatSper è stata ottenuta in un articolo seminale nel 2000 da D. Ren et. al.31, la prova definitiva che CatSper è un vero e proprio canale ionico è stata possibile solo dopo l'introduzione del metodo del patch clamp per spermatozoi nel 20062. Da allora questa tecnica ha permesso una caratterizzazione precisa di molte vie di conduzione ionica negli spermatozoi 9,28,37,39,40,44,46,48-54.
Si riteneva che il metodo classico e più semplice per studiare le caratteristiche dei canali ionici, la tecnica del patch clamp, non fosse applicabile agli spermatozoi a causa della loro motilità e morfologia specifica (Figura 1A). In particolare, il minuscolo volume del citoplasma spermatico e lo stretto attaccamento della membrana plasmatica dello sperma alle rigide strutture intracellulari come la guaina fibrosa e il nucleo dello spermatozoo sono state le principali sfide55. Queste due caratteristiche strutturali si traducono in una cellula sottile a forma di freccia progettata per penetrare attraverso ambienti altamente viscosi come i paramenti protettivi delle uova, senza deformazioni o danni significativi alla membrana plasmatica.
Il primo passo del metodo del patch clamp è la creazione della tenuta ermetica tra una pipetta di registrazione (una micropipetta di vetro) e la membrana plasmatica cellulare. Per ottenere ciò, è necessario estrarre una quantità sufficiente di membrana plasmatica all'interno della pipetta di registrazione per formare un gigaseal meccanicamente stabile tra la membrana plasmatica e il vetro. La membrana plasmatica deve essere flessibile e non rigida (Figura 1B). Come accennato in precedenza, l'intera superficie della membrana plasmatica dello spermatozoo è piuttosto aderente, ad eccezione della regione nota come gocciolina citoplasmatica (Figura 1A e Figura 2). Quindi, la natura rigida della membrana plasmatica degli spermatozoi è stata considerata un ostacolo principale nell'ottenere la tenuta ermetica o "gigaseal", così chiamata perché sono necessari >109 ohm per buone registrazioni. Tuttavia, l'introduzione della tecnica del patch clamp per gli spermatozoi nel 20062 ha rimosso questa barriera e questo metodo potrebbe essere applicato con successo a spermatozoi di diverse specie di mammiferi 2,41,51,56. Questa scoperta è stata ottenuta concentrandosi sulla gocciolina citoplasmatica (CD)2,8, una minuscola struttura che si trova lungo la parte centrale dello spermatozoo (Figura 1A e Figura 2), ed è semplicemente il residuo dello spermatide allungato, un precursore delle cellule spermatiche da cui si sviluppano la testa e la coda. Funzionalmente, può aiutare la cellula ad adattarsi ai cambiamenti nell'osmolarità extracellulare durante l'eiaculazione. La caratteristica importante è che la membrana plasmatica all'interno del CD è abbastanza flessibile da poter essere aspirata nella pipetta per formare una tenuta gigaohm. Pertanto, il CD dello sperma è la parte migliore sulla superficie dello sperma attraverso la quale è possibile ottenere una formazione gigaseal di successo e la transizione a una modalità a cellula intera che alla fine accoppia elettricamente la cellula spermatica a un amplificatore patch-clamp 2,8. Vale la pena notare che pubblicazioni precedenti hanno riportato la formazione di gigaseal nella testa dello spermatozoo, che consente la registrazione nella configurazione 54,57,58,59. Tuttavia, le registrazioni in configurazione a cellula intera sono state finora riportate solo eseguendo la formazione gigaseal nella regione CD. Questa modalità a cellula intera consente l'accesso elettrico all'intero volume degli spermatozoi e, quindi, consente il rilevamento delle attività dei canali ionici situati sul flagello dello spermatozoo e sulla testa dello spermatozoo. Per soli pochi anni dal suo sviluppo, la tecnica del patch clamp per spermatozoi ha portato a enormi progressi nella nostra comprensione dei canali ionici degli spermatozoi ed è finora una delle tecniche più robuste per indagare direttamente la funzionalità dei canali ionici degli spermatozoi 9,28,37,39,40,44,46,48,49, 50,51,52,53 (Figura 1).
Il patch clamp per sperma varia in alcuni dettagli dalla classica tecnica del patch clamp, come descritto di seguito. In primo luogo, la maggior parte della membrana plasmatica dello sperma è strettamente attaccata alla rigida struttura intracellulare e, quindi, gli spermatozoi non hanno quasi nessuna membrana plasmatica "di riserva" da aspirare nella pipetta. L'unica regione flessibile è la membrana del CD che assomiglia alla membrana plasmatica di molte cellule somatiche e quindi può essere facilmente aspirata nella pipetta. Per formare una tenuta gigaohm con il CD, viene creata una pressione negativa mediante una leggera aspirazione nella parte superiore della pipetta per aspirare una piccola porzione della membrana plasmatica dello sperma nella punta della micropipetta (Figura 1B). Questa parte della membrana forma un'invaginazione a forma di Ω nella punta della pipetta e stabilisce una tenuta ermetica con le sue pareti interne.
In secondo luogo, la gocciolina citoplasmatica negli spermatozoi umani e di topo è compresa tra 1 e 2 μm (Figura 1 e Figura 2). Pertanto, l'applicazione della tecnica del patch-clamp a un oggetto così piccolo richiede un'ottica ad alta risoluzione. La maggior parte dei rig patch-clamp per spermatozoi sono dotati di un microscopio invertito con un contrasto di interferenza differenziale (DIC) o componenti ottici Nomarski (Figura 2 e Figura 3). L'uso di un microscopio dotato di ottiche DIC per il patch clamp per spermatozoi è altamente raccomandato rispetto alle ottiche a contrasto di fase più convenzionali, poiché le informazioni spaziali visualizzate in DIC aiutano a ottenere una precisione superiore nel posizionamento di una pipetta per patch sul minuscolo CD. Si consiglia inoltre di utilizzare un obiettivo a immersione in acqua 60x o un obiettivo simile, con apertura numerica di 1,2. Questo obiettivo ha una lunga distanza di lavoro (0,28 mm), che consente l'osservazione di spermatozoi che nuotano liberamente in soluzione (Figura 2). L'obiettivo è inoltre dotato di un collare di regolazione per adattarsi allo spessore del vetrino coprioggetto (variabile da 0,13 a 0,21 mm). Questa combinazione della lunga distanza di lavoro e del collare di regolazione consente l'osservazione attraverso due vetrini coprioggetti da 0,13 mm; Un vetrino coprioggetto funge da fondo di vetro della camera di registrazione e il vetrino coprioggetti da 5 mm con gli spermatozoi depositati è posizionato sopra. Come discusso di seguito, depositare gli spermatozoi su vetrini rotondi da 5 mm facilmente sostituibili, piuttosto che direttamente sul fondo della camera di registrazione, è un modo conveniente per caricare gli spermatozoi freschi nella camera di registrazione.
In terzo luogo, il patch clamp rig per lo sperma deve essere dotato di un amplificatore patch-clamp a basso rumore e di un digitalizzatore per registrare correnti elettriche minuscole (intervallo di picoampere) e minuscole variazioni del potenziale di membrana. Questa apparecchiatura deve garantire il più basso amprumore dell'amplificatore. L'assenza di vibrazioni è una parte essenziale di una registrazione patch clamp di successo. Il bloccaggio del cerotto spermatico richiede un micromanipolatore preciso e privo di deriva che può essere collegato al microscopio invertito con una piattaforma di micromanipolatore per garantire una migliore stabilità rispetto a un supporto per micromanipolatore indipendente (Figura 3A). Per testare la configurazione, non si dovrebbe vedere alcun movimento della punta della pipetta (ingrandimento inferiore a 60x) anche quando una persona salta su e giù sul pavimento vicino al tavolo di isolamento dalle vibrazioni.
Protocollo
Tutti gli esperimenti sono stati eseguiti in conformità con le linee guida NIH per la ricerca sugli animali e approvati dall'UC Berkeley Animal Care and Use Committee (AUP 2015-07-7742), con ogni sforzo fatto per ridurre al minimo la sofferenza degli animali. Tutti i metodi descritti sono coerenti con le raccomandazioni del gruppo di esperti scientifici sull'eutanasia dell'American Veterinary Medical Association e del comitato IACUC. Tutte le procedure sperimentali che utilizzano campioni di derivazione umana sono state approvate dal Comitato per la ricerca umana presso l'Università della California, Berkeley, numero di protocollo IRB 2013-06-5395.
1. Realizzazione di micropipette di vetro per la registrazione di patch-clamp di spermatozoi a cellule intere.
NOTA: Le piccole dimensioni della gocciolina citoplasmatica richiedono micropipette di vetro con punte sottili.
- Per la fabbricazione di micropipette, iniziare con capillari in vetro borosilicato con un diametro esterno di 1,5 mm, un diametro interno di 0,86 mm e un filamento interno. Tirare il puntale su un estrattore per micropipette (Figura 3B).
- Per modellare e lucidare il puntale della pipetta, posizionare per un momento un filo caldo in prossimità del puntale. Eseguire questo processo di lucidatura a fuoco con un ingrandimento di 100x utilizzando una lucidatrice per pipette (Figura 3C, D).
- Assicurarsi che il diametro interno del puntale della pipetta sia di ~2 μm prima della lucidatura a fuoco e che si riduca a ~0,5 μm dopo un'adeguata lucidatura.
NOTA: Si consiglia l'uso solo di pipette appena estratte il giorno della registrazione. In questo modo si evita l'accumulo di particelle di polvere sul puntale della pipetta.
2. Impostazione del rig
- Montaggio della camera di registrazione
- Utilizzare una camera di perfusione a forma di diamante a basso volume con flusso laminare e tassi di cambio della soluzione relativamente rapidi (Figura 4). Collegare la camera tramite un collettore a un sistema di perfusione alimentato a gravità (Figura 5).
- Per perfondere una soluzione attraverso la camera di registrazione, assemblare un semplice sistema di perfusione autocostruito alimentato a gravità con un collettore di politetrafluoroetilene che collega la camera di perfusione a otto linee di perfusione separate.
NOTA: Il tubo non deve rilasciare plastificanti nelle soluzioni, poiché tali sostanze chimiche possono influire in modo significativo sulla normale funzione degli spermatozoi60 e alterare l'attività dei canali ionici 61,62. Si consiglia vivamente un tubo in politetrafluoroetilene di piccolo diametro come tubo di perfusione principale. - Poiché il tubo in politetrafluoroetilene è piuttosto rigido, creare collegamenti flessibili con tubi in silicone ad alta purezza che si adattino al tubo in politetrafluoroetilene. Inoltre, utilizzare siringhe (ad es. siringhe Luer Lock) prive di lubrificante, poiché l'olio minerale o altri additivi lubrificanti possono interferire con la registrazione dei canali ionici (Figura 5).
- Assemblaggio di un ponte agar
- Per evitare variazioni del potenziale di giunzione del liquido durante le registrazioni, mantenere stabile l'ambiente intorno all'elettrodo di riferimento utilizzando un ponte agar (Figura 4).
- Per realizzare un ponte di agar, realizzare un capillare di vetro a forma di L piegandolo sotto un piccolo fuoco di un bruciatore Bunsen e lasciarlo raffreddare.
- Preparare una soluzione di agarosio all'1% in 1 M KCl e riscaldarla in un forno a microonde fino a quando l'agarosio si scioglie e la soluzione diventa trasparente. Riempire accuratamente il capillare di vetro a forma di L con la soluzione di cui sopra per evitare bolle d'aria e lasciarlo raffreddare a temperatura ambiente. I ponti di agar possono essere conservati in 1 M KCl per ~2 mesi a +4 °C.
- Per utilizzare un ponte agar, riempire un elettrodo di riferimento a pellet Ag/AgCl con 1 M KCl e inserire il ponte agar con cautela per evitare che l'agarosio solidificato fuoriesca dal capillare di vetro.
- Quindi, inserire il perno dorato (2 mm) del cavo dell'headstage dell'amplificatore nella fessura dell'elettrodo di riferimento da 2 mm (oro) e inserire l'estremità del ponte di agar a forma di L nella camera di perfusione come mostrato nella Figura 4.
- Soluzioni e ricette
NOTA: Tutti i reagenti e le sostanze chimiche devono essere della massima purezza. Tutte le soluzioni preparate vengono filtrate attraverso un filtro PES sterile da 0,22 μm e conservate a 4 °C per un massimo di un mese. Va notato che l'esatta regolazione dell'osmolarità è un prerequisito per il successo del patch clamping.- Preparare la soluzione di fluido tubulare umano (HTF) come descritto nella Tabella 1. Regolare il pH a 7,4 con NaOH. L'osmolarità deve essere compresa tra 280 ± 5 mOsm, misurata utilizzando un osmometro a pressione di vapore.
- Preparare un "bagno" ad alta soluzione salina (HS) o una soluzione "extracellulare" come indicato nella Tabella 2. Regolare il pH a 7,4 con NaOH. L'osmolarità dovrebbe essere di 320 ± 5 mOsm.
- Preparare il "bagno" di cesio metansolfonato o la soluzione "extracellulare" come descritto nella Tabella 3. Regolare il pH a 7,4 con CsOH e l'osmolarità a 320 ± 5 mOsm.
- Per preparare la soluzione intracellulare di "pipetta" di cesio metansolfonato (CsMeSO3), seguire la Tabella 4 e regolare il pH a 7,4 con CsOH. L'osmolarità deve essere fino a 10 mOsm superiore a quella della soluzione HS.
3. Isolamento e purificazione degli spermatozoi dei mammiferi
NOTA: Eutanasia di topi maschi C57BL/6 di età compresa tra 3 e 6 mesi mediante inalazione di CO2 seguita da lussazione cervicale. Dopo la lussazione cervicale, eseguire immediatamente la raccolta dei tessuti (cauda o corpo epididimo) dai topi.
- Isolamento degli spermatozoi di topo epididimali
NOTA: Eutanasia di topi maschi C57BL/6 di età compresa tra 3 e 6 mesi mediante inalazione di CO2 seguita da lussazione cervicale. Dopo la lussazione cervicale, eseguire immediatamente la raccolta dei tessuti (cauda o corpo epididimo) dai topi.- Aprire la zona addominale inferiore del topo con le forbici ed estrarre entrambi gli epididimi.
- Metterli in una piastra per colture cellulari da 35 mm riempita con soluzione HS (soluzione ad alta capacità salina, vedere Tabella 2). Assicurarsi che un'aliquota della soluzione di HS sia preriscaldata a temperatura ambiente prima del contatto con gli spermatozoi.
- Trasferire gli epididimi in una nuova capsula di coltura cellulare contenente una soluzione di HS e rimuovere accuratamente tutto il grasso residuo.
- Separare gli epididimi in caput, corpo e cauda utilizzando una lama di bisturi #15 (Figura 6).
- Trasferire il corpo (o la cauda, se necessario) di ciascun epididimo in una nuova piastra per colture cellulari contenente una soluzione di HS. Praticare più incisioni nella parte isolata dell'epididimo utilizzando una lama di bisturi #11 appuntita.
- Trasferire le parti degli epididimi con incisioni multiple in una provetta da microcentrifuga da 1,5 mL contenente 1,5 mL di soluzione HS.
- Agitare brevemente gli spermatozoi dall'epididimo nella soluzione utilizzando una pinza Dumont superfine di tipo 5a. Scartare gli epididimi e lasciare la provetta a temperatura ambiente per 10 minuti.
- Attendere che la materia solida (cellule non spermatiche) si sedimenti sul fondo della provetta, quindi trasferire il surnatante in un'altra provetta da microcentrifuga da 1,5 mL.
- Conservare la miscela di sperma a temperatura ambiente con accesso all'aria per un massimo di 2 ore, durante le quali è possibile eseguire gli esperimenti. Gli spermatozoi isolati perdono le loro prestazioni 3 ore dopo l'isolamento.
- Capitazione degli spermatozoi di topo
NOTA: Tutti gli spermatozoi dell'epididimo sono adatti per il patch-clamp, ma solo gli spermatozoi dell'epididimo della cauda sono abbastanza maturi da diventare competenti per la fecondazione. Poiché gli spermatozoi caudali possono andare incontro a capacitazione, eseguire esperimenti, in particolare la capacitazione degli spermatozoi, utilizzando spermatozoi caudali.- Eseguire la raccolta di spermatozoi su spermatozoi caudali o eiaculati (vedere i passaggi 3.1.1-4).
- Prendere i caudi isolati come descritto nel passaggio 3.1.4. e applicare più incisioni come descritto nel passaggio 3.1.5. Trasferire i caudi in una piastra di coltura cellulare da 10 mm con 2 mL di soluzione capacitativa.
- Incubare il tessuto caudale in questa soluzione di capacitazione inizialmente per 10 minuti a 37 °C e 5% di CO2, quindi scartare il tessuto e incubare gli spermatozoi rilasciati per altri 50-80 minuti.
NOTA: La capacitazione in vitro degli spermatozoi caudali di topo si ottiene con un'incubazione di 60-90 minuti. Gli spermatozoi capacitati sono identificati visivamente in base all'eccessiva flessione asimmetrica dei loro flagelli nota come iperattivazione. Questo tipo di motilità consente agli spermatozoi di nuotare in modo non lineare.
- Raccolta e purificazione di sperma umano
NOTA: In questo caso, sono stati ottenuti campioni di sperma fresco da un totale di 21 volontari sani di età compresa tra 21 e 38 anni e spermatozoi purificati con la tecnica swim-up a temperatura ambiente come descritto in dettaglio in48,63. In sintesi, la procedura è la seguente:- Lasciare i campioni di eiaculato umano a temperatura ambiente per 60 minuti per consentire la liquefazione prima di essere purificati (durate più lunghe possono influire negativamente sulla qualità dello sperma).
- Preriscaldare circa 7 mL di soluzione di HTF a 37 °C in una provetta da centrifuga da 50 mL. Valutare visivamente il volume dell'eiaculato: se il volume è superiore a 1 ml, preparare più provette di soluzione HTF.
- Applicare con cura 1 mL di eiaculato liquefatto sul fondo di ciascuna provetta senza sollevare i filamenti di sperma sulla superficie del tampone. L'interfaccia tra sperma e HTF dovrebbe essere il più chiara possibile. Evitare le bolle d'aria.
- Posizionare le provette in un'incubatrice a 37 °C per 1 ora in un supporto che le tenga a un angolo di 45° per ottenere la massima superficie. Se l'incubatrice è un'incubatrice a CO2 , chiudere bene il tappo per evitare l'acidificazione del tampone (per questa procedura non è necessaria la CO2 ). Durante l'incubazione, gli spermatozoi mobili nuoteranno gradualmente verso la superficie del tampone HTF.
- Dopo 1 ora raccogliere la frazione più alta di 1 mL da tutti i campioni in una provetta da centrifuga da 15 mL, combinando così spermatozoi di altissima qualità e altamente mobili per il clamping dei patch. Non tentare di rimuovere tutto il surnatante, lasciare diversi mL di HTF rimasti sopra il plasma seminale per evitare contaminazioni. La sospensione cellulare purificata può essere conservata a temperatura ambiente per diverse ore.
NOTA: Un eiaculato normale dovrebbe contenere almeno 15 x 106 spermatozoi per ml64, ma la conta degli spermatozoi varia notevolmente tra i campioni. L'ostacolo di un basso numero di cellule può essere superato lasciando riposare la sospensione di spermatozoi purificati per 30-60 minuti a temperatura ambiente prima del clampaggio del cerotto. In questa condizione, le cellule si accumuleranno gradualmente sul fondo della provetta da centrifuga e formeranno una nuvola di cellule visibile da cui è possibile pipettare le cellule nella camera di registrazione (vedi sotto).
- Capitazione degli spermatozoi umani
NOTA: La capacitazione in vitro di spermatozoi umani può essere realizzata mediante incubazione di 4 ore in soluzione di capacitazione: 20% di siero fetale bovino, 25 mM di NaHCO3 in tamponi HTF o HS48,51 . Gli spermatozoi capacitati possono essere identificati visivamente in base alla loro motilità vigorosa e all'eccessiva flessione asimmetrica dei flagelli che consente agli spermatozoi di nuotare in modo non lineare.- Preparare una soluzione di capacitazione 2x e miscelare 1:1 con la sospensione di spermatozoi.
- Eseguire l'incubazione a 37 °C e 5% di CO2 per un minimo di 4 ore. Per garantire un'alta percentuale di celle capacitate, il tempo di incubazione non deve essere inferiore a 4 ore.
4. Preparazione della soluzione di rivestimento (necessaria solo per il patch-clamp per spermatozoi umani)
NOTA: Un passaggio essenziale consiste nel sollevare lo spermatozoo attaccato dal vetrino coprioggetti prima del rodaggio. Questo passaggio è necessario solo per gli spermatozoi umani e richiede il rivestimento del vetrino coprioggetti per creare una superficie di vetro meno adesiva. Il rivestimento del vetrino coprioggetti riduce la probabilità che gli spermatozoi si attacchino al vetrino coprioggetti e consente agli spermatozoi umani di essere sollevati dal vetrino coprioggetti dopo la formazione gigaseal.
- Diluire 200 μL di eiaculato in 5 mL di soluzione HS in una provetta da centrifuga da 15 mL.
- Centrifugare a 300 x g per 5 minuti e rimuovere il surnatante.
- Risospendere il pellet in 1 mL di soluzione HS e trasferirlo in una provetta da microcentrifuga.
- Sonicare per 10 minuti a 25 °C utilizzando un bagno di sonicazione riempito d'acqua.
- Centrifugare a 10.000 x g per 5 min.
- Trasferire il surnatante in una nuova provetta da microcentrifuga e utilizzarlo per il rivestimento (istruzioni di seguito).
5. Registrazione della conduttanza ionica dall'intera membrana plasmatica dello sperma.
- Attaccare lo sperma al vetrino coprioggetti.
NOTA: Prima della registrazione con patch clamp, gli spermatozoi vengono placcati su vetrini rotondi da 5 mm.- Se si lavora con cellule umane, immergere brevemente i vetrini coprioggetti nella soluzione di rivestimento preparata utilizzando una pinza affilata.
- Inserire quattro vetrini di copertura in un singolo pozzetto di una piastra a 4 pozzetti e coprire con 300 μl di soluzione HS. Evitare che i vetrini del coperchio galleggino fissandoli con nastro adesivo sul fondo della piastra a 4 pozzetti, spingendoli con la punta di plastica di un pipettatore.
- Risospendere delicatamente le sospensioni concentrate di spermatozoi umani (passaggio 3.3.5) o di topo (passaggio 3.1.9) dalla provetta di conservazione (20-50 μL di spermatozoi concentrati) in 300 μL di soluzione HS sopra il vetrino coprioggetti.
- Assicurarsi che gli spermatozoi si accumulino sul fondo del pozzetto dove le loro teste si attaccheranno al vetrino coprioggetti e i loro flagelli batteranno vigorosamente nella soluzione appena sopra il vetrino coprioggetti. È importante lasciare che gli spermatozoi sedimentino sul vetrino coprioggetti per circa 10 minuti a temperatura ambiente prima di registrare.
NOTA: Se gli spermatozoi umani si attaccano male, tornare al passaggio 5.1.1 e diluire la soluzione di rivestimento preparata con una soluzione HS (da 1:20 a 1:2). Questo passaggio deve essere adattato a campioni di sperma di diversi donatori umani in base alla motilità variabile degli spermatozoi che è comune nelle preparazioni di spermatozoi umani.
- Posizionamento del vetrino coprioggetto
- Prelevare un vetrino coprioggetti con cellule leggermente aderenti dal pozzetto e collocarlo in un pozzetto a forma di diamante della camera di registrazione contenente la soluzione di HS (Figura 4).
- Accendere il sistema di perfusione (Figura 5) riempito con soluzione HS per risciacquare la camera e rimuovere i detriti e gli spermatozoi staccati in eccesso dalla camera. Ciò aumenterà la probabilità che la pipetta di registrazione rimanga pulita quando raggiunge le cellule. Questo passaggio è utile quando si lavora con celle non capacitate che tendono ad aderire più forte al vetrino coprioggetti.
NOTA: Se si registra da spermatozoi capacitati, si deve evitare di accendere la perfusione subito dopo che un nuovo vetrino coprioggetto è stato inserito nella camera. Gli spermatozoi capacitati hanno una motilità vigorosa e si attaccano solo liberamente al vetrino coprioggetti. Pertanto, per garantire che sia disponibile il maggior numero di spermatozoi capacitati, è importante attendere ~ 10 minuti e lasciare che gli spermatozoi capacitati aderiscano al vetrino coprioggetti prima di attivare la perfusione. Una volta scelta la cella capacitata appropriata e formata una gigaseal, la perfusione può essere riattivata.
- Selezione di una cellula spermatica per la registrazione del patch-clamp.
- Trova uno spermatozoo adatto con una gocciolina citoplasmatica utilizzando un ingrandimento di 600x (vedi sotto). Questo viene fatto utilizzando una lente ad immersione in acqua 60x come descritto nei metodi con un oculare con ingrandimento 10x. Negli spermatozoi isolati dal corpo epididimo, il CD si trova solitamente vicino al centro della parte centrale. Nelle cellule caudali, la CD di solito si trova vicino all'anulus (Figura 2C). Per gli spermatozoi umani, il CD si trova nella regione del collo (Figura 2A, B).
NOTA: Inoltre, l'opzione di ingrandimento estraibile 1,6x del microscopio può essere utilizzata per esaminare da vicino la morfologia degli spermatozoi (ingrandimento 960x). - Assicurarsi che la gocciolina citoplasmatica sia ovale e abbia una forma leggermente allungata (Figura 2G), simile a un fuso. I CD che appaiono molto rotondi e ingranditi sono spesso fragili e inadatti per il patching (Figura 2D, F).
- Selezionare uno spermatozoo che sia mobile con la testa attaccata al vetrino coprioggetti, in modo tale che la cellula spermatica sia parzialmente fissata, ma il CD e il resto del flagello continuino a muoversi con il battito flagellare. Assicurati che la testa dello spermatozoo sia attaccata liberamente al vetrino coprioggetti in modo che ruoti un po' mentre il flagello si muove da un lato all'altro.
NOTA: L'attacco allentato è importante poiché dopo la formazione del sigillo gigaohm e prima del passaggio alla modalità a cellula intera, lo spermatozoo deve essere sollevato dal vetrino coprioggetti nella soluzione.
- Trova uno spermatozoo adatto con una gocciolina citoplasmatica utilizzando un ingrandimento di 600x (vedi sotto). Questo viene fatto utilizzando una lente ad immersione in acqua 60x come descritto nei metodi con un oculare con ingrandimento 10x. Negli spermatozoi isolati dal corpo epididimo, il CD si trova solitamente vicino al centro della parte centrale. Nelle cellule caudali, la CD di solito si trova vicino all'anulus (Figura 2C). Per gli spermatozoi umani, il CD si trova nella regione del collo (Figura 2A, B).
- Formare un gigaseal
NOTA: Per registrare le correnti CatSper monovalenti in modalità a cella intera, le pipette vengono riempite con una soluzione di Cs-metansolfonato (nota anche come pipetta o intracellulare) (Tabella 4) - questo produce una resistenza della pipetta di 11-17 MΩ (Figura 7A), calcolata automaticamente dall'amplificatore dopo l'applicazione di un passo di tensione da 0 mV a 10 mV. Le pipette possono anche essere riempite con altre soluzioni a seconda dell'applicazione. Si raccomanda di realizzare soluzioni con anioni mobili come metansolfonato, Cl- , aspartato o ioni simili per ridurre la resistenza della pipetta. L'osmolarità della soluzione della pipetta deve essere fino a 10 mOsm superiore a quella della soluzione del bagno. Una tonicità leggermente più elevata della soluzione della pipetta aiuta a mantenere la resistenza di accesso agli spermatozoi il più bassa possibile durante la registrazione con patch clamp.- Dopo la selezione visiva di uno spermatozoo con una morfologia appropriata (Figura 2G), riempire la micropipetta con una soluzione pipettata (Tabella 4) e fissarla nel portapipetta.
- Per mantenere il puntale della pipetta pulito dai detriti, applicare una pressione positiva sulla pipetta utilizzando il gruppo a forma di tubo a U per garantire che la soluzione della pipetta fuoriesca dal puntale dopo essere stata immersa nella soluzione extracellulare, nota anche come soluzione "a bagno" (vedere la Tabella 2).
NOTA: Se le condizioni lo consentono, si consiglia vivamente di formare il sigillo in perfusione costante, poiché questa condizione garantisce la massima pulizia del puntale della pipetta. - Abbassare la pipetta e immergere la punta nella soluzione del bagno (Tabella 2). A questo punto, è possibile misurare la resistenza della pipetta (Figura 7A).
- Per visualizzare chiaramente la cellula, posizionare la punta della pipetta sopra il CD con l'apertura della punta allineata diagonalmente (circa 45°) verso il CD.
- Abbassare rapidamente la punta della pipetta verso il CD in modo che si trovi sullo stesso piano focale, entro pochi μm dal CD.
- Non appena la punta della pipetta tocca il CD, applicare una pressione negativa alla pipetta utilizzando il "boccaglio" per spostare parte della gocciolina nella punta e formare una tenuta gigaohm, nota anche in elettrofisiologia come "evento di aspirazione". Di solito, dopo il contatto iniziale con il puntale della pipetta, la pressione negativa nella pipetta può essere mantenuta fino a un minuto per ottenere gradualmente una tenuta di gigaohm.
- Dopo aver formato con successo il sigillo gigaohm (> 4-20 GΩ), sollevare lo spermatozoo dal vetrino coprioggetti (Figura 7B).
NOTA: Questo passaggio non è richiesto per gli spermatozoi di roditori a causa della loro lunghezza; Tuttavia, il distacco parziale del flagello spermatico è utile per alleviare la potenziale deriva della pipetta. Il distacco degli spermatozoi umani è un passaggio essenziale, poiché la CD è piccola (1~3 μm); se la cellula viene lasciata attaccata al vetrino coprioggetti, anche una leggera deriva della pipetta durante l'esperimento può interrompere il CD. Dopo che lo spermatozoo è stato sollevato, il suo flagello normalmente continua a battere, mentre la cellula è attaccata solo alla micropipetta.
- Rodaggio e transizione alla modalità a cella intera.
- Compensare i transitori di capacità parassita utilizzando la modalità di compensazione dell'amplificatore prima di passare alla modalità a cella intera (Figura 7B). Per osservare inizialmente i transitori di capacità, mantenere il potenziale di membrana a 0 mV e applicare impulsi a 10 mV utilizzando lo strumento "Test di membrana" (Figura 7B).
- Eseguire un rodaggio e una transizione alla modalità a cella intera applicando impulsi di tensione brevi (1 ms) gradualmente crescenti (430-650 mV, incrementi di ~50 mV) combinati con un'aspirazione molto leggera (Figura 7C).
NOTA: Per applicare gli impulsi di rodaggio , utilizzare il protocollo di rodaggio precedentemente programmato all'interno del software patch clamp. Gli impulsi di tensione di break-in vengono applicati allo spermatozoo utilizzando l'ingresso di comando ad alta tensione (retrocommutato) sul retro dell'amplificatore. - Dopo l'applicazione di ogni impulso di tensione di interruzione, avviare lo strumento di test della membrana per verificare se compaiono transitori di capacità maggiori.
NOTA: La presenza di transitori di grande capacità (Figura 7C) indica che l'effrazione è avvenuta e che viene misurata l'intera capacità della cellula (~1 pF per gli spermatozoi umani e ~2,5 pF o più per gli spermatozoi murini). - Montare i transitori di grande capacità utilizzando lo strumento di test a membrana per determinare la capacità dell'intera cella e la sua resistenza di accesso.
NOTA: La resistenza di accesso deve essere la più bassa possibile per un'efficiente perfusione dell'interno dello spermatozoo con la soluzione per micropipetta, nonché per un morsetto di tensione affidabile della membrana plasmatica dello sperma. La resistenza di accesso è solitamente di 25-30 MΩ e 50-70 MΩ rispettivamente per le soluzioni intracellulari basate su Cs+ /K+ e NMDG. - Dopo il rodaggio riuscito, procedere con gli esperimenti pianificati di patch-clamp dell'intera cella, come l'applicazione di varie soluzioni per il bagno (Figura 8) contenenti diversi composti o la misurazione delle attività dei canali utilizzando protocolli di passo di tensione (Figura 8, Figura 9) o di rampa di tensione. Se l'irruzione non è andata a buon fine, tornare al passaggio 6.4.1. scegliendo una micropipetta nuova e selezionando un altro spermatozoo appropriato.
Risultati
Il metodo del patch clamp per lo sperma consente la registrazione diretta del canale CatSper.
Come accennato in precedenza, le registrazioni CatSper sono state eseguite stabilendo un sigillo ad alta resistenza (gigaohm) tra la pipetta del cerotto e lo spermatozoo dei mammiferi alla sua gocciolina citoplasmatica. Dopo il rodaggio e la transizione alla modalità a cellula intera, si ottiene il pieno accesso elettrico all'intero corpo dello spermatozoo e al suo interno, compresa la testa dello spermatozoo e il flagello 2,8,39,51. Questa condizione consente in definitiva la registrazione da qualsiasi canale ionico attivo situato sulla membrana plasmatica dello sperma. Per la registrazione delle correnti di CatSper monovalenti 2,8,39,51 è preferibile una soluzione a bagno nominalmente priva di bivalente (DVF) contenente cesio o sodio come principale ione permeato. Mentre il canale CatSper conduce ioni bivalenti come Ca2+ e Ba2+, questi si muovono attraverso il poro di CatSper a una velocità molto più lenta, risultando in conduttanze appena rilevabili di pochi picoampere (~10-20 pA)2,8,39,51. Pertanto, misurare correnti monovalenti e, quindi, maggiori, attraverso il canale CatSper è un modo più conveniente per valutare la corrente (Figura 8). È importante notare che CatSper è anche permeabile al potassio; pertanto, il canale CatSper deve essere bloccato, o gli spermatozoi carenti di CatSper devono essere utilizzati in situazioni in cui si desidera studiare solo i canali del potassio 2,3,8,28,65 degli spermatozoi. Variando la composizione ionica della pipetta e della soluzione del bagno, è possibile escludere selettivamente alcuni canali ionici, creando al contempo le condizioni per la registrazione selettiva solo da specifici tipi di canali ionici. Ad esempio, l'aggiunta di Cs+ nella soluzione della pipetta provoca il blocco della permeabilità ionica attraverso i canali del potassio degli spermatozoi.
Il canale CatSper è regolato in modo diverso tra le specie di mammiferi.
Gli spermatozoi di specie diverse sono diversi nella loro morfologia e nelle vie di regolazione interne66. Non sorprende che i loro canali ionici siano regolati in modo univoco in modi che riflettono i microambienti specializzati dei tratti riproduttivi maschili e femminili. Il metodo del patch-clamp spermatico è stato applicato con successo a sei specie di mammiferi: murino2, ratto56, umano39,51, bovino, cinghiale e macaco41, come mostrato nella Figura 9. Per questi esperimenti, gli spermatozoi di macachi maschi adulti rhesus [Macaca mulatta] sono stati ottenuti dal California National Primate Research Center in conformità con gli standard dell'Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC) secondo protocolli animali approvati dall'Università della California, Davis, come descritto in41; e tutti gli studi sono stati condotti in conformità con la Guida del National Institutes of Health degli Stati Uniti per la cura e l'uso degli animali da laboratorio. Lo sperma di toro e di cinghiale è stato ottenuto come sottoprodotto esente dall'approvazione specifica IACUC da parte del Dipartimento di Scienze Animali dell'UCD e tutti gli animali sono stati mantenuti in strutture approvate dall'AAALAC. Lo sperma di toro e di verro può essere ottenuto anche da fonti commerciali.
Il primate (macaco Rhesus) e gli spermatozoi umani hanno mostrato proprietà e regolazione simili del canale CatSper. È interessante notare che l'attivazione del progesterone di CatSper sembra essere unica per gli spermatozoi dei primati (Figure 9 e 41), poiché gli spermatozoi di cinghiali, tori e roditori non hanno mostrato alcuna alterazione stimolata dal progesterone delle loro correnti CatSper. Negli spermatozoi di toro e verro, anche l'attività basale del canale CatSper era al di sotto dei limiti rilevabili (Figura 9), suggerendo che in queste specie, l'afflusso di calcio e la conseguente iperattivazione sono guidati da altri canali/trasportatori, o che è necessario un diverso stimolatore naturale per l'attivazione dei loro canali CatSper. In tutte le specie di spermatozoi qui menzionate, compresi gli spermatozoi di toro e di cinghiale, è stato ottenuto il pieno accesso elettrico all'interno degli spermatozoi e le cellule sono state registrate in modalità a cellula intera, come era evidente dalla comparsa dei grandi artefatti di capacità al momento del rodaggio (Figura 7). Questa condizione consente una facile registrazione del canale funzionale di CatSper, e la sua assenza dagli spermatozoi di cinghiale e bovino indica che questo canale è bloccato da un inibitore endogeno ancora sconosciuto presente negli spermatozoi di queste specie o richiede l'attivazione di un modulatore specifico. Tuttavia, si tratta di esperimenti preliminari e saranno necessari ulteriori esperimenti per gli spermatozoi di cinghiale e toro per garantire l'importanza funzionale del canale CatSper in queste specie. Questo ampio spettro di diversità dei canali ionici degli spermatozoi tra le specie potrebbe essere correlato al rapporto tra spermatozoi e dimensioni dell'uovo, la relazione tra le dimensioni degli spermatozoi e i paramenti protettivi dell'uovo, o fungere da barriera alla fecondazione da parte di altre specie66.

Figura 1: Diversità morfologica degli spermatozoi dei mammiferi. (A) Pannello inferiore: rappresentazione schematica di uno spermatozoo; I compartimenti cellulari sono etichettati. Pannelli superiori: Immagini DIC di spermatozoi di diverse specie in senso orario: ratto (Rn; Rattus norvegicus); mouse (Mm; Mus musculus); toro (Bt; Bos taurus); cinghiale (Sd; sus scrofa domesticus); umano (Hs; Homo sapiens) e macaco rhesus (Mmu; Macaca mulatta). La barra di scala si applica a tutte le immagini DIC. Gli inserti indicano goccioline citoplasmatiche. (B) Patching degli spermatozoi di mammifero. Per ottenere la corretta formazione della tenuta tra il puntale della pipetta e la membrana plasmatica, una parte della membrana plasmatica viene aspirata delicatamente nel puntale della pipetta. Il trasferimento alla modalità a cellula intera viene eseguito rompendo la membrana plasmatica tra la punta e la cellula (questa cifra è stata riprodotta da8). Pannello di destra: spermatozoi umani attaccati a una micropipetta di registrazione. (C) Rappresentazione schematica dello spermatozoo umano e di alcuni dei canali ionici flagellari studiati negli spermatozoi umani con il metodo del patch clamp, nonché degli ioni che conducono. CatSper- canale ionico del calcio39,51; Hv1- canale del protone 51,56,67; Slo3/Slo1- canali del potassio 50,53,65,68; TRPV4- canale cationico del potenziale del recettore transitorio vanilloide tipo 448. Clicca qui per visualizzare una versione più grande di questa figura.
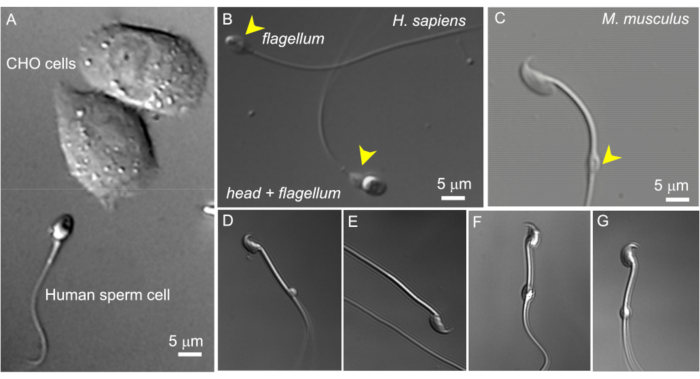
Figura 2: Dimensioni degli spermatozoi e morfologia variabile delle goccioline citoplasmatiche. Le immagini DIC di spermatozoi vivi intatti. (A) Confronto delle dimensioni di uno spermatozoo umano (in basso) e di due cellule CHO (in alto). (B) Spermatozoo umano (Homo sapiens) intatto (in basso) e uno spermatozoo senza testa (flagello, in alto). Le goccioline citoplasmatiche sono indicate da punte di freccia gialle; Questa figura è stata riprodotta da8. (C) Spermatozoo murino (Mus musculus) intatto con goccioline citoplasmatiche (CD) di forma normale indicate dalla punta di freccia gialla. (D-G) Gli spermatozoi murini dell'epididimo hanno goccioline citoplasmatiche di diverse dimensioni e forme; solo (C) e (G) sono adatti per il patch-clamp. (D) la CD è microscopica e unilaterale; (E) CD mancante; (F) Il CD contiene particelle all'interno che possono ostruire la pipetta di registrazione; (G) La CD è liscia, uniforme e non gonfia. La formazione di un gigaseal con questo tipo di CD si tradurrà probabilmente in una registrazione di successo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Componenti del patch clamp per lo sperma. (A) Tipico impianto di elettrofisiologia dello sperma con componenti essenziali: (1) microscopio invertito; (2) digitalizzatore a basso rumore; (3) amplificatore; (4) micromanipolatore a bassa deriva accoppiato al microscopio invertito con una piattaforma di micromanipolatore; (5) computer PC; (6) una tavola d'aria antivibrante; (7) Gabbia di Faraday per proteggere l'impianto dalle interferenze elettriche ambientali. È essenziale che tutti i componenti alimentati elettricamente del rig, inclusi la tastiera e il mouse del computer, producano un rumore elettrico basso o nullo (50 Hz o 60 Hz) e che tutti i componenti del rig siano adeguatamente collegati a terra. (B) Estrattore per micropipette utilizzato per registrare la fabbricazione di pipette. (C) (1) microForge utilizzato per la lucidatura a fuoco con pipette; (2) capillari in vetro borosilicato con diametro esterno 1,5 mm, diametro interno 0,86 mm e filamento interno; (3) Scatola di raccolta pipette. (D) Fasi di riuscita della lucidatura a fuoco delle pipette: (a) pipetta non lucidata con diametro interno di 2 mm; b) pipetta lucidata a fuoco con diametro interno di 0,5 mm; (c) Pipetta sigillata troppo lucidata non adatta per la registrazione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Componenti del sistema della camera di registrazione e suo assemblaggio. (A) Componenti essenziali del sistema della camera di registrazione: (1) adattatore per tavolino per microscopio per piattaforme della serie 20 con (2) due morsetti di supporto del tavolino; (3-4) Piattaforma riscaldata magnetica serie PM con (3) morsetti magnetici per sostenere la camera di perfusione; (5) camera di perfusione; (6) ponte agar; (7) morsetto magnetico, elettrodo di riferimento con jack da 2 mm per pellet Ag/AgCl; (8) supporto magnetico (MAG-1) per la linea di aspirazione; (9) tubo di aspirazione; (10) O-holder del tubo di aspirazione. (B) Sistema di camera di registrazione assemblato con i componenti indicati da (A). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Componenti del sistema di perfusione. (A) Linea di perfusione assemblata e (B) i suoi componenti essenziali: (1) siringhe da 20 ml e 3 ml; (2) rubinetto con attacchi Luer; 4 vie; blocco maschio; (3) adattatore femmina per tubo luer, 1/16"; (4) Tubo di perfusione in politetrafluoroetilene (PTFE) (tubo in PTFE Microbore, 0,022" ID × 0,042" OD); (5) Collettore di perfusione in politetrafluoroetilene a 8 posizioni; (6) Tubo del connettore in silicone (tubo in silicone polimerizzato al platino, diametro interno da 1/32" × diametro esterno da 3/32"); (7) Tubo del connettore del collettore (tubo in PTFE, 1/32" ID × 1/16" OD). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Dissezione di topo maschio. (A) Organi riproduttivi maschili murini; Vengono mostrati sia il testicolo che l'epididimo. (B) Gli epididimi sono trasferiti in una piastra di coltura cellulare da 35 mm contenente una soluzione di HS e il grasso residuo e il dotto deferente sono rimossi. (C) Ogni epididimo viene poi diviso in caput, corpus e cauda utilizzando una lama di bisturi #15. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Formazione di gigaseal e irruzione con lo spermatozoo murino. L'interfaccia dello strumento "Membrane Test" del software di patch clamp commerciale. Tre fasi di clampaggio del cerotto spermatico: (A) la pipetta registrata viene immersa in una soluzione HS a bagno che produce una resistenza della pipetta di 14,8 MΩ; (B) Si forma un gigaseal (la resistenza è di 4,7 GΩ), i transitori di capacità vengono compensati e lo spermatozoo viene sollevato dal vetrino coprioggetti; (C) Passaggio alla modalità a cella intera. Il rodaggio e la transizione nella modalità a cella intera vengono eseguiti applicando impulsi di tensione brevi (1 ms) gradualmente crescenti (430-650 mV, ~50 mV) combinati con un'aspirazione leggera, come mostrato a sinistra. L'effrazione si è verificata, come evidente dalla comparsa dei grandi transitori di capacità che riflettono l'intera capacità della cellula (~2,93 pF per questo spermatozoo). Clicca qui per visualizzare una versione più grande di questa figura.
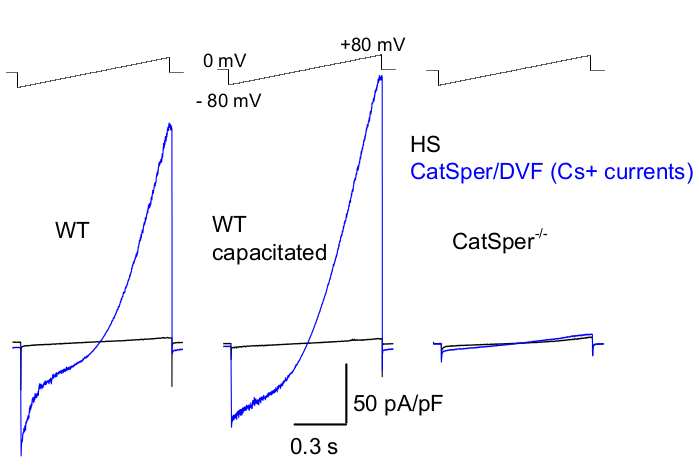
Figura 8: Registrazione di CatSper murino da spermatozoi epididimali della cauda wild type (WT), capacitati e knockout per CatPer. Per registrare l'attività monovalente di CatSper, viene applicato un protocollo di rampa ogni 5 s e le correnti CatSper sono suscitate dalle rampe di tensione da un potenziale di mantenimento di 0 mV39,51. Le rampe di tensione (da -80 mV a 80 mV; 850 ms) sono applicate in HS e in soluzione nominalmente priva di bivalenti (DVF). I dati sono stati campionati a 2-5 kHz e filtrati a 1 kHz. Le correnti basali sono registrate nella soluzione HS, che non produce corrente CatSper a causa dell'inibizione da parte dell'elevato magnesio extracellulare39,51. Le correnti di base sono utili per stimare la conduttanza delle perdite (percorsi non dei canali ionici). Densità di corrente rappresentative di CatSper a cellule intere Cs+ (pA/pF; blu) registrate da spermatozoi murini WT caudali (non capacitati; sinistro e capacitato; al centro) e da spermatozoi murini caudali carenti di CatSper (a destra). Le correnti sono state suscitate da rampe di tensione a partire da un potenziale di mantenimento di 0 mV e le rampe sono state applicate da -80 mV a 80 mV in HS e in soluzione nominalmente priva di bivalente. Correnti di base (nero) registrate in soluzione HS. Per ottenere le densità di corrente, le ampiezze di corrente CatSper sono state normalizzate alla capacità della cella (pA/pF). Clicca qui per visualizzare una versione più grande di questa figura.
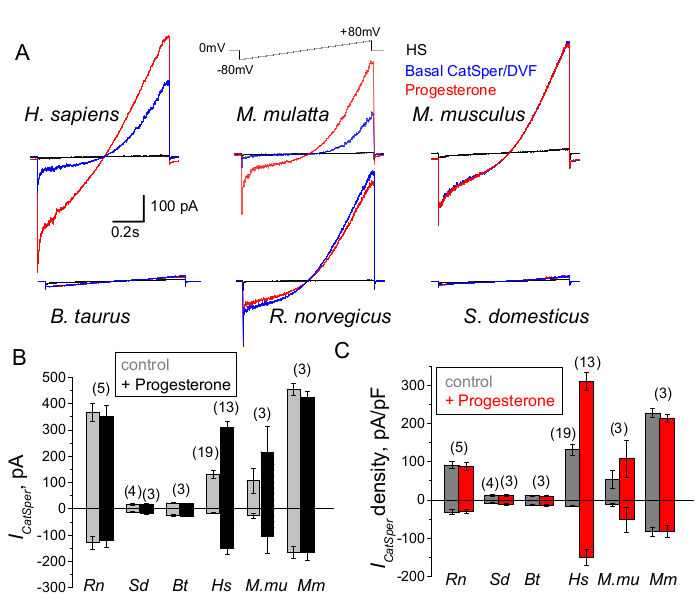
Figura 9: Regolazione del progesterone di CatSper in diverse specie di mammiferi. (A) Corrente rappresentativa di CatSper ottenuta da spermatozoi di diverse specie mediante un protocollo di rampa di tensione come indicato. Specie: umano (Hs; H. sapiens); macaco rhesus (Mmu; M. mulatta), topo (Mm; M. musculus), toro (Bt; B. taurus); ratto (Rn; R. norvegicus); cinghiale (Sd; S. scrofa domesticus). Sono state registrate le correnti CatSper in assenza (blu) e presenza (rosso) di 1 mM di progesterone, così come le correnti basali in soluzione HS (nero). (B) Registrazioni delle ampiezze di corrente CatSper (ICatSper, pA) e (C) Registrazioni delle densità medie di corrente (pA/pF) da spermatozoi di diverse specie, come indicato; n indica il numero di singoli spermatozoi utilizzati. I dati sono medi +/- S.E.M. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10: La differenza nella motilità flagellare. Due esempi rappresentativi di goccioline citoplasmatiche e motilità flagellare. Le immagini sovrapposte degli stessi spermatozoi di ratto (Rn) e umani (Hs) sono state scattate in due diversi punti temporali quando mostrano la deflessione flagellare più distale. I rettangoli tratteggiati indicano la regione con le goccioline citoplasmatiche e la loro corrispondente mobilità spaziale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 11: Assemblaggio del tubo a U e suoi componenti essenziali. (A) Componenti del tubo a U: (1) pipetta sierologica da 10 mL; (2) Tubo in silicone; (3) Tubo connettore in silicone; (4) siringa da 1 ml; (5) Adattatore femmina luer barb; (6) adattatore luer integrale maschio da 1/8"; (7) rubinetto con attacchi Luer; 4 vie; blocco maschio; (8) adattatore maschio Luer serie, 1/16". (B) Tubo a U completamente assemblato e (C) Tubo a U fissato alla gabbia di Faraday. Clicca qui per visualizzare una versione più grande di questa figura.
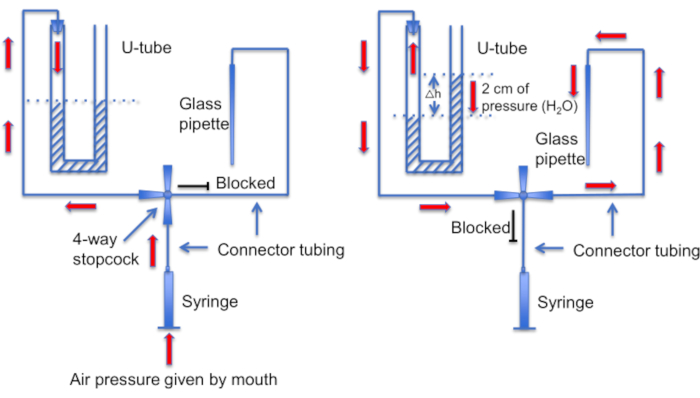
Figura 12: Una rappresentazione schematica dell'assieme del tubo a U. Pannello sinistro: la pressione positiva dell'aria è fornita dalla bocca per creare una differenza nei livelli del liquido nel tubo a U. Il livello del liquido nel corno destro aumenta di 2 cm. Dopo aver creato questa differenza di livello, il rubinetto viene ruotato per collegare il tubo a U alla linea che porta a una pipetta di registrazione. Pannello destro: il livello di liquido più elevato nell'avvisatore destro crea una pressione positiva che spinge costantemente la soluzione della pipetta fuori dal puntale della pipetta e mantiene il puntale pulito dai detriti. Clicca qui per visualizzare una versione più grande di questa figura.
| Prodotti chimici | Peso molare (g/mol) | millimetro | g per 1L |
| NaCl | 58.44 | 97.8 | 5,72 g |
| Kcl | 74.55 | 5 | 0,373 grammi |
| KH2PO4 | 136.09 | 0.37 | 50,4 mg compresse rivestite di film |
| MgSO4 x 7.H2O | 246.48 | 0.2 | 49,3 mg |
| CaCl2 x 2.H2O | 147.02 | 2 | 0,294 g |
| HEPES | 238.3 | 20 | 4.766 grammi |
| Glucosio | 180.2 | 3 | 0,540 g |
| Lattato di sodio (60% p/p) | 112.06 | 20 | 3 ml |
| Piruvato di sodio | 110 | 0.4 | 44 mg |
Tabella 1: Soluzione di fluido tubulare umano (HTF)
| Prodotti chimici | Peso molare (g/mol) | millimetro | g per 1L |
| NaCl | 58.44 | 135 | 7.889 grammi |
| Kcl | 74.55 | 5 | 0,373 grammi |
| CaCl2 x 2. H2O | 147.02 | 2 | 0,294 g |
| MgSO4 x 7. H2O | 246.48 | 1 | 0,247 g |
| HEPES | 238.3 | 20 | 4.766 grammi |
| Glucosio | 180.2 | 5 | 0,901 g |
| Lattato di sodio (60% p/p) | 112.06 | 10 | Flacone da 1,5 ml |
| Piruvato di sodio | 110 | 1 | 0,110 g |
Tabella 2: Soluzione ad alta soluzione salina (HS)
| Prodotti chimici | Peso molare (g/mol) | millimetro | g (per 500 ml) |
| CsMeSO3 | 228.0 | 140 | 15.960 grammi |
| HEPES | 238.3 | 40 | 4.766 grammi |
| EDTA | 292.24 | 1 | 0,146 g |
Tabella 3: Soluzione da bagno CsMeSO3 (Soluzione da bagno senza bivalente: DVF)
| Prodotti chimici | Peso molare (g/mol) | millimetro | mg (per 25 ml) |
| CsMeSO3 | 228.0 | 130 | 741 mg compresse rivestite con film |
| HEPES | 238.3 | 70 | 417 mg compresse rivestite con film |
| EDTA | 292.24 | 2 | 14,6 mg compresse rivestite di film |
| EGTA | 380.35 | 3 | 28,5 mg compresse rivestite con film |
| CsCl | Soluzione 1 M | 1 | 25 μl |
Tabella 4: Soluzione per pipette CsMeSO3
Discussione
Descriviamo un protocollo dettagliato per eseguire registrazioni elettrofisiologiche da spermatozoi di varie specie. Data l'importanza fisiologica dei canali ionici e dei trasportatori elettrogenici per gli spermatozoi, questa tecnica è un potente strumento per studiare la fisiologia degli spermatozoi e i difetti che portano all'infertilità maschile. Lo sperimentatore potrebbe trovare l'esecuzione di questa tecnica impegnativa all'inizio, ma con perseveranza e resistenza, il successo segue.
Gli spermatozoi dei mammiferi sono lunghi (di solito >50 μm), stretti e molto mobili. La frequenza del battito basale (BF) degli spermatozoi dei mammiferi varia notevolmente con valori medi da 4 Hz (topo 69), 7-15 Hz (cinghiale 70,71), 11 Hz (ratto 72), 11-20 Hz (toro 18), 24 Hz (macaco rhesus 23) e fino a 25 Hz (umano 3). La gocciolina citoplasmatica (CD) è la via d'ingresso per la registrazione dagli spermatozoi. Negli spermatozoi dei roditori il CD è spesso distale ma si muove lungo il flagello (Figura 10), creando un ulteriore ostacolo alla registrazione. Tuttavia, negli spermatozoi umani la CD si trova più comunemente vicino alla testa. I componenti chiave di un patch-clamp per spermatozoi di successo sono quindi un'ottica eccellente per consentire una visione chiara e nitida del CD e un sistema di micromanipolatore altamente preciso senza deriva o vibrazione. È previsto un alto tasso iniziale di fallimento ed è normale entro i primi giorni dal patch clamp dello sperma. Si consiglia una pratica di routine che preveda numerosi tentativi a settimana. Ottenere diverse registrazioni al giorno alla settimana stabilirà una routine e migliorerà le capacità motorie.
Fino a poco tempo fa, l'identificazione e la caratterizzazione farmacologica dei canali ionici degli spermatozoi era ostacolata dall'incapacità di studiarli direttamente. Il campo si è basato in gran parte su studi di immunocitochimica, che spesso soffrono di non specificità degli anticorpi e/o della mancanza di modelli genetici corrispondenti. Per studiare i canali del calcio, è stato ampiamente utilizzato il classico metodo di imaging del calcio, che ha i suoi vantaggi e limiti 73,74,75,76,77. Sebbene l'imaging del calcio sia un metodo relativamente semplice che è applicabile per studi a rendimento medio-alto 78,79,80,81 ed è meno invasivo, richiede cellule relativamente intatte e quindi rappresenta un ostacolo per sezionare la funzione dei canali ionici disaccoppiati dalle cascate di segnalazione intracellulare o per distinguerli dagli scambiatori ionici di calcio. Inoltre, è difficile controllare il potenziale di membrana e quindi è più difficile escludere il contributo dei canali del calcio voltaggio-dipendenti. Tra i numerosi vantaggi della fluorimetria del calcio c'è l'uso di coloranti raziometrici di calcio che consentono una misurazione precisa delle variazioni della concentrazione di ioni calcio. Allo stesso tempo, bisogna essere consapevoli che la sensibilità di questi coloranti può variare in base alle variazioni del pH intracellulare.
Di seguito vengono descritti i passaggi critici all'interno del protocollo, inclusi i passaggi per la risoluzione dei problemi del metodo. È essenziale utilizzare solo reagenti puri per la preparazione delle soluzioni sperimentali, poiché anche una piccola contaminazione con ioni indesiderati (come magnesio o metalli pesanti) può compromettere la rilevazione di correnti monovalenti. Date le piccole dimensioni degli spermatozoi, ci si può aspettare un numero relativamente basso di canali ionici per cellula. Pertanto, la corrente netta varia da pochi pA a diverse centinaia di pA. Pertanto, il rumore elettrico interno dell'impianto deve essere minimo per garantire il rilevamento di piccole correnti e si consiglia vivamente l'uso di apparecchiature prive di deriva. Al fine di distinguere una conduttanza specifica dal rumore elettrico e dalla perdita di fondo, l'apparecchio di registrazione e il sistema di messa a terra devono essere massimizzati. Ciò si ottiene mettendo a terra correttamente il carro per evitare qualsiasi interferenza elettrica82. L'uso di una gabbia di Faraday è altamente raccomandato per proteggersi dalle interferenze elettriche prodotte da una varietà di dispositivi elettrici, come le luci degli edifici e i cavi elettrici a parete. È essenziale che tutti i componenti alimentati elettricamente del rig, inclusi la tastiera e il mouse del computer, irradino poco o nessun rumore elettrico (50 Hz o 60 Hz) e che tutti i componenti del rig siano adeguatamente collegati a terra. Il rumore elettrico nella configurazione a cella intera quando tutti i canali ionici sono chiusi dovrebbe essere < 0,5-1 pA.
Un altro punto importante è quello di monitorare le corrette osmolarità delle soluzioni di lavoro. La composizione delle soluzioni intra ed extracellulari deve essere determinata con precisione e le loro osmolarità devono essere misurate correttamente. La soluzione extracellulare deve essere leggermente ipotonica rispetto alla soluzione della pipetta, in quanto provoca un minuscolo rigonfiamento cellulare e impedisce che la pipetta venga ostruita dalla membrana dello sperma. Nota: se la soluzione della pipetta è troppo ipertonica e differisce dalla soluzione del bagno per più di 10 mOsm, ne consegue un eccessivo rigonfiamento cellulare e la rottura del sigillo. Di conseguenza, la cella sarà fragile e il gigaseal andrà perso entro pochi secondi dall'effrazione. In base alla nostra esperienza, una preparazione imprecisa della soluzione è uno degli errori più comuni che impedisce il successo del patch-clamping.
Un altro potenziale ostacolo da evitare è la plastica contenente plastificanti/ftalati, nonché le siringhe lubrificate con olio minerale. I tubi, le siringhe e tutte le apparecchiature di plastica che incontrano le soluzioni, e quindi gli spermatozoi, non devono rilasciare plastificanti o altre tossine o oli ambientali, poiché tali sostanze chimiche possono alterare in modo significativo l'attività dei canali ionici. Utilizziamo tubi in teflon di piccolo diametro come linea di perfusione principale. Il teflon (PTFE) ha pochi composti rilasciabili ma è piuttosto rigido. I collegamenti flessibili sono realizzati con tubi in silicone ad alta purezza che si adattano ai tubi in teflon. Tutte le siringhe utilizzate per il sistema di perfusione sono prive di lubrificante, poiché l'olio minerale o altri additivi lubrificanti possono interferire con la registrazione dei canali ionici.
Non possiamo sopravvalutare l'importanza di utilizzare il bicchiere giusto e di estrarre la forma corretta della micropipetta. Pertanto, la fabbricazione ottimale di micropipette in vetro è un prerequisito per il successo del patching. Utilizziamo micropipette di vetro realizzate solo in vetro borosilicato contenente un filamento per un migliore riempimento della soluzione. La punta delle pipette deve essere lucidata a fuoco per garantire la tenuta ideale. I puntali per pipette che superano i 2 μm di diametro (e quindi hanno una resistenza di 10 MΩ o inferiore) non sono generalmente adatti per il patch-clamp per gli spermatozoi.
Un altro passo importante è assicurarsi che il puntale della micropipetta sia mantenuto pulito da eventuali detriti o bolle d'aria prima della formazione del sigillo. Si tratta di un compito difficile, dato che la micropipetta viene caricata in una soluzione piena di cellule mobili. Un fattore che aiuta a evitare l'"urto" accidentale della pipetta negli spermatozoi che nuotano liberamente, è quello di utilizzare una perfusione costante per lavare via tutte le cellule non aderenti. Un altro strumento è un "tubo a U" fatto in casa che consente di passare dalla modalità di pressione positiva a quella negativa per mantenere pulito l'ugello (Figura 11 e Figura 12).
Poiché gli spermatozoi variano notevolmente nella forma e nelle dimensioni delle loro goccioline citoplasmatiche (CD), è importante scegliere una gocciolina con una morfologia adeguata. Come mostrato nella Figura 2, solo i CD piccoli (1-3 μm), lisci, uniformi e non eccessivamente gonfi sono adatti per il patch-clamp. Minuscolo, unilaterale; I CD "gonfi" e completamente trasparenti producono sigilli deboli o assenti. I CD che contengono particelle solubili di grandi dimensioni possono ostruire la pipetta di registrazione. Quando gli spermatozoi testicolari di topo entrano nell'epididimo, i loro CD si trovano nella regione del collo, vicino alla testa. Mentre viaggiano attraverso l'epididimo, i loro CD si muovono lungo la parte centrale e alla fine arrivano alla connessione tra la parte centrale e la parte principale (l'anello) quando gli spermatozoi raggiungono la cauda epididimo. Pertanto, come accennato in precedenza, negli spermatozoi isolati dal corpo epididimo, il CD si trova solitamente vicino al centro della parte centrale. Nelle cellule caudali, la CD di solito si trova vicino all'anulus (Figura 2C). Per gli spermatozoi umani, il CD si trova nella regione del collo (Figura 2A, B).
Sebbene questo non sia un problema per gli spermatozoi isolati da animali da laboratorio, esiste una significativa variabilità tra i donatori umani. La variazione della qualità dello sperma all'interno dello stesso donatore influisce principalmente sulla qualità della membrana plasmatica dello sperma e talvolta rende relativamente difficile la formazione della foca. C'è meno variabilità nel comportamento dei canali ionici e nella farmacologia, fattori che probabilmente sono correlati con la genetica o la fisiologia individuale. Bisogna essere persistenti e valutare i campioni di varie donazioni per più giorni, oltre a fare affidamento su più donatori umani partecipanti. Lavorare con materiale umano richiede una pazienza extra, poiché la qualità dello sperma donato varia notevolmente all'interno dello stesso donatore, a seconda di vari fattori ambientali. Si consiglia di valutare i campioni di vari giorni di donazione per prendere una decisione finale sullo stato di donatore. Mentre gli spermatozoi purificati eiaculati sono generalmente adatti per l'elettrofisiologia entro poche ore (fino a 12 ore dopo l'isolamento per gli spermatozoi umani), gli spermatozoi murini dell'epididimo sono adatti per il cerotto solo entro una finestra di 2 ore dopo l'isolamento.
Infine, ma non meno importante, la formazione di gigaseal differisce tra gli spermatozoi. Per gli spermatozoi murini/roditori, la formazione di gigaseal avviene quasi istantaneamente, mentre sono necessari diversi secondi (e talvolta fino a un minuto) per formare un gigaseal con uno spermatozoo umano. Spesso l'aspirazione iniziale si traduce in una resistenza di ingresso che varia da 200 MΩ a 800 MΩ. La commutazione del potenziale di mantenimento a -60 mV e la fornitura di impulsi brevi "Membrane Test" fino a 10 mV spesso aiutano a salvare la formazione di gigaseal (attraverso il movimento indotto dal campo di tensione della membrana nella pipetta).
La tecnica del patch clamp per gli spermatozoi consente lo studio dettagliato di specifici canali ionici nel loro sistema di espressione naturale. Il successo della tecnica dipende da un'attrezzatura adeguata, spermatozoi vitali di alta qualità, reagenti puri, competenze di elettrofisiologia di base, pazienza e perseveranza. Il metodo apre nuove frontiere nella fisiologia degli spermatozoi studiando la diversità evolutiva dei canali ionici, i meccanismi della loro regolazione e le alterazioni della loro funzione quando si spostano dal tratto riproduttivo maschile a quello femminile e sono alterati da condizioni esogene, come il pH e i ligandi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da NIH Grant R01GM111802, Pew Biomedical Scholars Award 00028642, Alfred P. Sloan Award FR-2015-65398 e Packer Wentz Endowment Will (to P.V.L.). Questo lavoro è stato sostenuto anche dalla Deutsche Forschungsgemeinschaft (Fondazione tedesca per la ricerca) 368482240/GRK2416 (fino a N.M.) e dalla China Scholarship Council Fellowship a B.L. Ringraziamo il Dr. Dan Feldman per aver condiviso il tessuto di ratto, Katie Klooster e Stuart Meyers della UC Davis per l'aiuto con l'acquisizione di spermatozoi di primati e Steven Mansell per l'aiuto con l'analisi dell'acquisizione dei dati da spermatozoi di cinghiale e toro.
Materiali
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
Riferimenti
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. Ion Channels of Excitable Membranes 3rd Edition. , Sinauer Associates - an imprint of Oxford University Press. (2001).
- Molleman, A. An Introductory Guide to Patch Clamp Electrophysiology. , John Wiley & Sons Ltd. (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082(2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130(2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153(2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53(2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853(2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438(2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426(2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5(2019).
- World Health Organization. World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009(2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212(2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon