Method Article
Mucoromycete Phycomyces blakesleeanus ile Cinsel Haçlar
Bu Makalede
Özet
Burada, P. blakesleeanus çiftleşmesinin indüksiyonu için temel bir protokol sunuyoruz.
Özet
Mucoromycota filumu içindeki ipliksi bir mantar olan Phycomyces blakesleeanus, çevresel algı ve uyarlanabilir tepkiler için olağanüstü kapasitesi ile ayırt edilir. Geçmiş çalışmalar, yerçekimi, ışık, nem ve besin mevcudiyeti dahil olmak üzere çevresel uyaranların büyüme dinamiklerini ve üreme stratejilerini etkilediğini göstermiş olsa da, altta yatan mekanizmalar araştırmanın odak alanı olmaya devam etmektedir. Çevresel ipuçları eşeyli veya eşeysiz üremeyi tetikler. Eşeyli üreme, hifal kemoretraksiyonu tetikleyen feromon sinyallemesi ile başlar ve sonunda bir zigospor oluşumuyla sonuçlanan seri morfolojik geçişlere yol açar.
Laboratuvar ortamında, P. blakesleeanus'un çaprazlanması, farklı aşamalarda cinsel döngüye giren tamamlayıcı misellere neden olur. Çalışmamız, çevresel ipuçlarının P. blakesleeanus miselleri boyunca çiftleşmeyi tetikleyip tetikleyemeyeceğini test etmeyi amaçlıyor. Besin değeri sınırlı ortamlarda yetiştirilen P. blakesleeanu'nin çaprazlamaları, besin yoksunluğuna uygun bir cinsel tepkiyi tetiklemek için besin açısından sınırlı agar'a tabi tutulacaktır. P. blakesleeanus'ta çiftleşmenin başarılı bir şekilde tetiklenmesi, belirli aşamalarda büyük miktarda eşeyli üreyen misel gerektiren gelecekteki çalışmaları kolaylaştıracaktır. Bu araştırmanın sonucu, P. blakesleeanus üreme mekanizmalarının çevresel faktörlerden nasıl etkilendiğine dair anlayışımızı daha da geliştirecek ve filamentli mantarların eşeyli üremesine ilişkin daha geniş bilgi tabanına katkıda bulunacaktır.
Giriş
Laboratuvar koşullarında mantar sistemlerinde çiftleşmenin indüksiyonu, ökaryotik genetik, hücre biyolojisi, evrimsel biyoloji ve biyoteknolojinin anlaşılmasını ilerletmiştir. Dikaryan mantarları, özellikle Ascomycota, laboratuvar ortamında çiftleşme indüksiyonu hakkında en kapsamlı bilgiye sahiptir1. İlginç bir şekilde, eşeyli üremenin önerildiği ilk mantar olan Syzygites megalocarpus, Ascomycota'nın bir üyesi değil, Mucoromycota2 filumunun bir üyesidir. Mucoromycota filumu, daha önce "Zygomycota" olarak sınıflandırılan, ancak şimdi Dikaryan soylarınınkardeşi olarak kabul edilen, erken ayrılan bir gruptur 3,4. Mucoromycota, Zoopagomycota ile birlikte, bu filumlar mantarların karasal ekosistemlere geçişini temsil ettiği için evrimsel olarak önemlidir 4,5. Diğer mantarlar gibi, Mucoromycetes de çevrelerine yanıt olarak eşeysiz ve eşeyli üreme stratejileri kullanır 3,6. Besin açısından sınırlı koşullar altında, mukoromisetler cinsel döngüyebaşlayacaktır 6. Mucoromysetler hem homotalik hem de heterotalik çiftleşme mekanizmaları sergilerler, burada uyumluluk, sırasıyla (-) ve (+) olarak adlandırılan çiftleşme tipi genler sexM ve sexP tarafından belirlenir 7,8,9.
Blakeslee10, mukoromiset cinsel döngüsünün dış koşullara duyarlılığını vurgulayarak, nemin oluşumları için kritik olduğunu ve substrattaki besin mevcudiyetinin önemli bir rol oynadığını belirtti. Tamamlayıcı çiftleşme türleri, öncü olarak beta-karoten kullanılarak trisporik asitlerin (TA) işbirlikçi sentezi yoluyla cinsel döngüye başlar 11,12,13. TA'nın saptanmasını takiben, yanıt veren vejetatif hifler kalınlaşır ve çok dallı zigoforlar haline gelir 14,15,16. Zigoforlar TA üretimine devam eder ve karşılıklı olarak kemoatrasyon yapar. P. blakesleeanus'ta, zigoforlar substrat içinde farklılaşır ve katı agar ortamında kolayca görülemezler17. Temas kurulduğunda, zigoforlar iç içe geçer ve hava zigoforları haline gelir.
Cinsel döngü devam ettikçe, zigoforların uçları bağlanır ve hücrelerin ortası, tabanda koralloid şişlik ile halka benzeri bir yapı oluşturmak için dışarı çıkar ve progametangiuma geçişi tamamlar. Progametangium'u oluşturan hücrelerin uçları kaynaşmaya ve gametangium'a dönüşmeye başlar. Gametangia aşamasında, zigoforlar diken benzeri süslemeler sergiler. Uçlardaki hücre duvarı çözülür ve zigosporun oluşacağı alanı sınırlayan maceracı septa ortaya çıkar ve zigoforlar maşa benzeri süspansiyonlar gibi davranır18. Zigospor, hücre duvarı kalınlaştıkça pigmentli hale gelir ve ek diken benzeri süslemeler kazanır17,18. Bir kez oluştuğunda, zigospor büyüme döngüsünü yeniden başlatmadan önce bir uyku dönemine girecektir.
Phycomyces blakesleeanus, büyük hücreleri ve çevreye duyarlı sporanjiyoforları ile dikkat çeken heterotalik bir mukoromisettir 6,8,18. Bu organizma laboratuvarda kolayca yetiştirilir ve cinsel döngünün zigospor oluşumuna yol açan kısımları 8-10 gün içinde gözlemlenebilir. Bir model olarak, P. blakesleeanus, çevresindeki ışığı algılama yeteneği açısından incelenmiştir17,19. Yetiştirme kolaylığı ve çiftleşmeyi teşvik etme kapasitesi, onu ışığı algılama yeteneğinin arkasındaki mekanizmayı incelemek için ideal bir model haline getirdi20; Bu bulgular aynı zamanda mantarlarda ışık algılama mekanizmalarının evrimsel korunumunu da vurguladı. P. blakesleeanus'ta ışığın, bu korunmuş ışık algılayıcı proteinler aracılığıyla cinsel üremeyi engellediği gösterilmiştir21. Son evrimsel gelişimsel çalışmalar, P. blakesleeanus cinsel döngüsü6 sırasında hangi genlerin hücre farklılaşmasına katkıda bulunduğunu anlamaya çalışmıştır. Morfogenezin spesifik genlerle ilişkilendirilmesi, gen ekspresyonu çalışmalarını gerçekleştirmek için aynı hücre tiplerinden yeterli dokunun izole edilmesini gerektirecektir.
Bir laboratuvar ortamında P. blakesleeanus'un çiftleşmesini indüklemek için protokoller daha önce tanımlanmış olsa da, bazıları sadece kullanılacak ortamın türünü ve ilgili suşları belirtir18. Bazı protokol açıklamaları, spesifik ortam formülasyonunu içermez, ancak varsayımsal tamamlayıcı eşleşme tiplerinin bir plaka10 üzerinde nereye yerleştirileceğini açıklar. Daha yeni protokoller, her bir çiftleşme tipinin sporlarını karıştırarak ve karışık spor süspansiyonu21 ile aşılayarak veya çiftleşme tiplerini biraz arayla yerleştirerek ve kültürün 20 gün boyunca kuluçkaya yatmasına izin vererek zigospor üretiminin artmasına izin verir22. Bu yaklaşımlar, özellikle zigosporlar olmak üzere bol miktarda farklılaşmış hücreler oluşturmak için yararlıdır, ancak gelişimsel bir zaman seyrini gözlemlemek veya tek hücreli transkriptomik için zigosporlardan önce oluşan cinsel yapıları seçmek için uygun olmayabilir. Diğer çalışmalar, cinsel döngü başladığında seri morfolojik geçişlerin gözlemlenmesine izin vermek için tamamlayıcı çiftleşme türlerini katı ortamlara birbirinden uzak tutarak bunu ele almıştır 6,22,23. Diğer mantarlarda olduğu gibi, P. blakesleeanus mycelia radyal olarak genişler24,25. Bu nedenle, tamamlayıcı çiftleşme türleri aynı plaka üzerinde yetiştirildiğinde, misellerinin farklı kısımları farklı zamanlarda temas edecektir. Miseller arasındaki temas, P. blakesleeanus cinsel döngüsünün ilk adımlarından biri olduğundan, bu, etkileşen misellerin farklı bölümlerinin cinsel döngünün farklı aşamalarında olacağı anlamına gelir. Bu eşzamansızlık, bir gen ekspresyonu çalışmasının sonucunu etkileyebilir, öyle ki farklılaşmış hücre tipleri karıştırılırsa ve farklı gen ekspresyon programlarına sahiplerse, o zaman bir genin rolünü belirli bir yapıya atfetmek zor olacaktır.
P. blakesleeanus'un cinsel döngü sırasında morfogenezde yer alan genleri incelemek için bir model olarak değerine ek olarak, güçlü büyümesi ve birkaç gün içinde farklılaşma kapasitesi, onu erken ayrılan filamentli mantarlarla ilgilenen öğrencileri eğitmek ve mantarların çeşitliliği ve gelişim süreçleri hakkında bilgi edinmek için bir lisans sınıfı ortamında kullanmak için ideal bir mantar haline getirir. Burada sunulan protokol, besin mevcudiyetinin miselyum görünümü, çiftleşmenin indüksiyonu ve belirli cinsel yapılar için zenginleştirme üzerindeki etkisini, niceliklendirme, gözlem veya potansiyel tek hücreli transkriptomik için göstermek için iki farklı ortam türünün üç konsantrasyonunu kullanır.
Protokol
1. Medya hazırlığı
- Toz mısır unu agar (CMA) veya patates dekstroz agarını (PDA) deiyonize suda askıya alın. % 100 CMA veya PDA için, üreticinin talimatlarına uyun ve 1 L deiyonize suda 17 g CMA'yı veya 1 L deiyonize suda 39 g PDA'yı askıya alın. % N% CMA veya PDA için, üretici tarafından önerilen miktarın 1 / N'sini askıya alın ve% 7.5'lik (a / h) bir agar konsantrasyonu elde etmek için ek agar ile takviye edin.
NOT: İsteğe bağlı adım: Otoklavlamadan önce, bakteriyel kontaminasyon söz konusuysa 25 μg/mL kloramfenikol ekleyin. - Ortamı otoklavda 121 °C'de 15 dakika sterilize edin.
- Ortamı 60 °C'ye ayarlanmış bir su banyosunda 30 dakika bekleterek ~ 60 ° C'ye soğutun.
NOT: Sıcak medya şişesi çok az rahatsızlık vererek veya hiç rahatsızlık duymadan 6 saniye boyunca tutulabiliyorsa, dökülmeye hazırdır. - Plakaları aseptik koşullar altında laminer akış başlığına veya biyolojik güvenlik kabinine dökün. Medya şişesini açık, boş bir Petri kabının üzerine eğin ve yalnızca altını tamamen kaplayacak kadar dökün.
- Alternatif olarak, bir cam serolojik pipet kullanın ve her plakaya 20 mL ortam pipetleyin.
NOT: Bu yaklaşım, medya şişesinin daha düşük bir sıcaklıkta kalma süresini artırır ve agarın erken katılaşma riskini artırır.
- Alternatif olarak, bir cam serolojik pipet kullanın ve her plakaya 20 mL ortam pipetleyin.
- Medyanın yeniden katılaşmasına izin verin. Hemen kullanılmayacaksa plakaları 4 °C'de saklayın.
2. Mantar sporlarının veya dokularının hazırlanması
- Her P. blakesleeanus çiftleşme türünün kültürlerini elde edin (örneğin, NRRL 1555 (-), NRRL 1554 (+), NRRL 1464 (-) ve NRRL 1465 (+)). Melezleri sporlarla aşılamak için, önce her çiftleşme türünü saf kültürde% 100 CMA veya PDA'da büyütün
- Mevcut kültürlerden öncü miselin bir kısmını kesin ve eksize edilen miselyumu% 100 CMA / PDA plakasına yerleştirin. Saf kültürleri 12 saatlik bir ışık döngüsü altında 27 ° C'de 1 hafta boyunca inkübe edin.
- Sporanjiyoforlar mevcut olduğunda, aseptik teknik kullanılarak sterilize edilmiş, deiyonize edilmiş suda %0.01 Tween 20 ile sporlaşan saf bir kültürü doldurun. Bir P1000 mikropipet ile, plakadan 1.0 mL Tween 20-spor karışımını bir mikrosantrifüj tüpüne çekin.
- 30 saniye boyunca mini bir santrifüjde santrifüjleyin, ardından süpernatanı boşaltın.
- Daha fazla spora ihtiyaç duyulursa, aynı mikrosantrifüj tüpüne 1.0 mL Tween 20 spor karışımı eklemeye devam edin ve adım 2.4'ü tekrarlayın. Uygun miktarda spor elde ettikten sonra, süpernatanı boşaltın ve 500 μL steril deiyonize su ile değiştirin.
- İsteğe bağlı: Sporların konsantrasyonunu tahmin etmek için bir hematitometre kullanın, bu da daha fazla su eklenmesi gerekip gerekmediğini veya sporların yeniden santrifüjlenmesi gerekip gerekmediğini bildirir.
- Alternatif olarak, haçları saf kültürlerden gelen öncü misellerle aşılayın.
- Dokuyu çıkarmak ve aşıyı hemen plakalamak için sterilize edilmiş bir tıraş bıçağı veya mantar deliği delici kullanın.
- Çaprazları 2 çaprazlar, 4 çaprazlar veya 8 çaprazlar olarak ayarlayın (Şekil 1).
NOT: Transkriptomik çalışma için çarpılar ayarlanıyorsa, gösterge plakaları olarak hizmet etmek için koşul/ortam başına 1-2 ek plaka ayarlanması önerilir. Gösterge plakaları, araştırmacıların deney plakalarına ışık maruziyetini sınırlamasına izin verir, çünkü ışık P. blakesleeanus'ta cinsel üremeyi engeller.- 2 yönlü bir çaprazlama için, tamamlayıcı eşleşme türlerini birbirinin karşısına yerleştirin (Şekil 1A).
- (-) çiftleşme tipi NRRL 1555 veya NRRL 1464 misellerini, PDA veya CMA üzerindeki bir Petri kabının kenarından en az 1 cm uzağa yerleştirin.
- Aynı plakaya, (-) çiftleşme tipinin yerleştirildiği yerin karşısına ve Petri kabının kenarından 1 cm uzağa, (+) çiftleşme tipini, NRRL 1554 veya NRRL1465 yerleştirin (Şekil 1A).
NOT: Tamamlayıcı çiftleşme türleri arasındaki mesafe, cinsel döngüye katılan dokunun boyutunu etkileyecektir. Birbirinden daha uzak çiftleşme türleri, miselin daha fazla genişlemesine izin verir ve bu da iki partner arasındaki cinsel etkileşimlerin sayısını artıracaktır.
- 4 bir çaprazlama için, çiftleşme türleri gibi birbirinin karşısına, ancak tamamlayıcı bir çiftleşme türüne komşu olacak şekilde yerleştirin (Şekil 1B).
- (-) çiftleşme türleri NRRL 1555 ve NRRL 1464'ün sporlarını veya misellerini, PDA veya CMA üzerindeki bir Petri kabının kenarından en az 1 cm uzağa karşılıklı olarak yerleştirin.
- Aynı plaka üzerinde, iki (-) çiftleşme türü arasında ve plakanın kenarından en az 1 cm uzakta bir yer seçin ve bölgeyi (+) çiftleşme türü, NRRL 1554 veya 1465 sporları veya miselleri ile aşılayın.
- Aynı plakaya, ilk (+) çiftleşme tipinin aşılandığı yerin karşısına ve plakadan en az 1 cm uzağa, diğer (+) çiftleşme tipini yerleştirin.
- 8 bir çaprazlama için, Petri kabının çevresi boyunca, her çiftleşme türünden dört tane içeren alternatif çiftleşme türleri (Şekil 1C).
- 2 yönlü bir çaprazlama için, tamamlayıcı eşleşme türlerini birbirinin karşısına yerleştirin (Şekil 1A).
- Aşılamadan sonra, plakaları parafilm ile kapatın veya (mühürsüz bırakın) ve karanlıkta 22 ° C'de inkübe etmeden önce ikincil bir kaba koyun. Çiftleşmenin kanıtı için plakaları günlük olarak gözlemleyin, bu süre zarfında plakanın altından fotoğraflar çekin ve kültürler büyüdükçe miselleri izleyin.
NOT: Aşılamadan 24 saat sonra, miselin tüm medya türlerinde genişlediğini görmeyi bekleyin, ancak bireylerin bu aşamada temas halinde olması muhtemel değildir. - Ortam tipine (PDA veya CMA) ve formülasyona (% 25,% 50,% 100) bağlı olarak, misel temas etmeye başlarsa, çiftleşme kanıtı için bir diseksiyon kapsamı altında temas halinde olan tamamlayıcı çiftleşme tiplerinin misellerini inceleyin. Diseksiyon dürbününe monte edilmiş bir kamera veya akıllı telefon ile etkileşime giren misellerin fotoğraflarını çekin.
- Miselin görüntülerini elde edin ve bunları birleştirin (örneğin, Panorama Stitcher uygulamasını kullanarak). Miselin alanını tahmin etmek için ImageJ'yi kullanın (çevrimiçi eğitimlere bakın).
Sonuçlar
4 bir çaprazlamayı takiben, her bir suş, miselyum alanındaki değişiklikle belirlendiği gibi büyüme hızında biraz değişmiştir (Şekil 2). İstatistiksel olarak anlamlı olmasa da, NRRL 1555% 25 CMA,% 25 PDA veya% 100 PDA ile kaplandığında alanda daha hızlı bir değişikliğe sahipti. Benzer şekilde, NRRL 1465, %50 PDA veya CMA'da yetiştirildiğinde alanda daha yüksek bir değişikliğe sahipti. NRRL 1464, %100 CMA ile yetiştirildiğinde alanda en hızlı artışa sahip oldu. 24 saat (1 DPI) sonra, PDA'da büyüyen suşlar, CMA'da büyüyen suşlara göre daha sarı göründü (Şekil 3) - PDA'nın daha önce pigment üretimini arttırdığı gösterilmiştir26. % 100 PDA'daki suşlar, ortalama olarak, 24 saat sonra daha yüksek bir alan ölçüsüne sahipti (Tablo 1). Bu, 1 DPI ile en küçük ortalama alana sahip olan %25 CMA'nın aksinedir (Tablo 1).
Komşu suşlar arasındaki temas 2 DPI'ye kadar gözlenmedi ve sadece PDA'da yetiştirilen suşlar arasında, özellikle %100 PDA'da gözlendi (Şekil 4). 2 DPI'da% 100 PDA'da çiftleşme gözlendi. CMA'da yetiştirilen suşlar 2 DPI'da temas etmedi, ancak %100 CMA birbirine çok yakın büyüyen suşlara sahipti (Şekil 4). 3 günlük inkübasyondan (3 DPI) sonra, farklılaşmış hücre tiplerinin yoğunluğu farklı olmasına rağmen, PDA'nın tüm formülasyonlarında yetiştirilen suşlar çiftleşme sergilemiştir (Tablo 2 ve Şekil 5). % 25 CMA'nın bir kopyası ve% 50 CMA'nın bir kopyası da çiftleşme sergiledi (Tablo 2); kalan CMA plakaları herhangi bir çiftleşme göstermedi (Tablo 2). İlginç bir şekilde, PDA'da yetiştirilen suşların daha yoğun, sarı misel ve hava hiflerine sahip olduğu ortaya çıktı ve bu da sporanjiyoforlara dönüşmüş olabilir (Şekil 5). 4 DPI ile, PDA plakaları aseksüel sporanjiyoforların yanı sıra çiftleşme reaksiyonları sergiliyordu (Şekil 6). CMA plakaları daha yaygın misel ve daha az sporanjiyofor içeren suşlara sahipti (Şekil 6). %100 CMA'da çiftleşme gözlenmedi (Tablo 2).
Temsili plakalar, cinsel döngünün başlangıcı ile ilişkili hücre tiplerinin kolayca gözlemlenip gözlemlenemeyeceğini değerlendirmek için 4 DPI'da bir diseksiyon kapsamı altında gözlendi. Genel olarak, azalan bir besin konsantrasyonu, niteliksel olarak daha az yoğun, farklılaşmış, cinsel misel ile ilişkilendirildi (Şekil 7 ve Şekil 8). % 100 PDA üzerinde büyütüldüğünde, bireysel hava zigoforları veya progametangia görselleştirilemedi ve bir hücre kütlesi olarak ortaya çıktı (Şekil 7A). %50 ve %25 PDA'nın çiftleşme bölgesinde daha düşük hücre yoğunluğuna sahip olduğu görülürken, %25'lik PDA plakaları kolayca ayırt edilebilen hücrelere sahipti (Şekil 7B,C). % 50 PDA ile% 25 PDA'da gözlenen hücre tipleri karşılaştırıldığında, daha düşük konsantrasyondakilerin ağırlıklı olarak aynı tip olduğu görülürken, daha yüksek konsantrasyonda, farklı aşamalarda bir hücre karışımı vardı (Şekil 7D, E). Özellikle, %50 PDA ile, 4 DPI'da gözlemlenen hücreler, yeni ortaya çıkan hava zigoforlarını (Şekil 7D, yıldız) ve bazıları progametangia'ya geçiş yapan (Şekil 7D, ok) içeriyordu. % 25 PDA ile, çoğu hücre çok benzer gelişim aşamalarında gibi görünüyordu (Şekil 7E).
Çeşitli CMA konsantrasyonlarının plakaları, 4 DPI'da PDA plakaları ile birlikte değerlendirildi (Şekil 8). Daha önce belirtildiği gibi, %100 CMA kullanıldığında çiftleşme gözlenmemiştir (Şekil 8A). % 50 CMA veya% 25 CMA'da çiftleşme gözlendi ve eşeyli üreme ile ilişkili hücre tiplerinin toplam sayısı daha düşüktü (Şekil 8B, C). 4 DPI'da gözlenen hava zigoforları, etkileşim bölgesi boyunca aynı boyut ve yükseklikte görünmektedir (Şekil 8B, C). Cinsel döngüye katılan toplam hücre sayısının daha düşük olduğu göz önüne alındığında, bunlar varsayımsal olarak sterilize edilmiş tıraş bıçakları veya diseksiyon iğneleri ile eksize edilebilir ve aşağı akış RNA izolasyonu için hemen sıvı nitrojen içinde dondurulabilir. Aynı gelişimsel zaman noktasında belirli yapıları seçebilmek, morfolojik değişiklikleri genlere bağlamaya çalışan gen ekspresyonu çalışmalarının sağlamlığını artırabilir.
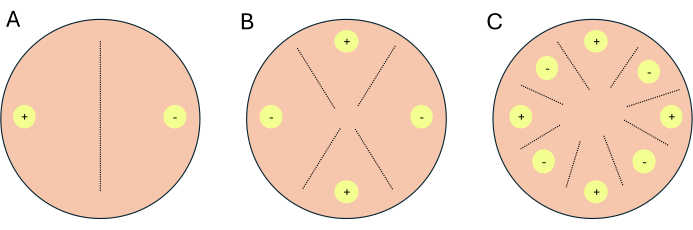
Şekil 1: Üç çapraz formatın şeması. (A) Tamamlayıcı çiftleşme tiplerine (+) ve (-) sahip iki aşılama bölgesine (sarı daireler) sahip 2 yönlü bir çaprazlama. (B) (+) çiftleşme tipinde iki aşılama bölgesi (+ ile sarı daireler) ve (-) çiftleşme tipi iki aşılama bölgesi (- ile sarı daireler) olan 4 yönlü bir çaprazlama. (C) Tamamlayıcı çiftleşme tiplerinin alternatif aşılama bölgelerine (sarı daireler) sahip 8 yönlü bir çaprazlama (+) ve (-). Kesikli çizgiler, çiftleşme etkileşimlerinin tahmin edilen bölgesini temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
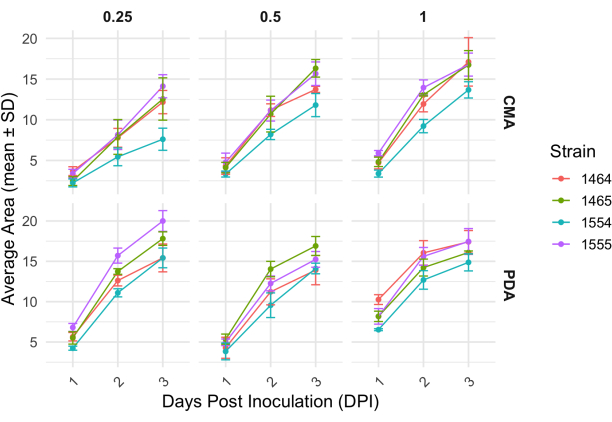
Şekil 2: Farklı konsantrasyonlarda CMA ve PDA üzerindeki her bir suş için zaman içinde alandaki değişim. P. blakesleeanus kolonilerinin ortalama alanı, aşılamadan sonraki 3 gün boyunca çizildi. Hata çubukları, ortalama alanın standart sapmasını temsil eder. Ayrıca Tablo 1'e bakınız. Grafikler ggplot227 ile oluşturuldu. Kısaltma: DPI = aşılamadan sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
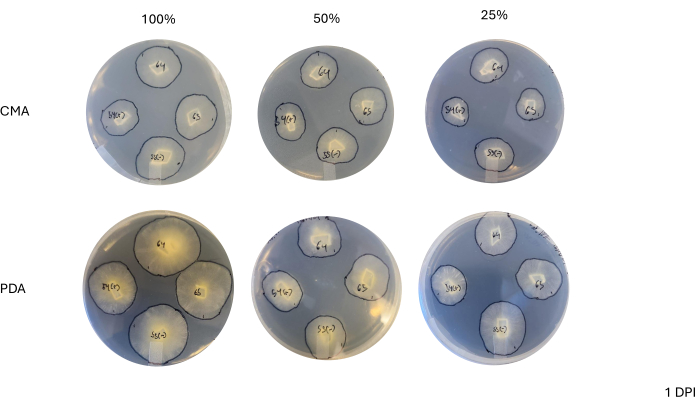
Şekil 3: Aşılamadan 1 gün sonra 4 yönlü haçların temsili görüntüleri. Kolonilerin karşılaştırılması, ortam tipi ve formülasyonu arasında farklılıklar gösterir, %100 PDA'daki kolonilerin CMA'dan daha sarı göründüğünü ve büyümenin %100 PDA'da daha hızlı göründüğünü vurgular. Görüntüler Petri kabının altından çekildi. Miselin ana hatlarını çizmek için bir işaretleyici ile siyah çizgiler çizildi. Kısaltmalar: CMA = mısır unu agar; PDA = patates dekstroz agar; DPI = aşılamadan sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Aşılamadan 2 gün sonra 4 yönlü haçların temsili görüntüleri. Kolonilerin karşılaştırılması, PDA'daki kolonilerin CMA'dakilerden daha yoğun bir miselyuma sahip göründüğü misel büyümesinin görünür yoğunluğunu vurgular. Ek olarak, PDA'daki koloniler daha sarı görünür ve çoğu ya temas etmiştir ya da temas noktasına yaklaşmaktadır. Kırmızı ok uçları, doku yoğunluğundaki artışla gösterildiği gibi, çiftleşme etkileşimlerinin başladığı alanları vurgular. Bu, yalnızca %100 CMA'dakilerin temasa yaklaştığı CMA'daki kolonilerin aksinedir ve tüm CMA formülasyonları, PDA'dakilere kıyasla nispeten daha az sarı olan kolonilere sahiptir ve hiçbiri çiftleşmeye başlamamıştır. Görüntüler Petri kabının altından çekildi. Miselin ana hatlarını çizmek için bir işaretleyici ile siyah çizgiler çizildi. Kısaltmalar: CMA = mısır unu agar; PDA = patates dekstroz agar; DPI = aşılamadan sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Aşılamadan 3 gün sonra 4 yönlü çaprazların temsili görüntüleri. İki ortam türü arasındaki kolonilerin karşılaştırılması, misel yoğunluğunun PDA'da büyütüldüğünde CMA'ya kıyasla daha yüksek olduğunu vurgulamaktadır. Kırmızı ok uçları, tüm PDA plakalarının en az bir çiftleşme etkileşimi alanına ev sahipliği yaptığını vurgulamaktadır. %100 CMA ve %50 CMA'daki koloniler temas etmemiş, ancak %25 CMA'daki (mavi ok) iki koloni temas kurmuştur. Görüntüler Petri kabının üstünden çekildi. Kısaltmalar: CMA = mısır unu agar; PDA = patates dekstroz agar; DPI = aşılamadan sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
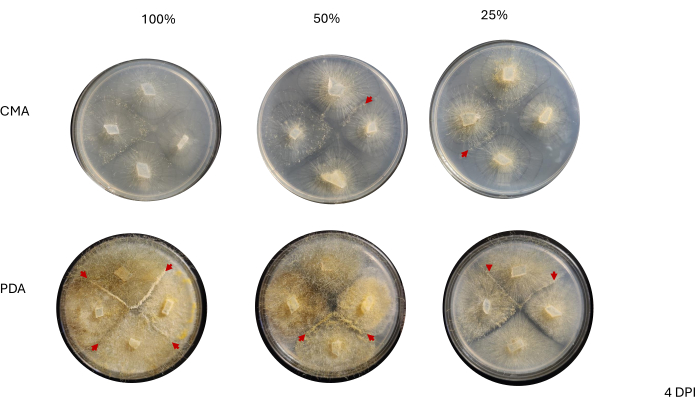
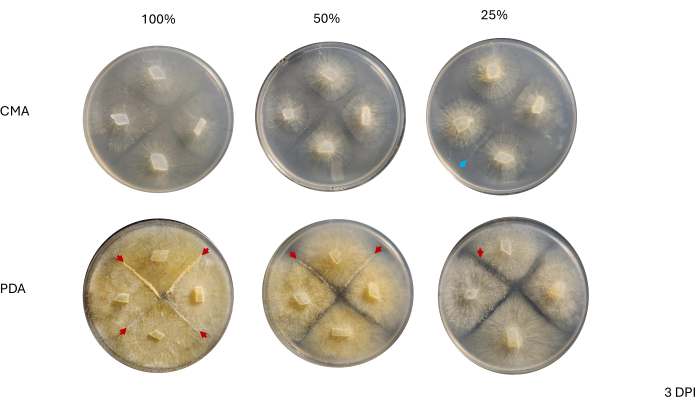
Şekil 6: Aşılamadan 4 gün sonra 4 yönlü çaprazlamaların temsili görüntüleri. PDA'daki tüm koloniler en az bir çiftleşme etkileşimine (kırmızı oklar) ev sahipliği yapar ve sarı bir miselyum gösterir. Ek olarak, PDA'daki koloniler, çiftleşme etkileşimlerinin gözlemlenmesini engelleyebilecek geniş hava hiflerinin (yani aseksüel sporangia) büyümesini gösterir. % 50 ve% 25 CMA'daki koloniler ayrıca çiftleşme etkileşimlerinin kanıtlarını (kırmızı ok uçları) sergiler ve PDA'dakilere kıyasla daha az hava hiphal büyümesine sahiptir. Görüntüler Petri kabının üstünden çekildi. Kısaltmalar: CMA = mısır unu agar; PDA = patates dekstroz agar; DPI = aşılamadan sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: (A) %100 PDA, (B) %50 PDA ve (C) %25 PDA. İlgi alanları büyütüldü (kırmızı dikdörtgenler). Tüm görüntüler 4 DPI'da alındı. (D)% 50 PDA'nın ek bir görünümü, farklı aşamalarda cinsel olarak üreyen hücrelerin varlığını vurgular: genç hava zigoforları: yıldızlar; Daha eski hava zigoforları: kırmızı oklar. (E) % 25 PDA, farklı aşamalarda eşeyli olarak üreyen hücreler sergiler, ancak bu temsili görünüm,% 50 PDA'ya kıyasla bu yapıların daha az kalabalık olduğunu gösterir. Ölçek çubukları = 1 mm (A-C), 0,5 mm (D,E). Kısaltmalar: PDA = patates dekstroz agar; DPI = aşılamadan sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
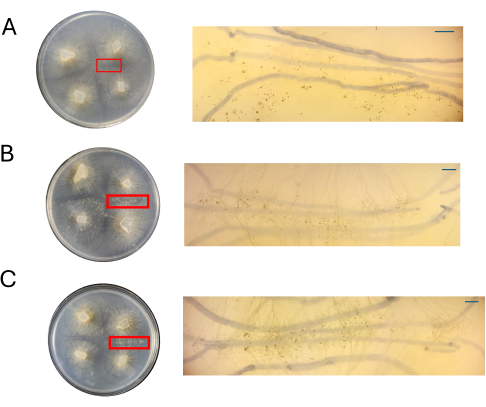
Şekil 8: CMA'daki haçların görüntüleri. (A) %100 CMA, (B) %50 CMA ve (C) ilgilenilen bölgelerin büyütülmesiyle %25 CMA. %50 (B) ve %25 (K) SMA'da belirgin cinsel yapılar kolayca gözlenir ve çapraşıklık minimaldir. Bu zaman noktasında %100 CMA'da hiçbir cinsel yapı görülmez. Tüm görüntüler 4 DPI'da alındı. Petri kabı görüntüleri ve diseksiyon skopu görüntüleri Petri kabının üstünden elde edildi. Diseksiyon dürbünü görüntülerinin arka planlarındaki koyu çizgiler, miselyumun genişlemesini izlemek için kullanılan siyah bir işaretleyici ile çizilir. Ölçek çubukları = 1 mm. Kısaltmalar: CMA = mısır unu agar; DPI = aşılamadan sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: 4 gün boyunca her suş için misel alanı. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Farklı ortamlardaki her bir suş için temas ve çiftleşmenin ikili değerlendirmesi. 0 = Hayır, 1 = Evet. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Laboratuvar ortamında P. blakesleeanus'ta eşeyli üremeyi indüklemek için basit bir protokol burada sunulmuştur. Bu protokol için en kritik hususlardan biri besin sınırlamasıdır. Mantarların, besin sınırlaması 6,28,29,30,31,32 gibi zorlu çevresel koşullara bir yanıt olarak eşeyli üremeyi seçtiği varsayılmaktadır. Besin seviyesinin değiştirilmesi deneysel tasarımı bilgilendirebilir. Örneğin, bir araştırmacı hava zigoforlarında ifade edilen genleri gametangia ile karşılaştırmakla ilgileniyorsa, cinsel yapıların yoğunluğu daha yüksek CMA veya PDA formülasyonlarına kıyasla daha az olacağından daha aşırı bir besin sınırlaması (% 25 CMA gibi) önerilecektir. % 50 veya% 25 CMA ile gözlemlenen gibi daha düşük bir cinsel yapı yoğunluğu, belirli bir farklılaşmış hücre tipinin izolasyonunun sadece daha kolay olmayacağı anlamına gelmez (hücreler kolayca tanımlanıp eksize edileceği için), aynı zamanda sadece ilgilenilen hücre tipinin örneklenmesini sağlar.
Kursiyerler veya öğrenciler de bu protokolden faydalanacaktır, çünkü bu grubun hücre farklılaşmasını izlemesini ve P. blakesleeanus cinsel döngüsü sırasında gelişen çeşitli hücre tiplerini güvenilir bir şekilde ayırt etmesini sağlar. CMA ve PDA'nın kullanımı, mukoromisetlerin 18,22,23 çiftleşmesinin indüksiyonu ile ilgili önceki çalışmaları yansıtır ve toz formlar satın alınabilir, bu da onları diğer sentetik ortamlara kıyasla bir eğitim veya öğretim ortamında daha erişilebilir ortam seçenekleri arasında yapar.
Bu protokolün amacı nihai olarak gelişim ve farklılaşmayı göstermek olduğundan ve besin konsantrasyonunun farklı hücre tiplerinin kolayca gözlemlenip gözlemlenemeyeceğini etkilediğine dikkat çekildiğinden, bu protokoldeki kritik bir adım, uygun ortam bileşiminin sağlanmasıdır (protokol bölüm 1). Seyreltilmiş PDA veya CMA'ya ilave agar tozu eklenmezse, ortam düzgün bir şekilde katılaşmayabilir ve sonraki çiftleşme etkileşimleri kolayca gözlenemeyebilir. Ek olarak, tamamlayıcı ve benzeri çiftleşme türlerinin yerleştirilmesine çok dikkat edilmelidir (protokol bölüm 2). P. blakesleeanus heterotalik olduğu için tamamlayıcı bir çiftleşme partnerine ihtiyaç duyar ve eğer bu partner erişilemezse veya bunun yerine benzer bir çiftleşme türü kullanılırsa, çiftleşme gerçekleşmez 10,33,34.
Bu protokolün bir sınırlaması, cinsel yapıların asenkron gelişimidir. P. blakesleeanus, katı ortamda yetişen diğer mantarlar gibi, her yöne radyal olarak genişler. Bu, miselyumun bazı bölümlerinin cinsel döngünün diğerlerinden daha ileri aşamalarında olacağı anlamına gelir. Ascomycetes35'te cinsel gelişimi senkronize etmek için protokoller mevcuttur, ancak bunlar Mucoromycetes'e başarılı bir şekilde uyarlanmamıştır. Bu, cinsel döngü sırasında gen ekspresyonunu araştıran çalışmanın, çok fazla hücrenin farklı gelişim aşamalarında olması durumunda gürültüye maruz kalacağı anlamına gelir. Bu çalışmadaki gözlemler göz önüne alındığında, besin mevcudiyetinin sınırlandırılması genel olarak daha az eşeyli üreyen hücreye yol açarken, gözlemlenen hücrelerin benzer gelişim aşamalarında olduğu görülmektedir. Bu nedenle, besinlerin sınırlandırılması, farklılaşmış cinsel yapıların yoğunluğunu sınırlamaya yardımcı olabilir ve bir araştırmacıya daha düşük verim pahasına çoğunlukla senkronize dokuya erişim sağlar.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Colorado Koleji Doğa Bilimleri Yürütme Komitesi'ne, Organizma Biyolojisi ve Ekoloji Bölümü'ne ve Hevey Ailesi Öğrenci Araştırmaları Fonu'na bu çalışmayı finanse ettikleri için teşekkür ederiz. Ayrıca teknik destekleri için Alice Keller ve Tia Hutchens'a da teşekkürlerimizi sunarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
Referanslar
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır