Method Article
Половые скрещивания с мукоромицетом Phycomyces blakesleeanus
В этой статье
Резюме
Здесь мы представляем основной протокол индукции спаривания P. blakesleeanus .
Аннотация
Phycomyces blakesleeanus, нитчатый гриб из семейства Mucoromycota, отличается своей замечательной способностью к восприятию окружающей среды и адаптивным реакциям. Хотя прошлые работы показали, что стимулы окружающей среды, включая гравитацию, свет, влагу и доступность питательных веществ, влияют на динамику его роста и репродуктивные стратегии, лежащие в его основе механизмы остаются в центре внимания. Сигналы окружающей среды запускают половое или бесполое размножение. Половое размножение начинается с передачи феромонных сигналов, которые запускают гифальную хемоаттракцию, что в конечном итоге приводит к серийным морфологическим переходам, кульминацией которых является образование зигосспоры.
В лабораторных условиях скрещивание P. blakesleeanus приводит к комплементарному мицелию, проходящему половой цикл на разных стадиях. Наша работа направлена на то, чтобы проверить, могут ли сигналы окружающей среды вызвать спаривание в мицелии P. blakesleeanus. Скрещивания P. blakesleeanu, выращенные на средах с ограничением питательных веществ, будут подвергаться воздействию агара с ограниченным содержанием питательных веществ, чтобы вызвать сексуальную реакцию в соответствии с депривацией питательных веществ. Успешное инициирование спаривания у P. blakesleeanus облегчит будущие исследования, требующие большого количества мицелия, воспроизводящего половым путем на определенных стадиях. Результаты этого исследования еще больше углубят наше понимание того, как факторы окружающей среды влияют на репродуктивные механизмы P. blakesleeanus , что внесет свой вклад в более широкую базу знаний о половом размножении нитчатых грибов.
Введение
Индукция спаривания в грибковых системах в лабораторных условиях продвинула понимание эукариотической генетики, клеточной биологии, эволюционной биологии и биотехнологии. Дикарийские грибы, в частности Ascomycota, обладают наиболее обширными знаниями об индукции спаривания в лабораторных условиях1. Интересно, что первый гриб, у которого было предложено половое размножение, Syzygites megalocarpus, не является членом Ascomycota, а скорее членом типа Mucoromycota2. Тип Mucoromycota является раннедивергирующей группой, ранее классифицированной как "Zygomycota", но теперь считающейся сестринской линией Дикарья 3,4. Mucoromycota, наряду с Zoopagomycota, являются эволюционно значимыми, так как эти типы представляют собой переход грибов к наземным экосистемам 4,5. Как и другие грибы, мукоромицеты используют бесполые и половые репродуктивные стратегии в ответ на окружающую среду 3,6. В условиях ограниченного количества питательных веществ мукоромицеты начинают половой цикл6. Мукоровицеты демонстрируют как гомоталльные, так и гетероталлические механизмы спаривания, где совместимость определяется генами типа спаривания sexM и sexP, обозначенными как (-) и (+) соответственно 7,8,9.
Блейксли10 подчеркнул чувствительность полового цикла мукоровицетов к внешним условиям, отметив, что влажность имеет решающее значение для их формирования и что доступность питательных веществ в субстрате играет значительную роль. Комплементарные типы спаривания начинают половой цикл путем кооперативного синтеза триспоровых кислот (ТА) с использованием бета-каротина в качестве предшественника 11,12,13. После обнаружения ТА реагирующие вегетативные гифы утолщаются и становятся сильно разветвленными зигофорами 14,15,16. Зигофоры продолжают продукцию TA и взаимно хемоаттрактируются. У P. blakesleeanus зигофоры дифференцируются в пределах субстрата и не видны на твердых агаровых средах17. При контакте зигофоры переплетаются и становятся воздушными зигофорами.
По мере продолжения полового цикла кончики зигофоров прикрепляются, а середина клеток выталкивается, образуя кольцеобразную структуру с коралловидным набуханием у основания, завершая переход к прогаметангиуму. Кончики клеток, образующих прогаметангий, начинают сливаться и развиваться в гаметангий. На стадии гаметангии зигофоры демонстрируют колючий орнамент. Клеточная стенка на концах растворяется, и появляются придаточные перегородки, ограничивающие область, где будет формироваться зигоспора, а зигофоры действуют как щипцеобразные суспензоры18. Зигосспора становится пигментированной по мере того, как ее клеточная стенка утолщается, и она приобретает дополнительный шипообразный орнамент17,18. После формирования зигосспора вступает в период покоя, прежде чем возобновить цикл роста.
Phycomyces blakesleeanus — гетероталлический мукоровицет, отличающийся крупными клетками и экологически чувствительными спорангиофорами 6,8,18. Этот организм легко культивируется в лаборатории, и участки полового цикла, приводящие к образованию зигоспор, можно наблюдать в течение 8-10 дней. В качестве модели P. blakesleeanus был исследован на предмет его способности воспринимать свет в окружающей среде17,19. Легкость выращивания и способность вызывать спаривание также сделали его идеальной моделью для изучения механизма, лежащего в основе его способности восприниматьсвет. Эти результаты также высветили эволюционное сохранение светочувствительных механизмов у грибов. Было показано, что у P. blakesleeanus свет подавляет половое размножение через эти консервативные светочувствительные белки21. Недавние исследования эволюционного развития были направлены на то, чтобы понять, какие гены способствуют дифференцировке клеток во время полового цикла P. blakesleeanus 6. Корреляция морфогенеза с конкретными генами потребовала бы выделения достаточного количества тканей из одних и тех же типов клеток для проведения исследований экспрессии генов.
В то время как протоколы индуцирования спаривания P. blakesleeanus в лабораторных условиях были описаны ранее, в некоторых из них упоминается только тип используемой среды исоответствующие штаммы. Некоторые описания протоколов не включают конкретную формулировку среды, но описывают, где расположить предполагаемые комплементарные типы сопряжения на пластине10. Более поздние протоколы позволяют увеличить производство зигоспор либо путем смешивания спор каждого типа спаривания и инокуляции смешанной споровой суспензией21, либо путем размещения типов спаривания на некотором расстоянии друг от друга и предоставления культуре возможности инкубации в течение 20 дней22. Эти подходы полезны для получения достаточного количества дифференцированных клеток, в частности, зигоспор, но могут не подходить для наблюдения за ходом развития или отбора половых структур, которые формируются до зигоспор для транскриптомики одиночных клеток. В других работах этот вопрос решался путем размещения комплементарных типов спаривания на расстоянии друг от друга на твердых средах, чтобы можно было наблюдать за последовательными морфологическими переходами в начале полового цикла 6,22,23. Как и в случае с другими грибами, мицелий P. blakesleeanus расширяется радиальнов 24,25 раза. Поэтому, когда на одной и той же пластине выращиваются комплементарные типы, разные части их мицелия будут соприкасаться в разное время. Поскольку контакт между мицелиями является одним из первых этапов полового цикла P. blakesleeanus, это означает, что разные части взаимодействующего мицелия будут находиться на разных стадиях полового цикла. Эта асинхронность может повлиять на результаты исследования экспрессии генов, так что если дифференцированные типы клеток смешиваются и если они имеют различные программы экспрессии генов, то будет трудно приписать роль гена одной конкретной структуре.
В дополнение к ценности P. blakesleeanus в качестве модели для изучения генов, участвующих в морфогенезе во время полового цикла, его энергичный рост и способность к дифференцировке в течение нескольких дней делают его идеальным грибом для обучения студентов, заинтересованных в ранней дивергации нитчатых грибов, и для использования в аудиториях бакалавриата для изучения разнообразия грибов и процессов их развития. Представленный здесь протокол использует три концентрации двух различных типов сред для демонстрации влияния доступности питательных веществ на внешний вид мицелия, индукцию спаривания и обогащение определенными половыми структурами либо для количественной оценки, либо для наблюдения, либо для потенциальной транскриптомики одиночных клеток.
протокол
1. Подготовка СМИ
- Суспензируйте порошковый агар из кукурузной муки (CMA) или картофельный декстроза-агар (PDA) в деионизированной воде. Для получения 100% CMA или PDA следуйте инструкциям производителя и суспендируйте 17 г CMA в 1 л деионизированной воды или 39 г PDA в 1 л деионизированной воды. Для N% CMA или PDA суспендируйте 1/N от рекомендованного производителем количества и добавьте дополнительный агар для достижения концентрации агара 7,5% (w/v).
ПРИМЕЧАНИЕ: Необязательный шаг: Перед автоклавированием добавьте 25 мкг/мл хлорамфеникола, если есть опасения по поводу бактериального загрязнения. - Стерилизовать среду в автоклаве при температуре 121 °C в течение 15 минут.
- Охладите среду до ~60 °C, поместив ее на 30 минут на водяную баню, установленную на 60 °C.
ПРИМЕЧАНИЕ: Если теплую бутылку со средой можно держать в течение 6 секунд практически без дискомфорта, то она готова к наливанию. - В асептических условиях разливайте пластины в колпак с ламинарным потоком или шкаф биологической безопасности. Наклоните бутылку со средой над открытой пустой чашкой Петри и налейте ровно столько, чтобы полностью покрыть дно.
- В качестве альтернативы используйте стеклянную серологическую пипетку и внесите 20 мл среды в каждую пластину.
ПРИМЕЧАНИЕ: Такой подход увеличивает время, в течение которого бутылка со средой находится при более низкой температуре, и повышает риск преждевременного затвердевания агара.
- В качестве альтернативы используйте стеклянную серологическую пипетку и внесите 20 мл среды в каждую пластину.
- Дайте носителю снова затвердеть. Храните пластины при температуре 4 °C, если не используете сразу.
2. Подготовка грибковых спор или тканей
- Получите культуры каждого типа спаривания P. blakesleeanus (например, NRRL 1555 (-), NRRL 1554 (+), NRRL 1464 (-) и NRRL 1465 (+)). Чтобы инокулировать скрещивания спорами, сначала выращивают каждый тип спаривания в чистой культуре на 100% ХМА или КПК
- Вырежьте часть мицелия по переднему краю из существующих культур и поместите вырезанный мицелий на пластину со 100% CMA/PDA. Инкубировать чистые культуры в течение 1 недели при температуре 27 °C при 12-часовом световом цикле.
- Как только спорангиофоры присутствуют, залейте спорулирующую чистую культуру 0,01% Tween 20 в стерилизованную деионизированную воду, используя асептический метод. С помощью микропипетки P1000 наберите 1,0 мл смеси спор Tween 20 из планшета в пробирку для микроцентрифуги.
- Центрифугируйте в мини-центрифуге в течение 30 с, затем сцедите надосадочную жидкость.
- Если требуется больше спор, продолжайте добавлять 1,0 мл смеси спор Tween 20 в ту же микроцентрифужную пробирку и повторите шаг 2.4. После получения подходящего количества спор сцедите надосадочную жидкость и замените ее 500 мкл стерильной деионизированной воды.
- Дополнительно: Используйте гемацитометр для оценки концентрации спор, который сообщит, нужно ли добавить больше воды или повторно центрифугировать споры.
- В качестве альтернативы можно инокулировать скрещивания передовым мицелием из чистых культур.
- Используйте стерилизованное бритвенное лезвие или сверло для пробковых отверстий, чтобы вырезать ткань и немедленно ввести инокулянт.
- Настройте кресты как 2-ходовые кресты, 4-сторонние кресты или 8-сторонние кресты (рис. 1).
ПРИМЕЧАНИЕ: Если для транскриптомной работы настраиваются кроссы, рекомендуется установить 1-2 дополнительные пластины для каждого состояния/среды, которые будут служить индикаторными пластинами. Индикаторные пластины позволяют исследователям ограничивать воздействие света на экспериментальные пластины, поскольку свет подавляет половое размножение P. blakesleeanus.- Для двустороннего скрещивания поместите дополнительные типы спаривания друг напротив друга (рисунок 1A).
- Поместите мицелий (-) типа спаривания, NRRL 1555 или NRRL 1464, на расстоянии не менее 1 см от края чашки Петри на PDA или CMA.
- На той же пластине, напротив того места, где был размещен тип сопряжения (-), и на расстоянии 1 см от края чашки Петри, поместите тип сопряжения (+), NRRL 1554 или NRRL1465 (рис. 1A).
Примечание: Расстояние между комплементарными типами спаривания будет влиять на размер ткани, участвующей в половом цикле. Типы спаривания, расположенные дальше друг от друга, позволяют мицелию расширяться больше, что увеличит количество сексуальных взаимодействий между двумя партнерами.
- Для 4-стороннего скрещивания разместите похожие типы спаривания друг напротив друга, но рядом с комплементарным типом спаривания (Рисунок 1B).
- Поместите споры или мицелий (-) типов спаривания, NRRL 1555 и NRRL 1464, друг напротив друга на расстоянии не менее 1 см от края чашки Петри на КПК или ХМА.
- На той же пластине выберите место между двумя (-) типами сопряжения и на расстоянии не менее 1 см от края пластины и инокулируйте участок спорами или мицелием типа (+), NRRL 1554 или 1465.
- На той же пластине, напротив того места, где был привит первый (+) тип сопряжения, и на расстоянии не менее 1 см от пластины, поместите другой (+) тип сопряжения.
- Для 8-стороннего скрещивания чередуйте типы спаривания вдоль периферии чашки Петри, по четыре типа спаривания каждого типа (рис. 1C).
- Для двустороннего скрещивания поместите дополнительные типы спаривания друг напротив друга (рисунок 1A).
- После инокуляции запечатайте планшеты парапленкой или (оставьте их незакрытыми) и поместите их во вторичный контейнер перед инкубацией при температуре 22 °C в темноте. Ежедневно наблюдайте за пластинами на предмет признаков спаривания, в течение которого делайте фотографии из-под пластины и отслеживайте мицелий по мере роста культур.
ПРИМЕЧАНИЕ: Через 24 часа после прививки ожидайте распространения мицелия на все типы сред, но люди вряд ли будут контактировать на этом этапе. - В зависимости от типа среды (PDA или CMA) и рецептуры (25%, 50%, 100%), если мицелий начинает контактировать, осмотрите мицелии комплементарных типов спаривания, которые находятся в контакте под препарирующим эндоскопом для доказательства спаривания. Сделайте фотографии взаимодействующего мицелия с помощью камеры или смартфона, установленных на препарирующем эндоскопе.
- Получите изображения мицелия и сшейте их вместе (например, с помощью приложения Panorama Stitcher). Используйте ImageJ для оценки площади мицелия (см. онлайн-уроки).
Результаты
После 4-стороннего скрещивания скорость роста каждого штамма незначительно варьировалась, что определялось изменением площади мицелия (Рисунок 2). Несмотря на то, что NRRL 1555 не является статистически значимым, он имел более быстрое изменение площади при нанесении покрытия на 25% CMA, 25% PDA или 100% PDA. Аналогичным образом, NRRL 1465 имел более высокое изменение площади при выращивании на 50% PDA или CMA. NRRL 1464 показал самый быстрый прирост площади при выращивании на 100% CMA. Через 24 ч (1 DPI) штаммы, растущие на ОАП, выглядели более желтыми по сравнению со штаммами, выращенными на ЦМА (Рисунок 3)-ранее было показано, что ОАП увеличивает продукцию пигмента26. Штаммы на 100% ОАП имели в среднем более высокую площадь через 24 ч (Таблица 1). Это контрастирует с 25% CMA, который имел наименьшую среднюю площадь в 1 DPI (табл. 1).
Контакт между соседними штаммами не наблюдался до 2 DPI и только среди штаммов, выращенных на PDA, особенно 100% PDA (рис. 4). Спаривание наблюдалось при 100% PDA при 2 DPI. Штаммы, выращенные на КМА, не контактировали при 2 DPI, хотя при 100% CMA были штаммы, которые росли очень близко друг к другу (рис. 4). Через 3 дня инкубации (3 DPI) штаммы, выращенные на всех формах PDA, демонстрировали спаривание, хотя плотность дифференцированных типов клеток различалась (табл. 2 и рис. 5). Одна репликация 25% ХМА и одна реплика 50% ХМА также продемонстрировали спаривание (Таблица 2); остальные пластины CMA не показали никакого сопряжения (Таблица 2). Интересно, что штаммы, выращенные на ОАП, имели более плотный желтый мицелий и воздушные гифы, которые могли развиваться в спорангиофоры (Рисунок 5). К 4 DPI пластины PDA проявляли брачные реакции наряду с бесполыми спорангиофорами (рис. 6). В планшетах CMA были штаммы с большим количеством диффузного мицелия и меньшим количеством спорангиофоров (Рисунок 6). Спаривание не наблюдалось при 100% CMA (Таблица 2).
Репрезентативные пластины наблюдались под препарирующим эндоскопом при 4 DPI, чтобы оценить, можно ли легко наблюдать типы клеток, связанные с началом полового цикла. В целом, снижение концентрации питательных веществ коррелировало с качественно менее плотным, дифференцированным, половым мицелием (рис. 7 и рис. 8). При выращивании на 100% ОАП отдельные воздушные зигофоры или прогаметангии не могли быть визуализированы и проявлялись в виде массы клеток (рис. 7А). В то время как 50% и 25% PDA, по-видимому, имеют более низкую плотность клеток в месте спаривания, пластины с 25% PDA содержат клетки, которые можно легко различить (рис. 7B, C). При сравнении типов клеток, наблюдаемых при 50% ОАП и 25% ОАП, те, которые имели более низкую концентрацию, представляли собой преимущественно один и тот же тип, в то время как при более высокой концентрации наблюдалась смесь клеток на разных стадиях (рис. 7D, E). Примечательно, что при 50% ОАП клетки, наблюдаемые при 4 DPI, включали воздушные зигофоры, которые только что появились (Рисунок 7D, звездочка), и некоторые, которые переходили в прогаметангию (Рисунок 7D, стрелка). При 25% ОАП большинство клеток, по-видимому, находились на очень похожих стадиях развития (Рисунок 7E).
Планшеты с различными концентрациями ХМА оценивали вместе с планшетами PDA при 4 DPI (рис. 8). Как упоминалось ранее, осеменение не наблюдалось при использовании 100% CMA (Рисунок 8A). При 50% CMA или 25% CMA наблюдалось спаривание, и общее количество типов клеток, связанных с половым размножением, было ниже (рис. 8B, C). Воздушные зигофоры, наблюдаемые при 4 DPI, оказались одинаковыми по размеру и высоте в зоне взаимодействия (рис. 8B, C). Учитывая меньшее общее количество клеток, участвующих в половом цикле, их гипотетически можно вырезать стерилизованными бритвенными лезвиями или иглами для препарирования и немедленно заморозить в жидком азоте для выделения РНК. Возможность выбора конкретных структур в один и тот же момент развития может повысить надежность исследований экспрессии генов, направленных на установление связи морфологических изменений с генами.
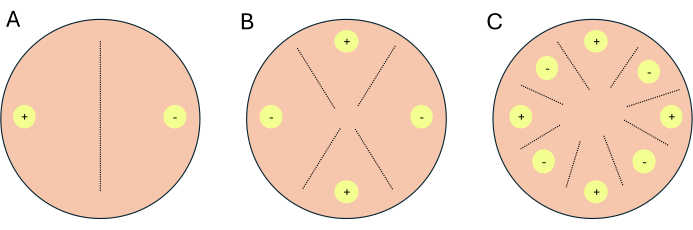
Рисунок 1: Схема трех форматов скрещивания. (A) 2-стороннее скрещивание с двумя сайтами инокуляции (желтые круги) с комплементарными типами спаривания (+) и (-). (B) 4-стороннее скрещивание с двумя сайтами инокуляции (+) типа спаривания (+) и двумя сайтами инокуляции (-) типа спаривания (желтые круги с -). (C) 8-стороннее скрещивание с чередующимися местами инокуляции (желтые круги) комплементарных типов спаривания (+) и (-). Пунктирные линии представляют прогнозируемое место брачных взаимодействий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
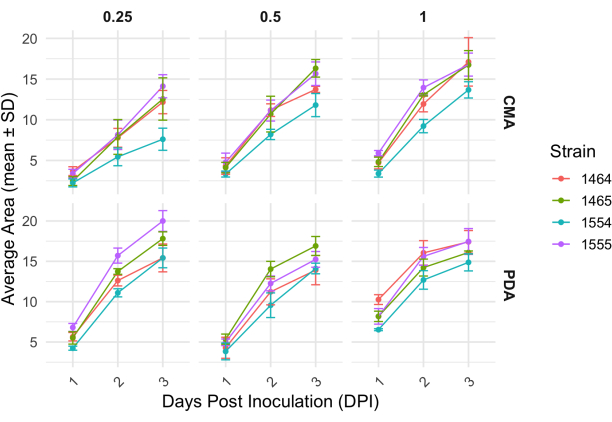
Рисунок 2: Изменение площади с течением времени для каждого штамма ХМА и ФМА при различных концентрациях. Средняя площадь колоний P. blakesleeanus была построена в течение 3 дней после инокуляции. Полосы погрешностей представляют собой стандартное отклонение средней площади. Также см. Таблицу 1. Графики были сгенерированы с помощью ggplot227. Сокращение: DPI = дни после прививки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
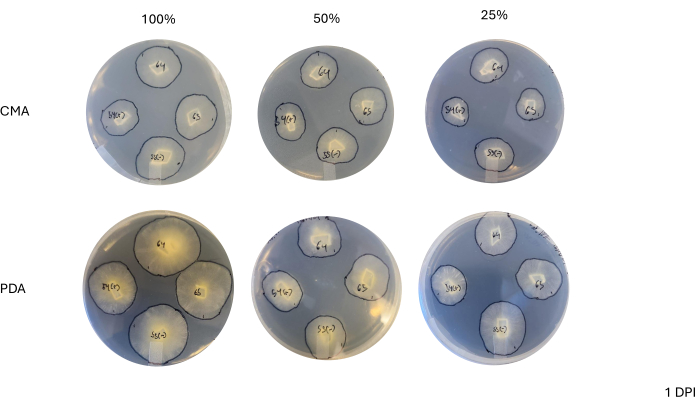
Рисунок 3: Репрезентативные изображения 4-полосных скрещиваний через 1 день после прививки. Сравнение колоний показывает различия в зависимости от типа среды и состава, подчеркивая, что колонии на 100% ОАП выглядят более желтыми, чем ХМА, и что рост происходит быстрее на 100% ОАП. Изображения были сделаны со дна чашки Петри. Маркером были нарисованы черные линии, чтобы очертить мицелий. Сокращения: CMA = агар из кукурузной муки; PDA = агар картофельная декстроза; DPI = дни после прививки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Репрезентативные изображения 4-полосных скрещиваний через 2 дня после прививки. Сравнение колоний подчеркивает кажущуюся плотность роста мицелия, при которой колонии на ОАП, по-видимому, имеют более плотный мицелий, чем на КМА. Кроме того, колонии на ОАП выглядят более желтыми, и большинство из них либо вступили в контакт, либо приближаются к точке контакта. Красными стрелками выделены области, где началось брачное взаимодействие, о чем свидетельствует увеличение плотности тканей. Это контрастирует с колониями на КМА, где только те, которые на 100% ХМА, приближаются к контакту, и все составы ХМА имеют колонии, которые относительно менее желтые по сравнению с теми, которые принимают КПК, и ни одна из них не начала спариваться. Изображения были сделаны со дна чашки Петри. Маркером были нарисованы черные линии, чтобы очертить мицелий. Сокращения: CMA = агар из кукурузной муки; PDA = агар картофельная декстроза; DPI = дни после прививки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
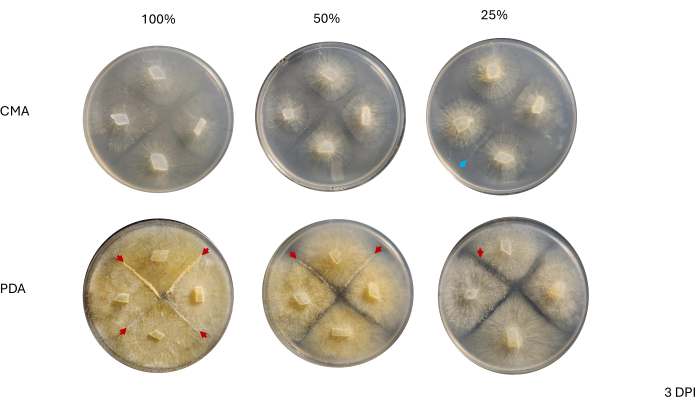
Рисунок 5: Репрезентативные изображения 4-полосных скрещиваний через 3 дня после прививки. Сравнение колоний между двумя типами сред показывает, что плотность мицелия выше при выращивании на ОАП по сравнению с КМА. Красные стрелки указывают на то, что все пластины PDA содержат по крайней мере один сайт брачных взаимодействий. Колонии на 100% CMA и 50% CMA не вступали в контакт, но две колонии на 25% CMA (синяя стрелка) вступили в контакт. Снимки были сделаны с высоты чашки Петри. Сокращения: CMA = агар из кукурузной муки; PDA = агар картофельная декстроза; DPI = дни после прививки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
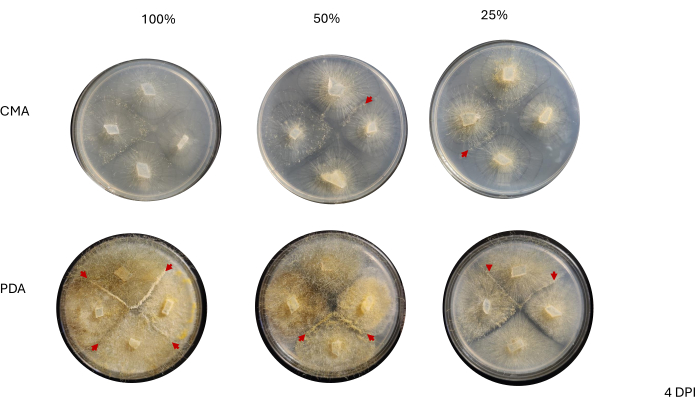
Рисунок 6: Репрезентативные изображения 4-полосных скрещиваний через 4 дня после прививки. Все колонии на PDA имеют по крайней мере одно брачное взаимодействие (красные стрелки) и демонстрируют желтый мицелий. Кроме того, в колониях на ОАП наблюдается значительный рост воздушных гиф (т.е. бесполых спорангий), которые могут препятствовать наблюдению за брачными взаимодействиями. Колонии на 50% и 25% CMA также демонстрируют признаки брачных взаимодействий (красные стрелки) и имеют меньший рост гиф в воздухе по сравнению с колониями на ОАП. Снимки были сделаны с высоты чашки Петри. Сокращения: CMA = агар из кукурузной муки; PDA = агар картофельная декстроза; DPI = дни после прививки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Изображения крестов на ОАП. (А) 100% КПК, (Б) 50% ОАП и (В) 25% КПК. Области интереса были увеличены (красные прямоугольники). Все снимки были получены с разрешением 4 DPI. Дополнительный вид (D) 50% PDA подчеркивает наличие клеток, размножающихся половым путем, на разных стадиях: молодые воздушные зигофоры: звездочки; Старые воздушные зигофоры: Красные стрелки. (E) 25% ОАП проявляют клетки, размножающиеся половым путем, на разных стадиях, хотя этот репрезентативный вид показывает меньшую скученность этих структур по сравнению с 50% ОАП. Масштабные линейки = 1 мм (A-C), 0,5 мм (D,E). Сокращения: PDA = агар картофельной декстрозы; DPI = дни после прививки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
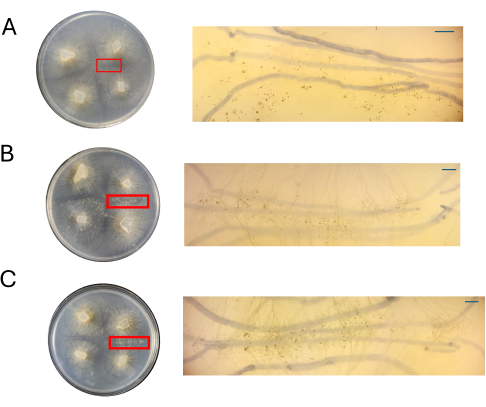
Рисунок 8: Изображения крестов на CMA. (A) 100% CMA, (B) 50% CMA и (C) 25% CMA с увеличением областей интереса. Отчетливые половые структуры легко наблюдаются при 50% (В) и 25% (С) КМА, а скученность минимальна. На данный момент при 100% CMA не видно никаких половых структур. Все снимки были получены с разрешением 4 DPI. Изображения чашки Петри и изображения препарирующего телескопа были получены с высоты над чашкой Петри. Темные линии на заднем плане изображений препарирующего прицела нарисованы черным маркером, который использовался для отслеживания расширения мицелия. Масштабные линейки = 1 мм. Сокращения: CMA = агар из кукурузной муки; DPI = дни после прививки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Площадь мицелия для каждого штамма за 4 дня. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Попарная оценка контакта и спаривания для каждого штамма на различных средах. 0 = Нет, 1 = Да. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Здесь представлен простой протокол индуцирования полового размножения у P. blakesleeanus в лабораторных условиях. Одним из наиболее важных соображений для этого протокола является ограничение питательных веществ. Предполагается, что грибы кооптировали половое размножение в ответ на суровые условия окружающей среды, такие как ограничение питательных веществ 6,28,29,30,31,32. Изменение уровня питательных веществ может помочь в разработке плана эксперимента. Например, если исследователь заинтересован в сравнении генов, экспрессируемых в воздушных зигофорах, с гаметангией, то будет рекомендовано более экстремальное ограничение питательных веществ (например, 25% ХМА), поскольку плотность половых структур будет меньше по сравнению с более высокими составами ХМА или КПК. Более низкая плотность половых структур, подобная той, которая наблюдалась при 50% или 25% CMA, означает, что выделение конкретного типа дифференцированных клеток не только будет проще (поскольку клетки будут легко идентифицировать и удалены), но также обеспечит выборку только интересующего типа клеток.
Стажеры или студенты также получат пользу от этого протокола, поскольку он позволяет этой группе отслеживать дифференцировку клеток и надежно различать различные типы клеток, которые развиваются во время полового цикла P. blakesleeanus. Использование АБК и ОАП отражает предыдущую работу по индукции спаривания мукоровицетов 18,22,23, и порошкообразные формы доступны для покупки, что делает их одним из более доступных вариантов сред в учебных или образовательных условиях по сравнению с другими синтетическими средами.
Поскольку целью данного протокола в конечном итоге является демонстрация развития и дифференцировки, а также было указано, что концентрация питательных веществ влияет на то, можно ли легко наблюдать различные типы клеток, важнейшим шагом в этом протоколе является обеспечение соответствующего состава среды (раздел 1 протокола). Если к разбавленному PDA или CMA не добавить дополнительный порошок агара, среда может не затвердеть должным образом, и последующие сопрягаемые взаимодействия могут быть затруднены. Кроме того, пристальное внимание следует уделять размещению комплементарных и сходных типов спаривания (раздел 2 протокола). Поскольку P. blakesleeanus является гетероталлическим, ему требуется комплементарный партнер для спаривания, и если этот партнер недоступен или вместо него используется аналогичный тип спаривания, то спаривание не произойдет 10,33,34.
Ограничением этого протокола является асинхронное развитие сексуальных структур. P. blakesleeanus, как и другие грибы, выращенные на твердой среде, разрастается радиально во всех направлениях. Это означает, что части мицелия будут находиться на более поздних стадиях полового цикла, чем другие. Существуют протоколы синхронизации полового развития у Ascomycetes35, но они не были успешно адаптированы к Mucoromycetes. Это означает, что работа по исследованию экспрессии генов во время полового цикла будет подвергаться воздействию шума, если слишком много клеток находятся на разных стадиях развития. Учитывая наблюдения в этом исследовании, можно предположить, что, хотя ограничение доступности питательных веществ приводит к уменьшению общего количества клеток, размножающихся половым путем, наблюдаемые клетки, по-видимому, находятся на аналогичных стадиях развития. Таким образом, ограничение питательных веществ может помочь ограничить плотность дифференцированных половых структур, предоставляя исследователю доступ к преимущественно синхронным тканям за счет более низких выходов.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Мы хотели бы поблагодарить Исполнительный комитет по естественным наукам Колорадского колледжа, факультет биологии и экологии организмов и Фонд студенческих исследований семьи Хеви за финансирование этой работы. Мы также выражаем благодарность Элис Келлер и Тиа Хатченс за их техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
Ссылки
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены