Method Article
Cruzamentos sexuais com o mucoromiceto Phycomyces blakesleeanus
Neste Artigo
Resumo
Aqui apresentamos um protocolo básico para a indução do acasalamento de P. blakesleeanus .
Resumo
Phycomyces blakesleeanus, um fungo filamentoso dentro do filo Mucoromycota, distingue-se por sua notável capacidade de percepção ambiental e respostas adaptativas. Embora trabalhos anteriores tenham mostrado que os estímulos ambientais, incluindo gravidade, luz, umidade e disponibilidade de nutrientes, influenciam sua dinâmica de crescimento e estratégias reprodutivas, os mecanismos subjacentes continuam sendo uma área focal de pesquisa. Sinais ambientais desencadeiam a reprodução sexuada ou assexuada. A reprodução sexuada começa com a sinalização de feromônios, que desencadeia a quimioatração das hifas, levando a transições morfológicas seriais que culminam na formação de um zigosporo.
Em um ambiente de laboratório, cruzamentos de P. blakesleeanus resultam em micélios complementares submetidos ao ciclo sexual em diferentes estágios. Nosso trabalho visa testar se pistas ambientais podem desencadear o acasalamento através dos micélios de P. blakesleeanus. Cruzamentos de P. blakesleeanus cultivados em meios com limitação de nutrientes serão submetidos a ágar com limitação de nutrientes para desencadear uma resposta sexual de acordo com a privação de nutrientes. O desencadeamento bem-sucedido do acasalamento em P. blakesleeanus facilitará estudos futuros que requerem uma grande quantidade de micélios de reprodução sexual em estágios específicos. O resultado desta pesquisa aumentará ainda mais nossa compreensão de como os mecanismos reprodutivos de P. blakesleeanus são influenciados por fatores ambientais, contribuindo para a base de conhecimento mais ampla sobre a reprodução sexuada de fungos filamentosos.
Introdução
A indução do acasalamento em sistemas fúngicos em condições de laboratório avançou na compreensão da genética eucariótica, biologia celular, biologia evolutiva e biotecnologia. Os fungos dikaryan, em particular o Ascomycota, apresentam o conhecimento mais extenso sobre a indução do acasalamento em um ambiente de laboratório1. Curiosamente, o primeiro fungo em que a reprodução sexuada foi proposta, Syzygites megalocarpus, não é membro de Ascomycota, mas sim membro do filo Mucoromycota2. O filo Mucoromycota é um grupo divergente inicial anteriormente classificado como "Zygomycota", mas agora considerado irmão das linhagens Dikaryan 3,4. O Mucoromycota, juntamente com o Zoopagomycota, são evolutivamente significativos, pois esses filos representam a transição de fungos para ecossistemas terrestres 4,5. Como outros fungos, os mucoromicetes usam estratégias assexuadas e reprodutivas sexuais em resposta ao seu ambiente 3,6. Em condições de limitação de nutrientes, os mucoromicetes iniciam o ciclo sexual6. Os mucoromicetes exibem mecanismos de acasalamento homotálicos e heterotálicos, onde a compatibilidade é determinada pelos genes do tipo de acasalamento sexM e sexP, designados como (-) e (+) respectivamente 7,8,9.
Blakeslee10 enfatizou a sensibilidade do ciclo sexual do mucoromiceto às condições externas, observando que a umidade é crítica para sua formação e que a disponibilidade de nutrientes no substrato desempenha um papel significativo. Os tipos complementares de acasalamento iniciam o ciclo sexual por meio da síntese cooperativa de ácidos trispóricos (AT) usando beta-caroteno como precursor 11,12,13. Após a detecção de TA, as hifas vegetativas respondentes engrossam e se tornam zigóforos altamente ramificados 14,15,16. Os zigóforos continuam a produção de TA e se atraem mutuamente. Em P. blakesleeanus, os zigóforos se diferenciam dentro do substrato e não são facilmente visíveis em meio de ágar sólido17. Ao fazer contato, os zigóforos se entrelaçam e se tornam zigóforos aéreos.
À medida que o ciclo sexual continua, as pontas dos zigóforos se ligam e o meio das células se empurra para fora para formar uma estrutura semelhante a um anel com inchaço coralóide na base, completando a transição para o progametângio. As pontas das células que formam o progametângio começam a se fundir e se desenvolver no gametângio. No estágio de gametângio, os zigóforos exibem ornamentação semelhante a espinhos. A parede celular nas pontas se dissolve e surgem septos adventícios, delimitando a área onde o zigósporo se formará, e os zigóforos atuam como suspensórios em forma de pinça18. O zigosporo ficará pigmentado à medida que sua parede celular engrossa e adquire ornamentação adicional semelhante a espinhos17,18. Uma vez formado, o zigosporo entrará em um período de dormência antes de reiniciar o ciclo de crescimento.
Phycomyces blakesleeanus é um mucoromiceto heterotálico notável por suas células grandes e esporangióforos ambientalmente responsivos 6,8,18. Este organismo é facilmente cultivado em laboratório e as porções do ciclo sexual que levam à formação de zigosporos podem ser observadas no período de 8 a 10 dias. Como modelo, P. blakesleeanus foi examinado por sua capacidade de sentir a luz em seu ambiente17,19. A facilidade de cultivo e a capacidade de induzir o acasalamento também o tornaram um modelo ideal para estudar o mecanismo por trás de sua capacidade de perceber a luz20; Essas descobertas também destacaram a conservação evolutiva dos mecanismos de detecção de luz em fungos. Em P. blakesleeanus, a luz demonstrou inibir a reprodução sexuada por meio dessas proteínas sensíveis à luz conservadas21. Estudos evolutivos recentes de desenvolvimento têm procurado entender quais genes estão contribuindo para a diferenciação celular durante o ciclo sexual de P. blakesleeanus 6. Correlacionar a morfogênese a genes específicos exigiria que tecido suficiente dos mesmos tipos de células fosse isolado para realizar estudos de expressão gênica.
Embora os protocolos para induzir o acasalamento de P. blakesleeanus em um ambiente de laboratório tenham sido descritos anteriormente, alguns mencionam apenas o tipo de meio a ser usado e as cepas relevantes18. Algumas descrições de protocolo não incluem formulação de mídia específica, mas descrevem onde posicionar tipos de acoplamento complementares presuntivos em uma placa10. Protocolos mais recentes permitem o aumento da produção de zigosporos misturando esporos de cada tipo de acasalamento e inoculando com a suspensão mista de esporos21 ou colocando os tipos de acasalamento a alguma distância e deixando a cultura incubar por 20 dias22. Essas abordagens são úteis para gerar amplas células diferenciadas, especificamente zigosporos, mas podem não ser adequadas para observar um curso de tempo de desenvolvimento ou selecionar estruturas sexuais que se formam antes dos zigosporos para transcriptômica de célula única. Outro trabalho abordou isso colocando tipos de acasalamento complementares distantes em meios sólidos para permitir a observação de transições morfológicas seriais à medida que o ciclo sexual começa 6,22,23. Como é o caso de outros fungos, o micélio de P. blakesleeanus se expande radialmente24,25. Portanto, quando os tipos de acasalamento complementares são cultivados na mesma placa, diferentes porções de seus micélios entrarão em contato em momentos diferentes. Como o contato entre micélios está entre uma das primeiras etapas do ciclo sexual de P. blakesleeanus, isso significa que diferentes porções dos micélios em interação estarão em diferentes estágios do ciclo sexual. Essa assincronia pode afetar o resultado de um estudo de expressão gênica, de modo que, se tipos de células diferenciados forem misturados e se tiverem programas de expressão gênica distintos, será difícil atribuir o papel de um gene a uma estrutura específica.
Além do valor de P. blakesleeanus como modelo para examinar genes envolvidos na morfogênese durante o ciclo sexual, seu crescimento vigoroso e capacidade de se diferenciar no espaço de alguns dias o tornam um fungo ideal para treinar alunos interessados em fungos filamentosos divergentes precoces e para uso em uma sala de aula de graduação para aprender sobre a diversidade de fungos e seus processos de desenvolvimento. O protocolo aqui apresentado faz uso de três concentrações de dois tipos diferentes de meios para demonstrar o efeito da disponibilidade de nutrientes na aparência do micélio, na indução do acasalamento e no enriquecimento de estruturas sexuais específicas, seja para quantificação, observação ou potencial transcriptômica de célula única.
Protocolo
1. Preparação de mídia
- Suspenda o ágar fubá em pó (CMA) ou o ágar batata dextrose (PDA) em água deionizada. Para 100% CMA ou PDA, siga as instruções do fabricante e suspenda 17 g de CMA em 1 L de água deionizada ou 39 g de PDA em 1 L de água deionizada. Para N% CMA ou PDA, suspenda 1/N da quantidade recomendada pelo fabricante e suplemente com ágar adicional para atingir uma concentração de ágar de 7,5% (p/v).
NOTA: Etapa opcional: Antes da autoclavagem, adicione 25 μg/mL de cloranfenicol se a contaminação bacteriana for uma preocupação. - Esterilize o meio em autoclave, a 121 °C por 15 min.
- Resfrie o meio a ~60 °C, colocando-o por 30 min em banho-maria ajustado para 60 °C.
NOTA: Se a garrafa quente de mídia puder ser mantida por 6 s com pouco ou nenhum desconforto, ela estará pronta para ser derramada. - Despeje as placas em condições assépticas em uma capela de fluxo laminar ou cabine de segurança biológica. Incline o frasco de mídia sobre uma placa de Petri aberta e vazia e despeje apenas o suficiente para cobrir completamente o fundo.
- Em alternativa, utilize uma pipeta serológica de vidro e pipete 20 ml de meio em cada placa.
NOTA: Essa abordagem aumenta o tempo que a garrafa de mídia fica em uma temperatura mais baixa e aumenta o risco de solidificar prematuramente o ágar.
- Em alternativa, utilize uma pipeta serológica de vidro e pipete 20 ml de meio em cada placa.
- Permita que a mídia se solidifique novamente. Armazene as placas a 4 °C se não forem usadas imediatamente.
2. Preparação de esporos ou tecidos de fungos
- Obtenha culturas de cada tipo de acasalamento de P. blakesleeanus (por exemplo, NRRL 1555 (-), NRRL 1554 (+), NRRL 1464 (-) e NRRL 1465 (+)). Para inocular cruzamentos com esporos, primeiro cultive cada tipo de acasalamento em cultura pura em 100% CMA ou PDA
- Corte uma porção de micélios de ponta de culturas existentes e coloque o micélio excisado em uma placa 100% CMA / PDA. Incubar culturas puras durante 1 semana a 27 °C num ciclo de luz de 12 horas.
- Uma vez que os esporangióforos estejam presentes, inunde uma cultura pura esporulante com 0,01% de Tween 20 em água esterilizada e deionizada usando técnica asséptica. Com uma micropipeta P1000, retire 1,0 mL da mistura de esporos Tween 20 da placa e coloque-a em um tubo de microcentrífuga.
- Centrifugue em uma mini centrífuga por 30 s e, em seguida, decantar o sobrenadante.
- Se forem necessários mais esporos, continue a adicionar 1,0 mL da mistura de esporos Tween 20 no mesmo tubo de microcentrífuga e repita a etapa 2.4. Depois de obter uma quantidade adequada de esporos, decantar o sobrenadante e substituí-lo por 500 μL de água deionizada estéril.
- Opcional: Use um hemacitômetro para estimar a concentração de esporos, o que informará se mais água precisa ser adicionada ou se os esporos precisam ser centrifugados novamente.
- Alternativamente, inocule os cruzamentos com micélios de ponta das culturas puras.
- Use uma lâmina de barbear esterilizada ou broca de cortiça para extirpar o tecido e colocar o inóculo imediatamente.
- Configure as cruzes como cruzes de 2 vias, cruzes de 4 vias ou cruzes de 8 vias (Figura 1).
NOTA: Se as cruzes estiverem sendo configuradas para trabalho transcriptômico, é recomendável configurar 1-2 placas adicionais por condição/mídia para servir como placas indicadoras. As placas indicadoras permitem que os investigadores limitem a exposição à luz às placas experimentais, pois a luz inibe a reprodução sexuada em P. blakesleeanus.- Para uma cruz de 2 vias, coloque os tipos de acoplamento complementares opostos um ao outro (Figura 1A).
- Coloque os micélios do tipo de acasalamento (-), NRRL 1555 ou NRRL 1464, a pelo menos 1 cm de distância da borda de uma placa de Petri em PDA ou CMA.
- Na mesma placa, oposta de onde o tipo de acoplamento (-) foi colocado e a 1 cm de distância da borda da placa de Petri, coloque o tipo de acoplamento (+), NRRL 1554 ou NRRL1465 (Figura 1A).
NOTA: A distância entre os tipos de acasalamento complementares influenciará o tamanho do tecido que participa do ciclo sexual. Os tipos de acasalamento mais distantes permitem que os micélios se expandam mais, o que aumentará o número de interações sexuais entre os dois parceiros.
- Para uma cruz de 4 vias, coloque tipos de acoplamento opostos um ao outro, mas vizinhos de um tipo de acoplamento complementar (Figura 1B).
- Coloque os esporos ou micélios dos tipos de acasalamento (-), NRRL 1555 e NRRL 1464, opostos um ao outro a pelo menos 1 cm de distância da borda de uma placa de Petri em PDA ou CMA.
- Na mesma placa, escolha um local entre os dois tipos de acasalamento (-) e pelo menos 1 cm de distância da borda da placa e inocule o local com esporos ou micélios do tipo de acasalamento (+), NRRL 1554 ou 1465.
- Na mesma placa, oposta ao local onde o primeiro (+) tipo de acasalamento foi inoculado e a pelo menos 1 cm de distância da placa, coloque o outro (+) tipo de acasalamento.
- Para uma cruz de 8 vias, alterne os tipos de acoplamento ao longo da periferia da placa de Petri, apresentando quatro de cada tipo de acoplamento (Figura 1C).
- Para uma cruz de 2 vias, coloque os tipos de acoplamento complementares opostos um ao outro (Figura 1A).
- Após a inoculação, feche as placas com parafilme ou (deixe-as sem lacre) e coloque-as em um recipiente secundário antes de incubar a 22 ° C no escuro. Observe as placas diariamente em busca de evidências de acasalamento, durante o qual tire fotos de baixo da placa e rastreie os micélios à medida que as culturas crescem.
NOTA: Após 24 h após a inoculação, espere ver micélios se expandindo em todos os tipos de meios, mas os indivíduos provavelmente não estarão em contato neste estágio. - Dependendo do tipo de meio (PDA ou CMA) e da formulação (25%, 50%, 100%), se os micélios começarem a fazer contato, inspecione os micélios dos tipos de acasalamento complementares que estão em contato sob um escopo de dissecação para evidências de acasalamento. Tire fotos de micélios interagindo com uma câmera ou um smartphone montado no escopo de dissecação.
- Adquira imagens de micélios e junte-as (por exemplo, usando o aplicativo Panorama Stitcher). Use o ImageJ para estimar a área do micélio (veja os tutoriais online).
Resultados
Após um cruzamento de 4 vias, cada cepa variou ligeiramente em sua taxa de crescimento, conforme determinado pela mudança na área do micélio (Figura 2). Embora não seja estatisticamente significativo, o NRRL 1555 teve uma mudança mais rápida na área quando plaqueado em 25% CMA, 25% PDA ou 100% PDA. Da mesma forma, NRRL 1465 teve uma mudança maior na área quando cultivado em 50% de PDA ou CMA. NRRL 1464 teve o aumento mais rápido na área quando cultivado em 100% CMA. Após 24 h (1 DPI), as cepas que crescem em PDA pareciam mais amarelas em relação às cepas cultivadas em CMA (Figura 3) - PDA demonstrou anteriormente aumentar a produção de pigmento26. As cepas em 100% de PCA apresentaram, em média, maior medida de área após 24 h (Tabela 1). Isso contrasta com o CMA de 25%, que teve a menor área média em 1 DPI (Tabela 1).
O contato entre linhagens vizinhas não foi observado até 2 DPI e apenas entre as cepas cultivadas em PDA, especialmente 100% PDA (Figura 4). O acasalamento foi observado em 100% de PCA a 2 DPI. As cepas cultivadas em CMA não fizeram contato a 2 DPI, embora 100% CMA apresentasse cepas que cresceram muito próximas umas das outras (Figura 4). Após 3 dias de incubação (3 DPI), as cepas cultivadas em todas as formulações de BDA exibiram acasalamento, embora a densidade de tipos celulares diferenciados tenha diferido (Tabela 2 e Figura 5). Uma repetição de 25% de CMA e uma repetição de 50% de CMA também exibiram acasalamento (Tabela 2); as demais placas de CMA não apresentaram nenhum acasalamento (Tabela 2). Curiosamente, as cepas cultivadas no PDA pareciam ter micélios amarelos mais densos e hifas aéreas, que poderiam estar se desenvolvendo em esporangióforos (Figura 5). Aos 4 DPI, as placas de PCA exibiam reações de acasalamento ao lado de esporangióforos assexuados (Figura 6). As placas CMA apresentaram cepas com micélios mais difusos e menos esporangióforos (Figura 6). O acasalamento não foi observado em 100% de AVC (Tabela 2).
Placas representativas foram observadas sob um escopo de dissecação a 4 DPI para avaliar se os tipos celulares associados ao início do ciclo sexual poderiam ser facilmente observados. Em geral, uma concentração decrescente de nutrientes foi correlacionada com micélios sexuais qualitativamente menos densos e diferenciados (Figura 7 e Figura 8). Quando cultivados em 100% de PDA, zigóforos aéreos individuais ou progametângios não puderam ser visualizados e apareceram como uma massa de células (Figura 7A). Enquanto 50% e 25% de PDA pareciam ter menor densidade celular no local do acasalamento, as placas de 25% de PDA apresentavam células que podiam ser facilmente distinguidas ( Figura 7B , C ). Ao comparar os tipos de células observadas em 50% de PCA a 25%, aquelas na concentração mais baixa pareciam ser predominantemente do mesmo tipo, enquanto na concentração mais alta, havia uma mistura de células em diferentes estágios (Figura 7D, E). Notavelmente, com 50% de PDA, as células observadas a 4 DPI incluíam zigóforos aéreos que haviam acabado de emergir (Figura 7D, asterisco) e alguns que estavam em transição para progametângio (Figura 7D, seta). Com 25% de PDA, a maioria das células parecia estar em estágios de desenvolvimento muito semelhantes (Figura 7E).
As placas das várias concentrações de CMA foram avaliadas juntamente com as placas de PDA a 4 DPI (Figura 8). Como mencionado anteriormente, o acasalamento não foi observado quando 100% de CMA foi usado (Figura 8A). Em 50% CMA ou 25% CMA, o acasalamento foi observado e o número total de tipos de células associadas à reprodução sexuada foi menor (Figura 8B, C). Os zigóforos aéreos observados a 4 DPI pareciam ter o mesmo tamanho e altura em toda a zona de interação (Figura 8B, C). Dado o menor número total de células que participam do ciclo sexual, elas poderiam hipoteticamente ser excisadas com lâminas de barbear esterilizadas ou agulhas de dissecação e imediatamente congeladas em nitrogênio líquido para isolamento de RNA a jusante. Ser capaz de selecionar estruturas específicas no mesmo momento de desenvolvimento pode aumentar a robustez dos estudos de expressão gênica que buscam conectar mudanças morfológicas aos genes.
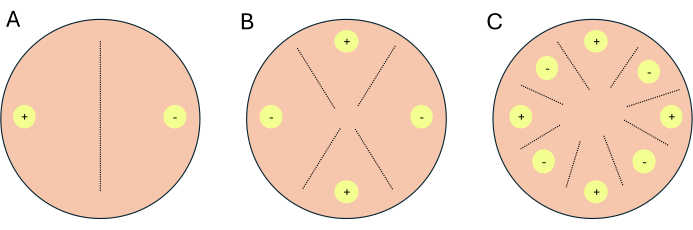
Figura 1: Esquema de três formatos de cruz. (A) Uma cruz de 2 vias com dois locais de inoculação (círculos amarelos) com tipos de acoplamento complementares (+) e (-). (B) uma cruz de 4 vias com dois locais de inoculação do tipo (+) de acasalamento (círculos amarelos com +) e dois locais de inoculação do tipo (-) de acasalamento (círculos amarelos com -). (C) Uma cruz de 8 vias com locais de inoculação alternados (círculos amarelos) de tipos de acasalamento complementares (+) e (-). As linhas tracejadas representam o local previsto das interações de acasalamento. Clique aqui para ver uma versão maior desta figura.
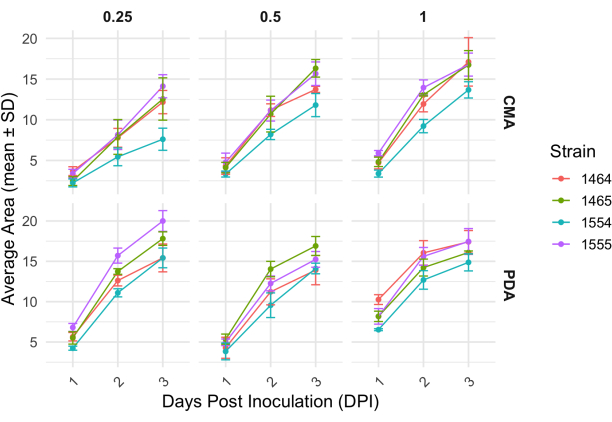
Figura 2: Mudança na área ao longo do tempo para cada cepa em CMA e PDA em diferentes concentrações. A área média das colônias de P. blakesleeanus foi plotada ao longo de 3 dias após a inoculação. As barras de erro representam o desvio padrão da área média. Veja também a Tabela 1. As parcelas foram geradas com ggplot227. Abreviatura: DPI = dias após a inoculação. Clique aqui para ver uma versão maior desta figura.
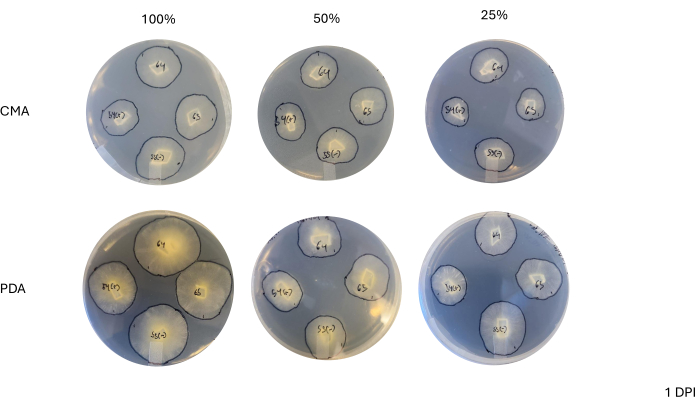
Figura 3: Imagens representativas de cruzamentos de 4 vias 1 dia após a inoculação. A comparação das colônias mostra diferenças entre o tipo de meio e a formulação, destacando que as colônias em 100% de PDA parecem mais amarelas do que CMA e que o crescimento parece mais rápido em 100% de PDA. As imagens foram tiradas do fundo da placa de Petri. Linhas pretas foram desenhadas com um marcador para delinear os micélios. Abreviaturas: CMA = ágar fubá; PDA = ágar batata dextrose; DPI = dias após a inoculação. Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagens representativas de cruzamentos de 4 vias 2 dias após a inoculação. A comparação das colônias destaca a densidade aparente do crescimento micelial, onde as colônias no PDA parecem ter um micélio mais denso do que as do CMA. Além disso, as colônias no PDA parecem mais amarelas e a maioria fez contato ou está se aproximando do ponto de contato. As pontas das setas vermelhas destacam as áreas onde as interações de acasalamento começaram, conforme indicado por um aumento na densidade do tecido. Isso contrasta com as colônias em CMA, onde apenas aquelas em 100% de CMA estão se aproximando do contato, e todas as formulações de CMA apresentam colônias que são relativamente menos amarelas em comparação com aquelas em PDA e nenhuma começou a acasalar. As imagens foram tiradas do fundo da placa de Petri. Linhas pretas foram desenhadas com um marcador para delinear os micélios. Abreviaturas: CMA = ágar fubá; PDA = ágar batata dextrose; DPI = dias após a inoculação. Clique aqui para ver uma versão maior desta figura.
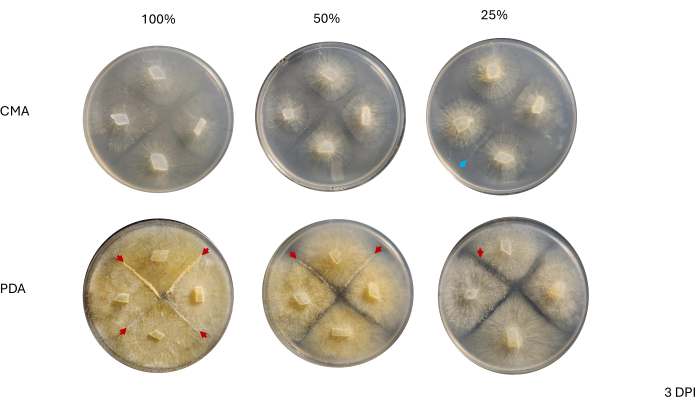
Figura 5: Imagens representativas de cruzamentos de 4 vias 3 dias após a inoculação. A comparação das colônias entre os dois tipos de meio destaca que a densidade micelial é maior quando cultivada em PDA em comparação com CMA. As pontas de seta vermelhas destacam que todas as placas de PDA hospedam pelo menos um local de interações de acasalamento. As colônias em 100% CMA e 50% CMA não fizeram contato, mas duas colônias em 25% CMA (seta azul) fizeram contato. As imagens foram tiradas de cima da placa de Petri. Abreviaturas: CMA = ágar fubá; PDA = ágar batata dextrose; DPI = dias após a inoculação. Clique aqui para ver uma versão maior desta figura.
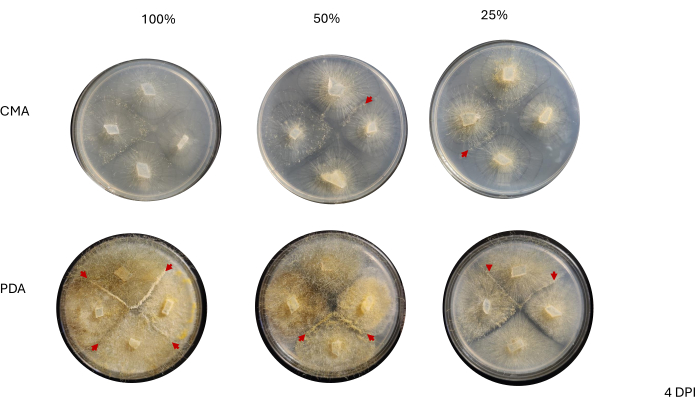
Figura 6: Imagens representativas de cruzamentos de 4 vias 4 dias após a inoculação. Todas as colônias no PDA hospedam pelo menos uma interação de acasalamento (setas vermelhas) e exibem um micélio amarelo. Além disso, as colônias no PDA mostram extenso crescimento de hifas aéreas (ou seja, esporângios assexuados) que podem impedir a observação das interações de acasalamento. As colônias em 50% e 25% de CMA também exibem evidências de interações de acasalamento (pontas de setas vermelhas) e têm menor crescimento de hifas aéreas em comparação com aquelas em PDA. As imagens foram tiradas de cima da placa de Petri. Abreviaturas: CMA = ágar fubá; PDA = ágar batata dextrose; DPI = dias após a inoculação. Clique aqui para ver uma versão maior desta figura.

Figura 7: Imagens de cruzamentos em PDA. (A) 100% PDA, (B) 50% PDA e (C) 25% PDA. As regiões de interesse foram ampliadas (retângulos vermelhos). Todas as imagens foram adquiridas a 4 DPI. Uma visão adicional de (D) 50% de PDA destaca a presença de células que se reproduzem sexualmente em diferentes estágios: zigóforos aéreos jovens: asteriscos; zigóforos aéreos mais antigos: setas vermelhas. (E) 25% de PDA exibe células sexualmente reprodutoras em diferentes estágios, embora essa visão representativa mostre uma menor aglomeração dessas estruturas em comparação com 50% de PDA. Barras de escala = 1 mm (A-C), 0,5 mm (D,E). Abreviaturas: PDA = ágar batata dextrose; DPI = dias após a inoculação. Clique aqui para ver uma versão maior desta figura.
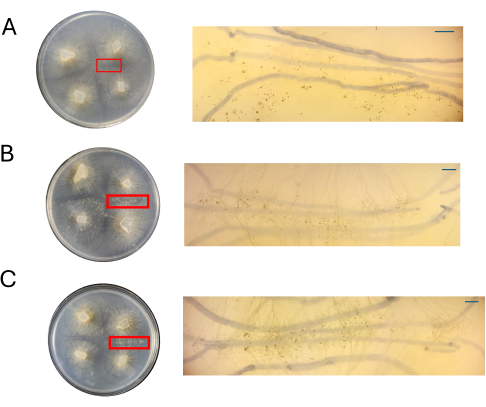
Figura 8: Imagens de cruzes no CMA. (A) 100% CMA, (B) 50% CMA e (C) 25% CMA com ampliação das regiões de interesse. Estruturas sexuais distintas são prontamente observadas para 50% (B) e 25% (C) de CMA, e o apinhamento é mínimo. Nenhuma estrutura sexual é vista em 100% CMA neste momento. Todas as imagens foram adquiridas a 4 DPI. Imagens de placas de Petri e imagens de escopo de dissecação foram obtidas acima da placa de Petri. As linhas escuras nos planos de fundo das imagens do escopo de dissecação são desenhadas com um marcador preto que foi usado para rastrear a expansão do micélio. Barras de escala = 1 mm. Abreviaturas: CMA = ágar fubá; DPI = dias após a inoculação. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Área de micélios para cada cepa ao longo de 4 dias. Clique aqui para baixar esta tabela.
Tabela 2: Avaliação em pares de contato e acasalamento para cada cepa em diferentes meios. 0 = Não, 1 = Sim. Clique aqui para baixar esta tabela.
Discussão
Um protocolo simples para induzir a reprodução sexuada em P. blakesleeanus em um ambiente de laboratório é apresentado aqui. Uma das considerações mais críticas para este protocolo é a limitação de nutrientes. Supõe-se que os fungos cooptaram a reprodução sexuada como resposta a condições ambientais adversas, como limitação de nutrientes 6,28,29,30,31,32. Variar o nível de nutrientes pode informar o projeto experimental. Por exemplo, se um pesquisador estiver interessado em comparar os genes expressos em zigóforos aéreos versus gametângios, uma limitação de nutrientes mais extrema (como 25% de CMA) seria recomendada, pois a densidade das estruturas sexuais será menor em comparação com formulações mais altas de CMA ou PDA. Uma densidade mais baixa de estruturas sexuais, como a observada com 50% ou 25% de CMA, significa que o isolamento de um tipo específico de célula diferenciada não só seria mais fácil (já que as células seriam facilmente identificadas e excisadas), mas também garantiria que apenas o tipo de célula de interesse fosse amostrado.
Estagiários ou estudantes também se beneficiariam deste protocolo, pois permite que este grupo rastreie a diferenciação celular e distinga de forma confiável entre os vários tipos de células que se desenvolvem durante o ciclo sexual de P. blakesleeanus. O uso de CMA e PDA reflete trabalhos anteriores sobre a indução do acasalamento de mucoromicetes 18,22,23, e formas em pó estão disponíveis para compra, tornando-as entre as opções de mídia mais acessíveis em um ambiente de treinamento ou educacional em comparação com outras mídias sintéticas.
Uma vez que o objetivo deste protocolo é, em última análise, demonstrar desenvolvimento e diferenciação, e foi apontado que a concentração de nutrientes afeta se tipos de células distintos podem ser facilmente observados, uma etapa crítica neste protocolo é garantir a composição apropriada do meio (seção 1 do protocolo). Se o pó de ágar adicional não for adicionado ao PDA ou CMA diluído, o meio pode não solidificar adequadamente e as interações de acasalamento subsequentes podem não ser facilmente observadas. Além disso, deve-se prestar muita atenção à colocação de tipos de acasalamento complementares e semelhantes (seção 2 do protocolo). Como P. blakesleeanus é heterotálico, requer um parceiro de acasalamento complementar e, se esse parceiro for inacessível ou um tipo de acasalamento semelhante for usado, o acasalamento não ocorrerá 10,33,34.
Uma limitação deste protocolo é o desenvolvimento assíncrono das estruturas sexuais. P. blakesleeanus, como outros fungos cultivados em meio sólido, expande-se radialmente em todas as direções. Isso significa que porções do micélio estarão em estágios mais avançados do ciclo sexual do que outras. Existem protocolos para sincronizar o desenvolvimento sexual em Ascomycetes35, mas estes não foram adaptados com sucesso para Mucoromycetes. Isso significa que o trabalho que investiga a expressão gênica durante o ciclo sexual estará sujeito a ruídos se muitas células estiverem em diferentes estágios de desenvolvimento. Dadas as observações neste estudo, parece que, embora a limitação da disponibilidade de nutrientes leve a menos células que se reproduzem sexualmente em geral, as células observadas parecem estar em estágios semelhantes de desenvolvimento. Portanto, a limitação de nutrientes pode ajudar a limitar a densidade de estruturas sexuais diferenciadas, concedendo ao pesquisador acesso a tecidos principalmente sincronizados às custas de rendimentos mais baixos.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Gostaríamos de agradecer ao Comitê Executivo de Ciências Naturais do Colorado College, ao Departamento de Biologia e Ecologia do Organismo e ao Hevey Family Fund for Student Research por financiar este trabalho. Também estendemos nossa gratidão a Alice Keller e Tia Hutchens por seu apoio técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
Referências
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados