Method Article
粘液菌類Phycomyces blakesleeanusとの性交配
要約
ここでは、 P. blakesleeanus の交配誘導のための基本的なプロトコルを紹介します。
要約
Phycomyces blakesleeanusは、Mucoromycota門内の糸状菌であり、環境認識と適応応答の顕著な能力によって区別されます。過去の研究では、重力、光、水分、栄養素の利用可能性などの環境刺激が成長ダイナミクスと生殖戦略に影響を与えることが示されていますが、その根底にあるメカニズムは依然として研究の焦点領域です。環境的な手がかりは、有性生殖または無性生殖を引き起こします。有性生殖は、フェロモンシグナル伝達から始まり、それが菌糸の化学引力を引き起こし、最終的には一連の形態学的遷移を引き起こし、接合胞子の形成に至ります。
実験室の設定では、 P. blakesleeanus の交配により、さまざまな段階で性周期を経る相補的な菌糸体が生じます。私たちの研究は、環境の手がかりが P.blakesleeanusの菌糸体全体で交配を引き起こすかどうかをテストすることを目的としています。栄養制限培地で栽培された P. blakesleeanuの交配は、栄養不足の寒天にさらされ、栄養不足に応じた性的反応を引き起こします。 P. blakesleeanus の交配が成功すれば、特定の段階で大量の有性生殖菌糸体を必要とする将来の研究が促進されます。この研究の結果は、 P. blakesleeanus の生殖メカニズムが環境要因によってどのように影響を受けるかについての理解を深め、糸状菌の有性生殖に関する幅広い知識ベースに貢献します。
概要
実験室条件での真菌系での交配の誘導は、真核生物の遺伝学、細胞生物学、進化生物学、およびバイオテクノロジーの理解を前進させました。ジカリアン菌類、特に子嚢菌は、実験室での交配誘導に関する最も広範な知識を特徴としています1。興味深いことに、有性生殖が提案された最初の真菌であるSyzygites megalocarpusは、子嚢菌のメンバーではなく、門Mucoromycota2のメンバーです。門Mucoromycotaは、以前は「Zygomycota」として分類されていたが、現在はDikarian系統の姉妹と見なされている初期の分岐グループです3,4。ムコロミコタは、ズーパゴマイコタとともに、これらの門が真菌の陸生生態系への移行を表しているため、進化的に重要です4,5。他の菌類と同様に、ムコロミセストは環境に応じて無性生殖および有性生殖戦略を使用します3,6。栄養が制限された条件下では、粘液菌類は性周期を開始します6。ムコロ菌は、ホモタル型とヘテロタリックの両方の交配メカニズムを示し、適合性は、それぞれ(-)と(+)として指定される交配型遺伝子sexMとsexPによって決定されます7,8,9。
Blakeslee10は、粘液菌の性周期の外部条件に対する感受性を強調し、水分がそれらの形成に重要であり、基質内の栄養素の利用可能性が重要な役割を果たすことを指摘しました。相補的な交配タイプは、β-カロテンを前駆体として用いたトリスポリン酸(TA)の協調合成を通じて性周期を開始する11,12,13。TAの検出に続いて、応答する栄養菌糸は肥厚し、高度に分岐した接合胞子となる14,15,16。接合子は、TAおよび相互にケモアトラクトの産生を続けます。P. blakesleeanusでは、接合胞は基質内で分化し、固体寒天培地では容易には見えない17。接触すると、接合胞は絡み合い、空中接合胞になります。
性周期が続くと、接合子の先端が付着し、細胞の中央が押し出されてリング状の構造を形成し、基部にコラロイドが膨らみ、プロガメタンギウムへの移行が完了します。プロガメタンギウムを形成する細胞の先端が融合し始め、ガメタンギウムに発達します。ガメタンギアの段階では、接合動物はとげのような装飾を示します。先端の細胞壁が溶解し、不定中隔が現れ、接合胞子が形成される領域を画定し、接合胞子はトング状の懸濁液として作用する18。接合子は、その細胞壁が厚くなるにつれて色素沈着し、追加のとげのような装飾を獲得する17,18。形成されると、接合子は成長サイクルを再開する前に休眠期間に入ります。
Phycomyces blakesleeanusは、その大きな細胞と環境応答性胞子嚢6,8,18で有名な異種粘液菌です。この生物は実験室で容易に培養でき、接合子の形成につながる性周期の部分は8〜10日で観察できます。モデルとして、P. blakesleeanusは、その環境中の光を感知する能力について調べられてきた17,19。栽培の容易さと交配を誘発する能力も、光を知覚する能力の背後にあるメカニズムを研究するための理想的なモデルになりました20。これらの知見は、菌類における光感知機構の進化的保存も浮き彫りにした。P. blakesleeanusでは、光はこれらの保存された光感知タンパク質を介して有性生殖を阻害することが示されています21。近年の進化的発生研究は、P. blakesleeanusの性サイクル6における細胞分化にどのような遺伝子が寄与しているかを理解しようとしてきた。形態形成を特定の遺伝子と相関させるには、遺伝子発現研究を行うために、同じ細胞型の十分な組織を単離する必要があります。
実験室環境でP. blakesleeanusの交配を誘導するためのプロトコルは以前に説明されているが、使用する培地の種類と関連する株についてのみ言及しているものもある18。いくつかのプロトコルの説明は、特定の培地の定式化を含んでいないが、プレート10上の推定相補的な嵌合タイプをどこに位置付けるかを記述している。より最近のプロトコルでは、各交配タイプの胞子を混合し、混合胞子懸濁液21を接種するか、または交配タイプをある程度離して配置し、培養物を20日間インキュベートさせることによって、接合子の産生を増加させることができる22。これらのアプローチは、十分な分化細胞、特に接合子を生成するのに役立ちますが、発生の時間経過を観察したり、シングルセルトランスクリプトミクスのために接合子の前に形成される性的構造を選択したりするのには適していない可能性があります。他の研究では、性周期が始まるときに連続的な形態学的遷移を観察できるように、固体媒体上に距離を置いて補完的な交配タイプを配置することにより、これに対処しています6,22,23。他の真菌の場合と同様に、P. blakesleeanus myceliaは放射状に拡大します24,25。したがって、相補的な交配タイプを同じプレート上で成長させると、それらの菌糸体の異なる部分が異なる時間に接触します。菌糸体間の接触は、P. blakesleeanusの性周期の最初のステップの1つであるため、これは、相互作用する菌糸体の異なる部分が性周期の異なる段階にあることを意味します。この非同期性は、遺伝子発現研究の結果に影響を与える可能性があり、分化した細胞タイプが混在し、それらが異なる遺伝子発現プログラムを持っている場合、遺伝子の役割を1つの特定の構造に帰することは困難になります。
P. blakesleeanusは、性周期における形態形成に関与する遺伝子を調べるためのモデルとしての価値に加えて、その活発な成長と数日間で分化する能力により、早期に分岐する糸状菌類に関心のある学生のトレーニングや、真菌の多様性とその発生過程について学ぶための学部教室での使用に理想的な菌類となっています。ここで提示するプロトコルは、菌糸体の外観、交配の誘導、および特定の性的構造の濃縮に対する栄養素の利用可能性の影響を実証するために、2つの異なるタイプの培地の3つの濃度を利用しています。
プロトコル
1. 培地の準備
- 粉末コーンミール寒天(CMA)またはジャガイモデキストロース寒天(PDA)を脱イオン水に懸濁します。100%CMAまたはPDAの場合は、製造元の指示に従って、17 gのCMAを1 Lの脱イオン水に、または39 gのPDAを1 Lの脱イオン水に懸濁します。.N%CMAまたはPDAの場合、メーカー推奨量の1/Nを懸濁し、追加の寒天を添加して7.5%(w / v)の寒天濃度を達成します。
注:オプションの手順:オートクレーブの前に、細菌汚染が懸念される場合は、25μg/mLのクロラムフェニコールを追加してください。 - オートクレーブ内で培地を121°Cで15分間滅菌します。
- 培地を 60 °C に設定したウォーターバスに 30 分間置き、~60 °C まで冷却します。
注:温かいメディアのボトルを6秒間保持でき、不快感がほとんどまたはまったくない場合は、注ぐ準備ができています。 - 無菌条件下でプレートを層流フードまたは生物学的安全キャビネットに注ぎます。メディアのボトルを開いた空のペトリ皿の上に傾け、底を完全に覆うのに十分な量だけを注ぎます。
- あるいは、ガラス血清学的ピペットを使用し、各プレートに20mLの培地をピペットで入れます。
注:このアプローチでは、メディアボトルが低温にある時間が長くなり、寒天が早期に固化するリスクが高まります。
- あるいは、ガラス血清学的ピペットを使用し、各プレートに20mLの培地をピペットで入れます。
- メディアが再固まるのを待ちます。プレートをすぐに使用しない場合は、4°Cで保管してください。
2.真菌胞子または組織の準備
- 各 P. blakesleeanus の交配タイプ(例:NRRL 1555 (-)、NRRL 1554 (+)、NRRL 1464 (-)、NRRL 1465(+))の培養物を入手します。交配に胞子を接種するには、まず、100%CMAまたはPDAで純粋培養で各交配タイプを成長させます
- 既存の培養物から最先端の菌糸体の一部を切り取り、切除した菌糸体を100%CMA/PDAプレート上に置きます。純粋培養物を27°Cで1週間、12時間の光サイクルでインキュベートします。
- 胞子嚢が存在したら、無菌技術を使用して、滅菌済みの脱イオン水に0.01%Tween 20を胞子形成の純粋な培養物に浸します。P1000マイクロピペットを使用して、プレートから1.0 mLのTween 20胞子混合物をマイクロ遠心チューブに吸引します。
- ミニ遠心分離機で30秒間遠心分離し、上清をデカントします。
- さらに胞子が必要な場合は、Tween 20胞子混合物を1.0 mL同じ微量遠心チューブに続けて加え、ステップ2.4を繰り返します。適切な量の胞子を得た後、上清をデカントし、500μLの滅菌脱イオン水と交換します。
- オプション:血球計算盤を使用して胞子の濃度を推定し、さらに水を追加する必要があるか、胞子を再遠心分離する必要があるかを通知します。
- あるいは、純粋な培養物からの最先端の菌糸体を交配種に接種します。
- 滅菌したかみそりの刃またはコルク穴あけ器を使用して組織を切除し、すぐに接種物をプレート化します。
- クロスを 2 方向クロス、4 方向クロス、または 8 方向クロスとして設定します (図 1)。
注:トランスクリプトーム研究のためにクロスを設定する場合は、インジケータープレートとして機能するように、条件/メディアごとに1〜2枚の追加のプレートを設定することをお勧めします。インジケータプレートは、光が P. blakesleeanusの有性生殖を阻害するため、研究者は実験プレートへの光曝露を制限することができます。- 2方向クロスの場合は、相補的な嵌合タイプを互いに向かい合わせに配置します(図1A)。
- (-)嵌合タイプのNRRL 1555またはNRRL 1464の菌糸体を、PDAまたはCMA上のペトリ皿の端から少なくとも1 cm離して置きます。
- 同じプレート上に、(-)嵌合タイプが置かれた場所とは反対側で、ペトリ皿の端から1 cm離して、(+)嵌合タイプ、NRRL 1554またはNRRL1465を置きます(図1A)。
注:相補的な交配タイプ間の距離は、性周期に関与する組織のサイズに影響を与えます。交配タイプがさらに離れていると、菌糸体がより拡大し、2人のパートナー間の性的相互作用の数が増加します。
- 4方向クロスの場合、互いに向かい合った嵌合タイプのように配置しますが、相補的な嵌合タイプに隣接します(図1B)。
- (-)嵌合タイプであるNRRL 1555およびNRRL 1464の胞子または菌糸体を、PDAまたはCMA上のペトリ皿の端から少なくとも1 cm離して互いに対向させます。
- 同じプレート上で、2つの(-)嵌合タイプ間の位置を選択し、プレートの端から少なくとも1 cm離して、(+)嵌合タイプ、NRRL 1554または1465の胞子または菌糸体をその場所に接種します。
- 同じプレート上に、最初の(+)嵌合タイプを接種した場所の反対側に、プレートから少なくとも1 cm離して、もう一方の(+)嵌合タイプを置きます。
- 8方向クロスの場合、ペトリ皿の周囲に沿って交互の嵌合タイプ、各嵌合タイプが4つ特徴です(図1C)。
- 2方向クロスの場合は、相補的な嵌合タイプを互いに向かい合わせに配置します(図1A)。
- 接種後、プレートをパラフィルムで密封するか(密封しないままにして)、二次容器に入れてから、暗所で22°Cでインキュベートします。交配の証拠がないかプレートを毎日観察し、その間にプレートの下から写真を撮り、培養物が成長するにつれて菌糸体を追跡します。
注:接種後24時間後、菌糸体がすべてのメディアタイプで拡大すると予想されますが、この段階では個人が接触する可能性は低いです。 - 培地の種類(PDAまたはCMA)と製剤(25%、50%、100%)にもよりますが、菌糸体が接触し始めた場合は、解剖範囲で接触している相補的な交配タイプの菌糸体を検査し、交配の証拠を探します。解剖スコープに取り付けられたカメラまたはスマートフォンで相互作用する菌糸体の写真を撮ります。
- 菌糸体の画像を取得し、それらをつなぎ合わせます(たとえば、Panorama Stitcherアプリケーションを使用します)。ImageJ を使用して、菌糸体の面積を推定します (オンライン チュートリアルを参照)。
結果
4方向交配後、各菌株は、菌糸体の面積の変化によって決定される成長率がわずかに変化しました(図2)。統計的に有意ではありませんが、NRRL 1555 は、25% CMA、25% PDA、または 100% PDA にめっきした場合、面積の変化が速くなりました。同様に、NRRL 1465は、50%PDAまたはCMAで成長した場合、面積の変化が大きかった。NRRL 1464は、100%CMAで成長した場合、面積が最も急速に増加しました。24時間後(1DPI)、PDA上で増殖した株は、CMA上で増殖した株に比べて黄色く見えた(図3)-PDAは、以前に顔料産生を増加させることが示されている26。100%PDAの株は、平均して、24時間後の面積の測定値が高かった(表1)。これは、1 DPIで平均面積が最も小さかったCMAが25%であったのとは対照的です(表1)。
隣接する菌株間の接触は2DPIまで観察されず、PDA、特に100%PDAで成長した菌株間でのみ観察されました(図4)。嵌合は、2DPIで100%PDAで観察されました。CMAで増殖した株は2DPIでは接触しませんでしたが、100%CMAは互いに非常に接近して増殖する株を特徴としていました(図4)。3日間のインキュベーション(3 DPI)後、PDAのすべての製剤で増殖した株は交配を示しましたが、分化した細胞タイプの密度は異なりました(表2 および 図5)。25% CMA の 1 回の複製と 50% CMA の 1 回の複製も交配を示しました(表 2)。残りのCMAプレートは嵌合を示さなかった(表2)。興味深いことに、PDAで増殖した株は、より密度の高い黄色の菌糸体と空中菌糸を持っているように見え、これが胞子嚢に発達していた可能性があります(図5)。4 DPIまでに、PDAプレートは無性性胞子嚢と並んで交配反応を示していました(図6)。CMAプレートは、よりびまん性菌糸体で、胞子嚢が少ない株を持っていました(図6)。100%CMAでは嵌合は観察されませんでした(表2)。
代表的なプレートを4DPIの解剖スコープで観察し、性周期の始まりに関連する細胞型が容易に観察できるかどうかを評価しました。一般に、栄養素の濃度の低下は、質的に密度が低く、分化した性菌糸体と相関していました(図7 および 図8)。100% PDA で増殖した場合、個々の空中接合胞体またはプロガメタンジアは可視化できず、細胞の塊として現れました(図 7A)。50%および25%PDAは交配部位の細胞密度が低いように見えましたが、25%PDAプレートは容易に識別できる細胞を特徴としていました(図7B、C)。50% PDA と 25% PDA で観察された細胞の種類を比較すると、低濃度の細胞は主に同じタイプであるように見えましたが、高濃度では、異なる段階の細胞が混在していました (図 7D、E)。注目すべきは、50%のPDAで、4 DPIで観察された細胞には、出現したばかりの空中接合胞(図7D、アスタリスク)とプロガメタンジアに移行している細胞(図7D、矢印)が含まれていました。PDAが25%の場合、ほとんどの細胞は非常に類似した発生段階にあるように見えました(図7E)。
さまざまな濃度のCMAのプレートを、PDAプレートと並べて4DPIで評価しました(図8)。前述のように、100%CMAを使用した場合、嵌合は観察されませんでした(図8A)。50%CMAまたは25%CMAのいずれかで、交配が観察され、有性生殖に関連する細胞型の総数は減少した(図8B、C)。4 DPIで観察された空中接合胞は、相互作用ゾーン全体で同じサイズと高さであるように見えました(図8B、C)。性周期に関与する細胞の総数が少ないことを考えると、これらは滅菌されたカミソリの刃または解剖針で仮想的に切除され、すぐに液体窒素で凍結されて下流のRNA単離のために可能になります。同じ発生時点で特定の構造を選択できることは、形態学的変化を遺伝子に結びつけようとする遺伝子発現研究の堅牢性を高める可能性があります。
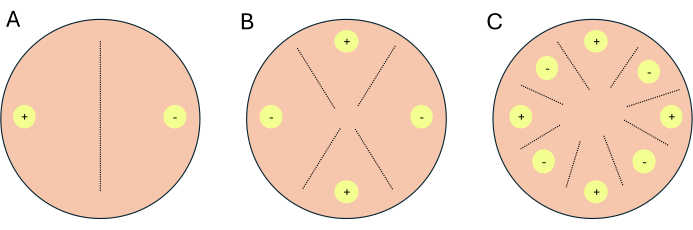
図1:3つのクロスフォーマットの概略図(A)2つの接種部位(黄色の円)と相補的な交配タイプ(+)と(-)を持つ2方向クロス。(B)(+)交配型(+の黄色の円)と(-)の交配タイプの2つの接種部位と(-の黄色の円)の2つの接種部位を持つ4方向十字架。(C)相補的な交配タイプ(+)と(-)の交互の接種部位(黄色の円)を持つ8方向十字架。破線は、交配相互作用の予測部位を表しています。この図の拡大版を表示するには、ここをクリックしてください。
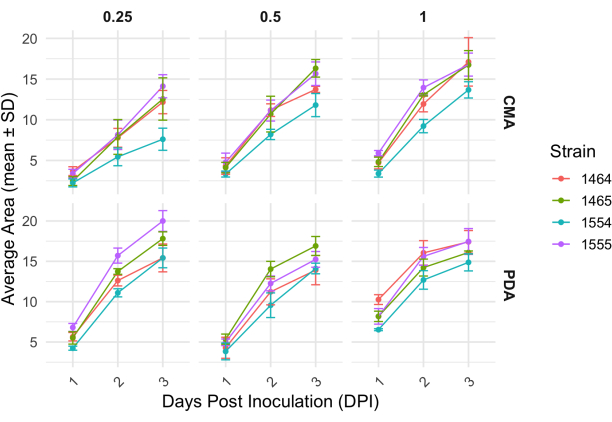
図2:CMAとPDAの異なる濃度における各株の経時的な面積の変化。P. blakesleeanusのコロニーの平均面積は、接種後3日間にわたってプロットされました。エラーバーは、平均面積の標準偏差を表します。表 1 も参照してください。プロットはggplot227で生成した。略語:DPI =接種後日数。この図の拡大版を表示するには、ここをクリックしてください。
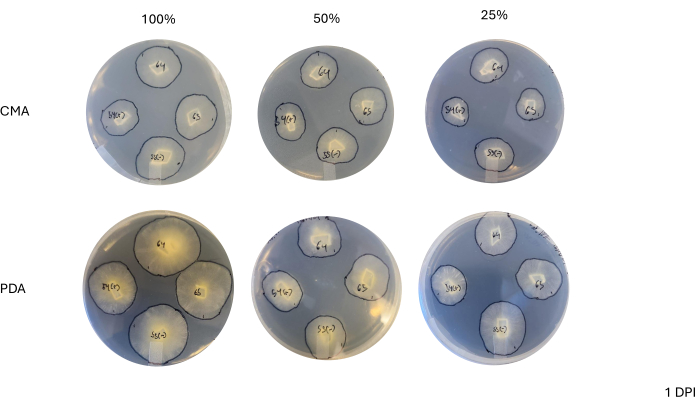
図3:接種後1日での4方向交差の代表的な画像。 コロニーの比較では、培地の種類や組成によって違いが見られ、100% PDA のコロニーは CMA よりも黄色が多く、100% PDA のコロニーは成長が速く見えることが強調されています。画像はシャーレの底から撮影したものです。黒い線は、菌糸体の輪郭を描くためのマーカーで描かれました。略語:CMA =コーンミール寒天;PDA = ジャガイモデキストロース寒天;DPI = 接種後日数。 この図の拡大版を表示するには、ここをクリックしてください。

図4:接種後2日目の4方向交差の代表画像。 コロニーの比較は、菌糸体の成長の見かけの密度を強調しており、PDA上のコロニーはCMA上のコロニーよりも密な菌糸体を持っているように見えます。さらに、PDA上のコロニーはより黄色く見え、ほとんどのコロニーが接触したか、接触点に近づいています。赤い矢印は、組織密度の増加によって示されるように、交配相互作用が始まった領域を強調しています。これは、100% CMAのコロニーのみが接触に近づいており、すべてのCMA製剤はPDAのコロニーに比べて黄色が比較的少なく、交配を開始したコロニーがないのとは対照的です。画像はシャーレの底から撮影したものです。黒い線は、菌糸体の輪郭を描くためのマーカーで描かれました。略語:CMA =コーンミール寒天;PDA = ジャガイモデキストロース寒天;DPI = 接種後日数。 この図の拡大版を表示するには、ここをクリックしてください。
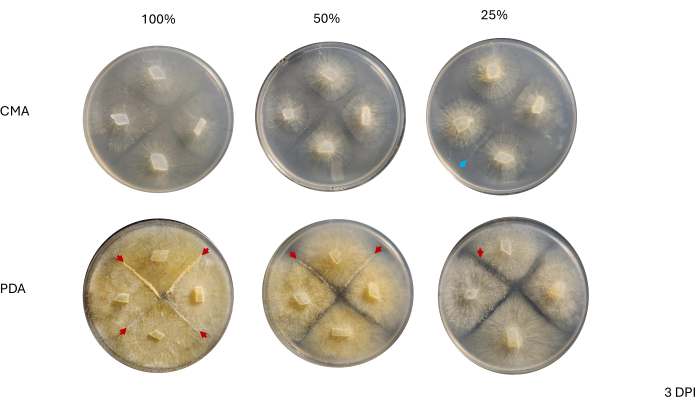
図5:接種後3日目の4方向交差の代表的な画像。 2つの培地タイプ間のコロニーを比較すると、PDAで成長した場合、CMAと比較して菌糸体密度が高くなることが強調されています。赤い矢印は、すべてのPDAプレートが少なくとも1つの嵌合相互作用部位をホストしていることを強調しています。100% CMA と 50% CMA のコロニーは接触していませんが、25% CMA の 2 つのコロニー (青矢印) は接触しています。画像はペトリ皿の上から撮影しました。略語:CMA =コーンミール寒天;PDA = ジャガイモデキストロース寒天;DPI = 接種後日数。 この図の拡大版を表示するには、ここをクリックしてください。
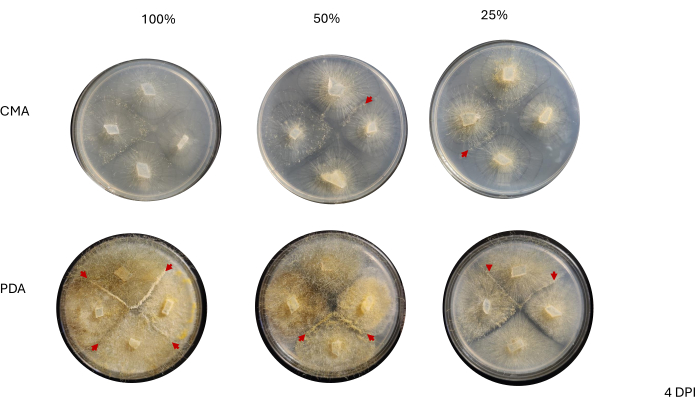
図6:接種後4日目の4方向交差の代表的な画像。 PDA上のすべてのコロニーは、少なくとも1つの交配相互作用(赤い矢印)を宿主とし、黄色の菌糸体を示します。さらに、PDA上のコロニーは、空中菌糸(すなわち、無性胞子嚢)の広範な成長を示し、交配相互作用の観察を妨げる可能性があります。50%および25%CMAのコロニーも交配相互作用の証拠(赤い矢印)を示し、PDAのコロニーと比較して空中菌糸の成長が少なくなります。画像はペトリ皿の上から撮影しました。略語:CMA =コーンミール寒天;PDA = ジャガイモデキストロース寒天;DPI = 接種後日数。 この図の拡大版を表示するには、ここをクリックしてください。

図7:PDA上のクロスの画像(A)100%PDA、(B)50%PDA、(C)25%PDA。関心領域は拡大されました(赤い長方形)。すべての画像は4DPIで取得されました。(D)50%PDAの追加ビューは、さまざまな段階で有性生殖細胞の存在を強調しています:若い空中接合子:アスタリスク;古い空中接合胞子:赤い矢印。(E)25%のPDAは、さまざまな段階で有性生殖細胞を示しますが、この代表的な見解は、50%のPDAと比較してこれらの構造の混雑が少ないことを示しています。スケールバー = 1 mm (A-C)、0.5 mm (D、E)。略語:PDA =ジャガイモデキストロース寒天;DPI = 接種後日数。この図の拡大版を表示するには、ここをクリックしてください。
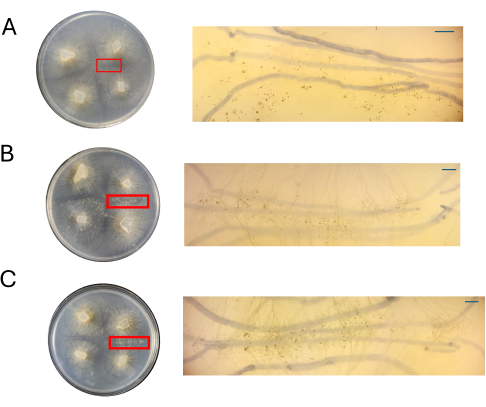
図8:CMAの十字の画像。 (A)100%CMA、(B)50%CMA、および(C)25%CMA(関心領域の拡大)。CMAの50%(B)と25%(C)では、明確な性的構造が容易に観察され、混雑は最小限に抑えられています。この時点では、100%CMAでは性的な構造は見られません。すべての画像は4DPIで取得されました。ペトリ皿の画像と解剖スコープの画像は、ペトリ皿の上から取得しました。解剖スコープ画像の背景にある暗い線は、菌糸体の拡大を追跡するために使用された黒いマーカーで描かれています。スケールバー= 1 mm。略語:CMA =コーンミール寒天;DPI = 接種後日数。 この図の拡大版を表示するには、ここをクリックしてください。
表1:4日間にわたる各菌株の菌糸体の面積。この表をダウンロードするには、ここをクリックしてください。
表2:異なる媒体上の各ひずみの接触と嵌合のペアワイズ評価 0 = いいえ、1 = はい。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
実験室の設定でP.blakesleeanusの有性生殖を誘導するための簡単なプロトコルがここに提示されています。このプロトコルの最も重要な考慮事項の1つは、栄養素の制限です。真菌は、栄養制限6,28,29,30,31,32などの過酷な環境条件への応答として有性生殖を取り入れたと仮定されています。栄養素のレベルを変えることで、実験計画に情報を提供できます。例えば、研究者が空中接合子とガメタンジアで発現する遺伝子を比較することに興味がある場合、性的構造の密度はCMAまたはPDAのより高い製剤と比較して低いため、より極端な栄養制限(25%CMAなど)が推奨されるでしょう。50%または25%のCMAで観察されたような性構造の密度が低いということは、特定の分化細胞タイプの単離が容易になるだけでなく(細胞の同定と切除が容易になるため)、目的の細胞タイプのみがサンプリングされることを保証することを意味します。
研修生や学生もこのプロトコルの恩恵を受けるでしょう、なぜならそれはこのグループが細胞分化を追跡し、P. blakesleeanusの性サイクル中に発生する様々な細胞タイプを確実に区別することを可能にするからです。CMAおよびPDAの使用は、粘液菌18,22,23の交配の誘導に関する先行研究を反映しており、粉末形態は購入可能であり、他の合成培地と比較して、トレーニングまたは教育の場で培地のよりアクセスしやすい選択肢の一つとなっている。
このプロトコルの目標は、最終的に発生と分化を実証することであり、栄養素濃度が異なる細胞タイプを容易に観察できるかどうかに影響を与えることが指摘されているため、このプロトコルの重要なステップは、適切な培地組成を確保することです(プロトコルセクション1)。希釈したPDAまたはCMAに寒天粉末を追加で添加しないと、培地が適切に固化せず、その後の交配相互作用が観察されない場合があります。さらに、相補型および類似型の交配タイプの配置に細心の注意を払う必要があります(プロトコルセクション2)。P. blakesleeanusはヘテロタリックであるため、補完的な交配パートナーが必要であり、そのパートナーにアクセスできないか、代わりに同様の交配タイプが使用されている場合、交配は発生しません10,33,34。
このプロトコルの制限は、性的構造の非同期的な発達です。 P. blakesleeanusは、固体培地で成長した他の菌類と同様に、すべての方向に放射状に広がります。これは、菌糸体の一部が他の部分よりも性周期の進行段階にあることを意味します。子嚢菌類35の性的発達を同期させるためのプロトコルが存在しますが、これらはムコロ菌類にうまく適応されていません。これは、性周期中の遺伝子発現を調査する研究が、異なる発生段階にある細胞が多すぎるとノイズにさらされることを意味します。この研究の観察結果を考えると、栄養素の利用可能性を制限すると、全体的な性生殖細胞が少なくなる一方で、観察された細胞は同様の発達段階にあるように見えるようです。したがって、栄養素の制限は、分化した性構造の密度を制限するのに役立ち、研究者が低収率を犠牲にしてほぼ同期組織にアクセスできるようになる可能性があります。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この作業に資金を提供してくださったコロラド大学自然科学実行委員会、生物生物学および生態学部、および学生研究のためのHevey Family Fundに感謝します。また、Alice Keller 氏と Tia Hutchens 氏の技術サポートにも感謝の意を表します。
資料
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
参考文献
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved