Method Article
Mucoromycete Phycomyces blakesleeanus를 가진 성적 십자가
요약
여기에서 우리는 P. blakesleeanus 짝짓기의 유도를 위한 기본 프로토콜을 제시합니다.
초록
Phycomyces blakesleeanus는 Mucoromycota 문 내의 사상 곰팡이로, 환경 인식과 적응 반응에 대한 놀라운 능력으로 구별됩니다. 과거 연구에서는 중력, 빛, 수분 및 영양분 가용성을 포함한 환경적 자극이 성장 역학과 생식 전략에 영향을 미친다는 것을 보여주었지만, 기본 메커니즘은 여전히 연구의 핵심 영역으로 남아 있습니다. 환경적 단서는 유성 생식 또는 무성 생식을 유발합니다. 유성 생식은 페로몬 신호로 시작되어 균사 화학 인력을 유발하여 결국 접합자 포자의 형성으로 절정에 이르는 일련의 형태 학적 전이로 이어집니다.
실험실 환경에서 P. blakesleeanus 의 교배는 서로 다른 단계에서 성기를 겪는 상보적 균사체를 초래합니다. 우리의 연구는 환경적 단서가 P. blakesleeanus의 균사체를 가로질러 짝짓기를 유발할 수 있는지 테스트하는 것을 목표로 합니다. 영양이 제한된 배지에서 자란 P. blakesleeanu의 교배는 영양 결핍에 따라 성적 반응을 유발하기 위해 영양이 제한된 한천에 노출됩니다. P. blakesleeanus 에서 짝짓기를 성공적으로 유발하면 특정 단계에서 많은 양의 유성 생식 균사체가 필요한 향후 연구를 촉진할 수 있습니다. 이 연구의 결과는 P. blakesleeanus 생식 메커니즘이 환경 요인에 의해 어떻게 영향을 받는지에 대한 이해를 더욱 향상시켜 사상균의 유성 생식에 대한 광범위한 지식 기반에 기여할 것입니다.
서문
실험실 조건에서 곰팡이 시스템에서의 짝짓기 유도는 진핵 유전학, 세포 생물학, 진화 생물학 및 생명 공학에 대한 이해를 발전 시켰습니다. 디카리안 균류(dikaryan fungi), 특히 아스코마이코타(Ascomycota)는 실험실 환경에서 짝짓기 유도에 대한 가장 광범위한 지식을 가지고 있다1. 흥미롭게도, 유성 생식이 제안된 첫 번째 곰팡이인 Syzygites megalocarpus는 Ascomycota의 구성원이 아니라 Mucoromycota2 문의 구성원입니다. Mucoromycota 문은 이전에 "Zygomycota"로 분류되었지만 지금은 Dikaryan 계통 3,4의 자매로 간주되는 초기 분기 그룹입니다. Mucoromycota는 Zoopagomycota와 함께 곰팡이가 육상 생태계로의 전환을 나타내기 때문에 진화적으로 중요합니다 4,5. 다른 곰팡이와 마찬가지로 점액균류는 환경에 대응하여 무성 생식 및 유성 생식 전략을 사용합니다 3,6. 영양이 제한된 상태에서 점액균류는 성기6를 시작한다. 점액균류는 호모탈릭(homothallic)과 이종(heterothallic) 짝짓기 메커니즘을 모두 나타내며, 여기서 호환성은 각각 (-) 및 (+)로 지정된 짝짓기 유형 유전자 sexM 및 sexP에 의해 결정됩니다 7,8,9.
Blakeslee10은 외부 조건에 대한 점막균 성주기의 민감성을 강조하면서 수분이 형성에 중요하며 기질의 영양 가용성이 중요한 역할을 한다고 지적했습니다. 상보적 짝짓기 유형은 베타 카로틴을 전구체로 사용하여 트리스포릭산(TA)의 협력 합성을 통해 성기를 시작합니다 11,12,13. TA의 검출 후, 반응하는 식물 균사는 두꺼워지고 고도로 분지된 접합체가 됩니다 14,15,16. 접합체는 TA의 생산을 계속하고 상호 화학유인합니다. P. blakesleeanus에서 접합체는 기질 내에서 분화되며 고체 한천 배지에서 쉽게 볼 수 없습니다17. 접촉하면 접합체가 얽혀 공중 접합체가 됩니다.
성주기가 계속됨에 따라 접합체의 끝이 부착되고 세포의 중간이 돌출되어 기저부에서 산호질이 부풀어 오르는 고리 모양의 구조를 형성하여 progametangium으로의 전환을 완료합니다. progametangium을 형성하는 세포의 끝이 융합되기 시작하여 gametangium으로 발달합니다. gametangia 단계에서 zygophores는 가시 같은 장식을 보여줍니다. 끝부분의 세포벽이 용해되고 외래성 격막이 나타나 접합포자가 형성될 영역을 구분하고, 접합포자는 집게와 같은 서스펜서역할을 합니다 18. 접합포자는 세포벽이 두꺼워짐에 따라 색소가 형성되고 추가적인 가시 같은 장식을 획득하게 됩니다17,18. 일단 형성되면 접합포자는 성장 주기를 다시 시작하기 전에 휴면 기간에 들어갑니다.
Phycomyces blakesleeanus는 큰 세포와 환경 적으로 반응하는 포자낭 균류로 유명한 이종 점액 균류입니다 6,8,18. 이 유기체는 실험실에서 쉽게 배양되며 접합자 포자의 형성으로 이어지는 성주기의 부분은 8-10 일 동안 관찰 할 수 있습니다. 모델로서 P. blakesleeanus는 환경에서 빛을 감지하는 능력에 대해 조사되었습니다17,19. 재배의 용이성과 짝짓기를 유도하는 능력은 또한 빛을 감지하는 능력의 이면에 있는 메커니즘을 연구하는 데 이상적인 모델이었습니다20; 이러한 발견은 또한 곰팡이에서 빛 감지 메커니즘의 진화적 보존을 강조했습니다. P. blakesleeanus에서 빛은 이러한 보존된 빛 감지 단백질을 통해 유성 생식을 억제하는 것으로 나타났습니다21. 최근의 진화 발달 연구는 P. blakesleeanus 성기 동안 세포 분화에 기여하는 유전자가 무엇인지 이해하려고 노력했습니다6. 형태형성을 특정 유전자와 연관시키려면 유전자 발현 연구를 수행하기 위해 동일한 세포 유형의 충분한 조직을 분리해야 합니다.
실험실 환경에서 P. blakesleeanus의 짝짓기를 유도하기 위한 프로토콜이 이전에 설명되었지만, 일부는 사용할 배지의 유형과 관련 균주만 언급합니다18. 일부 프로토콜 설명은 특정 매체 제형을 포함하지 않지만, 플레이트(10) 상에 추정되는 상보적 결합 유형을 위치시킬 위치를 설명한다. 보다 최근의 프로토콜은 각 짝짓기 유형의 포자를 혼합하고 혼합 포자 현탁액21을 접종하거나 짝짓기 유형을 약간 떨어뜨려 배양하고 배양액이 20일 동안 배양하도록 함으로써 접합자포자의 생산을 증가시킬 수 있습니다22. 이러한 접근법은 충분히 분화된 세포, 특히 접합포자를 생성하는 데 유용하지만, 발달 시간 경과를 관찰하거나 단일 세포 전사체학에서 접합자보다 먼저 형성되는 성 구조를 선택하는 데는 적합하지 않을 수 있습니다. 다른 연구에서는 성 주기가 시작될 때 연속적인 형태학적 전이를 관찰할 수 있도록 단단한 매체에 상보적인 짝짓기 유형을 멀리 배치함으로써 이 문제를 해결했습니다 6,22,23. 다른 곰팡이의 경우와 마찬가지로 P. blakesleeanus 균사체는 방사상으로 확장됩니다24,25. 그러므로, 상보적인 짝짓기 유형이 같은 판에서 자랄 때, 그들의 균사체의 다른 부분이 다른 시간에 접촉하게 될 것입니다. 균사체 사이의 접촉은 P. blakesleeanus 성기의 첫 번째 단계 중 하나이기 때문에 이는 상호 작용하는 균사체의 다른 부분이 성주기의 다른 단계에 있음을 의미합니다. 이러한 비동시성은 유전자 발현 연구의 결과에 영향을 미칠 수 있으며, 분화된 세포 유형이 혼합되고 서로 다른 유전자 발현 프로그램이 있는 경우 하나의 특정 구조에 유전자의 역할을 부여하기 어려울 수 있습니다.
P. blakesleeanus는 성생식 주기 동안 형태 형성에 관여하는 유전자를 조사하기 위한 모델로서 가치가 있을 뿐만 아니라, 활발한 성장과 며칠 동안에 분화할 수 있는 능력으로 인해 조기 발산 사상균에 관심이 있는 학생들을 훈련시키고 학부 교실 환경에서 곰팡이의 다양성과 발달 과정에 대해 배우기 위해 사용하는 데 이상적인 곰팡이입니다. 여기에 제시된 프로토콜은 정량화, 관찰 또는 잠재적인 단세포 전사체학을 위해 균사체 모양, 짝짓기 유도 및 특정 성 구조에 대한 농축에 대한 영양소 가용성의 효과를 입증하기 위해 두 가지 유형의 배지의 세 가지 농도를 사용합니다.
프로토콜
1. 배지 준비
- 분말 옥수수 가루 한천(CMA) 또는 감자 포도당 한천(PDA)을 탈이온수에 현탁시킵니다. 100% CMA 또는 PDA의 경우 제조업체의 지침에 따라 17L의 탈이온수 또는 39L의 탈이온수 1L에 PDA 1g을 현탁합니다. N% CMA 또는 PDA의 경우 제조업체 권장량의 1/N을 현탁하고 추가 한천을 보충하여 7.5%(w/v)의 한천 농도를 달성합니다.
참고: 선택적 단계: 고압증기멸균 전에 박테리아 오염이 우려되는 경우 25μg/mL의 클로람페니콜을 첨가합니다. - 오토클레이브에서 121°C에서 15분 동안 매체를 멸균합니다.
- 60°C로 설정된 수조에 30분 동안 두어 미디어를 ~60°C로 냉각합니다.
알림: 따뜻한 미디어 병을 불편함이 거의 또는 전혀 없이 6초 동안 유지할 수 있으면 따를 준비가 된 것입니다. - 무균 상태에서 플레이트를 층류 후드 또는 생물 안전 캐비닛에 붓습니다. 열려 있고 비어 있는 페트리 접시 위로 미디어 병을 기울이고 바닥을 완전히 덮을 만큼만 붓습니다.
- 또는 유리 혈청학 피펫과 피펫 20mL의 배지를 각 플레이트에 사용합니다.
알림: 이 접근 방식은 미디어 병이 더 낮은 온도에 있는 시간을 늘리고 한천을 조기에 응고시킬 위험을 높입니다.
- 또는 유리 혈청학 피펫과 피펫 20mL의 배지를 각 플레이트에 사용합니다.
- 미디어가 다시 통합될 때까지 기다립니다. 즉시 사용하지 않을 경우 플레이트를 4°C에서 보관하십시오.
2. 곰팡이 포자 또는 조직 준비
- 각 P. blakesleeanus 짝짓기 유형(예: NRRL 1555(-), NRRL 1554(+), NRRL 1464(-) 및 NRRL 1465(+))의 배양을 얻습니다. 포자로 십자가를 접종하려면 먼저 100% CMA 또는 PDA에서 순수 배양에서 각 짝짓기 유형을 성장시킵니다
- 기존 배양물에서 최첨단 균사체의 일부를 잘라내고 절제된 균사체를 100% CMA/PDA 플레이트에 놓습니다. 순수 배양물을 27°C에서 12시간 주기로 1주일 동안 배양합니다.
- 포자낭이 존재하면 무균 기술을 사용하여 멸균된 탈이온수에 0.01% Tween 20을 주입합니다. P1000 마이크로피펫을 사용하여 플레이트에서 Tween 20-포자 혼합물 1.0mL를 마이크로 원심분리 튜브로 추출합니다.
- 미니 원심분리기에서 30초 동안 원심분리기를 사용한 다음 상층액을 디캔팅합니다.
- 더 많은 포자가 필요한 경우 Tween 20 포자 혼합물 1.0mL를 동일한 마이크로 원심분리 튜브에 계속 추가하고 2.4단계를 반복합니다. 적절한 양의 포자를 얻은 후 상층액을 디캔팅하고 500μL의 멸균 탈이온수로 교체합니다.
- 선택 사항: 혈구계를 사용하여 포자의 농도를 추정하면 더 많은 물을 추가해야 하는지 또는 포자를 다시 원심분리해야 하는지 여부를 알 수 있습니다.
- 또는 순수 배양에서 나온 최첨단 균사체를 십자가에 접종하십시오.
- 멸균된 면도날이나 코르크 구멍 천공을 사용하여 조직을 절제하고 즉시 접종물을 도금합니다.
- 십자가를 2방향 교차, 4방향 교차 또는 8방향 교차로 설정합니다(그림 1).
참고: 전사체 작업을 위해 십자가를 설정하는 경우 지표 플레이트로 사용할 조건/매체당 1-2개의 추가 플레이트를 설정하는 것이 좋습니다. 지시판은 빛이 P. blakesleeanus의 유성 생식을 억제하기 때문에 조사관이 실험판에 대한 빛 노출을 제한할 수 있도록 합니다.- 2방향 교차의 경우 상호 보완적인 결합 유형을 서로 반대편에 배치합니다(그림 1A).
- (-) 짝짓기 유형인 NRRL 1555 또는 NRRL 1464의 균사체를 PDA 또는 CMA의 페트리 접시 가장자리에서 최소 1cm 떨어진 곳에 놓습니다.
- 같은 플레이트에서 (-) 짝짓기 유형이 배치된 곳의 반대편과 페트리 접시 가장자리에서 1cm 떨어진 곳에 (+) 짝짓기 유형, NRRL 1554 또는 NRRL1465를 놓습니다(그림 1A).
참고: 보완적인 짝짓기 유형 사이의 거리는 성주기에 참여하는 조직의 크기에 영향을 미칩니다. 짝짓기 유형이 더 멀어지면 균사체가 더 많이 확장되어 두 파트너 간의 성적 상호 작용 횟수가 증가합니다.
- 4방향 교차의 경우, 짝짓기 유형과 같이 서로 마주보지만 보완적인 짝짓기 유형과 인접하게 배치합니다(그림 1B).
- (-) 짝짓기 유형인 NRRL 1555 및 NRRL 1464의 포자 또는 균사체를 PDA 또는 CMA의 페트리 접시 가장자리에서 최소 1cm 떨어진 곳에 서로 마주 보게 놓습니다.
- 동일한 플레이트에서 두 (-) 짝짓기 유형 사이의 위치를 선택하고 플레이트 가장자리에서 최소 1cm 떨어진 곳을 선택하고 (+) 짝짓기 유형인 NRRL 1554 또는 1465의 포자 또는 균사체를 해당 부위에 접종합니다.
- 동일한 플레이트에서, 첫 번째(+) 짝짓기 유형이 접종된 반대편에 플레이트에서 최소 1cm 떨어진 곳에 다른 (+) 짝짓기 유형을 배치합니다.
- 8방향 교배의 경우, 페트리 접시의 주변을 따라 교대로 짝짓기 유형을 배치하며, 각 짝짓기 유형마다 4개씩 있습니다(그림 1C).
- 2방향 교차의 경우 상호 보완적인 결합 유형을 서로 반대편에 배치합니다(그림 1A).
- 접종 후 플레이트를 파라필름으로 밀봉하거나(밀봉하지 않은 상태로 두고) 어두운 곳에서 22°C에서 배양하기 전에 보조 용기에 넣습니다. 짝짓기의 증거를 찾기 위해 매일 판을 관찰하고, 판 아래에서 사진을 찍고, 배양이 성장함에 따라 균사체를 추적하십시오.
참고: 접종 후 24시간 후에는 균사체가 모든 미디어 유형에서 확장되는 것을 볼 수 있을 것으로 예상되지만 이 단계에서 개인이 접촉할 가능성은 없습니다. - 배지 유형(PDA 또는 CMA) 및 제형(25%, 50%, 100%)에 따라 균사체가 접촉하기 시작하면 해부 범위 아래에서 접촉하는 상보적 짝짓기 유형의 균사체를 검사하여 짝짓기의 증거를 찾습니다. 해부 스코프에 장착된 카메라 또는 스마트폰으로 상호 작용하는 균사체의 사진을 찍습니다.
- 균사체의 이미지를 획득하고 함께 스티칭합니다(예: Panorama Stitcher 애플리케이션 사용). ImageJ를 사용하여 균사체의 면적을 추정합니다(온라인 자습서 참조).
결과
4방향 교배 후 각 균주는 균사체 면적의 변화에 따라 결정되는 성장 속도가 약간 달랐습니다(그림 2). 통계적으로 유의하지는 않지만 NRRL 1555는 25% CMA, 25% PDA 또는 100% PDA에 도금했을 때 면적 변화가 더 빨랐습니다. 유사하게, NRRL 1465는 50% PDA 또는 CMA에서 성장할 때 면적 변화가 더 높았습니다. NRRL 1464는 100% CMA에서 성장했을 때 면적이 가장 빠르게 증가했습니다. 24시간(1DPI) 후, PDA에서 자란 균주는 CMA에서 자란 균주에 비해 더 황색으로 나타났으며(그림 3)-PDA는 이전에 색소 생산을 증가시키는 것으로 나타났습니다26. 100% PDA에 대한 균주는 평균적으로 24시간 후에 더 높은 면적 측정을 가졌습니다(표 1). 이는 1DPI에서 평균 면적이 가장 작은 25% CMA와 대조됩니다(표 1).
인접 균주 간의 접촉은 2 DPI까지 관찰되지 않았으며 PDA에서 성장한 균주, 특히 100% PDA 사이에서만 관찰되었습니다(그림 4). 짝짓기는 2DPI에서 100% PDA에서 관찰되었습니다. CMA에서 성장한 균주는 2DPI에서 접촉하지 않았지만 100% CMA는 서로 매우 가깝게 자란 균주를 특징으로 했습니다(그림 4). 3일간의 배양(3 DPI) 후, PDA의 모든 제형에서 성장한 균주는 분화된 세포 유형의 밀도는 달랐지만 짝짓기를 나타냈습니다(표 2 및 그림 5). 25% CMA의 1회 반복과 50% CMA의 1회 반복에서도 짝짓기가 나타났습니다(표 2). 나머지 CMA 플레이트는 어떠한 짝짓기도 나타내지 않았다(표 2). 흥미롭게도, PDA에서 자란 균주는 더 조밀한 노란색 균사체와 공중 균사를 가지고 있는 것으로 보였으며, 이는 포자낭단으로 발달했을 수 있습니다(그림 5). 4 DPI까지 PDA 플레이트는 무성 포자낭형성체와 함께 짝짓기 반응을 보였다(그림 6). CMA 플레이트는 확산성 균사체가 더 많고 포자낭단이 더 적은 균주를 가졌습니다(그림 6). 100% CMA에서는 짝짓기가 관찰되지 않았습니다(표 2).
성 주기의 시작과 관련된 세포 유형을 쉽게 관찰할 수 있는지 여부를 평가하기 위해 4DPI의 해부 범위에서 대표 플레이트를 관찰했습니다. 일반적으로 영양소의 농도 감소는 질적으로 밀도가 낮고 분화된 성 균사체와 상관관계가 있었습니다(그림 7 및 그림 8). 100% PDA에서 성장했을 때, 개별 공중 접합체 또는 프로가메탕기아(progametangia)는 시각화될 수 없었고 세포 덩어리로 나타났습니다(그림 7A). 50%와 25% PDA는 짝짓기 부위에서 세포 밀도가 낮은 것으로 보였지만, 25% PDA 플레이트는 쉽게 구별할 수 있는 세포를 특징으로 했습니다(그림 7B,C). 50% PDA와 25% PDA에서 관찰된 세포 유형을 비교할 때, 낮은 농도의 세포는 주로 동일한 유형인 것으로 보인 반면, 높은 농도에서는 서로 다른 단계의 세포가 혼합되어 있었습니다(그림 7D, E). 특히, 50% PDA로 4DPI에서 관찰된 세포에는 방금 출현한 공중 접합체(그림 7D, 별표)와 프로가메탕기아로 전이되는 세포(그림 7D, 화살표)가 포함되어 있습니다. 25%의 PDA를 가진 대부분의 세포는 매우 유사한 발달 단계에 있는 것으로 보였습니다(그림 7E).
다양한 농도의 CMA 플레이트를 4DPI에서 PDA 플레이트와 함께 평가했습니다(그림 8). 앞서 언급했듯이 100% CMA를 사용했을 때 짝짓기가 관찰되지 않았습니다(그림 8A). 50% CMA 또는 25% CMA에서 짝짓기가 관찰되었으며 유성 생식과 관련된 전체 세포 유형 수는 더 낮았습니다(그림 8B, C). 4 DPI에서 관찰된 공중 접합체는 상호 작용 영역 전체에서 동일한 크기와 높이로 나타났습니다(그림 8B, C). 성 순환에 참여하는 세포의 전체 수가 적다는 점을 감안할 때, 이러한 세포는 멸균된 면도날이나 해부 바늘로 절제하고 다운스트림 RNA 분리를 위해 액체 질소에서 즉시 동결할 수 있습니다. 동일한 발달 시점에서 특정 구조를 선택할 수 있으면 형태학적 변화를 유전자에 연결하려는 유전자 발현 연구의 견고성을 높일 수 있습니다.
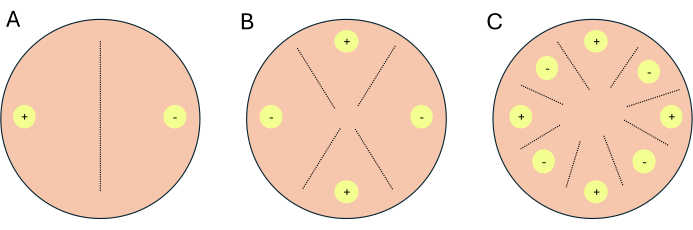
그림 1: 세 가지 교차 형식의 개략도. (A) 상보적인 짝짓기 유형(+) 및 (-)가 있는 두 개의 접종 부위(노란색 원)가 있는 2방향 십자가. (B) (+) 짝짓기 유형(+가 있는 노란색 원)의 접종 부위 2개와 짝짓기 -유형(-이 있는 노란색 원)의 접종 부위 2개가 있는 4방향 십자가. (C) 상보적인 짝짓기 유형(+)과 (-)의 접종 부위(노란색 원)가 번갈아 가며 있는 8방향 십자가. 파선은 짝짓기 상호 작용의 예측된 위치를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
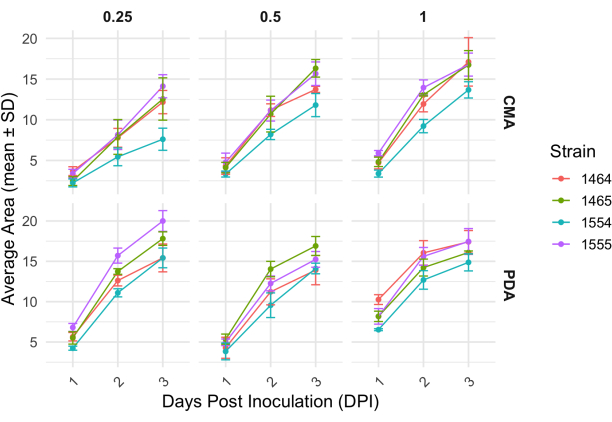
그림 2: 서로 다른 농도에서 CMA 및 PDA의 각 균주에 대한 시간 경과에 따른 면적 변화. P. blakesleeanus 군집의 평균 면적은 접종 후 3일 동안 표시되었습니다. 오차 막대는 평균 영역의 표준 편차를 나타냅니다. 표 1도 참조하십시오. 플롯은 ggplot227로 생성되었습니다. 약어: DPI = 접종 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
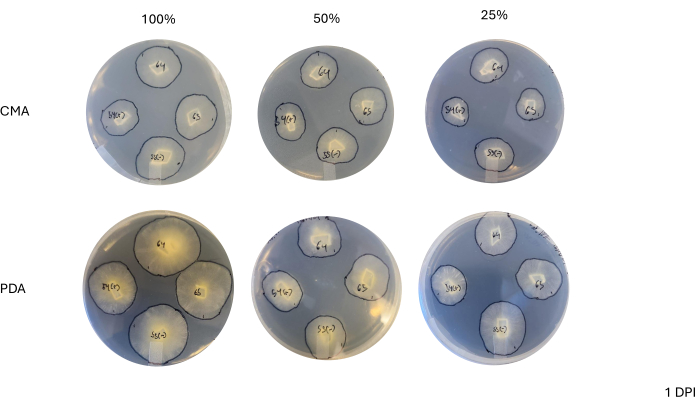
그림 3: 접종 후 1일 시점의 4방향 교배의 대표 이미지. 콜로니를 비교한 결과, 배지 유형과 제형에 따른 차이가 나타나며, 100% PDA를 투여한 콜로니는 CMA보다 더 노랗게 나타나고 100% PDA를 투여한 콜로니는 더 빠르게 성장한다는 점을 강조할 수 있습니다. 이미지는 페트리 접시 바닥에서 가져왔습니다. 검은 선은 균사체를 윤곽을 그리는 마커로 그려졌습니다. 약어: CMA = 옥수수 가루 한천; PDA = 감자 포도당 한천; DPI = 접종 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 접종 후 2일 후의 4방향 교배의 대표 이미지. 군체의 비교는 균사체 성장의 명백한 밀도를 강조하며, PDA의 군체는 CMA의 군체보다 더 밀도가 높은 균사체를 가지고 있는 것으로 보입니다. 또한 PDA의 군집은 더 노랗게 보이며 대부분은 접촉했거나 접촉 지점에 근접해 있습니다. 빨간색 화살촉은 짝짓기 상호 작용이 시작된 영역을 강조 표시하며, 이는 조직 밀도의 증가로 표시됩니다. 이는 100% CMA를 투여한 콜로니만 접촉에 가까워지고 모든 CMA 제형은 PDA에 비해 상대적으로 덜 노란색인 콜로니를 특징으로 하며 짝짓기를 시작한 콜로니가 없는 것과는 대조적입니다. 이미지는 페트리 접시 바닥에서 가져왔습니다. 검은 선은 균사체를 윤곽을 그리는 마커로 그려졌습니다. 약어: CMA = 옥수수 가루 한천; PDA = 감자 포도당 한천; DPI = 접종 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
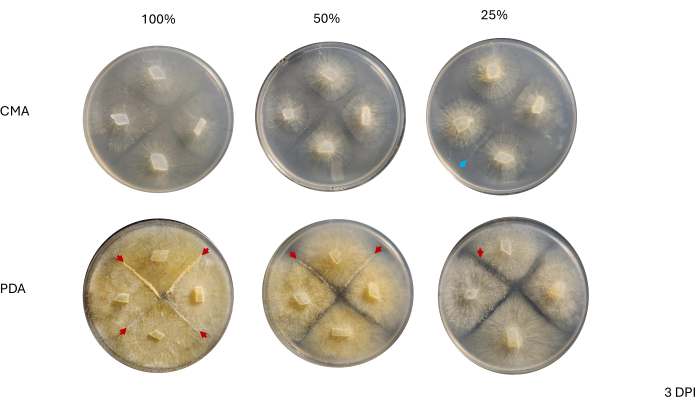
그림 5: 접종 후 3일 후의 4방향 교배의 대표 이미지. 두 배지 유형 간의 콜로니를 비교하면 PDA에서 자랄 때 CMA에 비해 균사체 밀도가 더 높다는 것을 알 수 있습니다. 빨간색 화살표는 모든 PDA 플레이트가 짝짓기 상호 작용의 하나 이상의 위치를 호스트한다는 것을 강조합니다. 100% CMA 및 50% CMA의 콜로니는 접촉하지 않았지만 25% CMA(파란색 화살표)의 두 콜로니는 접촉했습니다. 이미지는 페트리 접시 위에서 촬영했습니다. 약어: CMA = 옥수수 가루 한천; PDA = 감자 포도당 한천; DPI = 접종 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
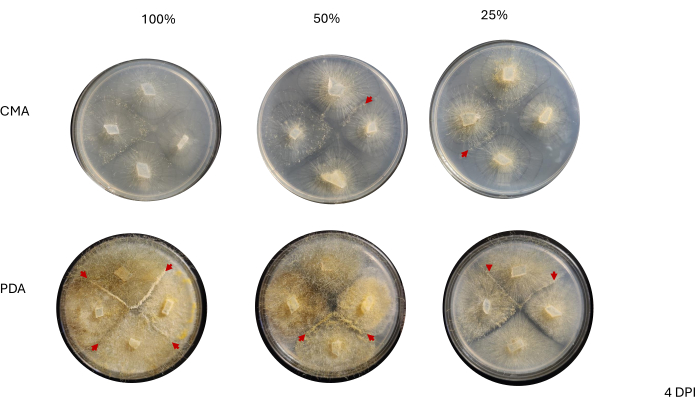
그림 6: 접종 후 4일째 되는 시점의 4방향 교배의 대표 이미지. PDA의 모든 군체는 적어도 하나의 짝짓기 상호 작용(빨간색 화살표)을 수용하고 노란색 균사체를 표시합니다. 또한 PDA의 군체는 짝짓기 상호 작용의 관찰을 방해할 수 있는 공중 균사(즉, 무성 포자낭)의 광범위한 성장을 보여줍니다. 50% 및 25% CMA의 군체는 또한 짝짓기 상호 작용의 증거를 나타내며(빨간색 화살촉) PDA에 비해 공중 균사 성장이 적습니다. 이미지는 페트리 접시 위에서 촬영했습니다. 약어: CMA = 옥수수 가루 한천; PDA = 감자 포도당 한천; DPI = 접종 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: PDA의 십자가 이미지. (A) 100% PDA, (B) 50% PDA 및 (C) 25% PDA. 관심 영역이 확대되었습니다(빨간색 사각형). 모든 이미지는 4DPI로 획득했습니다. (D) 50% PDA의 추가 보기는 서로 다른 단계에서 유성 생식 세포의 존재를 강조합니다: 젊은 공중 접합체: 별표; 더 오래된 공중 접합자 : 빨간 화살표. (E) 25% PDA는 서로 다른 단계에서 유성 생식 세포를 나타내지만, 이 대표적인 견해는 50% PDA에 비해 이러한 구조의 밀집이 적다는 것을 보여줍니다. 스케일 바 = 1mm(AC), 0.5mm(D,E). 약어 : PDA = 감자 포도당 한천; DPI = 접종 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
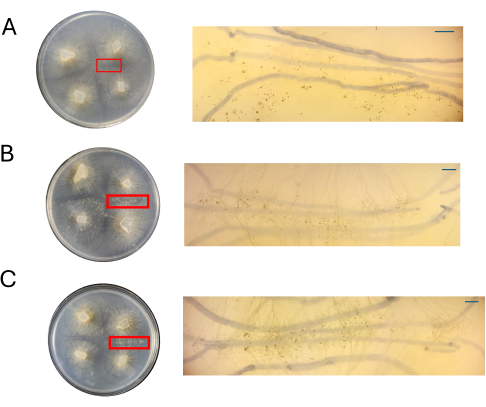
그림 8: CMA의 십자가 이미지. (A) 100% CMA, (B) 50% CMA 및 (C) 25% CMA(관심 영역 확대). CMA의 50%(B) 및 25%(C)에서 뚜렷한 성 구조가 쉽게 관찰되며 밀집이 최소화됩니다. 이 시점에서 100% CMA에서 성적 구조가 보이지 않습니다. 모든 이미지는 4DPI로 획득했습니다. 페트리 접시 이미지 및 해부 범위 이미지는 페트리 접시 위에서 얻었습니다. 해부 스코프 이미지의 배경에 있는 어두운 선은 균사체의 확장을 추적하는 데 사용된 검은색 마커로 그려집니다. 스케일 바 = 1mm. 약어: CMA = 옥수수 가루 한천; DPI = 접종 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 4일 동안 각 균주에 대한 균사체 면적. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 서로 다른 매체의 각 스트레인에 대한 접촉 및 결합의 쌍별 평가.0 = 아니오, 1 = 예. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
실험실 환경에서 P. blakesleeanus의 유성 생식을 유도하기 위한 간단한 프로토콜이 여기에 제시되어 있습니다. 이 프로토콜에서 가장 중요한 고려 사항 중 하나는 영양소 제한입니다. 곰팡이는 영양 제한 6,28,29,30,31,32와 같은 가혹한 환경 조건에 대한 반응으로 유성 생식을 선택했다는 가설이 있습니다. 영양소 수준을 다양화하면 실험 설계에 영향을 줄 수 있습니다. 예를 들어, 연구자가 공중 접합체와 가합체에서 발현되는 유전자를 비교하는 데 관심이 있는 경우, 성 구조의 밀도가 CMA 또는 PDA의 더 높은 제형에 비해 낮기 때문에 더 극단적인 영양 제한(예: 25% CMA)이 권장됩니다. 50% 또는 25% CMA에서 관찰된 것과 같은 성 구조의 밀도가 낮다는 것은 특정 분화된 세포 유형의 분리가 더 쉬울 뿐만 아니라(세포를 쉽게 식별하고 절제하기 때문에) 관심 세포 유형만 샘플링할 수 있음을 의미합니다.
연수생 또는 학생도 이 그룹이 세포 분화를 추적하고 P. blakesleeanus 성기 동안 발생하는 다양한 세포 유형을 안정적으로 구별할 수 있으므로 이 프로토콜의 이점을 누릴 수 있습니다. CMA 및 PDA의 사용은 점액균류 18,22,23의 짝짓기 유도에 대한 이전 연구를 반영하며, 분말 형태를 구매할 수 있어 다른 합성 배지에 비해 훈련 또는 교육 환경에서 더 접근하기 쉬운 배지 선택 중 하나입니다.
이 프로토콜의 목표는 궁극적으로 발달 및 분화를 입증하는 것이며 영양소 농도가 뚜렷한 세포 유형을 쉽게 관찰할 수 있는지 여부에 영향을 미친다는 점이 지적되었기 때문에 이 프로토콜의 중요한 단계는 적절한 배지 조성을 보장하는 것입니다(프로토콜 섹션 1). 희석된 PDA 또는 CMA에 추가 한천 분말을 첨가하지 않으면 배지가 제대로 응고되지 않을 수 있으며 후속 결합 상호 작용이 쉽게 관찰되지 않을 수 있습니다. 또한, 상보적인 짝짓기 유형과 유사한 짝짓기 유형의 배치에 세심한 주의를 기울여야 합니다(프로토콜 섹션 2). P. blakesleeanus는 이종(heterothallic)이기 때문에 보완적인 짝짓기 파트너가 필요하며, 그 파트너에 접근할 수 없거나 유사한 짝짓기 유형이 대신 사용되면 짝짓기가 발생하지 않습니다 10,33,34.
이 프로토콜의 한계는 성적 구조의 비동기적 발달입니다. P. blakesleeanus는 고체 매체에서 자라는 다른 곰팡이와 마찬가지로 모든 방향으로 방사형으로 확장됩니다. 이것은 균사체의 일부가 다른 부분보다 성기의 더 진행된 단계에 있음을 의미합니다. Ascomycetes35의 성 발달을 동기화하기 위한 프로토콜이 존재하지만, 이는 점액균류에 성공적으로 적용되지 않았습니다. 이것은 성기 동안 유전자 발현을 조사하는 작업이 너무 많은 세포가 다른 발달 단계에 있는 경우 소음의 대상이 될 수 있음을 의미합니다. 이 연구의 관찰 결과를 감안할 때, 영양소 가용성을 제한하면 전반적인 유성 생식 세포가 감소하는 것으로 보이지만 관찰된 세포는 유사한 발달 단계에 있는 것으로 보입니다. 따라서 영양소의 제한은 분화된 성 구조의 밀도를 제한하는 데 도움이 될 수 있으며, 연구자가 더 낮은 수율을 희생하면서 대부분 동기화된 조직에 접근할 수 있도록 할 수 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 작업에 자금을 지원해 주신 Colorado College Natural Sciences Executive Committee, Organismal Biology and Ecology Department, Hevey Family Fund for Student Research에 감사드립니다. 또한 기술 지원을 해주신 Alice Keller와 Tia Hutchens에게도 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
참고문헌
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유