Method Article
الصلبان الجنسية مع خميات الغم المخاطية Phycomyces blakesleeanus
In This Article
Summary
نقدم هنا بروتوكولا أساسيا لتحريض P. blakesleeanus التزاوج.
Abstract
تتميز Phycomyces blakesleeanus ، وهي فطر خيطي داخل شعبة Mucoromycota ، بقدرتها الرائعة على الإدراك البيئي والاستجابات التكيفية. في حين أن العمل السابق أظهر أن المحفزات البيئية ، بما في ذلك الجاذبية والضوء والرطوبة وتوافر المغذيات ، تؤثر على ديناميكيات نموها واستراتيجياتها الإنجابية ، تظل الآليات الأساسية مجالا محوريا للبحث. تؤدي الإشارات البيئية إلى التكاثر الجنسي أو اللاجنسي. يبدأ التكاثر الجنسي بإشارات الفرمون ، مما يؤدي إلى الجذب الكيميائي للخيوط ، مما يؤدي في النهاية إلى تحولات مورفولوجية متسلسلة تبلغ ذروتها في تكوين زيجوبور.
في بيئة معملية ، تداخل P. blakesleeanus تؤدي إلى خضوع الفطريات التكميلية للدورة الجنسية في مراحل مختلفة. يهدف عملنا إلى اختبار ما إذا كانت الإشارات البيئية يمكن أن تؤدي إلى التزاوج عبر فطريات P. blakesleeanus. ستخضع تهجينات P. blakesleeanuالمزروعة على وسائط محدودة المغذيات لأجار محدود المغذيات لتحفيز استجابة جنسية وفقا للحرمان من المغذيات. التحفيز الناجح للتزاوج في P. blakesleeanus سيسهل الدراسات المستقبلية التي تتطلب كمية كبيرة من الفطريات المتكاثرة جنسيا في مراحل محددة. ستعزز نتيجة هذا البحث فهمنا لكيفية تأثر الآليات التناسلية P. blakesleeanus بالعوامل البيئية ، مما يساهم في قاعدة المعرفة الأوسع حول التكاثر الجنسي للفطريات الخيطية.
Introduction
أدى تحريض التزاوج في الأنظمة الفطرية في الظروف المختبرية إلى تطوير فهم علم الوراثة حقيقيات النواة ، وبيولوجيا الخلية ، وعلم الأحياء التطوري ، والتكنولوجيا الحيوية. تتميز فطريات الديكاريان ، ولا سيما Ascomycota ، بالمعرفة الأكثر شمولا حول تحريض التزاوج في بيئة معملية1. ومن المثير للاهتمام ، أن الفطريات الأولى التي تم فيها اقتراح التكاثر الجنسي ، Syzygites megalocarpus ، ليست عضوا في Ascomycota ، بل هي عضو في شعبة Mucoromycota2. شعبة Mucoromycota هي مجموعة متباينة مبكرا تصنف سابقا باسم "Zygomycota" ولكنها تعتبر الآن أخت سلالات ديكاريان3،4. تعتبر Mucoromycota ، جنبا إلى جنب مع Zoopagomycota ، ذات أهمية تطورية لأن هذه الشعب تمثل انتقال الفطريات إلى النظم البيئية الأرضية4،5. مثل الفطريات الأخرى ، تستخدم الفطريات الغدمية استراتيجيات الإنجاب اللاجنسية والجنسية استجابة لبيئتها3،6. في ظل ظروف محدودة المغذيات ، ستبدأ الفطريات المخاطية الدورة الجنسية6. تظهر خميات الغشاء المخاطي آليات التزاوج المتجانسة وغير المتجانسة ، حيث يتم تحديد التوافق من خلال الجينات من نوع التزاوج sexM و sexP ، المعينة على أنها (-) و (+) على التوالي7،8،9.
أكد Blakeslee10 على حساسية الدورة الجنسية للخميات المخاطية للظروف الخارجية ، مشيرا إلى أن الرطوبة أمر بالغ الأهمية لتكوينها وأن توافر المغذيات في الركيزة يلعب دورا مهما. تبدأ أنواع التزاوج التكميلية الدورة الجنسية من خلال التخليق التعاوني لأحماض التريكسبوريك (TA) باستخدام بيتا كاروتين كمقدمة11،12،13. بعد اكتشاف TA ، تتكاثف الخيوط الخضرية المستجيبة وتصبح zygophores شديدة التفرع14،15،16. تستمر zygophores في إنتاج TA والجذب الكيميائي المتبادل. في P. blakesleeanus ، تتمايز البيضة الملقحة داخل الركيزة ولا يمكن رؤيتها بسهولة على وسائط الأجار الصلبة17. عند الاتصال ، تتشابك zygophores وتصبح zygophores هوائية.
مع استمرار الدورة الجنسية ، ترتبط أطراف الزيجوفورات ، ويدفع منتصف الخلايا للخارج لتشكيل بنية تشبه الحلقة مع تورم المرجان في القاعدة ، مما يكمل الانتقال إلى البروجامتانغوم. تبدأ أطراف الخلايا المكونة للبروجامتانجيوم في الاندماج والتطور إلى gametangium. في مرحلة gametangia ، تعرض zygophores زخرفة تشبه الشوكة. يذوب جدار الخلية عند الأطراف وتظهر حواجز عرضية ، تحدد المنطقة التي سيتشكل فيها الأبوغ البيضي ، وتعمل الزيجوفورات كمعلقات تشبه الملقط18. سيصبح الزيجوبوغ مصطبغة مع سماكة جدار الخلية ويكتسب زخرفة إضافية تشبه الشوكة17،18. بمجرد تشكيله ، سيدخل الأبواغ الملقحة فترة سكون قبل إعادة بدء دورة النمو.
Phycomyces blakesleeanus هو خم الغشاء المخاطي غير المتجانس يتميز بخلاياه الكبيرة والخلايا البوغية المستجيبةبيئيا 6،8،18. يزرع هذا الكائن الحي بسهولة في المختبر ويمكن ملاحظة أجزاء من الدورة الجنسية التي تؤدي إلى تكوين الأبواغ الملقحة في غضون 8-10 أيام. كنموذج ، P. blakesleeanus تم فحصه لقدرته على استشعار الضوء في بيئته17،19. كما أن سهولة الزراعة والقدرة على تحفيز التزاوج جعلته نموذجا مثاليا لدراسة الآلية الكامنة وراء قدرته على إدراك الضوء20. سلطت هذه النتائج الضوء أيضا على الحفظ التطوري لآليات استشعار الضوء في الفطريات. في P. blakesleeanus ، ثبت أن الضوء يمنع التكاثر الجنسي عبر هذه البروتينات المحفوظة المستشعرةللضوء 21. سعت الدراسات التنموية التطورية الحديثة إلى فهم الجينات التي تساهم في تمايز الخلايا خلال P. blakesleeanus الدورة الجنسية6. يتطلب ربط التشكل بجينات معينة عزل أنسجة كافية من نفس أنواع الخلايا لإجراء دراسات التعبير الجيني.
في حين أن بروتوكولات إحداث تزاوج P. blakesleeanus في بيئة معملية قد تم وصفها سابقا ، فإن البعض يذكر فقط نوع الوسيط المراد استخدامه والسلالات ذات الصلة18. لا تتضمن بعض أوصاف البروتوكول صياغة وسائط محددة ولكنها تصف مكان وضع أنواع التزاوج التكميلية المفترضة على اللوحة10. تسمح البروتوكولات الحديثة بزيادة إنتاج الأبواغ الملقحة إما عن طريق خلط الجراثيم من كل نوع من أنواع التزاوج والتلقيح بمعلق الأبواغ المختلط21 أو عن طريق وضع أنواع التزاوج على مسافة من بينها وترك الثقافة تحتضن لمدة 20 يوما22. هذه الأساليب مفيدة لتوليد خلايا متمايزة وافرة ، وتحديدا الأبواغ الملقحة ، ولكنها قد لا تكون مناسبة لمراقبة مسار زمني للنمو أو اختيار الهياكل الجنسية التي تتشكل قبل الأبواغ الملقحة لنسخ الخلية الواحدة. عالج عمل آخر هذا من خلال وضع أنواع التزاوج التكميلية على مسافة متباعدة على وسائط صلبة للسماح بملاحظة التحولات المورفولوجية التسلسلية مع بدء الدورة الجنسية6،22،23. كما هو الحال مع الفطريات الأخرى ، P. blakesleeanus الفطريات تتوسع شعاعيا24,25. لذلك ، عندما تزرع أنواع التزاوج التكميلية على نفس الطبق ، تتلامس أجزاء مختلفة من الفطريات في أوقات مختلفة. نظرا لأن الاتصال بين الفطريات هو من بين الخطوات الأولى في الدورة الجنسية P. blakesleeanus ، فهذا يعني أن أجزاء مختلفة من الفطريات المتفاعلة ستكون في مراحل مختلفة من الدورة الجنسية. يمكن أن يؤثر هذا التباين المتزامن على نتيجة دراسة التعبير الجيني ، بحيث إذا تم خلط أنواع الخلايا المتمايزة وإذا كان لديها برامج تعبير جيني مميزة ، فسيكون من الصعب عزو دور الجين إلى بنية معينة واحدة.
بالإضافة إلى قيمة P. blakesleeanus كنموذج لفحص الجينات المشاركة في التشكل أثناء الدورة الجنسية ، فإن نموه القوي وقدرته على التمايز في غضون أيام قليلة يجعله فطرا مثاليا لتدريب الطلاب المهتمين بالفطريات الخيطية المتباينة المبكرة ولاستخدامها في بيئة الفصل الدراسي الجامعي للتعرف على تنوع الفطريات وعملياتها التنموية. يستخدم البروتوكول المقدم هنا ثلاثة تركيزات من نوعين مختلفين من الوسائط لإثبات تأثير توافر المغذيات على مظهر الفطريات ، وتحريض التزاوج ، والإثراء لهياكل جنسية معينة ، إما للقياس الكمي أو الملاحظة أو النسخ المحتملة أحادية الخلية.
Protocol
1. إعداد وسائل الإعلام
- قم بتعليق مسحوق أجار دقيق الذرة (CMA) أو أجار سكر العنب للبطاطس (PDA) في الماء منزوع الأيونات. للحصول على CMA أو PDA بنسبة 100٪ ، اتبع تعليمات الشركة المصنعة 17 جم من CMA في 1 لتر من الماء منزوع الأيونات أو 39 جم من المساعد الشخصي الرقمي في 1 لتر من الماء منزوع الأيونات. بالنسبة إلى N٪ CMA أو PDA ، قم بتعليق 1 / N من الكمية الموصى بها من قبل الشركة المصنعة واستكمله مع أجار إضافي لتحقيق تركيز أجار بنسبة 7.5٪ (وزن / حجم).
ملاحظة: خطوة اختيارية: قبل التعقيم، أضف 25 ميكروغرام/مل من الكلورامفينيكول إذا كان التلوث البكتيري مصدر قلق. - تعقيم الوسائط في الأوتوكلاف عند 121 درجة مئوية لمدة 15 دقيقة.
- قم بتبريد الوسائط إلى ~ 60 درجة مئوية عن طريق وضعها لمدة 30 دقيقة في حمام مائي مضبوطة على 60 درجة مئوية.
ملاحظة: إذا كان من الممكن الاحتفاظ بزجاجة الوسائط الدافئة لمدة 6 ثوان مع القليل من الانزعاج أو بدونها ، فهي جاهزة للصب. - صب الألواح في ظروف معقمة في غطاء تدفق رقائقي أو خزانة أمان بيولوجية. قم بإمالة زجاجة الوسائط فوق طبق بتري مفتوح وفارغ واسكب ما يكفي فقط لتغطية الجزء السفلي بالكامل.
- بدلا من ذلك، استخدم ماصة زجاجية مصلية وماصة 20 مل من الوسائط في كل لوحة.
ملاحظة: يزيد هذا النهج من الوقت الذي تكون فيه زجاجة الوسائط في درجة حرارة منخفضة ويزيد من خطر تصلب الأجار قبل الأوان.
- بدلا من ذلك، استخدم ماصة زجاجية مصلية وماصة 20 مل من الوسائط في كل لوحة.
- اسمح للوسائط بإعادة التوحيد. قم بتخزين الأطباق في درجة حرارة 4 درجات مئوية إذا لم يتم استخدامها على الفور.
2. تحضير الجراثيم الفطرية أو الأنسجة
- الحصول على مزارع من كل P. blakesleeanus نوع التزاوج (على سبيل المثال ، NRRL 1555 (-) ، NRRL 1554 (+) ، NRRL 1464 (-) ، و NRRL 1465 (+)). لتلقيح التهجين بالجراثيم ، قم أولا بزراعة كل نوع من أنواع التزاوج في مزرعة نقية على CMA أو PDA بنسبة 100٪
- قم بقص جزء من الفطريات الرائدة من الثقافات الموجودة وضع الفطريات المستقطوعة على صفيحة CMA / PDA بنسبة 100٪. احتضان الثقافات النقية لمدة أسبوع واحد عند 27 درجة مئوية تحت دورة ضوئية مدتها 12 ساعة.
- بمجرد وجود sporangiophores ، قم بإغراق مزرعة نقية بوغية ب 0.01٪ Tween 20 في ماء معقم منزوع الأيونات باستخدام تقنية معقمة. باستخدام ماصة دقيقة P1000، اسحب 1.0 مل من خليط Tween 20-spore من اللوحة إلى أنبوب الطرد المركزي الدقيق.
- جهاز طرد مركزي في جهاز طرد مركزي صغير لمدة 30 ثانية ، ثم صب المادة الطافية.
- إذا كانت هناك حاجة إلى المزيد من الجراثيم ، فاستمر في إضافة 1.0 مل من خليط بوغ Tween 20 إلى نفس أنبوب الطرد المركزي الدقيق وكرر الخطوة 2.4. بعد الحصول على كمية مناسبة من الجراثيم ، قم بصب المادة الطافية واستبدلها ب 500 ميكرولتر من الماء المعقم منزوع الأيونات.
- اختياري: استخدم مقياس الدمى لتقدير تركيز الجراثيم ، والذي سيحدد ما إذا كانت هناك حاجة إلى إضافة المزيد من الماء أو ما إذا كانت الجراثيم بحاجة إلى إعادة الطرد المركزي.
- بدلا من ذلك ، قم بتلقيح الصلبان بالفطريات الرائدة من الثقافات النقية.
- استخدم شفرة حلاقة معقمة أو حفار ثقب الفلين لاستئصال الأنسجة ولوحة اللقاح على الفور.
- قم بإعداد الصلبان كتقاطعات ثنائية الاتجاه أو تقاطعات رباعية أو تقاطعات ذات 8 اتجاهات (الشكل 1).
ملاحظة: إذا تم إعداد الصلبان للعمل النسخي ، فمن المستحسن إعداد 1-2 لوحات إضافية لكل حالة / وسائط لتكون بمثابة لوحات مؤشر. تسمح لوحات المؤشر للمحققين بالحد من التعرض للضوء للصفائح التجريبية ، حيث يمنع الضوء التكاثر الجنسي في P. blakesleeanus.- للحصول على صليب ثنائي الاتجاه ، ضع أنواع التزاوج التكميلية مقابل بعضها البعض (الشكل 1 أ).
- ضع الفطريات من نوع التزاوج (-) ، NRRL 1555 أو NRRL 1464 ، على بعد 1 سم على الأقل من حافة طبق بتري على المساعد الرقمي الشخصي أو CMA.
- على نفس اللوحة ، مقابل المكان الذي تم فيه وضع نوع التزاوج (-) وعلى بعد 1 سم من حافة طبق بتري ، ضع نوع التزاوج (+) ، NRRL 1554 أو NRRL1465 (الشكل 1 أ).
ملاحظة: ستؤثر المسافة بين أنواع التزاوج التكميلية على حجم الأنسجة المشاركة في الدورة الجنسية. تسمح أنواع التزاوج المتباعدة للفطريات بالتوسع أكثر ، مما سيزيد من عدد التفاعلات الجنسية بين الشريكين.
- للحصول على صليب رباعي اتجاهات ، ضع أنواع التزاوج المماثلة مقابل بعضها البعض ولكن بجوار نوع التزاوج التكميلي (الشكل 1 ب).
- ضع الجراثيم أو الفطريات من أنواع التزاوج (-) ، NRRL 1555 و NRRL 1464 ، مقابل بعضها البعض على بعد 1 سم على الأقل من حافة طبق بتري على المساعد الشخصي الرقمي أو CMA.
- في نفس اللوحة ، اختر موقعا بين نوعي التزاوج (-) وعلى بعد 1 سم على الأقل من حافة اللوحة وقم بتلقيح الموقع بالجراثيم أو الفطريات من نوع التزاوج (+) ، NRRL 1554 أو 1465.
- على نفس اللوحة ، مقابل المكان الذي تم فيه تلقيح نوع التزاوج الأول (+) وعلى بعد 1 سم على الأقل من اللوحة ، ضع نوع التزاوج الآخر (+).
- للحصول على 8 اتجاهات ، أنواع التزاوج البديلة على طول محيط طبق بتري ، والتي تضم أربعة من كل نوع من أنواع التزاوج (الشكل 1 ج).
- للحصول على صليب ثنائي الاتجاه ، ضع أنواع التزاوج التكميلية مقابل بعضها البعض (الشكل 1 أ).
- بعد التلقيح ، أغلق الألواح بالبارافيلم أو (اتركها غير محكمة الغلق) وضعها في وعاء ثانوي قبل الحضانة عند 22 درجة مئوية في الظلام. راقب الصفائح يوميا للحصول على دليل على التزاوج خلال هذه الفترة ، والتقط صورا من أسفل الصفيحة وتتبع الفطريات مع نمو الثقافات.
ملاحظة: بعد 24 ساعة من التلقيح ، توقع أن ترى الفطريات تتوسع في جميع أنواع الوسائط ولكن من غير المحتمل أن يكون الأفراد على اتصال في هذه المرحلة. - اعتمادا على نوع الوسائط (المساعد الشخصي الرقمي أو CMA) والتركيبة (25٪ ، 50٪ ، 100٪) ، إذا بدأت الفطريات في الاتصال ، فقم بفحص الفطريات لأنواع التزاوج التكميلية التي تتلامس تحت نطاق تشريح بحثا عن دليل على التزاوج. التقط صورا للفطريات المتفاعلة باستخدام كاميرا أو هاتف ذكي مثبت على نطاق التشريح.
- احصل على صور للفطريات وقم بربطها معا (على سبيل المثال ، باستخدام تطبيق Panorama Stitcher). استخدم ImageJ لتقدير مساحة الفطريات (انظر البرامج التعليمية عبر الإنترنت).
النتائج
بعد تقاطع رباعي الاتجاهات ، اختلفت كل سلالة قليلا في معدل نموها كما هو محدد من خلال التغير في مساحة الفطريات (الشكل 2). على الرغم من عدم وجود دلالة إحصائية ، إلا أن NRRL 1555 كان لديه تغيير أسرع في المساحة عند طلاءه بنسبة 25٪ CMA أو 25٪ PDA أو 100٪ PDA. وبالمثل ، كان لدى NRRL 1465 تغيير أعلى في المساحة عند نموه على 50٪ PDA أو CMA. كان لدى NRRL 1464 أسرع زيادة في المساحة عند نموها على CMA بنسبة 100٪. بعد 24 ساعة (1 نقطة في البوصة) ، بدت السلالات التي تنمو على المساعد الرقمي الشخصي أكثر صفراء مقارنة بالسلالات المزروعة على CMA (الشكل 3) - وقد ثبت سابقا أن المساعد الرقمي الشخصي يزيد من إنتاج الصبغة26. كان للسلالات على المساعد الشخصي الرقمي بنسبة 100٪ ، في المتوسط ، مقياس أعلى للمساحة بعد 24 ساعة (الجدول 1). هذا على النقيض من CMA 25٪ ، الذي كان له أصغر متوسط مساحة عند 1 نقطة في البوصة (الجدول 1).
لم يلاحظ الاتصال بين السلالات المجاورة حتى 2 نقطة في البوصة وفقط بين السلالات المزروعة على المساعد الرقمي الشخصي ، وخاصة المساعد الرقمي الشخصي بنسبة 100٪ (الشكل 4). لوحظ التزاوج على المساعد الشخصي الرقمي بنسبة 100٪ عند 2 نقطة في البوصة. لم تتلامس السلالات المزروعة على CMA عند 2 نقطة في البوصة ، على الرغم من أن CMA بنسبة 100٪ تتميز بسلالات نمت بالقرب من بعضها البعض (الشكل 4). بعد 3 أيام من الحضانة (3 نقطة في البوصة) ، أظهرت السلالات المزروعة على جميع تركيبات المساعد الشخصي الرقمي التزاوج ، على الرغم من اختلاف كثافة أنواع الخلايا المتمايزة (الجدول 2 والشكل 5). كما أظهرت نسخة مكررة واحدة من 25٪ CMA ونسخة مكررة واحدة من 50٪ CMA تزاوجا (الجدول 2). لم تظهر لوحات CMA المتبقية أي تزاوج (الجدول 2). ومن المثير للاهتمام ، أن السلالات المزروعة على المساعد الرقمي الشخصي يبدو أنها تحتوي على فطريات صفراء أكثر كثافة وخيوط هوائية ، والتي يمكن أن تتطور إلى sporangiophores (الشكل 5). بحلول 4 نقطة في البوصة ، كانت لوحات المساعد الشخصي الرقمي تظهر تفاعلات تزاوج جنبا إلى جنب مع sporangiophores اللاجنسية (الشكل 6). تحتوي صفائح CMA على سلالات ذات فطريات أكثر انتشارا وعدد أقل من الأبواغ (الشكل 6). لم يلاحظ التزاوج على CMA بنسبة 100٪ (الجدول 2).
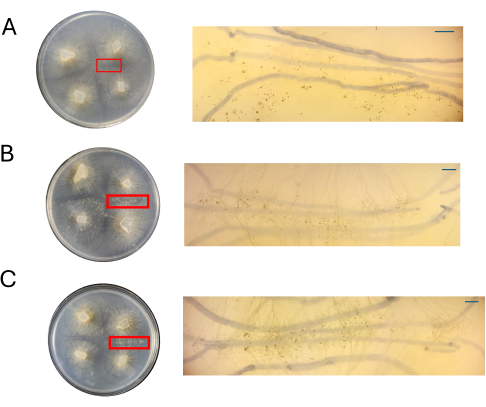
لوحظت الصفائح التمثيلية تحت نطاق تشريح عند 4 نقطة في البوصة لتقييم ما إذا كان يمكن ملاحظة أنواع الخلايا المرتبطة ببداية الدورة الجنسية بسهولة. بشكل عام ، ارتبط انخفاض تركيز العناصر الغذائية بالفطريات الجنسية الأقل كثافة ومتمايزة من الناحية النوعية (الشكل 7 والشكل 8). عندما تنمو على المساعد الشخصي الرقمي بنسبة 100٪ ، لا يمكن تصور البيضة المائية الهوائية الفردية أو progametangia وظهرت ككتلة من الخلايا (الشكل 7 أ). بينما يبدو أن 50٪ و 25٪ PDA لهما كثافة خلايا أقل في موقع التزاوج ، فإن لوحات المساعد الرقمي الشخصي بنسبة 25٪ تتميز بخلايا يمكن تمييزها بسهولة (الشكل 7 ب ، ج). عند مقارنة أنواع الخلايا التي لوحظت في 50٪ PDA إلى 25٪ PDA ، بدا أن تلك الموجودة في التركيز المنخفض هي في الغالب من نفس النوع ، بينما عند التركيز الأعلى ، كان هناك مزيج من الخلايا في مراحل مختلفة (الشكل 7D ، E). والجدير بالذكر ، مع 50٪ من المساعد الرقمي الشخصي ، تضمنت الخلايا التي لوحظت عند 4 نقطة في البوصة البيضة الملقحة الهوائية التي ظهرت للتو (الشكل 7D ، علامة النجمة) وبعضها كان ينتقل إلى progametangia (الشكل 7D ، السهم). مع 25٪ من المساعد الرقمي الشخصي ، بدا أن معظم الخلايا في مراحل نمو متشابهة جدا (الشكل 7E).
تم تقييم لوحات التركيزات المختلفة من CMA جنبا إلى جنب مع لوحات المساعد الرقمي الشخصي عند 4 نقطة في البوصة (الشكل 8). كما ذكرنا سابقا ، لم يلاحظ التزاوج عند استخدام CMA بنسبة 100٪ (الشكل 8 أ). عند 50٪ CMA أو 25٪ CMA ، لوحظ التزاوج وكان العدد الإجمالي لأنواع الخلايا المرتبطة بالتكاثر الجنسي أقل (الشكل 8 ب ، ج). يبدو أن الزيجوفورات الهوائية التي لوحظت عند 4 نقطة في البوصة لها نفس الحجم والارتفاع عبر منطقة التفاعل (الشكل 8 ب ، ج). نظرا لانخفاض العدد الإجمالي للخلايا المشاركة في الدورة الجنسية ، يمكن افتراضيا استئصالها باستخدام شفرات حلاقة معقمة أو إبر تشريح وتجميدها على الفور في النيتروجين السائل لعزل الحمض النووي الريبي في اتجاه مجرى النهر. قد تؤدي القدرة على تحديد هياكل محددة في نفس المرحلة الزمنية التنموية إلى زيادة متانة دراسات التعبير الجيني التي تسعى إلى ربط التغيرات المورفولوجية بالجينات.
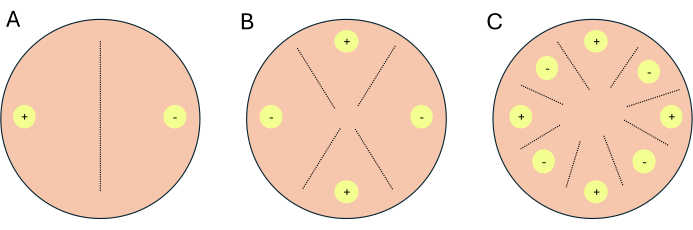
الشكل 1: تخطيطي من ثلاثة تنسيقات متقاطعة. (أ) صليب ثنائي الاتجاه مع موقعين للتلقيح (دوائر صفراء) مع أنواع التزاوج التكميلية (+) و (-). (ب) صليب من 4 اتجاهات مع موقعين للتلقيح من نوع التزاوج (+) (دوائر صفراء مع +) وموقعين للتلقيح من نوع التزاوج (-) التزاوج (دوائر صفراء مع -). (ج) تهجين من 8 اتجاهات مع مواقع تلقيح متناوبة (دوائر صفراء) من أنواع التزاوج التكميلية (+) و (-). تمثل الخطوط المتقطعة الموقع المتوقع لتفاعلات التزاوج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
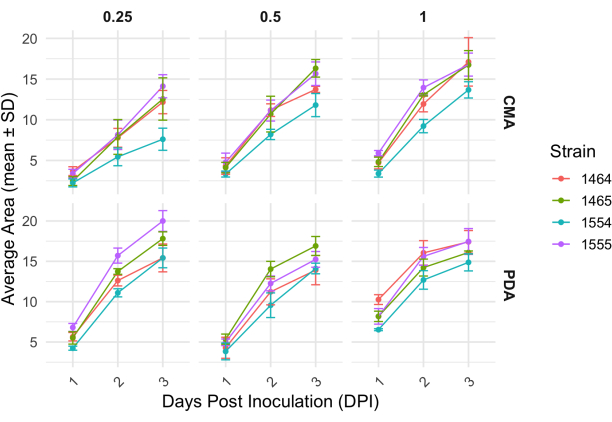
الشكل 2: التغيير في المساحة بمرور الوقت لكل سلالة على CMA و PDA بتركيزات مختلفة. متوسط مساحة P. blakesleeanus مستعمرات تم رسمها على مدى 3 أيام بعد التلقيح. تمثل أشرطة الخطأ الانحراف المعياري للمساحة المتوسطة. انظر أيضا الجدول 1. تم إنشاء المؤامرات باستخدام ggplot227. الاختصار: DPI = أيام بعد التطعيم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
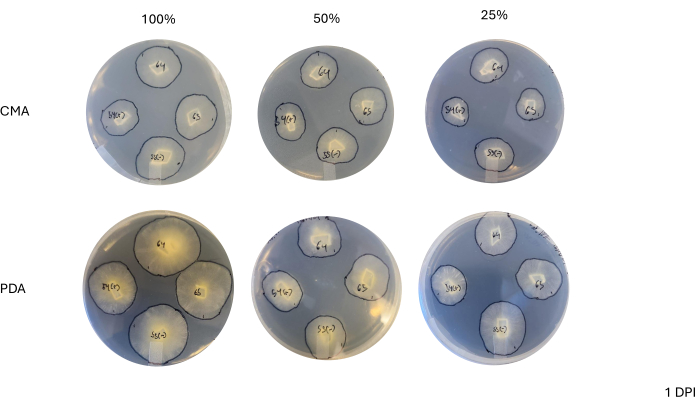
الشكل 3: صور تمثيلية للصلبان ذات 4 اتجاهات في يوم واحد بعد التطعيم. تظهر مقارنة المستعمرات اختلافات عبر نوع الوسائط وصياغتها ، مما يسلط الضوء على أن المستعمرات على المساعد الرقمي الشخصي بنسبة 100٪ تظهر صفراء أكثر من CMA وأن النمو يظهر بشكل أسرع على المساعد الرقمي الشخصي بنسبة 100٪. تم التقاط الصور من قاع طبق بتري. تم رسم خطوط سوداء بعلامة لتحديد الفطريات. الاختصارات: CMA = أجار دقيق الذرة. المساعد الشخصي الشخصي = أجار سكر العنب البطاطس. DPI = أيام بعد التلقيح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: صور تمثيلية للصلبان ذات 4 اتجاهات بعد يومين من التطعيم. تسلط مقارنة المستعمرات الضوء على الكثافة الظاهرة لنمو الفطريات ، حيث يبدو أن المستعمرات الموجودة على القناة الشريانية السالكة تحتوي على فطريات أكثر كثافة من تلك الموجودة على CMA. بالإضافة إلى ذلك ، تظهر المستعمرات الموجودة على المساعد الرقمي الشخصي أكثر صفراء ومعظمها إما اتصل أو يقترب من نقطة الاتصال. تسلط رؤوس الأسهم الحمراء الضوء على المناطق التي بدأت فيها تفاعلات التزاوج ، كما يتضح من زيادة كثافة الأنسجة. هذا على عكس المستعمرات الموجودة على CMA حيث يقترب فقط أولئك الذين يتناولون CMA بنسبة 100٪ من الاتصال ، وتتميز جميع تركيبات CMA بمستعمرات أقل صفراء نسبيا مقارنة بتلك الموجودة على المساعد الرقمي الشخصي ولم يبدأ أي منها في التزاوج. تم التقاط الصور من قاع طبق بتري. تم رسم خطوط سوداء بعلامة لتحديد الفطريات. الاختصارات: CMA = أجار دقيق الذرة. المساعد الشخصي الشخصي = أجار سكر العنب البطاطس. DPI = أيام بعد التلقيح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
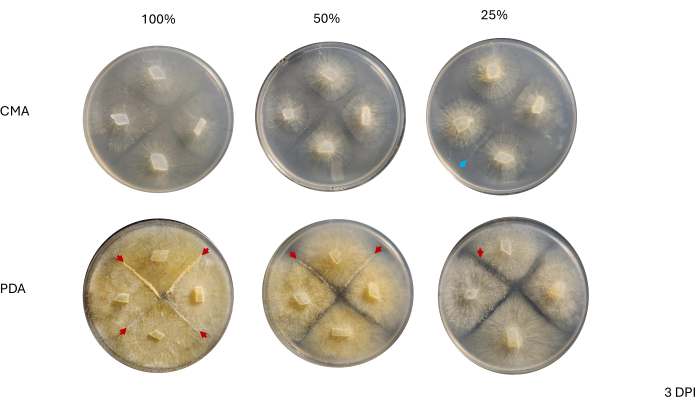
الشكل 5: صور تمثيلية للصلبان ذات 4 اتجاهات بعد 3 أيام من التطعيم. تسلط مقارنة المستعمرات بين نوعي الوسائط الضوء على أن كثافة الفطريات تكون أعلى عند زراعتها على المساعد الرقمي الشخصي مقارنة ب CMA. تبرز رؤوس الأسهم الحمراء أن جميع صفائح المساعد الرقمي الشخصي تستضيف موقعا واحدا على الأقل لتفاعلات التزاوج. لم تتلامس المستعمرات الموجودة على 100٪ CMA و 50٪ CMA ، لكن مستعمرتين على 25٪ CMA (السهم الأزرق) قد اتصلت. تم التقاط الصور من فوق طبق بتري. الاختصارات: CMA = أجار دقيق الذرة. المساعد الشخصي الشخصي = أجار سكر العنب البطاطس. DPI = أيام بعد التلقيح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
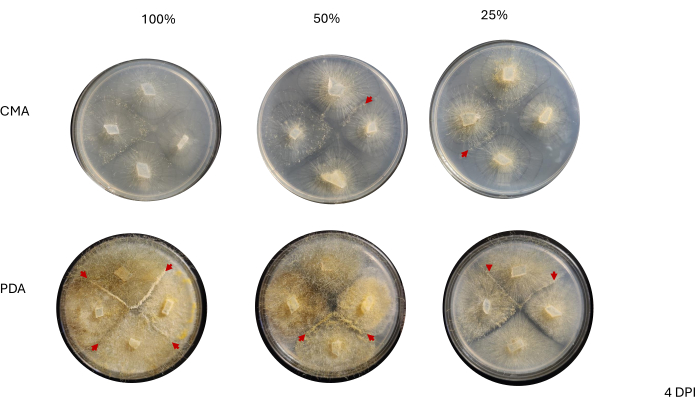
الشكل 6: صور تمثيلية للصلبان ذات 4 اتجاهات بعد 4 أيام من التطعيم. تستضيف جميع المستعمرات الموجودة على المساعد الرقمي الشخصي تفاعلا واحدا على الأقل من التزاوج (الأسهم الحمراء) وتعرض فطريات صفراء. بالإضافة إلى ذلك ، تظهر المستعمرات الموجودة على القناة الشريانية السالكة نموا مكثفا للخيوط الهوائية (أي الأبوغية اللاجنسية) التي قد تعيق مراقبة تفاعلات التزاوج. تظهر المستعمرات الموجودة على 50٪ و 25٪ CMA أيضا دليلا على تفاعلات التزاوج (رؤوس الأسهم الحمراء) ولديها نمو خيوطي هوائي أقل مقارنة بتلك الموجودة على القناة الشريانية السالكة. تم التقاط الصور من فوق طبق بتري. الاختصارات: CMA = أجار دقيق الذرة. المساعد الشخصي الشخصي = أجار سكر العنب البطاطس. DPI = أيام بعد التلقيح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: صور التهجين على المساعد الرقمي الشخصي. (أ) 100٪ PDA ، (B) 50٪ PDA ، و (C) 25٪ PDA. تم تكبير المناطق ذات الأهمية (مستطيلات حمراء). تم الحصول على جميع الصور بدقة 4 نقاط في البوصة. يسلط عرض إضافي ل (D) 50٪ PDA الضوء على وجود خلايا تتكاثر جنسيا في مراحل مختلفة: zygophores الجوي الصغير: العلامات النجمية. الزيجوفور الجوي القديم: الأسهم الحمراء. (ه) يظهر 25٪ من المساعد الرقمي الشخصي خلايا تتكاثر جنسيا في مراحل مختلفة ، على الرغم من أن هذا الرأي التمثيلي يظهر ازدحاما أقل لهذه الهياكل مقارنة ب 50٪ من المساعد الرقمي الشخصي. أشرطة المقياس = 1 مم (A-C) ، 0.5 مم (D ، E). الاختصارات: المساعد الشخصي الرقمي = أجار سكر العنب البطاطس. DPI = أيام بعد التلقيح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 8: صور الصلبان على CMA. (أ) 100٪ CMA ، (B) 50٪ CMA ، و (C) 25٪ CMA مع تكبير مناطق الاهتمام. يتم ملاحظة الهياكل الجنسية المميزة بسهولة ل 50٪ (B) و 25٪ (C) CMA ، والازدحام ضئيل. لا توجد هياكل جنسية على CMA بنسبة 100٪ في هذه النقطة الزمنية. تم الحصول على جميع الصور بدقة 4 نقاط في البوصة. تم الحصول على صور طبق بتري وصور نطاق تشريح من فوق طبق بتري. يتم رسم الخطوط الداكنة في خلفيات صور نطاق التشريح بعلامة سوداء تم استخدامها لتتبع تمدد الفطريات. أشرطة المقياس = 1 مم. الاختصارات: CMA = أجار دقيق الذرة. DPI = أيام بعد التلقيح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: مساحة الفطريات لكل سلالة على مدار 4 أيام. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: التقييم الزوجي للتلامس والتزاوج لكل سلالة على وسائط مختلفة. 0 = لا ، 1 = نعم. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
بروتوكول بسيط للحث على التكاثر الجنسي في P. blakesleeanus في بيئة معملية يتم تقديمه هنا. أحد أهم الاعتبارات لهذا البروتوكول هو الحد من المغذيات. من المفترض أن الفطريات اختارت التكاثر الجنسي كرد فعل على الظروف البيئية القاسية مثل الحد من المغذيات6،28،29،30،31،32. يمكن أن يؤدي تغيير مستوى العناصر الغذائية إلى إبلاغ التصميم التجريبي. على سبيل المثال ، إذا كان الباحث مهتما بمقارنة الجينات المعبر عنها في البيضة الملقحة الهوائية مقابل gametangia ، التوصية بقيود أكثر تطرفا على المغذيات (مثل 25٪ CMA) لأن كثافة الهياكل الجنسية ستكون أقل مقارنة بالتركيبات الأعلى من CMA أو PDA. تعني الكثافة المنخفضة للهياكل الجنسية ، مثل ما لوحظ بنسبة 50٪ أو 25٪ CMA أن عزل نوع معين من الخلايا المتمايزة لن يكون أسهل فحسب (حيث يمكن التعرف على الخلايا واستئصالها بسهولة) ولكن سيضمن أيضا أخذ عينات من نوع الخلية محل الاهتمام فقط.
سيستفيد المتدربون أو الطلاب أيضا من هذا البروتوكول لأنه يمكن هذه المجموعة من تتبع تمايز الخلايا والتمييز بشكل موثوق بين أنواع الخلايا المختلفة التي تتطور خلال الدورة الجنسية P. blakesleeanus . يعكس استخدام CMA و PDA العمل السابق على تحريض تزاوج الفطريات المخاطية18،22،23 ، وأشكال المسحوق متاحة للشراء ، مما يجعلها من بين الخيارات الأكثر سهولة للوسائط في بيئة تدريبية أو تعليمية مقارنة بالوسائط الاصطناعية الأخرى.
نظرا لأن الهدف من هذا البروتوكول هو في النهاية إظهار التطور والتمايز ، وقد تمت الإشارة إلى أن تركيز المغذيات يؤثر على ما إذا كان يمكن ملاحظة أنواع الخلايا المتميزة بسهولة ، فإن الخطوة الحاسمة في هذا البروتوكول هي ضمان تكوين الوسائط المناسب (قسم البروتوكول 1). إذا لم تتم إضافة مسحوق أجار إضافي إلى المساعد الرقمي الشخصي المخفف أو CMA المخفف ، فقد لا تصلب الوسائط بشكل صحيح ، وقد لا يمكن ملاحظة تفاعلات التزاوج اللاحقة بسهولة. بالإضافة إلى ذلك ، يجب إيلاء اهتمام وثيق لوضع أنواع التزاوج التكميلية وما شابهها (قسم البروتوكول 2). نظرا لأن P. blakesleeanus غير متجانس ، فإنه يتطلب شريكا تكميليا للتزاوج ، وإذا تعذر الوصول إلى هذا الشريك أو تم استخدام نوع التزاوج المماثل بدلا من ذلك ، فلن يحدث التزاوج10،33،34.
أحد قيود هذا البروتوكول هو التطور غير المتزامن للهياكل الجنسية. P. blakesleeanus ، مثل الفطريات الأخرى المزروعة على الوسائط الصلبة ، يتوسع شعاعيا في جميع الاتجاهات. هذا يعني أن أجزاء من الفطريات ستكون في مراحل أكثر تقدما من الدورة الجنسية من غيرها. توجد بروتوكولات لمزامنة التطور الجنسي في الفطرياتالفطرية 35 ، ولكن لم يتم تكييفها بنجاح مع خميات الغشاء المخاطي. هذا يعني أن العمل الذي يبحث في التعبير الجيني أثناء الدورة الجنسية سيتعرض للضوضاء إذا كان عدد كبير جدا من الخلايا في مراحل نمو مختلفة. بالنظر إلى الملاحظات الواردة في هذه الدراسة ، يبدو أنه في حين أن الحد من توافر المغذيات يؤدي إلى عدد أقل من الخلايا التكاثرية جنسيا بشكل عام ، يبدو أن الخلايا التي تمت ملاحظتها في مراحل مماثلة من التطور. لذلك ، قد يساعد الحد من العناصر الغذائية في الحد من كثافة الهياكل الجنسية المتمايزة ، مما يمنح الباحث إمكانية الوصول إلى الأنسجة المتزامنة في الغالب على حساب الغلة المنخفضة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
نود أن نشكر اللجنة التنفيذية للعلوم الطبيعية في كلية كولورادو ، وقسم علم الأحياء والبيئة العضوية ، وصندوق عائلة هيفي لأبحاث الطلاب لتمويل هذا العمل. كما نعرب عن امتناننا لأليس كيلر وتيا هاتشنز على دعمهما الفني.
Materials
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
References
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved