Method Article
הכלאות מיניות עם Mucoromycete Phycomyces blakesleeanus
In This Article
Summary
כאן אנו מציגים פרוטוקול בסיסי לאינדוקציה של הזדווגות P. blakesleeanus .
Abstract
Phycomyces blakesleeanus, פטרייה חוטית בתוך פילום Mucoromycota, נבדלת ביכולתה המדהימה לתפיסה סביבתית ותגובות אדפטיביות. בעוד שעבודות קודמות הראו כי גירויים סביבתיים, כולל כוח משיכה, אור, לחות וזמינות חומרים מזינים, משפיעים על דינמיקת הצמיחה ואסטרטגיות הרבייה שלו, המנגנונים הבסיסיים נותרו תחום מחקר מרכזי. רמזים סביבתיים מעוררים רבייה מינית או א-מינית. רבייה מינית מתחילה באיתות פרומון, המעורר משיכה כימית היפאלית, ובסופו של דבר מוביל למעברים מורפולוגיים סדרתיים שמגיעים לשיאם בהיווצרות זיגוספור.
בסביבת מעבדה, הכלאות של P. blakesleeanus גורמות לתפטיר משלים לעבור את המחזור המיני בשלבים שונים. מטרת העבודה שלנו היא לבדוק אם רמזים סביבתיים יכולים לעורר הזדווגות על פני התפטיר של P. blakesleeanus. הכלאות של P. blakesleeanuהגדלות על מדיה מוגבלת בחומרים מזינים יהיו חשופות לאגר מוגבל בחומרים מזינים כדי לעורר תגובה מינית בהתאם למחסור בחומרים מזינים. הפעלה מוצלחת של הזדווגות ב-P. blakesleeanus תקל על מחקרים עתידיים הדורשים כמות גדולה של תפטירים המתרבים מינית בשלבים ספציפיים. תוצאות מחקר זה ישפרו עוד יותר את הבנתנו כיצד מנגנוני הרבייה של P. blakesleeanus מושפעים מגורמים סביבתיים, ויתרמו לבסיס הידע הרחב יותר על רבייה מינית של פטריות חוטיות.
Introduction
השראת הזדווגות במערכות פטרייתיות בתנאי מעבדה קידמה את ההבנה של גנטיקה אאוקריוטית, ביולוגיה של התא, ביולוגיה אבולוציונית וביוטכנולוגיה. פטריות הדיקריאניות, במיוחד ה-Ascomycota, מציגות את הידע הנרחב ביותר על אינדוקציה של הזדווגות בסביבת מעבדה1. מעניין שהפטרייה הראשונה שבה הוצעה רבייה מינית, Syzygites megalocarpus, אינה חברה ב-Ascomycota, אלא חברה בפילום Mucoromycota2. הפילום Mucoromycota היא קבוצה מוקדמת שסווגה בעבר כ-"Zygomycota" אך נחשבת כיום לאחות לשושלות דיקריות 3,4. ה-Mucoromycota, יחד עם Zoopagomycota, הם בעלי משמעות אבולוציונית מכיוון שפילות אלה מייצגות את המעבר של פטריות למערכות אקולוגיות יבשתיות 4,5. כמו פטריות אחרות, ה-Mucoromycetes משתמשים באסטרטגיות רבייה א-מיניות ומיניות בתגובה לסביבתם 3,6. בתנאים מוגבלים בחומרים מזינים, מוקורומיצטים יתחילו את המחזור המיני6. מוקורומיצטים מציגים מנגנוני הזדווגות הומוטליים והטרוטליים כאחד, כאשר התאימות נקבעת על ידי הגנים מסוג ההזדווגות sexM ו-sexP, המסומנים כ-(-) ו-(+) בהתאמה 7,8,9.
Blakeslee10 הדגיש את הרגישות של המחזור המיני של mucoromycete לתנאים חיצוניים, וציין כי לחות היא קריטית להיווצרותם וכי זמינות החומרים המזינים במצע ממלאת תפקיד משמעותי. סוגי הזדווגות משלימים מתחילים את המחזור המיני באמצעות סינתזה שיתופית של חומצות טריספוריות (TA) תוך שימוש בבטא-קרוטן כקודמן 11,12,13. לאחר גילוי TA, הקורים הצמחיים המגיבים מתעבים והופכים לזיגופורים מסועפים מאוד 14,15,16. הזיגופורים ממשיכים לייצר TA ומשיכה כימית הדדית. ב-P. blakesleeanus, זיגופורים מתמיינים בתוך המצע ואינם נראים בקלות על מצע אגר מוצק17. ביצירת מגע, הזיגופורים משתלבים זה בזה והופכים לזיגופורים אוויריים.
ככל שהמחזור המיני נמשך, קצות הזיגופורים מתחברים, ומרכז התאים נדחף החוצה ליצירת מבנה דמוי טבעת עם נפיחות אלמוגית בבסיס, ומשלימה את המעבר לפרוגמטנגיום. קצות התאים היוצרים את הפרוגמטנגיום מתחילים להתמזג ולהתפתח לגמטנגיום. בשלב הגמטנגיה, הזיגופורים מציגים קישוטים דמויי קוצים. דופן התא בקצוות מתמוססת ומופיעות מחיצות הרפתקניות, התוחמות את האזור שבו ייווצר הזיגוספור, והזיגופורים פועלים כמתלים דמויי מלקחיים18. הזיגוספור יהפוך לפיגמנטי ככל שדופן התא שלו מתעבה והוא מקבל קישוט נוסף דמוי קוץ17,18. לאחר היווצרותו, הזיגוספור ייכנס לתקופה של תרדמה לפני שיתחיל מחדש את מחזור הגדילה.
Phycomyces blakesleeanus הוא רירית הטרותאלית הבולטת בתאים הגדולים שלה ובספורנגיופורים המגיבים לסביבה 6,8,18. אורגניזם זה מעובד בקלות במעבדה וניתן לראות את חלקי המחזור המיני המובילים להיווצרות זיגוספורים בטווח של 8-10 ימים. כמודל, P. blakesleeanus נבדק על יכולתו לחוש אור בסביבתו17,19. קלות הטיפוח והיכולת לגרום להזדווגות הפכו אותו גם למודל אידיאלי לחקר המנגנון שמאחורי יכולתו לקלוט אור20; ממצאים אלה הדגישו גם את השימור האבולוציוני של מנגנוני חישת אור בפטריות. ב-P. blakesleeanus, הוכח כי האור מעכב רבייה מינית באמצעות חלבוני חישת אור משומריםאלה 21. מחקרים התפתחותיים אבולוציוניים אחרונים ביקשו להבין אילו גנים תורמים להתמיינות תאים במהלך המחזור המיני P. blakesleeanus 6. מתאם מורפוגנזה לגנים ספציפיים ידרוש בידוד מספיק רקמה מאותם סוגי תאים לביצוע מחקרי ביטוי גנים.
בעוד שפרוטוקולים להשראת הזדווגות של P. blakesleeanus בסביבת מעבדה תוארו בעבר, חלקם מזכירים רק את סוג המדיום לשימוש ואת הזנים הרלוונטיים18. חלק מתיאורי הפרוטוקול אינם כוללים ניסוח מדיה ספציפי אך מתארים היכן למקם סוגי הזדווגות משלימים משוערים על לוח10. פרוטוקולים עדכניים יותר מאפשרים ייצור מוגבר של זיגוספורים על ידי ערבוב נבגים מכל סוג הזדווגות וחיסון בתרחיף נבגים מעורב21 או על ידי הצבת סוגי הזדווגות במרחק מה זה מזה ומתן אפשרות לתרבית לדגור במשך 20 יום22. גישות אלו שימושיות ליצירת תאים ממוינים בשפע, במיוחד זיגוספורים, אך ייתכן שלא יתאימו לתצפית על מהלך זמן התפתחותי או לבחירת מבנים מיניים הנוצרים לפני זיגוספורים עבור טרנסקריפטומיקה של תא בודד. עבודות אחרות התייחסו לכך על ידי הצבת סוגי הזדווגות משלימים במרחק זה מזה על מצע מוצק כדי לאפשר תצפית על מעברים מורפולוגיים סדרתיים עם תחילת המחזור המיני 6,22,23. כמו במקרה של פטריות אחרות, תפטיר P. blakesleeanus מתרחב רדיאלית24,25. לכן, כאשר מגדלים סוגי הזדווגות משלימים על אותה צלחת, חלקים שונים של התפטיר שלהם יבואו במגע בזמנים שונים. מכיוון שמגע בין תפטירים הוא אחד הצעדים הראשונים במחזור המיני של P. blakesleeanus, המשמעות היא שחלקים שונים של תפטיר אינטראקציה יהיו בשלבים שונים במחזור המין. אסינכרוני זה יכול להשפיע על התוצאה של מחקר ביטוי גנים, כך שאם סוגי תאים מובחנים מעורבבים ואם יש להם תוכניות ביטוי גנים מובהקות, יהיה קשה לייחס את תפקידו של גן למבנה מסוים אחד.
בנוסף לערכו של P. blakesleeanus כמודל לבחינת גנים המעורבים במורפוגנזה במהלך המחזור המיני, צמיחתו הנמרצת ויכולתו להתמיין בטווח של מספר ימים הופכים אותו לפטרייה אידיאלית להכשרת סטודנטים המעוניינים בפטריות חוטיות מתפצלות מוקדמות ולשימוש במסגרת כיתה לתואר ראשון כדי ללמוד על מגוון הפטריות ותהליכי ההתפתחות שלהן. הפרוטוקול המוצג כאן עושה שימוש בשלושה ריכוזים של שני סוגים שונים של מדיה כדי להדגים את ההשפעה של זמינות חומרים מזינים על מראה התפטיר, השראת הזדווגות והעשרה למבנים מיניים מסוימים, בין אם לכימות או תצפית או טרנסקריפטומיקה פוטנציאלית של תא בודד.
Protocol
1. הכנת מדיה
- השעו אבקת אגר קמח תירס (CMA) או אגר דקסטרוז תפוחי אדמה (PDA) במים נטולי יונים. עבור 100% CMA או PDA, עקוב אחר הוראות היצרן והשהה 17 גרם CMA ב-1 ליטר מים נטולי יונים או 39 גרם PDA ב-1 ליטר מים נטולי יונים. עבור N% CMA או PDA, יש להשעות 1/N מהכמות המומלצת על ידי היצרן ולהוסיף אגר נוסף כדי להשיג ריכוז אגר של 7.5% (w/v).
הערה: שלב אופציונלי: לפני החיטוי, הוסף 25 מיקרוגרם/מ"ל של כלורמפניקול אם יש חשש לזיהום חיידקי. - יש לעקר מדיה בחיטוי, בטמפרטורה של 121 מעלות צלזיוס למשך 15 דקות.
- יש לקרר את המדיה ל-~60 מעלות צלזיוס על ידי הנחתה למשך 30 דקות באמבט מים המוגדר ל-60 מעלות צלזיוס.
הערה: אם ניתן להחזיק את בקבוק המדיה החם במשך 6 שניות עם מעט או ללא אי נוחות, אז הוא מוכן למזיגה. - יוצקים צלחות בתנאים אספטיים בקולט אדים או בארון בטיחות ביולוגי. הטו את בקבוק המדיה על צלחת פטרי פתוחה וריקה ומזגו רק מספיק כדי לכסות לחלוטין את התחתית.
- לחלופין, השתמש בפיפטה סרולוגית מזכוכית והכניס פיפטה של 20 מ"ל מדיה לכל צלחת.
הערה: גישה זו מגדילה את הזמן שבו בקבוק המדיה נמצא בטמפרטורה נמוכה יותר ומעלה את הסיכון להתמצקות מוקדמת של האגר.
- לחלופין, השתמש בפיפטה סרולוגית מזכוכית והכניס פיפטה של 20 מ"ל מדיה לכל צלחת.
- אפשר למדיה להתאחד מחדש. אחסן את הצלחות בטמפרטורה של 4 מעלות צלזיוס אם לא משתמשים בהן מיד.
2. הכנת נבגים פטרייתיים או רקמות
- השג תרביות מכל סוג הזדווגות של P. blakesleeanus (למשל, NRRL 1555 (-), NRRL 1554 (+), NRRL 1464 (-) ו-NRRL 1465 (+)). כדי לחסן הכלאות עם נבגים, יש לגדל תחילה כל סוג הזדווגות בתרבית טהורה על 100% CMA או PDA
- חותכים חלק מהתפטיר המובילים מתרביות קיימות ומניחים את התפטיר שנכרת על צלחת 100% CMA/PDA. דגרו על תרביות טהורות למשך שבוע בטמפרטורה של 27 מעלות צלזיוס במחזור אור של 12 שעות.
- ברגע שספורנגיופורים נוכחים, הציפו תרבית טהורה נבגית עם 0.01% טווין 20 במים מעוקרים ונטולי יונים בטכניקה אספטית. בעזרת מיקרופיפטה P1000, שואבים 1.0 מ"ל מתערובת 20 הנבגים מהצלחת לתוך צינור מיקרו-צנטריפוגה.
- צנטריפוגה במיני צנטריפוגה למשך 30 שניות, ואז שפכו את הסופרנטנט.
- אם יש צורך בנבגים נוספים, המשך להוסיף 1.0 מ"ל מתערובת הנבגים Tween 20 לאותו צינור מיקרו-צנטריפוגה וחזור על שלב 2.4. לאחר השגת כמות מתאימה של נבגים, יש לשפוך את הסופרנטנט ולהחליף אותו ב-500 מיקרוליטר של מים סטריליים נטולי יונים.
- אופציונלי: השתמש בהמציטומטר כדי להעריך את ריכוז הנבגים, שיודיע אם יש צורך להוסיף עוד מים או אם יש צורך בצנטריפוגה מחדש של הנבגים.
- לחלופין, חסנו את הצלבים בתפטירים מובילים מהתרביות הטהורות.
- השתמש בסכין גילוח מעוקר או בחור חור שעם כדי לכרות את הרקמה ולצלחת את החיסון מיד.
- הגדירו את הצלבים כצלבים דו-כיווניים, צלבים ארבע-כיווניים או צלבים שמונים כיווניים (איור 1).
הערה: אם מוגדרים צלבים לעבודת תעתיק, מומלץ להגדיר 1-2 לוחות נוספים לכל מצב/מדיה שישמשו כלוחות חיווי. לוחות חיווי מאפשרים לחוקרים להגביל את החשיפה לאור ללוחות ניסוי, מכיוון שאור מעכב רבייה מינית ב-P. blakesleeanus.- עבור חצייה דו-כיוונית, הניחו סוגי הזדווגות משלימים זה מול זה (איור 1A).
- הנח את התפטיר מסוג ההזדווגות (-), NRRL 1555 או NRRL 1464, במרחק של לפחות 1 ס"מ מקצה צלחת פטרי על מחשב כף יד או CMA.
- על אותה צלחת, מול המקום שבו הוצב סוג ההזדווגות (-) ובמרחק של סנטימטר אחד מקצה צלחת הפטרי, הניחו את סוג ההזדווגות (+), NRRL 1554 או NRRL1465 (איור 1A).
הערה: המרחק בין סוגי הזדווגות משלימים ישפיע על גודל הרקמה המשתתפת במחזור המין. סוגי הזדווגות רחוקים יותר זה מזה מאפשרים לתפטיר להתרחב יותר, מה שיגדיל את מספר האינטראקציות המיניות בין שני בני הזוג.
- עבור חצייה ארבע-כיוונית, מקמו כמו טיפוסי הזדווגות זה מול זה, אך שכנים לסוג הזדווגות משלים (איור 1B).
- הניחו את הנבגים או התפטירים של סוגי ההזדווגות (-), NRRL 1555 ו-NRRL 1464, זה מול זה במרחק של לפחות 1 ס"מ מקצה צלחת פטרי על מחשב כף יד או CMA.
- באותה צלחת, בחר מיקום בין שני סוגי ההזדווגות (-) ובמרחק של לפחות 1 ס"מ מקצה הצלחת וחסן את האתר בנבגים או בתפטירים מסוג ההזדווגות (+), NRRL 1554 או 1465.
- על אותה צלחת, מול המקום שבו חוסן סוג ההזדווגות הראשון (+) ובמרחק של לפחות 1 ס"מ מהצלחת, הניחו את סוג ההזדווגות השני (+).
- עבור הצלבה של 8 כיוונים, סוגי הזדווגות לסירוגין לאורך ההיקף של צלחת הפטרי, הכוללים ארבעה מכל סוג הזדווגות (איור 1C).
- עבור חצייה דו-כיוונית, הניחו סוגי הזדווגות משלימים זה מול זה (איור 1A).
- לאחר החיסון, אטמו את הצלחות עם פרפילם או (השאירו אותן לא אטומות) והניחו אותן בכלי משני לפני הדגירה ב-22 מעלות צלזיוס בחושך. התבוננו בצלחות מדי יום בחיפוש אחר עדויות להזדווגות ובמהלכו צלמו תמונות מתחת לצלחת ועקבו אחר התפטיר ככל שהתרביות גדלות.
הערה: לאחר 24 שעות לאחר החיסון, צפו לראות את התפטיר מתפשט בכל סוגי המדיה אך לא סביר שאנשים יהיו במגע בשלב זה. - בהתאם לסוג המדיה (PDA או CMA) והניסוח (25%, 50%, 100%), אם התפטיר מתחיל ליצור מגע, בדוק תפטירים של סוגי הזדווגות משלימים הנמצאים במגע תחת היקף ניתוח לעדויות להזדווגות. צלם תמונות של תפטירים באינטראקציה עם מצלמה או סמארטפון המותקן על טווח הניתוח.
- רכוש תמונות של תפטיר ותפור אותן יחד (למשל, באמצעות אפליקציית Panorama Stitcher). השתמש ב-ImageJ כדי להעריך את שטח התפטיר (ראה מדריכים מקוונים).
תוצאות
לאחר הכלאה של 4 כיוונים, כל זן השתנה מעט בקצב הגדילה שלו כפי שנקבע על ידי השינוי בשטח התפטיר (איור 2). למרות שלא היה מובהק סטטיסטית, ל-NRRL 1555 היה שינוי מהיר יותר בשטח כאשר הוא מצופה על 25% CMA, 25% PDA או 100% PDA. באופן דומה, ל-NRRL 1465 היה שינוי גבוה יותר בשטח כאשר גדל על 50% PDA או CMA. ל-NRRL 1464 הייתה העלייה המהירה ביותר בשטח כאשר גדל על 100% CMA. לאחר 24 שעות (1 DPI), זנים הגדלים על PDA נראו צהובים יותר ביחס לזנים שגדלו על CMA (איור 3)-PDA הוכח בעבר כמגביר את ייצור הפיגמנט26. לזנים על 100% PDA היה בממוצע מדד גבוה יותר של שטח לאחר 24 שעות (טבלה 1). זאת בניגוד ל-25% CMA, שהיה לו השטח הממוצע הקטן ביותר ב-1 DPI (טבלה 1).
מגע בין זנים שכנים לא נצפה עד 2 DPI ורק בין זנים שגדלו על PDA, במיוחד 100% PDA (איור 4). ההזדווגות נצפתה על 100% PDA ב-2 DPI. הזנים שגדלו על CMA לא יצרו מגע ב-2 DPI, אם כי 100% CMA הציגו זנים שגדלו קרוב מאוד זה לזה (איור 4). לאחר 3 ימי דגירה (3 DPI), זנים שגדלו על כל התכשירים של PDA הראו הזדווגות, אם כי צפיפות סוגי התאים המובחנים הייתה שונה (טבלה 2 ואיור 5). שכפול אחד של 25% CMA ושכפול אחד של 50% CMA הציגו גם הזדווגות (טבלה 2); לוחות ה-CMA הנותרים לא הראו הזדווגות כלשהי (טבלה 2). באופן מעניין, הזנים שגדלו על PDA נראו בעלי תפטירים צהובים צפופים יותר וקורים אוויריים, שיכולים היו להתפתח לספורנגיופורים (איור 5). ב-4 DPI, לוחות ה-PDA הראו תגובות הזדווגות לצד ספורנגיופורים א-מיניים (איור 6). ללוחות ה-CMA היו זנים עם יותר תפטירים מפוזרים ופחות ספורנגיופורים (איור 6). הזדווגות לא נצפתה ב-100% CMA (טבלה 2).
לוחות מייצגים נצפו תחת היקף ניתוח ב-4 DPI כדי להעריך אם ניתן לצפות בקלות בסוגי תאים הקשורים לתחילת המחזור המיני. באופן כללי, ירידה בריכוז החומרים המזינים הייתה בקורלציה עם תפטירים מיניים פחות צפופים ומובחנים מבחינה איכותית (איור 7 ואיור 8). כאשר גדלו על 100% PDA, לא ניתן היה לדמיין זיגופורים אוויריים בודדים או פרוגמטנגיה והופיעו כמסה של תאים (איור 7A). בעוד שנראה של-50% ו-25% PDA יש צפיפות תאים נמוכה יותר באתר ההזדווגות, לוחות ה-PDA של 25% הציגו תאים שניתן להבחין בהם בקלות (איור 7B,C). כאשר משווים את סוגי התאים שנצפו ב-50% PDA ל-25% PDA, אלה בריכוז הנמוך יותר נראו בעיקר מאותו הסוג, בעוד שבריכוז הגבוה יותר, היה ערבוב של תאים בשלבים שונים (איור 7D,E). יש לציין שעם 50% PDA, התאים שנצפו ב-4 DPI כללו זיגופורים אוויריים שזה עתה הופיעו (איור 7D, כוכבית) וכמה שעברו לפרוגמטנגיה (איור 7D, חץ). עם 25% PDA, נראה שרוב התאים נמצאים בשלבי התפתחות דומים מאוד (איור 7E).
לוחות של הריכוזים השונים של CMA הוערכו לצד לוחות ה-PDA ב-4 DPI (איור 8). כפי שצוין קודם לכן, הזדווגות לא נצפתה כאשר נעשה שימוש ב-100% CMA (איור 8A). ב-50% CMA או 25% CMA, נצפתה הזדווגות והמספר הכולל של סוגי תאים הקשורים לרבייה מינית היה נמוך יותר (איור 8B,C). הזיגופורים האוויריים שנצפו ב-4 DPI נראו באותו גודל וגובה על פני אזור האינטראקציה (איור 8B,C). בהתחשב במספר הכולל הנמוך יותר של תאים המשתתפים במחזור המין, ניתן היה לכרות אותם באופן היפותטי עם סכיני גילוח מעוקרים או מחטי ניתוח ולהקפיא מיד בחנקן נוזלי לבידוד RNA במורד הזרם. היכולת לבחור מבנים ספציפיים באותה נקודת זמן התפתחותית עשויה להגביר את החוסן של מחקרי ביטוי גנים המבקשים לקשר בין שינויים מורפולוגיים לגנים.
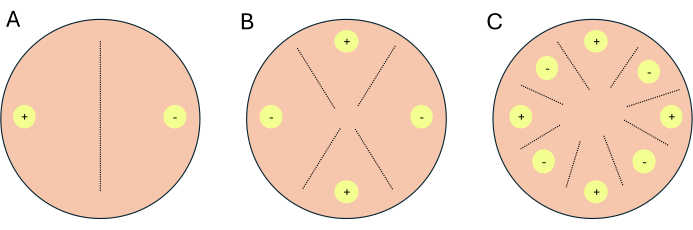
איור 1: סכמטי של שלושה פורמטים צולבים. (A) הכלאה דו-כיוונית עם שני אתרי חיסון (עיגולים צהובים) עם סוגי הזדווגות משלימים (+) ו-(-). (B) הכלאה ארבע-כיוונית עם שני אתרי חיסון מסוג (+) הזדווגות (עיגולים צהובים עם +) ושני אתרי חיסון מסוג (-) הזדווגות (עיגולים צהובים עם -). (C) הכלאה של 8 כיוונים עם אתרי חיסון מתחלפים (עיגולים צהובים) של סוגי הזדווגות משלימים (+) ו-(-). הקווים המקווקווים מייצגים את האתר החזוי של אינטראקציות הזדווגות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
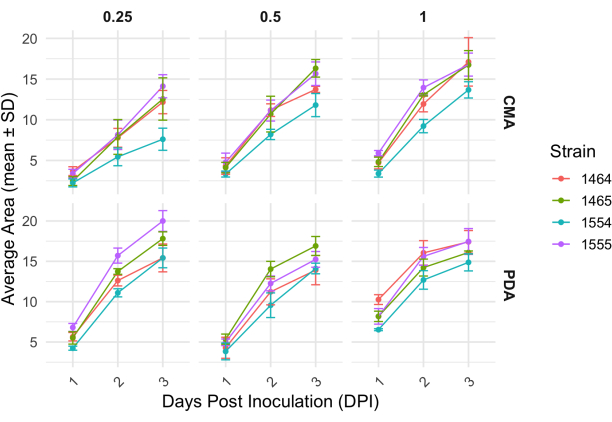
איור 2: שינוי בשטח לאורך זמן עבור כל זן על CMA ו-PDA בריכוזים שונים. השטח הממוצע של מושבות P. blakesleeanus תוכנן במשך 3 ימים לאחר החיסון. קווי שגיאה מייצגים את סטיית התקן של השטח הממוצע. ראה גם טבלה 1. עלילות נוצרו עם ggplot227. קיצור: DPI = ימים לאחר החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
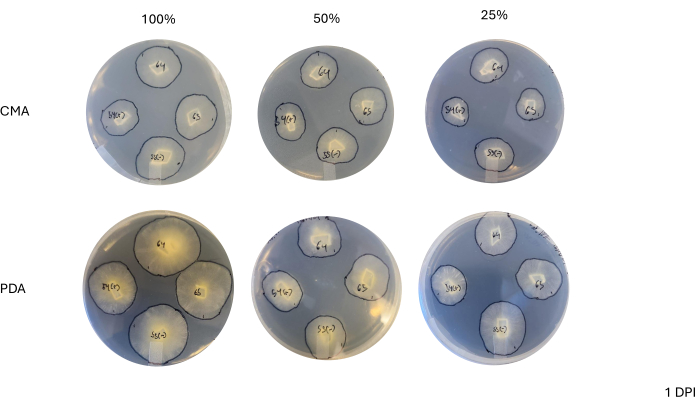
איור 3: תמונות מייצגות של צלבים 4 כיוונים ביום אחד לאחר החיסון. השוואה בין מושבות מראה הבדלים בין סוג המדיה והפורמולה, ומדגישה כי מושבות על 100% PDA נראות צהובות יותר מ-CMA וכי הצמיחה נראית מהירה יותר ב-100% PDA. התמונות צולמו מתחתית צלחת הפטרי. קווים שחורים שורטטו עם טוש כדי לתאר את התפטיר. קיצורים: CMA = אגר קמח תירס; PDA = אגר דקסטרוז תפוחי אדמה; DPI = ימים לאחר החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: תמונות מייצגות של הצלבות 4 כיווניות יומיים לאחר החיסון. השוואה בין מושבות מדגישה את הצפיפות לכאורה של צמיחת תפטיר, כאשר נראה כי למושבות על PDA יש תפטיר צפוף יותר מאלו על CMA. בנוסף, מושבות על PDA נראות צהובות יותר ורובן יצרו מגע או מתקרבות לנקודת המגע. ראשי החצים האדומים מדגישים אזורים שבהם החלו אינטראקציות הזדווגות, כפי שמעידה עלייה בצפיפות הרקמות. זאת בניגוד למושבות ב-CMA שבהן רק אלה עם 100% CMA מתקרבים למגע, וכל פורמולציות ה-CMA כוללות מושבות שהן פחות צהובות יחסית לאלו על PDA ואף אחת מהן לא החלה להזדווג. התמונות צולמו מתחתית צלחת הפטרי. קווים שחורים שורטטו עם טוש כדי לתאר את התפטיר. קיצורים: CMA = אגר קמח תירס; PDA = אגר דקסטרוז תפוחי אדמה; DPI = ימים לאחר החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
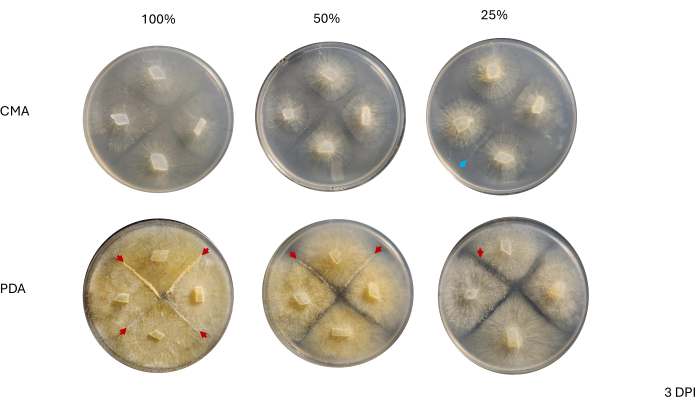
איור 5: תמונות מייצגות של צלבים 4 כיוונים 3 ימים לאחר החיסון. השוואה בין מושבות בין שני סוגי המדיה מדגישה שצפיפות התפטיר גבוהה יותר כאשר מגדלים אותה על PDA בהשוואה ל-CMA. ראשי החצים האדומים מדגישים שכל לוחות ה-PDA מארחים לפחות אתר אחד של אינטראקציות הזדווגות. המושבות על 100% CMA ו-50% CMA לא יצרו קשר, אך שתי מושבות על 25% CMA (חץ כחול) יצרו קשר. התמונות צולמו מעל צלחת הפטרי. קיצורים: CMA = אגר קמח תירס; PDA = אגר דקסטרוז תפוחי אדמה; DPI = ימים לאחר החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
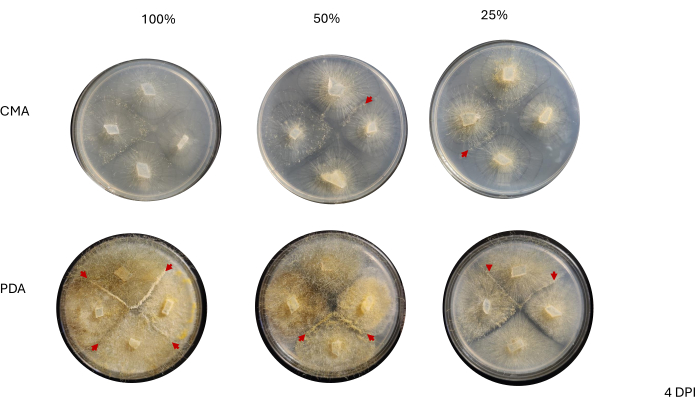
איור 6: תמונות מייצגות של צלבים 4 כיוונים 4 ימים לאחר החיסון. כל המושבות ב-PDA מארחות לפחות אינטראקציית הזדווגות אחת (חיצים אדומים) ומציגות תפטיר צהוב. בנוסף, המושבות על PDA מראות צמיחה נרחבת של קורים אוויריים (כלומר ספורנגיה א-מינית) שעלולה לעכב תצפית על אינטראקציות הזדווגות. המושבות על 50% ו-25% CMA מציגות גם עדויות לאינטראקציות הזדווגות (ראשי חץ אדומים) ויש להן פחות צמיחת קורים אווירית בהשוואה לאלו על PDA. התמונות צולמו מעל צלחת הפטרי. קיצורים: CMA = אגר קמח תירס; PDA = אגר דקסטרוז תפוחי אדמה; DPI = ימים לאחר החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: תמונות של צלבים על מחשב כף יד. (A) 100% PDA, (B) 50% PDA ו-(C) 25% PDA. אזורי העניין הוגדלו (מלבנים אדומים). כל התמונות נרכשו ברזולוציה של 4 DPI. תצוגה נוספת של (D) 50% PDA מדגישה את נוכחותם של תאים המתרבים מינית בשלבים שונים: זיגופורים אוויריים צעירים: כוכביות; זיגופורים אוויריים ישנים יותר: חיצים אדומים. (E) 25% PDA מציג תאים מתרבים מינית בשלבים שונים, אם כי השקפה מייצגת זו מראה פחות צפיפות של מבנים אלה בהשוואה ל-50% PDA. פסי קנה מידה = 1 מ"מ (AC), 0.5 מ"מ (D,E). קיצורים: PDA = אגר דקסטרוז תפוחי אדמה; DPI = ימים לאחר החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
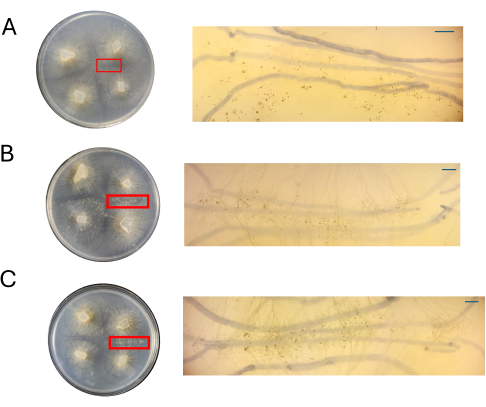
איור 8: תמונות של צלבים ב-CMA. (א) 100% CMA, (ב) 50% CMA ו-(ג) 25% CMA עם הגדלה של אזורי עניין. מבנים מיניים מובהקים נצפים בקלות עבור 50% (B) ו-25% (C) CMA, והצפיפות מינימלית. לא נראים מבנים מיניים ב-100% CMA בשלב זה. כל התמונות נרכשו ברזולוציה של 4 DPI. תמונות צלחת פטרי ותמונות היקף ניתוח התקבלו מעל צלחת הפטרי. הקווים הכהים ברקע של תמונות סקופ החיתוך מצוירים בטוש שחור ששימש למעקב אחר התפשטות התפטיר. פסי קנה מידה = 1 מ"מ. קיצורים: CMA = אגר קמח תירס; DPI = ימים לאחר החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה 1: אזור התפטיר עבור כל זן במשך 4 ימים. אנא לחץ כאן להורדת טבלה זו.
טבלה 2: הערכה זוגית של מגע והזדווגות עבור כל זן במדיות שונות. 0 = לא, 1 = כן. אנא לחץ כאן להורדת טבלה זו.
Discussion
פרוטוקול פשוט להשראת רבייה מינית ב-P. blakesleeanus בתנאי מעבדה מוצג כאן. אחד השיקולים הקריטיים ביותר לפרוטוקול זה הוא הגבלת חומרים מזינים. ההשערה היא שפטריות בחרו ברבייה מינית כתגובה לתנאים סביבתיים קשים כגון הגבלת חומרים מזינים 6,28,29,30,31,32. שינוי רמת החומרים המזינים יכול להודיע על תכנון הניסוי. לדוגמה, אם חוקר מעוניין להשוות את הגנים המתבטאים בזיגופורים אוויריים לעומת גמטנגיה, אז יומלץ על מגבלה תזונתית קיצונית יותר (כגון 25% CMA) מכיוון שצפיפות המבנים המיניים תהיה נמוכה יותר בהשוואה לפורמולציות גבוהות יותר של CMA או PDA. צפיפות נמוכה יותר של מבנים מיניים, כמו מה שנצפה עם 50% או 25% CMA פירושה שבידוד של סוג תא מובחן ספציפי לא רק יהיה קל יותר (מכיוון שהתאים יזוהו ויכרתו בקלות) אלא גם יבטיח שרק סוג התא המעניין נדגם.
מתלמדים או סטודנטים יפיקו תועלת גם מפרוטוקול זה מכיוון שהוא מאפשר לקבוצה זו לעקוב אחר התמיינות התאים ולהבחין באופן אמין בין סוגי התאים השונים המתפתחים במהלך המחזור המיני של P. blakesleeanus. השימוש ב-CMA ו-PDA משקף עבודה קודמת על השראת הזדווגות של mucoromycetes 18,22,23, וצורות אבקה זמינות לרכישה, מה שהופך אותן לבחירה הנגישה יותר של מדיה במסגרת הדרכה או חינוך בהשוואה למדיה סינתטית אחרת.
מכיוון שמטרת פרוטוקול זה היא בסופו של דבר להדגים התפתחות והתמיינות, וצוין כי ריכוז החומרים המזינים משפיע על השאלה אם ניתן לצפות בקלות בסוגי תאים מובחנים, שלב קריטי בפרוטוקול זה הוא הבטחת הרכב המדיה המתאים (סעיף פרוטוקול 1). אם לא מתווספת אבקת אגר נוספת למחשב כף יד או CMA מדולל, ייתכן שהמדיה לא תתמצק כראוי, וייתכן שלא ניתן יהיה להבחין בקלות באינטראקציות הזדווגות שלאחר מכן. בנוסף, יש להקדיש תשומת לב רבה למיקום של סוגי הזדווגות משלימים ודומים (סעיף פרוטוקול 2). מכיוון ש-P. blakesleeanus הוא הטרוטלי, הוא זקוק לבן זוג משלים, ואם בן הזוג הזה אינו נגיש או שמשתמשים בסוג הזדווגות דומה במקומו, אז ההזדווגות לא תתרחש 10,33,34.
מגבלה של פרוטוקול זה היא התפתחות אסינכרונית של מבנים מיניים. P. blakesleeanus, כמו פטריות אחרות הגדלות על מצע מוצק, מתרחב רדיאלית לכל הכיוונים. המשמעות היא שחלקים מהתפטיר יהיו בשלבים מתקדמים יותר של המחזור המיני מאחרים. קיימים פרוטוקולים לסנכרון ההתפתחות המינית ב-Ascomycetes35, אך אלה לא הותאמו בהצלחה ל-Mucoromycetes. משמעות הדבר היא שעבודה החוקרת ביטוי גנים במהלך המחזור המיני תהיה נתונה לרעש אם יותר מדי תאים נמצאים בשלבי התפתחות שונים. בהתחשב בתצפיות במחקר זה, נראה כי בעוד שהגבלת זמינות החומרים המזינים מובילה לפחות תאים המתרבים מינית באופן כללי, נראה כי התאים שנצפו נמצאים בשלבי התפתחות דומים. לכן, הגבלה של חומרים מזינים עשויה לעזור להגביל את הצפיפות של מבנים מיניים מובחנים, ולהעניק לחוקר גישה לרקמות סינכרוניות בעיקר על חשבון יבולים נמוכים יותר.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
אנו רוצים להודות לוועד המנהל של מדעי הטבע של קולורדו קולג', למחלקה לביולוגיה ואקולוגיה של אורגניזמים ולקרן משפחת Hevey למחקר סטודנטים על מימון העבודה הזו. אנו גם מודים לאליס קלר וטיה האצ'נס על התמיכה הטכנית שלהן.
Materials
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
References
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved