Method Article
Cruzamientos sexuales con el mucoromiceto Phycomyces blakesleeanus
En este artículo
Resumen
Aquí presentamos un protocolo básico para la inducción del apareamiento de P. blakesleeanus .
Resumen
Phycomyces blakesleeanus, un hongo filamentoso dentro del filo Mucoromycota, se distingue por su notable capacidad de percepción ambiental y respuestas adaptativas. Si bien trabajos anteriores han demostrado que los estímulos ambientales, como la gravedad, la luz, la humedad y la disponibilidad de nutrientes, influyen en su dinámica de crecimiento y estrategias reproductivas, los mecanismos subyacentes siguen siendo un área focal de investigación. Las señales ambientales desencadenan la reproducción sexual o asexual. La reproducción sexual comienza con la señalización de feromonas, que desencadena la quimioatracción de hifas, lo que finalmente conduce a transiciones morfológicas en serie que culminan en la formación de una cigospora.
En un entorno de laboratorio, los cruces de P. blakesleeanus dan como resultado micelios complementarios que experimentan el ciclo sexual en diferentes etapas. Nuestro trabajo tiene como objetivo probar si las señales ambientales pueden desencadenar el apareamiento a través de los micelios de P. blakesleeanus. Los cruces de P. blakesleeanucultivados en medios con nutrientes limitados se someterán a agar con nutrientes limitados para desencadenar una respuesta sexual de acuerdo con la privación de nutrientes. El desencadenamiento exitoso del apareamiento en P. blakesleeanus facilitará futuros estudios que requieran una gran cantidad de micelios que se reproduzcan sexualmente en etapas específicas. El resultado de esta investigación mejorará aún más nuestra comprensión de cómo los mecanismos reproductivos de P. blakesleeanus están influenciados por factores ambientales, contribuyendo a la base de conocimiento más amplia sobre la reproducción sexual de hongos filamentosos.
Introducción
La inducción del apareamiento en sistemas fúngicos en condiciones de laboratorio ha avanzado en la comprensión de la genética eucariota, la biología celular, la biología evolutiva y la biotecnología. Los hongos dikaryan, en particular el Ascomycota, presentan el conocimiento más extenso sobre la inducción del apareamiento en un entorno de laboratorio1. Curiosamente, el primer hongo en el que se propuso la reproducción sexual, Syzygites megalocarpus, no es un miembro de Ascomycota, sino más bien un miembro del filo Mucoromycota2. El filo Mucoromycota es un grupo divergente temprano anteriormente clasificado como "Zygomycota", pero ahora considerado hermano de los linajes Dikaryan 3,4. Los Mucoromycota, junto con Zoopagomycota, son evolutivamente significativos ya que estos filos representan la transición de los hongos a los ecosistemas terrestres 4,5. Al igual que otros hongos, los Mucoromycetes utilizan estrategias reproductivas asexuales y sexuales en respuesta a su entorno 3,6. En condiciones de limitación de nutrientes, los mucoromycetes comenzarán el ciclo sexual6. Los mucoromycetes exhiben mecanismos de apareamiento homotálicos y heterotálicos, donde la compatibilidad está determinada por los genes de tipo de apareamiento sexM y sexP, designados como (-) y (+) respectivamente 7,8,9.
Blakeslee10 enfatizó la sensibilidad del ciclo sexual de los mucoromicetos a las condiciones externas, señalando que la humedad es crítica para su formación y que la disponibilidad de nutrientes en el sustrato juega un papel importante. Los tipos de apareamiento complementarios inician el ciclo sexual a través de la síntesis cooperativa de ácidos trispóricos (AT) utilizando betacaroteno como precursor 11,12,13. Tras la detección de AT, las hifas vegetativas que responden se engrosan y se convierten en cigoforos muy ramificados 14,15,16. Los cigoforos continúan produciendo TA y se atraen mutuamente. En P. blakesleeanus, los zigóforos se diferencian dentro del sustrato y no son fácilmente visibles en medios de agar sólido17. Al hacer contacto, los cigoforos se entrelazan y se convierten en cigoforos aéreos.
A medida que el ciclo sexual continúa, las puntas de los cigoforos se unen y el centro de las células empuja hacia afuera para formar una estructura en forma de anillo con hinchazón coraloide en la base, completando la transición al progametangio. Las puntas de las células que forman el progametangio comienzan a fusionarse y se desarrollan en el gametangio. En la etapa de gametangia, los cigoforos muestran una ornamentación en forma de espinas. La pared celular en las puntas se disuelve y aparecen tabiques adventicios, delimitando el área donde se formará la zigospora, y los cigoforos actúan como suspensores en forma de pinzas18. La zigospora se pigmentará a medida que su pared celular se engrose y adquiera una ornamentación adicional en forma de espina17,18. Una vez formada, la zigospora entrará en un período de latencia antes de reiniciar el ciclo de crecimiento.
Phycomyces blakesleeanus es un mucoromiceto heterotálico que destaca por sus células grandes y esporangióforos sensibles al medio ambiente 6,8,18. Este organismo se cultiva fácilmente en el laboratorio y las partes del ciclo sexual que conducen a la formación de zigosporas se pueden observar en el lapso de 8 a 10 días. Como modelo, P. blakesleeanus ha sido examinado por su capacidad para detectar la luz en su entorno17,19. La facilidad de cultivo y la capacidad de inducir el apareamiento también lo convirtieron en un modelo ideal para estudiar el mecanismo detrás de su capacidad para percibir la luz20; Estos hallazgos también destacaron la conservación evolutiva de los mecanismos de detección de la luz en los hongos. En P. blakesleeanus, se ha demostrado que la luz inhibe la reproducción sexual a través de estas proteínas sensibles a la luz conservadas21. Los estudios recientes sobre el desarrollo evolutivo han tratado de comprender qué genes contribuyen a la diferenciación celular durante el ciclo sexual de P. blakesleeanus 6. La correlación de la morfogénesis con genes específicos requeriría que se aislara suficiente tejido de los mismos tipos de células para realizar estudios de expresión génica.
Si bien los protocolos para inducir el apareamiento de P. blakesleeanus en un entorno de laboratorio han sido descritos previamente, algunos solo mencionan el tipo de medio a utilizar y las cepas relevantes18. Algunas descripciones de protocolos no incluyen una formulación de medios específica, pero sí describen dónde colocar los presuntos tipos de apareamiento complementarios en una placa10. Los protocolos más recientes permiten aumentar la producción de zigosporas mezclando esporas de cada tipo de apareamiento e inoculándolas con la suspensión de esporas mixtas21 o colocando los tipos de apareamiento a cierta distancia y dejando que el cultivo incube durante 20 días22. Estos enfoques son útiles para generar células ampliamente diferenciadas, específicamente zigosporas, pero pueden no ser adecuados para observar un curso de tiempo de desarrollo o seleccionar estructuras sexuales que se forman antes de las zigosporas para la transcriptómica de una sola célula. Otros trabajos han abordado esto colocando los tipos de apareamiento complementarios a distancia en medios sólidos para permitir la observación de transiciones morfológicas en serie a medida que comienza el ciclo sexual 6,22,23. Al igual que ocurre con otros hongos, el micelio de P. blakesleeanus se expande radialmente24,25. Por lo tanto, cuando se cultivan tipos de apareamiento complementarios en la misma placa, diferentes porciones de sus micelios entrarán en contacto en diferentes momentos. Dado que el contacto entre micelios es uno de los primeros pasos en el ciclo sexual de P. blakesleeanus, esto significa que diferentes porciones de micelios interactivos estarán en diferentes etapas del ciclo sexual. Esta asincronía podría afectar el resultado de un estudio de expresión génica, de modo que si se mezclan tipos de células diferenciadas y si tienen programas de expresión génica distintos, entonces sería difícil atribuir el papel de un gen a una estructura en particular.
Además del valor de P. blakesleeanus como modelo para examinar los genes involucrados en la morfogénesis durante el ciclo sexual, su crecimiento vigoroso y su capacidad para diferenciarse en el lapso de unos pocos días lo convierten en un hongo ideal para entrenar a estudiantes interesados en hongos filamentosos divergentes tempranos y para su uso en un aula de pregrado para aprender sobre la diversidad de hongos y sus procesos de desarrollo. El protocolo presentado aquí hace uso de tres concentraciones de dos tipos diferentes de medios para demostrar el efecto de la disponibilidad de nutrientes en la apariencia del micelio, la inducción del apareamiento y el enriquecimiento de estructuras sexuales particulares, ya sea para la cuantificación, la observación o la posible transcriptómica de una sola célula.
Protocolo
1. Preparación de los medios
- Suspenda el agar de harina de maíz en polvo (CMA) o el agar dextrosa de papa (PDA) en agua desionizada. Para 100% CMA o PDA, siga las instrucciones del fabricante y suspenda 17 g de CMA en 1 L de agua desionizada o 39 g de PDA en 1 L de agua desionizada. Para N% CMA o PDA, suspenda 1/N de la cantidad recomendada por el fabricante y complemente con agar adicional para lograr una concentración de agar de 7.5% (p/v).
NOTA: Paso opcional: Antes de esterilizar en autoclave, agregue 25 μg/mL de cloranfenicol si la contaminación bacteriana es una preocupación. - Esterilice los medios en un autoclave, a 121 °C durante 15 min.
- Enfríe el medio a ~60 °C colocándolo durante 30 minutos en un baño de agua ajustado a 60 °C.
NOTA: Si la botella tibia de medios se puede sostener durante 6 segundos con poca o ninguna molestia, entonces está lista para verter. - Vierta las placas en condiciones asépticas en una campana de flujo laminar o en una cabina de seguridad biológica. Incline el frasco de medios sobre una placa de Petri abierta y vacía y vierta solo lo suficiente para cubrir completamente el fondo.
- Alternativamente, utilice una pipeta serológica de vidrio y pipetee 20 mL de medio en cada placa.
NOTA: Este enfoque aumenta el tiempo que la botella de medio está a una temperatura más baja y aumenta el riesgo de solidificar prematuramente el agar.
- Alternativamente, utilice una pipeta serológica de vidrio y pipetee 20 mL de medio en cada placa.
- Permita que los medios se vuelvan a solidificar. Guarde las placas a 4 °C si no se utilizan inmediatamente.
2. Preparación de esporas o tejidos fúngicos
- Obtenga cultivos de cada tipo de apareamiento de P. blakesleeanus (por ejemplo, NRRL 1555 (-), NRRL 1554 (+), NRRL 1464 (-) y NRRL 1465 (+)). Para inocular los cruces con esporas, primero cultive cada tipo de apareamiento en cultivo puro en 100% CMA o PDA
- Corte una porción de micelio de vanguardia de los cultivos existentes y coloque el micelio extirpado en una placa 100% CMA/PDA. Incubar cultivos puros durante 1 semana a 27 °C bajo un ciclo de luz de 12 h.
- Una vez que los esporangióforos estén presentes, inunde un cultivo puro esporulado con 0.01% Tween 20 en agua esterilizada y desionizada utilizando técnica aséptica. Con una micropipeta P1000, extraiga 1,0 ml de la mezcla de 20 esporas Tween de la placa y colóquela en un tubo de microcentrífuga.
- Centrífuga en una mini centrífuga durante 30 s, luego decantar el sobrenadante.
- Si se necesitan más esporas, continúe agregando 1.0 mL de la mezcla de esporas Tween 20 en el mismo tubo de microcentrífuga y repita el paso 2.4. Después de obtener una cantidad adecuada de esporas, decantar el sobrenadante y reemplazarlo con 500 μL de agua desionizada estéril.
- Opcional: Utilice un hematitómetro para estimar la concentración de esporas, lo que informará si es necesario agregar más agua o si las esporas deben volver a centrifugarse.
- Alternativamente, inocule los cruces con micelios de vanguardia de los cultivos puros.
- Use una hoja de afeitar esterilizada o un barrenador de agujeros de corcho para extirpar el tejido y colocar el inóculo en placa de inmediato.
- Configure las cruces como cruces de 2 vías, cruces de 4 vías o cruces de 8 vías (Figura 1).
NOTA: Si se están configurando cruces para el trabajo transcriptómico, se recomienda configurar 1-2 placas adicionales por condición/medio para que sirvan como placas indicadoras. Las placas indicadoras permiten a los investigadores limitar la exposición a la luz a las placas experimentales, ya que la luz inhibe la reproducción sexual en P. blakesleeanus.- Para un cruce de 2 vías, coloque los tipos de apareamiento complementarios uno frente al otro (Figura 1A).
- Coloque el micelio del tipo de apareamiento (-), NRRL 1555 o NRRL 1464, al menos a 1 cm del borde de una placa de Petri en PDA o CMA.
- En la misma placa, frente a donde se colocó el tipo de apareamiento (-) y a 1 cm del borde de la placa de Petri, coloque el tipo de apareamiento (+), NRRL 1554 o NRRL1465 (Figura 1A).
NOTA: La distancia entre los tipos de apareamiento complementarios influirá en el tamaño del tejido que participa en el ciclo sexual. Los tipos de apareamiento más separados permiten que los micelios se expandan más, lo que aumentará el número de interacciones sexuales entre los dos miembros de la pareja.
- Para un cruce de 4 vías, coloque los tipos de apareamiento similares uno frente al otro pero junto a un tipo de apareamiento complementario (Figura 1B).
- Coloque las esporas o micelios de los tipos de apareamiento (-), NRRL 1555 y NRRL 1464, uno frente al otro al menos a 1 cm del borde de una placa de Petri en PDA o CMA.
- En la misma placa, elija una ubicación entre los dos tipos de apareamiento (-) y al menos a 1 cm del borde de la placa e inocule el sitio con esporas o micelios del tipo de apareamiento (+), NRRL 1554 o 1465.
- En la misma placa, frente a donde se inoculó el primer tipo de apareamiento (+) y al menos a 1 cm de distancia de la placa, coloque el otro tipo de apareamiento (+).
- Para un cruce de 8 vías, alterne los tipos de acoplamiento a lo largo de la periferia de la placa de Petri, con cuatro de cada tipo de acoplamiento (Figura 1C).
- Para un cruce de 2 vías, coloque los tipos de apareamiento complementarios uno frente al otro (Figura 1A).
- Después de la inoculación, selle las placas con parafilm o (déjelas sin sellar) y colóquelas en un recipiente secundario antes de incubar a 22 °C en la oscuridad. Observe las placas diariamente en busca de evidencia de apareamiento durante ese tiempo, tome fotografías desde debajo de la placa y trace los micelios a medida que crecen los cultivos.
NOTA: Después de 24 horas después de la inoculación, se espera ver que los micelios se expanden en todos los tipos de medios, pero no es probable que las personas estén en contacto en esta etapa. - Dependiendo del tipo de medio (PDA o CMA) y de la formulación (25%, 50%, 100%), si los micelios comienzan a hacer contacto, inspeccione los micelios de los tipos de apareamiento complementarios que estén en contacto bajo un endoscopio de disección para ver si hay evidencia de apareamiento. Tome fotos de los micelios interactuando con una cámara o un teléfono inteligente montado en el telescopio de disección.
- Adquiera imágenes de micelios y únalas (por ejemplo, utilizando la aplicación Panorama Stitcher). Utilice ImageJ para estimar el área del micelio (consulte los tutoriales en línea).
Resultados
Después de un cruzamiento de 4 vías, cada cepa varió ligeramente en su tasa de crecimiento determinada por el cambio en el área del micelio (Figura 2). Si bien no fue estadísticamente significativo, NRRL 1555 tuvo un cambio más rápido en el área cuando se cubrió con 25% de CMA, 25% de PDA o 100% de PDA. De manera similar, NRRL 1465 tuvo un mayor cambio en el área cuando se cultivó con 50% de PDA o CMA. NRRL 1464 tuvo el aumento más rápido en el área cuando se cultivó con 100% CMA. Después de 24 h (1 DPI), las cepas que crecían en PDA parecían más amarillas en relación con las cepas cultivadas en CMA (Figura 3)-Se ha demostrado previamente que PDA aumenta la producción de pigmento26. Las cepas con PDA 100% presentaron, en promedio, una mayor medida de área después de 24 h (Tabla 1). Esto contrasta con el 25% de CMA, que tuvo el área promedio más pequeña con 1 DPI (Tabla 1).
El contacto entre cepas vecinas no se observó hasta 2 DPI y solo entre cepas cultivadas con PDA, especialmente 100% PDA (Figura 4). El apareamiento se observó en 100% PDA a 2 DPI. Las cepas cultivadas en CMA no entraron en contacto a 2 DPI, aunque el 100% de CMA presentó cepas que crecieron muy cerca unas de otras (Figura 4). Después de 3 días de incubación (3 DPI), las cepas cultivadas en todas las formulaciones de PDA mostraron apareamiento, aunque la densidad de los tipos de células diferenciadas difirió (Tabla 2 y Figura 5). Una réplica de 25% de CMA y una réplica de 50% de CMA también exhibieron apareamiento (Tabla 2); el resto de las placas CMA no mostraron ningún apareamiento (Tabla 2). Curiosamente, las cepas cultivadas en PDA parecían tener micelios amarillos más densos e hifas aéreas, que podrían haberse convertido en esporangióforos (Figura 5). A los 4 DPI, las placas PDA mostraban reacciones de apareamiento junto con los esporangióforos asexuales (Figura 6). Las placas CMA presentaron cepas con micelios más difusos y menos esporangióforos (Figura 6). No se observó apareamiento en el 100% de CMA (Tabla 2).
Se observaron placas representativas bajo un osciloscopio de disección a 4 DPI para evaluar si los tipos de células asociados con el inicio del ciclo sexual podían observarse fácilmente. En general, una concentración decreciente de nutrientes se correlacionó con micelios sexuales diferenciados cualitativamente menos densos (Figura 7 y Figura 8). Cuando se cultivaron con 100% de PDA, los zigóforos aéreos individuales o progametangios no se pudieron visualizar y aparecieron como una masa de células (Figura 7A). Mientras que el 50% y el 25% de PDA parecían tener una menor densidad celular en el sitio de apareamiento, las placas de PDA del 25% presentaban células que podían distinguirse fácilmente (Figura 7B, C). Al comparar los tipos de células observadas en el 50% de PDA con el 25% de PDA, las de menor concentración parecían ser predominantemente del mismo tipo, mientras que en la concentración más alta, había una mezcla de células en diferentes estadios (Figura 7D,E). En particular, con un 50% de PDA, las células observadas a 4 DPI incluían cigoforos aéreos que acababan de emerger (Figura 7D, asterisco) y algunos que estaban en transición a progametangia (Figura 7D, flecha). Con un 25% de PDA, la mayoría de las células parecían estar en etapas de desarrollo muy similares (Figura 7E).
Las placas de las diversas concentraciones de CMA se evaluaron junto con las placas PDA a 4 DPI (Figura 8). Como se mencionó anteriormente, no se observó apareamiento cuando se utilizó CMA al 100% (Figura 8A). Con un 50% de CMA o un 25% de CMA, se observó apareamiento y el número total de tipos de células asociadas con la reproducción sexual fue menor (Figura 8B, C). Los cigoforos aéreos observados a 4 DPI parecían tener el mismo tamaño y altura en toda la zona de interacción (Figura 8B,C). Dado el menor número total de células que participan en el ciclo sexual, éstas podrían hipotéticamente ser extirpadas con cuchillas de afeitar esterilizadas o agujas de disección e inmediatamente congeladas en nitrógeno líquido para el aislamiento posterior del ARN. Ser capaz de seleccionar estructuras específicas en el mismo punto de tiempo de desarrollo puede aumentar la solidez de los estudios de expresión génica que buscan conectar los cambios morfológicos con los genes.
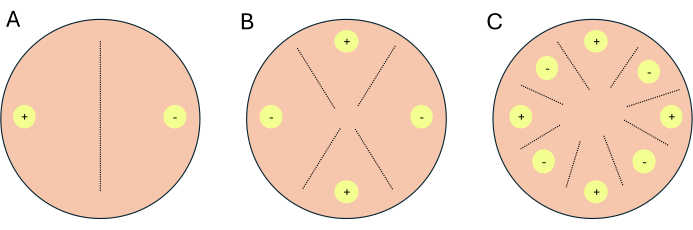
Figura 1: Esquema de tres formatos de cruz. (A) Un cruzamiento de 2 vías con dos sitios de inoculación (círculos amarillos) con tipos de apareamiento complementarios (+) y (-). (B) un cruzamiento de 4 vías con dos sitios de inoculación de tipo de apareamiento (+) (círculos amarillos con +) y dos sitios de inoculación de tipo de apareamiento (-) (círculos amarillos con -). (C) Un cruzamiento de 8 vías con sitios de inoculación alternos (círculos amarillos) de los tipos de apareamiento complementarios (+) y (-). Las líneas discontinuas representan el sitio previsto de las interacciones de apareamiento. Haga clic aquí para ver una versión más grande de esta figura.
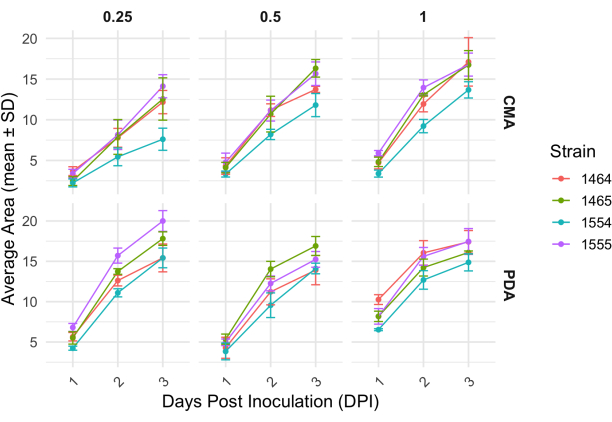
Figura 2: Cambio en el área a lo largo del tiempo para cada cepa en CMA y PDA a diferentes concentraciones. El área promedio de las colonias de P. blakesleeanus se graficó durante 3 días después de la inoculación. Las barras de error representan la desviación estándar del área media. Véase también la Tabla 1. Los gráficos se generaron con ggplot227. Abreviatura: DPI = días después de la inoculación. Haga clic aquí para ver una versión más grande de esta figura.
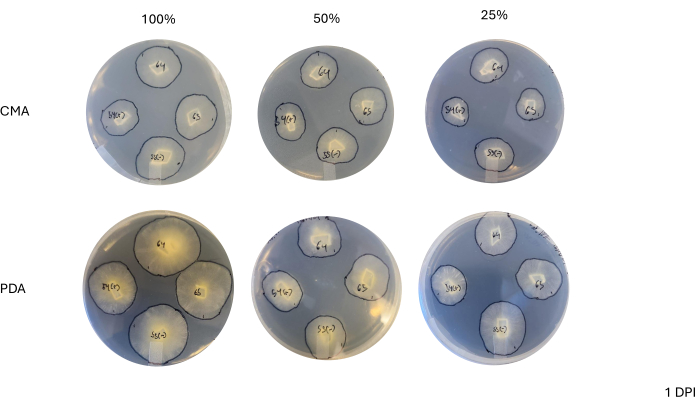
Figura 3: Imágenes representativas de cruces de 4 vías 1 día después de la inoculación. La comparación de las colonias muestra diferencias según el tipo de medio y la formulación, destacando que las colonias con 100% de PDA parecen más amarillas que con CMA y que el crecimiento parece más rápido con 100% de PDA. Las imágenes fueron tomadas desde el fondo de la placa de Petri. Se dibujaron líneas negras con un rotulador para delinear los micelios. Abreviaturas: CMA = agar harina de maíz; PDA = agar patata dextrosa; DPI = días después de la inoculación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes representativas de cruces de 4 vías a los 2 días después de la inoculación. La comparación de las colonias pone de manifiesto la densidad aparente del crecimiento micelial, donde las colonias en PDA parecen tener un micelio más denso que las de CMA. Además, las colonias en PDA parecen más amarillas y la mayoría han hecho contacto o se están acercando al punto de contacto. Las puntas de flecha rojas resaltan las áreas donde han comenzado las interacciones de apareamiento, como lo indica un aumento en la densidad del tejido. Esto contrasta con las colonias en CMA, donde solo las que tienen CMA al 100% están cerca del contacto, y todas las formulaciones de CMA presentan colonias que son relativamente menos amarillas en comparación con las de PDA y ninguna ha comenzado a aparearse. Las imágenes fueron tomadas desde el fondo de la placa de Petri. Se dibujaron líneas negras con un rotulador para delinear los micelios. Abreviaturas: CMA = agar harina de maíz; PDA = agar patata dextrosa; DPI = días después de la inoculación. Haga clic aquí para ver una versión más grande de esta figura.
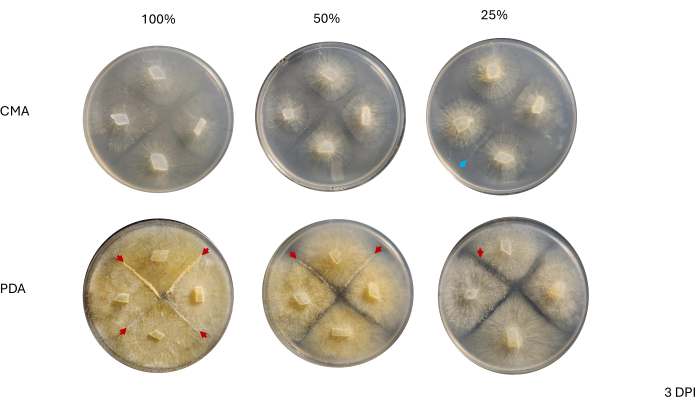
Figura 5: Imágenes representativas de cruces de 4 vías a los 3 días después de la inoculación. La comparación de las colonias entre los dos tipos de medios destaca que la densidad micelial es mayor cuando se cultiva en PDA en comparación con CMA. Las puntas de flecha rojas resaltan que todas las placas PDA albergan al menos un sitio de interacciones de apareamiento. Las colonias en el 100% de CMA y el 50% de CMA no han hecho contacto, pero dos colonias en el 25% de CMA (flecha azul) sí lo han hecho. Las imágenes fueron tomadas desde arriba de la placa de Petri. Abreviaturas: CMA = agar harina de maíz; PDA = agar patata dextrosa; DPI = días después de la inoculación. Haga clic aquí para ver una versión más grande de esta figura.
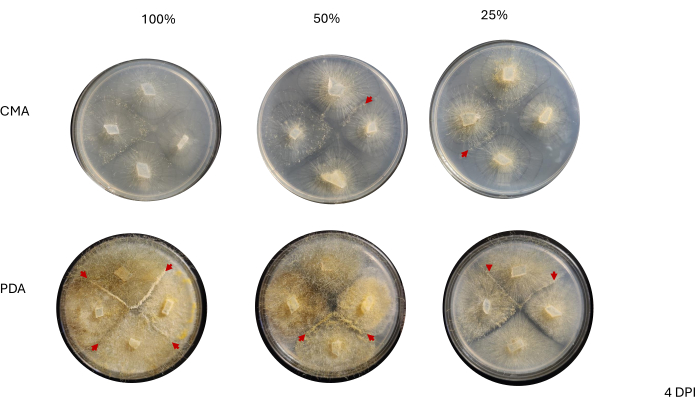
Figura 6: Imágenes representativas de cruces de 4 vías a los 4 días después de la inoculación. Todas las colonias en PDA albergan al menos una interacción de apareamiento (flechas rojas) y muestran un micelio amarillo. Además, las colonias en PDA muestran un crecimiento extenso de hifas aéreas (es decir, esporangios asexuales) que pueden impedir la observación de las interacciones de apareamiento. Las colonias en 50% y 25% CMA también exhiben evidencia de interacciones de apareamiento (puntas de flecha rojas) y tienen menos crecimiento de hifas aéreas en comparación con las de PDA. Las imágenes fueron tomadas desde arriba de la placa de Petri. Abreviaturas: CMA = agar harina de maíz; PDA = agar patata dextrosa; DPI = días después de la inoculación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Imágenes de cruces en PDA. (A) 100% PDA, (B) 50% PDA y (C) 25% PDA. Las regiones de interés se ampliaron (rectángulos rojos). Todas las imágenes fueron adquiridas a 4 DPI. Una vista adicional de (D) 50% PDA destaca la presencia de células que se reproducen sexualmente en diferentes etapas: cigóforos aéreos jóvenes: asteriscos; Zigoforos aéreos más antiguos: flechas rojas. (E) El 25% de PDA exhibe células que se reproducen sexualmente en diferentes etapas, aunque esta vista representativa muestra un menor hacinamiento de estas estructuras en comparación con el 50% de PDA. Barras de escala = 1 mm (A-C), 0,5 mm (D,E). Abreviaturas: PDA = agar patata dextrosa; DPI = días después de la inoculación. Haga clic aquí para ver una versión más grande de esta figura.
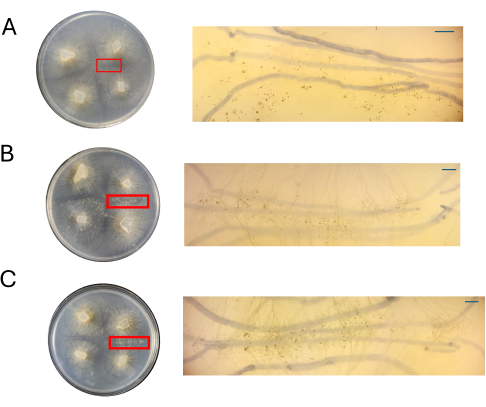
Figura 8: Imágenes de cruces en CMA. (A) 100% CMA, (B) 50% CMA y (C) 25% CMA con aumento de regiones de interés. Se observan fácilmente estructuras sexuales distintas para el 50% (B) y el 25% (C) de CMA, y el hacinamiento es mínimo. No se observan estructuras sexuales en 100% CMA en este momento. Todas las imágenes fueron adquiridas a 4 DPI. Las imágenes de la placa de Petri y las imágenes del telescopio de disección se obtuvieron desde arriba de la placa de Petri. Las líneas oscuras en los fondos de las imágenes del telescopio de disección se dibujan con un marcador negro que se utilizó para rastrear la expansión del micelio. Barras de escala = 1 mm. Abreviaturas: CMA = agar harina de maíz; DPI = días después de la inoculación. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Área de micelios para cada cepa durante 4 días. Haga clic aquí para descargar esta tabla.
Tabla 2: Evaluación por pares del contacto y apareamiento para cada cepa en diferentes medios. 0 = No, 1 = Sí. Haga clic aquí para descargar esta tabla.
Discusión
Aquí se presenta un protocolo simple para inducir la reproducción sexual en P. blakesleeanus en un entorno de laboratorio. Una de las consideraciones más críticas para este protocolo es la limitación de nutrientes. Se plantea la hipótesis de que los hongos cooptaron la reproducción sexual como respuesta a las duras condiciones ambientales, como la limitación de nutrientes 6,28,29,30,31,32. La variación del nivel de nutrientes puede informar el diseño experimental. Por ejemplo, si un investigador está interesado en comparar los genes expresados en los cigoforos aéreos frente a los gametangios, entonces se recomendaría una limitación de nutrientes más extrema (como un 25% de CMA) ya que la densidad de las estructuras sexuales será menor en comparación con las formulaciones más altas de CMA o PDA. Una menor densidad de estructuras sexuales, como la que se observó con un 50% o un 25% de CMA, significa que el aislamiento de un tipo específico de células diferenciadas no sólo sería más fácil (ya que las células se identificarían y extirparían fácilmente), sino que también garantizaría que sólo se muestreara el tipo de célula de interés.
Los aprendices o estudiantes también se beneficiarían de este protocolo, ya que permite a este grupo rastrear la diferenciación celular y distinguir de manera confiable entre los diversos tipos de células que se desarrollan durante el ciclo sexual de P. blakesleeanus. El uso de CMA y PDA refleja el trabajo previo sobre la inducción del apareamiento de los mucoromycetes 18,22,23, y las formas en polvo están disponibles para su compra, lo que las convierte en una de las opciones de medios más accesibles en un entorno educativo o de capacitación en comparación con otros medios sintéticos.
Dado que el objetivo de este protocolo es, en última instancia, demostrar el desarrollo y la diferenciación, y se ha señalado que la concentración de nutrientes influye en la facilidad de observación de distintos tipos de células, un paso crítico en este protocolo es garantizar la composición adecuada de los medios (sección 1 del protocolo). Si no se agrega polvo de agar adicional al PDA o CMA diluido, es posible que el medio no se solidifique correctamente y que las interacciones de acoplamiento posteriores no se observen fácilmente. Además, se debe prestar mucha atención a la ubicación de los tipos de apareamiento complementarios y similares (sección 2 del protocolo). Como P. blakesleeanus es heterotálico, requiere un compañero de apareamiento complementario, y si ese compañero es inaccesible o se utiliza un tipo de apareamiento similar en su lugar, entonces el apareamiento no ocurrirá 10,33,34.
Una limitación de este protocolo es el desarrollo asincrónico de las estructuras sexuales. P. blakesleeanus, al igual que otros hongos cultivados en medios sólidos, se expande radialmente en todas las direcciones. Esto significa que partes del micelio estarán en etapas más avanzadas del ciclo sexual que otras. Existen protocolos para sincronizar el desarrollo sexual en Ascomycetes35, pero no se han adaptado con éxito a Mucoromycetes. Esto significa que el trabajo que investiga la expresión génica durante el ciclo sexual estará sujeto a ruido si hay demasiadas células en diferentes etapas de desarrollo. Dadas las observaciones de este estudio, parecería que, si bien limitar la disponibilidad de nutrientes conduce a menos células que se reproducen sexualmente en general, las células que se observan parecen estar en etapas similares de desarrollo. Por lo tanto, la limitación de nutrientes puede ayudar a limitar la densidad de estructuras sexuales diferenciadas, lo que otorga a un investigador acceso a tejido mayoritariamente sincrónico a expensas de rendimientos más bajos.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Nos gustaría agradecer al Comité Ejecutivo de Ciencias Naturales de Colorado College, al Departamento de Biología y Ecología de Organismos y al Fondo de la Familia Hevey para la Investigación Estudiantil por financiar este trabajo. También extendemos nuestro agradecimiento a Alice Keller y Tia Hutchens por su apoyo técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
Referencias
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados