Method Article
Sexuelle Kreuzungen mit dem Mucoromyceten Phycomyces blakesleeanus
In diesem Artikel
Zusammenfassung
Hier stellen wir ein grundlegendes Protokoll für die Induktion der Paarung von P. blakesleeanus vor.
Zusammenfassung
Phycomyces blakesleeanus, ein filamentöser Pilz aus dem Stamm der Mucoromycota, zeichnet sich durch seine bemerkenswerte Fähigkeit zur Umweltwahrnehmung und adaptiven Reaktionen aus. Während frühere Arbeiten gezeigt haben, dass Umweltreize wie Schwerkraft, Licht, Feuchtigkeit und Nährstoffverfügbarkeit die Wachstumsdynamik und die Fortpflanzungsstrategien beeinflussen, bleiben die zugrunde liegenden Mechanismen ein Schwerpunkt der Forschung. Umwelteinflüsse lösen sexuelle oder asexuelle Fortpflanzung aus. Die sexuelle Fortpflanzung beginnt mit der Pheromonsignalisierung, die eine Hyphen-Chemoattraktion auslöst und schließlich zu seriellen morphologischen Übergängen führt, die in der Bildung einer Zygospore gipfeln.
In einer Laborumgebung führen Kreuzungen von P. blakesleeanus zu komplementären Myzelien, die den Sexualzyklus in verschiedenen Stadien durchlaufen. Unsere Arbeit zielt darauf ab, zu testen, ob Umweltreize eine Paarung über das Myzel von P. blakesleeanus auslösen können. Kreuzungen von P. blakesleeanu s,die auf nährstoffbegrenzten Medien gezüchtet werden, werden nährstoffbegrenztem Agar unterzogen, um eine sexuelle Reaktion in Übereinstimmung mit dem Nährstoffmangel auszulösen. Die erfolgreiche Auslösung der Paarung bei P. blakesleeanus wird zukünftige Studien erleichtern, die eine große Menge an sexuell reproduzierenden Myzelien in bestimmten Stadien erfordern. Das Ergebnis dieser Forschung wird unser Verständnis darüber, wie die Fortpflanzungsmechanismen von P. blakesleeanus durch Umweltfaktoren beeinflusst werden, weiter verbessern und zu einer breiteren Wissensbasis über die sexuelle Fortpflanzung von filamentösen Pilzen beitragen.
Einleitung
Die Induktion der Paarung in Pilzsystemen unter Laborbedingungen hat das Verständnis der eukaryotischen Genetik, Zellbiologie, Evolutionsbiologie und Biotechnologie vorangetrieben. Die dikarischen Pilze, insbesondere die Ascomycota, verfügen über das umfangreichste Wissen über die Paarungsinduktion in einer Laborumgebung1. Interessanterweise ist der erste Pilz, bei dem die sexuelle Fortpflanzung vorgeschlagen wurde, Syzygites megalocarpus, kein Mitglied der Ascomycota, sondern ein Mitglied des Stammes Mucoromycota2. Der Stamm Mucoromycota ist eine frühe divergierende Gruppe, die früher als "Zygomycota" klassifiziert wurde, heute aber als Schwester der dikaryischen Linien gilt 3,4. Die Mucoromycota sind zusammen mit Zoopagomycota evolutionär bedeutsam, da diese Stämme den Übergang von Pilzen zu terrestrischen Ökosystemen darstellen 4,5. Wie andere Pilze auch, verwenden die Mukoromyceten asexuelle und sexuelle Fortpflanzungsstrategien als Reaktion auf ihre Umwelt 3,6. Unter nährstoffarmen Bedingungen beginnen Mukoromyceten den Sexualzyklus6. Mukoromyceten weisen sowohl homothallische als auch heterothallische Paarungsmechanismen auf, wobei die Kompatibilität durch die Paarungstyp-Gene sexM und sexP bestimmt wird, die als (-) bzw. (+) bezeichnet werden 7,8,9.
Blakeslee10 betonte die Empfindlichkeit des Mukoromyceten-Sexualzyklus gegenüber äußeren Bedingungen und stellte fest, dass Feuchtigkeit für ihre Bildung entscheidend ist und dass die Nährstoffverfügbarkeit im Substrat eine wichtige Rolle spielt. Komplementäre Paarungstypen beginnen den Sexualzyklus durch kooperative Synthese von Trisporinsäuren (TA) unter Verwendung von Beta-Carotin als Vorläufer 11,12,13. Nach dem Nachweis von TA verdicken sich die reagierenden vegetativen Hyphen und werden zu stark verzweigten Zygophoren 14,15,16. Die Zygophoren setzen die Produktion von TA fort und ziehen sich gegenseitig chemoan. In P. blakesleeanus differenzieren sich Zygophoren innerhalb des Substrats und sind auf festen Agarmedien nicht ohne weiteres sichtbar17. Bei Kontakt verflechten sich die Zygophoren und werden zu Zygophoren in der Luft.
Im weiteren Verlauf des Sexualzyklus heften sich die Spitzen der Zygophoren an, und die Mitte der Zellen schiebt sich heraus, um eine ringförmige Struktur mit einer koralloiden Schwellung an der Basis zu bilden, die den Übergang zum Progametangium vervollständigt. Die Spitzen der Zellen, die das Progametangium bilden, beginnen zu verschmelzen und entwickeln sich zum Gametangium. Im Gametangia-Stadium weisen die Zygophoren dornenartige Verzierungen auf. Die Zellwand an den Spitzen löst sich auf und es erscheinen Adventivsepten, die den Bereich abgrenzen, in dem sich die Zygospore bilden wird, und die Zygophoren wirken als zangenartige Suspensoren18. Die Zygospore wird pigmentiert, wenn sich ihre Zellwand verdickt und sie zusätzliche dornenartige Verzierungen erhält17,18. Sobald sich die Zygospore gebildet hat, tritt sie in eine Ruhephase ein, bevor sie den Wachstumszyklus wieder aufnimmt.
Phycomyces blakesleeanus ist ein heterothallischer Mukoromycet, der sich durch seine großen Zellen und umweltrelevanten Sporangiophoren auszeichnet 6,8,18. Dieser Organismus lässt sich leicht im Labor kultivieren und die Teile des Sexualzyklus, die zur Bildung von Zygosporen führen, können innerhalb von 8-10 Tagen beobachtet werden. Als Modell wurde P. blakesleeanus auf seine Fähigkeit untersucht, Licht in seiner Umgebung wahrzunehmen17,19. Die einfache Kultivierung und die Fähigkeit, Paarungen zu induzieren, machten sie auch zu einem idealen Modell, um den Mechanismus hinter ihrer Fähigkeit, Licht wahrzunehmen, zu untersuchen20; Diese Ergebnisse unterstreichen auch die evolutionäre Konservierung der Lichtsensormechanismen in Pilzen. Bei P. blakesleeanus wurde gezeigt, dass Licht die sexuelle Fortpflanzung über diese konservierten lichtempfindlichen Proteine hemmt21. Neuere evolutionäre Entwicklungsstudien haben versucht zu verstehen, welche Gene zur Zelldifferenzierung während des Sexualzyklus von P. blakesleeanus beitragen6. Die Korrelation der Morphogenese mit bestimmten Genen würde erfordern, dass ausreichend Gewebe derselben Zelltypen isoliert wird, um Genexpressionsstudien durchführen zu können.
Während Protokolle zur Induktion der Paarung von P. blakesleeanus in einer Laborumgebung bereits beschrieben wurden, erwähnen einige nur die Art des zu verwendenden Mediums und die relevanten Stämme18. Einige Protokollbeschreibungen enthalten keine spezifische Medienformulierung, beschreiben jedoch, wo mutmaßliche komplementäre Stecktypen auf einer Platte10 positioniert werden müssen. Neuere Protokolle ermöglichen eine erhöhte Produktion von Zygosporen, indem entweder Sporen jedes Paarungstyps gemischt und mit der gemischten Sporensuspension21 geimpft werden, oder indem die Paarungstypen in einiger Entfernung voneinander platziert und die Kultur 20 Tage lang inkubiert wird22. Diese Ansätze sind nützlich für die Erzeugung großer differenzierter Zellen, insbesondere Zygosporen, sind aber möglicherweise nicht geeignet für die Beobachtung eines Entwicklungszeitverlaufs oder die Auswahl sexueller Strukturen, die sich vor den Zygosporen für die Einzelzelltranskriptomik bilden. Andere Arbeiten haben sich damit befasst, indem sie komplementäre Paarungstypen mit Abstand voneinander auf festen Medien platzierten, um die Beobachtung serieller morphologischer Übergänge zu Beginn des Sexualzyklus zu ermöglichen 6,22,23. Wie andere Pilze auch, dehnt sich das Myzel von P. blakesleeanus radial aus24,25. Wenn also komplementäre Paarungstypen auf derselben Platte gezüchtet werden, kommen verschiedene Teile ihres Myzels zu unterschiedlichen Zeiten in Kontakt. Da der Kontakt zwischen Myzelien zu einem der ersten Schritte im Sexualzyklus von P. blakesleeanus gehört, bedeutet dies, dass sich verschiedene Teile des interagierenden Myzels in unterschiedlichen Stadien des Sexualzyklus befinden. Diese Asynchronität könnte sich auf das Ergebnis einer Genexpressionsstudie auswirken, so dass es schwierig wäre, die Rolle eines Gens einer bestimmten Struktur zuzuschreiben, wenn differenzierte Zelltypen gemischt werden und wenn sie unterschiedliche Genexpressionsprogramme haben.
Neben dem Wert von P. blakesleeanus als Modell für die Untersuchung von Genen, die an der Morphogenese während des Sexualzyklus beteiligt sind, machen sein kräftiges Wachstum und seine Fähigkeit, sich innerhalb weniger Tage zu differenzieren, ihn zu einem idealen Pilz für die Ausbildung von Studenten, die sich für früh divergierende filamentöse Pilze interessieren, und für den Einsatz in einem Bachelor-Klassenzimmer, um mehr über die Vielfalt von Pilzen und ihre Entwicklungsprozesse zu erfahren. Das hier vorgestellte Protokoll verwendet drei Konzentrationen von zwei verschiedenen Arten von Medien, um die Wirkung der Nährstoffverfügbarkeit auf das Aussehen des Myzels, die Induktion der Paarung und die Anreicherung für bestimmte Sexualstrukturen zu demonstrieren, entweder zur Quantifizierung, zur Beobachtung oder zur potenziellen Einzelzell-Transkriptomik.
Protokoll
1. Vorbereitung der Medien
- Suspendieren Sie pulverisiertes Maismehl-Agar (CMA) oder Kartoffel-Dextrose-Agar (PDA) in entionisiertem Wasser. Befolgen Sie für 100 % CMA oder PDA die Anweisungen des Herstellers und suspendieren Sie 17 g CMA in 1 l entionisiertem Wasser oder 39 g PDA in 1 l entionisiertem Wasser. Für N% CMA oder PDA suspendieren Sie 1/N der vom Hersteller empfohlenen Menge und ergänzen Sie mit zusätzlichem Agar, um eine Agarkonzentration von 7,5 % (w/v) zu erreichen.
HINWEIS: Optionaler Schritt: Fügen Sie vor dem Autoklavieren 25 μg/ml Chloramphenicol hinzu, wenn eine bakterielle Kontamination ein Problem darstellt. - Sterilisieren Sie das Medium im Autoklaven bei 121 °C für 15 Minuten.
- Kühlen Sie das Medium auf ~60 °C ab, indem Sie es 30 Minuten lang in ein auf 60 °C eingestelltes Wasserbad legen.
HINWEIS: Wenn die warme Flasche mit dem Medium 6 s lang ohne bis gar keine Beschwerden gehalten werden kann, ist sie bereit zum Ausgießen. - Gießen Sie Platten unter aseptischen Bedingungen in einer Laminar-Flow-Haube oder einer biologischen Sicherheitswerkbank. Kippen Sie die Flasche mit dem Medium über eine offene, leere Petrischale und gießen Sie nur so viel ein, dass der Boden vollständig bedeckt ist.
- Alternativ können Sie eine serologische Glaspipette verwenden und 20 ml Medium in jede Platte pipettieren.
HINWEIS: Dieser Ansatz erhöht die Zeit, in der die Medienflasche eine niedrigere Temperatur hat, und erhöht das Risiko, dass sich der Agar vorzeitig verfestigt.
- Alternativ können Sie eine serologische Glaspipette verwenden und 20 ml Medium in jede Platte pipettieren.
- Lassen Sie die Medien wieder festigen. Lagern Sie die Platten bei 4 °C, wenn sie nicht sofort verwendet werden.
2. Aufbereitung von Pilzsporen oder -gewebe
- Besorgen Sie sich Kulturen jedes Paarungstyps von P. blakesleeanus (z. B. NRRL 1555 (-), NRRL 1554 (+), NRRL 1464 (-) und NRRL 1465 (+)). Um Kreuzungen mit Sporen zu impfen, züchten Sie zuerst jeden Paarungstyp in Reinkultur auf 100% CMA oder PDA
- Schneiden Sie einen Teil des hochmodernen Myzels aus vorhandenen Kulturen ab und legen Sie das herausgeschnittene Myzel auf eine 100% CMA/PDA-Platte. Inkubieren Sie Reinkulturen 1 Woche lang bei 27 °C unter einem 12-stündigen Lichtzyklus.
- Sobald Sporangiophoren vorhanden sind, wird eine sporulierende Reinkultur mit 0,01 % Tween 20 in sterilisiertem, deionisiertem Wasser unter Verwendung einer aseptischen Technik geflutet. Ziehen Sie mit einer P1000-Mikropipette 1,0 ml der Tween-20-Sporen-Mischung von der Platte in ein Mikrozentrifugenröhrchen.
- In einer Minizentrifuge 30 s zentrifugieren, dann den Überstand dekantieren.
- Wenn mehr Sporen benötigt werden, geben Sie weiterhin 1,0 mL der Tween 20-Sporenmischung in dasselbe Mikrozentrifugenröhrchen und wiederholen Sie Schritt 2.4. Nachdem Sie eine geeignete Menge an Sporen erhalten haben, dekantieren Sie den Überstand und ersetzen Sie ihn durch 500 μl steriles deionisiertes Wasser.
- Optional: Verwenden Sie ein Hämazytometer, um die Konzentration der Sporen abzuschätzen, das Aufschluss darüber gibt, ob mehr Wasser hinzugefügt werden muss oder ob die Sporen erneut zentrifugiert werden müssen.
- Alternativ inokulieren Sie die Kreuzungen mit hochmodernen Myzelien aus den Reinkulturen.
- Verwenden Sie eine sterilisierte Rasierklinge oder einen Korklochbohrer, um das Gewebe herauszuschneiden und das Inokulum sofort zu plattieren.
- Richten Sie die Kreuze als 2-Wege-Kreuze, 4-Wege-Kreuze oder 8-Wege-Kreuze ein (Abbildung 1).
HINWEIS: Wenn Kreuze für transkriptomische Arbeiten eingerichtet werden, wird empfohlen, 1-2 zusätzliche Platten pro Bedingung/Medium einzurichten, die als Indikatorplatten dienen. Indikatorplatten ermöglichen es den Forschern, die Lichtexposition von Versuchsplatten zu begrenzen, da Licht die sexuelle Fortpflanzung bei P. blakesleeanus hemmt.- Für ein 2-Wege-Kreuz platzieren Sie komplementäre Gegenstücke einander (Abbildung 1A).
- Das Myzel des Paarungstyps (-), NRRL 1555 oder NRRL 1464, mindestens 1 cm vom Rand einer Petrischale entfernt auf PDA oder CMA platzieren.
- Auf dieselbe Platte, gegenüber der Stelle, an der der (-) Gegenstecker platziert wurde, und 1 cm vom Rand der Petrischale entfernt, den (+) Gegentyp NRRL 1554 oder NRRL1465 platzieren (Abbildung 1A).
HINWEIS: Der Abstand zwischen komplementären Paarungsarten beeinflusst die Größe des Gewebes, das am Sexualzyklus beteiligt ist. Paarungsarten, die weiter auseinander liegen, ermöglichen es dem Myzel, sich stärker auszudehnen, was die Anzahl der sexuellen Interaktionen zwischen den beiden Partnern erhöht.
- Für ein 4-Wege-Kreuz platzieren Sie ähnliche Gegenstücktypen gegenüber, aber neben einem komplementären Gegenstücktyp (Abbildung 1B).
- Platzieren Sie die Sporen oder Myzelien der (-) Paarungstypen NRRL 1555 und NRRL 1464 mindestens 1 cm vom Rand einer Petrischale entfernt auf PDA oder CMA.
- Wählen Sie auf derselben Platte einen Ort zwischen den beiden (-) Paarungstypen und mindestens 1 cm vom Rand der Platte entfernt und beimpfen Sie die Stelle mit Sporen oder Myzelien des (+) Paarungstyps NRRL 1554 oder 1465.
- Auf dieselbe Platte, gegenüber der Stelle, an der der erste (+) Gegentyp geimpft wurde, und mindestens 1 cm von der Platte entfernt, den anderen (+) Gegentyp platzieren.
- Für ein 8-Wege-Kreuz wechseln Sie die Paarungstypen entlang der Peripherie der Petrischale ab, wobei von jedem Paarungstyp vier vorhanden sind (Abbildung 1C).
- Für ein 2-Wege-Kreuz platzieren Sie komplementäre Gegenstücke einander (Abbildung 1A).
- Verschließen Sie die Platten nach dem Impfen mit Parafilm oder (lassen Sie sie unversiegelt) und legen Sie sie in einen zweiten Behälter, bevor Sie sie bei 22 °C im Dunkeln inkubieren. Beobachten Sie die Platten täglich auf Anzeichen einer Paarung, machen Sie Fotos unter der Platte und verfolgen Sie die Myzelien, während die Kulturen wachsen.
HINWEIS: Nach 24 Stunden nach der Impfung ist damit zu rechnen, dass sich das Myzel bei allen Medientypen ausbreitet, aber es ist unwahrscheinlich, dass Personen zu diesem Zeitpunkt in Kontakt kommen. - Abhängig vom Medientyp (PDA oder CMA) und der Formulierung (25 %, 50 %, 100 %), wenn das Myzel Kontakt aufzunehmen beginnt, untersuchen Sie die Myzelien komplementärer Paarungstypen, die in Kontakt stehen, unter einem Präparierbereich auf Anzeichen einer Paarung. Machen Sie Fotos von interagierenden Myzelien mit einer Kamera oder einem Smartphone, das am Präparierfernrohr montiert ist.
- Erfassen Sie Bilder von Myzelien und fügen Sie sie zusammen (z. B. mit der Panorama Stitcher-Anwendung). Verwenden Sie ImageJ, um die Fläche des Myzels zu schätzen (siehe Online-Tutorials).
Ergebnisse
Nach einer 4-Wege-Kreuzung variierte jeder Stamm leicht in seiner Wachstumsrate, die durch die Veränderung der Fläche des Myzels bestimmt wurde (Abbildung 2). Obwohl NRRL 1555 statistisch nicht signifikant ist, zeigte es eine schnellere Flächenänderung, wenn es auf 25 % CMA, 25 % PDA oder 100 % PDA plattiert wurde. In ähnlicher Weise hatte NRRL 1465 eine höhere Flächenveränderung, wenn sie auf 50% PDA oder CMA angebaut wurde. NRRL 1464 hatte die schnellste Flächenzunahme, wenn sie auf 100 % CMA angebaut wurde. Nach 24 h (1 DPI) erschienen Stämme, die auf PDA wuchsen, im Vergleich zu den Stämmen, die auf CMA wuchsen, gelber (Abbildung 3) - PDA hat zuvor gezeigt, dass sie die Pigmentproduktion erhöhen26. Stämme mit 100 % PDA wiesen nach 24 h im Durchschnitt ein höheres Flächenmaß auf (Tabelle 1). Dies steht im Gegensatz zu 25 % CMA, die mit 1 DPI die geringste durchschnittliche Fläche aufwies (Tabelle 1).
Der Kontakt zwischen benachbarten Stämmen wurde erst bei 2 DPI und nur bei Stämmen beobachtet, die auf PDA gezüchtet wurden, insbesondere bei 100 % PDA (Abbildung 4). Die Paarung wurde auf 100 % PDA bei 2 DPI beobachtet. Die auf CMA gezüchteten Stämme hatten bei 2 DPI keinen Kontakt, obwohl 100% CMA Stämme aufwies, die sehr nahe beieinander wuchsen (Abbildung 4). Nach 3-tägiger Inkubation (3 DPI) zeigten Stämme, die auf allen PDA-Formulierungen gezüchtet wurden, eine Paarung, obwohl sich die Dichte der differenzierten Zelltypen unterschied (Tabelle 2 und Abbildung 5). Ein Replikat von 25 % CMA und ein Replikat von 50 % CMA zeigten ebenfalls eine Paarung (Tabelle 2); die übrigen CMA-Platten zeigten keine Paarung (Tabelle 2). Interessanterweise schienen die auf PDA gezüchteten Stämme dichtere, gelbe Myzelien und Lufthyphen zu haben, die sich zu Sporangiophoren entwickelt haben könnten (Abbildung 5). Bei 4 DPI zeigten die PDA-Platten Paarungsreaktionen neben asexuellen Sporangiophoren (Abbildung 6). Die CMA-Platten wiesen Stämme mit diffuseren Myzelien und weniger Sporangiophoren auf (Abbildung 6). Bei 100 % CMA wurde keine Paarung beobachtet (Tabelle 2).
Repräsentative Platten wurden unter einem Präparierbereich bei 4 DPI beobachtet, um zu beurteilen, ob Zelltypen, die mit dem Beginn des Sexualzyklus assoziiert sind, leicht beobachtet werden können. Im Allgemeinen korrelierte eine abnehmende Nährstoffkonzentration mit qualitativ weniger dichten, differenzierten, sexuellen Myzelien (Abbildung 7 und Abbildung 8). Wenn sie auf 100% PDA gezüchtet wurden, konnten einzelne Zygophoren oder Progametangien nicht sichtbar gemacht werden und erschienen als Masse von Zellen (Abbildung 7A). Während 50 % und 25 % PDA an der Paarungsstelle eine geringere Zelldichte aufwiesen, wiesen die 25 % PDA-Platten Zellen auf, die leicht unterschieden werden konnten (Abbildung 7B, C). Beim Vergleich der Zelltypen, die bei 50 % PDA und 25 % PDA beobachtet wurden, schienen die Zellen in der niedrigeren Konzentration überwiegend derselbe Typ zu sein, während es bei der höheren Konzentration eine Mischung von Zellen in verschiedenen Stadien gab (Abbildung 7D, E). Bemerkenswert ist, dass bei 50 % PDA die bei 4 DPI beobachteten Zellen Luftzygophoren enthielten, die gerade erst geschlüpft waren (Abbildung 7D, Sternchen) und einige, die in Progametangien übergingen (Abbildung 7D, Pfeil). Mit 25% PDA schienen sich die meisten Zellen in sehr ähnlichen Entwicklungsstadien zu befinden (Abbildung 7E).
Platten der verschiedenen CMA-Konzentrationen wurden neben den PDA-Platten bei 4 DPI bewertet (Abbildung 8). Wie bereits erwähnt, wurde keine Paarung beobachtet, wenn 100 % CMA verwendet wurde (Abbildung 8A). Bei 50 % CMA oder 25 % CMA wurde eine Paarung beobachtet und die Gesamtzahl der Zelltypen, die mit der sexuellen Fortpflanzung assoziiert sind, war geringer (Abbildung 8B, C). Die bei 4 DPI beobachteten Zygophoren aus der Luft schienen in der gesamten Interaktionszone die gleiche Größe und Höhe zu haben (Abbildung 8B,C). Angesichts der geringeren Gesamtzahl von Zellen, die am Sexualzyklus beteiligt sind, könnten diese hypothetisch mit sterilisierten Rasierklingen oder Präpariernadeln herausgeschnitten und sofort in flüssigem Stickstoff eingefroren werden, um die RNA anschließend zu isolieren. Die Möglichkeit, spezifische Strukturen zum gleichen Entwicklungszeitpunkt auszuwählen, kann die Robustheit von Genexpressionsstudien erhöhen, die versuchen, morphologische Veränderungen mit Genen in Verbindung zu bringen.
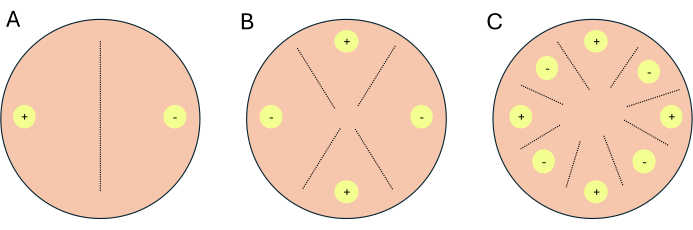
Abbildung 1: Schematische Darstellung von drei Kreuzformaten. (A) Eine 2-Wege-Kreuzung mit zwei Impfstellen (gelbe Kreise) mit komplementären Paarungstypen (+) und (-). (B) eine 4-Wege-Kreuzung mit zwei Inokulationsstellen vom (+) Paarungstyp (gelbe Kreise mit +) und zwei Impfstellen von (-) vom Paarungstyp -(gelbe Kreise mit -). (C) Eine 8-Wege-Kreuzung mit abwechselnden Impfstellen (gelbe Kreise) komplementärer Paarungstypen (+) und (-). Die gestrichelten Linien stellen den vorhergesagten Ort der Paarungsinteraktionen dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
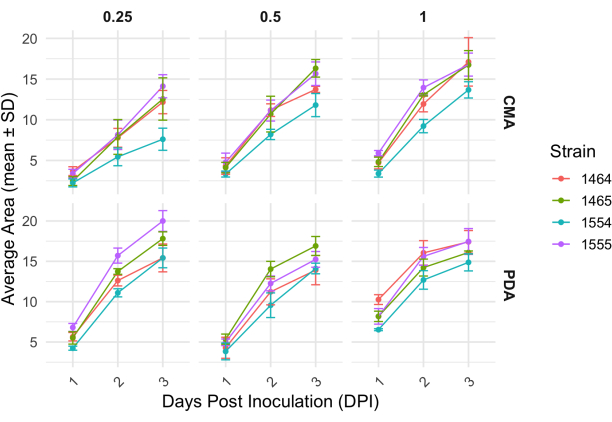
Abbildung 2: Veränderung der Fläche im Laufe der Zeit für jeden Stamm auf CMA und PDA bei unterschiedlichen Konzentrationen. Die durchschnittliche Fläche der P. blakesleeanus-Kolonien wurde über 3 Tage nach der Inokulation aufgetragen. Fehlerbalken stellen die Standardabweichung der mittleren Fläche dar. Siehe auch Tabelle 1. Die Diagramme wurden mit ggplot227 erstellt. Abkürzung: DPI = Tage nach der Impfung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
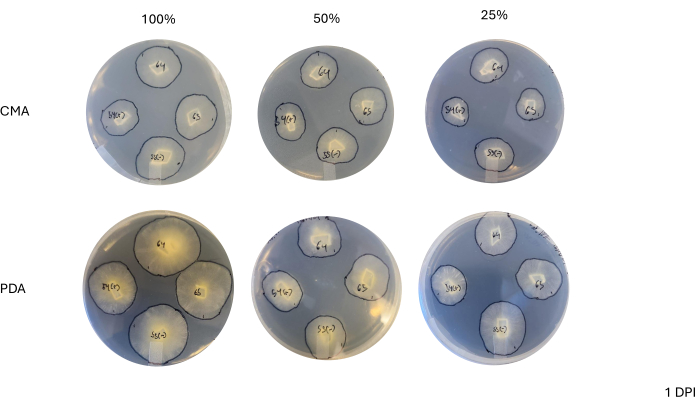
Abbildung 3: Repräsentative Bilder von 4-Wege-Kreuzungen 1 Tag nach der Inokulation. Der Vergleich der Kolonien zeigt Unterschiede je nach Medientyp und Formulierung, was zeigt, dass Kolonien auf 100 % PDA gelber erscheinen als CMA und dass das Wachstum auf 100 % PDA schneller erscheint. Die Bilder wurden vom Boden der Petrischale aufgenommen. Schwarze Linien wurden mit einem Marker gezeichnet, um das Myzel zu umreißen. Abkürzungen: CMA = Maismehl-Agar; PDA = Kartoffel-Dextrose-Agar; DPI = Tage nach der Impfung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative Bilder von 4-Wege-Kreuzungen 2 Tage nach der Inokulation. Der Vergleich der Kolonien zeigt die scheinbare Dichte des Myzelwachstums, wobei die Kolonien auf PDA ein dichteres Myzel zu haben scheinen als die auf CMA. Zusätzlich erscheinen Kolonien auf PDA gelber und die meisten haben entweder Kontakt aufgenommen oder nähern sich dem Kontaktpunkt. Die roten Pfeilspitzen markieren Bereiche, in denen Paarungsinteraktionen begonnen haben, was durch eine Zunahme der Gewebedichte angezeigt wird. Dies steht im Gegensatz zu Kolonien auf CMA, bei denen nur diejenigen mit 100% CMA kurz vor dem Kontakt stehen, und alle CMA-Formulierungen Kolonien aufweisen, die im Vergleich zu denen auf PDA relativ weniger gelb sind und keine mit der Paarung begonnen hat. Die Bilder wurden vom Boden der Petrischale aufgenommen. Schwarze Linien wurden mit einem Marker gezeichnet, um das Myzel zu umreißen. Abkürzungen: CMA = Maismehl-Agar; PDA = Kartoffel-Dextrose-Agar; DPI = Tage nach der Impfung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
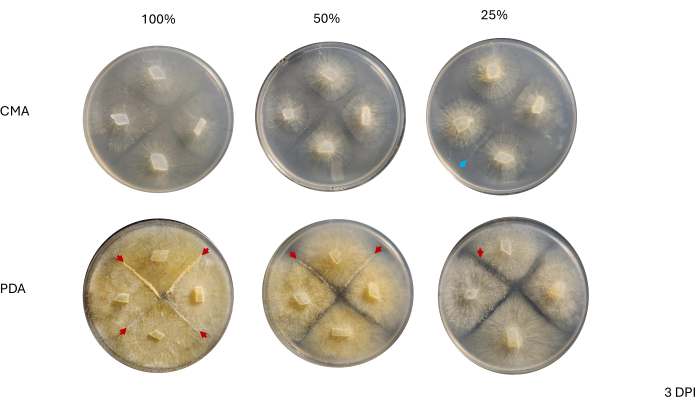
Abbildung 5: Repräsentative Bilder von 4-Wege-Kreuzungen 3 Tage nach der Inokulation. Der Vergleich der Kolonien zwischen den beiden Medientypen zeigt, dass die Myzeldichte höher ist, wenn sie auf PDA gezüchtet wird, verglichen mit CMA. Die roten Pfeilspitzen zeigen, dass alle PDA-Platten mindestens eine Stelle der Paarungsinteraktionen beherbergen. Die Völker mit 100 % CMA und 50 % CMA haben keinen Kontakt aufgenommen, aber zwei Völker mit 25 % CMA (blauer Pfeil) haben Kontakt aufgenommen. Die Bilder wurden von oberhalb der Petrischale aufgenommen. Abkürzungen: CMA = Maismehl-Agar; PDA = Kartoffel-Dextrose-Agar; DPI = Tage nach der Impfung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
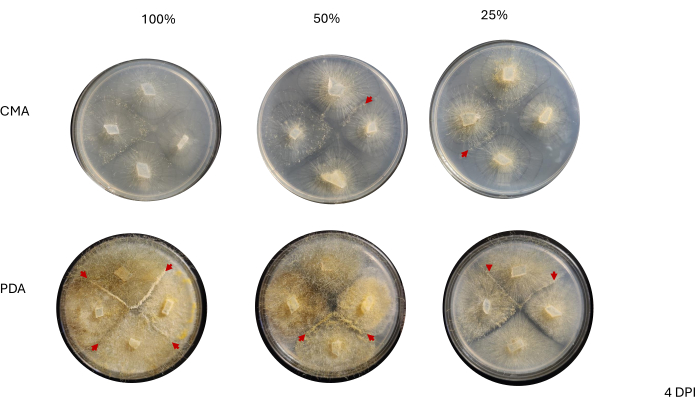
Abbildung 6: Repräsentative Bilder von 4-Wege-Kreuzungen 4 Tage nach der Inokulation. Alle Kolonien auf PDA beherbergen mindestens eine Paarungsinteraktion (rote Pfeile) und weisen ein gelbes Myzel auf. Darüber hinaus zeigen die Kolonien auf PDA ein ausgedehntes Wachstum von Lufthyphen (d.h. asexuellen Sporangien), die die Beobachtung von Paarungsinteraktionen behindern könnten. Die Kolonien auf 50% und 25% CMA zeigen ebenfalls Hinweise auf Paarungsinteraktionen (rote Pfeilspitzen) und weisen im Vergleich zu denen auf PDA ein geringeres Wachstum der Hyphen aus der Luft auf. Die Bilder wurden von oberhalb der Petrischale aufgenommen. Abkürzungen: CMA = Maismehl-Agar; PDA = Kartoffel-Dextrose-Agar; DPI = Tage nach der Impfung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Bilder von Kreuzungen auf PDA. (A) 100 % PDA, (B) 50 % PDA und (C) 25 % PDA. Die interessierenden Bereiche wurden vergrößert (rote Rechtecke). Alle Bilder wurden mit 4 DPI aufgenommen. Eine zusätzliche Ansicht von (D) 50% PDA zeigt das Vorhandensein von sexuell reproduzierenden Zellen in verschiedenen Stadien: junge Zygophoren in der Luft: Sternchen; Ältere Zygophoren in der Luft: rote Pfeile. (E) 25% PDA weist sexuell reproduzierende Zellen in verschiedenen Stadien auf, obwohl diese repräsentative Ansicht eine geringere Überfüllung dieser Strukturen im Vergleich zu 50% PDA zeigt. Maßstabsleisten = 1 mm (A-C), 0,5 mm (D,E). Abkürzungen: PDA = Kartoffel-Dextrose-Agar; DPI = Tage nach der Impfung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
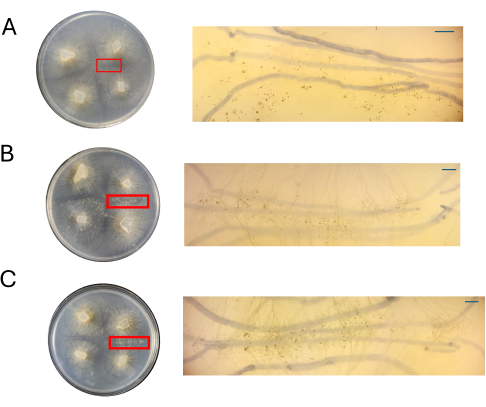
Abbildung 8: Bilder von Kreuzen auf CMA. (A) 100 % CMA, (B) 50 % CMA und (C) 25 % CMA mit Vergrößerung der interessierenden Regionen. Ausgeprägte Sexualstrukturen sind bei 50% (B) und 25% (C) CMA leicht zu beobachten, und die Überfüllung ist minimal. Zu diesem Zeitpunkt sind bei 100% CMA keine sexuellen Strukturen zu sehen. Alle Bilder wurden mit 4 DPI aufgenommen. Petrischale-Bilder und Präparierskop-Bilder wurden von oberhalb der Petrischale aufgenommen. Die dunklen Linien im Hintergrund der Bilder des Präparierzielfernrohrs sind mit einem schwarzen Marker gezeichnet, mit dem die Ausdehnung des Myzels verfolgt wurde. Maßstabsleisten = 1 mm. Abkürzungen: CMA = Maismehl-Agar; DPI = Tage nach der Impfung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Myzelfläche für jeden Stamm über 4 Tage. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Paarweise Beurteilung von Kontakt und Passung für jeden Stamm auf verschiedenen Medien. 0 = Nein, 1 = Ja. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Ein einfaches Protokoll zur Induktion der sexuellen Fortpflanzung bei P. blakesleeanus in einer Laborumgebung wird hier vorgestellt. Eine der wichtigsten Überlegungen für dieses Protokoll ist die Nährstoffbeschränkung. Es wird angenommen, dass Pilze die sexuelle Fortpflanzung als Reaktion auf raue Umweltbedingungen wie Nährstoffbeschränkung kooptierten 6,28,29,30,31,32. Die Variation des Nährstoffgehalts kann die Versuchsplanung beeinflussen. Wenn ein Forscher beispielsweise daran interessiert ist, die Gene, die in Zygophoren in der Luft exprimiert werden, mit Gametangien zu vergleichen, dann wird eine extremere Nährstoffbeschränkung (z. B. 25 % CMA) empfohlen, da die Dichte der Sexualstrukturen im Vergleich zu höheren Formulierungen von CMA oder PDA geringer ist. Eine geringere Dichte an Sexualstrukturen, wie sie bei 50 % oder 25 % CMA beobachtet wurde, bedeutet, dass die Isolierung eines bestimmten differenzierten Zelltyps nicht nur einfacher wäre (da die Zellen leicht identifiziert und herausgeschnitten werden könnten), sondern auch sicherstellen würde, dass nur der interessierende Zelltyp beprobt wird.
Auch Auszubildende oder Studenten würden von diesem Protokoll profitieren, da es dieser Gruppe ermöglicht, die Zelldifferenzierung zu verfolgen und zuverlässig zwischen den verschiedenen Zelltypen zu unterscheiden, die sich während des Sexualzyklus von P. blakesleeanus entwickeln. Die Verwendung von CMA und PDA spiegelt frühere Arbeiten über die Induktion der Paarung von Mukoromyceten 18,22,23 wider, und pulverförmige Formen sind käuflich zu erwerben, wodurch sie im Vergleich zu anderen synthetischen Medien zu den leichter zugänglichen Medien in einem Schulungs- oder Bildungsumfeld gehören.
Da das Ziel dieses Protokolls letztlich darin besteht, die Entwicklung und Differenzierung zu demonstrieren, und darauf hingewiesen wurde, dass die Nährstoffkonzentration einen Einfluss darauf hat, ob bestimmte Zelltypen leicht beobachtet werden können, ist ein kritischer Schritt in diesem Protokoll die Sicherstellung der geeigneten Medienzusammensetzung (Protokollabschnitt 1). Wenn verdünntem PDA oder CMA kein zusätzliches Agarpulver zugesetzt wird, verfestigt sich das Medium möglicherweise nicht richtig und nachfolgende Paarungswechselwirkungen können möglicherweise nicht leicht beobachtet werden. Darüber hinaus sollte der Platzierung von komplementären und ähnlichen Paarungstypen besondere Aufmerksamkeit geschenkt werden (Protokollabschnitt 2). Da P. blakesleeanus heterothallisch ist, benötigt er einen komplementären Paarungspartner, und wenn dieser Partner nicht zugänglich ist oder stattdessen ein ähnlicher Paarungstyp verwendet wird, findet die Paarung nicht statt 10,33,34.
Eine Einschränkung dieses Protokolls ist die asynchrone Entwicklung sexueller Strukturen. P. blakesleeanus dehnt sich, wie andere Pilze, die auf festen Medien wachsen, radial in alle Richtungen aus. Das bedeutet, dass sich Teile des Myzels in einem fortgeschritteneren Stadium des Sexualzyklus befinden als andere. Es gibt Protokolle zur Synchronisierung der sexuellen Entwicklung bei Ascomyceten35, aber diese wurden nicht erfolgreich an Mucoromyceten angepasst. Das bedeutet, dass die Arbeit zur Untersuchung der Genexpression während des Sexualzyklus mit Lärm behaftet ist, wenn sich zu viele Zellen in unterschiedlichen Entwicklungsstadien befinden. Angesichts der Beobachtungen in dieser Studie scheint es, dass die Einschränkung der Nährstoffverfügbarkeit zwar zu weniger sexuell reproduzierenden Zellen führt, die beobachteten Zellen sich jedoch in ähnlichen Entwicklungsstadien zu befinden scheinen. Daher kann die Begrenzung der Nährstoffe dazu beitragen, die Dichte differenzierter Sexualstrukturen zu begrenzen, was einem Forscher Zugang zu weitgehend synchronem Gewebe auf Kosten geringerer Erträge gewährt.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Wir danken dem Colorado College Natural Sciences Executive Committee, dem Organismal Biology and Ecology Department und dem Hevey Family Fund for Student Research für die Finanzierung dieser Arbeit. Wir danken auch Alice Keller und Tia Hutchens für ihre technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Agar powder | ThermoFisher | 3453PK | |
| chloramphenicol | FisherSci | BP904-100 | |
| Cornmeal agar | Carolina | 742460 | |
| Panorama Stitcher | Apple App Store | ||
| Phycomyces blakesleeanus (-) NRRL 1555 | United States Department of Agriculture - Agricultural Research Service | 1555 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) NRRL 1564 | United States Department of Agriculture - Agricultural Research Service | 1564 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (-) Tube Culture | Carolina Biological Supply | 156183 | Education-grade culture available for purchase; NRRL 1555 |
| Phycomyces blakesleeanus (+) NRRL 1554 | United States Department of Agriculture - Agricultural Research Service | 1554 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) NRRL 1565 | United States Department of Agriculture - Agricultural Research Service | 1565 | USDA-ARS will only ship to academic researchers; see below for alternatives |
| Phycomyces blakesleeanus (+) Tube Culture | Carolina | 156182 | Education-grade culture available for purchase; NRRL 1554 |
| Potato dextrose agar | FisherSci | DF0013-17-6 | |
| Sprout Plus Mini Centrifuge | Heathrow Scientific | SKU 120610 | |
| Tween 20 | Sigma-Aldrich | P6585-10ML |
Referenzen
- NaranjoOrtiz, M. A., Gabaldón, T. Fungal evolution: diversity, taxonomy and phylogeny of the fungi. Biol Rev Camb Philos Soc. 94 (6), 2101-2137 (2019).
- Idnurm, A. Sex determination in the firstdescribed sexual fungus. Eukaryot Cell. 10 (11), 1485-1491 (2011).
- Spatafora, J. W., et al. A phylumlevel phylogenetic classification of zygomycete fungi based on genomescale data. Mycologia. 108 (5), 1028-1046 (2016).
- Wang, Y., et al. Divergent evolution of early terrestrial fungi reveals the evolution of mucormycosis pathogenicity factors. Genome Biol Evol. 15 (4), evad046(2023).
- Gryganskyi, A. P., et al. Sequencing the genomes of the first terrestrial fungal lineages: what have we learned. Microorganisms. 11 (7), 1830(2023).
- Peña, J. F. The evolutionary developmental biology of Mucoromycotina [Doctoral dissertation]. , University of California, Riverside. (2022).
- Wetzel, J., Burmester, A., Kolbe, M., Wöstemeyer, J. The matingrelated loci sexM and sexP of the zygomycetous fungus Mucor mucedo and their transcriptional regulation by trisporoid pheromones. Microbiology (Reading). 158 (Pt 4), 1016-1021 (2012).
- Camino, L. P., Idnurm, A., CerdáOlmedo, E. Diversity, ecology, and evolution in Phycomyces. Fungal Biol. 119 (11), 1007-1021 (2015).
- Gryganskyi, A. P., et al. Structure, function, and phylogeny of the mating locus in the Rhizopus oryzae complex. PLoS One. 5 (12), e15273(2010).
- Blakeslee, A. F. Sexual reproduction in the Mucorineae. Proc Am Acad Arts Sci. 40, 205-319 (1904).
- Sutter, R. P., Grandin, A. B., Dye, B. D., Moore, W. R. (-) mating typespecific mutants of Phycomyces defective in sex pheromone biosynthesis. Fungal Genet Biol. 20 (4), 268-279 (1996).
- Sahadevan, Y., RichterFecken, M., Kaerger, K., Voigt, K., Boland, W. Early and late trisporoids differentially regulate βcarotene production and gene transcript levels in the mucoralean fungi Blakeslea trispora and Mucor mucedo. Appl Environ Microbiol. 79 (23), 7466-7475 (2013).
- Gooday, G. W., Carlile, M. J. The discovery of fungal sex hormones: III. Trisporic acid and its precursors. Mycologist. 11 (3), 126-130 (1997).
- Banbury, G. H. Processes controlling zygophore formation and zygotropism in Mucor mucedo Brefeld. Nature. 173, 499-500 (1954).
- Sutter, R. P., Whitaker, J. P. Zygophorestimulating precursors (pheromones) of trisporic acids active in (-)Phycomyces blakesleeanus. Acidcatalyzed anhydro derivatives of methyl 4dihydrotrisporateC and 4dihydrotrisporateC. J Biol Chem. 256 (5), 2334-2341 (1981).
- Gooday, G. W. Functions of trisporic acid. Philos Trans R Soc Lond B Biol Sci. 284, 509-520 (1978).
- Bergman, K., et al. Phycomyces. Bacteriol Rev. 33 (1), 99-157 (1969).
- O'Donnell, K. L., Hooper, G. R., Fields, W. G. Zygosporogenesis in Phycomyces blakesleeanus. Can J Bot. 54, 2573-2586 (1976).
- Delbrück, M., Reichardt, W. I. System analysis for the light growth reactions of Phycomyces. Cellular Mechanics in Differentiation and Growth. Rudnick, D. , Princeton University Press. 3-44 (1957).
- Idnurm, A., et al. The Phycomyces madA gene encodes a bluelight photoreceptor for phototropism and other light responses. Proc Natl Acad Sci USA. 103 (12), 4546-4551 (2006).
- Shakya, V. P. S., Idnurm, A. The inhibition of mating in Phycomyces blakesleeanus by light is dependent on the MadAMadB complex that acts in a sexspecific manner. Fungal Genet Biol. 101, 20-30 (2017).
- Yamazaki, Y., Miyazaki, A., Kataoka, H., Ootaki, T. Effects of chemical components and nitrogen sources on zygospore development in Phycomyces blakesleeanus. Mycoscience. 42 (1), 11-17 (2001).
- Idnurm, A., Walton, F. J., Floyd, A., Heitman, J. Identification of the sex genes in an early diverged fungus. Nature. 451 (7175), 193-196 (2008).
- Agrios, G. N. Plant pathogens and disease: general introduction. Encyclopedia of Microbiology. Schaecter, M. , Elsevier. 613-646 (2009).
- Valle, M., et al. Impact of water activity on the radial growth of fungi in a dairy environment. Food Res Int. 157, 111247(2022).
- Heo, Y. M., et al. Investigation of filamentous fungi producing safe, functional watersoluble pigments. Mycobiology. 46 (3), 269-277 (2018).
- Wickham, H. ggplot2 elegant graphics for data analysis. , Springer International Publishing. Cham, Switzerland. (2016).
- Lubkowitz, M. A., et al. Schizosaccharomyces pombe isp4 encodes a transporter representing a novel family of oligopeptide transporters. Mol Microbiol. 28 (4), 729-741 (1998).
- Nelson, M. A., Metzenberg, R. L. Sexual development genes of Neurospora crassa. Genetics. 132 (1), 149-162 (1992).
- Sato, S., Suzuki, H., Widyastuti, U., Hotta, Y., Tabata, S. Identification and characterization of genes induced during sexual differentiation in Schizosaccharomyces pombe. Curr Genet. 26 (1), 31-37 (1994).
- Grishkan, I., Korol, A. B., Nevo, E., Wasser, S. P. Ecological stress and sex evolution in soil microfungi. Proc Biol Sci. 270 (1510), 13-18 (2003).
- Bernstein, H., Byers, G. S., Michod, R. E. Evolution of sexual reproduction: importance of DNA repair, complementation, and variation. Am Nat. 117 (4), 537-549 (1981).
- Heitman, J., et al. The fungal kingdom. , ASM Press. (2017).
- Heitman, J., et al. Sex in fungi molecular determination and evolutionary implications. , ASM Press. (2007).
- Wang, Z., LópezGiráldez, F., Wang, J., Trail, F., Townsend, J. P. Integrative activity of mating loci, environmentally responsive genes, and secondary metabolism pathways during sexual development of Chaetomium globosum. mBio. 10, (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten