Method Article
Domuz Kemik İliği Mezenkimal Kök Hücreleri ve Türemiş Hücre Dışı Veziküllerinin İzolasyonu ve Tanımlanması
Bu Makalede
Özet
Bu makale, domuz kemik iliği mezenkimal kök hücrelerini (pBM-MSC'ler) ve bunlardan türetilen hücre dışı vezikülleri (EV'ler) izole etmek ve tanımlamak için bir yöntemi detaylandırarak, BM-MSC'lerin ve bunlardan türetilen EV'lerin transplantasyon etkinliğinin klinik öncesi değerlendirmesi için metodolojik bir temel sağlar.
Özet
Translasyonel araştırma ve rejeneratif tıpta kök hücre tedavisinin gelişmesiyle birlikte, bir tür pluripotent kök hücre olarak kemik iliği mezenkimal kök hücreleri (BM-MSC'ler), anında bulunabilirlikleri ve kanıtlanmış güvenlikleri nedeniyle tercih edilmektedir. BM-MSC'lerin transplantasyonunun, parakrin mekanizmalar yoluyla immün ve inflamatuar yanıtların modüle edilmesiyle ilişkili olabilecek çeşitli hastalıklarda yaralı dokuların onarımında büyük yararı olduğu bildirilmiştir. Çift katmanlı lipid membran yapısına sahip hücre dışı veziküller (EV'ler), kök hücrelerin parakrin etkilerinin ana aracıları olarak kabul edilir. Hücre iletişimi ve epigenetik düzenlemedeki önemli rolleri ile tanınan EV'ler, immünoterapi için in vivo olarak zaten uygulanmıştır. Bununla birlikte, maternal hücrelerine benzer şekilde, EV'lerin transplantasyonunun etkinliği üzerine yapılan çalışmaların çoğu hala küçük hayvanlar düzeyinde kalmaktadır ve bu da klinik çeviri için temel kanıt sağlamak için yeterli değildir. Burada, ilk önce kemik iliği hücrelerini (BMC) domuz kemik iliğinden izole etmek için yoğunluk gradyanlı santrifüjleme kullanıyoruz ve daha sonra mikroskop altında gözlem sonuçları, indüklenmiş farklılaşma testi ve akış sitometrisi ile tanımlanan hücre kültürü ile domuz BM-MSC'lerini (pBM-MSC'ler) elde ediyoruz. Ayrıca, transmisyon elektron mikroskobu (TEM), nanopartikül izleme analizi (NTA) ve western blotlama teknikleriyle başarılı bir şekilde kanıtlanan ultrasantrifüjleme ile hücre süpernatantındaki pBM-MSC'lerden türetilen EV'leri izole ediyoruz. Genel olarak, pBM-MSC'ler ve bunlardan türetilen EV'ler, BM-MSC'lerin ve bunlardan türetilen EV'lerin transplantasyon etkinliği üzerine klinik öncesi çalışmalarda yaygın olarak kullanılabilecek aşağıdaki protokollerle etkili bir şekilde izole edilebilir ve tanımlanabilir.
Giriş
Son 10 yılda kök hücre tedavisi, travma, solunum ve kardiyovasküler hastalıklar gibi çeşitli hastalık ve yaralanmalardan muzdarip hastalar için büyük faydalar vaat etti. Alandaki ilerlemeyle birlikte, kemik iliği mezenkimal kök hücreleri (BM-MSC'ler), erişilebilirlikleri ve diğer hücre tiplerine rağmen klinik araştırmalar için altın standart olarak kabul edilenaz sayıda etik anlaşmazlık 1 nedeniyle insanlar tarafından yavaş yavaş tercih edilmektedir2. BM-MSC'lere dayalı tedaviler, immün ve enflamatuar yanıtları modüle etme ve farklılaşma veya parakrin mekanizmalar yoluyla yaralı dokuları onarma konusundaki benzersiz yetenekleri nedeniyle giderek daha fazla araştırmacı için çekicidir3.
Uluslararası Hücre Dışı Veziküller Derneği'nin (ISEV)onayladığı gibi hücre dışı veziküller (EV'ler), hücrelerden doğal olarak salınan lipid çift katmanlı bir yapıya sahip toplam parçacıkları ifade eder. Farklı hücre tiplerindenEV'lerde proteinler, lipitler ve genetik materyaller (örneğin, miRNA, mRNA, DNA molekülleri ve ayrıca uzun kodlamayan RNA'lar) gibi çeşitli içeriklerin son keşifleriyle 5, hücre iletişimi ve epigenetik düzenlemedeki önemli rolleri kabul edilmiştir6. Maternal hücreler için yeni bir ikame olarak, EV'ler immünoterapi ve rejeneratif tıpta, devam eden klinik öncesi araştırma ve takip klinik çalışmaları için temel teşkil eden in vivo çalışmalarla uygulanmıştır7.
Bununla birlikte, şu anda, BM-MSC'lerin ve bunlardan türetilen EV'lerin transplantasyonunun etkinliği üzerine yapılan çalışmaların çoğu, klinik çeviri için gerekli kanıtları sağlamak için yeterli olmayan küçük hayvanlar düzeyinde kalmaktadır. Sonuç olarak, BM-MSC'lerin ve bunlardan türetilen EV'lerin domuz gibi büyük hayvanlar düzeyinde nakli konusunda klinik öncesi araştırmalar yapmak son derece acildir.
MSC'lerin kemik iliğinde son derece düşük sayılarda bulunduğu ve toplam hücrelerin sadece %0.01 ila %0.001'ini oluşturduğu bildirilmiştir8. Bununla birlikte, BM-MSC'lerin klinik öncesi uygulaması çok sayıda hücre gerektirir (hayvan başına ≥107 )9; gereken EV miktarı daha da fazladır, bunun medyan dozu domuz10'da vücut ağırlığının kilogramı başına 0.25 mg proteindir. Bu büyük sayılara ulaşmak için, MSC'leri in vitro olarak büyük genişlemelerini sağlamak ve daha sonra yüksek protein konsantrasyonuna sahip EV'lerini elde etmek için domuz kemik iliğinden izole etmek ve kültürlemek için güvenli ve etkili bir yönteme acil ihtiyaç vardır.
Şimdiye kadar, BM-MSC'leri ve bunlardan türetilen EV'leri izole etmek için çeşitli yöntemler vardır. BM-MSC'leri izole etmek için mevcut yöntemler arasında kemik iliği hücrelerinin (BMC'ler) 11 doğrudan ekilmesi, yoğunluk gradyanlı santrifüjleme, hücre yüzeyi moleküler etiket sıralama ve akış sitometrisi taraması yer alır. Hücre yüzeyi moleküler etiket sınıflandırması ve akış sitometrisi taramasının hücre adezyon oranında azalma, 24 saat mortalitede artış ve proliferasyon inhibisyonu12 ile sonuçlandığı, BMC'lerin doğrudan kültürünün ise çok sayıda karışık hematopoietik hücre ile sonuçlanabileceği bildirilmiştir. Bu nedenle, yoğunluk gradyanlı santrifüjleme artık BM-MSC'leri elde etmek için yaygın olarak kullanılmaktadır. EV'leri hücre süpernatantlarından izole etmek için mevcut yöntemler arasında ultrasantrifüjleme, ultrafiltrasyon, polimer çökeltme ve boyut dışlama13 bulunur. Diğer yöntemlerle karşılaştırıldığında, ultrasantrifüjleme, EV ayırma14 için "altın standart" olan düşük maliyet, kullanım kolaylığı ve karmaşık ön işlem olmaksızın büyük hacimli hazırlama ile uyumluluk avantajına sahiptir. Bununla birlikte, işlem sırasında farklı laboratuvarlardaki reaktiflerde ve tekniklerde büyük bir heterojenlikvardır 3,15 ve bu da okuyucular için yanıltıcı olabilir. Bu makale, pBM-MSC'leri ve bunlardan türetilen EV'leri ayrıntılı olarak izole etmek için bir dizi ardışık adımı açıklamaktadır ve sonraki tanımlama sonuçları, yöntemin klinik öncesi araştırmalarda daha fazla analiz için pBM-MSC'leri ve EV'lerini elde etmek için mümkün olduğunu kanıtlamaktadır. Bu sistematik çalışmanın, klinik deneylerin mümkün olan en kısa sürede gerçekleştirilebilmesi için pBM-MSC'lerin ve bunlardan türetilen EV'lerin transplantasyonunun klinik öncesi değerlendirmesinde yer alan araştırmacılar için metodolojik bir temel sağlayabileceğini umuyoruz.
Protokol
ABD Ulusal Sağlık Enstitüleri tarafından yayınlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na göre, tüm deneysel prosedürler Çin Tıp Bilimleri Akademisi, Fuwai Hastanesi, Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylandı.
1. Hayvanlar için ameliyat öncesi hazırlık
- Çin Bilimler Akademisi Zooloji Enstitüsü'nden yaklaşık 12 aylıkken yetişkin erkek Çin minidomuzlarını (30 ± 5 kg) alın ve en az 2 hafta önceden Fuwai Hastanesi Hayvan Deney Merkezi'nin tesislerine yerleştirin. Hayvanların sağlıklı olduğundan emin olmak için kan rutin muayeneleri gibi ameliyat öncesi denetimler yapın.
- Operasyondan bir gün önce minidomun uyluk bölgesinin derisini temizleyin ve tıraş edin. Aspirasyonu önlemek için, kemik iliği ekstraksiyonundan önce minipig'i 12 saat oruç tutun.
2. Hücre izolasyonu ve ekimi için hazırlık
- Mezenkimal kök hücreleri kemik iliğinden izole etmek için Percoll (1.130 g / mL) kullanın. İzotonik bir ortam elde etmek için stok çözeltisini 10x konsantre PBS ile 9:1 oranında karıştırın. Daha sonra, pBM-MSC'leri izole etmek için son ayırma çözeltisi olarak kullanılabilen% 60 Percoll çözeltisi (1.077 g / mL) elde etmek için izotonik ortamı 3: 2 oranında PBS ile karıştırın.
- Tam bir ortam elde etmek için Iscove'un Modifiye Dulbecco's Medium'unu (IMDM) %10 fetal sığır serumu ve %1.0 penisilin-streptomisin ile hazırlayın. Sonraki hücre yetiştiriciliği için tüm ortamı ve PBS'yi 37 ° C'lik bir su banyosunda önceden ısıtın.
3. Hayvanlar için anestezi
- Genel anesteziyi ketamin (10 mg / kg) ve ksilazin (2 mg / kg) ile intramüsküler olarak uygulayın. Minipig yavaş solunuma ve daha az uzuv aktivitesine sahip olduğunda endotrakeal entübasyonu hızlı bir şekilde gerçekleştirin ve başarısız entübasyonu önlemek için spontan solunumu koruyun.
- Taşıyıcı gaz olarak oksijen (1,5 L / dak) ile% 2 izofluran soluyarak anestezinin bakımını gerçekleştirin. Anestezi sırasında, minipig'in kalp atış hızını, solunumunu ve kan oksijen doygunluğunu gerçek zamanlı olarak izleyin.
4. Minipigden kemik iliği çıkarılması
- Minipig'i yanal konuma getirin. Sonraki hücre kültürü için yeterli miktarda kemik iliği sağlamak için, minidomuzun proksimal uyluk kemiğindeki kemik iliği delinme noktasını bulun (Şekil 1). Operasyon uygulanmadan önce delinme bölgesinin cildini dezenfekte edin ve örtün.
- Baskın olmayan el ile delinme noktasının etrafındaki cildi sıkın ve kemik iliği biyopsi iğnesini baskın el ile bu noktada dikey olarak delin. İğnenin kortikal kemikle temas ettiğini hissettiğinizde, iğneyi delmek için kolu hafifçe sola ve sağa çevirin. İğne kemik iliği boşluğuna girdiğinde, genellikle direnç kaybetme hissi vardır.
- Delinme yerine oturduktan sonra, çekirdek iğneyi geri çekin. Daha sonra dış iğnenin ucuna tek kullanımlık steril 50 mL'lik bir şırınga takın ve şırınganın iç duvarını önceden heparin ile durulayın.
- 20 mL kemik iliğini yavaşça çıkarın ve dikkatlice steril 50 mL'lik bir santrifüj tüpüne aktarın.
- İşlem tamamlandığında iğneyi dışarı çekin ve örtüyü çıkarın. Delinme bölgesini dezenfekte edin ve hemostaz için 20 dakika boyunca bastırın.
- Spontan solunumu geri kazandırdıktan sonra minipig'i ekstübe edin. Uzuvların serbest hareketi ile tamamen uyandığında, beslenmeye devam etmek için minidomuzu kafese geri koyun.
5. Mezenkimal kök hücrelerin kemik iliğinden izole edilmesi
- Kemik iliğine eşit miktarda önceden ısıtılmış PBS ekleyin ve iyice karıştırın. Daha sonra, seyreltilmiş kemik iliğinin 20 mL'sini steril 50 mL'lik bir santrifüj tüpünde 1: 1 hacim oranında %60 yoğunluk gradyan solüsyon seviyesinin üzerine aktarmak için steril bir pipet kullanın.
- Tüpü oda sıcaklığında (RT) 20 dakika boyunca 600 x g'da (hızlanma (ACC) = 5, yavaşlama (DEC) = 5) santrifüjleyin.
NOT: Santrifüjlemeden sonra tüpte serum fazı, mononükleer hücre fazı, yoğunluk gradyan orta fazı ve yukarıdan aşağıya çökeltme fazı dahil olmak üzere dört faz oluşur. Mononükleer hücre fazı, serum ile yoğunluk gradyan ortamı arasında ince bir topaklaştırıcı tabakadır. Kemik iliğinden elde edilen mezenkimal kök hücreler bu aşamada yer alır. - Mononükleer hücre fazını steril 15 mL'lik bir santrifüj tüpüne çekin ve 5 dakika boyunca 800 x g'da PBS ile iki kez yıkayın.
- Yıkanmış hücreleri 2 mL tam ortamda yeniden süspanse edin ve yeniden süspanse edilmiş hücreleri 3-5 x 105 / mL yoğunlukta 175cm2'lik bir hücre kültürü şişesine yerleştirin.
NOT: Mezenkimal kök hücreleri izole etmek için yukarıdaki tüm prosedürler Şekil 2'de görülebilir.
6. Mezenkimal kök hücrelerin in vitro olarak yetiştirilmesi
- Kültür şişesini 37 °C'de% 5 CO2 doymuş nemlendirilmiş bir atmosferde inkübe edin. Çökelmiş hematopoietik kök hücrelerin yapışık büyümesini önlemek için kültür şişesini her 24 saatte bir hafifçe çalkalayın ve mikroskop altında hücre büyümesini, morfolojisini ve kontaminasyonunu gözlemleyin.
- Kültür ortamını ilk kez 3 gün sonra değiştirin ve ardından ortamı her 2-3 günde bir değiştirin. Hücre kolonileri %80-90 birleşime ulaştığında, hücreleri 1:2 oranında alt kültüre alın.
7. pBM-MSC'lerin adipojenik, osteojenik ve kondrojenik farklılaşması
- Adipojenik farklılaşma testi
- Kit talimatlarına göre BM-MSC'ler için adipojenik farklılaşma ortamı A (Orta A) ve B (Orta B) hazırlayın. Kit ile ilgili özel bilgiler Malzeme Tablosunda bulunabilir.
- Altı oyuklu plakaya 1 mL %0.1 jelatin ekleyin ve her bir oyuğun dibini eşit şekilde kaplayabilmesi için hafifçe çalkalayın. Ardından altı oyuklu plakayı en az 30 dakika boyunca temiz bir tezgaha veya CO2 inkübatöre yerleştirin.
- 30 dakika sonra jelatini aspire edin ve her oyuğa 2 mL genel tam ortam ekleyin. Daha sonra pBM-MSC'leri 2 x 104 hücre/cm2 hücre yoğunluğunda altı oyuklu plakaya yerleştirin. Bundan sonra, plakayı 37 ° C'de% 5 CO2 doymuş nemde inkübe edin.
- Hücreler% 100 birleşime ulaştığında, tüm ortamı dikkatlice çıkarın ve plakanın her bir oyuğuna 2 mL Ortam A ekleyin. 3 gün sonra, Orta A'yı plakadan çıkarın ve her oyuğa 2 mL Orta B ekleyin.
- 1 gün baktıktan sonra, Orta B'yi çıkarın ve indüksiyon için Orta A ile değiştirin. "3 gün boyunca Orta A, 1 gün boyunca Orta B" şekline göre, indüksiyon için Orta A ve B'yi sırayla kullanın.
- Dönem boyunca her gün hücre durumunu gözlemleyin. Ortam A'nın indüksiyon işlemi sırasında hücreler küçülür veya ölürse, hücre durumu düzelene kadar zamanında Ortam B ile değiştirin.
- İndüksiyon ve bakım işlemini tekrarlayın ve mikroskop altında uygun boyutta yeterli lipid damlacıkları gözlendiğinde boyamaya hazırlanın.
- Altı oyuklu plakada adipojenik farklılaşma için ortamı çıkarın ve 1x PBS ile nazikçe yıkayın. Her kuyucuğa 2 mL% 4 paraformaldehit çözeltisi ekleyin ve RT'de 30 dakika sabitleyin.
- Paraformaldehit fiksatifini çıkarın ve fiksatifin iyice çıkarıldığından emin olmak için iki veya üç kez 1x PBS ile yıkayın. Her oyuğa 2 mL Yağ Kırmızı O boya ekleyin ve RT'de 30 dakika boyayın.
- Yağ Kırmızı O boyasını çıkarın ve iki veya üç kez 1x PBS ile yıkayın. Her oyuğa 2 mL 1x PBS ekleyin ve ardından mikroskop altında adipojenik farklılaşmanın etkisini gözlemleyin.
- Osteojenik farklılaşma testi
- Kit talimatlarına göre osteojenik farklılaşma için tüm ortamı hazırlayın.
- pBM-MSC'leri dikmek ve kültürlemek için 7.1.2-7.1.3 adımlarını izleyin.
- Hücreler% 70 birleşmeye ulaştığında, genel tam ortamı dikkatlice çıkarın ve plakanın her bir oyuğuna osteojenik farklılaşma için 2 mL ortam ekleyin.
- Her 3 günde bir taze osteojenik farklılaşma ortamına geçin. İndüksiyona 2-4 hafta devam edin ve osteogenez sırasında belirgin kalsiyum nodülleri ortaya çıktığında Alizarin Kırmızı boyası ile lekelenmeye hazırlanın.
- Altı oyuklu plakada osteojenik farklılaşma için ortamı çıkarın ve 1x PBS ile nazikçe yıkayın. Her kuyucuğa 2 mL% 4 paraformaldehit çözeltisi ekleyin ve RT'de 30 dakika sabitleyin.
- Paraformaldehit fiksatifini çıkarın ve fiksatifin iyice temizlendiğinden emin olmak için iki veya üç kez 1x PBS ile yıkayın. Her oyuğa 2 mL Alizarin Kırmızı boya ekleyin ve RT'de 10 dakika boyayın.
- Alizarin Kırmızı boyasını çıkarın ve iki veya üç kez 1x PBS ile yıkayın. Her oyuğa 2 mL 1x PBS ekleyin ve ardından mikroskop altında osteojenik farklılaşmanın etkisini gözlemleyin.
- Kondrojenik farklılaşma testi
- Ön karışımı kit talimatlarına göre kondrojenik farklılaşma için hazırlayın.
- 3-4 x 105 pBM-MSC'leri steril 15 mL'lik bir santrifüj tüpüne aktarın. 20 ° C'de 4 dakika boyunca 250 x g'da santrifüjleyin.
- Süpernatanı çıkarın ve önceki adımda santrifüjleme ile elde edilen peleti yeniden süspanse etmek için 0,5 mL ön karışım ekleyin ve ardından 20 °C'de 5 dakika boyunca 150 x g'da santrifüjleyin. Hücreleri tekrar yıkamak için bu adımı tekrarlayın.
- Kondrojenik farklılaşma için tüm ortamı hazırlayın.
- Önceki adımda elde edilen hücreyi 0.5 mL tam ortam ile yeniden süspanse edin ve 150 x g'da 20 ° C'de 5 dakika santrifüjleyin.
- Gaz değişimini kolaylaştırmak için santrifüj tüpünün kapağını sökün. 37 °C, %5CO2 ve doymuş nemde bir inkübatöre dik olarak yerleştirin.
- Hücreler toplanıyor gibi göründüğünde (genellikle fiili duruma bağlı olarak 24-48 saat sonra), kıkırdak toplarının alttan ayrılmasını ve ortamda asılı kalmasını sağlamak için santrifüj tüpünün altını hafifçe vurun.
- Her 2-3 günde bir kondrojenik farklılaşma için taze tam ortama geçin. Tüpte 1.5-2 mm çapında kıkırdak topları oluşana kadar indüksiyona devam edin ve ardından boyama için bölümler hazırlayın.
- Kıkırdak toplarının parafin bölümlerini patolojik deneylerin rutin adımlarına göre hazırlayın. Mumdan arındırılmış bölümlere Alicia mavisi boyası ekleyin ve 37 °C'de 1 saat boyayın.
- Slaytı 5 dakika akan su ile durulayın ve kuruduktan sonra mikroskop altında Alicia mavisinin lekelenme etkisini gözlemleyin.
8. Akım sitometrisi ile hücre fenotipinin tanımlanması
- Hücre kolonileri 3-5 pasajlarında% 80 -% 90 birleşime ulaştığında, kültür ortamını çıkarın ve hücreleri önceden ısıtılmış PBS ile iki kez yıkayın. Daha sonra hücreleri 3-4 mL% 0.25 tripsin / EDTA ile sindirin ve 37 ° C'de% 5 CO2 doymuş nemlendirilmiş bir atmosferde 2-3 dakika boyunca mikroskop altında şişenin dibinden ayrılana kadar inkübe edin.
- Hücreleri 10 mL'lik tam bir ortamla hasat edin ve hücre süspansiyonunu steril bir 15 mL'lik santrifüj tüpüne aktarın. Hücre süspansiyonunu RT'de 5 dakika boyunca 800 x g'da santrifüjleyin. Süpernatanı atın ve hücreleri 4 °C PBS ile yıkayın.
- Hücreleri 4 °C PBS ile 10 mL'ye yeniden süspanse edin. Hücre süspansiyonu, her 1.5 mL mikrotüpte 1 mL hacme sahip, sırasıyla negatif kontrol, FITC izotip kontrolü, PE izotip kontrolü, APC izotip kontrolü, CD105, CD29, CD90, CD14 ve CD45 grubu olarak adlandırılan dokuz gruba ayrılır. Her mikrotüpteki hücre sayısının 1 x 105 ile 1 x 106 arasında olduğundan emin olun.
- Süspansiyonu 800 x g'de 4 ° C'de 5 dakika boyunca santrifüjleyin ve her bir mikrotüpteki hücreleri tekrar 100 μL 4 ° C PBS ile yeniden süspanse edin. Negatif kontrol grubu dışında, akış sitometrisi için karşılık gelen izotip kontrolünden (FITC, PE ve APC Fare IgG1 kappa İzotip Kontrolü) ve antikorlardan (CD105, CD29, CD90, CD14 ve CD45 Monoklonal Antikor) 5 μL ekleyin adım 8.3'teki sıraya göre her bir mikrotüpe. Yavaşça karıştırın ve karanlıkta 4 °C'de 1,5 saat inkübe edin.
- Her mikrotüpe 1 mL 4 °C PBS ekleyin ve 4 °C'de 10 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı atın ve hücreleri yeniden süspanse etmek için 200 μL 4 °C PBS ekleyin.
- Hücre süspansiyonunu16 filtreledikten sonra akış sitometrisi üzerinde en az 10.000 hücreyi test edin ve akış sitometrisi yazılımını kullanarak verileri analiz edin.
9. Domuz kemik iliği mezenkimal kök hücrelerinden türetilen hücre dışı veziküllerin (EV'ler) izole edilmesi
- pBM-MSC'lerin birleşmesi %80-90'a ulaştığında, süpernatanı atın ve hücreleri PBS 2x ile yıkayın. Daha sonra her bir kültür şişesine 25 mL serumsuz IMDM ekleyin ve 37 ° C'de% 5 CO2 nemlendirilmiş bir atmosferde 48 saat boyunca inkübe etmeye devam edin.
- Hücre süpernatantını (şartlandırılmış ortam, CM) 50 mL'lik bir santrifüj tüpüne toplayın ve hücre kalıntılarını gidermek için 4 ° C'de 10 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı tekrar 50 mL'lik başka bir santrifüj tüpüne toplayın. Süpernatanı topladıktan sonra EV'lerin izolasyonunu mümkün olan en kısa sürede gerçekleştirin. Uzun süreli depolama için, EV kaybını önlemek için süpernatanı buzdolabında -80 °C'de saklayın.
- Süpernatanı adım 9.3'te 2.000 x g'da 4 ° C'de 20 dakika boyunca santrifüjleyin.
- Süpernatanı, yüksek hızlı santrifüj için kullanılan steril bir tüpe aktarın ve 4 ° C'de 30 dakika boyunca 16.500 x g'da santrifüjleyin.
- Süpernatanı tekrar bir ultrasantrifüj tüpüne aktarın ve sabit açılı bir rotor ile 4 ° C'de en az 70 dakika boyunca 120.000 x g'da santrifüjleyin.
- Süpernatanı tamamen atın. Her bir ultrasantrifüj tüpüne 1 mL 4 °C PBS ekleyin ve çökeltmeyi bir mikropipet ile yeniden süspanse edin. Aynı gruptaki çözeltiyi bir ultrasantrifüj tüpüne karıştırın ve ardından hacmi tüpün 3 / 4'ünden fazla yapmak için 4 °C PBS ekleyin.
- 4 ° C'de 60 dakika boyunca 120.000 x g'da santrifüjleyin ve süpernatanı mümkün olduğunca çıkarın.
- Çökelticiyi steril PBS ile tekrar askıya alın ve EV'leri -80 °C'lik bir buzdolabında saklayın.
NOT: Yeniden süspanse edilecek PBS miktarı, her iki 175cm2 kültür şişesinden gelen çökeltme için 100 μL olarak belirlenebilir. EV'leri izole etmek için yukarıdaki tüm adımlar Şekil 3'te sistematik olarak gösterilmektedir.
10. Transmisyon elektron mikroskobu (TEM), nanoparçacık izleme analizi (NTA) ve western blotting ile EV'lerin tanımlanması
- EV numunesini 25 °C'lik bir su banyosunda çözdürdükten sonra buzun üzerine yerleştirin ve ardından NTA tespiti17 için PBS ile önceki konsantrasyonun yarısına kadar seyreltin.
- Numunenin 10 μL'sini bakır ağ üzerine pipetleyin, 1 dakika oturmasına izin verin ve yüzen sıvıyı filtre kağıdı ile emdirin. Daha sonra bakır ağa 10 μL fosfotungstik asit ekleyin, 1 dakika bekletin ve fazla sıvıyı emdirin.
- RT'de birkaç dakika kuruduktan sonra, 100 KV hızlanma voltajı18 koşulu altında elektron mikroskobu görüntülemesi yapın.
- EV örneğini RIPA lizis tamponunda (25 mM Tris· HCl (pH 7.6), 150 mM sodyum klorür [NaCl], %1 nonil fenoksipolietoksiletanol (NP-40), %1 sodyum deoksikolat, %0.1 sodyum dodesil sülfat (SDS), 1 mM Fenilmetansülfonil florür (PMSF), 1x proteaz inhibitörü) ve Alix, TSG101, CD81 ve CD63 gibi EV'ler için spesifik belirteçlerin ekspresyonunu western blotting19 ile tespit edin.
Sonuçlar
Domuz kemik iliği mezenkimal kök hücrelerinin oluşturulması
Domuz kemik iliğinden elde edilen mezenkimal kök hücreler başarılı bir şekilde izole edildi ve in vitro kültüre edildi ve farklı günlerdeki pBM-MSC'lerin morfolojisi Şekil 4'te görülebilir. pBM-MSC'lerin birincil kültüründe, mikroskobik gözlem, hücre yapışmasının ekimden bir gün sonra meydana geldiğini ve yapışık hücrelerin genellikle yuvarlak şekilli olduğunu gösterdi. Primer pBM-MSC'ler genellikle ekimden sonra 3 gün boyunca hareketsiz fazda kaldı ve 4. günde hücre çoğalması başladı. Hücre morfolojisi, proliferasyondan sonra yuvarlaktan iğ, çok taraflı veya yıldız tipine değişti ve çekirdekler merkezidir ve bazı hücrelerde çift nükleoller bulunur. Hücre kolonileri, hücre proliferasyonunun başlamasından 7-9 gün sonra oluşturuldu ve 12-14 günde %80-90 hücre birleşmesi sağlanabildi. Mikroskobik gözlem, yapışık hücrelerin dağınık koloniler halinde büyüdüğünü ve dönen bir düzende düzenlendiğini gösterdi.
Hücre proliferasyonu geçtikten sonra önemli ölçüde hızlandı ve bir hafta içinde %80-90 birleşmeye ulaşılabildi. Hücre morfolojisi, yaklaşık 2-3: 1'lik bir uzunluk / genişlik oranı ile fibroblastlara benzeyen ikinci geçitten itibaren homojen iğ şeklindeydi. Hücreler farklılaşmışsa, çokgen veya yıldız şeklinde görünebilirler. Geçtikten sonra, hücreler artık dağınık koloniler olarak değil, paralel bir düzende eşit ve radyal olarak büyüdü.
Boyama ile hücre farklılaşma potansiyelinin belirlenmesi
Adipojenik farklılaşma testinde, Yağ Kırmızısı O boyama, çekirdeğin etrafında farklı boyutlarda yuvarlak turuncu-kırmızı lipid damlacıklarının ortaya çıktığını gösterdi (Şekil 5A); Osteojenik farklılaşma testinde, Alizarin Kırmızı boyaması hücre yüzeyinde kırmızı nodüller gösterdi (Şekil 5B), bu da pBM-MSC'lerden farklılaşan osteoblastlar tarafından biriktirilen kalsiyum tuzları ile renk reaksiyonunun neden olduğu renkten kaynaklandı. Kondrojenik farklılaşma testinde, Alicia mavisi boyaması, kıkırdak toplarındaki endoasidik mukopolisakkaritin boyanmasından kaynaklanan tüm doku bölümünün mavi olduğunu gösterdi (Şekil 5C).
Akım sitometrisi ile hücre fenotipinin tanımlanması
Hücre yüzeyi belirteçlerinin tahlilleri, pBM-MSC'lerin bir fenotipini oluşturmak için gerçekleştirildi. Akış sitometrisi sonuçlarından (Şekil 6), CD105, CD29 ve CD90 gibi üç pozitif belirteç, pBM-MSC'lerin yüzeyinde sırasıyla %96.5, %99.8 ve %92'yi oluşturan önemli ölçüde eksprese edildi (Şekil 6A-C). Bununla birlikte, CD14 ve CD45'in ekspresyonu negatifti (Şekil 6D,E). Bu arada, karşılık gelen izotip kontrollerinin sonuçlarının tümü negatifti, bu da şekilde zaten üst üste bindirilmiş ve antikorların spesifik olmayan bağlanma olasılığını dışladı.
pBM-MSC'lerden türetilen EV'lerin NTA, TEM ve western blotting ile tanımlanması
NTA'nın sonucu, medyan parçacık boyutunun EV'ler aralığında olan 126.9 nm olduğunu gösterdi; ayrıca, EV numunesinin orijinal konsantrasyonu 1.5 x 1010 parçacık/mL idi ve boyuta atanan doğru değer Şekil 7A'da bulunabilir. Parçacık yörünge diyagramı, parçacıkların düzensiz Brown hareketinde olduğunu gösteren Şekil 7B'de gösterilmiştir. Ayrıca, EV'lerin klasik yapısı olan diskoid vezikül, elektron mikroskobu altında 50.000x büyütmelerde net bir şekilde görülebilir (Şekil 7C). Ayrıca, Alix, TSG101, CD81 ve CD63 gibi EV'ler için spesifik belirteçlerin ekspresyonu, numunede western blotting ile tespit edildi (Şekil 7D).
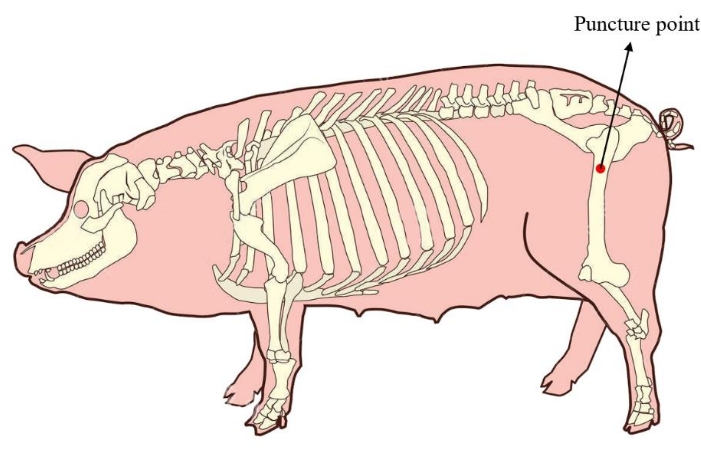
Şekil 1: Minipig'in kemik iliği delinme noktası. Kırmızı alan, minidomuzun proksimal uyluk kemiğinde bulunan kemik iliğinin çıkarılmasının delinme noktasını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
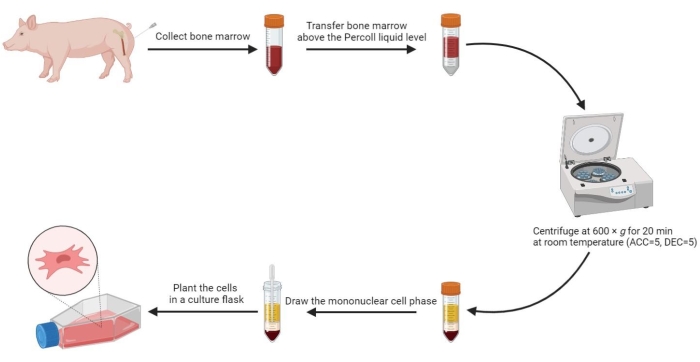
Şekil 2: Domuz kemik iliğinden mezenkimal kök hücrelerin izole edilmesi. Mezenkimal kök hücrelerin domuz kemik iliğinden izole edilmesi süreci akış şemasında gösterilmiştir ve yoğunluk gradyanlı santrifüjlemeden sonra dört sıvı faz net bir şekilde gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
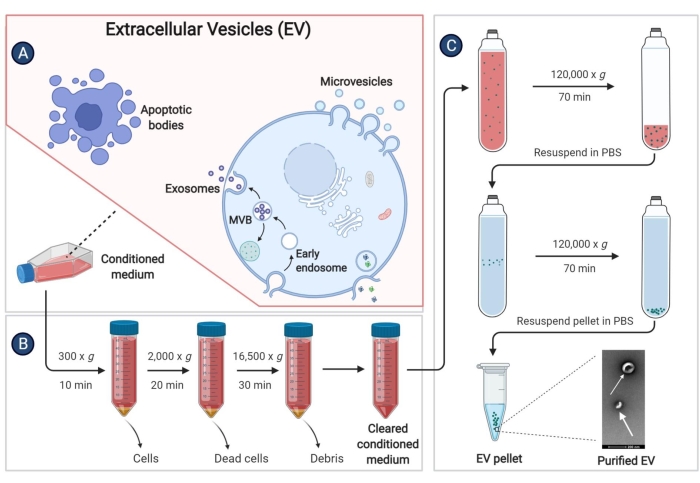
Şekil 3: pBM-MSC'lerden türetilen EV'lerin izole edilmesi. Şematik diyagram, EV'leri ultrasantrifüjleme yoluyla şartlandırılmış ortamdan izole etmek için belirli adımları göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Farklı günlerde pBM-MSC'lerin morfolojik özellikleri. pBM-MSC'lerin benzer morfolojiközellikleri, 100x mikroskobik alan altında ekimden sonraki 3., 5., 7. ve 9. günlerde görülebilir ve 9. günde hücre kolonileri oluşmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5. Boyama ile pBM-MSC'lerin farklılaşma potansiyelinin belirlenmesi. (A) pBM-MSC'lerin sırasıyla adipojenik, (B) osteojenik ve (C) kondrojenik farklılaşma testi. pBM-MSC'lerin farklılaşma potansiyeli bu boyama sonuçları ile tanımlanabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
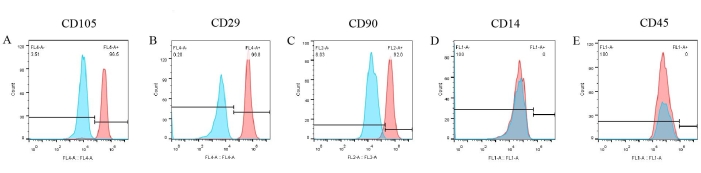
Şekil 6: Akış sitometrisi ile pBM-MSC'lerin tanımlama sonuçları. CD105, CD29 ve CD90, pBM-MSC'lerin yüzeyinde sırasıyla %96.5, %99.8 ve %92.0 ile anlamlı olarak eksprese edilirken, CD14 ve CD45'in ekspresyonu negatiftir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
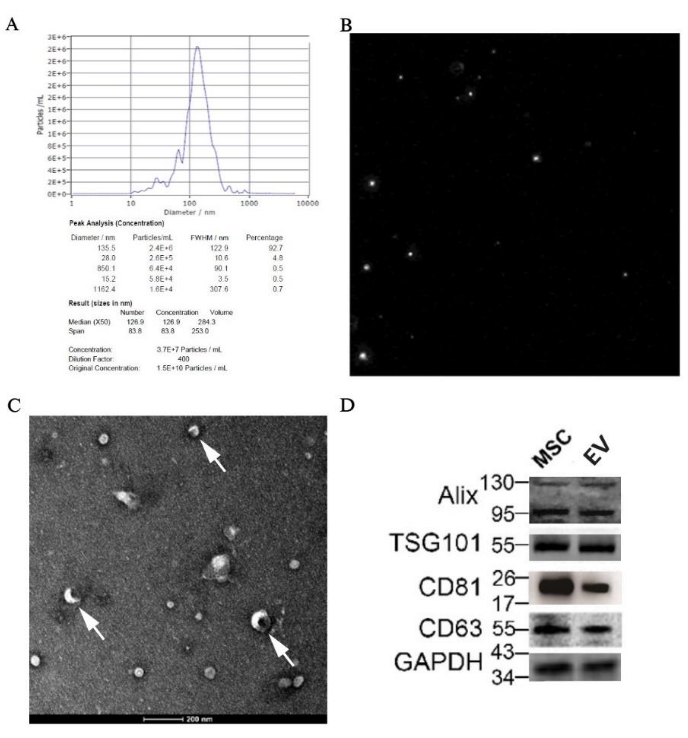
Şekil 7: pBM-MSC'lerden türetilen EV'lerin morfoloji ve moleküler biyoloji ile tanımlama sonuçları. (A) pBM-MSC'lerden türetilen EV'lerin sırasıyla parçacık boyutu dağılım grafiği ve (B) parçacık yörünge diyagramı ile NTA sonucu; (C) 50.000x büyütme oranında çekilen TEM görüntüsü ve beyaz ok, diskoid veziküllerin klasik yapısını göstermektedir. (D) EV'ler için spesifik belirteçlerin western blotlama ile ifade edilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Minipiglerin geleneksel kemik iliği ponksiyon noktası iliak krest20'de konumlandırıldı. Bulunması kolay olmasına rağmen, kemik iliği ekstraksiyon miktarı21 ° C ile sınırlıdır (genel olarak sadece yaklaşık 5 mL), bu nedenle in vivo transplantasyon için in vitro olarak çok sayıda genleşme gereksinimini karşılamak zordur. Bu yöntemde, kemik iliği ponksiyon noktasını proksimal femura yeniden konumlandırdık ve bu bölgeden en az 20 mL kemik iliği çıkarılabilir, bu da sonraki hücre kültürü için yeterli miktarda pBM-MSC'yi garanti eder.
BM-MSC'leri yoğunluk gradyanlı santrifüjleme ile izole etmek için kullanılan iki ana ayırma çözümü Percoll ve Ficoll'dur. Percoll, yeni bir toksik olmayan ve tahriş edici olmayan yoğunluk gradyanlı santrifüj ayırma maddesi olan silikonlaştırılmış polivinilpirolidondan (PVP) oluşur. Percoll'un düşük difüzyon sabiti, nispeten kararlı bir yoğunluk gradyanı ile sonuçlanır; Bu nedenle, tatmin edici hücre ayrımı genellikle düşük merkezkaç kuvvetlerinde (200-1000 x g) onlarca dakika içinde elde edilebilir. Ficoll kullanılarak pBM-MSC'lerin izolasyonu için yöntem daha önce bildirilmiştir21. Ficoll ile karşılaştırıldığında, Percoll, pBM-MSC'leri izole etmek için mevcut yöntemleri tamamlayabilen, kolay çalışabilirlik, düşük viskozite, toksik olmama ve hücre agregasyonuna neden olmama avantajları nedeniyle kademeli olarak kullanılmaktadır.
pBM-MSC'lerin izole edilmesinde ve kültürlenmesinde bazı kritik adımlar göz ardı edilemez. İlk olarak, yoğunluk gradyanlı santrifüjlemeden sonra farklı sıvı fazların başarılı bir şekilde tabakalandırılması, saflaştırılmış pBM-MSC'leri izole etmenin anahtarıdır. BM-MSC'ler, bir tür kemik iliği mononükleer hücresi (BM-MNC'ler) olarak, lenfositler ve monositlerinkine benzer, yaklaşık 1.075 g / mL özgül ağırlığa sahiptir. Percoll'un orijinal yoğunluğu 1.130 g/mL'dir ve yoğunluk-gradyan santrifüjlemeden sonra BM-MSC'leri içeren hücre katmanını başarılı bir şekilde elde etmek için, %60 izotonik yoğunluk gradyan ayırma çözeltisinin (1.077 g/mL) Percoll yoğunluk-konsantrasyon ilişkisine göre önceden yapılandırılması gerekir22. Ayrıca, uygun santrifüjleme koşulları da başarılı tabakalaşmaya katkıda bulunur. Percoll'un düşük difüzyon sabiti göz önüne alındığında, ekstrakte edilen kemik iliğini 600 x g'da 20 dakika boyunca nispeten düşük hızlanma/yavaşlama seviyelerinde (ACC = 5, DEC = 5) santrifüjledik ve bu da iyi bir tabakalaşma etkisi elde etti. İkinci olarak, hücre kültürü için uygun ekim yoğunluğu da gereklidir. Sonraki transplantasyon için yeterli sayıda MSC (genellikle hayvan başına 107'den fazla9) elde etmek için, hücre kültürü için 175cm2 kültür şişeleri kullanıyoruz. Daha önceki bir çalışmada20, elde edilen BM-ÇUŞ'lar genellikle 5 x 105 /cm2 yoğunlukta yetiştirme için kültür şişelerine ekildi. Yoğunluk gradyanlı santrifüjlemeden sonra, her 5 mL domuz kemik iliği23 için 2-3 x 107 BM-MNC elde edilebileceği bildirilmiştir. Bu nedenle, bu protokolde, her 20 mL domuz kemik iliğinden izole edilen toplam BM-ÇUŞ'ların uygun bir yoğunluk için 175cm2'lik bir kültür şişesine dikilmesini öneriyoruz. Üçüncüsü, pBM-MSC'lerin izolasyonu ve kültürü sırasında safsızlıklardan kaçınılmalıdır. Mononükleer hücre fazını çizerken, ayırma sıvısı ile karışmaması için pipet Percoll fazına sokulmamalıdır. Ayrıca, 24 saatlik hücre ekiminden sonra, kırmızı kan hücrelerinin yapışmasını azaltmak için kültür şişesi hafifçe çalkalanmalıdır.
Ultrasantrifüjleme işlemi sırasında, bu yöntemle yüksek seviyelerde protein agregatı ve lipoprotein kontaminasyonu, kaçınılmaz olarak EV'lerin14 miktar tayinini ve fonksiyonel analizini tehlikeye atar. Proseste kontaminasyonu mümkün olduğunca azaltmak için, ultrasantrifüj adımından önce süpernatan aktarılırken her seferinde dipte 5 mm derinlikte sıvı tutulmalıdır. Bu arada, ilk ultrasantrifüjden sonra, peletin steril PBS'de yeniden askıya alınması ve ardından tekrar ultrasantrifüjleme yapılması, lipoprotein kontaminasyonunu etkili bir şekilde azaltabilir.
Yoğunluk gradyanlı santrifüjleme ve ultrasantrifüjleme, sırasıyla BM-MSC'lerin ve bunlardan türetilen EV'lerin izole edilmesinde yaygın olarak kullanılmasına rağmen, bu iki tekniğin de kendi sınırlamaları vardır. Bir yandan, Percoll tekniği uzun ve zahmetlidir ve MSC24'ü izole etmek için alternatif bir yöntem olarak bir yatak başı hücre konsantrasyon cihazı aracılığıyla BM konsantre numunesi verildiği bildirilmiştir. Öte yandan, ultrasantrifüjleme yöntemi sadece yüksek eğitimli teknisyenler değil, aynı zamanda pahalı ekipman da gerektirir; bu nedenle, iki veya daha fazla tekniğin birlikte uygulanması, EV'lerin daha verimli izolasyonu için makul bir strateji sunabilir25. Ayrıca, pBM-MSC'lerin ve bunlardan türetilen EV'lerin tanımlanmasının da iyileştirilmesi gerekmektedir. Örneğin, MSC'lerin26'yı tanımlamak için uluslararası kriterlere göre, CD73, CD34 ve HLA-DR gibi bazı pozitif veya negatif belirteçlerin ekspresyonu, bu çalışmada BM-MSC fenotiplerinin akış sitometrisi ile tanımlama sonuçlarında hala eksiktir. Buna ek olarak, EV'leri izole etme işlemi sırasında kontaminasyonu önlemek için önlemler alınmış olsa da, laboratuvarımızın sınırlamaları nedeniyle, takip çalışmasının iyileştirilmesine yardımcı olmak için EV numunesinin saflığını değerlendiremiyoruz.
Bu çalışma, pBM-MSC'lerin ve bunlardan türetilen EV'lerin izolasyonu için yöntemleri sistematik olarak müteakip tanımlama sonuçlarıyla kanıtlanan sıralı olarak birleştirmektedir. Özellikle, bu süreç sırasında farklı laboratuvarlarda var olan heterojenlik sorununu bir dereceye kadar çözebilecek bazı özel deneysel koşulları açıklayarak, bu adım dizisindeki temel işlemleri vurguladık. Bu metodik çalışma, BM-MSC'lerin ve bunlardan türetilen EV'lerin transplantasyon etkinliği üzerine klinik öncesi çalışmalarda yaygın olarak kullanılabilir ve bu da klinik araştırmalar için yeterli düzeyde deneysel bir temel sağlayabilir.
Açıklamalar
Tüm yazarların beyan edeceği herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yang Jianzhong ve Wang Xuemin'e kemik iliği ekstraksiyonu operasyonuna katkılarından dolayı teşekkür ederiz. Bu çalışma, CAMS Tıp Bilimleri İnovasyon Fonu (CIFMS) [hibe numarası 2016-I2M-1-009], Çin Ulusal Doğa Bilimleri Vakfı (no: 82070307; no: 81874461) tarafından sağlanan hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
Referanslar
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır