Method Article
Porcine Bone Marrow Mesenchymal Stem Cells and their derived Extracellular Vesicles의 분리 및 식별(Isolation and Identification of Porcine Bone Marrow Mesenchymal Stem Cells and their derived Extracellular Vesicles)
요약
이 논문에서는 돼지 골수 중간엽 줄기세포(pBM-MSC) 및 이로부터 유래한 세포외 소포체(EV)를 분리 및 식별하는 방법을 자세히 설명하여 BM-MSC 및 그 파생 EV의 이식 효능에 대한 전임상 평가를 위한 방법론적 기반을 제공합니다.
초록
중개 연구 및 재생 의학에서 줄기세포 치료법이 개발됨에 따라 만능 줄기세포의 일종인 골수 중간엽 줄기세포(BM-MSC)는 즉각적인 가용성과 입증된 안전성으로 인해 선호되고 있습니다. BM-MSC의 이식은 다양한 질병에서 손상된 조직을 복구하는 데 큰 이점이 있는 것으로 보고되었으며, 이는 부분비 메커니즘을 통한 면역 및 염증 반응 조절과 관련이 있을 수 있습니다. 이중층 지질막 구조를 특징으로 하는 세포외 소포체(EV)는 줄기세포의 부분비 효과의 주요 매개체로 간주됩니다. 세포 소통 및 후성유전학적 조절에서 중요한 역할을 하는 것으로 인정받은 EV는 이미 면역 요법을 위해 in vivo 에 적용되었습니다. 그러나 모세포와 마찬가지로 EV의 이식 효능에 대한 대부분의 연구는 여전히 소형 동물 수준에 머물러 있어 임상 번역에 필수적인 증거를 제공하기에 충분하지 않습니다. 여기에서는 밀도-구배 원심분리를 사용하여 처음에는 돼지 골수에서 골수 세포(BMC)를 분리하고, 이후 현미경으로 관찰한 결과, 유도 분화 분석 및 유세포 분석을 통해 확인된 세포 배양을 통해 돼지 BM-MSC(pBM-MSC)를 얻습니다. 또한, 투과전자현미경(TEM), 나노입자 추적 분석(NTA) 및 웨스턴 블로팅(western blotting) 기법으로 입증된 초원심분리를 통해 세포 상등액에서 pBM-MSC 유래의 EV를 분리합니다. 전반적으로 pBM-MSC 및 파생된 EV는 BM-MSC 및 파생된 EV의 이식 효능에 대한 전임상 연구에 널리 사용될 수 있는 다음 프로토콜에 의해 효과적으로 분리 및 식별될 수 있습니다.
서문
지난 10년 동안 줄기세포 치료는 외상, 호흡기, 심혈관 질환 등 다양한 질병과 부상으로 고통받는 환자들에게 큰 이점을 약속했습니다. 이 분야의 발전에 따라 골수 중간엽 줄기세포(BM-MSC)는 접근성과 윤리적 논쟁이 적다는 이유로 점차 사람들의 선호를 받고있으며1, 이는 다른 세포 유형에도 불구하고 임상 연구의 황금 표준으로 간주되어 왔습니다2. BM-MSC를 기반으로 한 치료법은 면역 및 염증 반응을 조절하고 분화 또는 부분비 메커니즘을 통해 손상된 조직을 복구하는 고유한 능력으로 인해 점점 더 많은 연구자들에게 매력적입니다3.
ISEV(International Society for Extracellular Vesicles)가 승인한4가지 세포외 소포체(EV)는 세포에서 자연적으로 방출되는 지질 이중층 구조를 가진 총 입자를 말합니다. 최근 다양한 세포 유형의 EV에서 단백질, 지질 및 유전 물질(예: miRNA, mRNA, DNA 분자 및 긴 비암호화 RNA)과 같은 다양한 내용물이 발견됨에 따라5 세포 통신 및 후성유전학적 조절에서 이들의 중요한 역할이 인식되고 있습니다6. EV는 모세포를 대체할 수 있는 새로운 약으로, 면역요법 및 재생의학에 적용되었으며, 생체 내 연구를 통해 현재 진행 중인 전임상 연구 및 후속 임상시험의 기초가 되고 있다7.
그러나 현재 BM-MSC와 그 파생 EV의 이식 효능에 대한 대부분의 연구는 여전히 소형 동물 수준에 머물러 있어 임상 번역에 필요한 증거를 제공하기에 충분하지 않습니다. 따라서 돼지와 같은 대형 동물 수준에서 BM-MSC 및 그 파생 EV의 이식에 대한 전임상 연구를 수행하는 것이 매우 시급합니다.
MSC는 골수에서 매우 적은 수로 존재하는 것으로 보고되었으며, 이는전체 세포의 0.01%에서 0.001%에 불과하다8. 그러나 BM-MSC의 전임상 투여에는 많은 수의 세포(≥107 마리)가 필요합니다.9; 필요한 EV의 양은 훨씬 더 많으며, 그 중간 용량은 돼지체중 1kg당 0.25mg입니다 10. 이러한 많은 수를 달성하기 위해서는 돼지 골수에서 MSC를 분리 및 배양하여 체외 에서 대규모 확장을 달성하고 이후에 높은 단백질 농도의 EV를 획득하는 안전하고 효과적인 방법이 시급히 필요합니다.
지금까지 BM-MSC와 그 파생 EV를 분리하는 다양한 방법이 있습니다. BM-MSC를 분리하는 현재 방법에는 골수 세포(BMC)11의 직접 이식, 밀도 구배 원심분리, 세포 표면 분자 라벨 분류 및 유세포 분석 스크리닝이 포함됩니다. 세포 표면 분자 표지 분류 및 유세포 분석 스크리닝은 세포 부착률 감소, 24시간 사망률 증가 및 증식 억제12를 초래하는 반면, BMC의 직접 배양은 많은 수의 혼합 조혈 세포를 초래할 수 있는 것으로 보고되었습니다. 따라서 밀도 구배 원심분리는 이제 BM-MSC를 얻기 위해 일반적으로 사용됩니다. 세포 상등액에서 EV를 분리하는 현재 방법에는 초원심분리, 한외여과, 폴리머 침전 및 크기 배제가 포함됩니다13. 다른 방법과 비교했을 때, 초원심분리는 저렴한 비용, 사용 편의성 및 복잡한 전처리 없이 대량 준비와의 호환성이라는 장점이 있으며, 이는 EV 분리의 "황금 표준"이었습니다14. 그러나 3,15 프로세스 동안 서로 다른 실험실의 시약과 기술에는 큰 이질성이 존재하며, 이는 독자에게 오해의 소지가 있을 수 있습니다. 이 기사에서는 pBM-MSC 및 이로부터 파생된 EV를 분리하기 위한 일련의 순차적 단계를 자세히 설명하고, 후속 식별 결과는 전임상 연구에서 추가 분석을 위해 pBM-MSC 및 EV를 얻는 방법이 실현 가능하다는 것을 입증합니다. 우리는 이 체계적인 연구가 pBM-MSC 및 그 파생 EV의 이식에 대한 전임상 평가에 종사하는 연구자들에게 방법론적 기반을 제공하여 가능한 한 빨리 임상 시험이 수행될 수 있기를 바랍니다.
프로토콜
미국 국립보건원(National Institutes of Health)에서 발행한 실험 동물의 관리 및 사용 가이드(Guide for the Care and Use of Laboratory Animals)에 따르면 모든 실험 절차는 중국 의학원(Chinese Academy of Medical Sciences) 푸와이 병원(Fuwai Hospital) 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았습니다.
1. 동물을 위한 수술 전 준비
- 생후 12개월쯤 된 성체 수컷 중국 미니피그(30±5kg)를 중국과학원 동물학연구소에서 입양하여 최소 2주 전에 후와이병원 동물실험센터 시설에 수용합니다. 동물이 건강한지 확인하기 위해 혈액 정기 검사와 같은 수술 전 검사를 수행합니다.
- 수술 전날 미니돼지의 허벅지 부위 피부를 청소하고 면도합니다. 흡인을 피하려면 골수 추출 전에 12시간 동안 미니피그를 단식하십시오.
2. 세포 분리 및 배양을 위한 준비
- Percoll(1.130g/mL)을 사용하여 골수에서 중간엽 줄기세포를 분리합니다. 스톡 용액을 9:1의 비율로 10x 농축 PBS와 혼합하여 등장성 매체를 얻습니다. 그런 다음 등장성 매체와 PBS를 3:2의 비율로 혼합하여 60% Percoll 용액(1.077g/mL)을 획득하며, 이는 pBM-MSC를 분리하기 위한 최종 분리 용액으로 사용할 수 있습니다.
- 10%의 소 태아 혈청과 1.0%의 페니실린-스트렙토마이신을 함유한 Iscove의 변형 둘베코의 배지(IMDM)를 준비하여 완전한 배지를 얻습니다. 후속 세포 배양을 위해 전체 배지와 PBS를 37°C 수조에서 예열합니다.
3. 동물을 위한 마취
- 케타민(10mg/kg)과 자일라진(2mg/kg)을 근육 주사로 전신 마취를 실시합니다. 미니피그의 호흡이 느리고 사지 활동이 적을 때 신속하게 기관내 삽관을 실시하고, 삽관 실패를 방지하기 위해 자발적 호흡을 보존합니다.
- 산소(1.5L/min)를 운반 가스로 하여 2% 이소플루란을 흡입하여 마취 유지를 수행합니다. 마취 중에는 미니피그의 심박수, 호흡 및 혈중 산소 포화도를 실시간으로 모니터링합니다.
4. 미니돼지에서 골수 추출
- 미니피그를 옆으로 놓습니다. 후속 세포 배양을 위한 충분한 양의 골수를 확보하려면 미니피그의 대퇴골 근위부에서 골수 천자 지점을 찾습니다(그림 1). 수술을 하기 전에 천자 부위의 피부를 소독하고 드레이프하십시오.
- 주로 사용하지 않는 손으로 천자 지점 주위의 피부를 조이고 주로 사용하는 손으로 골수 생검 바늘을 천공 지점에서 수직으로 찔러줍니다. 바늘이 피질 뼈에 닿는 느낌이 들면 손잡이를 좌우로 부드럽게 돌려 바늘을 뚫습니다. 바늘이 골수강에 들어갈 때 종종 저항력을 잃는 느낌이 듭니다.
- 펑크가 나면 코어 바늘을 빼냅니다. 그런 다음 일회용 멸균 50mL 주사기를 바깥쪽 바늘 끝에 붙이고 주사기 내벽을 미리 헤파린으로 헹굽니다.
- 골수 20mL를 천천히 추출하여 멸균 50mL 원심분리 튜브에 조심스럽게 옮깁니다.
- 절차가 완료되면 바늘을 빼내고 커튼을 제거합니다. 천자 부위를 소독하고 지혈을 위해 20분 동안 누르십시오.
- 자발 호흡을 회복한 후 미니피그를 발관합니다. 팔다리를 자유롭게 움직이며 완전히 깨어나면 미니피그를 우리로 돌려보내 먹이를 계속 먹게 합니다.
5. 골수에서 중간엽 줄기세포 분리
- 예열된 PBS를 같은 부피의 골수에 넣고 잘 섞습니다. 그런 다음 멸균 피펫을 사용하여 1:1 부피 비율로 60% 밀도 구배 용액 수준 이상으로 희석된 골수 20mL를 멸균 50mL 원심분리 튜브에서 조심스럽게 옮깁니다.
- 실온(RT)에서 20분 동안 600 x g (가속(ACC) = 5, 감속(DEC) = 5)에서 튜브를 원심분리합니다.
참고: 원심분리 후 튜브에는 혈청기, 단핵 세포상, 밀도 구배 중간 상 및 위에서 아래로 침전기를 포함한 4개의 상이 형성됩니다. 단핵 세포상(mononuclear cell phase)은 혈청과 밀도 구배 배지 사이의 얇은 응집층입니다. 골수에서 유래한 중간엽 줄기세포가 이 단계에 위치합니다. - 단핵 세포상을 멸균 15mL 원심분리 튜브에 주입하고 800 x g 에서 PBS로 5분 동안 두 번 세척합니다.
- 세척된 세포를 2mL의 완전한 배지에 재현탁하고 재현탁된 세포를 3-5 x 105/mL의 밀도로 175cm2 세포 배양 플라스크에 심습니다.
참고: 중간엽 줄기세포를 분리하기 위한 위의 모든 절차는 그림 2에서 볼 수 있습니다.
6. in vitro에서 중간엽 줄기세포 배양
- 배양 플라스크를 37 ° C에서 5 %CO2의 포화 가습 분위기에서 배양한다. 침전된 조혈모세포의 부착 증식을 방지하기 위해 24시간마다 배양 플라스크를 부드럽게 흔들어 현미경으로 세포 성장, 형태 및 오염을 관찰합니다.
- 3일 후에 처음으로 배양 배지를 교체하고 2-3일마다 배지를 교체하십시오. 세포 군집이 80%-90% 합류점에 도달하면 1:2의 비율로 세포를 계대배양합니다.
7. pBM-MSC의 지방형성, 골형성 및 연골형성 분화
- Adipogenic 분화 분석
- 키트 지침에 따라 BM-MSC에 대한 지방 분화 배지 A(배지 A) 및 B(배지 B)를 준비합니다. 키트에 대한 구체적인 정보는 재료 표에서 확인할 수 있습니다.
- 6웰 플레이트에 0.1% 젤라틴 1mL를 넣고 각 웰의 바닥을 고르게 덮을 수 있도록 부드럽게 흔듭니다. 그런 다음 6웰 플레이트를 깨끗한 벤치 또는 CO2 인큐베이터에 최소 30분 동안 놓습니다.
- 30분 후 젤라틴을 흡인하고 각 웰에 일반 완전 배지 2mL를 추가합니다. 그런 다음 pBM-MSC를 2 x 104 cells/cm2의 셀 밀도로 6웰 플레이트에 심습니다. 그 후, 5 % CO2의 포화 습도에서 37 ° C에서 플레이트를 배양하십시오.
- 세포가 100% 합류점에 도달하면 전체 배지를 조심스럽게 제거하고 플레이트의 각 웰에 배지 A 2mL를 추가합니다. 3일 후, 플레이트에서 미디엄 A를 제거하고 각 웰에 미디엄 B 2mL를 추가합니다.
- 1일 유지 후 Medium B를 제거하고 Medium A로 교체하여 인덕션을 사용합니다. "Medium A는 3일, Medium B는 1일"의 방식에 따라 Medium A와 B를 차례로 사용하여 인덕션을 실시합니다.
- 기간 동안 매일 세포 상태를 관찰하십시오. 배지 A의 유도 과정에서 세포가 줄어들거나 죽으면 세포 상태가 회복될 때까지 시간이 지나면 배지 B로 교체하십시오.
- 유도 및 유지 관리 과정을 반복하고 현미경에서 적절한 크기의 충분한 지질 방울이 관찰되면 염색을 준비합니다.
- 6웰 플레이트에서 지방생성 분화를 위한 배지를 제거하고 1x PBS로 부드럽게 세척합니다. 각 웰에 4% 파라포름알데히드 용액 2mL를 추가하고 RT에서 30분 동안 고정합니다.
- 파라포름알데히드 정착제를 제거하고 1x PBS로 2-3회 세척하여 고정제가 완전히 제거되었는지 확인합니다. 각 웰에 Oil Red O 염료 2mL를 넣고 RT에서 30분 동안 염색합니다.
- Oil Red O 염료를 제거하고 1x PBS로 2-3회 세척합니다. 각 웰에 1x PBS 2mL를 첨가한 다음 현미경으로 지방생성 분화 효과를 관찰합니다.
- 골형성 분화 분석
- 키트 지침에 따라 골형성 분화를 위한 완전한 배지를 준비합니다.
- 7.1.2-7.1.3 단계에 따라 pBM-MSC를 심고 배양합니다.
- 세포가 70% confluence에 도달하면 일반적인 완전 배지를 조심스럽게 제거하고 골형성 분화를 위해 플레이트의 각 웰에 2mL의 배지를 추가합니다.
- 3일마다 새로운 골형성 분화 배지로 교체하십시오. 2-4 주 동안 유도를 계속하고, 골형성 중 명백한 칼슘 결절이 나타나면 Alizarin Red 염료로 염색할 준비를 합니다.
- 6웰 플레이트에서 골형성 분화를 위한 배지를 제거하고 1x PBS로 부드럽게 세척합니다. 각 웰에 4% 파라포름알데히드 용액 2mL를 추가하고 RT에서 30분 동안 고정합니다.
- 파라포름알데히드 고정액을 제거하고 1x PBS로 2-3회 세척하여 고정액이 완전히 세척되었는지 확인합니다. 각 웰에 Alizarin Red 염료 2mL를 추가하고 RT에서 10분 동안 염색합니다.
- Alizarin Red 염료를 제거하고 1x PBS로 2-3회 세척합니다. 각 웰에 1x PBS 2mL를 첨가한 후 현미경으로 골형성 분화 효과를 관찰합니다.
- 연골형성 분화 분석
- 키트 지침에 따라 연골 형성 분화를 위해 프리믹스를 준비합니다.
- 3-4 x 10 5pBM-MSC를 멸균 15mL 원심분리 튜브로 옮깁니다. 20°C에서 4분 동안 250 x g의 원심분리기.
- 상층액을 제거하고 프리믹스 0.5 mL를 첨가하여 이전 단계에서 원심분리하여 얻은 펠릿을 재현탁시킨 후, 20°C에서 150 x g 에서 5분 동안 원심분리한다. 이 단계를 반복하여 셀을 다시 씻습니다.
- 연골형성 분화를 위한 완전한 배지를 준비합니다.
- 이전 단계에서 얻은 세포를 0.5mL의 완전한 배지와 원심분리로 150 x g 에서 20°C에서 5분 동안 재현탁합니다.
- 가스 교환을 용이하게 하기 위해 원심분리기 튜브의 캡을 푸십시오. 37°C, 5% CO2 및 포화 습도의 인큐베이터에 똑바로 세웁니다.
- 세포가 응집되는 것처럼 보일때(실제 상황에 따라 보통 24-48시간 후) 원심분리기 튜브의 바닥을 튕겨 연골 볼이 바닥에서 분리되어 배지에 매달리도록 합니다.
- 연골 형성 분화를 위해 2-3일마다 새로운 완전한 배지로 변경합니다. 직경이 1.5-2mm인 연골 볼이 튜브에 형성될 때까지 유도를 계속한 다음 염색을 위한 섹션을 준비합니다.
- 병리학 실험의 일상적인 단계에 따라 연골 볼의 파라핀 절편을 준비합니다. 디왁스 처리된 부분에 알리시아 블루 염료를 첨가하고 37°C에서 1시간 동안 염색합니다.
- 슬라이드를 흐르는 물로 5분 동안 헹구고 건조 후 현미경으로 Alicia blue의 염색 효과를 관찰합니다.
8. 유세포 분석에 의한 세포 표현형 동정
- 세포 군집이 3-5 통로에서 80 % -90 % 합류점에 도달하면 배양 배지를 제거하고 예열 된 PBS로 세포를 두 번 세척합니다. 그런 다음 3-4mL의 0.25% 트립신/EDTA로 세포를 분해하고 현미경으로 플라스크 바닥에서 분리될 때까지 2-3분 동안 5% CO2 의 포화 가습 분위기에서 37°C에서 배양합니다.
- 10mL 완전 배지로 세포를 채취하고 세포 현탁액을 멸균 15mL 원심분리 튜브로 옮깁니다. RT에서 5분 동안 800 x g 에서 세포 현탁액을 원심분리하고 상층액을 버리고 4°C PBS로 세포를 세척합니다.
- 4°C PBS로 세포를 10mL로 재현탁합니다. 세포 현탁액은 각 1.5mL 마이크로튜브에 1mL 부피의 9개 그룹으로 나뉘며, 각각 negative control, FITC isotype control, PE isotype control, APC isotype control, CD105, CD29, CD90, CD14 및 CD45 group이라고 합니다. 각 마이크로튜브의 세포 수가 1 x 105 에서 1 x 106 사이인지 확인합니다.
- 현탁액을 800 x g 에서 4°C에서 5분 동안 원심분리한 후 각 마이크로튜브의 세포를 100μL의 4°C PBS로 다시 현탁시킵니다. 음성 대조군을 제외하고 8.3단계의 순서에 따라 각 microtube에 해당 isotype control(FITC, PE 및 APC Mouse IgG1 kappa Isotype Control) 및 유세포분석을 위한 항체(CD105, CD29, CD90, CD14 및 CD45 Monoclonal Antibody) 5μL를 추가합니다. 부드럽게 섞어 어두운 곳에서 4 °C에서 1.5 시간 동안 배양합니다.
- 각 마이크로튜브에 4°C PBS 1mL를 추가하고 300 x g 에서 4°C에서 10분 동안 원심분리합니다. 상등액을 버리고 4°C PBS 200μL를 첨가하여 세포를 재현탁합니다.
- 세포 현탁액(16 )을 필터링한 후 유세포 분석에서 최소 10,000개의 세포를 테스트하고 유세포 분석 소프트웨어를 사용하여 데이터를 분석합니다.
9. 돼지 골수 중간엽 줄기세포에서 유래한 세포외 소포체(EV) 분리
- pBM-MSC 합류점이 80%-90%에 도달하면 상층액을 버리고 PBS 2x로 세포를 세척합니다. 그런 다음 각 배양 플라스크에 25mL의 무혈청 IMDM을 추가하고 37°C에서 5%CO2 의 가습 분위기에서 48시간 동안 계속 배양합니다.
- 세포 상등액(조절된 배지, CM)을 50mL 원심분리 튜브에 넣고 300 x g 에서 4°C에서 10분 동안 원심분리하여 세포 파편을 제거합니다.
- 상층액을 다른 50mL 원심분리 튜브에 다시 수집합니다. 상등액을 채취한 후 가능한 한 빨리 EV의 격리를 수행하십시오. 장기 보관의 경우 상등액을 -80°C의 냉장고에 보관하여 EV의 손실을 방지하십시오.
- 단계 9.3에서 상층액을 2,000 x g 에서 4°C에서 20분 동안 원심분리합니다.
- 상층액을 16,500 x g 의 고속 원심분리기 및 원심분리기에 사용되는 멸균 튜브에 4°C에서 30분 동안 옮깁니다.
- 상층액을 다시 초원심분리 튜브에 옮기고 고정 각도 로터를 사용하여 4°C에서 최소 70분 동안 120,000 x g 에서 원심분리합니다.
- 상등액을 완전히 버리십시오. 각 초원심분리 튜브에 4°C PBS 1mL를 추가하고 마이크로피펫으로 침전을 재현탁합니다. 동일한 그룹의 용액을 초원심분리기 튜브에 혼합한 다음 4°C PBS를 추가하여 부피를 튜브의 3/4 이상으로 만듭니다.
- 120,000 x g 에서 4°C에서 60분간 원심분리하고 상층액을 최대한 제거합니다.
- 침전제를 멸균 PBS로 다시 현탁시키고 EV를 -80°C 냉장고에 보관하십시오.
참고: 재현탁을 위한 PBS의 양은 175cm2 배양 플라스크 2개당 침전에 대해 100μL로 측정할 수 있습니다. 위의 모든 EV를 분리하는 단계는 그림 3에 체계적으로 나와 있습니다.
10. 투과전자현미경(TEM), 나노입자 추적 분석(NTA), 웨스턴 블로팅을 통한 전기차 식별
- EV 샘플을 25°C 수조에서 해동한 후 얼음 위에 놓고 NTA 검출을 위해 PBS로 이전 농도의 절반으로 희석합니다17.
- 구리 메쉬에 시료 10μL를 피펫팅하고 1분 동안 침전시킨 후 여과지로 부유 액체를 흡수합니다. 그런 다음 구리 메쉬에 포스 포 텅스텐 산 10 μL를 첨가하고 1 분 동안 그대로 둔 다음 과도한 액체를 흡수합니다.
- RT에서 몇 분 동안 건조시킨 후 100KV 가속 전압18 조건에서 전자 현미경 이미징을 수행합니다.
- RIPA 용해 버퍼(25mM Tris· HCl(pH 7.6), 150mM 염화나트륨[NaCl], 1% 노닐 페녹시폴리에톡실에탄올(NP-40), 1% 데옥시콜레이트나트륨, 0.1% 도데실황산나트륨(SDS), 1mM 페닐메탄설포닐플루오라이드(PMSF), 1x 프로테아제 억제제), 웨스턴 블로팅19에 의해 Alix, TSG101, CD81 및 CD63과 같은 EV에 대한 특이적 마커의 발현을 검출합니다.
결과
돼지 골수 중간엽 줄기세포 확립
돼지 골수에서 유래한 중간엽 줄기세포를 성공적으로 분리하여 in vitro에서 배양했으며, 다른 날의 pBM-MSC의 형태를 그림 4에서 볼 수 있습니다. pBM-MSC의 1차 배양에서 현미경 관찰은 파종 하루 후에 세포 부착이 발생했으며 부착 세포는 일반적으로 둥근 모양임을 보여주었습니다. 1차 pBM-MSC는 일반적으로 파종 후 3일 동안 정지 상태를 유지했으며 세포 증식은 4일 째에 시작되었습니다. 증식 후 세포 형태가 원형에서 방추형, 다변 또는 별 유형으로 변경되었으며 핵은 중심이며 일부 세포에서는 이중 핵이 있습니다. 세포 집락은 세포 증식이 시작된 후 7-9일 후에 형성되었으며 12-14일에 80%-90% 세포 합류를 달성할 수 있었습니다. 현미경 관찰은 부착 세포가 흩어진 군체로 성장하고 소용돌이 패턴으로 배열되어 있음을 보여주었습니다.
세포 증식은 계대 형성 후 현저히 가속화되었으며 일주일 내에 80%-90% 합류에 도달할 수 있었습니다. 세포 형태는 두 번째 통로에서 균질한 방추체 모양으로 섬유아세포를 닮았으며 길이 대 너비 비율은 약 2-3:1이었습니다. 세포가 분화되면 다각형이나 별 모양으로 보일 수 있습니다. 계대 배양 후, 세포는 더 이상 흩어져있는 군체로 성장하지 않고 평행 한 배열로 균일하고 방사상으로 성장했습니다.
염색(staining)을 통한 세포 분화 가능성 확인
지방생성 분화 분석법에서 Oil Red O 염색은 서로 다른 크기의 둥근 주황색-빨간색 지질 방울이 핵 주위에 나타나는 것을 보여주었습니다(그림 5A). 골형성 분화 분석법에서 Alizarin Red 염색은 세포 표면에 적색 결절을 보여주었는데(그림 5B), 이는 pBM-MSC와 분화된 조골세포에 의해 침전된 칼슘염과의 색 반응으로 인해 발생했습니다. 연골형성 분화 분석법에서 Alicia blue 염색은 전체 조직 섹션이 파란색임을 보여주었으며(그림 5C), 이는 연골 볼에서 내산성 점액다당류의 염색으로 인해 발생했습니다.
유세포 분석에 의한 세포 표현형 확인
pBM-MSC의 표현형을 생성하기 위해 세포 표면 마커의 분석을 수행했습니다. 유세포 분석 결과(그림 6)에서 CD105, CD29 및 CD90과 같은 3개의 양성 마커가 pBM-MSC 표면에서 각각 96.5%, 99.8% 및 92%를 차지하는 유의하게 발현되었습니다(그림 6A-C). 그러나 CD14 및 CD45의 발현은 음성이었습니다(그림 6D, E). 한편, 해당 동형 대조군의 결과는 모두 음성이었으며, 이는 이미 그림에 겹쳐져 항체의 비특이적 결합 가능성을 배제했습니다.
NTA, TEM 및 웨스턴 블로팅에 의한 pBM-MSC에서 파생된 EV 식별
NTA의 결과는 중간 입자 크기가 126.9nm로 EV 범위 내에 있음을 보여주었습니다. 또한 EV 샘플의 원래 농도는 1.5 x 1010 particles/mL였으며 크기에 할당된 정확한 값은 그림 7A에서 확인할 수 있습니다. 입자 궤적 다이어그램은 그림 7B에 나타나 있으며, 이는 입자가 불규칙한 브라운 운동에 있음을 보여줍니다. 또한, EV의 고전적인 구조인 원반형 소포는 전자 현미경에서 50,000배의 배율로 명확하게 볼 수 있습니다(그림 7C). 또한 알릭스(Alix), TSG101, CD81 및 CD63과 같은 EV에 대한 특정 마커의 발현은 웨스턴 블로팅(western blotting)에 의해 샘플에서 검출되었습니다(그림 7D).
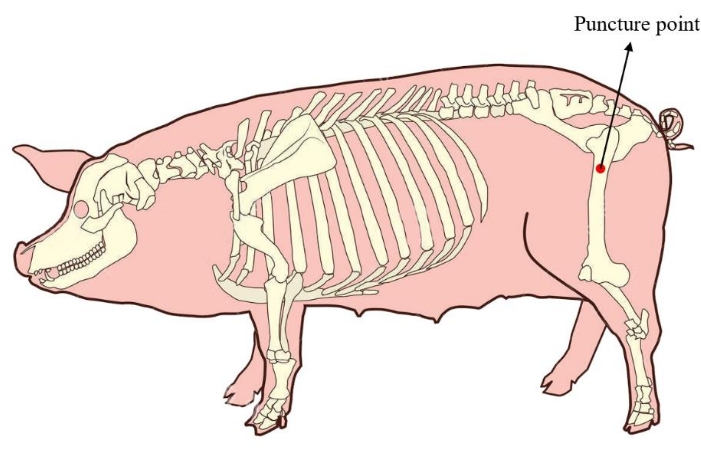
그림 1: 미니피그의 골수 천자 지점. 빨간색 부분은 미니돼지의 대퇴골 근위부에 위치한 골수를 추출하는 천자 지점을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
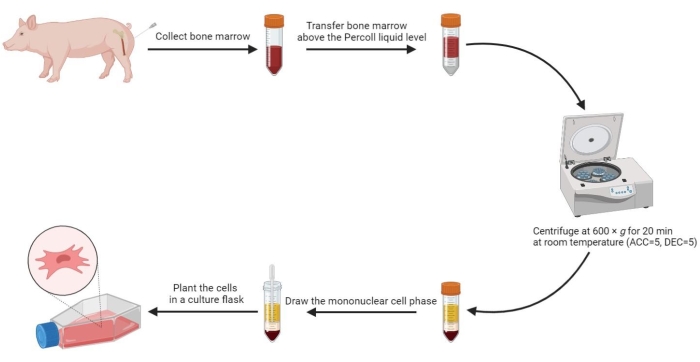
그림 2: 돼지 골수에서 중간엽 줄기세포 분리. 돼지 골수에서 중간엽 줄기세포를 분리하는 과정이 순서도에 나타나 있으며, 밀도 구배 원심분리 후 4개의 액체상이 명확하게 설명되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
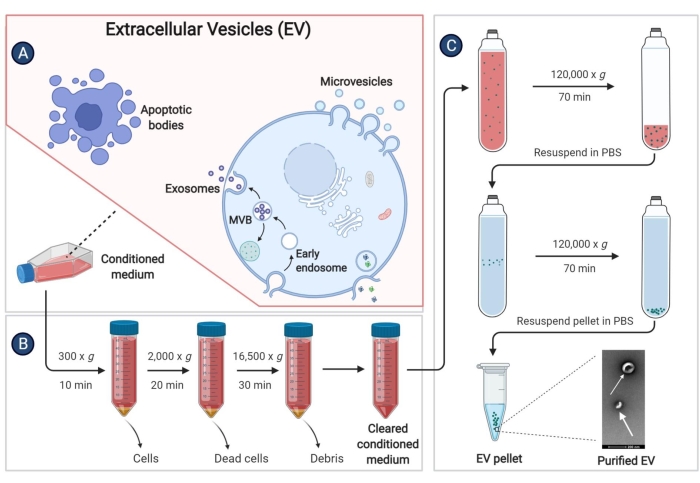
그림 3: pBM-MSC에서 파생된 EV 분리. 개략도는 초원심분리에 의해 조절된 매체에서 EV를 분리하는 구체적인 단계를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 다른 날에 대한 pBM-MSC의 형태학적 특성. pBM-MSCs의 유사한 형태학적 특성은 100x 현미경 필드 아래에서 심은 후 3일, 5일, 7일, 9일 째에 볼 수 있으며 9일 째에는 세포 군집이 형성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 염색에 의한 pBM-MSC의 분화 가능성 확인. pBM-MSC의 (A) 지방생성, (B) 골형성 및 (C) 연골형성 분화 분석. pBM-MSC의 분화 가능성은 이러한 염색 결과를 통해 확인할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
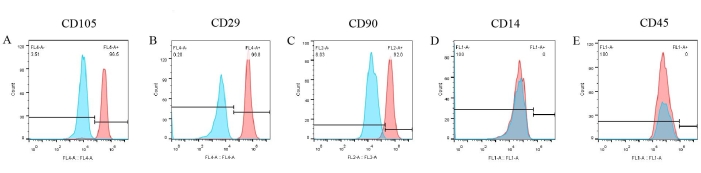
그림 6: 유세포 분석에 의한 pBM-MSC의 식별 결과. CD105, CD29, CD90은 pBM-MSC의 표면에서 각각 96.5%, 99.8%, 92.0%로 현저하게 발현되는 반면, CD14와 CD45의 발현은 음성이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
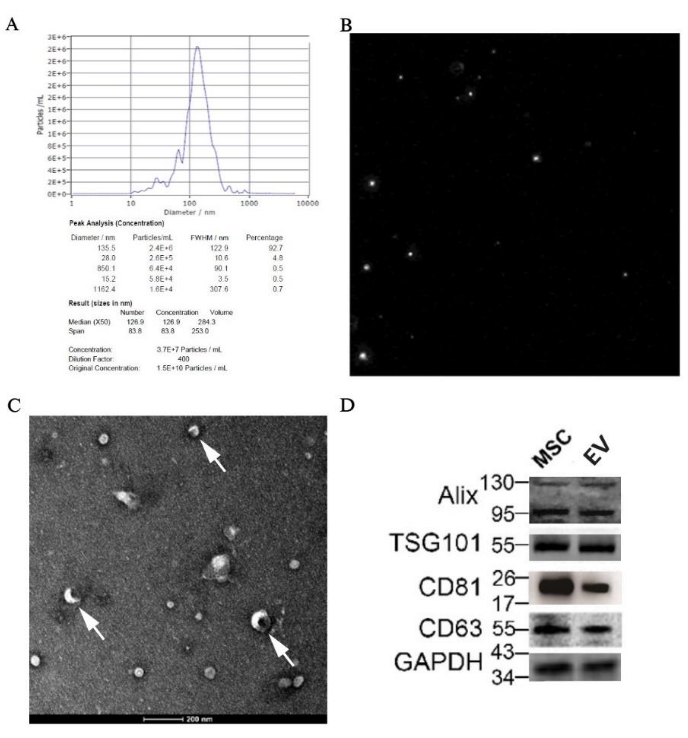
그림 7: 형태학 및 분자 생물학에 의한 pBM-MSC에서 파생된 EV의 식별 결과. (A) pBM-MSC에서 파생된 EV의 NTA 결과(각각 입자 크기 분포 그래프 및 (B) 입자 궤적 다이어그램 포함; (C) 50,000배 배율로 촬영한 TEM 이미지, 흰색 화살표는 원반형 소포의 고전적인 구조를 보여줍니다. (D) 웨스턴 블로팅에 의한 EV에 대한 특정 마커의 발현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
미니피그의 전통적인 골수 천자 지점은 장골능20에 위치했습니다. 골수 추출량은 쉽게 찾을 수 있지만, 골수 추출량은21개(일반적으로 5mL 정도)로 제한되어 있어 in vivo 이식을 위한 많은 수의 in vitro 확장 요구 사항을 충족하기 어렵습니다. 이 방법에서는 골수 천자 지점을 근위 대퇴골로 재배치하고 이 부위에서 최소 20mL의 골수를 추출할 수 있어 후속 세포 배양을 위한 충분한 양의 pBM-MSC를 보장할 수 있습니다.
밀도-구배 원심분리로 BM-MSC를 분리하는 데 사용되는 두 가지 주요 분리 솔루션은 Percoll과 Ficoll입니다. Percoll은 새로운 무독성 및 무자극 밀도 구배 원심 분리제인 실리콘화 폴리비닐피롤리돈(PVP)으로 구성됩니다. Percoll의 낮은 확산 상수는 상대적으로 안정적인 밀도 구배를 초래합니다. 따라서 일반적으로 낮은 원심력(200-1000 x g)에서 수십 분 이내에 만족스러운 세포 분리를 달성할 수 있습니다. Ficoll을 사용하여 pBM-MSC를 분리하는 방법은 이전에 보고되었습니다21. Percoll은 Ficoll에 비해 등투과성이 용이하고 점도가 낮으며 독성이 없고 세포 응집을 일으키지 않는 장점으로 인해 점차 사용되어 왔으며, 이는 기존의 pBM-MSC 분리 방법을 보완할 수 있습니다.
pBM-MSC를 분리하고 배양할 때 몇 가지 중요한 단계를 무시할 수 없습니다. 첫째, 밀도-구배 원심분리 후 다양한 액체상의 성공적인 성층화는 정제된 pBM-MSC를 분리하는 데 핵심입니다. BM-MSC는 골수 단핵 세포(BM-MNC)의 일종으로, 비중은 림프구 및 단핵구와 유사한 약 1.075g/mL입니다. Percoll의 원래 밀도는 1.130g/mL이며, 밀도-구배 원심분리 후 BM-MSC를 포함하는 세포층을 성공적으로 얻기 위해서는 Percoll 밀도-농도 관계22에 따라 60% 등장성 밀도 구배 분리 용액(1.077g/mL)을 미리 구성해야 합니다. 또한 적절한 원심분리 조건도 성공적인 계층화에 기여합니다. Percoll의 낮은 확산상수를 고려하여 추출한 골수를 600 x g에서 상대적으로 낮은 가감속 수준(ACC = 5, DEC = 5)에서 20분 동안 원심분리하여 우수한 층화 효과를 얻었습니다. 둘째, 적절한 파종 밀도도 세포 배양에 필수적입니다. 후속 이식을 위해 충분한 수의 MSC(보통 동물9당 10,7개 이상)를 획득하기 위해 세포 배양에 175cm2 배양 플라스크를 사용합니다. 이전 연구(20)에서, 얻어진 BM-MNC는 일반적으로 5 x 105/cm2의 밀도로 배양을 위해 배양 플라스크에 심었습니다. 밀도-구배 원심분리 후 돼지 골수 5mL당 2-3 x 107 BM-MNC를 얻을 수 있는 것으로 보고되었습니다23. 따라서 이 프로토콜에서는 각 20mL 돼지 골수에서 분리된 총 BM-MNC를 적절한 밀도를 위해 175cm2 배양 플라스크에 심는 것이 좋습니다. 셋째, pBM-MSC의 분리 및 배양 중에 불순물을 피해야 합니다. 단핵 세포상을 그릴 때 분리 액체와 혼합되지 않도록 피펫을 Percoll 상에 삽입해서는 안 됩니다. 또한, 세포를 심은 지 24시간 후에는 배양 플라스크를 부드럽게 흔들어 적혈구의 부착을 줄여야 합니다.
초원심분리 과정에서 이 방법을 통한 높은 수준의 단백질 응집체 및 지단백질 오염은 필연적으로 EV14의 정량화 및 기능 분석을 손상시킵니다. 공정에서 오염을 최대한 줄이기 위해 초원심분리 단계 전에 상층액을 이송할 때 매번 바닥에 5mm 깊이의 액체를 유지해야 합니다. 한편, 첫 번째 초원심분리 후 펠릿을 멸균 PBS에 재현탁시킨 다음 초원심분리를 다시 수행하면 지단백질 오염을 효과적으로 줄일 수 있습니다.
밀도 구배 원심분리와 초원심분리는 각각 BM-MSC와 그 파생 EV를 분리하는 데 널리 사용되어 왔지만, 이 두 기술에는 고유한 한계도 있습니다. 한편으로는, Percoll 기법은 시간이 오래 걸리고 번거롭기 때문에, 병상 세포 농축 장치를 통해 BM 농축 검체를 생성하는 것이 MSC를 분리하는 대체 방법으로 보고되었습니다24. 반면에 초원심분리 방법에는 고도로 훈련된 기술자뿐만 아니라 값비싼 장비도 필요합니다. 그러므로, 둘 이상의 기술의 조합된 적용은 EV(25)의 보다 효율적인 절연을 위한 합리적인 전략을 제시할 수 있다. 또한 pBM-MSC 및 파생된 EV의 식별도 개선이 필요합니다. 예를 들어, MSC26 정의를 위한 국제 기준에 따르면 CD73, CD34 및 HLA-DR과 같은 일부 양성 또는 음성 마커의 발현은 이 연구에서 유세포 분석에 의한 BM-MSC 표현형 식별 결과에서 여전히 누락되어 있습니다. 또한 EV를 격리하는 과정에서 오염을 방지하기 위한 조치가 취해졌지만 실험실의 한계로 인해 후속 작업을 개선하기 위해 EV 샘플의 순도를 평가할 수 없습니다.
이 연구는 pBM-MSC와 그 파생된 EV를 순차적으로 분리하는 방법을 결합하며, 이는 후속 식별 결과에 의해 체계적으로 입증되었습니다. 특히, 우리는 이 일련의 단계에서 핵심 작업을 강조했으며, 이 과정에서 다른 실험실에 존재하는 이질성 문제를 어느 정도 해결할 수 있는 몇 가지 특정 실험 조건을 설명했습니다. 이 방법론적 연구는 BM-MSC 및 그 파생 EV의 이식 효능에 대한 전임상 연구에 널리 사용될 수 있으며, 이는 임상 연구를 위한 충분한 수준의 실험적 기반을 제공할 수 있습니다.
공개
모든 저자는 선언할 이해 상충이 없습니다.
감사의 말
골수 추출 수술에 기여한 Yang Jianzhong과 Wang Xuemin에게 감사드립니다. 이 연구는 CAMS Innovation Fund for Medical Sciences(CIFMS) [보조금 번호 2016-I2M-1-009], 중국 국립자연과학재단(NO: 82070307, NO: 81874461)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
참고문헌
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유