Method Article
ブタ骨髄間葉系幹細胞およびそれら由来の細胞外小胞の単離と同定
要約
この記事では、ブタの骨髄間葉系幹細胞(pBM-MSC)とそれらに由来する細胞外小胞(EV)を単離および同定する方法を詳しく説明し、BM-MSCとその派生EVの移植効果を前臨床で評価するための方法論的基盤を提供します。
要約
トランスレーショナルリサーチや再生医療における幹細胞治療の発展に伴い、骨髄間葉系幹細胞(BM-MSC)は、多能性幹細胞の一種として、その即時利用可能性と安全性の証明から好まれています。BM-MSCの移植は、パラクリンメカニズム を介した 免疫応答と炎症反応の調節に関連している可能性のある、さまざまな疾患の損傷組織の修復に非常に有益であることが報告されています。細胞外小胞(EV)は、脂質膜の二層構造を特徴としており、幹細胞のパラクリン効果の主なメディエーターと考えられています。細胞コミュニケーションとエピジェネティックな制御における重要な役割が認められているEVは、すでに in vivo で免疫療法に応用されています。しかし、その母体細胞と同様に、EVの移植の有効性に関する研究のほとんどはまだ小動物のレベルにとどまっており、臨床応用に不可欠な証拠を提供するには不十分です。ここでは、密度勾配遠心分離法を用いてブタの骨髄から骨髄細胞(BMC)を最初に単離し、その後、顕微鏡観察、誘導分化アッセイ、フローサイトメトリーの結果により、細胞培養によってブタのBM-MSC(pBM-MSC)を得ます。さらに、細胞上清中のpBM-MSCsに由来するEVを超遠心分離により単離し、透過型電子顕微鏡(TEM)、ナノ粒子追跡分析(NTA)、ウェスタンブロッティングの技術によって成功裏に証明しました。全体として、pBM-MSCsとその派生EVは、BM-MSCsとその派生EVの移植有効性に関する前臨床試験で広く使用されている可能性のある以下のプロトコルによって効果的に分離および同定することができます。
概要
過去10年間、幹細胞治療は、外傷、呼吸器、心血管疾患など、さまざまな病気や怪我に苦しむ患者に大きな利益を約束してきました。この分野の進歩に伴い、骨髄間葉系幹細胞(BM-MSC)は、そのアクセスのしやすさと倫理的な紛争が少ない1ことから、徐々に人々に支持されるようになってきており、これは他の細胞タイプにもかかわらず臨床研究のゴールドスタンダードと考えられてきました2。BM-MSCに基づく治療法は、免疫応答と炎症反応を調節し、分化またはパラクリンメカニズム を介して 損傷した組織を修復する独自の能力により、ますます多くの研究者にとって魅力的になっています3。
細胞外小胞(EV)は、International Society for Extracellular Vesicles(ISEV)が推奨している4、細胞から自然に放出される脂質二重層構造を持つ全粒子を指します。近年、タンパク質、脂質、遺伝物質(miRNA、mRNA、DNA分子、長鎖ノンコーディングRNAなど)など、さまざまな細胞タイプのEV5の様々な内容物が発見され、細胞コミュニケーションやエピジェネティックな制御における重要な役割が認識されてきました6。EVは、母体細胞の新たな代替として、免疫療法や再生医療に応用され、 in vivoでの研究が進められており、現在進行中の前臨床研究やフォローアップ臨床試験の基礎となっています7。
しかし、現在のところ、BM-MSCおよびその派生EVの移植の有効性に関する研究のほとんどは、まだ小動物のレベルにとどまっており、臨床翻訳に必要な証拠を提供するには不十分です。そのため、BM-MSCsおよびその派生EVをブタなどの大型動物レベルで移植する前臨床研究を行うことが極めて急務となっています。
MSCは骨髄中に非常に少ない数で存在し、全細胞の0.01%から0.001%しか占めていないことが報告されています8。しかし、BM-MSCの前臨床投与には多数の細胞(1匹あたり≥107 )が必要です9。必要なEVの量はさらに多く、その用量の中央値は豚10の体重1キログラムあたり0.25mgのタンパク質です。これらの大量数を達成するためには、ブタの骨髄からMSCを分離して培養し、 in vitro でMSCの大規模な拡大を達成し、その後、高タンパク質濃度のEVを獲得する安全で効果的な方法が急務です。
これまで、BM-MSCとその派生EVを分離する方法は様々です。BM-MSCを単離するための現在の方法には、骨髄細胞(BMC)の直接植え付け11、密度勾配遠心分離、細胞表面分子標識ソーティング、およびフローサイトメトリースクリーニングが含まれます。細胞表面の分子標識選別およびフローサイトメトリースクリーニングは、細胞接着率の低下、24時間死亡率の増加、および増殖阻害をもたらすことが報告されています12が、BMCの直接培養は、多数の混合造血細胞をもたらす可能性があります。したがって、密度勾配遠心分離は、BM-MSCを得るために現在一般的に使用されています.細胞上清からEVを単離するための現在の方法には、超遠心分離、限外ろ過、ポリマー沈殿、およびサイズ排除が含まれます13。他の方法と比較して、超遠心分離には、低コスト、使いやすさ、および複雑な前処理のない大量調製との互換性という利点があり、これはEV分離の「ゴールドスタンダード」です14。しかし、プロセス3,15では、異なるラボ間で試薬や技術に大きな不均一性が存在するため、読者に誤解を与える可能性があります。この記事では、pBM-MSCとそれらに由来するEVを単離するための一連の一連のステップを詳しく説明し、その後の同定結果により、前臨床研究でさらに分析するためにpBM-MSCとそのEVを取得する方法が可能であることが証明されています。この体系的な研究が、pBM-MSCおよびその派生EVの移植の前臨床評価に従事する研究者に方法論的基盤を提供し、できるだけ早く臨床試験を実施できるようになることを願っています。
プロトコル
米国国立衛生研究所(NIH)が発行した「Guide for the Care and Use of Laboratory Animals」によると、すべての実験手順は、中国医学院福和病院の動物施設管理および使用委員会(IACUC)によって承認されました。
1.動物の術前準備
- 生後約12ヶ月の中国のミニブタ(30±5kg)の成体オスの中国産ミニブタを中国科学院動物学研究所から入手し、少なくとも2週間前に福井病院動物実験センターの施設に収容してください。血液定期検査などの術前検査を実施して、動物が健康であることを確認する。
- 手術の前日にミニブタの大腿部の皮膚をきれいにして剃ります。誤嚥を避けるために、骨髄摘出の12時間前にミニブタを絶食します。
2. 細胞単離・培養の準備
- Percoll(1.130 g / mL)を使用して、骨髄から間葉系幹細胞を単離します。.ストック溶液を10倍濃縮PBSと9:1の比率で混合して、等張培地を得ます。次に、等張培地とPBSを3:2の比率で混合して、pBM-MSCを単離するための最終分離溶液として使用できる60%Percoll溶液(1.077 g / mL)を取得します。
- IscoveのModified Dulbecco's Medium(IMDM)を10%ウシ胎児血清と1.0%ペニシリン-ストレプトマイシンで調製し、完全な培地を得ます。培地全体とPBSを37°Cのウォーターバスで予熱し、その後の細胞培養に使用します。
3.動物の麻酔
- ケタミン(10 mg / kg)とキシラジン(2 mg / kg)を筋肉内に全身麻酔します。.ミニブタの呼吸が遅く、手足の活動が少ない場合は、気管内挿管を迅速に実施し、挿管の失敗を防ぐために自発呼吸を維持します。.
- 2%イソフルランを吸入し、酸素(1.5L/min)をキャリアガスとして吸入して麻酔の維持を行います。麻酔中は、ミニブタの心拍数、呼吸、血中酸素飽和度をリアルタイムで監視します。
4.ミニブタから骨髄を抽出
- ミニブタを横向きの位置に置きます。その後の細胞培養に十分な量の骨髄を確保するには、骨髄穿刺点をミニブタの大腿骨近位部に位置させます(図1)。手術を適用する前に、穿刺部位の皮膚を消毒してドレープします。
- 利き手でない方の手で穿刺点周辺の皮膚を引き締め、利き手の点で骨髄生検針を垂直に穿刺します。皮質骨に針が接触しているのを感じたら、ハンドルを左右にゆっくり回して針をドリルで開けます。針が骨髄腔に入ると、抵抗を失うような感覚がよくあります。
- 穿刺が所定の位置に配置されたら、コアニードルを引き出します。その後、使い捨ての滅菌済み50mLシリンジをアウターニードルの端に取り付け、シリンジの内壁を事前にヘパリンですすいでください。
- 20mLの骨髄をゆっくりと抽出し、滅菌済みの50mL遠心チューブに慎重に移します。
- 施術が完了したら、針を抜いてドレープを外します。穿刺部位を消毒し、止血のために20分間押します。
- 自発呼吸を回復した後、ミニブタを抜管します。手足が自由に動いて完全に目覚めたら、ミニブタをケージに戻して給餌を続けます。
5. 骨髄から間葉系幹細胞を単離する
- 予熱したPBSを等量骨髄に加え、十分に混合します。次に、滅菌ピペットを使用して、希釈した骨髄20 mLを60%密度勾配溶液レベルより1:1の容量比で、滅菌済みの50 mL遠心チューブに慎重に移します。
- チューブを600 x g (加速(ACC)= 5、減速(DEC)= 5)で室温(RT)で20分間遠心分離します。
注:遠心分離後、チューブ内には、血清相、単核細胞相、密度勾配中相、上から下への沈殿相の4つの相が形成されます。単核細胞相は、血清と密度勾配培地との間の薄い凝集層です。骨髄由来の間葉系幹細胞は、この相に位置しています。 - 単核細胞相を滅菌済みの15 mL遠心チューブに引き込み、PBSで800 x g で5分間2回洗浄します。
- 洗浄した細胞を2mLの完全培地に再懸濁し、再懸濁した細胞を175 cm2 細胞培養フラスコに3-5 x 105 / mLの密度で植えます。
注:間葉系幹細胞を単離するための上記のすべての手順は、 図2で見ることができます。
6. in vitroでの間葉系幹細胞の培養
- 培養フラスコを37°Cで、5%CO2の飽和加湿雰囲気でインキュベートします。沈殿した造血幹細胞の付着増殖を防ぐために、培養フラスコを24時間ごとに静かに振るうとともに、細胞の増殖、形態、および汚染を顕微鏡で観察します。
- 3日後に初めて培地を交換し、その後2〜3日ごとに培地を交換します。細胞コロニーが80%〜90%のコンフルエントに達したら、細胞を1:2の比率で継代培養します。
7. pBM-MSCの脂肪形成性、骨形成性、軟骨形成性の分化
- 脂肪分化アッセイ
- キットの指示に従って、BM-MSC用の脂肪原性分化培地A(培地A)とB(培地B)を調製します。キットに関する具体的な情報は、 資料の表に記載されています。
- 0.1%ゼラチン1mLを6ウェルプレートに加え、各ウェルの底を均一に覆うように静かに振とうします。次に、6ウェルプレートをクリーンベンチまたはCO2 インキュベーターに少なくとも30分間置きます。
- 30分後、ゼラチンを吸引し、2 mLの一般的な完全培地を各ウェルに加えます。次に、pBM-MSCを2 x 104 細胞/cm2の細胞密度で6ウェルプレートに植えます。その後、プレートを5%CO2の飽和湿度で37°Cでインキュベートします。
- 細胞が100%のコンフルエントに達したら、完全な培地を慎重に取り出し、プレートの各ウェルに2 mLの培地Aを加えます。3日後、ミディアムAをプレートから取り出し、各ウェルに2 mLのミディアムBを加えます。
- 1日間保持した後、ミディアムBを取り外し、インダクション用のミディアムAと交換します。「A中を3日間、B中を1日」という方法に従い、A中とBを順番に使用して導入します。
- 期間中は毎日細胞の状態を観察します。培地Aの誘導過程で細胞が縮小または死滅した場合は、細胞の状態が回復するまで、できるだけ早く培地Bと交換してください。
- 導入とメンテナンスのプロセスを繰り返し、顕微鏡下で適切なサイズの脂肪滴が十分に観察されたら、染色の準備をします。
- 6ウェルプレートで脂肪分化用の培地を取り出し、1x PBSで穏やかに洗浄します。各ウェルに2 mLの4%パラホルムアルデヒド溶液を加え、室温で30分間固定します。
- パラホルムアルデヒド固定液を取り外し、1x PBSで2〜3回洗浄して、固定液が完全に除去されていることを確認してください。各ウェルに2 mLのOil Red O色素を加え、室温で30分間染色します。
- オイルレッドO染料を取り除き、1x PBSで2〜3回洗います。各ウェルに2mLの1x PBSを添加し、顕微鏡で脂肪形成分化の影響を観察します。
- 骨分化アッセイ
- キットの指示に従って、骨形成分化のための完全な培地を準備します。
- 手順7.1.2-7.1.3に従って、pBM-MSCを植えて培養します。
- 細胞が70%のコンフルエントに達したら、一般的な完全培地を慎重に取り出し、プレートの各ウェルに骨形成分化用の培地2 mLを加えます。
- 3日ごとに新鮮な骨形成分化培地に交換します。誘導を2〜4週間続け、骨形成中に明らかなカルシウム結節が現れたときにアリザリンレッド染料で染色する準備をします。
- 6ウェルプレートで骨分化用培地を取り出し、1x PBSで優しく洗浄します。各ウェルに2 mLの4%パラホルムアルデヒド溶液を加え、室温で30分間固定します。
- パラホルムアルデヒド固定液を取り外し、1x PBSで2〜3回洗浄して、固定剤が完全に洗浄されていることを確認します。2 mLのAlizarin Red色素を各ウェルに加え、室温で10分間染色します。
- Alizarin Red染料を取り除き、1x PBSで2〜3回洗います。各ウェルに2mLの1x PBSを添加し、顕微鏡で骨形成分化の影響を観察します。
- 軟骨分化アッセイ
- キットの指示に従って、軟骨分化のためのプレミックスを準備します。
- 3-4 x 105 pBM-MSCを滅菌済みの15 mL遠心分離チューブに移します。250 x g で20°Cで4分間遠心分離します。
- 上清を取り除き、0.5 mLのプレミックスを加えて、前のステップで遠心分離して得られたペレットを再懸濁した後、150 x g で20°Cで5分間遠心分離します。 この手順を繰り返して、細胞を再度洗浄します。
- 軟骨分化のための完全な培地を準備します。
- 前のステップで得られた細胞を0.5 mLの完全培地で再懸濁し、150 x g で20°Cで5分間遠心分離します。
- 遠心分離管のキャップを緩めて、ガス交換を容易にします。37°C、5%CO2、飽和湿度のインキュベーターに直立させます。
- 細胞が凝集しているように見える場合(実際の状況に応じて、通常は24〜48時間後)、遠心分離管の底をフリックして、軟骨ボールを底から分離し、培地に懸濁させます。
- 2〜3日ごとに軟骨分化のための新鮮な完全培地に交換します。直径1.5〜2 mmの軟骨ボールがチューブ内に形成されるまで誘導を続け、次に染色用の切片を準備します。
- 軟骨ボールのパラフィン切片を病理学的実験のルーチンステップに従って調製します。ワックスを抜いた部分にアリシアブルー染料を加え、37°Cで1時間染色します。
- スライドを流水で5分間すすぎ、乾燥後に顕微鏡でアリシアブルーの染色効果を観察します。
8. フローサイトメトリーによる細胞表現型の同定
- 細胞コロニーが継代3〜5で80%〜90%のコンフルエントに達したら、培地を取り出し、予熱したPBSで細胞を2回洗浄します。次に、細胞を3〜4mLの0.25%トリプシン/ EDTAで消化し、5%CO2 の飽和加湿雰囲気で37°Cで2〜3分間インキュベートし、顕微鏡下でフラスコの底から取り外します。
- 10 mLの完全培地で細胞を回収し、細胞懸濁液を滅菌済みの15 mL遠心チューブに移します。細胞懸濁液を800 x g でRTで5分間遠心分離し、上清を捨て、細胞を4°CのPBSで洗浄します。
- 細胞を4°CのPBSで10mLに再懸濁します。細胞懸濁液は、1.5mLマイクロチューブ各中に1mLの容量を有する9つのグループに分けられ、それぞれネガティブコントロール、FITCアイソタイプコントロール、PEアイソタイプコントロール、APCアイソタイプコントロール、CD105、CD29、CD90、CD14、およびCD45グループと名付けられます。各マイクロチューブ内のセルの数が 1 x 105 から 1 x 106 の間であることを確認してください。
- 懸濁液を800 x g で4°Cで5分間遠心分離し、各マイクロチューブ内の細胞を100 μLの4°C PBSで再度懸濁します。ネガティブコントロール群を除き、ステップ8.3の順番に従って、対応するアイソタイプコントロール(FITC、PE、およびAPC Mouse IgG1 kappa Isotype Control)とフローサイトメトリー用抗体(CD105、CD29、CD90、CD14、およびCD45モノクローナル抗体)を5 μLを各マイクロチューブに加えます。穏やかに混合し、暗所で4°Cで1.5時間インキュベートします。
- 各マイクロチューブに4°C PBS1 mLを加え、300 x g で4°Cで10分間遠心分離します。 上清を捨て、200 μLの4 °C PBSを加えて細胞を再懸濁します。
- 細胞懸濁液16 をろ過した後、フローサイトメトリーで少なくとも10,000個の細胞を試験し、フローサイトメトリーソフトウェアを用いてデータを解析する。
9. ブタ骨髄間葉系幹細胞由来の細胞外小胞(EV)の単離
- pBM-MSCのコンフルエンスが80%〜90%に達したら、上清を捨て、細胞をPBS 2xで洗浄します。次に、25 mLの無血清IMDMを各培養フラスコに加え、5% CO2 の加湿雰囲気下で37°Cで48時間インキュベートします。
- 細胞上清(調整培地、CM)を50 mLの遠心チューブに集め、300 x g で4°Cで10分間遠心分離して、細胞の破片を取り除きます。
- 上清を別の50mL遠心分離チューブに再度収集します。上清を回収した後は、できるだけ早くEVの分離を実施してください。長期保存する場合は、上澄み液を-80°Cの冷蔵庫に保管して、EVの紛失を防ぎます。
- ステップ9.3で上清を2,000 x g で4°Cで20分間遠心分離します。
- 上清を高速遠心分離機および16,500 x g で4°Cで30分間遠心分離するために使用される滅菌チューブに移します。
- 上清を再び超遠心チューブに移し、固定角ローターを使用して、120,000 x g で4°Cで少なくとも70分間遠心分離します。
- 上澄みを完全に捨てます。各超遠心チューブに4°C PBS1 mLを加え、マイクロピペットで沈殿物を再懸濁します。同じグループの溶液を超遠心チューブに混合し、4°CのPBSを加えて、チューブの3/4を超える容量にします。
- 120,000 x g で4°Cで60分間遠心分離し、上清をできるだけ取り除きます。
- 沈殿物を滅菌PBSで再度懸濁し、EVを-80°Cの冷蔵庫に保管します。
注:再懸濁のためのPBSの量は、2つの175 cm2 培養フラスコごとに100 μLとして決定できます。上記のEVの絶縁手順をすべて 図3 に体系的に示しています。
10. 透過型電子顕微鏡(TEM)、ナノ粒子追跡分析(NTA)、ウェスタンブロッティングによるEVの同定
- EVsサンプルを25°Cのウォーターバスで解凍した後、氷上に置いた後、NTA検出用のPBSで前の濃度の半分に希釈します17。
- 銅メッシュ上にサンプル10μLをピペットで移し、1分間沈殿させ、浮遊液を濾紙で吸収します。次に、銅メッシュに10μLのリンタングステン酸を加え、1分間放置して余分な液体を吸収します。
- RTで数分間乾燥させた後、100KVの加速電圧18の条件下で電子顕微鏡イメージングを行う。
- ステップ 9.9 の EV サンプルを RIPA 溶解バッファー (25 mM Tris·HCl(pH 7.6)、150 mM塩化ナトリウム[NaCl]、1%ノニルフェノキシポリエトキシレタノール(NP-40)、1%デオキシコール酸ナトリウム、0.1%ドデシル硫酸ナトリウム(SDS)、1 mMフェニルメタンスルホニルフッ化物(PMSF)、1xプロテアーゼ阻害剤)、およびAlix、TSG101、CD81、CD63などのEVの特異的マーカーの発現をウェスタンブロッティング19により検出します。
結果
ブタ骨髄間葉系幹細胞の樹立
ブタの骨髄由来の間葉系幹細胞の単離とin vitroでの培養に成功し、異なる日のpBM-MSCの形態を 図4に示します。pBM-MSCsの初代培養では、顕微鏡観察により、植え付けの1日後に細胞接着が起こり、接着細胞は通常丸い形をしていることが示されました。一次pBM-MSCは、植え付け後3日間は一般に静止期に留まり、細胞増殖は4日目に 始まりました。細胞形態は増殖後に円形から紡錘体型、多国間型、または星型に変化し、核は中心であり、一部の細胞では二重核小体があります。細胞コロニーは、細胞増殖の開始後7〜9日で形成され、12〜14日で80%〜90%の細胞コンフルエンスを達成できました。顕微鏡観察の結果、接着細胞は散在するコロニーとして増殖し、渦巻くように配置されていることが分かりました。
継代後、細胞増殖は著しく加速され、1週間で80%-90%のコンフルエンスに達することができました。細胞形態は、第2継代から均質な紡錘形であり、線維芽細胞に似ており、長さと幅の比率は約2〜3:1でした。セルが分化していた場合、多角形または星型に見えることがあります。継代後、細胞は散在するコロニーとしてではなく、平行に均一に放射状に増殖しました。
染色による細胞分化電位の同定
脂肪形成分化アッセイでは、Oil Red O染色により、核の周囲に異なるサイズの丸いオレンジレッドの脂肪滴が現れることが示されました(図5A)。骨形成分化アッセイでは、Alizarin Red染色は細胞表面に赤い結節を示しました(図5B)これは、pBM-MSCから分化した骨芽細胞によって沈着したカルシウム塩との色反応によって引き起こされました。軟骨分化アッセイでは、アリシアブルー染色により、軟骨ボール中のエンド酸性ムコ多糖の染色によって引き起こされた組織切片全体が青色であることが示されました(図5C)。
フローサイトメトリーによる細胞表現型の同定
細胞表面マーカーのアッセイを行い、pBM-MSCの表現型を作製した。フローサイトメトリーの結果(図6)から、CD105、CD29、CD90などの3つの陽性マーカーがpBM-MSCの表面に有意に発現し、それぞれ96.5%、99.8%、92%を占めていました(図6A-C)。しかし、CD14およびCD45の発現は陰性であった(図6D、E)。一方、対応するアイソタイプコントロールの結果はすべて陰性であり、これはすでに図に重ねて表示されており、抗体の非特異的結合の可能性を排除しています。
NTA、TEM、およびウェスタンブロッティングによるpBM-MSC由来のEVの同定
NTAの結果、粒子サイズの中央値は126.9nmであり、EVの範囲内であることが示されました。また、EVサンプルの元の濃度は1.5 x 1010 粒子/mLであり、サイズに割り当てられた正確な値は 図7Aに記載されています。粒子の軌道図を 図7Bに示し、粒子が不規則なブラウン運動をしていたことを示しています。さらに、EVの古典的な構造である円盤状小胞は、電子顕微鏡で50,000倍の倍率ではっきりと見ることができました(図7C)。また、Alix、TSG101、CD81、CD63などのEVの特異的マーカーの発現がウェスタンブロッティングによってサンプルから検出されました(図7D)。
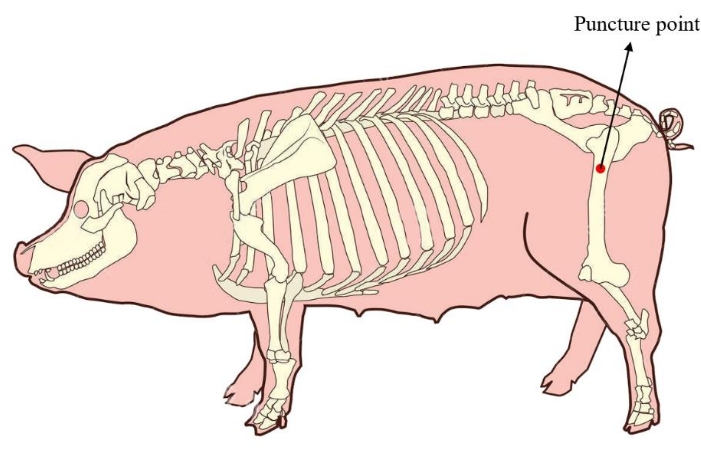
図1:ミニブタの骨髄穿刺点。 赤い領域は、ミニブタの近位大腿骨に位置する骨髄を抽出する穿刺点を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
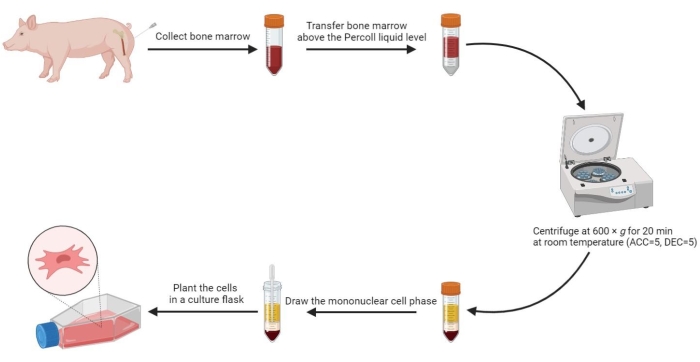
図2:ブタの骨髄からの間葉系幹細胞を分離する。 ブタの骨髄から間葉系幹細胞を単離する過程をフローチャートに示し、密度勾配遠心分離後の4つの液相を明瞭に示しています。 この図の拡大版を表示するには、ここをクリックしてください。
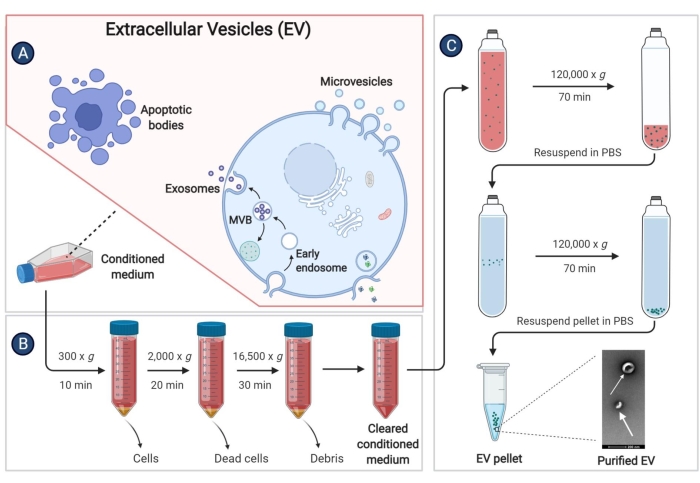
図3:pBM-MSCから派生したEVの分離。 この概略図は、超遠心分離によって調整された媒体からEVを分離する具体的な手順を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:異なる日におけるpBM-MSCの形態学的特徴。 pBM-MSCの同様の形態学的特徴は、100倍顕微鏡フィールドの下で植え付け後3日目、5日目、7日目、および9日目 に見られ、9日目 に細胞コロニーが形成されています。 この図の拡大版を表示するには、ここをクリックしてください。

図 5.染色によるpBM-MSCの分化電位の同定。 (A)脂肪原性、(B)骨原性、および(C)pBM-MSCの軟骨原性分化アッセイ。pBM-MSCの分化ポテンシャルは、これらの染色結果から同定できます。 この図の拡大版を表示するには、ここをクリックしてください。
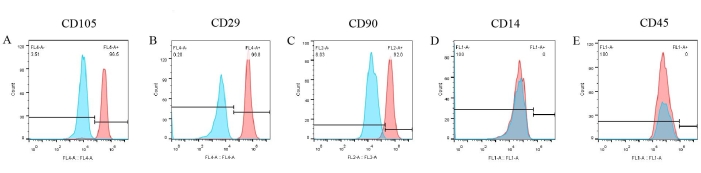
図6:フローサイトメトリーによるpBM-MSCの同定結果。 pBM-MSCsの表面にはCD105、CD29、CD90がそれぞれ96.5%、99.8%、92.0%と有意に発現しているが、CD14とCD45の発現は陰性である。 この図の拡大版を表示するには、ここをクリックしてください。
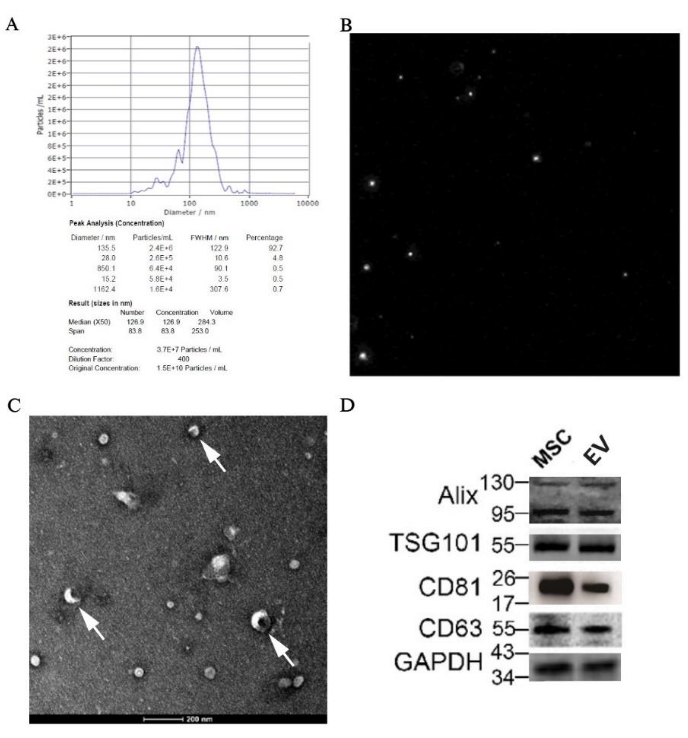
図7:pBM-MSCs由来EVの形態学および分子生物学的な同定結果(A)pBM-MSCs由来EVのNTA結果(粒度分布グラフ付き)、(B)粒子軌道図。(C)50,000倍の倍率で撮影したTEM画像で、白矢印は円板状小胞の古典的な構造を示しています。(D)ウェスタンブロッティングによるEVの特異的マーカーの発現。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ミニブタの伝統的な骨髄穿刺点は、腸骨稜20に位置していた。骨髄抽出量は21個(一般的には5mL程度)と限られていますが、in vivoでの移植にはin vitroでの多数の増殖の要求を満たすことは困難です。この方法では、骨髄穿刺点を大腿骨近位部に再配置し、この部位から少なくとも20mLの骨髄を抽出でき、その後の細胞培養に十分な量のpBM-MSCを保証します。
密度勾配遠心分離法によるBM-MSCの単離に使用される主な分離溶液は、PercollとFicollの2つです。Percollは、新規の無毒で刺激性のない密度勾配遠心分離剤であるシリコン化ポリビニルピロリドン(PVP)で構成されています。Percollの拡散定数が低いため、密度勾配は比較的安定しています。したがって、通常、低い遠心力(200-1000 x g)で数十分以内に満足のいく細胞分離を達成できます。Ficollを用いたpBM-MSCの単離法は、以前に報告されている21。Ficollと比較して、Percollは、操作が容易で、粘度が低く、毒性がなく、細胞凝集を引き起こさないという利点により、徐々に使用されてきました。
pBM-MSCの単離と培養では、いくつかの重要なステップを無視することはできません。まず、密度勾配遠心分離後のさまざまな液相の成層化を成功させることが、精製されたpBM-MSCを単離するための鍵です。BM-MSCは、骨髄単核細胞(BM-MNC)の一種として、リンパ球や単球と同様の比重(約1.075 g / mL)を持っています。Percollの元の密度は1.130 g/mLであり、密度勾配遠心分離後にBM-MSCを含む細胞層を正常に得るためには、Percoll密度-濃度関係22に従って、60%等張密度勾配分離溶液(1.077 g/mL)を事前に構成する必要がある。さらに、適切な遠心分離条件も層別化の成功に貢献します。Percollの拡散定数が低いことを考慮し、抽出した骨髄を600 x gで比較的低い加減速レベル(ACC=5、DEC=5)で20分間遠心分離し、良好な成層化効果を達成しました。第二に、細胞培養には適切な植栽密度も不可欠です。その後の移植のために十分な数のMSC(通常は動物9あたり107を超える)を獲得するために、細胞培養に175cm2の培養フラスコを使用します。以前の研究20では、得られたBM-MNCは通常、5 x 105 / cm2の密度で培養フラスコに植えられていました。密度勾配遠心分離後、ブタ骨髄23の5mLごとに2-3×107 BM-MNCが得られることが報告されている。したがって、このプロトコルでは、各20 mLのブタ骨髄から単離された合計BM-MNCを175 cm2培養フラスコに適切な密度で植えることをお勧めします。第三に、pBM-MSCの単離および培養中に不純物を避ける必要があります。単核細胞相を描画するときは、分離液と混ざらないように、ピペットをパーコール相に挿入しないでください。さらに、細胞植え付けの24時間後、赤血球の付着を減らすために培養フラスコを穏やかに振とうする必要があります。
超遠心分離の過程で、この方法による高レベルのタンパク質凝集体およびリポタンパク質の汚染は、必然的にEVの定量と機能分析を損なうことになります14。プロセスでの汚染をできるだけ減らすために、超遠心分離ステップの前に上清を移送する際には、毎回底部に5mmの深さの液体を保持する必要があります。一方、最初の超遠心分離後、ペレットを滅菌PBSに再懸濁してから再度超遠心分離を行うことで、リポタンパク質の汚染を効果的に減らすことができます。
密度勾配遠心分離法と超遠心分離法は、それぞれBM-MSCおよびその誘導EVの単離に広く使用されていますが、これら2つの技術にも独自の制限があります。一方では、Percoll法は長くて面倒であり、ベッドサイドの細胞濃縮装置 を介して BM濃縮標本を生成することは、MSCを単離する代替方法として報告されています24。一方、超遠心分離法は、高度な訓練を受けた技術者だけでなく、高価な機器も必要です。したがって、2つ以上の技術の併用適用は、EV25のより効率的な絶縁のための合理的な戦略を提示し得る。さらに、pBM-MSCとその派生EVの同定にも改善が必要です。例えば、MSCs 26を定義するための国際的な基準によれば、CD73、CD34、HLA-DRなどの一部の陽性または陰性のマーカーの発現は、この研究のフローサイトメトリーによるBM-MSC表現型の同定結果からまだ欠落しています。また、EVの分離過程では汚染を避けるための対策が講じられていますが、当研究室の制約により、EVサンプルの純度を評価してフォローアップ作業の改善に役立てることができません。
本研究では、pBM-MSCとその誘導EVを順次単離する方法を組み合わせ、その後の同定結果によって体系的に証明されます。特に、この一連のステップの主要な操作を強調し、このプロセス中に異なる研究室に存在する不均一性の問題をある程度解決できるいくつかの特定の実験条件を説明しました。この方法論的研究は、BM-MSCおよびその派生EVの移植有効性に関する前臨床研究で広く使用される可能性があり、臨床研究に十分なレベルの実験的根拠を提供する可能性があります。
開示事項
すべての著者は、宣言すべき利益相反はありません。
謝辞
骨髄摘出術の運営に貢献してくださったYang Jianzhong氏とWang Xuemin氏に感謝します。この研究は、CAMS Innovation Fund for Medical Sciences(CIFMS)[助成金番号2016-I2M-1-009]、中国国家自然科学基金(no:82070307;no:81874461)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
参考文献
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved