Method Article
Isolamento e Identificação de Células-Tronco Mesenquimais da Medula Óssea Suína e suas Vesículas Extracelulares Derivadas
Neste Artigo
Resumo
Este artigo elabora um método para isolar e identificar células-tronco mesenquimais da medula óssea suína (pBM-MSCs) e vesículas extracelulares (EVs) derivadas delas, fornecendo uma base metodológica para a avaliação pré-clínica da eficácia do transplante de BM-MSCs e seus EVs derivados.
Resumo
Com o desenvolvimento da terapia com células-tronco em pesquisa translacional e medicina regenerativa, as células-tronco mesenquimais da medula óssea (BM-MSCs), como uma espécie de células-tronco pluripotentes, são favorecidas por sua disponibilidade instantânea e segurança comprovada. Tem sido relatado que o transplante de BM-MSCs é de grande benefício para reparar tecidos lesados em várias doenças, o que pode estar relacionado à modulação das respostas imunes e inflamatórias por meio de mecanismos parácrinos. As vesículas extracelulares (EVs), com uma estrutura de membrana lipídica de camada dupla, são consideradas os principais mediadores dos efeitos parácrinos das células-tronco. Reconhecidos por seus papéis cruciais na comunicação celular e na regulação epigenética, os EVs já foram aplicados in vivo para imunoterapia. No entanto, semelhante às suas células maternas, a maioria dos estudos sobre a eficácia do transplante de EVs ainda permanece no nível de pequenos animais, o que não é suficiente para fornecer evidências essenciais para a tradução clínica. Aqui, usamos a centrifugação com gradiente de densidade para isolar as células da medula óssea (BMC) da medula óssea suína no início, e obtemos BM-MSCs suínas (pBM-MSCs) por cultura de células posteriormente, identificadas pelos resultados da observação ao microscópio, ensaio de diferenciação induzida e citometria de fluxo. Além disso, isolamos EVs derivados de pBM-MSCs em sobrenadante celular por ultracentrifugação, comprovado pelas técnicas de microscopia eletrônica de transmissão (TEM), análise de rastreamento de nanopartículas (NTA) e western blotting com sucesso. No geral, as pBM-MSCs e seus EVs derivados podem ser isolados e identificados de forma eficaz pelos seguintes protocolos, que podem ser amplamente utilizados em estudos pré-clínicos sobre a eficácia do transplante de BM-MSCs e seus EVs derivados.
Introdução
Nos últimos 10 anos, a terapia com células-tronco prometeu grandes benefícios para pacientes que sofrem de uma variedade de doenças e lesões, como traumas, doenças respiratórias e cardiovasculares. Com o progresso no campo, as células-tronco mesenquimais da medula óssea (BM-MSCs) estão gradualmente sendo favorecidas pelas pessoas por sua acessibilidade e poucas disputas éticas1, que têm sido consideradas o padrão-ouro para pesquisas clínicas, apesar de outros tipos celulares2. As terapias baseadas em BM-MSCs também são atraentes para cada vez mais pesquisadores devido à sua capacidade única de modular as respostas imunes e inflamatórias e reparar tecidos lesados por meio de diferenciação ou mecanismos parácrinos3.
As vesículas extracelulares (EVs), como endossa a Sociedade Internacional de Vesículas Extracelulares (ISEV)4, referem-se ao total de partículas com uma estrutura de bicamada lipídica que são naturalmente liberadas das células. Com as recentes descobertas de vários conteúdos, como proteínas, lipídios e materiais genéticos (por exemplo, miRNA, mRNA, moléculas de DNA, bem como RNAs não codificantes longos) em EVs de diferentes tipos de células5, seus papéis cruciais na comunicação celular e na regulação epigenética foram reconhecidos6. Como um novo substituto para as células maternas, as EVs têm sido aplicadas em imunoterapia e medicina regenerativa com estudos in vivo, que servem de base para a pesquisa pré-clínica em andamento e ensaios clínicos de acompanhamento7.
No entanto, atualmente, a maioria dos estudos sobre a eficácia do transplante de BM-MSCs e seus EVs derivados ainda permanece no nível de pequenos animais, o que não é suficiente para fornecer as evidências necessárias para a tradução clínica. Consequentemente, é extremamente urgente realizar pesquisas pré-clínicas sobre o transplante de BM-MSCs e seus EVs derivados no nível de animais de grande porte, como suínos.
Tem sido relatado que as CTMs estão presentes em números extremamente baixos na medula óssea, representando apenas 0,01% a 0,001% do total de células8. No entanto, a administração pré-clínica de BM-MSCs requer um grande número de células (≥107 por animal)9; a quantidade de EVs necessária é ainda maior, cuja dose média é de 0,25 mg de proteína por quilograma de peso corporal em suínos10. Para atingir esses grandes números, há uma necessidade urgente de um método seguro e eficaz para isolar e cultivar MSCs da medula óssea suína para alcançar sua expansão maciça in vitro e adquirir seus EVs com alta concentração de proteína posteriormente.
Até agora, existem vários métodos para isolar BM-MSCs e seus EVs derivados. Os métodos atuais para isolar BM-MSCs incluem plantio direto de células da medula óssea (BMCs)11, centrifugação com gradiente de densidade, classificação de rótulos moleculares de superfície celular e triagem por citometria de fluxo. Foi relatado que a classificação do rótulo molecular da superfície celular e a triagem por citometria de fluxo resultam em uma diminuição na taxa de adesão celular, um aumento na mortalidade em 24 horas e inibição da proliferação12, enquanto a cultura direta de BMCs pode resultar em um alto número de células hematopoiéticas mistas. Portanto, a centrifugação com gradiente de densidade agora é comumente usada para obter BM-MSCs. Os métodos atuais para isolar EVs de sobrenadantes celulares incluem ultracentrifugação, ultrafiltração, precipitação de polímero e exclusão de tamanho13. Em comparação com outros métodos, a ultracentrifugação tem a vantagem de baixo custo, facilidade de uso e compatibilidade com a preparação de grandes volumes sem pré-tratamento complicado, que tem sido o "padrão ouro" para a separação de EV14. No entanto, existe uma grande heterogeneidade em reagentes e técnicas em diferentes laboratórios durante o processo 3,15, o que pode ser enganoso para os leitores. Este artigo explica uma série de etapas sequenciais para isolar pBM-MSCs e EVs derivadas delas em detalhes, e os resultados de identificação subsequentes provam que o método é viável para obter pBM-MSCs e seus EVs para análise posterior em pesquisas pré-clínicas. Esperamos que este trabalho sistemático possa fornecer uma base metodológica para pesquisadores envolvidos na avaliação pré-clínica do transplante de pBM-MSCs e seus EVs derivados, para que os ensaios clínicos possam ser realizados o mais rápido possível.
Protocolo
De acordo com o Guia para o Cuidado e Uso de Animais de Laboratório publicado pelo National Institutes of Health, EUA, todos os procedimentos experimentais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC), Hospital Fuwai, Academia Chinesa de Ciências Médicas.
1. Preparação pré-operatória para os animais
- Obtenha miniporcos chineses machos adultos (30 ± 5 kg) com cerca de 12 meses de idade no Instituto de Zoologia da Academia Chinesa de Ciências e aloje-os nas instalações do Centro Experimental de Animais do Hospital Fuwai, com pelo menos 2 semanas de antecedência. Realize inspeções pré-operatórias, como exames de sangue de rotina, para garantir que os animais estejam saudáveis.
- Limpe e raspe a pele da região da coxa do minipig no dia anterior à operação. Para evitar aspiração, jejue o minipig por 12 h antes da extração da medula óssea.
2. Preparação para isolamento e cultivo celular
- Use Percoll (1.130 g/mL) para isolar células-tronco mesenquimais da medula óssea. Misturar a solução-mãe com PBS concentrado a 10x na proporção de 9:1 para obter um meio isotónico. Em seguida, misture o meio isotônico com PBS na proporção de 3:2 para adquirir solução de Percoll a 60% (1,077 g/mL), que pode ser usada como solução de separação final para isolar pBM-MSCs.
- Prepare o Meio de Dulbecco Modificado de Iscove (IMDM) com 10% de soro fetal bovino e 1,0% de penicilina-estreptomicina para obter um meio completo. Pré-aqueça o meio completo e o PBS em banho-maria a 37 °C para posterior cultivo celular.
3. Anestesia para os animais
- Administrar anestesia geral com cetamina (10 mg/kg) e xilazina (2 mg/kg) por via intramuscular. Realize a intubação endotraqueal rapidamente quando o minipig tiver respiração lenta e menos atividade dos membros e preserve a respiração espontânea para evitar falha na intubação.
- Realizar manutenção da anestesia por inalação de isoflurano a 2%, com oxigênio (1,5 L/min) como gás carreador. Durante a anestesia, monitore a frequência cardíaca, a respiração e a saturação de oxigênio no sangue do minipig em tempo real.
4. Extraindo medula óssea do minipig
- Coloque o minipig em uma posição lateral. Para garantir uma quantidade suficiente de medula óssea para a cultura de células subsequente, localize o ponto de punção da medula óssea no fêmur proximal do minipig (Figura 1). Desinfete e cubra a pele da área de punção antes da aplicação da operação.
- Aperte a pele ao redor do ponto de punção com a mão não dominante e perfure a agulha de biópsia da medula óssea verticalmente no ponto com a mão dominante. Ao sentir a agulha em contato com o osso cortical, gire suavemente a alça para a esquerda e para a direita para perfurar a agulha. Quando a agulha entra na cavidade da medula óssea, muitas vezes há uma sensação de perda de resistência.
- Depois que a punção estiver no lugar, retire a agulha central. Em seguida, coloque uma seringa estéril descartável de 50 mL na extremidade da agulha externa e enxágue a parede interna da seringa com heparina com antecedência.
- Extraia 20 mL de medula óssea lentamente e transfira-os para um tubo de centrífuga estéril de 50 mL com cuidado.
- Quando o procedimento estiver concluído, puxe a agulha e remova a cortina. Desinfete o local da punção e pressione por 20 min para hemostasia.
- Extubar o minipig depois de restaurar a respiração espontânea. Quando estiver totalmente acordado com o movimento livre dos membros, retorne o minipig à gaiola para continuar se alimentando.
5. Isolando células-tronco mesenquimais da medula óssea
- Adicione um volume igual de PBS pré-aquecido à medula óssea e misture-os bem. Em seguida, use uma pipeta estéril para transferir 20 mL da medula óssea diluída acima do nível de solução de gradiente de densidade de 60% em uma proporção de volume de 1:1 em um tubo de centrífuga estéril de 50 mL com cuidado.
- Centrifugar o tubo a 600 x g (aceleração (ACC) = 5, desaceleração (DEC) = 5) durante 20 min à temperatura ambiente (RT).
NOTA: Quatro fases são formadas no tubo após a centrifugação, incluindo a fase sérica, a fase celular mononuclear, a fase média do gradiente de densidade e a fase de precipitação de cima para baixo. A fase celular mononuclear é uma fina camada floculante entre o soro e o meio de gradiente de densidade. As células-tronco mesenquimais derivadas da medula óssea estão localizadas nesta fase. - Puxe a fase da célula mononuclear para um tubo de centrífuga estéril de 15 mL e lave duas vezes com PBS a 800 x g por 5 min.
- Ressuspenda as células lavadas em 2 mL de meio completo e plante as células ressuspensas em um frasco de cultura de2 células de 175 cm a uma densidade de 3-5 x 105 / mL.
NOTA: Todos os procedimentos acima para isolar células-tronco mesenquimais podem ser vistos na Figura 2.
6. Cultivo de células-tronco mesenquimais in vitro
- Incubar o balão de cultura a 37 °C numa atmosfera humidificada saturada de 5% de CO2. Agitar suavemente o frasco de cultura de 24 em 24 h para evitar o crescimento aderente das células estaminais hematopoiéticas precipitadas e observar o crescimento, a morfologia e a contaminação das células ao microscópio.
- Substitua o meio de cultura pela primeira vez após 3 dias e, em seguida, troque o meio a cada 2-3 dias. Quando as colônias de células atingirem 80% -90% de confluência, subcultive as células na proporção de 1:2.
7. Diferenciação adipogênica, osteogênica e condrogênica de pBM-MSCs
- Ensaio de diferenciação adipogênica
- Prepare os meios de diferenciação adipogénica A (Meio A) e B (Meio B) para BM-MSCs de acordo com as instruções do kit. Informações específicas sobre o kit podem ser encontradas na Tabela de Materiais.
- Adicione 1 mL de gelatina a 0,1% à placa de seis poços e agite suavemente para cobrir o fundo de cada poço uniformemente. Em seguida, coloque a placa de seis poços em uma bancada limpa ou incubadora de CO2 por pelo menos 30 min.
- Após 30 min, aspire a gelatina e adicione 2 mL de meio geral completo em cada poço. Em seguida, plante as pBM-MSCs na placa de seis poços a uma densidade celular de 2 x 104 células / cm2. Em seguida, incubar a placa a 37 °C em humidade saturada de 5% CO2.
- Quando as células atingirem 100% de confluência, remova o meio completo com cuidado e adicione 2 mL de Meio A a cada poço da placa. Após 3 dias, remova o meio A da placa e adicione 2 mL de meio B a cada poço.
- Após a manutenção por 1 dia, remova o meio B e substitua-o pelo meio A para indução. De acordo com a maneira de "Médio A por 3 dias, Médio B por 1 dia", use o Médio A e B sequencialmente para indução.
- Observe o estado da célula todos os dias durante o período. Se as células encolherem ou morrerem durante o processo de indução do meio A, substitua-o pelo meio B a tempo até que o estado da célula se recupere.
- Repita o processo de indução e manutenção e prepare-se para a coloração quando gotículas lipídicas suficientes de tamanho adequado forem observadas ao microscópio.
- Remova o meio para diferenciação adipogênica na placa de seis poços e lave com 1x PBS suavemente. Adicione 2 mL de solução de paraformaldeído a 4% em cada poço e fixe por 30 min em RT.
- Remova o fixador de paraformaldeído e lave com 1x PBS duas ou três vezes para garantir que o fixador seja removido completamente. Adicione 2 mL de corante Oil Red O em cada poço e core por 30 min em RT.
- Remova o corante Oil Red O e lave com 1x PBS duas ou três vezes. Adicione 2 mL de 1x PBS a cada poço e, em seguida, observe o efeito da diferenciação adipogênica ao microscópio.
- Ensaio de diferenciação osteogênica
- Prepare o meio completo para diferenciação osteogênica de acordo com as instruções do kit.
- Siga as etapas 7.1.2-7.1.3 para plantar e cultivar pBM-MSCs.
- Quando as células atingirem 70% de confluência, remova o meio completo geral com cuidado e adicione 2 mL de meio para diferenciação osteogênica a cada poço da placa.
- Mude para meio de diferenciação osteogênica fresco a cada 3 dias. Continue a indução por 2-4 semanas e prepare-se para corar com o corante vermelho de alizarina quando nódulos de cálcio óbvios aparecerem durante a osteogênese.
- Remova o meio para diferenciação osteogênica na placa de seis poços e lave com 1x PBS suavemente. Adicione 2 mL de solução de paraformaldeído a 4% em cada poço e fixe por 30 min em RT.
- Remova o fixador de paraformaldeído e lave com 1x PBS duas ou três vezes para garantir que o fixador seja bem limpo. Adicione 2 mL de corante vermelho de alizarina em cada poço e core por 10 min em RT.
- Remova o corante vermelho de alizarina e lave com 1x PBS duas ou três vezes. Adicione 2 mL de 1x PBS a cada poço e, em seguida, observe o efeito da diferenciação osteogênica ao microscópio.
- Ensaio de diferenciação condrogênica
- Prepare a pré-mistura para diferenciação condrogênica de acordo com as instruções do kit.
- Transfira 3-4 x 105 pBM-MSCs para um tubo de centrífuga estéril de 15 mL. Centrifugue a 250 x g durante 4 min a 20 °C.
- Remova o sobrenadante e adicione 0,5 mL de pré-mistura para ressuspender o pellet obtido por centrifugação na etapa anterior e, em seguida, centrifugue a 150 x g por 5 min a 20 ° C. Repita esta etapa para lavar as células novamente.
- Prepare o meio completo para a diferenciação condrogênica.
- Ressuspenda a célula obtida na etapa anterior com 0,5 mL de meio completo e centrifugue a 150 x g por 5 min a 20 °C.
- Desaperte a tampa do tubo da centrífuga para facilitar a troca gasosa. Coloque-o na vertical em uma incubadora a 37 °C, 5% de CO2 e umidade saturada.
- Quando as células parecerem agregar-se (geralmente após 24-48 h, dependendo da situação real), agite o fundo do tubo de centrifugação para fazer com que as bolas de cartilagem se desprendam do fundo e fiquem suspensas no meio.
- Mude para meio completo fresco para diferenciação condrogênica a cada 2-3 dias. Continue a indução até que bolas de cartilagem com um diâmetro de 1,5-2 mm sejam formadas no tubo e, em seguida, prepare as seções para coloração.
- Prepare seções de parafina de bolas de cartilagem de acordo com as etapas de rotina de experimentos patológicos. Adicione o corante azul Alicia às secções desparafinadas e manche a 37 °C durante 1 h.
- Enxágue a lâmina com água corrente por 5 min e, em seguida, observe o efeito de coloração do azul de Alicia ao microscópio após a secagem.
8. Identificação do fenótipo celular por citometria de fluxo
- Quando as colônias celulares atingirem 80% -90% de confluência nas passagens 3-5, remova o meio de cultura e lave as células duas vezes com PBS pré-aquecido. Em seguida, digerir as células com 3-4 ml de tripsina a 0,25% / EDTA e incubá-las a 37 °C numa atmosfera humidificada saturada de CO2 a 5% durante 2-3 min até que sejam separadas do fundo do frasco ao microscópio.
- Colha as células com um meio completo de 10 ml e transfira a suspensão celular para um tubo de centrifugação estéril de 15 ml. Centrifugar a suspensão da célula a 800 x g durante 5 min à RT. Rejeitar o sobrenadante e lavar as células com PBS a 4 °C.
- Ressuspenda as células a 10 ml com PBS a 4 °C. A suspensão celular é dividida em nove grupos com volume de 1 mL em cada microtubo de 1,5 mL, denominados controle negativo, controle isotípico FITC, controle isotipo PE, controle isotipo APC, grupo CD105, CD29, CD90, CD14 e CD45, respectivamente. Certifique-se de que o número de células em cada microtubo esteja entre 1 x 105 e 1 x 106.
- Centrifugue a suspensão a 800 x g por 5 min a 4 ° C e ressuspenda as células em cada microtubo com 100 μL de PBS a 4 ° C novamente. Exceto para o grupo de controle negativo, adicione 5 μL do controle de isotipo correspondente (FITC, PE e APC Mouse IgG1 kappa Isotype Control) e anticorpos (CD105, CD29, CD90, CD14 e CD45 Monoclonal Antibody) para citometria de fluxo para cada microtubo de acordo com a ordem na etapa 8.3. Misture delicadamente e incube por 1,5 h a 4 ° C no escuro.
- Adicione 1 mL de PBS a 4 ° C a cada microtubo e centrifugue a 300 x g por 10 min a 4 ° C. Rejeitar o sobrenadante e adicionar 200 μL de PBS a 4 °C para ressuspender as células.
- Teste pelo menos 10.000 células na citometria de fluxo após filtrar a suspensão celular16 e analise os dados usando o software de citometria de fluxo.
9. Isolação de vesículas extracelulares (EVs) derivadas de células-tronco mesenquimais da medula óssea suína
- Quando a confluência pBM-MSCs atingir 80%-90%, descarte o sobrenadante e lave as células com PBS 2x. Em seguida, adicione 25 mL de IMDM sem soro a cada frasco de cultura e continue a incubar a 37 ° C em uma atmosfera umidificada de 5% de CO2 por 48 h.
- Colete o sobrenadante celular (meio condicionado, CM) em um tubo de centrifugação de 50 mL e centrifugue a 300 x g por 10 min a 4 ° C para remover os detritos celulares.
- Recolher novamente o sobrenadante noutro tubo de centrifugação de 50 ml. Realize o isolamento dos EVs o mais rápido possível após a coleta do sobrenadante. Para armazenamento de longo prazo, armazene o sobrenadante na geladeira a -80 °C para evitar a perda de EVs.
- Centrifugar o sobrenadante no passo 9.3 a 2.000 x g durante 20 min a 4 °C.
- Transferir o sobrenadante para um tubo estéril utilizado para centrifugação de alta velocidade e centrifugar a 16.500 x g durante 30 min a 4 °C.
- Transferir novamente o sobrenadante para um tubo de ultracentrífuga e centrifugar a 120.000 x g durante pelo menos 70 min a 4 °C, com um rotor de ângulo fixo.
- Descarte o sobrenadante completamente. Adicionar 1 ml de PBS a 4 °C a cada tubo de ultracentrifugação e ressuspender a precipitação com uma micropipeta. Misturar a solução do mesmo grupo num tubo de ultracentrífuga e, em seguida, adicionar 4 °C PBS para fazer o volume superior a 3/4 do tubo.
- Centrifugar a 120.000 x g durante 60 min a 4 °C e remover o sobrenadante o máximo possível.
- Ressuspenda novamente o precipitante com PBS estéril e armazene os EVs em uma geladeira a -80 °C.
NOTA: A quantidade de PBS para ressuspensão pode ser determinada em 100 μL para a precipitação de cada dois frascos de cultura de 175 cm2 . Todas as etapas acima de isolamento de EVs são mostradas na Figura 3 sistematicamente.
10. Identificação de EVs por microscopia eletrônica de transmissão (TEM), análise de rastreamento de nanopartículas (NTA) e western blotting
- Colocar a amostra de EVs no gelo após descongelá-la em banho-maria a 25 °C e, em seguida, diluir até metade da concentração anterior com PBS para detecção de NTA17.
- Pipetar 10 μL da amostra na malha de cobre, deixá-la repousar durante 1 min e absorver o líquido flutuante com papel de filtro. Em seguida, adicione 10 μL de ácido fosfotúngstico à malha de cobre, deixe repousar por 1 min e absorva o excesso de líquido.
- Após secagem por alguns minutos em RT, realizar imagens de microscopia eletrônica sob a condição de tensão de aceleração de 100 KV18.
- Ressuspenda a amostra de EVs da etapa 9.9 no tampão de lise RIPA (25 mM Tris· HCl (pH 7,6), cloreto de sódio [NaCl] 150 mM, 1% de nonil fenoxipolietoxiletanol (NP-40), 1% de desoxicolato de sódio, 0,1% de dodecil sulfato de sódio (SDS), 1 mM de fluoreto de fenilmetanossulfonil (PMSF), 1x inibidor de protease) e detectar a expressão de marcadores específicos para EVs, como Alix, TSG101, CD81 e CD63 por western blotting19.
Resultados
Estabelecimento de células-tronco mesenquimais da medula óssea suína
Células-tronco mesenquimais derivadas da medula óssea suína foram isoladas e cultivadas in vitro com sucesso, e a morfologia das pBM-MSCs em diferentes dias pode ser vista na Figura 4. Na cultura primária de pBM-MSCs, a observação microscópica mostrou que a adesão celular ocorreu um dia após o plantio, e as células aderentes eram geralmente de formato redondo. As pBM-MSCs primárias geralmente permaneceram na fase quiescente por 3 dias após o plantio, e a proliferação celular começou no4º dia. A morfologia celular mudou de redonda para fusiforme, multilateral ou tipo estrela após a proliferação, e os núcleos são centrais, com nucléolos duplos em algumas células. As colônias celulares foram formadas 7-9 dias após o início da proliferação celular, e a confluência celular de 80% a 90% pôde ser alcançada em 12-14 dias. A observação microscópica mostrou que as células aderentes cresceram como colônias dispersas e foram dispostas em um padrão de redemoinho.
A proliferação celular foi significativamente acelerada após a passagem, e a confluência de 80% a 90% pôde ser alcançada em uma semana. A morfologia celular era homogênea em forma de fuso a partir da segunda passagem, assemelhando-se a fibroblastos, com uma proporção comprimento/largura de cerca de 2-3:1. Se as células fossem diferenciadas, elas poderiam parecer poligonais ou em forma de estrela. Após a passagem, as células não cresceram mais como colônias dispersas, mas de maneira uniforme e radial em um arranjo paralelo.
Identificação do potencial de diferenciação celular por coloração
No ensaio de diferenciação adipogênica, a coloração Oil Red O mostrou que gotículas lipídicas redondas laranja-avermelhadas de diferentes tamanhos apareceram ao redor do núcleo (Figura 5A); No ensaio de diferenciação osteogênica, a coloração com vermelho de alizarina mostrou nódulos vermelhos na superfície celular (Figura 5B), o que foi causado pela reação de cor com sais de cálcio depositados por osteoblastos diferenciados de pBM-MSCs. No ensaio de diferenciação condrogênica, a coloração com azul de Alicia mostrou que todo o corte do tecido era azul (Figura 5C), o que foi causado pela coloração de mucopolissacarídeo endoácido em bolas de cartilagem.
Identificação do fenótipo celular por citometria de fluxo
Ensaios dos marcadores de superfície celular foram realizados para criar um fenótipo de pBM-MSCs. A partir dos resultados da citometria de fluxo (Figura 6), três marcadores positivos, como CD105, CD29 e CD90, foram expressos significativamente na superfície das pBM-MSCs, representando 96,5%, 99,8% e 92%, respectivamente (Figura 6A-C). No entanto, a expressão de CD14 e CD45 foi negativa (Figura 6D,E). Enquanto isso, os resultados dos controles de isotipo correspondentes foram todos negativos, o que já foi sobreposto na figura, descartando a possibilidade de ligação não específica de anticorpos.
Identificação de EVs derivados de pBM-MSCs por NTA, TEM e western blotting
O resultado do NTA mostrou que o tamanho médio das partículas era de 126,9 nm, que estava dentro da faixa de EVs; além disso, a concentração original da amostra de EVs foi de 1,5 x 1010 partículas/mL, e o valor exato atribuído ao tamanho pode ser encontrado na Figura 7A. O diagrama de trajetória das partículas é mostrado na Figura 7B, ilustrando que as partículas estavam em movimento browniano irregular. Além disso, a vesícula discóide, como a estrutura clássica das EVs, pode ser vista claramente ao microscópio eletrônico em ampliações de 50.000x (Figura 7C). Além disso, a expressão de marcadores específicos para EVs como Alix, TSG101, CD81 e CD63 foi detectada na amostra por western blotting (Figura 7D).
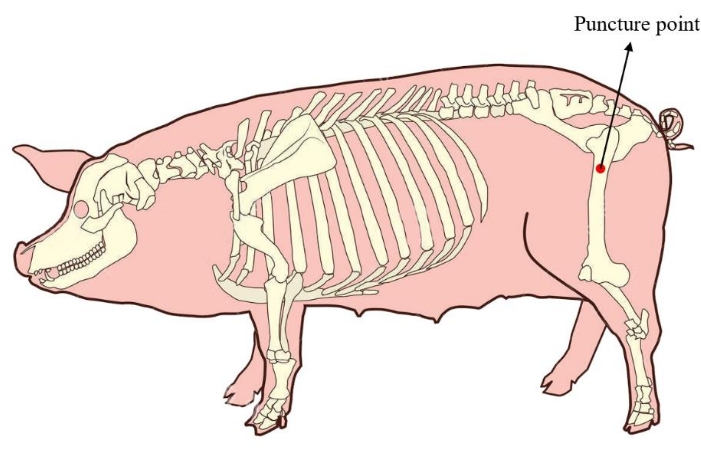
Figura 1: Ponto de punção da medula óssea do minipig. A área vermelha mostra o ponto de punção da extração da medula óssea, localizado no fêmur proximal do minipig. Clique aqui para ver uma versão maior desta figura.
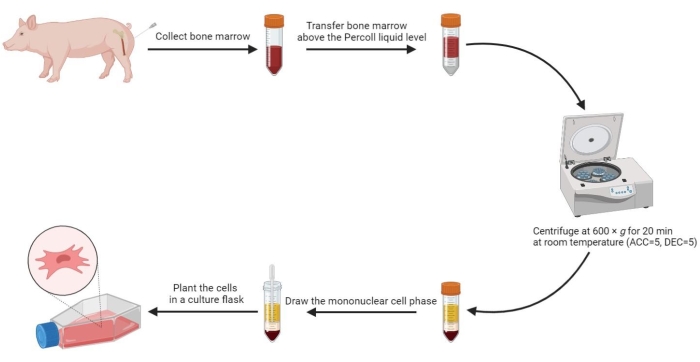
Figura 2: Isolando células-tronco mesenquimais da medula óssea suína. O processo de isolamento de células-tronco mesenquimais da medula óssea suína é mostrado no fluxograma, e quatro fases líquidas são ilustradas claramente após a centrifugação com gradiente de densidade. Clique aqui para ver uma versão maior desta figura.
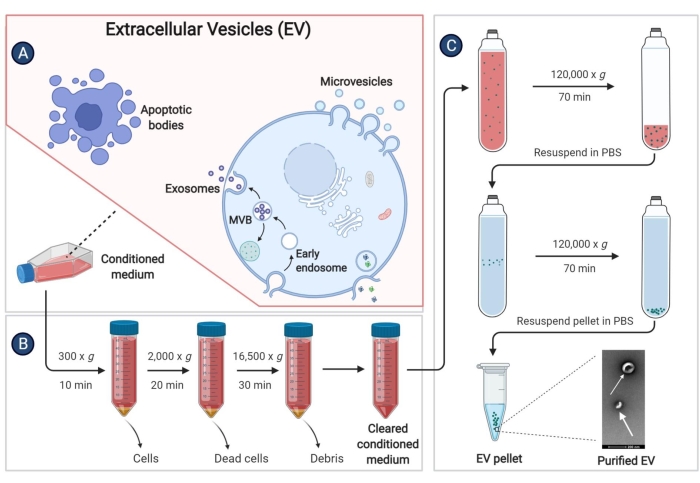
Figura 3: Isolando EVs derivados de pBM-MSCs. O diagrama esquemático demonstra etapas específicas para isolar EVs do meio condicionado por ultracentrifugação. Clique aqui para ver uma versão maior desta figura.

Figura 4: Características morfológicas das pBM-MSCs em dias diferentes. Características morfológicas semelhantes das pBM-MSCs podem ser vistas no3º,5º, 7º e9º dia após o plantio sob o campo microscópico 100x, e colônias de células foram formadas no9º dia. Clique aqui para ver uma versão maior desta figura.

Figura 5. Identificação do potencial de diferenciação de pBM-MSCs por coloração. (A) Ensaio de diferenciação adipogênica, (B) osteogênica e (C) condrogênica de pBM-MSCs, respectivamente. O potencial de diferenciação das pBM-MSCs pode ser identificado por esses resultados de coloração. Clique aqui para ver uma versão maior desta figura.
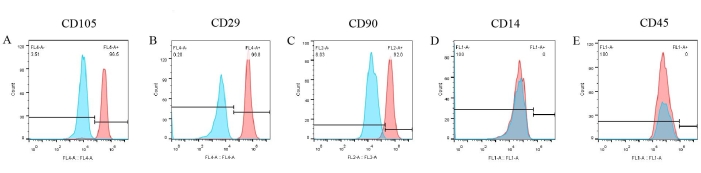
Figura 6: Resultados de identificação de pBM-MSCs por citometria de fluxo. CD105, CD29 e CD90 são expressos significativamente na superfície das pBM-MSCs, representando 96,5%, 99,8% e 92,0%, respectivamente, enquanto a expressão de CD14 e CD45 é negativa. Clique aqui para ver uma versão maior desta figura.
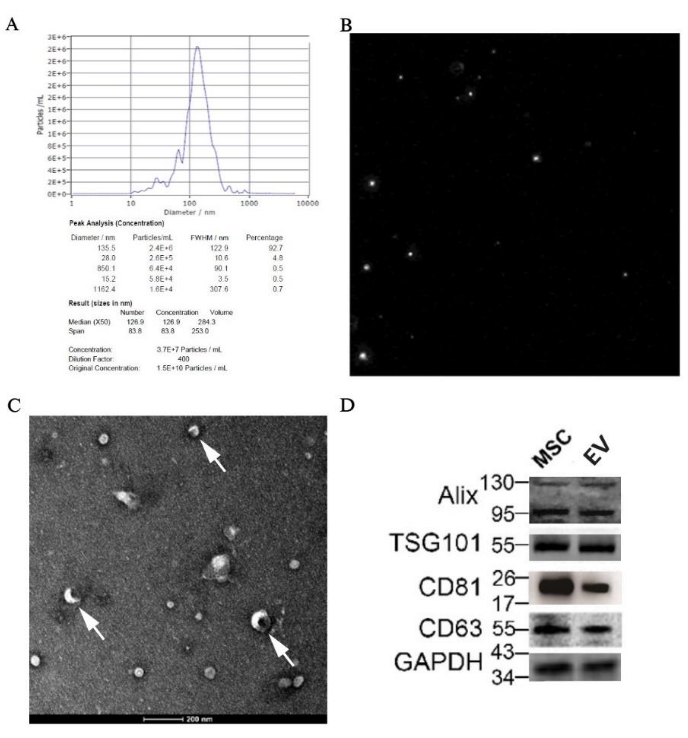
Figura 7: Resultados de identificação de EVs derivados de pBM-MSCs por morfologia e biologia molecular. (A) Resultado NTA de EVs derivados de pBM-MSCs, com gráfico de distribuição de tamanho de partícula e (B) diagrama de trajetória de partículas, respectivamente; (C) Imagem TEM tirada com ampliações de 50.000x, e a seta branca mostra a estrutura clássica das vesículas discóides. (D) Expressão de marcadores específicos para EVs por western blotting. Clique aqui para ver uma versão maior desta figura.
Discussão
O ponto de punção tradicional da medula óssea de minipigs foi posicionado na crista ilíaca20. Embora seja fácil de localizar, a quantidade de extração de medula óssea é limitadaa 21 (apenas cerca de 5 mL em geral), por isso é difícil atender à necessidade de um grande número de expansões in vitro para o transplante in vivo. Nesse método, reposicionamos o ponto de punção da medula óssea para o fêmur proximal, e pelo menos 20 mL de medula óssea podem ser extraídos desse local, garantindo uma quantidade suficiente de pBM-MSCs para posterior cultura celular.
As duas principais soluções de separação usadas para isolar BM-MSCs por centrifugação com gradiente de densidade são Percoll e Ficoll. Percoll é composto de polivinilpirrolidona siliconizada (PVP), que é um novo agente de separação centrífuga de gradiente de densidade não tóxico e não irritante. A baixa constante de difusão de Percoll resulta em um gradiente de densidade relativamente estável; Portanto, a separação celular satisfatória geralmente pode ser alcançada em dezenas de minutos com baixas forças centrífugas (200-1000 x g). O método para isolamento de pBM-MSCs usando Ficoll foi relatado anteriormente21. Comparado com o Ficoll, o Percoll tem sido gradualmente utilizado devido às suas vantagens de fácil isoperabilidade, baixa viscosidade, não toxicidade e não causar agregação celular, o que pode complementar os métodos existentes para isolar pBM-MSCs.
Ao isolar e cultivar pBM-MSCs, algumas etapas críticas não podem ser ignoradas. Em primeiro lugar, a estratificação bem-sucedida de diferentes fases líquidas após a centrifugação com gradiente de densidade é a chave para isolar pBM-MSCs purificadas. As BM-MSCs, como um tipo de células mononucleares da medula óssea (BM-MNCs), têm uma gravidade específica semelhante à dos linfócitos e monócitos, em torno de 1,075 g/mL. A densidade original de Percoll é de 1,130 g/mL, e para obter com sucesso a camada celular contendo BM-MSCs após centrifugação com gradiente de densidade, a solução separadora de gradiente de densidade isotônica a 60% (1,077 g/mL) precisa ser configurada antecipadamente de acordo com a relação densidade-concentração de Percoll22. Além disso, as condições de centrifugação adequadas também contribuem para uma estratificação bem-sucedida. Considerando a baixa constante de difusão de Percoll, centrifugamos a medula óssea extraída a 600 x g por 20 min em níveis relativamente baixos de aceleração/desaceleração (ACC = 5, DEC = 5), o que obteve um bom efeito de estratificação. Em segundo lugar, a densidade de plantio apropriada também é essencial para a cultura de células. Para adquirir um número suficiente de MSCs (geralmente mais de 107 por animal9) para transplante subsequente, usamos frascos de cultura de 175 cm2 para cultura de células. Em um estudo anterior20, as BM-MNCs obtidas foram geralmente plantadas em frascos de cultura para cultivo na densidade de 5 x 105/cm2. Foi relatado que, após centrifugação com gradiente de densidade, 2-3 x 107 BM-MNCs podem ser obtidos para cada 5 mL de medula óssea suína23. Portanto, neste protocolo, recomendamos plantar BM-MNCs totais isolados de cada 20 mL de medula óssea suína em um frasco de cultura de 175 cm2 para uma densidade adequada. Em terceiro lugar, as impurezas devem ser evitadas durante o isolamento e cultura de pBM-MSCs. Ao desenhar a fase da célula mononuclear, a pipeta não deve ser inserida na fase de Percoll para não se misturar com o líquido de separação. Além disso, após 24 h de plantio celular, o frasco de cultura deve ser agitado suavemente para reduzir a aderência dos glóbulos vermelhos.
Durante o processo de ultracentrifugação, altos níveis de contaminação por agregados proteicos e lipoproteínas por esse método inevitavelmente comprometem a quantificação e a análise funcional das EVs14. A fim de reduzir ao máximo a contaminação no processo, deve reter-se sempre 5 mm de profundidade do líquido no fundo durante a transferência do sobrenadante antes da fase de ultracentrifugação. Enquanto isso, após a primeira ultracentrifugação, ressuspender o pellet em PBS estéril e, em seguida, realizar a ultracentrifugação novamente pode efetivamente reduzir a contaminação por lipoproteínas.
Embora a centrifugação e a ultracentrifugação com gradiente de densidade tenham sido amplamente utilizadas no isolamento de BM-MSCs e seus EVs derivados, respectivamente, essas duas técnicas também têm suas próprias limitações. Por um lado, a técnica de Percoll é demorada e complicada, e a produção de amostras de concentrado de MO por meio de um dispositivo de concentração de células à beira do leito foi relatada como um método alternativo para isolar MSCs24. Por outro lado, o método de ultracentrifugação requer não apenas técnicos altamente treinados, mas também equipamentos caros; portanto, a aplicação combinada de duas ou mais técnicas pode apresentar uma estratégia razoável para um isolamento mais eficiente das EVs25. Além disso, a identificação de pBM-MSCs e seus EVs derivados também precisa ser melhorada. Por exemplo, de acordo com os critérios internacionais para definição deCTM26, a expressão de alguns marcadores positivos ou negativos, como CD73, CD34 e HLA-DR, ainda está ausente dos resultados de identificação dos fenótipos de CTMs por citometria de fluxo neste estudo. Além disso, embora tenham sido tomadas medidas para evitar a contaminação durante o processo de isolamento de VEs, devido às limitações de nosso laboratório, não podemos avaliar a pureza da amostra de EVs para ajudar a melhorar o trabalho de acompanhamento.
Este estudo combina métodos para o isolamento de pBM-MSCs e seus EVs derivados sequencialmente, comprovados pelos resultados de identificação subsequentes sistematicamente. Em particular, destacamos as principais operações nesta série de etapas, explicando algumas condições experimentais específicas que podem resolver o problema da heterogeneidade existente em diferentes laboratórios durante este processo até certo ponto. Este trabalho metódico pode ser amplamente utilizado em estudos pré-clínicos sobre a eficácia do transplante de BM-MSCs e seus EVs derivados, o que poderia fornecer uma base experimental com um nível suficiente para pesquisa clínica.
Divulgações
Todos os autores não têm conflitos de interesse a declarar.
Agradecimentos
Agradecemos a Yang Jianzhong e Wang Xuemin por suas contribuições para a operação de extração de medula óssea. Este trabalho foi apoiado por doações do CAMS Innovation Fund for Medical Sciences (CIFMS) [número de concessão 2016-I2M-1-009], Fundação Nacional de Ciências Naturais da China (no: 82070307; no: 81874461).
Materiais
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
Referências
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados