Method Article
猪骨髓间充质干细胞及其衍生的细胞外囊泡的分离和鉴定
摘要
本文详细阐述了一种分离和鉴定猪骨髓间充质干细胞 (pBM-MSCs) 和源自它们的细胞外囊泡 (EVs) 的方法,为 BM-MSCs 及其衍生的 EVs 移植效果的临床前评价提供了方法学基础。
摘要
随着干细胞疗法在转化研究和再生医学中的发展,骨髓间充质干细胞 (BM-MSCs) 作为一种多能干细胞,因其即时可用和经过验证的安全性而受到青睐。据报道,BM-MSCs 移植对修复各种疾病中的受伤组织有很大的好处,这可能与 通过 旁分泌机制调节免疫和炎症反应有关。细胞外囊泡 (EV) 具有双层脂质膜结构,被认为是干细胞旁分泌作用的主要介质。EV 因其在细胞通讯和表观遗传调控中的关键作用而得到认可,已经在 体内 应用于免疫治疗。然而,与其母细胞类似,大多数关于 EVs 移植疗效的研究仍停留在小动物水平,不足以提供临床转化的重要证据。在这里,我们首先使用密度梯度离心法从猪骨髓中分离骨髓细胞 (BMC),然后通过细胞培养得到猪 BM-MSCs (pBM-MSCs),通过显微镜下观察的结果、诱导分化测定和流式细胞术进行鉴定。此外,我们通过超速离心分离细胞上清液中 pBM-MSCs 衍生的 EV,通过透射电子显微镜 (TEM) 、纳米颗粒跟踪分析 (NTA) 和蛋白质印迹技术成功证明。总体而言,pBM-MSCs 及其衍生的 EV 可以通过以下方案有效分离和鉴定,这些方案可能广泛用于 BM-MSCs 及其衍生的 EVs 移植效果的临床前研究。
引言
在过去的 10 年里,干细胞疗法有望为患有各种疾病和伤害的患者带来巨大益处,例如创伤、呼吸系统和心血管疾病。随着该领域的进步,骨髓间充质干细胞 (BM-MSC) 因其可及性和很少的伦理争议而逐渐受到人们的青睐1,与其他细胞类型不同,这被认为是临床研究的黄金标准2。基于 BM-MSC 的疗法也对越来越多的研究人员具有吸引力,因为它们具有调节免疫和炎症反应以及 通过 分化或旁分泌机制修复受损组织的独特能力3。
细胞外囊泡 (EV),正如国际细胞外囊泡学会 (ISEV) 认可的那样4,是指从细胞中自然释放的具有脂质双层结构的总颗粒。随着最近在不同细胞类型的 EV 中发现蛋白质、脂质和遗传物质(例如 miRNA、mRNA、DNA 分子以及长链非编码 RNA)等各种内容物5,它们在细胞通讯和表观遗传调控中的关键作用已得到认可6。作为母体细胞的新型替代品,EV 已应用于免疫疗法和再生医学,并进行了 体内研究,为正在进行的临床前研究和后续临床试验奠定了基础7。
然而,目前关于 BM-MSCs 及其衍生的 EVs 移植疗效的研究大多仍停留在小动物水平,不足以提供临床转化所需的证据。因此,在猪等大型动物水平开展 BM-MSCs 及其衍生的 EVs 移植的临床前研究极为紧迫。
据报道,MSC 在骨髓中的数量极少,仅占总细胞的 0.01% 至 0.001%8。然而,BM-MSC 的临床前给药需要大量细胞(≥每只动物 7 个)10 个)9;所需的 EV 量甚至更大,猪的中位剂量为每公斤体重 0.25 毫克蛋白质10。为了实现这些大量数据,迫切需要一种安全有效的方法来从猪骨髓中分离和培养 MSC,以实现其在体外的大规模扩增,并随后获得具有高蛋白浓度的 EV。
到目前为止,有多种方法可以分离 BM-MSC 及其衍生的 EV。目前分离 BM-MSC 的方法包括直接种植骨髓细胞 (BMC)11、密度梯度离心、细胞表面分子标记分选和流式细胞术筛选。据报道,细胞表面分子标记分选和流式细胞术筛选导致细胞粘附率降低,24 h 死亡率增加,增殖抑制12,而 BMCs 的直接培养可导致大量混合造血细胞。因此,密度梯度离心现在通常用于获得 BM-MSC。目前从细胞上清液中分离 EV 的方法包括超速离心、超滤、聚合物沉淀和尺寸排阻13。与其他方法相比,超速离心法具有成本低、易于使用、无需复杂预处理即可与大体积制备兼容等优点,这一直是 EV 分离的“金标准”14。然而,在此过程中,不同实验室的试剂和技术存在很大的异质性 3,15,这可能会误导读者。本文详细介绍了分离 pBM-MSCs 和源自它们的 EVs 的一系列连续步骤,随后的鉴定结果证明,该方法获得 pBM-MSCs 及其 EVs 用于临床前研究的进一步分析是可行的。我们希望这项系统性工作可以为从事 pBM-MSCs 及其衍生 EVs 移植临床前评价的研究人员提供方法学基础,以便尽早进行临床试验。
研究方案
根据美国国立卫生研究院出版的《实验动物护理和使用指南》,所有实验程序均已获得中国医学科学院阜外医院机构动物护理和使用委员会 (IACUC) 的批准。
1. 动物的术前准备
- 从中国科学院动物研究所获得大约 12 个月大的成年雄性中国迷你猪(30 ± 5 公斤),并至少提前 2 周将它们安置在抚外医院动物实验中心的设施中。进行术前检查,例如血常规检查,以确保动物健康。
- 手术前一天清洁并剃除迷你猪大腿区域的皮肤。为避免误吸,在骨髓提取前将迷你猪禁食 12 小时。
2. 细胞分离和培养的准备工作
- 使用 Percoll (1.130 g/mL) 从骨髓中分离间充质干细胞。将储备液与 10x 浓 PBS 以 9:1 的比例混合,以获得等渗培养基。然后将等渗培养基与 PBS 以 3:2 的比例混合,得到 60% Percoll 溶液 (1.077 g/mL),可用作分离 pBM-MSC 的最终分离溶液。
- 用 10% 胎牛血清和 1.0% 青霉素-链霉素制备 Iscove 改良的 Dulbecco 培养基 (IMDM),以获得完全培养基。在 37 °C 水浴中预热完全培养基和 PBS,用于后续细胞培养。
3. 动物麻醉
- 肌肉注射氯胺酮 (10 mg/kg) 和甲苯噻嗪 (2 mg/kg) 进行全身麻醉。当小型猪呼吸缓慢且肢体活动较少时,应迅速进行气管插管,并保持自主呼吸以防止插管失败。
- 通过吸入 2% 异氟醚,以氧气 (1.5 L/min) 为载气来维持麻醉。在麻醉期间,实时监测迷你猪的心率、呼吸和血氧饱和度。
4. 从小型猪中提取骨髓
- 将 minipig 放在侧面位置。为确保有足够的骨髓用于后续的细胞培养,请将骨髓穿刺点定位在小型猪的股骨近端(图 1)。手术前对穿刺部位的皮肤进行消毒和覆盖。
- 用非惯用手收紧穿刺点周围的皮肤,用惯用手垂直刺穿骨髓活检针的穿刺点。当感觉针头与皮质骨接触时,轻轻左右旋转手柄以钻孔。当针头进入骨髓腔时,经常有失去阻力的感觉。
- 穿刺到位后,拔出空芯针。然后将一次性无菌 50 mL 注射器连接到外针头末端,并提前用肝素冲洗注射器内壁。
- 缓慢提取 20 mL 骨髓,并小心地将它们转移到无菌的 50 mL 离心管中。
- 手术完成后,拔出针头并取下窗帘。对穿刺部位进行消毒并按压 20 分钟以止血。
- 恢复自主呼吸后拔管迷你猪。当它完全清醒并且四肢可以自由活动时,将迷你猪放回笼子继续喂食。
5. 从骨髓中分离间充质干细胞
- 向骨髓中加入等体积的预热 PBS 并充分混合。然后使用无菌移液器以 1:1 的体积比小心地将 20 mL 稀释的骨髓转移到无菌 50 mL 离心管中,浓度高于 60% 密度梯度溶液水平。
- 在室温 (RT) 下以 600 x g (加速度 (ACC) = 5,减速 (DEC) = 5)离心管 20 分钟。
注:离心后在管中形成四个相,从上到下包括血清期、单核细胞期、密度梯度培养基期和沉淀期。单核细胞相是血清和密度梯度介质之间的薄絮凝层。源自骨髓的间充质干细胞位于此阶段。 - 将单核细胞相吸入无菌的 15 mL 离心管中,并用 800 x g 的 PBS 洗涤两次,每次 5 分钟。
- 将洗涤后的细胞重悬于 2 mL 完全培养基中,并将重悬的细胞以 3-5 x 105/mL 的密度种植在 175 cm2 细胞培养瓶中。
注意:上述所有分离间充质干细胞的程序都可以在 图 2 中看到。
6. 体外培养间充质干细胞
- 将培养瓶在 37 °C 下在 5% CO2 的饱和加湿气氛中孵育。每 24 小时轻轻摇动培养瓶,以防止沉淀的造血干细胞粘附生长,并在显微镜下观察细胞生长、形态和污染。
- 3 天后首次更换培养基,然后每 2-3 天更换一次培养基。当细胞集落达到 80%-90% 汇合时,以 1:2 的比例传代培养细胞。
7. pBM-MSC 的成脂、成骨和成软骨分化
- 成脂分化测定
- 根据试剂盒说明为 BM-MSC 制备成脂分化培养基 A(培养基 A)和 B(培养基 B)。有关该套件的具体信息,请参阅 材料表。
- 向六孔板中加入 1 mL 0.1% 明胶并轻轻摇晃,使其均匀覆盖每个孔的底部。然后将六孔板置于干净的工作台或 CO2 培养箱中至少 30 分钟。
- 30 分钟后,吸出明胶并向每个孔中加入 2 mL 通用完全培养基。然后将 pBM-MSC 以 2 x 104 个细胞/cm2 的细胞密度种植在六孔板中。之后,将板在 37 °C 和 5% CO2 的饱和湿度下孵育。
- 当细胞达到 100% 汇合时,小心去除完全培养基,并向板的每个孔中加入 2 mL 培养基 A。3 天后,从板中取出培养基 A,并向每个孔中加入 2 mL 培养基 B。
- 维持 1 天后,取出培养基 B 并用培养基 A 替换以进行诱导。按照“培养基 A 3 天,培养基 B 1 天”的方式,依次使用培养基 A 和 B 进行诱导。
- 在此期间每天观察细胞状态。如果在培养基 A 的诱导过程中细胞收缩或死亡,请及时用培养基 B 替换,直到细胞状态恢复。
- 重复诱导和维持过程,并在显微镜下观察到足够大小合适的脂滴时准备染色。
- 在六孔板中取出用于成脂分化的培养基,并用 1x PBS 轻轻洗涤。向每个孔中加入 2 mL 4% 多聚甲醛溶液,并在室温下固定 30 分钟。
- 去除多聚甲醛固定剂,用 1x PBS 洗涤 2 或 3 次,以确保固定剂被彻底去除。向每个孔中加入 2 mL 油红 O 染料,并在室温下染色 30 分钟。
- 去除油红 O 染料,用 1x PBS 洗涤两到三次。向每个孔中加入 2 mL 的 1x PBS,然后在显微镜下观察成脂分化的效果。
- 成骨分化试验
- 根据试剂盒说明制备用于成骨分化的完全培养基。
- 按照步骤 7.1.2-7.1.3 种植和培养 pBM-MSCs。
- 当细胞达到 70% 汇合时,小心取出一般完全培养基,并向板的每个孔中加入 2 mL 用于成骨分化的培养基。
- 每 3 天更换一次新鲜的成骨分化培养基。继续诱导 2-4 周,当成骨过程中出现明显的钙结节时,准备用茜素红染料染色。
- 在六孔板中取出用于成骨分化的培养基,并用 1x PBS 轻轻洗涤。向每个孔中加入 2 mL 4% 多聚甲醛溶液,并在室温下固定 30 分钟。
- 去除多聚甲醛固定剂,用 1x PBS 洗涤 2 或 3 次,以确保固定剂彻底清洁。向每个孔中加入 2 mL 茜素红染料,并在室温下染色 10 分钟。
- 去除茜素红染料,用 1x PBS 洗涤两到三次。向每个孔中加入 2 mL 的 1x PBS,然后在显微镜下观察成骨分化的效果。
- 软骨形成分化试验
- 根据试剂盒说明制备用于软骨形成分化的预混料。
- 将 3-4 x 10个 5 pBM-MSC 转移到无菌的 15 mL 离心管中。在 20 °C 下以 250 x g 离心 4 分钟。
- 去除上清液,加入 0.5 mL 预混液,重悬上一步离心获得的沉淀,然后在 20 °C 下以 150 x g 离心 5 分钟。 重复此步骤以再次洗涤细胞。
- 准备用于软骨形成分化的完全培养基。
- 用 0.5 mL 完全培养基重悬上一步获得的细胞,并在 20 °C 下以 150 x g 离心 5 分钟。
- 拧开离心管的盖子,以便于气体交换。将其直立置于 37 °C、5% CO2 和饱和湿度的培养箱中。
- 当细胞出现聚集时(通常在 24-48 小时后,视实际情况而定),轻弹离心管底部,使软骨球从底部分离并悬浮在培养基中。
- 每 2-3 天更换为新鲜的完全培养基进行软骨形成分化。继续诱导,直到在管中形成直径为 1.5-2 毫米的软骨球,然后准备染色切片。
- 根据病理实验的常规步骤准备软骨球的石蜡切片。将 Alicia blue 染料加入脱蜡切片中,并在 37 °C 下染色 1 小时。
- 用流水冲洗载玻片 5 分钟,然后干燥后在显微镜下观察 Alicia blue 的染色效果。
8. 通过流式细胞术鉴定细胞表型
- 当细胞集落在第 3-5 次传代时达到 80%-90% 汇合时,去除培养基并用预热的 PBS 洗涤细胞两次。然后用 3-4 mL 的 0.25% 胰蛋白酶/EDTA 消化细胞,并在 37 °C 下在 5% CO2 的饱和潮湿气氛中孵育 2-3 分钟,直到它们在显微镜下从烧瓶底部分离。
- 用 10 mL 完全培养基收获细胞,并将细胞悬液转移到无菌 15 mL 离心管中。在 RT 下以 800 x g 离心细胞悬液 5 分钟。弃去上清液并用 4 °C PBS 洗涤细胞。
- 用 4 °C PBS 将细胞重悬至 10 mL。将细胞悬液分为 9 组,每组 1.5 mL 微管中体积为 1 mL,分别命名为阴性对照、FITC 同种型对照、PE 同种型对照、APC 同种型对照、CD105、CD29、CD90、CD14 和 CD45 组。确保每个微管中的细胞数在 1 x 105 和 1 x 106 之间。
- 在 4 °C 下以 800 x g 离心悬浮液 5 分钟,然后再次用 100 μL 4 °C PBS 重悬每个微管中的细胞。除阴性对照组外,根据步骤 8.3 中的顺序,向每个微管中加入 5 μL 相应的同种型对照(FITC、PE 和 APC 小鼠 IgG1 kappa 同种型对照)和抗体(CD105、CD29、CD90、CD14 和 CD45 单克隆抗体)用于流式细胞术。轻轻混合并在 4 °C 下避光孵育 1.5 小时。
- 向每个微管中加入 1 mL 4 °C PBS,并在 4 °C 下以 300 x g 离心 10 分钟。 弃去上清液,加入 200 μL 4 °C PBS 以重悬细胞。
- 过滤细胞悬液16 后,在流式细胞术上测试至少 10,000 个细胞,并使用流式细胞术软件分析数据。
9. 分离源自猪骨髓间充质干细胞的细胞外囊泡 (EV)
- 当 pBM-MSCs 汇合度达到 80%-90% 时,弃去上清液,用 PBS 2x 洗涤细胞。然后向每个培养瓶中加入 25 mL 无血清 IMDM,并在 37 °C 下在 5% CO2 的潮湿气氛中继续孵育 48 小时。
- 将细胞上清液(条件培养基,CM)收集到 50 mL 离心管中,并在 4 °C 下以 300 x g 离心 10 分钟以去除细胞碎片。
- 再次将上清液收集到另一个 50 mL 离心管中。收集上清液后尽快进行 EV 的分离。如需长期储存,请将上清液储存在 -80 °C 的冰箱中,以防止 EV 的损失。
- 在步骤 9.3 中,在 4 °C 下以 2,000 x g 离心 20 分钟。
- 将上清液转移到用于高速离心机的无菌管中,并在 4 °C 下以 16,500 x g 离心 30 分钟。
- 将上清液再次转移至超速离心管中,并在 4 °C 下以 120,000 x g 离心至少 70 分钟,并带有固定角转子。
- 完全弃去上清液。向每个超速离心管中加入 1 mL 4 °C PBS,并用微量移液器重悬沉淀。将同一组的溶液混合到超速离心管中,然后加入4°C PBS,使体积超过管的3/4。
- 在 4 °C 下以 120,000 x g 离心 60 分钟,并尽可能多地去除上清液。
- 再次用无菌 PBS 重悬沉淀物,并将 EV 储存在 -80 °C 冰箱中。
注:用于重悬的 PBS 量可确定为每两个 175 cm2 培养瓶中沉淀 100 μL。上述隔离 EV 的所有步骤都系统地显示在 图 3 中。
10. 通过透射电子显微镜 (TEM)、纳米颗粒跟踪分析 (NTA) 和蛋白质印迹鉴定 EV
- 将 EVs 样品在 25 °C 水浴中解冻后置于冰上,然后用 PBS 稀释至先前浓度的一半,用于 NTA 检测17。
- 在铜网上吸取 10 μL 样品,静置 1 分钟,然后用滤纸吸收漂浮液。然后,向铜网中加入 10 μL 磷钨酸,静置 1 分钟,并吸收多余的液体。
- 在 RT 下干燥几分钟后,在 100 KV 加速电压18 的条件下进行电子显微镜成像。
- 将步骤 9.9 中的 EVs 样品重悬于 RIPA 裂解缓冲液 (25 mM Tris·HCl (pH 7.6)、150 mM 氯化钠 [NaCl]、1% 壬基苯氧基聚乙氧基乙醇 (NP-40)、1% 脱氧胆酸钠、0.1% 十二烷基硫酸钠 (SDS)、1 mM 苯基甲磺酰氟 (PMSF)、1x 蛋白酶抑制剂),并通过蛋白质印迹检测 EV 特异性标志物的表达,如 Alix、TSG101、CD81 和 CD6319。
结果
猪骨髓间充质干细胞的建立
来源于猪骨髓的间充质干细胞在 体外成功分离和培养,不同日子的 pBM-MSCs 形态如图 4 所示。在 pBM-MSCs 的原代培养中,显微镜观察显示细胞贴壁发生在种植后 1 天,贴壁细胞通常呈圆形。原代 pBM-MSCs 在种植后一般保持静止期 3 d,细胞增殖在第 4 天开始。增殖后细胞形态由圆形变为梭形、多侧形或星形,细胞核位于中央,部分细胞呈双核仁。细胞增殖开始后 7-9 天形成细胞集落,12-14 天可达到 80%-90% 的细胞汇合。显微镜观察表明,贴壁细胞以分散的菌落形式生长,并以漩涡状排列。
传代后细胞增殖显著加速,一周内可达 80%-90% 汇合。从第二次传代开始,细胞形态呈均匀的纺锤形,类似于成纤维细胞,长宽比约为 2-3:1。如果细胞分化,它们可能呈多边形或星形。传代后,细胞不再以分散的菌落形式生长,而是以平行排列均匀地呈放射状生长。
通过染色鉴定细胞分化电位
在成脂分化测定中,油红 O 染色显示细胞核周围出现不同大小的圆形橙红色脂滴(图 5A);在成骨分化测定中,茜素红染色显示细胞表面有红色结节(图 5B),这是由与 pBM-MSC 分化的成骨细胞沉积的钙盐发生显色反应引起的。在软骨形成分化测定中,Alicia 蓝染色显示整个组织切片呈蓝色(图 5C),这是由软骨球中内酸性粘多糖染色引起的。
通过流式细胞术鉴定细胞表型
对细胞表面标志物进行检测以创建 pBM-MSC 的表型。从流式细胞术结果(图 6)来看,CD105、CD29 和 CD90 这三种阳性标志物在 pBM-MSCs 表面显著表达,分别占 96.5%、99.8% 和 92%(图 6A-C)。然而,CD14 和 CD45 的表达是阴性的 (图 6D,E)。同时,相应的同种型对照结果均为阴性,这在图中已经被覆盖,排除了抗体非特异性结合的可能性。
通过 NTA、TEM 和蛋白质印迹鉴定源自 pBM-MSC 的 EV
NTA 结果显示,中位粒径为 126.9 nm,在 EVs 范围内;此外,EVS 样品的原始浓度为 1.5 x 1010 颗粒/mL,分配给大小的准确值可在 图 7A 中找到。粒子轨迹图如图 7B 所示,说明粒子处于不规则的布朗运动中。此外,盘状囊泡作为 EV 的经典结构,在放大倍数为 50,000 倍的电子显微镜下可以清楚地看到(图 7C)。此外,通过蛋白质印迹在样品中检测 EV 特异性标志物如 Alix、TSG101、CD81 和 CD63 的表达(图 7D)。
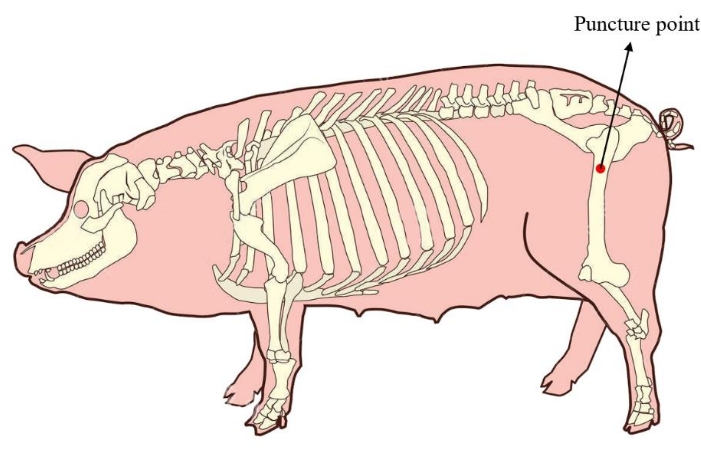
图 1:迷你猪的骨髓穿刺点。 红色区域显示提取骨髓的穿刺点,位于小型猪股骨近端。 请单击此处查看此图的较大版本。
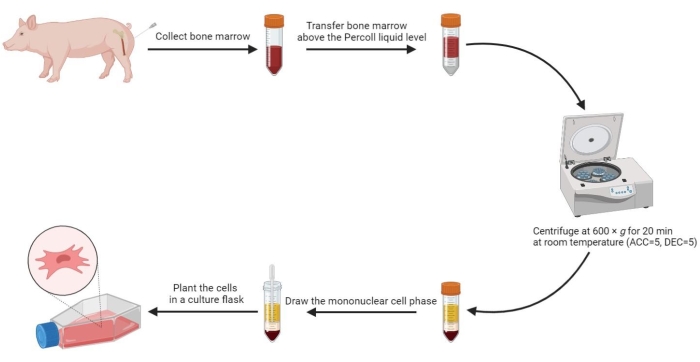
图 2:从猪骨髓中分离间充质干细胞。 从猪骨髓中分离间充质干细胞的过程如流程图所示,密度梯度离心后四种液相清晰可见。 请单击此处查看此图的较大版本。
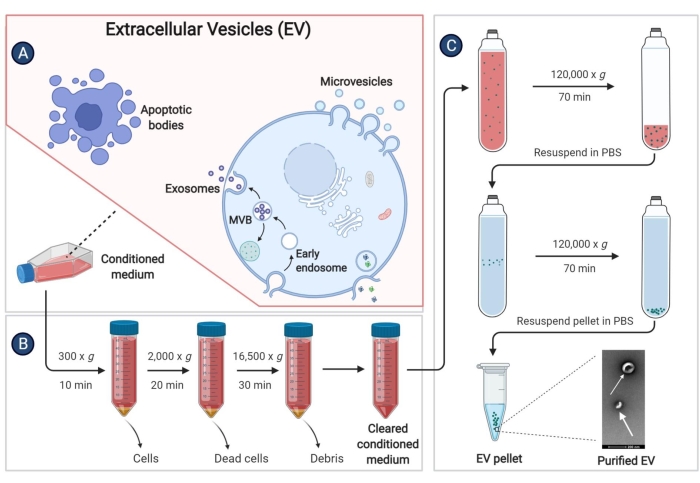
图 3:分离源自 pBM-MSC 的 EV。 示意图显示了通过超速离心从条件培养基中分离 EV 的具体步骤。 请单击此处查看此图的较大版本。

图 4:不同日期 pBM-MSC 的形态学特征。在 100x 显微视野下种植后的第 3天、第 5天、第 7 天和第 9 天可以看到类似的 pBM-MSCs 形态特征,并在第 9 天形成细胞集落。请单击此处查看此图的较大版本。

图 5.通过染色鉴定 pBM-MSCs 的分化电位。 (A) pBM-MSCs 的 (A) 成骨、(B) 成骨和 (C) 软骨形成分化测定。pBM-MSC 的分化电位可以通过这些染色结果来确定。 请单击此处查看此图的较大版本。
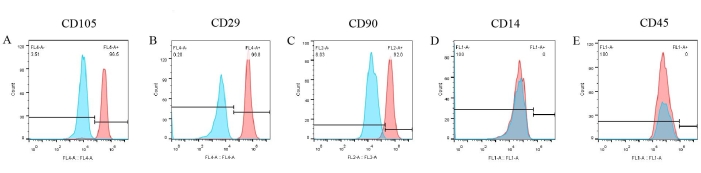
图 6:流式细胞术对 pBM-MSC 的鉴定结果。 CD105、CD29 和 CD90 在 pBM-MSCs 表面显著表达,分别占 96.5%、99.8% 和 92.0%,而 CD14 和 CD45 的表达为阴性。 请单击此处查看此图的较大版本。
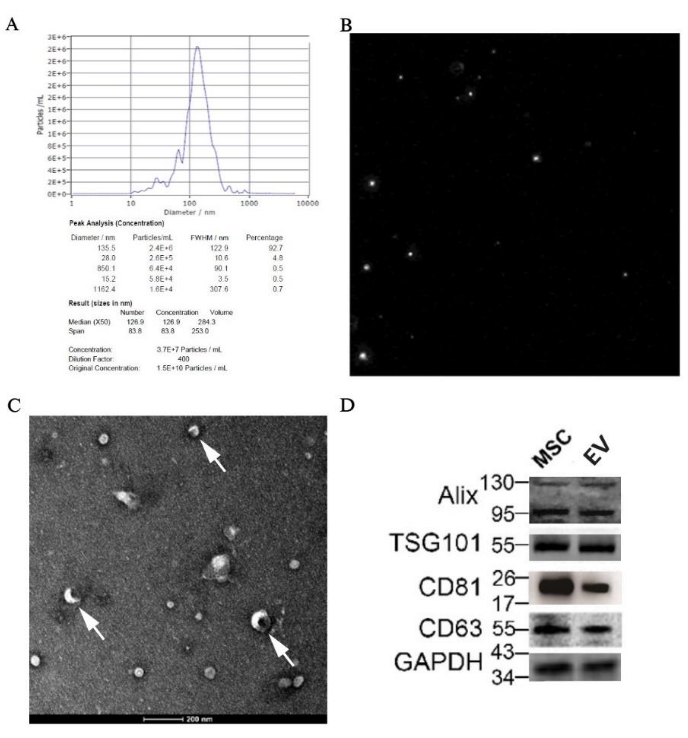
图 7:通过形态学和分子生物学对 pBM-MSC 衍生的 EV 的鉴定结果。 (A) 来自 pBM-MSC 的 EV 的 NTA 结果,分别附有粒度分布图和 (B) 颗粒轨迹图;(C) 以 50,000 倍放大倍率拍摄的 TEM 图像,白色箭头显示了盘状囊泡的经典结构。(D) 通过蛋白质印迹表达 EV 的特异性标志物。 请单击此处查看此图的较大版本。
讨论
小型猪的传统骨髓穿刺点位于髂嵴20 处。虽然很容易定位,但骨髓提取量有限21 (一般只有 5 mL 左右),因此很难满足体内移植体外大量扩增的要求。在这种方法中,我们将骨髓穿刺点重新定位到股骨近端,可以从该部位提取至少 20 mL 的骨髓,保证有足够量的 pBM-MSCs 用于后续的细胞培养。
用于通过密度梯度离心分离 BM-MSC 的两种主要分离溶液是 Percoll 和 Ficoll。Percoll 由硅化聚乙烯吡咯烷酮 (PVP) 组成,是一种新型无毒、无刺激性的密度梯度离心分离剂。Percoll 的低扩散常数导致相对稳定的密度梯度;因此,在低离心力 (200-1000 x g) 下,通常可以在数十分钟内实现令人满意的细胞分离。使用 Ficoll 分离 pBM-MSC 的方法之前已经报道过21.与 Ficoll 相比,Percoll 因其易等作性、低粘度、无毒、不引起细胞聚集等优点而逐渐得到应用,可以补充现有的分离 pBM-MSCs 的方法。
在分离和培养 pBM-MSC 时,一些关键步骤不容忽视。首先,密度梯度离心后不同液相的成功分层是分离纯化的 pBM-MSC 的关键。BM-MSCs 作为骨髓单核细胞 (BM-MNCs) 的一种,比重与淋巴细胞和单核细胞相似,约为 1.075 g/mL。Percoll 的原始密度为 1.130 g/mL,密度梯度离心后要成功获得含有 BM-MSCs 的细胞层,需要根据 Percoll 密度-浓度关系提前配置 60% 等渗密度梯度分离液 (1.077 g/mL)22。此外,适当的离心条件也有助于成功分层。考虑到 Percoll 的低扩散常数,我们将提取的骨髓以 600 x g 的离心力在相对较低的加减速水平 (ACC = 5 , DEC = 5) 下离心 20 min,取得了良好的分层效果。其次,适当的种植密度对于细胞培养也是必不可少的。为了获得足够数量的 MSC(通常每只动物超过 107 个 9)用于后续移植,我们使用 175 cm2 培养瓶进行细胞培养。在之前的研究20 中,通常将获得的 BM-MNC 种植到培养瓶中,以 5 x 105/cm2 的密度进行培养。据报道,密度梯度离心后,每 5 mL 猪骨髓可获得 2-3 x 107 个 BM-MNCs23。因此,在该方案中,我们建议将从每 20 mL 猪骨髓中分离的总 BM-MNC 种植到 175 cm2 培养瓶中,以获得合适的密度。第三,在分离和培养 pBM-MSC 时应避免杂质。吸取单核细胞相时,不应将移液器插入 Percoll 相,以免与分离液体混合。此外,细胞种植 24 小时后,应轻轻摇动培养瓶以减少红细胞的粘附。
在超速离心过程中,通过该方法产生的高水平蛋白质聚集体和脂蛋白污染不可避免地会影响 EV 的定量和功能分析14。为了尽可能减少过程中的污染,在超速离心步骤之前,每次转移上清液时,应在底部保留 5 mm 深的液体。同时,在第一次超速离心后,将沉淀重悬于无菌 PBS 中,然后再次进行超速离心,可有效减少脂蛋白污染。
尽管密度梯度离心和超速离心已分别广泛用于分离 BM-MSC 及其衍生的 EV,但这两种技术也有其自身的局限性。一方面,Percoll 技术冗长而繁琐, 据报道,通过 床旁细胞浓缩装置制备 BM 浓缩物标本是分离 MSC24 的替代方法。另一方面,超速离心法不仅需要训练有素的技术人员,还需要昂贵的设备;因此,两种或多种技术的组合应用可能为更有效地隔离 EV 提供了一种合理的策略25。此外,pBM-MSCs 及其衍生的 EVs 的鉴定也需要改进。例如,根据定义 MSCs26 的国际标准,本研究流式细胞术对 BM-MSC 表型的鉴定结果中仍然缺少一些阳性或阴性标志物的表达,如 CD73、CD34 和 HLA-DR。此外,尽管已采取措施避免在隔离 EV 过程中受到污染,但由于我们实验室的限制,我们无法评估 EV 样本的纯度以帮助改进后续工作。
本研究结合了 pBM-MSCs 及其衍生的 EVs 的分离方法,随后的鉴定结果系统地证明了这些方法。特别是,我们重点介绍了这一系列步骤中的关键作,解释了一些具体的实验条件,这些条件可以在一定程度上解决不同实验室在此过程中存在的异质性问题。该方法可广泛应用于 BM-MSCs 及其衍生的 EVs 移植疗效的临床前研究,为临床研究提供具有足够水平的实验依据。
披露声明
所有作者都没有需要声明的利益冲突。
致谢
我们感谢杨建中和王学敏对骨髓提取手术的贡献。这项工作得到了中国医学科学院医学创新基金 (CIFMS) [资助号 2016-I2M-1-009]、中国国家自然科学基金委员会(编号:82070307;编号:81874461)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
参考文献
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。