Method Article
Aislamiento e identificación de células madre mesenquimales de médula ósea porcina y sus vesículas extracelulares derivadas
En este artículo
Resumen
En este artículo se elabora un método para aislar e identificar células madre mesenquimales de médula ósea porcina (pBM-MSCs) y vesículas extracelulares (EVs) derivadas de ellas, proporcionando una base metodológica para la evaluación preclínica de la eficacia del trasplante de BM-MSCs y sus EVs derivadas.
Resumen
Con el desarrollo de la terapia con células madre en la investigación traslacional y la medicina regenerativa, las células madre mesenquimales de la médula ósea (BM-MSC), como un tipo de células madre pluripotentes, se ven favorecidas por su disponibilidad instantánea y seguridad comprobada. Se ha reportado que el trasplante de BM-MSCs es de gran beneficio para la reparación de tejidos lesionados en diversas enfermedades, lo que podría estar relacionado con la modulación de las respuestas inmunes e inflamatorias a través de mecanismos paracrinos. Las vesículas extracelulares (VE), con una estructura de membrana lipídica de doble capa, se consideran los principales mediadores de los efectos paracrinos de las células madre. Reconocidos por su papel crucial en la comunicación celular y la regulación epigenética, los VE ya se han aplicado in vivo para la inmunoterapia. Sin embargo, al igual que con sus células maternas, la mayoría de los estudios sobre la eficacia del trasplante de VE aún se mantienen a nivel de animales pequeños, lo que no es suficiente para proporcionar evidencia esencial para la traducción clínica. Aquí, utilizamos la centrifugación en gradiente de densidad para aislar las células de la médula ósea (BMC) de la médula ósea porcina al principio, y obtener posteriormente BM-MSC porcinas (pBM-MSC) mediante cultivo celular, identificadas por los resultados de la observación bajo el microscopio, el ensayo de diferenciación inducida y la citometría de flujo. Además, aislamos EVs derivados de pBM-MSCs en sobrenadante celular por ultracentrifugación, demostrado con éxito por las técnicas de microscopía electrónica de transmisión (TEM), análisis de seguimiento de nanopartículas (NTA) y western blot. En general, las pBM-MSC y sus VE derivadas pueden aislarse e identificarse eficazmente mediante los siguientes protocolos, que podrían ser ampliamente utilizados en estudios preclínicos sobre la eficacia del trasplante de las BM-MSC y sus VE derivadas.
Introducción
En los últimos 10 años, la terapia con células madre ha prometido grandes beneficios para los pacientes que padecen una variedad de enfermedades y lesiones, como traumatismos, enfermedades respiratorias y cardiovasculares. Con el progreso en el campo, las células madre mesenquimales de la médula ósea (BM-MSC) están siendo gradualmente favorecidas por las personas por su accesibilidad y pocas disputas éticas1, que han sido consideradas el estándar de oro para la investigación clínica a pesar de otros tipos de células2. Las terapias basadas en BM-MSCs también son atractivas para cada vez más investigadores debido a su capacidad única para modular las respuestas inmunitarias e inflamatorias y reparar los tejidos lesionados a través de mecanismos de diferenciación o paracrinos3.
Las vesículas extracelulares (VE), como avala la Sociedad Internacional de Vesículas Extracelulares (ISEV), se refieren al total de partículas con una estructura de bicapa lipídica que se liberan naturalmente de las células. Con los recientes descubrimientos de diversos contenidos como proteínas, lípidos y materiales genéticos (por ejemplo, miARN, ARNm, moléculas de ADN, así como ARN largos no codificantes) en VE de diferentes tipos de células5, se han reconocido sus funciones cruciales en la comunicación celular y la regulación epigenética6. Como sustituto novedoso de las células maternas, las VE se han aplicado en inmunoterapia y medicina regenerativa con estudios in vivo, que sirven de base para la investigación preclínica en curso y los ensayos clínicos de seguimiento7.
Sin embargo, en la actualidad, la mayoría de los estudios sobre la eficacia del trasplante de BM-MSCs y sus VE derivadas aún se mantienen a nivel de animales pequeños, lo que no es suficiente para proporcionar la evidencia necesaria para la traslación clínica. En consecuencia, es extremadamente urgente llevar a cabo investigaciones preclínicas sobre el trasplante de BM-MSCs y sus VE derivadas a nivel de animales grandes como los cerdos.
Se ha reportado que las MSCs están presentes en cantidades extremadamente bajas en la médula ósea, representando solo del 0,01% al 0,001% del total de células8. Sin embargo, la administración preclínica de BM-MSCs requiere un gran número de células (≥107 por animal)9; la cantidad de VE requerida es aún mayor, cuya dosis media es de 0,25 mg de proteína por kilogramo de peso corporal en cerdos10. Para lograr estos grandes números, existe una necesidad urgente de un método seguro y eficaz para aislar y cultivar MSC de médula ósea porcina para lograr su expansión masiva in vitro y adquirir posteriormente sus EV con alta concentración de proteínas.
Hasta ahora, existen varios métodos para aislar las BM-MSC y sus EV derivadas. Los métodos actuales para aislar las BM-MSC incluyen la siembra directa de células de médula ósea (BMC)11, la centrifugación en gradiente de densidad, la clasificación de etiquetas moleculares en la superficie celular y el cribado por citometría de flujo. Se ha reportado que la clasificación de etiquetas moleculares en la superficie celular y el cribado por citometría de flujo dan como resultado una disminución en la tasa de adhesión celular, un aumento en la mortalidad a las 24 h y la inhibición de la proliferación12, mientras que el cultivo directo de BMC puede resultar en un alto número de células hematopoyéticas mixtas. Por lo tanto, la centrifugación en gradiente de densidad ahora se usa comúnmente para obtener BM-MSC. Los métodos actuales para aislar EV de los sobrenadantes celulares incluyen ultracentrifugación, ultrafiltración, precipitación de polímeros y exclusión por tamaño13. En comparación con otros métodos, la ultracentrifugación tiene la ventaja de ser de bajo costo, facilidad de uso y compatibilidad con la preparación de grandes volúmenes sin un pretratamiento complicado, que ha sido el "estándar de oro" para la separación de EV14. Sin embargo, existe una gran heterogeneidad en los reactivos y técnicas en los diferentes laboratorios durante el proceso 3,15, lo que podría ser engañoso para los lectores. En este artículo se explican en detalle una serie de pasos secuenciales para aislar las pBM-MSCs y las VE derivadas de ellas, y los resultados de la identificación posterior demuestran que el método es factible para obtener pBM-MSCs y sus VE para su posterior análisis en la investigación preclínica. Esperamos que este trabajo sistemático pueda proporcionar una base metodológica para los investigadores que se dedican a la evaluación preclínica del trasplante de pBM-MSCs y sus EVs derivados, para que los ensayos clínicos puedan llevarse a cabo lo antes posible.
Protocolo
De acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio publicada por los Institutos Nacionales de Salud, EE. UU., Todos los procedimientos experimentales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC), Hospital Fuwai, Academia China de Ciencias Médicas.
1. Preparación preoperatoria de los animales
- Obtenga minicerdos chinos machos adultos (30 ± 5 kg) aproximadamente a los 12 meses de edad del Instituto de Zoología de la Academia China de Ciencias y alójelos en las instalaciones del Centro Experimental de Animales del Hospital de Fuwai, al menos con 2 semanas de anticipación. Llevar a cabo inspecciones preoperatorias, como exámenes de rutina de sangre, para asegurarse de que los animales estén sanos.
- Limpiar y afeitar la piel de la zona del muslo del minipig el día antes de la operación. Para evitar la aspiración, ayune el minicerdo durante 12 horas antes de la extracción de la médula ósea.
2. Preparación para el aislamiento y cultivo celular
- Utilice Percoll (1.130 g/mL) para aislar las células madre mesenquimales de la médula ósea. Mezcle la solución madre con PBS concentrado 10x en una proporción de 9:1 para obtener un medio isotónico. A continuación, mezcle el medio isotónico con PBS en una proporción de 3:2 para obtener una solución de Percoll al 60% (1,077 g/mL), que puede utilizarse como solución de separación final para aislar las pBM-MSC.
- Prepare el Medio de Dulbecco Modificado de Iscove (IMDM) con 10% de suero fetal bovino y 1,0% de penicilina-estreptomicina para obtener un medio completo. Precalentar el medio completo y el PBS en un baño de agua a 37 °C para el posterior cultivo celular.
3. Anestesia para los animales
- Administrar anestesia general con ketamina (10 mg/kg) y xilacina (2 mg/kg) por vía intramuscular. Llevar a cabo la intubación endotraqueal rápidamente cuando el minipig tenga una respiración lenta y menos actividad de las extremidades, y preservar la respiración espontánea para evitar el fracaso de la intubación.
- Realizar el mantenimiento de la anestesia por inhalación de isoflurano al 2%, con oxígeno (1,5 L/min) como gas portador. Durante la anestesia, controle la frecuencia cardíaca, la respiración y la saturación de oxígeno en sangre del minipig en tiempo real.
4. Extracción de médula ósea del minicerdo
- Coloque el minipig en posición lateral. Para asegurar una cantidad suficiente de médula ósea para el posterior cultivo celular, localice el punto de punción de la médula ósea en el fémur proximal del minipig (Figura 1). Desinfecte y cubra la piel de la zona de punción antes de aplicar la operación.
- Apriete la piel alrededor del punto de punción con la mano no dominante y perfore la aguja de biopsia de médula ósea verticalmente en el punto con la mano dominante. Cuando sienta la aguja en contacto con el hueso cortical, gire suavemente el mango hacia la izquierda y hacia la derecha para perforar la aguja. Cuando la aguja entra en la cavidad de la médula ósea, a menudo hay una sensación de pérdida de resistencia.
- Una vez que la punción esté en su lugar, retire la aguja central. A continuación, coloque una jeringa estéril desechable de 50 ml en el extremo de la aguja exterior y enjuague la pared interna de la jeringa con heparina con antelación.
- Extraiga 20 mL de médula ósea lentamente y transfiéralos a un tubo de centrífuga estéril de 50 mL con cuidado.
- Una vez finalizado el procedimiento, saque la aguja y retire el cortín. Desinfecte el sitio de punción y presione durante 20 min para hemostasia.
- Extubar el minicerdo después de restaurar la respiración espontánea. Cuando esté completamente despierto con libre movimiento de las extremidades, regrese el minicerdo a la jaula para continuar alimentándose.
5. Aislar las células madre mesenquimales de la médula ósea
- Agregue un volumen igual de PBS precalentado a la médula ósea y mezcle bien. A continuación, utilice una pipeta estéril para transferir cuidadosamente 20 ml de médula ósea diluida por encima del nivel de solución con gradiente de densidad del 60% en una proporción de volumen de 1:1 en un tubo de centrífuga estéril de 50 ml.
- Centrifugar el tubo a 600 x g (aceleración (ACC) = 5, deceleración (DEC) = 5) durante 20 min a temperatura ambiente (RT).
NOTA: Se forman cuatro fases en el tubo después de la centrifugación, incluida la fase sérica, la fase de célula mononuclear, la fase media de gradiente de densidad y la fase de precipitación de arriba a abajo. La fase de célula mononuclear es una fina capa de floculante entre el suero y el medio de gradiente de densidad. En esta fase se encuentran las células madre mesenquimales derivadas de la médula ósea. - Extraiga la fase de la célula mononuclear en un tubo de centrífuga estéril de 15 ml y lave dos veces con PBS a 800 x g durante 5 minutos.
- Vuelva a suspender las células lavadas en 2 mL de medio completo y plante las células resuspendidas en un matraz de cultivo celular de 175cm2 a una densidad de 3-5 x 105/mL.
NOTA: Todos los procedimientos anteriores para aislar células madre mesenquimales se pueden ver en la Figura 2.
6. Cultivo de células madre mesenquimales in vitro
- Incubar el matraz de cultivo a 37 °C en una atmósfera saturada y humidificada con un 5% deCO2. Agite suavemente el matraz de cultivo cada 24 horas para evitar el crecimiento adherente de las células madre hematopoyéticas precipitadas, y observe el crecimiento, la morfología y la contaminación de las células bajo un microscopio.
- Reemplace el medio de cultivo por primera vez después de 3 días y luego cambie el medio cada 2-3 días. Cuando las colonias celulares alcancen el 80%-90% de confluencia, subcultive las células en una proporción de 1:2.
7. Diferenciación adipogénica, osteogénica y condrogénica de las pBM-MSC
- Ensayo de diferenciación adipogénica
- Prepare el medio de diferenciación adipogénico A (medio A) y B (medio B) para BM-MSC de acuerdo con las instrucciones del kit. La información específica sobre el kit se puede encontrar en la Tabla de Materiales.
- Agregue 1 ml de gelatina al 0,1% a la placa de seis pocillos y agite suavemente para que pueda cubrir el fondo de cada pocillo de manera uniforme. A continuación, coloque la placa de seis pocillos en un banco limpio o en una incubadora deCO2 durante al menos 30 minutos.
- Después de 30 min, aspire la gelatina y agregue 2 mL de medio general completo a cada pocillo. A continuación, plante las pBM-MSC en la placa de seis pocillos a una densidad de celdas de 2 x 104 células/cm2. Después de eso, incubar la placa a 37 °C con una humedad saturada del 5% de CO2.
- Cuando las células alcancen el 100% de confluencia, retire el medio completo con cuidado y agregue 2 mL de medio A a cada pocillo de la placa. Después de 3 días, retire el medio A de la placa y agregue 2 mL de medio B a cada pocillo.
- Después de mantener durante 1 día, retire el medio B y reemplácelo con el medio A para la inducción. De acuerdo con la forma de "Medio A durante 3 días, Medio B durante 1 día", use el Medio A y B secuencialmente para la inducción.
- Observe el estado de la celda todos los días durante el período. Si las células se encogen o mueren durante el proceso de inducción del medio A, reemplácelo con el medio B a tiempo hasta que se recupere el estado de la célula.
- Repita el proceso de inducción y mantenimiento, y prepárese para la tinción cuando se observen suficientes gotas de lípidos de tamaño adecuado bajo el microscopio.
- Retire el medio para la diferenciación adipogénica en la placa de seis pocillos y lave suavemente con 1x PBS. Agregue 2 mL de solución de paraformaldehído al 4% a cada pocillo y fije durante 30 min en RT.
- Retire el fijador de paraformaldehído y lávese con 1x PBS dos o tres veces para asegurarse de que el fijador se retire completamente. Añadir 2 mL de tinte Oil Red O a cada pocillo y teñir durante 30 min a RT.
- Retire el tinte Oil Red O y lave con 1x PBS dos o tres veces. Agregue 2 mL de 1x PBS a cada pocillo y luego observe el efecto de la diferenciación adipogénica bajo un microscopio.
- Ensayo de diferenciación osteogénica
- Prepare el medio completo para la diferenciación osteogénica de acuerdo con las instrucciones del kit.
- Siga los pasos 7.1.2-7.1.3 para plantar y cultivar pBM-MSC.
- Cuando las células alcancen el 70% de confluencia, retire el medio completo general con cuidado y agregue 2 mL de medio para la diferenciación osteogénica a cada pocillo de la placa.
- Cambie a un medio de diferenciación osteogénico fresco cada 3 días. Continúe la inducción durante 2-4 semanas y prepárese para teñir con tinte rojo de alizarina cuando aparezcan nódulos de calcio evidentes durante la osteogénesis.
- Retire el medio para la diferenciación osteogénica en la placa de seis pocillos y lave suavemente con 1x PBS. Agregue 2 mL de solución de paraformaldehído al 4% a cada pocillo y fije durante 30 min en RT.
- Retire el fijador de paraformaldehído y lávelo con 1x PBS dos o tres veces para asegurarse de que el fijador se limpie a fondo. Agregue 2 mL de tinte rojo alizarina a cada pocillo y tiña durante 10 min en RT.
- Retira el tinte rojo alizarina y lava con 1x PBS dos o tres veces. Agregue 2 mL de 1x PBS a cada pocillo y luego observe el efecto de la diferenciación osteogénica bajo un microscopio.
- Ensayo de diferenciación condrogénica
- Prepare la premezcla para la diferenciación condrogénica de acuerdo con las instrucciones del kit.
- Transfiera 3-4 x 105 pBM-MSC a un tubo de centrífuga estéril de 15 mL. Centrifugar a 250 x g durante 4 min a 20 °C.
- Retirar el sobrenadante y añadir 0,5 mL de premezcla para resuspender el pellet obtenido por centrifugación en el paso anterior, y luego centrifugar a 150 x g durante 5 min a 20 °C. Repite este paso para volver a lavar las células.
- Prepare el medio completo para la diferenciación condrogénica.
- Resuspender la célula obtenida en el paso anterior con 0,5 mL de medio completo y centrifugar a 150 x g durante 5 min a 20 °C.
- Desenrosque la tapa del tubo de centrífuga para facilitar el intercambio de gases. Colóquelo en posición vertical en una incubadora a 37 °C, 5% de CO2 y humedad saturada.
- Cuando las células parezcan agregarse (generalmente después de 24-48 h, dependiendo de la situación real), golpee la parte inferior del tubo de centrífuga para que las bolas de cartílago se desprendan de la parte inferior y se suspendan en el medio.
- Cambie a un medio completo fresco para la diferenciación condrogénica cada 2-3 días. Continúe la inducción hasta que se formen bolas de cartílago con un diámetro de 1,5-2 mm en el tubo y luego prepare las secciones para la tinción.
- Prepare secciones de parafina de bolas de cartílago de acuerdo con los pasos rutinarios de los experimentos patológicos. Añadir el tinte azul Alicia a las secciones desparafinadas y teñir a 37 °C durante 1 h.
- Enjuague el portaobjetos con agua corriente durante 5 minutos y luego observe el efecto de tinción de Alicia blue bajo un microscopio después del secado.
8. Identificación del fenotipo celular por citometría de flujo
- Cuando las colonias celulares alcancen el 80%-90% de confluencia en los pasajes 3-5, retire el medio de cultivo y lave las celdas dos veces con PBS precalentado. A continuación, digerir las células con 3-4 mL de tripsina/EDTA al 0,25% e incubarlas a 37 °C en una atmósfera saturada y humidificada con un 5% de CO2 durante 2-3 min hasta que se desprendan del fondo del matraz bajo un microscopio.
- Recoja las células con un medio completo de 10 mL y transfiera la suspensión celular a un tubo de centrífuga estéril de 15 mL. Centrifugar la suspensión celular a 800 x g durante 5 min a RT. Deseche el sobrenadante y lave las celdas con PBS a 4 °C.
- Vuelva a suspender las células a 10 mL con PBS de 4 °C. La suspensión celular se divide en nueve grupos con un volumen de 1 mL en cada microtubo de 1,5 mL, denominados control negativo, control de isotipo FITC, control de isotipo PE, control de isotipo APC, grupo CD105, CD29, CD90, CD14 y CD45, respectivamente. Asegúrese de que el número de células en cada microtubo esté entre 1 x 105 y 1 x 106.
- Centrifugar la suspensión a 800 x g durante 5 min a 4 °C y volver a suspender las células en cada microtubo con 100 μL de PBS a 4 °C. Excepto para el grupo de control negativo, agregue 5 μL del control de isotipo correspondiente (FITC, PE y APC Mouse IgG1 kappa Isotype Control) y anticuerpos (CD105, CD29, CD90, CD14 y anticuerpo monoclonal CD45) para la citometría de flujo a cada microtubo de acuerdo con el orden del paso 8.3. Mezclar suavemente e incubar durante 1,5 h a 4 °C en la oscuridad.
- Añadir 1 mL de PBS de 4 °C a cada microtubo y centrifugar a 300 x g durante 10 min a 4 °C. Deseche el sobrenadante y añada 200 μL de PBS a 4 °C para resuspender las células.
- Pruebe al menos 10.000 células en la citometría de flujo después de filtrar la suspensión celular16 y analice los datos utilizando el software de citometría de flujo.
9. Aislamiento de vesículas extracelulares (VE) derivadas de células madre mesenquimales de médula ósea porcina
- Cuando la confluencia de pBM-MSCs alcance el 80%-90%, desechar el sobrenadante y lavar las células con PBS 2x. A continuación, añada 25 mL de IMDM sin suero a cada matraz de cultivo y continúe incubando a 37 °C en una atmósfera humidificada de 5% de CO2 durante 48 h.
- Recoja el sobrenadante celular (medio acondicionado, CM) en un tubo de centrífuga de 50 mL y centrifugue a 300 x g durante 10 min a 4 °C para eliminar los restos de la célula.
- Vuelva a recoger el sobrenadante en otro tubo de centrífuga de 50 mL. Lleve a cabo el aislamiento de los vehículos eléctricos lo antes posible después de recoger el sobrenadante. Para el almacenamiento a largo plazo, almacene el sobrenadante en el refrigerador a -80 °C para evitar la pérdida de EV.
- Centrifugar el sobrenadante en el paso 9.3 a 2.000 x g durante 20 min a 4 °C.
- Transfiera el sobrenadante a un tubo estéril utilizado para centrífuga de alta velocidad y centrífuga a 16.500 x g durante 30 min a 4 °C.
- Transfiera nuevamente el sobrenadante a un tubo de ultracentrífuga y centrifugue a 120.000 x g durante al menos 70 min a 4 °C, con un rotor de ángulo fijo.
- Deseche el sobrenadante por completo. Añadir 1 mL de PBS a 4 °C a cada tubo de ultracentrífuga y resuspender la precipitación con una micropipeta. Mezcle la solución del mismo grupo en un tubo ultracentrífugo y luego agregue 4 °C PBS para que el volumen sea superior a 3/4 del tubo.
- Centrifugar a 120.000 x g durante 60 min a 4 °C y eliminar el sobrenadante tanto como sea posible.
- Vuelva a suspender el precipitante con PBS estéril y guarde los EV en un refrigerador a -80 °C.
NOTA: La cantidad de PBS para la resuspensión puede determinarse en 100 μL para la precipitación de cada dos matraces de cultivo de 175cm2 . Todos los pasos anteriores para aislar los vehículos eléctricos se muestran sistemáticamente en la Figura 3 .
10. Identificación de vehículos eléctricos mediante microscopía electrónica de transmisión (TEM), análisis de seguimiento de nanopartículas (NTA) y Western blot
- Coloque la muestra de EV en hielo después de descongelarla en un baño de agua a 25 °C y luego diluya a la mitad de la concentración anterior con PBS para la detección de NTA17.
- Pipetear 10 μL de la muestra en la malla de cobre, dejar reposar durante 1 min, y absorber el líquido flotante con papel de filtro. Luego, agregue 10 μL de ácido fosfotúngstico a la malla de cobre, déjela reposar durante 1 minuto y absorba el exceso de líquido.
- Después de secar durante unos minutos en RT, realice imágenes de microscopía electrónica en la condición de voltaje de aceleración de 100 KV18.
- Vuelva a suspender la muestra de EVs del paso 9.9 en el tampón de lisis RIPA (25 mM Tris· HCl (pH 7,6), cloruro de sodio [NaCl] 150 mM, fenoxipolietoxiletetanol de nonilo al 1% (NP-40), desoxicolato de sodio al 1%, dodecil sulfato de sodio (SDS) al 0,1%, fluoruro de fenilmetanosulfonilo (PMSF), inhibidor de la proteasa 1x), y detectar la expresión de marcadores específicos para EV como Alix, TSG101, CD81 y CD63 por Western blot19.
Resultados
Establecimiento de células madre mesenquimales de médula ósea porcina
Las células madre mesenquimales derivadas de médula ósea porcina se aislaron y cultivaron con éxito in vitro, y la morfología de las pBM-MSC en diferentes días se puede ver en la Figura 4. En el cultivo primario de pBM-MSCs, la observación microscópica mostró que la adherencia celular ocurrió un día después de la siembra, y las células adherentes eran generalmente de forma redonda. Las pBM-MSCs primarias generalmente permanecieron en la fase de reposo durante 3 días después de la siembra, y la proliferación celular comenzó el4º día. La morfología de la célula cambió de redonda a fusiforme, multilateral o de tipo estrella después de la proliferación, y los núcleos son centrales, con doble nucleolo en algunas células. Las colonias celulares se formaron 7-9 días después del inicio de la proliferación celular, y se pudo lograr una confluencia celular del 80%-90% a los 12-14 días. La observación microscópica mostró que las células adherentes crecían como colonias dispersas y estaban dispuestas en un patrón de remolino.
La proliferación celular se aceleró significativamente después del paso, y se pudo alcanzar una confluencia del 80%-90% en una semana. La morfología de la célula era homogénea en forma de huso desde el segundo paso, parecida a los fibroblastos, con una relación longitud-anchura de aproximadamente 2-3:1. Si las células estuvieran diferenciadas, podrían aparecer poligonales o en forma de estrella. Después del paso, las células ya no crecían como colonias dispersas, sino uniforme y radialmente en una disposición paralela.
Identificación del potencial de diferenciación celular mediante tinción
En el ensayo de diferenciación adipogénica, la tinción con Oil Red O mostró que aparecieron gotas lipídicas redondas de color rojo anaranjado de diferentes tamaños alrededor del núcleo (Figura 5A); En el ensayo de diferenciación osteogénica, la tinción con rojo de alizarina mostró nódulos rojos en la superficie celular (Figura 5B), que fueron causados por la reacción de color con las sales de calcio depositadas por los osteoblastos diferenciados de las pBM-MSC. En el ensayo de diferenciación condrogénica, la tinción con azul de Alicia mostró que toda la sección de tejido era azul (Figura 5C), lo que fue causado por la tinción de mucopolisacárido endoácido en bolas de cartílago.
Identificación del fenotipo celular por citometría de flujo
Se realizaron ensayos de los marcadores de la superficie celular para crear un fenotipo de pBM-MSCs. A partir de los resultados de la citometría de flujo (Figura 6), tres marcadores positivos como CD105, CD29 y CD90 se expresaron significativamente en la superficie de las pBM-MSC, representando el 96,5%, 99,8% y 92%, respectivamente (Figura 6A-C). Sin embargo, la expresión de CD14 y CD45 fue negativa (Figura 6D,E). Mientras tanto, los resultados de los controles de isotipo correspondientes fueron todos negativos, lo que ya se ha superpuesto en la figura, descartando la posibilidad de una unión inespecífica de anticuerpos.
Identificación de VE derivadas de pBM-MSC por NTA, TEM y Western blot
El resultado de NTA mostró que el tamaño medio de partícula era de 126,9 nm, que estaba dentro del rango de los EV; además, la concentración original de la muestra de EVs era de 1,5 x10 10 partículas/mL, y el valor preciso asignado al tamaño se puede encontrar en la Figura 7A. El diagrama de la trayectoria de las partículas se muestra en la Figura 7B, lo que ilustra que las partículas estaban en un movimiento browniano irregular. Además, la vesícula discoide, como la estructura clásica de los vehículos eléctricos, se podía ver claramente bajo el microscopio electrónico con aumentos de 50.000x (Figura 7C). Además, se detectó en la muestra la expresión de marcadores específicos para EVs como Alix, TSG101, CD81 y CD63 mediante western blot (Figura 7D).
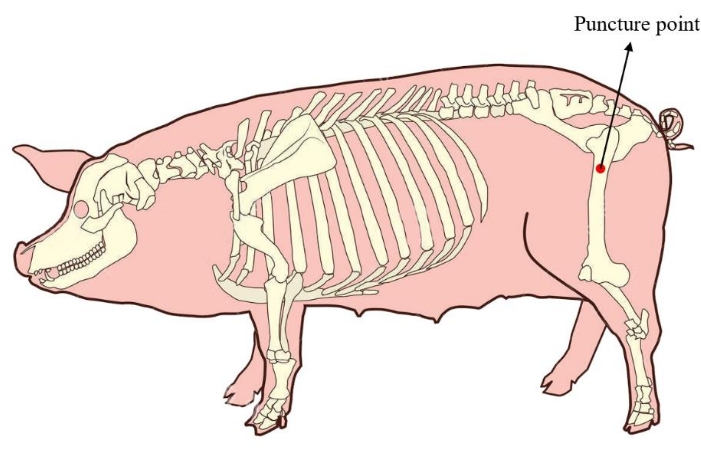
Figura 1: Punto de punción de la médula ósea del minicerdo. El área roja muestra el punto de punción de la médula ósea de extracción, ubicado en el fémur proximal del minicerdo. Haga clic aquí para ver una versión más grande de esta figura.
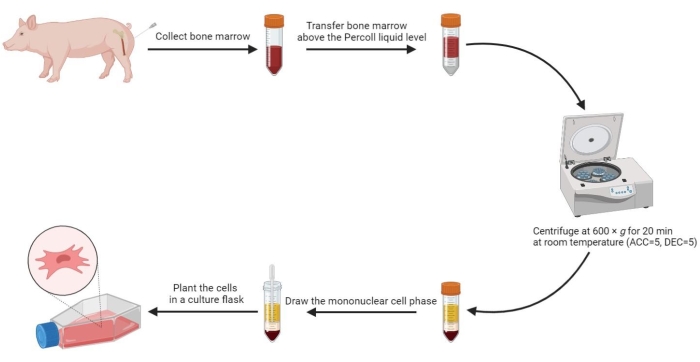
Figura 2: Aislamiento de células madre mesenquimales de médula ósea porcina. El proceso de aislamiento de las células madre mesenquimales de la médula ósea porcina se muestra en el diagrama de flujo, y las cuatro fases líquidas se ilustran claramente después de la centrifugación en gradiente de densidad. Haga clic aquí para ver una versión más grande de esta figura.
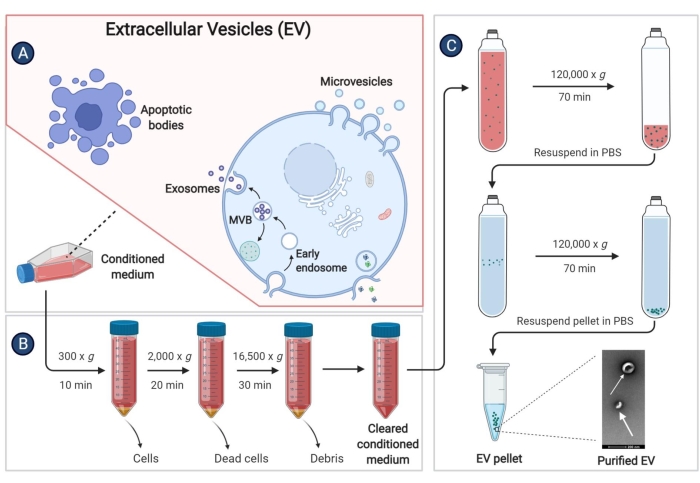
Figura 3: Aislamiento de vehículos eléctricos derivados de pBM-MSC. El diagrama esquemático muestra los pasos específicos para aislar los EV del medio acondicionado mediante ultracentrifugación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Características morfológicas de las pBM-MSCs en diferentes días. Las características morfológicas similares de las pBM-MSC se pueden ver en el3º,5º,7º y9º día después de la siembra bajo el campo microscópico 100x, y se han formado colonias celulares en el9º día. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Identificación del potencial de diferenciación de pBM-MSCs por tinción. (A) Ensayo de diferenciación adipogénica, (B) osteogénica y (C) condrogénica de pBM-MSCs, respectivamente. El potencial de diferenciación de las pBM-MSCs se puede identificar mediante estos resultados de tinción. Haga clic aquí para ver una versión más grande de esta figura.
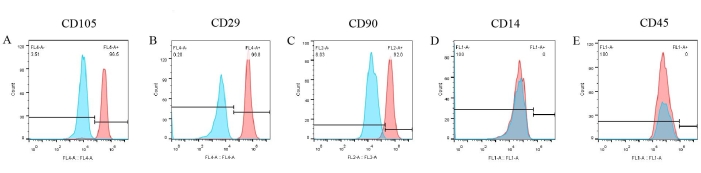
Figura 6: Resultados de la identificación de pBM-MSCs por citometría de flujo. CD105, CD29 y CD90 se expresan significativamente en la superficie de las pBM-MSCs, representando el 96,5%, 99,8% y 92,0%, respectivamente, mientras que la expresión de CD14 y CD45 es negativa. Haga clic aquí para ver una versión más grande de esta figura.
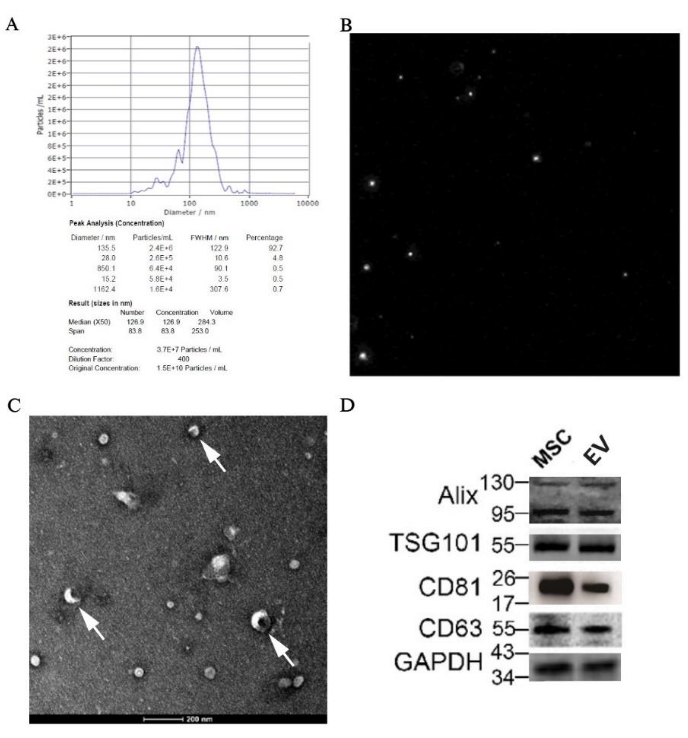
Figura 7: Resultados de la identificación de VEs derivadas de pBM-MSCs por morfología y biología molecular. (A) Resultado de NTA de EVs derivadas de pBM-MSCs, con gráfico de distribución de tamaño de partícula y (B) diagrama de trayectoria de partícula, respectivamente; (C) Imagen TEM tomada con aumentos de 50.000x, y la flecha blanca muestra la estructura clásica de las vesículas discoides. (D) Expresión de marcadores específicos para EVs por Western blot. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El punto de punción tradicional de la médula ósea de los minicerdos se colocó en la cresta ilíaca20. Aunque es fácil de localizar, la cantidad de extracción de médula ósea es limitada a21 (solo unos 5 mL en general), por lo que es difícil cumplir con el requerimiento de un gran número de expansiones in vitro para el trasplante in vivo. En este método, reposicionamos el punto de punción de la médula ósea al fémur proximal, y de este sitio se pueden extraer al menos 20 mL de médula ósea, lo que garantiza una cantidad suficiente de pBM-MSCs para el posterior cultivo celular.
Las dos principales soluciones de separación utilizadas para aislar BM-MSC mediante centrifugación en gradiente de densidad son Percoll y Ficoll. Percoll está compuesto por polivinilpirrolidona siliconada (PVP), que es un nuevo agente separador centrífugo de gradiente de densidad no tóxico y no irritante. La baja constante de difusión de Percoll da como resultado un gradiente de densidad relativamente estable; Por lo tanto, la separación celular satisfactoria generalmente se puede lograr en decenas de minutos a fuerzas centrífugas bajas (200-1000 x g). El método para el aislamiento de pBM-MSCs utilizando Ficoll ha sido reportado previamente21. En comparación con Ficoll, Percoll se ha utilizado gradualmente debido a sus ventajas de fácil isopermabilidad, baja viscosidad, no toxicidad y no causar agregación celular, lo que puede complementar los métodos existentes para aislar pBM-MSC.
Al aislar y cultivar pBM-MSCs, no se pueden ignorar algunos pasos críticos. En primer lugar, la estratificación exitosa de diferentes fases líquidas después de la centrifugación en gradiente de densidad es la clave para aislar las pBM-MSC purificadas. Las BM-MSCs, como tipo de células mononucleares de médula ósea (BM-MNCs), tienen una gravedad específica similar a la de los linfocitos y monocitos, alrededor de 1,075 g/mL. La densidad original de Percoll es de 1.130 g/mL, y para obtener con éxito la capa celular que contiene BM-MSCs después de la centrifugación en gradiente de densidad, es necesario configurar previamente una solución de separación en gradiente de densidad isotónica al 60% (1.077 g/mL) de acuerdo con la relación densidad-concentración de Percoll22. Además, las condiciones de centrifugación adecuadas también contribuyen al éxito de la estratificación. Teniendo en cuenta la baja constante de difusión de Percoll, centrifugamos la médula ósea extraída a 600 x g durante 20 min a niveles de aceleración/desaceleración relativamente bajos (ACC = 5, DEC = 5), lo que logró un buen efecto de estratificación. En segundo lugar, la densidad de plantación adecuada también es esencial para el cultivo celular. Con el fin de adquirir un número suficiente de MSCs (normalmente más de 107 por animal9) para su posterior trasplante, utilizamos matraces de cultivo de 175cm2 para el cultivo celular. En un estudio previo20, las BM-MNCs obtenidas se plantaron generalmente en matraces de cultivo para su cultivo a una densidad de 5 x 105/cm2. Se ha reportado que después de la centrifugación en gradiente de densidad, se pueden obtener 2-3 x 107 BM-MNCs por cada 5 mL de médula ósea porcina23. Por lo tanto, en este protocolo, recomendamos plantar BM-MNC totales aisladas de cada 20 mL de médula ósea porcina en un matraz de cultivo de 175cm2 para una densidad adecuada. En tercer lugar, deben evitarse las impurezas durante el aislamiento y el cultivo de las pBM-MSC. Al extraer la fase de celda mononuclear, la pipeta no debe insertarse en la fase Percoll para no mezclarse con el líquido de separación. Además, después de 24 h de la plantación de células, el matraz de cultivo debe agitarse suavemente para reducir la adherencia de los glóbulos rojos.
Durante el proceso de ultracentrifugación, los altos niveles de contaminación por agregados de proteínas y lipoproteínas a través de este método comprometen inevitablemente la cuantificación y el análisis funcional de las EV14. Con el fin de reducir la contaminación tanto como sea posible en el proceso, se debe retener 5 mm de profundidad de líquido en el fondo cada vez que se transfiere el sobrenadante antes de la etapa de ultracentrifugación. Mientras tanto, después de la primera ultracentrifugación, volver a suspender el pellet en PBS estéril y luego realizar nuevamente la ultracentrifugación puede reducir eficazmente la contaminación por lipoproteínas.
Aunque la centrifugación en gradiente de densidad y la ultracentrifugación se han utilizado ampliamente para aislar BM-MSC y sus EV derivados, respectivamente, estas dos técnicas también tienen sus propias limitaciones. Por un lado, la técnica de Percoll es larga y engorrosa, y se ha reportado que la producción de una muestra de concentrado de BM a través de un dispositivo de concentración de células de cabecera es un método alternativo para aislar MSCs24. Por otro lado, el método de ultracentrifugación requiere no solo técnicos altamente capacitados, sino también equipos costosos; por lo tanto, la aplicación combinada de dos o más técnicas puede presentar una estrategia razonable para un aislamiento más eficiente de los VE25. Además, también es necesario mejorar la identificación de las pBM-MSC y sus vehículos eléctricos derivados. Por ejemplo, de acuerdo con los criterios internacionales para la definición de MSCs26, la expresión de algunos marcadores positivos o negativos, como CD73, CD34 y HLA-DR, aún está ausente en los resultados de identificación de fenotipos de BM-MSC por citometría de flujo en este estudio. Además, aunque se han tomado medidas para evitar la contaminación durante el proceso de aislamiento de los VE, debido a las limitaciones de nuestro laboratorio, no podemos evaluar la pureza de la muestra de los VE para ayudar a mejorar el trabajo de seguimiento.
Este estudio combina métodos para el aislamiento secuencial de pBM-MSCs y sus EVs derivados, comprobados por los resultados de identificación posteriores. En particular, hemos destacado las operaciones clave en esta serie de pasos, explicando algunas condiciones experimentales específicas que pueden resolver hasta cierto punto el problema de heterogeneidad existente en diferentes laboratorios durante este proceso. Este trabajo metódico podría ser ampliamente utilizado en estudios preclínicos sobre la eficacia del trasplante de BM-MSCs y sus EVs derivadas, lo que podría proporcionar una base experimental con un nivel suficiente para la investigación clínica.
Divulgaciones
Todos los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Agradecemos a Yang Jianzhong y Wang Xuemin por sus contribuciones a la operación de extracción de médula ósea. Este trabajo fue apoyado por subvenciones del Fondo de Innovación CAMS para Ciencias Médicas (CIFMS) [subvención número 2016-I2M-1-009], Fundación Nacional de Ciencias Naturales de China (no: 82070307; no: 81874461).
Materiales
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
Referencias
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados