Method Article
عزل وتحديد الخلايا الجذعية الوسيطة لنخاع عظم الخنازير والحويصلات المشتقة منها خارج الخلية
In This Article
Summary
توضح هذه المقالة طريقة لعزل وتحديد الخلايا الجذعية الوسيطة لنخاع عظم الخنازير (pBM-MSCs) والحويصلات خارج الخلية (EVs) المشتقة منها ، مما يوفر أساسا منهجيا للتقييم قبل السريري لفعالية زرع BM-MSCs والمركبات الكهربائية المشتقة منها.
Abstract
مع تطور العلاج بالخلايا الجذعية في البحوث الانتقالية والطب التجديدي ، تفضل الخلايا الجذعية الوسيطة لنخاع العظم (BM-MSCs) ، كنوع من الخلايا الجذعية متعددة القدرات ، لتوافرها الفوري وسلامتها المثبتة. تم الإبلاغ عن أن زرع BM-MSCs له فائدة كبيرة لإصلاح الأنسجة المصابة في أمراض مختلفة ، والتي قد تكون مرتبطة بتعديل الاستجابات المناعية والالتهابية عبر آليات paracrine. تعتبر الحويصلات خارج الخلية (EVs) ، التي تتميز ببنية غشاء دهني مزدوجة الطبقة ، هي الوسطاء الرئيسيين للتأثيرات الباراكرين للخلايا الجذعية. معترف بها لأدوارها الحاسمة في التواصل الخلوي والتنظيم اللاجيني ، وقد تم بالفعل تطبيق المركبات الكهربائية في الجسم الحي للعلاج المناعي. ومع ذلك ، على غرار خلايا الأم ، لا تزال معظم الدراسات حول فعالية زرع المركبات الكهربائية على مستوى الصغيرة ، وهو ما لا يكفي لتقديم أدلة أساسية للترجمة السريرية. هنا ، نستخدم الطرد المركزي المتدرج للكثافة لعزل خلايا نخاع العظم (BMC) من نخاع عظم الخنزير في البداية ، والحصول على BM-MSCs الخنازير (pBM-MSCs) عن طريق زراعة الخلايا لاحقا ، والتي تم تحديدها من خلال نتائج المراقبة تحت المجهر ، ومقايسة التمايز المستحث ، وقياس التدفق الخلوي. علاوة على ذلك ، نقوم بعزل المركبات الكهربائية المشتقة من pBM-MSCs في الطاف الخلوي عن طريق الطرد المركزي الفائق ، والذي أثبتته تقنيات المجهر الإلكتروني للإرسال (TEM) ، وتحليل تتبع الجسيمات النانوية (NTA) ، والنشاف الغربي بنجاح. بشكل عام ، يمكن عزل pBM-MSCs والمركبات الكهربائية المشتقة منها وتحديدها بشكل فعال من خلال البروتوكولات التالية ، والتي يمكن استخدامها على نطاق واسع في الدراسات قبل السريرية حول فعالية زرع BM-MSCs والمركبات الكهربائية المشتقة منها.
Introduction
على مدى السنوات العشر الماضية ، وعد العلاج بالخلايا الجذعية بفوائد كبيرة للمرضى الذين يعانون من مجموعة متنوعة من الأمراض والإصابات ، مثل الصدمات وأمراض الجهاز التنفسي وأمراض القلب والأوعية الدموية. مع التقدم في هذا المجال ، يتم تفضيل الخلايا الجذعية الوسيطة لنخاع العظم (BM-MSCs) تدريجيا من قبل الناس لإمكانية الوصول إليها وبعض النزاعات الأخلاقية1 ، والتي تعتبر المعيار الذهبي للبحث السريري على الرغم من أنواع الخلايا الأخرى2. العلاجات القائمة على BM-MSCs جذابة أيضا لعدد متزايد من الباحثين نظرا لقدرتها الفريدة على تعديل الاستجابات المناعية والالتهابية وإصلاح الأنسجة المصابة عن طريق التمايز أو آليات paracrine3.
تشير الحويصلات خارج الخلية (EVs) ، كما تؤيد الجمعية الدولية للحويصلات خارج الخلية (ISEV)4 ، إلى الجسيمات الكلية ذات البنية ثنائية الطبقة الدهنية التي يتم إطلاقها بشكل طبيعي من الخلايا. مع الاكتشافات الحديثة لمحتويات مختلفة مثل البروتينات والدهون والمواد الوراثية (على سبيل المثال ، miRNA ، و mRNA ، وجزيئات الحمض النووي ، بالإضافة إلى الحمض النووي الريبي الطويل غير المشفر) في المركبات الكهربائية من أنواع مختلفة من الخلايا5 ، تم التعرف على أدوارها الحاسمة في الاتصال الخلوي والتنظيم اللاجيني6. كبديل جديد لخلايا الأم ، تم تطبيق EVs في العلاج المناعي والطب التجديدي من خلال دراسات في الجسم الحي ، والتي تعمل كأساس للبحث المستمر قبل السريري والتجارب السريرية للمتابعة7.
ومع ذلك ، في الوقت الحاضر ، لا تزال معظم الدراسات حول فعالية زرع BM-MSCs والمركبات الكهربائية المشتقة منها على مستوى الصغيرة ، والتي لا تكفي لتوفير الأدلة اللازمة للترجمة السريرية. وبالتالي ، من الملح للغاية إجراء بحث قبل السريري حول زرع BM-MSCs والمركبات الكهربائية المشتقة منها على مستوى الكبيرة مثل الخنازير.
تم الإبلاغ عن وجود الخلايا الجذعية الجذعية بأعداد منخفضة للغاية في نخاع العظام ، وهو ما يمثل 0.01٪ فقط إلى 0.001٪ من إجمالي الخلايا8. ومع ذلك ، فإن الإعطاء قبل السريري للخلايا الجذعية الجذعية BM يتطلب عددا كبيرا من الخلايا (≥107 لكل)9 ؛ كمية المركبات الكهربائية المطلوبة أكبر ، حيث يبلغ متوسط جرعتها 0.25 مجم من البروتين لكل كيلوغرام من وزن الجسم في الخنازير10. لتحقيق هذه الأعداد الكبيرة ، هناك حاجة ملحة لطريقة آمنة وفعالة لعزل واستزراع الخلايا الجذعية الجذعية من نخاع عظم الخنازير لتحقيق توسعها الهائل في المختبر والحصول على سياراتها الكهربائية بتركيز بروتين عال لاحقا.
حتى الآن ، هناك طرق مختلفة لعزل BM-MSCs والمركبات الكهربائية المشتقة منها. تشمل الطرق الحالية لعزل BM-MSCs الزراعة المباشرة لخلايا نخاع العظام (BMCs) 11 ، والطرد المركزي المتدرج للكثافة ، وفرز الملصقات الجزيئية لسطح الخلية ، وفحص قياس التدفق الخلوي. تم الإبلاغ عن أن فرز الملصقات الجزيئية لسطح الخلية وفحص قياس التدفق الخلوي يؤدي إلى انخفاض في معدل التصاق الخلايا ، وزيادة في معدل الوفيات لمدة 24 ساعة ، وتثبيط الانتشار12 ، في حين أن الثقافة المباشرة ل BMCs يمكن أن تؤدي إلى عدد كبير من الخلايا المكونة للدم المختلطة. لذلك ، يتم الآن استخدام الطرد المركزي المتدرج للكثافة بشكل شائع للحصول على BM-MSCs. تشمل الطرق الحالية لعزل المركبات الكهربائية عن المواد الطافية للخلايا الطرد المركزي الفائق ، والترشيح الفائق ، وهطول الأمطار البوليمر ، واستبعاد الحجم13. بالمقارنة مع الطرق الأخرى ، يتميز الطرد المركزي الفائق بالتكلفة المنخفضة وسهولة الاستخدام والتوافق مع التحضير بكميات كبيرة دون معالجة مسبقة معقدة ، والذي كان "المعيار الذهبي" لفصل EV14. ومع ذلك ، يوجد عدم تجانس كبير في الكواشف والتقنيات عبر المختبرات المختلفة أثناء العملية3،15 ، مما قد يكون مضللا للقراء. تشرح هذه المقالة سلسلة من الخطوات المتسلسلة لعزل pBM-MSCs و EVs المشتقة منها بالتفصيل ، وتثبت نتائج التحديد اللاحقة أن الطريقة ممكنة للحصول على pBM-MSCs و EVs لمزيد من التحليل في البحث قبل السريري. نأمل أن يوفر هذا العمل المنهجي أساسا منهجيا للباحثين المشاركين في التقييم قبل السريري لزرع pBM-MSCs والمركبات الكهربائية المشتقة منها ، بحيث يمكن إجراء التجارب السريرية في أسرع وقت ممكن.
Protocol
وفقا لدليل رعاية واستخدام المختبر الذي نشرته المعاهد الوطنية للصحة بالولايات المتحدة الأمريكية ، تمت الموافقة على جميع الإجراءات التجريبية من قبل اللجنة المؤسسية لرعاية واستخدامه (IACUC) ، مستشفى فواي ، الأكاديمية الصينية للعلوم الطبية.
1. التحضير قبل الجراحة للحيوانات
- احصل على خنازير صينية صغيرة بالغة (30 ± 5 كجم) في حوالي 12 شهرا من معهد علم ، الأكاديمية الصينية للعلوم ، وقم بإيوائها في مرافق المركز التجريبي للحيوان ، مستشفى فواي ، قبل أسبوعين على الأقل. قم بإجراء عمليات تفتيش قبل الجراحة مثل فحوصات الدم الروتينية للتأكد من صحة.
- نظف واحلق جلد منطقة الفخذ في الخنزير الصغير في اليوم السابق للعملية. لتجنب الشفط ، قم بصيام الخنزير الصغير لمدة 12 ساعة قبل استخراج نخاع العظم.
2. التحضير لعزل الخلايا وزراعتها
- استخدم بيركول (1.130 جم / مل) لعزل الخلايا الجذعية الوسيطة من نخاع العظام. امزج محلول المرق مع 10x PBS المركز بنسبة 9: 1 للحصول على وسط متساوي التوتر. ثم امزج الوسط متساوي التوتر مع PBS بنسبة 3: 2 للحصول على محلول بيركول 60٪ (1.077 جم / مل) ، والذي يمكن استخدامه كحل فصل نهائي لعزل pBM-MSCs.
- قم بإعداد Dulbecco's Medium المعدل من Iscove (IMDM) مع مصل بقري للجنين بنسبة 10٪ و 1.0٪ بنسلين ستربتومايسين للحصول على وسيط كامل. سخن الوسط الكامل و PBS في حمام مائي 37 درجة مئوية لزراعة الخلايا اللاحقة.
3. التخدير للحيوانات
- يجب تطبيق التخدير العام مع الكيتامين (10 ملغ/كغ) والزيلازين (2 ملغ/كغ) عن طريق الحقن العضلي. قم بإجراء التنبيب الرغامي بسرعة عندما يكون لدى الخنزير الصغير تنفس بطيء ونشاط أقل للأطراف ، والحفاظ على التنفس التلقائي لمنع فشل التنبيب.
- إجراء صيانة التخدير عن طريق استنشاق 2٪ إيزوفلوران ، مع الأكسجين (1.5 لتر / دقيقة) كغاز ناقل. أثناء التخدير ، راقب معدل ضربات القلب والتنفس وتشبع الأكسجين في الدم للخنزير الصغير في الوقت الفعلي.
4. استخراج نخاع العظم من الخنزير الصغير
- ضع الخنزير الصغير في وضع جانبي. لضمان كمية كافية من نخاع العظم لزراعة الخلايا اللاحقة ، حدد موقع نقطة ثقب نخاع العظم عند عظم الفخذ القريب من الخنزير الصغير (الشكل 1). تطهير ولف جلد منطقة البزل قبل إجراء العملية.
- شد الجلد حول نقطة البزل باليد غير المهيمنة ، واثقب إبرة خزعة نخاع العظم عموديا عند النقطة باليد المهيمنة. عند الشعور بالإبرة في ملامسة للعظم القشري ، قم بتدوير المقبض برفق إلى اليسار واليمين لحفر الإبرة. عندما تدخل الإبرة إلى تجويف نخاع العظم ، غالبا ما يكون هناك شعور بفقدان المقاومة.
- بعد وضع الثقب في مكانه ، اسحب الإبرة الأساسية. ثم قم بتوصيل حقنة معقمة سعة 50 مل يمكن التخلص منها بنهاية الإبرة الخارجية ، واشطف الجدار الداخلي للحقنة بالهيبارين مسبقا.
- استخرج 20 مل من نخاع العظم ببطء وانقلها إلى أنبوب طرد مركزي معقم سعة 50 مل بعناية.
- عند اكتمال الإجراء ، اسحب الإبرة وقم بإزالة الستارة. قم بتطهير موقع البزل واضغط عليه لمدة 20 دقيقة للإرقاء.
- قم بإخراج الخنزير الصغير بعد استعادة التنفس التلقائي. عندما يكون مستيقظا تماما مع حرية حركة الأطراف ، أعد الخنزير الصغير إلى القفص لمواصلة التغذية.
5. عزل الخلايا الجذعية الوسيطة من نخاع العظام
- أضف حجما متساويا من PBS المسخن مسبقا إلى نخاع العظم واخلطه جيدا. ثم استخدم ماصة معقمة لنقل 20 مل من نخاع العظم المخفف فوق مستوى محلول التدرج الكثافة 60٪ بنسبة حجم 1: 1 في أنبوب طرد مركزي معقم سعة 50 مل بعناية.
- جهاز الطرد المركزي للأنبوب عند 600 × جم (التسارع (ACC) = 5 ، التباطؤ (DEC) = 5) لمدة 20 دقيقة في درجة حرارة الغرفة (RT).
ملاحظة: يتم تشكيل أربع مراحل في الأنبوب بعد الطرد المركزي ، بما في ذلك مرحلة المصل ، ومرحلة الخلية أحادية النواة ، والمرحلة المتوسطة لتدرج الكثافة ، ومرحلة الترسيب من أعلى إلى أسفل. مرحلة الخلية أحادية النواة عبارة عن طبقة ندفية رقيقة بين المصل ووسط التدرج الكثافة. توجد الخلايا الجذعية الوسيطة المشتقة من نخاع العظم في هذه المرحلة. - اسحب مرحلة الخلية أحادية النواة إلى أنبوب طرد مركزي معقم سعة 15 مل ، واغسله مرتين باستخدام PBS عند 800 × جم لمدة 5 دقائق.
- أعد تعليق الخلايا المغسولة في 2 مل من الوسط الكامل وزرع الخلايا المعلقة في قارورة ثقافة خلية 175 سم2 بكثافة 3-5 × 105 / مل.
ملاحظة: يمكن رؤية جميع الإجراءات المذكورة أعلاه لعزل الخلايا الجذعية الوسيطة في الشكل 2.
6. زراعة الخلايا الجذعية الوسيطة في المختبر
- احتضان قارورة الاستزراع عند 37 درجة مئوية في جو رطب مشبع بنسبة 5٪ ثاني أكسيدالكربون. هز قارورة المزرعة برفق كل 24 ساعة لمنع النمو الملتصق للخلايا الجذعية المكونة للدم المترسبة ، ومراقبة نمو الخلايا ومورفولوجيتها وتلوثها تحت المجهر.
- استبدل وسط الثقافة لأول مرة بعد 3 أيام ، ثم قم بتغيير الوسيط كل 2-3 أيام. عندما تصل مستعمرات الخلايا إلى التقاء 80٪ -90٪ ، قم بزراعة الخلايا بنسبة 1: 2.
7. التمايز الخشبي ، العظمي ، والغضروفي ل pBM-MSCs
- مقايسة التمايز الشحمية
- قم بإعداد وسيط التمايز الحممي A (Medium A) و B (Medium B) ل BM-MSCs وفقا لتعليمات المجموعة. يمكن العثور على معلومات محددة حول المجموعة في جدول المواد.
- أضف 1 مل من الجيلاتين 0.1٪ إلى الطبق المكون من ستة آبار ورجه برفق حتى يتمكن من تغطية قاع كل بئر بالتساوي. ثم ضع الطبق المكون من ستة آبار في مقعد نظيف أو حاضنة CO2 لمدة 30 دقيقة على الأقل.
- بعد 30 دقيقة ، قم بشفط الجيلاتين وأضف 2 مل من الوسط العام الكامل لكل بئر. ثم زرع pBM-MSCs في صفيحة من ستة آبار بكثافة خلية 2 × 104 خلايا / سم2. بعد ذلك ، قم باحتضان اللوحة عند 37 درجة مئوية في رطوبة مشبعة تبلغ 5٪ ثاني أكسيدالكربون 2.
- عندما تصل الخلايا إلى التقاء 100٪ ، قم بإزالة الوسط الكامل بعناية وأضف 2 مل من Medium A إلى كل بئر من اللوحة. بعد 3 أيام ، قم بإزالة الوسط A من الطبق وأضف 2 مل من Medium B إلى كل بئر.
- بعد الحفاظ على 1 يوم ، قم بإزالة Medium B واستبدله ب Medium A للحث. وفقا لطريقة "متوسط أ لمدة 3 أيام ، متوسط ب لمدة يوم واحد" ، استخدم المتوسط أ و ب بالتتابع للحث.
- راقب حالة الخلية كل يوم خلال الفترة. إذا تقلصت الخلايا أو ماتت أثناء عملية تحريض الوسط A ، فاستبدلها ب Medium B في الوقت المناسب حتى تتعافى حالة الخلية.
- كرر عملية الحث والصيانة ، واستعد للتلوين عند ملاحظة قطرات دهون كافية بحجم مناسب تحت المجهر.
- قم بإزالة الوسط للتمايز المادي في اللوحة المكونة من ستة آبار ، واغسلها ب 1x PBS برفق. أضف 2 مل من محلول بارافورمالدهيد 4٪ إلى كل بئر وثبته لمدة 30 دقيقة في RT.
- قم بإزالة مثبت بارافورمالدهايد واغسله ب 1x PBS مرتين أو ثلاث مرات لضمان إزالة المثبت جيدا. أضف 2 مل من صبغة Oil Red O إلى كل بئر وصمة لمدة 30 دقيقة في RT.
- قم بإزالة صبغة Oil Red O واغسلها ب 1x PBS مرتين أو ثلاث مرات. أضف 2 مل من 1x PBS إلى كل بئر ، ثم لاحظ تأثير التمايز الشحمي تحت المجهر.
- مقايسة التمايز العظمي
- قم بإعداد الوسط الكامل للتمايز العظمي وفقا لتعليمات المجموعة.
- اتبع الخطوات 7.1.2-7.1.3 لزراعة واستزراع pBM-MSCs.
- عندما تصل الخلايا إلى 70٪ من التقاء ، قم بإزالة الوسط الكامل العام بعناية وأضف 2 مل من الوسط لتمايز العظم إلى كل بئر من اللوحة.
- قم بالتغيير إلى وسط التمايز العظمي الطازج كل 3 أيام. استمر في التحريض لمدة 2-4 أسابيع ، واستعد للتلطيخ بصبغة Alizarin Red عندما تظهر عقيدات كالسيوم الواضحة أثناء تكوين العظم.
- قم بإزالة وسيط التمايز العظمي في اللوحة المكونة من ستة آبار ، واغسلها باستخدام 1x PBS برفق. أضف 2 مل من محلول بارافورمالدهيد 4٪ إلى كل بئر وثبته لمدة 30 دقيقة في RT.
- قم بإزالة مثبت بارافورمالدهايد واغسله ب 1x PBS مرتين أو ثلاث مرات لضمان تنظيف المثبت جيدا. أضف 2 مل من صبغة Alizarin Red إلى كل بئر وصمة عار لمدة 10 دقائق في RT.
- قم بإزالة صبغة Alizarin Red واغسلها ب 1x PBS مرتين أو ثلاث مرات. أضف 2 مل من 1x PBS إلى كل بئر ، ثم لاحظ تأثير التمايز العظمي تحت المجهر.
- مقايسة التمايز الغضروفي
- قم بإعداد الخلطة الجاهزة للتمايز الغضروفي وفقا لتعليمات المجموعة.
- انقل 3-4 × 105 pBM-MSCs إلى أنبوب طرد مركزي معقم سعة 15 مل. جهاز طرد مركزي عند 250 × جم لمدة 4 دقائق عند 20 درجة مئوية.
- قم بإزالة المادة الطافية وأضف 0.5 مل من الخلطة المسبقة لإعادة تعليق الحبيبات التي تم الحصول عليها عن طريق الطرد المركزي في الخطوة السابقة ، ثم جهاز الطرد المركزي عند 150 × جم لمدة 5 دقائق عند 20 درجة مئوية. كرر هذه الخطوة لغسل الخلايا مرة أخرى.
- تحضير الوسط الكامل للتمايز الغضروراوي.
- أعد تعليق الخلية التي تم الحصول عليها في الخطوة السابقة ب 0.5 مل من الوسط الكامل وأجهزة الطرد المركزي عند 150 × جم لمدة 5 دقائق عند 20 درجة مئوية.
- قم بفك غطاء أنبوب الطرد المركزي لتسهيل تبادل الغازات. ضعه في وضع مستقيم في حاضنة عند 37 درجة مئوية ، و 5٪ ثاني أكسيد الكربون2 ، والرطوبة المشبعة.
- عندما تبدو الخلايا وكأنها تتجمع (عادة بعد 24-48 ساعة ، اعتمادا على الوضع الفعلي) ، قم بنقر الجزء السفلي من أنبوب الطرد المركزي لجعل كرات الغضروف تنفصل عن القاع وتعلق في الوسط.
- قم بالتغيير إلى وسط كامل طازج للتمايز الغضروفي كل 2-3 أيام. استمر في الحث حتى تتشكل كرات الغضروف التي يبلغ قطرها 1.5-2 مم في الأنبوب ، ثم قم بإعداد أقسام للتلطيخ.
- تحضير أقسام البارافين من كرات الغضروف وفقا للخطوات الروتينية للتجارب المرضية. أضف صبغة أليسيا الزرقاء إلى الأقسام المنزوع الشمع وصمة عار عند 37 درجة مئوية لمدة 1 ساعة.
- اشطف الشريحة بالماء الجاري لمدة 5 دقائق ، ثم لاحظ تأثير تلطيخ أليسيا الأزرق تحت المجهر بعد التجفيف.
8. تحديد النمط الظاهري للخلية عن طريق قياس التدفق الخلوي
- عندما تصل مستعمرات الخلايا إلى التقاء 80٪ -90٪ عند الممرات 3-5 ، قم بإزالة وسط الثقافة واغسل الخلايا مرتين باستخدام PBS المسخن مسبقا. ثم هضم الخلايا ب 3-4 مل من 0.25٪ تربسين / EDTA واحتضانها عند 37 درجة مئوية في جو مرطب مشبع بنسبة 5٪ ثاني أكسيد الكربون2 لمدة 2-3 دقائق حتى يتم فصلها عن قاع القارورة تحت المجهر.
- احصد الخلايا بوسط كامل سعة 10 مل وانقل معلق الخلية إلى أنبوب طرد مركزي معقم سعة 15 مل. قم بالطرد المركزي لتعليق الخلية عند 800 × جم لمدة 5 دقائق في RT. تخلص من المادة الطافية واغسل الخلايا ب 4 درجات مئوية PBS.
- أعد تعليق الخلايا إلى 10 مل مع 4 درجات مئوية PBS. ينقسم تعليق الخلية إلى تسع مجموعات بحجم 1 مل في كل أنبوب دقيق سعة 1.5 مل ، يسمى التحكم السلبي ، والتحكم في النمط المتنظير FITC ، والتحكم في النمط النظير PE ، والتحكم في النمط المتنظير APC ، و CD105 ، و CD29 ، و CD90 ، و CD14 ، و CD45 ، على التوالي. تأكد من أن عدد الخلايا في كل أنبوب دقيق يتراوح بين 1 × 105 و 1 × 106.
- قم بالطرد المركزي للتعليق عند 800 × جم لمدة 5 دقائق عند 4 درجات مئوية ، وأعد تعليق الخلايا في كل أنبوب دقيق ب 100 ميكرولتر من 4 درجات مئوية PBS مرة أخرى. باستثناء مجموعة التحكم السلبية ، أضف 5 ميكرولتر من التحكم في النمط المتماثل المقابل (FITC و PE و APC Mouse IgG1 kappa Isotype Control) والأجسام المضادة (CD105 و CD29 و CD90 و CD14 و CD45 الجسم المضاد أحادي النسيلة CD45) لقياس التدفق الخلوي لكل أنبوب دقيق وفقا للترتيب الوارد في الخطوة 8.3. تخلط بلطف وتحتضن لمدة 1.5 ساعة عند 4 درجات مئوية في الظلام.
- أضف 1 مل من 4 درجات مئوية PBS إلى كل أنبوب دقيق وجهاز طرد مركزي عند 300 × جم لمدة 10 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية وأضف 200 ميكرولتر من 4 درجات مئوية PBS لإعادة تعليق الخلايا.
- اختبر ما لا يقل عن 10,000 خلية على قياس التدفق الخلوي بعد تصفية تعليق الخلية16 وتحليل البيانات باستخدام برنامج قياس التدفق الخلوي.
9. عزل الحويصلات خارج الخلية (EVs) المشتقة من الخلايا الجذعية الوسيطة لنخاع عظم الخنازير
- عندما يصل التقاء pBM-MSCs إلى 80٪ -90٪ ، تخلص من المادة الطافية واغسل الخلايا باستخدام PBS 2x. ثم أضف 25 مل من IMDM الخالي من المصل إلى كل قارورة مزرعة واستمر في الحضانة عند 37 درجة مئوية في جو مرطب بنسبة 5٪ ثاني أكسيد الكربون2 لمدة 48 ساعة.
- اجمع المادة الطافية للخلية (الوسط المكيف ، سم) في أنبوب طرد مركزي سعة 50 مل وجهاز طرد مركزي عند 300 × جم لمدة 10 دقائق عند 4 درجات مئوية لإزالة بقايا الخلية.
- اجمع المادة الطافية مرة أخرى في أنبوب طرد مركزي آخر سعة 50 مل. قم بعزل المركبات الكهربائية في أسرع وقت ممكن بعد جمع المادة الطافية. للتخزين طويل الأمد، قم بتخزين المادة الطافية في الثلاجة عند -80 درجة مئوية لمنع فقدان المركبات الكهربائية.
- جهاز الطرد المركزي المادة الطافية في الخطوة 9.3 عند 2,000 × جم لمدة 20 دقيقة عند 4 درجات مئوية.
- انقل المادة الطافية إلى أنبوب معقم يستخدم في أجهزة الطرد المركزي عالية السرعة وأجهزة الطرد المركزي عند 16,500 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
- انقل المادة الطافية مرة أخرى إلى أنبوب طرد مركزي فائق ، وجهاز طرد مركزي عند 120.000 × جم لمدة 70 دقيقة على الأقل عند 4 درجات مئوية ، باستخدام دوار بزاوية ثابتة.
- تخلص من المادة الطافية تماما. أضف 1 مل من 4 درجات مئوية PBS إلى كل أنبوب طرد مركزي فائق وأعد تعليق هطول الأمطار باستخدام ماصة دقيقة. امزج المحلول من نفس المجموعة في أنبوب طرد مركزي فائق ، ثم أضف 4 درجات مئوية PBS لجعل الحجم أكثر من 3/4 من الأنبوب.
- جهاز طرد مركزي عند 120،000 × جم لمدة 60 دقيقة عند 4 درجات مئوية وإزالة المادة الطافية قدر الإمكان.
- أعد تعليق المرسب باستخدام PBS المعقم مرة أخرى ، وقم بتخزين المركبات الكهربائية في ثلاجة -80 درجة مئوية.
ملاحظة: يمكن تحديد كمية PBS لإعادة التعليق على أنها 100 ميكرولتر لهطول الأمطار من كل قارورتين استزراعية مقاس 175 سم2 . يتم عرض جميع الخطوات المذكورة أعلاه لعزل المركبات الكهربائية في الشكل 3 بشكل منهجي.
10. تحديد المركبات الكهربائية عن طريق المجهر الإلكتروني للإرسال (TEM) ، وتحليل تتبع الجسيمات النانوية (NTA) ، والنشاف الغربي
- ضع عينة المركبات الكهربائية على الجليد بعد إذابتها في حمام مائي 25 درجة مئوية ، ثم خفف إلى نصف التركيز السابق باستخدام PBS لاكتشاف NTA17.
- ماصة 10 ميكرولتر من العينة على الشبكة النحاسية ، اتركها تستقر لمدة 1 دقيقة ، وتمتص السائل العائم بورق الترشيح. ثم أضف 10 ميكرولتر من حمض الفوسفوتونغستيك إلى الشبكة النحاسية ، واتركها تقف لمدة 1 دقيقة ، وامتصاص السائل الزائد.
- بعد التجفيف لبضع دقائق في RT ، قم بإجراء التصوير المجهري الإلكتروني بشرط جهد تسريع 100 كيلو فولت18.
- قم بتعليق عينة المركبات الكهربائية من الخطوة 9.9 في المخزن المؤقت لتحلل RIPA (25 ملي تريس· حمض الهيدروكلوريك (الرقم الهيدروجيني 7.6) ، 150 ملي كلوريد الصوديوم [كلوريد الصوديوم] ، 1٪ نونوكلي بولي إيثوكسيل ثانول (NP-40) ، 1٪ ديوكسي كولات الصوديوم ، 0.1٪ كبريتات دوديسيل الصوديوم (SDS) ، 1 ملي مولار فينيل ميثان سولفونيل فلوريد (PMSF) ، 1x مثبط البروتياز) ، والكشف عن علامات محددة للمركبات الكهربائية مثل Alix و TSG101 و CD81 و CD63 بواسطة النشاف الغربي19.
النتائج
إنشاء الخلايا الجذعية الوسيطة لنخاع عظم الخنازير
تم عزل الخلايا الجذعية الوسيطة المشتقة من نخاع عظم الخنازير بنجاح وزراعتها في المختبر ، ويمكن رؤية مورفولوجيا pBM-MSCs في أيام مختلفة في الشكل 4. في الثقافة الأولية ل pBM-MSCs ، أظهرت الملاحظة المجهرية أن التصاق الخلايا حدث بعد يوم واحد من الزراعة ، وعادة ما تكون الخلايا الملتصقة مستديرة الشكل. ظلت pBM-MSCs الأولية بشكل عام في مرحلة الهدوء لمدة 3 أيام بعد الزراعة ، وبدأ تكاثر الخلايافي اليوم الرابع. تغير مورفولوجيا الخلية من نوع دائري إلى مغزل ، متعدد الأطراف ، أو نوع نجمي بعد الانتشار ، وتكون النوى مركزية ، مع وجود نوى مزدوجة في بعض الخلايا. تشكلت مستعمرات الخلايا بعد 7-9 أيام من بدء تكاثر الخلايا ، ويمكن تحقيق التقاء الخلايا بنسبة 80٪ -90٪ في 12-14 يوما. أظهرت الملاحظة المجهرية أن الخلايا الملتصقة نمت كمستعمرات متناثرة وتم ترتيبها في نمط دوامي.
تم تسريع تكاثر الخلايا بشكل كبير بعد المرور ، ويمكن الوصول إلى التقاء 80٪ -90٪ في غضون أسبوع. كان مورفولوجيا الخلية متجانسة على شكل مغزل من المقطع الثاني ، تشبه الخلايا الليفية ، مع نسبة طول إلى عرض تبلغ حوالي 2-3: 1. إذا كانت الخلايا متمايزة ، فقد تظهر متعددة الأضلاع أو على شكل نجمة. بعد المرور ، لم تعد الخلايا تنمو كمستعمرات متناثرة ، ولكن بشكل متساو وشعاعي في ترتيب متوازي.
تحديد إمكانات تمايز الخلايا عن طريق التلوين
في مقايسة التمايز الشحمي ، أظهر تلطيخ Oil Red O أن قطرات دهنية مستديرة برتقالية حمراء بأحجام مختلفة ظهرت حول النواة (الشكل 5 أ) ؛ في مقايسة التمايز العظمي ، أظهر تلطيخ أليزارين الأحمر عقيدات حمراء على سطح الخلية (الشكل 5 ب) ، والذي كان ناتجا عن تفاعل اللون مع أملاح الكالسيوم المترسبة بواسطة بانيات العظم المتمايزة عن pBM-MSCs. في مقايسة التمايز الغضروفي ، أظهر تلطيخ أليسيا الأزرق أن قسم الأنسجة بالكامل كان أزرق (الشكل 5 ج) ، والذي كان ناتجا عن تلطيخ عديدات السكاريد المخاطية الحمضية الداخلية في كرات الغضاريف.
تحديد النمط الظاهري للخلية عن طريق قياس التدفق الخلوي
تم إجراء فحوصات لعلامات سطح الخلية لإنشاء نمط ظاهري من pBM-MSCs. من نتائج قياس التدفق الخلوي (الشكل 6) ، تم التعبير عن ثلاث علامات إيجابية مثل CD105 و CD29 و CD90 بشكل كبير على سطح pBM-MSCs ، وهو ما يمثل 96.5٪ و 99.8٪ و 92٪ على التوالي (الشكل 6A-C). ومع ذلك ، كان التعبير عن CD14 و CD45 سلبيا (الشكل 6D ، E). وفي الوقت نفسه ، كانت نتائج ضوابط النمط المتماثل المقابلة كلها سلبية ، والتي تم تراكبها بالفعل في الشكل ، مما يستبعد إمكانية الارتباط غير المحدد للأجسام المضادة.
تحديد المركبات الكهربائية المشتقة من pBM-MSCs بواسطة NTA و TEM و Western Blotting
أظهرت نتيجة NTA أن متوسط حجم الجسيمات كان 126.9 نانومتر ، وهو ضمن نطاق المركبات الكهربائية. إلى جانب ذلك ، كان التركيز الأصلي لعينة المركبات الكهربائية 1.5 × 1010 جسيمات / مل ، ويمكن العثور على القيمة الدقيقة المخصصة للحجم في الشكل 7 أ. يظهر مخطط مسار الجسيمات في الشكل 7 ب ، موضحا أن الجسيمات كانت في حركة براونية غير منتظمة. علاوة على ذلك ، يمكن رؤية الحويصلة القرصية ، باعتبارها الهيكل الكلاسيكي للمركبات الكهربائية ، بوضوح تحت المجهر الإلكتروني بتكبير 50,000 مرة (الشكل 7 ج). أيضا ، تم الكشف عن تعبير علامات محددة للمركبات الكهربائية مثل Alix و TSG101 و CD81 و CD63 في العينة عن طريق النشاف الغربي (الشكل 7 د).
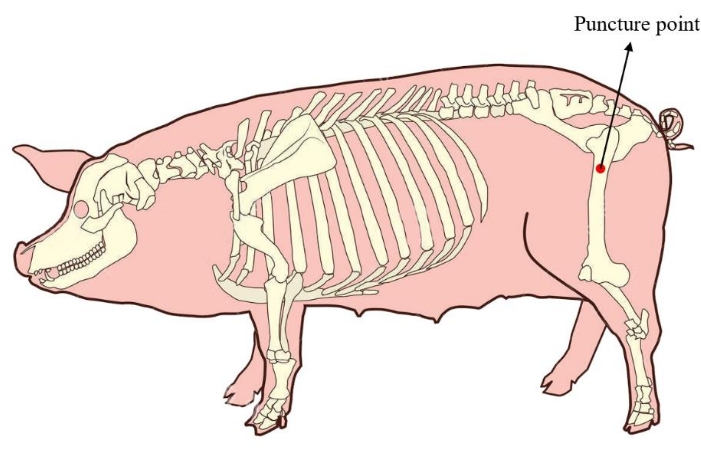
الشكل 1: نقطة ثقب نخاع العظم للخنزير الصغير. تظهر المنطقة الحمراء نقطة ثقب استخراج نخاع العظام ، وتقع عند عظم الفخذ القريب من الخنزير الصغير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
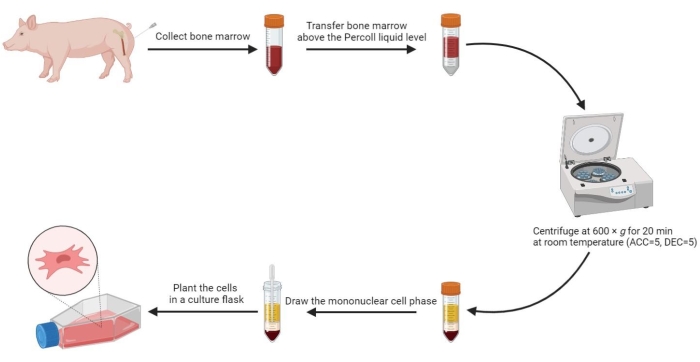
الشكل 2: عزل الخلايا الجذعية الوسيطة من نخاع عظم الخنازير. تظهر عملية عزل الخلايا الجذعية الوسيطة من نخاع عظم الخنازير في مخطط التدفق ، ويتم توضيح أربع مراحل سائلة بوضوح بعد الطرد المركزي المتدرج للكثافة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
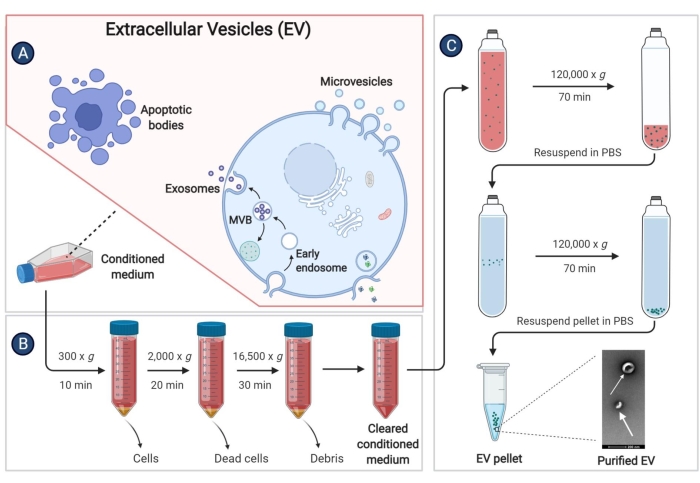
الشكل 3: عزل المركبات الكهربائية المشتقة من pBM-MSCs. يوضح الرسم التخطيطي خطوات محددة لعزل المركبات الكهربائية عن الوسط المكيف عن طريق الطرد المركزي الفائق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الخصائص المورفولوجية ل pBM-MSCs في أيام مختلفة. يمكن رؤية الخصائص المورفولوجية المماثلة ل pBM-MSCsفي اليوم 3 و 5 و 7 و 9 بعد الزراعة تحت الحقل المجهري 100x ، وقد تشكلت مستعمرات الخلايافي اليوم التاسع. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5. تحديد إمكانات التمايز ل pBM-MSCs عن طريق تلطيخ. (أ) مقايسة التمايز الغضروفي ، (ب) العظم ، و (ج) مقايسة التمايز الغضروفي ل pBM-MSCs ، على التوالي. يمكن تحديد إمكانات التمايز ل pBM-MSCs من خلال نتائج التلوين هذه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
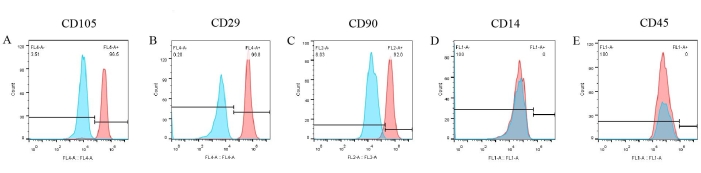
الشكل 6: نتائج تحديد pBM-MSCs عن طريق قياس التدفق الخلوي. يتم التعبير عن CD105 و CD29 و CD90 بشكل كبير على سطح pBM-MSCs ، وهو ما يمثل 96.5٪ و 99.8٪ و 92.0٪ على التوالي ، في حين أن التعبير عن CD14 و CD45 سلبي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
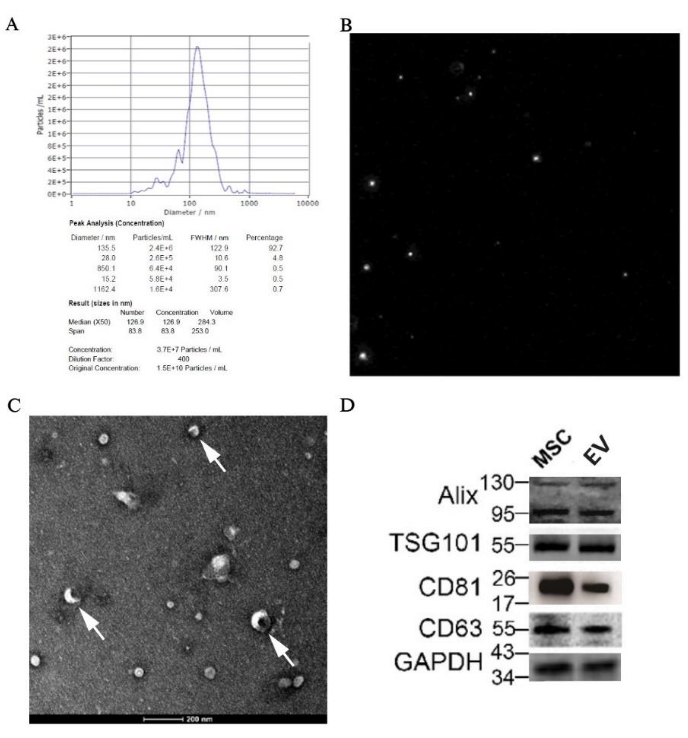
الشكل 7: نتائج تحديد المركبات الكهربائية المشتقة من pBM-MSCs بواسطة علم التشكل والبيولوجيا الجزيئية. (أ) نتيجة NTA للمركبات الكهربائية المشتقة من pBM-MSCs ، مع الرسم البياني لتوزيع حجم الجسيمات و (B) مخطط مسار الجسيمات ، على التوالي ؛ (ج) صورة TEM التي تم التقاطها بتكبير 50,000 ضعف، ويظهر السهم الأبيض التركيب الكلاسيكي للحويصلات القرصية. (د) التعبير عن علامات محددة للمركبات الكهربائية عن طريق النشاف الغربي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم وضع نقطة ثقب نخاع العظم التقليدية للخنازير الصغيرة عند القمة الحرقفية20. على الرغم من سهولة تحديد موقعه ، إلا أن كمية استخراج نخاع العظم محدودة21 (حوالي 5 مل فقط بشكل عام) ، لذلك من الصعب تلبية متطلبات عدد كبير من التوسعات في المختبر للزرع في الجسم الحي. في هذه الطريقة ، قمنا بإعادة وضع نقطة ثقب نخاع العظم إلى عظم الفخذ القريب ، ويمكن استخراج ما لا يقل عن 20 مل من نخاع العظم من هذا الموقع ، مما يضمن كمية كافية من pBM-MSCs لزراعة الخلايا اللاحقة.
محلولا الفصل الرئيسيان المستخدمان لعزل BM-MSCs عن طريق الطرد المركزي المتدرج الكثافة هما Percoll و Ficoll. يتكون Percoll من بولي فينيل بيروليدون السيليكون (PVP) ، وهو عامل فصل طرد مركزي متدرج غير سام وغير مزعج. ينتج عن ثابت الانتشار المنخفض ل Percoll تدرج كثافة مستقر نسبيا. لذلك ، يمكن عادة تحقيق فصل مرضي للخلايا في غضون عشرات الدقائق عند قوى الطرد المركزي المنخفضة (200-1000 × جم). تم الإبلاغ عن طريقة عزل pBM-MSCs باستخدام Ficoll سابقا21. بالمقارنة مع Ficoll ، تم استخدام Percoll تدريجيا نظرا لمزاياه المتمثلة في سهولة التشغيل ، واللزوجة المنخفضة ، وعدم السمية ، وعدم التسبب في تراكم الخلايا ، والتي يمكن أن تكمل الطرق الحالية لعزل pBM-MSCs.
في عزل وزراعة pBM-MSCs ، لا يمكن تجاهل بعض الخطوات الحاسمة. أولا ، يعد التقسيم الطبقي الناجح لمراحل السائل المختلفة بعد الطرد المركزي المتدرج الكثافة هو المفتاح لعزل pBM-MSCs المنقى. BM-MSCs ، كنوع من الخلايا أحادية النواة لنخاع العظام (BM-MNCs) ، لها ثقل نوعي مشابه لتلك الموجودة في الخلايا الليمفاوية والخلايا الوحيدة ، حوالي 1.075 جم / مل. الكثافة الأصلية ل Percoll هي 1.130 جم / مل ، وللحصول على طبقة الخلية التي تحتوي على BM-MSCs بنجاح بعد الطرد المركزي المتدرج للكثافة ، يجب تكوين محلول فصل تدرج متساوي التوتر بنسبة 60٪ (1.077 جم / مل) مسبقا وفقا لعلاقة بيركول للكثافة والتركيز22. وعلاوة على ذلك، تساهم ظروف الطرد المركزي المناسبة أيضا في نجاح التقسيم الطبقي. بالنظر إلى ثابت الانتشار المنخفض ل Percoll ، قمنا بالطرد المركزي لنخاع العظم المستخرج عند 600 × جم لمدة 20 دقيقة عند مستويات تسارع / تباطؤ منخفضة نسبيا (ACC = 5 ، DEC = 5) ، مما حقق تأثيرا طبقيا جيدا. ثانيا ، كثافة الزراعة المناسبة ضرورية أيضا لزراعة الخلايا. من أجل الحصول على عدد كاف من الخلايا الجذعية الجذعية (عادة أكثر من 107 لكل9) للزرع اللاحق ، نستخدم قوارير ثقافة 175 سم2 لزراعة الخلايا. في دراسة سابقة20 ، عادة ما تم زرع BM-MNCs التي تم الحصول عليها في قوارير استزراعية للزراعة بكثافة 5 × 105 / سم2. تم الإبلاغ عن أنه بعد الطرد المركزي المتدرج للكثافة ، يمكن الحصول على 2-3 × 107 BM-MNCs لكل 5 مل من نخاع عظم الخنازير23. لذلك ، في هذا البروتوكول ، نوصي بزراعة إجمالي BM-MNCs المعزولة من كل 20 مل من نخاع عظم الخنزير في قارورة استزراع 175 سم2 للحصول على كثافة مناسبة. ثالثا ، يجب تجنب الشوائب أثناء عزل واستزراع pBM-MSCs. عند سحب مرحلة الخلية أحادية النواة ، يجب عدم إدخال الماصة في مرحلة Percoll حتى لا تختلط مع السائل الفاصل. علاوة على ذلك ، بعد 24 ساعة من زراعة الخلايا ، يجب رج قارورة الثقافة برفق لتقليل التصاق خلايا الدم الحمراء.
أثناء عملية الطرد المركزي الفائق ، فإن المستويات العالية من تراكم البروتين وتلوث البروتين الدهني من خلال هذه الطريقة تضر حتما بالقياس الكمي والتحليل الوظيفي للمركباتالكهربائية 14. من أجل تقليل التلوث قدر الإمكان في هذه العملية ، يجب الاحتفاظ بعمق 5 مم من السائل في القاع في كل مرة عند نقل المادة الطافية قبل خطوة الطرد المركزي الفائق. وفي الوقت نفسه ، بعد الطرد المركزي الفائق الأول ، يمكن أن يؤدي تعليق الحبيبات في PBS المعقم ثم إجراء الطرد المركزي الفائق مرة أخرى إلى تقليل تلوث البروتين الدهني بشكل فعال.
على الرغم من أن الطرد المركزي المتدرج الكثافة والطرد المركزي الفائق قد تم استخدامهما على نطاق واسع في عزل BM-MSCs والمركبات الكهربائية المشتقة منها ، على التوالي ، فإن هاتين التقنيتين لهما أيضا حدودهما الخاصة. من ناحية أخرى ، فإن تقنية Percoll طويلة ومرهقة ، وقد تم الإبلاغ عن إنتاج عينة تركيز BM عبر جهاز تركيز الخلايا بجانب السرير كطريقة بديلة لعزل الخلايا الجذعيةالجذعية 24. من ناحية أخرى ، لا تتطلب طريقة الطرد المركزي الفائق فنيين مدربين تدريبا عاليا فحسب ، بل تتطلب أيضا معدات باهظة الثمن. لذلك ، قد يقدم التطبيق المشترك لتقنيتين أو أكثر استراتيجية معقولة لعزل أكثر كفاءة للمركباتالكهربائية 25. إلى جانب ذلك ، يحتاج تحديد pBM-MSCs والمركبات الكهربائية المشتقة منها أيضا إلى تحسين. على سبيل المثال ، وفقا للمعايير الدولية لتعريف الخلايا الجذعيةالجذعية 26 ، لا يزال التعبير عن بعض العلامات الإيجابية أو السلبية ، مثل CD73 و CD34 و HLA-DR ، مفقودا من نتائج تحديد الأنماط الظاهرية BM-MSC عن طريق قياس التدفق الخلوي في هذه الدراسة. بالإضافة إلى ذلك ، على الرغم من اتخاذ تدابير لتجنب التلوث أثناء عملية عزل المركبات الكهربائية ، نظرا لقيود مختبرنا ، فإننا غير قادرين على تقييم نقاء عينة المركبات الكهربائية للمساعدة في تحسين أعمال المتابعة.
تجمع هذه الدراسة بين طرق عزل pBM-MSCs والمركبات الكهربائية المشتقة منها بالتتابع ، والتي أثبتتها نتائج التحديد اللاحقة بشكل منهجي. على وجه الخصوص ، قمنا بتسليط الضوء على العمليات الرئيسية في هذه السلسلة من الخطوات ، وشرحنا بعض الظروف التجريبية المحددة التي يمكن أن تحل مشكلة عدم التجانس الموجودة في المختبرات المختلفة خلال هذه العملية إلى حد ما. يمكن استخدام هذا العمل المنهجي على نطاق واسع في الدراسات قبل السريرية حول فعالية زرع BM-MSCs والمركبات الكهربائية المشتقة منها ، والتي يمكن أن توفر أساسا تجريبيا بمستوى كاف للبحث السريري.
Disclosures
ليس لدى جميع المؤلفين تضارب في المصالح للإعلان عنه.
Acknowledgements
نشكر Yang Jianzhong و Wang Xuemin على مساهماتهم في عملية استخراج نخاع العظام. تم دعم هذا العمل من خلال منح من صندوق CAMS للابتكار للعلوم الطبية (CIFMS) [رقم المنحة 2016-I2M-1-009] ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم: 82070307 ؛ رقم: 81874461).
Materials
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
References
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved