Method Article
בידוד וזיהוי של תאי גזע מזנכימליים במח עצם חזירי והשלפוחיות החוץ-תאיות הנגזרות מהם
In This Article
Summary
מאמר זה מפרט שיטה לבידוד וזיהוי תאי גזע מזנכימליים של מח עצם חזירי (pBM-MSCs) ושלפוחיות חוץ-תאיות (EVs) הנגזרות מהם, ומספק בסיס מתודולוגי להערכה פרה-קלינית של יעילות ההשתלה של BM-MSCs וה-EVs הנגזרים מהם.
Abstract
עם התפתחות הטיפול בתאי גזע במחקר תרגומי ורפואה רגנרטיבית, תאי גזע מזנכימליים של מח עצם (BM-MSCs), כמעין תאי גזע פלוריפוטנטיים, מועדפים בשל זמינותם המיידית ובטיחותם המוכחת. דווח כי השתלת BM-MSCs מועילה מאוד לתיקון רקמות פגועות במחלות שונות, מה שעשוי להיות קשור לוויסות התגובות החיסוניות והדלקתיות באמצעות מנגנונים פרקריניים. שלפוחיות חוץ-תאיות (EVs), בעלות מבנה קרום שומני דו-שכבתי, נחשבות למתווכים העיקריים של ההשפעות הפרקריניות של תאי גזע. מוכרים בתפקידיהם המכריעים בתקשורת תאית ובוויסות אפיגנטי, EVs כבר יושמו in vivo לאימונותרפיה. עם זאת, בדומה לתאי האם שלו, רוב המחקרים על יעילות השתלת EVs עדיין נשארים ברמה של בעלי חיים קטנים, וזה לא מספיק כדי לספק ראיות חיוניות לתרגום קליני. כאן, אנו משתמשים בצנטריפוגה של שיפוע צפיפות כדי לבודד תאי מח עצם (BMC) ממח עצם חזירי בהתחלה, ומקבלים BM-MSCs חזיריים (pBM-MSCs) על ידי תרבית תאים לאחר מכן, המזוהים על ידי תוצאות התצפית תחת המיקרוסקופ, בדיקת התמיינות מושרה וזרימה ציטומטרית. יתר על כן, אנו מבודדים EVs שמקורם ב-pBM-MSCs בסופרנטנט התא על ידי אולטרה-צנטריפוגה, שהוכחה על ידי הטכניקות של מיקרוסקופ אלקטרונים הולכה (TEM), ניתוח מעקב אחר ננו-חלקיקים (NTA) וכתמים מערביים בהצלחה. בסך הכל, ניתן לבודד ולזהות ביעילות pBM-MSCs וה-EVs הנגזרים מהם על ידי הפרוטוקולים הבאים, שעשויים להיות בשימוש נרחב במחקרים פרה-קליניים על יעילות ההשתלה של BM-MSCs וה-EVs הנגזרים מהם.
Introduction
במהלך 10 השנים האחרונות, טיפול בתאי גזע הבטיח יתרונות גדולים לחולים הסובלים ממגוון מחלות ופציעות, כגון טראומה, מחלות נשימה ומחלות לב וכלי דם. עם ההתקדמות בתחום, תאי גזע מזנכימליים של מח עצם (BM-MSCs) מועדפים בהדרגה על ידי אנשים בשל נגישותם ומעט מחלוקות אתיות1, שנחשבו לסטנדרט הזהב למחקר קליני למרות סוגי תאים אחרים2. טיפולים המבוססים על BM-MSCs אטרקטיביים גם ליותר ויותר חוקרים בשל יכולתם הייחודית לווסת תגובות חיסוניות ודלקתיות ולתקן רקמות פגועות באמצעות התמיינות או מנגנונים פרקריניים3.
שלפוחיות חוץ-תאיות (EVs), כפישמאשרת האגודה הבינלאומית לשלפוחיות חוץ-תאיות (ISEV) 4, מתייחסות לסך החלקיקים בעלי מבנה דו-שכבתי של שומנים המשתחררים באופן טבעי מהתאים. עם הגילויים האחרונים של תכנים שונים כגון חלבונים, ליפידים וחומרים גנטיים (למשל, miRNA, mRNA, מולקולות DNA, כמו גם RNA ארוך שאינו מקודד) ב-EVs מסוגי תאים שונים5, הוכרו תפקידיהם המכריעים בתקשורת תאית ובוויסות אפיגנטי6. כתחליף חדשני לתאי האם, EVs יושמו באימונותרפיה וברפואה רגנרטיבית עם מחקרים in vivo, המשמשים כבסיס למחקר הפרה-קליני המתמשךולניסויים קליניים מעקב.
עם זאת, נכון לעכשיו, רוב המחקרים על יעילות ההשתלה של BM-MSCs וה-EVs הנגזרים מהם עדיין נשארים ברמה של בעלי חיים קטנים, מה שלא מספיק כדי לספק את הראיות הדרושות לתרגום קליני. כתוצאה מכך, דחוף ביותר לבצע מחקר פרה-קליני על השתלת BM-MSCs ו-EVs הנגזרים מהם ברמה של בעלי חיים גדולים כמו חזירים.
דווח כי MSCs נמצאים במספרים נמוכים ביותר במח העצם, המהווים רק 0.01% עד 0.001% מכלל התאים8. עם זאת, מתן פרה-קליני של BM-MSCs דורש מספר רב של תאים (≥107 לכל בעל חיים)9; כמות ה-EVs הנדרשת גדולה עוד יותר, שהמינון החציוני שלה הוא 0.25 מ"ג חלבון לק"ג משקל גוף בחזירים10. כדי להשיג את המספרים הגדולים הללו, יש צורך דחוף בשיטה בטוחה ויעילה לבודד ולתרבית MSCs ממח עצם חזיר כדי להשיג את התרחבותם המסיבית במבחנה ולרכוש את ה-EVs שלהם עם ריכוז חלבון גבוה לאחר מכן.
עד כה, ישנן שיטות שונות לבידוד BM-MSCs והרכבים החשמליים הנגזרים מהם. השיטות הנוכחיות לבידוד BM-MSCs כוללות שתילה ישירה של תאי מח עצם (BMCs)11, צנטריפוגה בצפיפות-שיפוע, מיון תווית מולקולרית על פני התא וסינון ציטומטריית זרימה. דווח כי מיון התווית המולקולרית של פני התא וסינון ציטומטריית זרימה מביאים לירידה בקצב הידבקות התאים, עלייה בתמותה של 24 שעות ועיכוב התפשטות12, בעוד שתרבית ישירה של BMCs יכולה לגרום למספר גבוה של תאים המטופויאטיים מעורבים. לכן, צנטריפוגה בשיפוע צפיפות משמשת כיום בדרך כלל להשגת BM-MSCs. השיטות הנוכחיות לבידוד EVs מסופרנטנטים תאיים כוללות אולטרה-צנטריפוגה, אולטרה-סינון, משקעים פולימריים ואי הכללת גודל13. בהשוואה לשיטות אחרות, לאולטרה-צנטריפוגה יש את היתרון של עלות נמוכה, קלות שימוש ותאימות להכנה בנפח גדול ללא טיפול מקדים מסובך, שהיה "תקן הזהב" להפרדת EV14. עם זאת, הטרוגניות גדולה קיימת בריאגנטים ובטכניקות במעבדות שונות במהלך התהליך 3,15, מה שעלול להטעות את הקוראים. מאמר זה מסביר בפירוט סדרה של שלבים עוקבים לבידוד pBM-MSCs ו-EVs הנגזרים מהם, ותוצאות הזיהוי הבאות מוכיחות כי השיטה אפשרית להשיג pBM-MSCs וה-EVs שלהם לניתוח נוסף במחקר פרה-קליני. אנו מקווים שעבודה שיטתית זו תוכל לספק בסיס מתודולוגי לחוקרים העוסקים בהערכה פרה-קלינית של השתלת pBM-MSCs וה-EVs הנגזרים מהם, כך שניתן יהיה לבצע ניסויים קליניים בהקדם האפשרי.
Protocol
על פי המדריך לטיפול ושימוש בחיות מעבדה שפורסם על ידי המכונים הלאומיים לבריאות, ארה"ב, כל הליכי הניסוי אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC), בית החולים פוואי, האקדמיה הסינית למדעי הרפואה.
1. הכנה טרום ניתוחית לבעלי החיים
- השיגו מיני-חזירים סיניים זכרים בוגרים (30 ± 5 ק"ג) בסביבות גיל 12 חודשים מהמכון לזואולוגיה, האקדמיה הסינית למדעים, ושיכנו אותם במתקנים של מרכז הניסויים לבעלי חיים, בית החולים פוואי, לפחות שבועיים מראש. בצע בדיקות טרום ניתוחיות כגון בדיקות דם שגרתיות כדי לוודא שבעלי החיים בריאים.
- נקו וגלחו את עור אזור הירך של המיני-חזיר יום לפני הניתוח. כדי למנוע שאיפה, צמו את המיני-חזיר למשך 12 שעות לפני שאיבת מח העצם.
2. הכנה לבידוד וטיפוח תאים
- השתמש בפרקול (1.130 גרם/מ"ל) כדי לבודד תאי גזע מזנכימליים ממח העצם. מערבבים את תמיסת המלאי עם PBS מרוכז פי 10 ביחס של 9:1 לקבלת מדיום איזוטוני. לאחר מכן מערבבים את המדיום האיזוטוני עם PBS ביחס של 3:2 כדי להשיג תמיסת פרקול 60% (1.077 גרם/מ"ל), שיכולה לשמש כתמיסת ההפרדה הסופית לבידוד pBM-MSCs.
- הכן את המדיום המותאם של Dulbecco (IMDM) של Iscove עם 10% סרום בקר עוברי ו-1.0% פניצילין-סטרפטומיצין לקבלת מדיום שלם. מחממים מראש את המדיום השלם ואת PBS באמבט מים של 37 מעלות צלזיוס לגידול תאים לאחר מכן.
3. הרדמה לבעלי חיים
- יש לתת הרדמה כללית עם קטמין (10 מ"ג/ק"ג) וקסילזין (2 מ"ג/ק"ג) תוך שרירית. בצע אינטובציה אנדוטרכיאלית במהירות כאשר למיני-חזיר יש נשימה איטית ופחות פעילות גפיים, ושמור על נשימה ספונטנית כדי למנוע אינטובציה כושלת.
- בצע תחזוקת הרדמה על ידי שאיפה של 2% איזופלורן, עם חמצן (1.5 ליטר לדקה) כגז הנשא. במהלך ההרדמה, עקוב אחר קצב הלב, הנשימה וריווי החמצן בדם של המיני-חזיר בזמן אמת.
4. חילוץ מח עצם מהמיני-חזיר
- הניחו את המיני-חזיר במצב רוחבי. כדי להבטיח כמות מספקת של מח עצם לתרבית תאים עוקבת, אתר את נקודת הניקוב של מח העצם בעצם הירך הפרוקסימלית של המיני-חזיר (איור 1). יש לחטא ולעטוף את עור אזור הניקוב לפני החלת הניתוח.
- הדק את העור סביב נקודת הניקוב ביד הלא דומיננטית, ונקב את מחט הביופסיה של מח העצם אנכית בנקודה עם היד הדומיננטית. כאשר מרגישים את המחט במגע עם עצם קליפת המוח, סובבו בעדינות את הידית ימינה ושמאלה כדי לקדוח את המחט. כאשר המחט נכנסת לחלל מח העצם, לעיתים קרובות יש תחושה של אובדן התנגדות.
- לאחר שהנקב נמצא במקומו, משוך את מחט הליבה. לאחר מכן חבר מזרק סטרילי חד פעמי של 50 מ"ל לקצה המחט החיצונית, ושטוף מראש את הדופן הפנימית של המזרק בהפרין.
- חלץ 20 מ"ל מח עצם לאט והעביר אותם לצינור צנטריפוגה סטרילי של 50 מ"ל בזהירות.
- בסיום ההליך, משוך החוצה את המחט והסר את הווילון. יש לחטא את מקום הניקוב וללחוץ עליו למשך 20 דקות להמוסטזיס.
- הוצא את המיני-חזיר לאחר שחזור הנשימה הספונטנית. כאשר הוא ער לחלוטין עם תנועה חופשית של גפיים, החזיר המיני לכלוב כדי להמשיך להאכיל.
5. בידוד תאי גזע מזנכימליים ממח העצם
- הוסף נפח שווה של PBS שחומם מראש למח העצם וערבב אותם היטב. לאחר מכן השתמש בפיפטה סטרילית כדי להעביר 20 מ"ל ממח העצם המדולל מעל רמת תמיסת השיפוע בצפיפות של 60% ביחס נפח של 1:1 בצינור צנטריפוגה סטרילי של 50 מ"ל בזהירות.
- צנטריפוגה של הצינור ב-600 x g (תאוצה (ACC) = 5, האטה (DEC) = 5) למשך 20 דקות בטמפרטורת החדר (RT).
הערה: ארבעה שלבים נוצרים בצינור לאחר צנטריפוגה, כולל שלב הסרום, שלב התא החד-גרעיני, שלב בינוני שיפוע צפיפות ושלב המשקעים מלמעלה למטה. שלב התא החד-גרעיני הוא שכבה פלוקולנטית דקה בין הסרום למדיום שיפוע הצפיפות. תאי גזע מזנכימליים שמקורם במח העצם ממוקמים בשלב זה. - משוך את שלב התא החד-גרעיני לתוך צינור צנטריפוגה סטרילי של 15 מ"ל, ושטוף פעמיים עם PBS ב-800 x גרם למשך 5 דקות.
- השעו מחדש את התאים השטופים ב -2 מ"ל של מדיום שלם ושתלו את התאים התלויים בבקבוק תרביתתאים בגודל 175 ס"מ בצפיפות של 3-5 x 105 / מ"ל.
הערה: ניתן לראות את כל ההליכים לעיל לבידוד תאי גזע מזנכימליים באיור 2.
6. טיפוח תאי גזע מזנכימליים במבחנה
- דגרו את בקבוק התרבות בטמפרטורה של 37 מעלות צלזיוס באווירה לחה רוויה של 5% CO2. יש לנער את בקבוק התרבית בעדינות כל 24 שעות כדי למנוע צמיחה דבוקה של תאי הגזע ההמטופויאטיים המשקעים, ולהתבונן בצמיחת תאים, מורפולוגיה וזיהום תחת מיקרוסקופ.
- החלף את מדיום התרבות בפעם הראשונה לאחר 3 ימים, ואז החלף את המדיום כל 2-3 ימים. כאשר מושבות התאים מגיעות למפגש של 80%-90%, תת-תרבית התאים ביחס של 1:2.
7. התמיינות אדיפוגנית, אוסטאוגנית וכונדרוגנית של pBM-MSCs
- בדיקת התמיינות אדיפוגנית
- הכן את מדיום ההתמיינות האדיפוגנית A (Medium A) ו-B (Medium B) עבור BM-MSCs בהתאם להוראות הערכה. מידע ספציפי על הערכה ניתן למצוא בטבלת החומרים.
- מוסיפים 1 מ"ל של 0.1% ג'לטין לצלחת שש הבארות ומנערים בעדינות כך שיוכל לכסות את תחתית כל באר באופן שווה. לאחר מכן הניחו את צלחת שש הבארות בספסל נקי או בחממת CO2 למשך 30 דקות לפחות.
- לאחר 30 דקות שואבים את הג'לטין ומוסיפים 2 מ"ל של מדיום שלם כללי לכל באר. לאחר מכן שתלו את ה-pBM-MSCs בצלחת שש הבארות בצפיפות תאים של 2 x 104 תאים/ס"מ2. לאחר מכן, דגרו את הצלחת בטמפרטורה של 37 מעלות צלזיוס בלחות רוויה של 5% CO2.
- כאשר התאים מגיעים למפגש של 100%, הסר את המדיום השלם בזהירות והוסף 2 מ"ל של מדיום A לכל באר בצלחת. לאחר 3 ימים, הוציאו את מדיום A מהצלחת והוסיפו 2 מ"ל של מדיום B לכל באר.
- לאחר תחזוקה של יום אחד, יש להסיר את מדיום B ולהחליף אותו במדיום A לאינדוקציה. על פי האופן של "בינוני A למשך 3 ימים, בינוני B ליום אחד", השתמש במדיום A ו- B ברצף לאינדוקציה.
- התבונן במצב התא כל יום במהלך התקופה. אם התאים מתכווצים או מתים במהלך תהליך האינדוקציה של מדיום A, החלף אותו במדיום B בזמן עד שמצב התא יתאושש.
- חזור על תהליך האינדוקציה והתחזוקה, והתכונן לצביעה כאשר נצפות מספיק טיפות שומן בגודל מתאים תחת המיקרוסקופ.
- הסר את המדיום להתמיינות אדיפוגנית בצלחת שש הבארות, ושטוף עם 1x PBS בעדינות. הוסף 2 מ"ל של תמיסת פרפורמלדהיד 4% לכל באר ותקן למשך 30 דקות ב-RT.
- הסר את הקיבוע הפרפורמלדהיד ושטוף עם 1x PBS פעמיים או שלוש כדי להבטיח שהקיבוע יוסר ביסודיות. הוסף 2 מ"ל צבע שמן אדום O לכל באר והכתים למשך 30 דקות ב-RT.
- הסר את צבע השמן האדום O ושטוף עם 1x PBS פעמיים או שלוש. הוסף 2 מ"ל של 1x PBS לכל באר, ולאחר מכן התבונן בהשפעת ההתמיינות האדיפוגנית במיקרוסקופ.
- בדיקת התמיינות אוסטאוגנית
- הכן את המדיום השלם להתמיינות אוסטאוגנית לפי הוראות הערכה.
- בצע את השלבים 7.1.2-7.1.3 כדי לשתול ולתרבית pBM-MSCs.
- כאשר התאים מגיעים למפגש של 70%, הסר את המדיום השלם הכללי בזהירות והוסף 2 מ"ל של מדיום להתמיינות אוסטאוגנית לכל באר בצלחת.
- החלף למדיום התמיינות אוסטאוגני טרי כל 3 ימים. המשיכו את האינדוקציה במשך 2-4 שבועות, והתכוננו להכתים בצבע אדום אליזרין כאשר מופיעים גושי סידן ברורים במהלך אוסטאוגנזה.
- הסר את המדיום להתמיינות אוסטאוגנית בצלחת שש הבארות, ושטוף עם 1x PBS בעדינות. הוסף 2 מ"ל של תמיסת פרפורמלדהיד 4% לכל באר ותקן למשך 30 דקות ב-RT.
- הסר את הקיבוע הפרפורמלדהיד ושטוף עם 1x PBS פעמיים או שלוש כדי להבטיח שהקיבוע ינוקה ביסודיות. הוסף 2 מ"ל של צבע אדום אליזרין לכל באר והכתים למשך 10 דקות ב- RT.
- הסר את הצבע האדום של אליזרין ושטוף עם 1x PBS פעמיים או שלוש. הוסף 2 מ"ל של 1x PBS לכל באר, ולאחר מכן התבונן בהשפעת ההתמיינות האוסטיאוגנית במיקרוסקופ.
- בדיקת התמיינות כונדרוגנית
- הכן את התערובת המוקדמת להתמיינות כונדרוגנית לפי הוראות הערכה.
- העבר 3-4 x 105 pBM-MSCs לצינור צנטריפוגה סטרילי של 15 מ"ל. צנטריפוגה ב-250 x גרם למשך 4 דקות ב-20 מעלות צלזיוס.
- הסר את הסופרנטנט והוסף 0.5 מ"ל של תערובת מוקדמת כדי להשעות מחדש את הגלולה שהתקבלה על ידי צנטריפוגה בשלב הקודם, ולאחר מכן צנטריפוגה ב-150 x גרם למשך 5 דקות ב-20 מעלות צלזיוס. חזור על שלב זה כדי לשטוף את התאים שוב.
- הכן את המדיום השלם להתמיינות כונדרוגנית.
- השעו מחדש את התא שהתקבל בשלב הקודם עם 0.5 מ"ל של מדיום שלם וצנטריפוגה ב -150 x גרם למשך 5 דקות ב -20 מעלות צלזיוס.
- נתק את מכסה צינור הצנטריפוגה כדי להקל על חילופי הגז. הנח אותו זקוף באינקובטור בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 ולחות רוויה.
- כאשר נראה שהתאים מצטברים (בדרך כלל לאחר 24-48 שעות, תלוי במצב בפועל), העבירו את החלק התחתון של צינור הצנטריפוגה כדי לגרום לכדורי הסחוס להתנתק מהתחתית ולתלות בתווך.
- החלף למדיום שלם טרי להתמיינות כונדרוגנית כל 2-3 ימים. המשיכו באינדוקציה עד שנוצרים כדורי סחוס בקוטר 1.5-2 מ"מ בצינור, ואז הכינו קטעים לצביעה.
- הכינו קטעי פרפין של כדורי סחוס על פי השלבים השגרתיים של ניסויים פתולוגיים. הוסף צבע כחול אליסיה לחלקים שהוסרו בשעווה והכתים בטמפרטורה של 37 מעלות צלזיוס למשך שעה.
- שטפו את השקופית במים זורמים למשך 5 דקות, ואז התבוננו באפקט הצביעה של אלישיה כחולה במיקרוסקופ לאחר הייבוש.
8. זיהוי פנוטיפ תא על ידי ציטומטריית זרימה
- כאשר מושבות התאים מגיעות למפגש של 80%-90% במעברים 3-5, הסר את מדיום התרבית ושטוף את התאים פעמיים עם PBS שחומם מראש. לאחר מכן עכל את התאים עם 3-4 מ"ל של 0.25% טריפסין/EDTA ודגר אותם בטמפרטורה של 37 מעלות צלזיוס באווירה לחה רוויה של 5% CO2 למשך 2-3 דקות עד שהם מנותקים מתחתית הבקבוק תחת מיקרוסקופ.
- קצרו את התאים עם מדיום שלם של 10 מ"ל והעבירו את תרחיף התאים לצינור צנטריפוגה סטרילי של 15 מ"ל. צנטריפוגה את תרחיף התא ב-800 x גרם למשך 5 דקות ב-RT. השליכו את הסופרנטנט ושטפו את התאים ב-4 מעלות צלזיוס PBS.
- השעו מחדש את התאים ל -10 מ"ל עם 4 מעלות צלזיוס PBS. מתלה התאים מחולק לתשע קבוצות בנפח של 1 מ"ל בכל מיקרו-צינור של 1.5 מ"ל, הנקרא בקרה שלילית, בקרת איזוטיפ FITC, בקרת איזוטיפ PE, בקרת איזוטיפ APC, קבוצת CD105, CD29, CD90, CD14 ו-CD45, בהתאמה. ודא שמספר התאים בכל מיקרו-צינור הוא בין 1 x 105 ל-1 x 106.
- צנטריפוגה את המתלה ב-800 x g למשך 5 דקות ב-4 מעלות צלזיוס, והשעיה מחדש של התאים בכל מיקרו-צינור עם 100 מיקרוליטר של 4 מעלות צלזיוס PBS שוב. מלבד קבוצת הבקרה השלילית, הוסף 5 מיקרוליטר של בקרת האיזוטיפ המתאימה (FITC, PE ו-APC Mouse IgG1 kappa Isotype Control) ונוגדנים (CD105, CD29, CD90, CD14 ו-CD45 נוגדן חד-שבטי) לזרימה ציטומטרית לכל מיקרו-צינור לפי הסדר בשלב 8.3. מערבבים בעדינות ודוגרים במשך שעה וחצי בחום של 4 מעלות צלזיוס בחושך.
- הוסף 1 מ"ל של 4 °C PBS לכל מיקרו-צינור וצנטריפוגה ב-300 x g למשך 10 דקות ב-4 °C. השליכו את הסופרנטנט והוסיפו 200 מיקרוליטר של 4 מעלות צלזיוס PBS כדי להשעות מחדש את התאים.
- בדוק לפחות 10,000 תאים על ציטומטריית הזרימה לאחר סינון תרחיף התא16 ונתח את הנתונים באמצעות תוכנת ציטומטריית הזרימה.
9. בידוד שלפוחיות חוץ-תאיות (EVs) שמקורן בתאי גזע מזנכימליים של מח עצם חזירי
- כאשר מפגש ה-pBM-MSCs מגיע ל-80%-90%, השליכו את הסופרנטנט ושטפו את התאים עם PBS 2x. לאחר מכן הוסיפו 25 מ"ל של IMDM ללא סרום לכל בקבוק תרבית והמשיכו לדגור בטמפרטורה של 37 מעלות צלזיוס באווירה לחה של 5% CO2 למשך 48 שעות.
- אסוף את הסופרנטנט של התא (מדיום ממוזג, CM) לתוך צינור צנטריפוגה של 50 מ"ל וצנטריפוגה ב-300 x g למשך 10 דקות ב-4 מעלות צלזיוס כדי להסיר את פסולת התא.
- אוספים שוב את הסופרנטנט לתוך צינור צנטריפוגה נוסף של 50 מ"ל. בצע את הבידוד של רכבים חשמליים בהקדם האפשרי לאחר איסוף הסופרנטנט. לאחסון לטווח ארוך, אחסן את הסופרנטנט במקרר בטמפרטורה של -80 מעלות צלזיוס כדי למנוע אובדן של רכבים חשמליים.
- צנטריפוגה את הסופרנטנט בשלב 9.3 ב-2,000 x גרם למשך 20 דקות ב-4 מעלות צלזיוס.
- העבירו את הסופרנטנט לצינור סטרילי המשמש לצנטריפוגה וצנטריפוגה במהירות גבוהה ב-16,500 x גרם למשך 30 דקות ב-4 מעלות צלזיוס.
- העבירו שוב את הסופרנטנט לצינור אולטרה-צנטריפוגה, וצנטריפוגה ב-120,000 x גרם למשך 70 דקות לפחות ב-4 מעלות צלזיוס, עם רוטור זווית קבועה.
- השליכו את הסופרנטנט לחלוטין. הוסף 1 מ"ל של 4 מעלות צלזיוס PBS לכל צינור אולטרה-צנטריפוגה והשהה מחדש את המשקעים בעזרת מיקרופיפטה. מערבבים את התמיסה מאותה קבוצה לתוך צינור אולטרה-צנטריפוגה, ולאחר מכן מוסיפים 4 מעלות צלזיוס PBS כדי להפוך את הנפח ליותר מ-3/4 מהצינור.
- צנטריפוגה ב-120,000 x גרם למשך 60 דקות ב-4 מעלות צלזיוס והסר את הסופרנטנט ככל האפשר.
- השעו שוב את המשקעים עם PBS סטרילי, ואחסנו את הרכבים החשמליים במקרר של -80 מעלות צלזיוס.
הערה: ניתן לקבוע את כמות ה-PBS להשעיה מחדש כ-100 מיקרוליטר עבור המשקעים מכל שתי צלוחיותתרבית בגודל 175 ס"מ. כל השלבים לעיל של בידוד רכבים חשמליים מוצגים באיור 3 באופן שיטתי.
10. זיהוי EVs על ידי מיקרוסקופ אלקטרונים שידור (TEM), ניתוח מעקב אחר ננו-חלקיקים (NTA) וכתמים מערביים
- הנח את דגימת ה-EVs על קרח לאחר הפשרתה באמבט מים של 25 מעלות צלזיוס, ולאחר מכן דלל למחצית מהריכוז הקודם עם PBS לזיהוי NTA17.
- פיפטה 10 מיקרוליטר מהדגימה על רשת הנחושת, הניחו לה להתיישב למשך דקה אחת, וספגו את הנוזל הצף בנייר פילטר. לאחר מכן, הוסיפו 10 מיקרוליטר של חומצה פוספוטונגסטית לרשת הנחושת, הניחו לה לעמוד במשך דקה אחת וספגו את עודפי הנוזלים.
- לאחר ייבוש של מספר דקות ב-RT, בצע הדמיית מיקרוסקופ אלקטרונים בתנאי מתח מאיץ של 100 KV18.
- השהה מחדש את דגימת ה-EVs משלב 9.9 במאגר ליזה RIPA (25 מ"מ Tris· HCl (pH 7.6), 150 מ"מ נתרן כלורי [NaCl], 1% נוניל פנוקספוליאתוקסילתנול (NP-40), 1% נתרן דאוקסיכולאט, 0.1% נתרן דודציל סולפט (SDS), 1 מ"מ פניל-מתאן סולפוניל פלואוריד (PMSF), מעכב פרוטאז 1x), ולזהות ביטוי של סמנים ספציפיים ל-EVs כגון Alix, TSG101, CD81 ו-CD63 על ידי Western Blotting19.
תוצאות
הקמת תאי גזע מזנכימליים של מח עצם חזיר
תאי גזע מזנכימליים שמקורם במח עצם חזירי בודדו בהצלחה ותרבו במבחנה, וניתן לראות את המורפולוגיה של pBM-MSCs בימים שונים באיור 4. בתרבית הראשונית של pBM-MSCs, תצפית מיקרוסקופית הראתה כי היצמדות התאים התרחשה יום לאחר השתילה, והתאים הדבקים היו בדרך כלל עגולים בצורתם. ה-pBM-MSCs העיקריים נשארו בדרך כלל בשלב השקט במשך 3 ימים לאחר השתילה, והתפשטות התאים החלה ביוםהרביעי . מורפולוגיה של התא השתנתה מעגול לציר, רב-צדדי או סוג כוכב לאחר התפשטות, והגרעינים מרכזיים, עם גרעינים כפולים בחלק מהתאים. מושבות תאים נוצרו 7-9 ימים לאחר תחילת התפשטות התאים, וניתן היה להשיג מפגש תאים של 80%-90% לאחר 12-14 ימים. התצפית המיקרוסקופית הראתה שתאים דבקים גדלו כמושבות מפוזרות ומסודרים בתבנית מסתחררת.
התפשטות התאים הואצה משמעותית לאחר המעבר, וניתן היה להגיע למפגש של 80%-90% תוך שבוע. מורפולוגיה של התא הייתה הומוגנית בצורת ציר מהמעבר השני, דומה לפיברובלסטים, עם יחס אורך לרוחב של כ-2-3:1. אם התאים היו מובחנים, הם עשויים להיראות מצולעים או בצורת כוכב. לאחר המעבר, התאים כבר לא גדלו כמושבות מפוזרות, אלא באופן שווה ורדיאלי בסידור מקביל.
זיהוי פוטנציאל התמיינות תאים על ידי צביעה
במבחן ההתמיינות האדיפוגנית, צביעת שמן אדום O הראתה שטיפות שומן כתומות-אדומות עגולות בגדלים שונים הופיעו סביב הגרעין (איור 5A); בבדיקת ההתמיינות האוסטיאוגנית, צביעת אליזרין אדום הראתה גושים אדומים על פני התא (איור 5B), שנגרמו על ידי תגובת הצבע עם מלחי סידן שהושקעו על ידי אוסטאובלסטים מובחנים מ-pBM-MSCs. במבחן ההתמיינות הכונדרוגנית, צביעה כחולה של אליסיה הראתה שכל אזור הרקמה היה כחול (איור 5C), שנגרם על-ידי צביעה של מוקופוליסכריד אנדו-חומצי בכדורי סחוס.
זיהוי פנוטיפ תא על ידי זרימה ציטומטרית
בדיקות של סמני פני התא בוצעו כדי ליצור פנוטיפ של pBM-MSCs. מתוצאות ציטומטריית הזרימה (איור 6), שלושה סמנים חיוביים כגון CD105, CD29 ו-CD90 באו לידי ביטוי באופן מובהק על פני השטח של pBM-MSCs, המהווים 96.5%, 99.8% ו-92%, בהתאמה (איור 6A-C). עם זאת, הביטוי של CD14 ו-CD45 היה שלילי (איור 6D,E). בינתיים, התוצאות של בקרות איזוטיפ תואמות היו כולן שליליות, מה שכבר הוצג באיור, ושולל את האפשרות של קשירה לא ספציפית של נוגדנים.
זיהוי EVs שמקורם ב-pBM-MSCs על ידי NTA, TEM ו-Western Blotting
התוצאה של NTA הראתה שגודל החלקיקים החציוני היה 126.9 ננומטר, שהיה בטווח של EVs; חוץ מזה, הריכוז המקורי של דגימת ה-EVs היה 1.5 x10 10 חלקיקים/מ"ל, ואת הערך המדויק שהוקצה לגודל ניתן למצוא באיור 7A. דיאגרמת מסלול החלקיקים מוצגת באיור 7B, וממחישה שהחלקיקים היו בתנועה בראונית לא סדירה. יתר על כן, ניתן היה לראות בבירור את השלפוחית הדיסקואידית, כמבנה הקלאסי של EVs, תחת מיקרוסקופ האלקטרונים בהגדלות של פי 50,000 (איור 7C). כמו כן, הביטוי של סמנים ספציפיים לרכבים חשמליים כגון Alix, TSG101, CD81 ו-CD63 זוהה בדגימה על ידי Western Blotting (איור 7D).
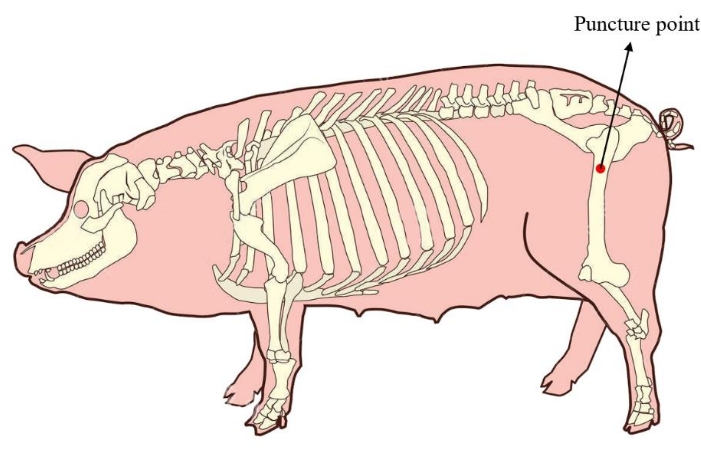
איור 1: נקודת ניקוב מח העצם של המיני-חזיר. האזור האדום מראה את נקודת הניקוב של חילוץ מח העצם, הממוקמת בעצם הירך הפרוקסימלית של המיני-חזיר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
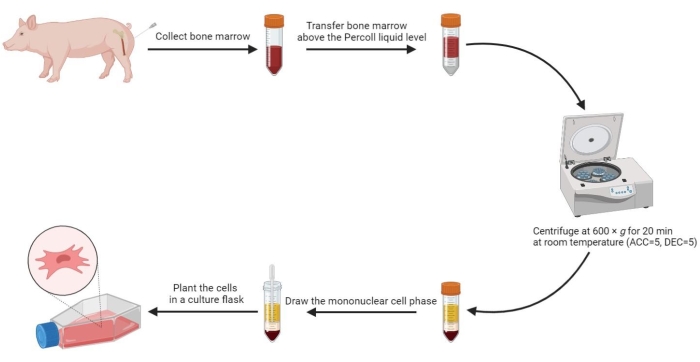
איור 2: בידוד תאי גזע מזנכימליים ממח עצם חזיר. תהליך בידוד תאי גזע מזנכימליים ממח עצם חזיר מוצג בתרשים הזרימה, וארבעה שלבים נוזליים מומחשים בבירור לאחר צנטריפוגה בשיפוע צפיפות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
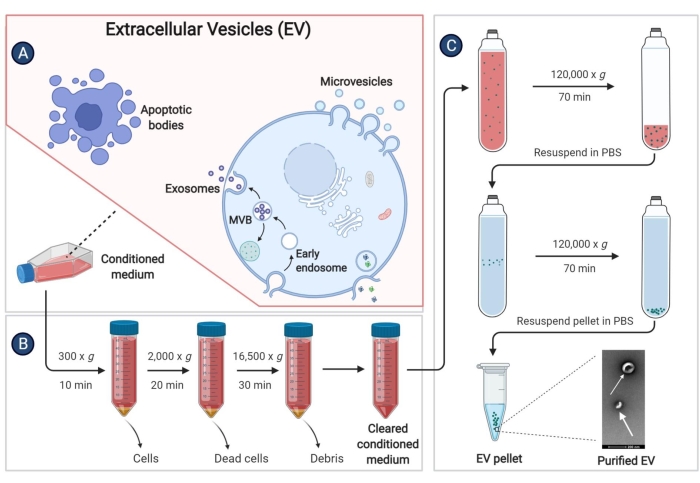
איור 3: בידוד רכבי EV הנגזרים מ-pBM-MSCs. התרשים הסכמטי מדגים שלבים ספציפיים לבידוד רכבים חשמליים מהמדיום המותנה על ידי אולטרה-צנטריפוגה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: מאפיינים מורפולוגיים של pBM-MSCs בימים שונים. ניתן לראות מאפיינים מורפולוגיים דומים של pBM-MSCs ביוםה-3,ה-5, ה-7וה-9 לאחר השתילה תחת השדה המיקרוסקופי פי 100, ומושבות תאים נוצרוביום התשיעי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5. זיהוי פוטנציאל התמיינות של pBM-MSCs על ידי צביעה. (A) בדיקת התמיינות אדיפוגנית, (B) אוסטאוגנית ו-(C) כונדרוגנית של pBM-MSCs, בהתאמה. ניתן לזהות את פוטנציאל ההתמיינות של pBM-MSCs על ידי תוצאות צביעה אלה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
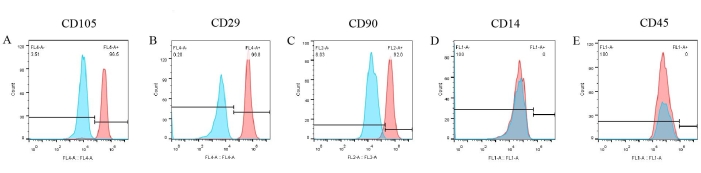
איור 6: תוצאות זיהוי של pBM-MSCs על ידי ציטומטריית זרימה. CD105, CD29 ו-CD90 באים לידי ביטוי באופן משמעותי על פני השטח של pBM-MSCs, המהווים 96.5%, 99.8% ו-92.0%, בהתאמה, בעוד שהביטוי של CD14 ו-CD45 הוא שלילי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
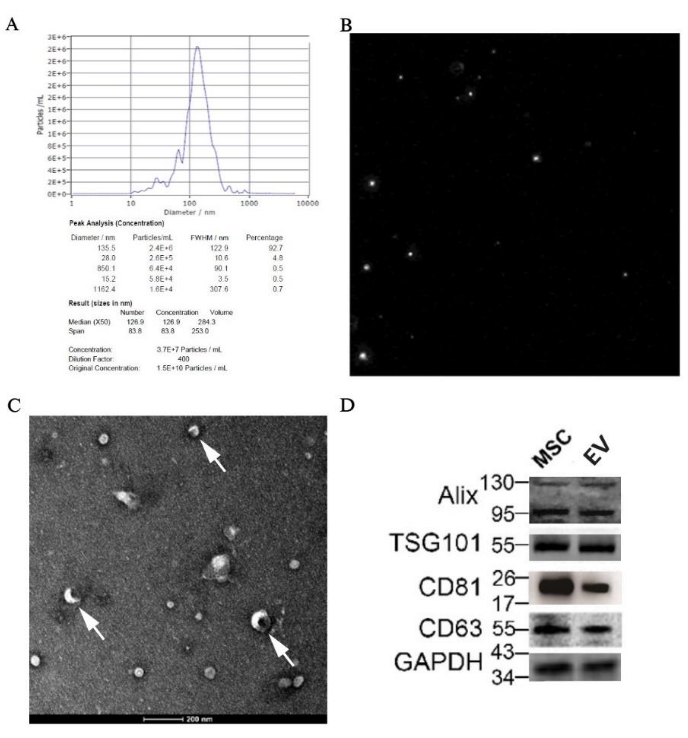
איור 7: תוצאות זיהוי של EVs שמקורם ב-pBM-MSCs על ידי מורפולוגיה וביולוגיה מולקולרית. (A) תוצאת NTA של EVs שמקורם ב-pBM-MSCs, עם גרף התפלגות גודל החלקיקים ו-(B) דיאגרמת מסלול חלקיקים, בהתאמה; (C) תמונת TEM שצולמה בהגדלות של פי 50,000, והחץ הלבן מראה את המבנה הקלאסי של שלפוחיות דיסקואידיות. (ד) ביטוי של סמנים ספציפיים לרכבים חשמליים על ידי כתמים מערביים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
נקודת ניקוב מח עצם מסורתית של מיני-חזירים הוצבה בפסגת הכסל20. למרות שקל לאתר, כמות מיצוי מח העצם מוגבלת21 (רק כ -5 מ"ל באופן כללי), ולכן קשה לעמוד בדרישה של מספר רב של הרחבות במבחנה להשתלה in vivo. בשיטה זו, מיקמנו מחדש את נקודת ניקוב מח העצם לעצם הירך הפרוקסימלית, וניתן להפיק לפחות 20 מ"ל של מח עצם מאתר זה, מה שמבטיח כמות מספקת של pBM-MSCs לתרבית תאים לאחר מכן.
שני פתרונות ההפרדה העיקריים המשמשים לבידוד BM-MSCs על ידי צנטריפוגה בשיפוע צפיפות הם Percoll ו-Ficoll. פרקול מורכב מפוליוויניל פירולידון (PVP) סיליקון, שהוא חומר הפרדה צנטריפוגלי צנטריפוגלי חדשני שאינו רעיל ולא מגרה. קבוע הדיפוזיה הנמוך של פרקול מביא לשיפוע צפיפות יציב יחסית; לכן, בדרך כלל ניתן להשיג הפרדת תאים משביעת רצון תוך עשרות דקות בכוחות צנטריפוגליים נמוכים (200-1000 x g). השיטה לבידוד של pBM-MSCs באמצעות Ficoll דווחה בעבר21. בהשוואה ל-Ficoll, נעשה שימוש בהדרגה ב-Percoll בשל יתרונותיו של יכולת פעולה קלה, צמיגות נמוכה, אי רעילות ואי גרימת צבירת תאים, מה שיכול להשלים את השיטות הקיימות לבידוד pBM-MSCs.
בבידוד וטיפוח pBM-MSCs, לא ניתן להתעלם מכמה שלבים קריטיים. ראשית, ריבוד מוצלח של פאזות נוזליות שונות לאחר צנטריפוגה בשיפוע צפיפות הוא המפתח לבידוד pBM-MSCs מטוהרים. BM-MSCs, כסוג של תאים חד-גרעיניים של מח עצם (BM-MNCs), הם בעלי משקל סגולי הדומה לזה של לימפוציטים ומונוציטים, בסביבות 1.075 גרם/מ"ל. הצפיפות המקורית של פרקול היא 1.130 גרם/מ"ל, וכדי להשיג בהצלחה את שכבת התא המכילה BM-MSCs לאחר צנטריפוגה בשיפוע צפיפות, יש להגדיר מראש תמיסת הפרדת שיפוע בצפיפות איזוטונית של 60% (1.077 גרם/מ"ל) בהתאם ליחס צפיפות-ריכוז פרקול22. יתר על כן, תנאי צנטריפוגה מתאימים תורמים גם הם לריבוד מוצלח. בהתחשב בקבוע הדיפוזיה הנמוך של פרקול, צנטריפוגה את מח העצם המופק ב-600 x גרם למשך 20 דקות ברמות תאוצה/האטה נמוכות יחסית (ACC = 5, DEC = 5), מה שהשיג אפקט ריבוד טוב. שנית, צפיפות שתילה מתאימה חיונית גם לתרבית תאים. על מנת לרכוש מספר מספיק של MSCs (בדרך כלל יותר מ-107 לכל בעל חיים9) להשתלה שלאחר מכן, אנו משתמשים בצלוחיותתרבית בגודל 175 ס"מ 2 לתרבית תאים. במחקר קודם20, ה-BM-MNCs שהושגו נשתלו בדרך כלל בצלוחיות תרבית לגידול בצפיפות של 5 x 105/cm2. דווח כי לאחר צנטריפוגה בשיפוע צפיפות, ניתן להשיג 2-3 x 107 BM-MNCs עבור כל 5 מ"ל של מח עצם חזיר23. לכן, בפרוטוקול זה, אנו ממליצים לשתול את סך ה-BM-MNCs המבודדים מכל מח עצם חזירי של 20 מ"ל לתוךבקבוק תרבית בגודל 175 ס"מ לצפיפות מתאימה. שלישית, יש להימנע מזיהומים במהלך הבידוד והתרבית של pBM-MSCs. בעת ציור שלב התא החד-גרעיני, אין להכניס את הפיפטה לשלב הפרקול כדי לא להתערבב עם הנוזל המפריד. יתר על כן, לאחר 24 שעות של שתילת תאים, יש לנער בעדינות את בקבוק התרבות כדי להפחית את היצמדות כדוריות הדם האדומות.
במהלך תהליך האולטרה-צנטריפוגה, רמות גבוהות של זיהום מצטבר חלבון וליפופרוטאין באמצעות שיטה זו פוגעות בהכרח בכימות ובניתוח התפקודי של EVs14. על מנת להפחית ככל האפשר את הזיהום בתהליך, יש לשמור על עומק של 5 מ"מ של נוזל בתחתית בכל פעם בעת העברת הסופרנטנט לפני שלב האולטרה-צנטריפוגה. בינתיים, לאחר האולטרה-צנטריפוגה הראשונה, השעיית הגלולה ב-PBS סטרילי ולאחר מכן ביצוע אולטרה-צנטריפוגה שוב יכולה להפחית ביעילות את זיהום הליפופרוטאין.
למרות שצנטריפוגה עם שיפוע צפיפות ואולטרה-צנטריפוגה היו בשימוש נרחב בבידוד BM-MSCs וה-EVs הנגזרים מהם, בהתאמה, לשתי הטכניקות הללו יש גם מגבלות משלהן. מצד אחד, טכניקת פרקול היא ארוכה ומסורבלת, ומניב דגימת תרכיז BM באמצעות מכשיר ריכוז תאים ליד המיטה דווח כשיטה חלופית לבידוד MSCs24. מצד שני, שיטת האולטרה-צנטריפוגה דורשת לא רק טכנאים מיומנים אלא גם ציוד יקר; לכן, יישום משולב של שתי טכניקות או יותר עשוי להציג אסטרטגיה סבירה לבידוד יעיל יותר של EVs25. חוץ מזה, גם הזיהוי של pBM-MSCs והרכבים החשמליים הנגזרים מהם זקוק לשיפור. לדוגמה, על פי הקריטריונים הבינלאומיים להגדרת MSCs26, הביטוי של כמה סמנים חיוביים או שליליים, כגון CD73, CD34 ו-HLA-DR, עדיין חסר בתוצאות הזיהוי של פנוטיפים של BM-MSC על ידי זרימה ציטומטרית במחקר זה. בנוסף, למרות שננקטו אמצעים למניעת זיהום במהלך תהליך בידוד הרכבים החשמליים, בשל מגבלות המעבדה שלנו, איננו יכולים להעריך את טוהר דגימת הרכבים החשמליים כדי לסייע בשיפור עבודת המעקב.
מחקר זה משלב שיטות לבידוד של pBM-MSCs וה-EVs הנגזרים מהם ברצף, שהוכחו על ידי תוצאות הזיהוי הבאות באופן שיטתי. בפרט, הדגשנו את הפעולות העיקריות בסדרת שלבים זו, והסברנו כמה תנאי ניסוי ספציפיים שיכולים לפתור במידה מסוימת את בעיית ההטרוגניות הקיימת במעבדות שונות במהלך תהליך זה. עבודה שיטתית זו עשויה להיות בשימוש נרחב במחקרים פרה-קליניים על יעילות ההשתלה של BM-MSCs וה-EVs הנגזרים מהם, מה שיכול לספק בסיס ניסיוני עם רמה מספקת למחקר קליני.
Disclosures
לכל המחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
אנו מודים ליאנג ג'יאן-ג'ונג ולוואנג שואה-מין על תרומתם לתפעול מיצוי מח העצם. עבודה זו נתמכה על ידי מענקים מקרן החדשנות CAMS למדעי הרפואה (CIFMS) [מספר מענק 2016-I2M-1-009], הקרן הלאומית למדעי הטבע של סין (מס': 82070307; לא: 81874461).
Materials
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
References
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087 (2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961 (2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581 (2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738 (2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300 (2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979 (2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057 (2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -. J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077 (2016).
- Lindqvist, R., Wilson, I. D. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. , 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved