Method Article
Быстрое обнаружение фекального антигена инфекции Helicobacter pylori на основе технологии Double Intent Sandwich Detection
В этой статье
Резюме
В данном исследовании была разработана методика сэндвич-детекции на основе двойных антител для быстрого обнаружения фекальных антигенов, инфицированных Helicobacter pylori.
Аннотация
Helicobacter pylori может паразитировать на слизистой оболочке желудка, что может вызвать ряд желудочно-кишечных заболеваний после инфекции и тесно связано с гастритом, язвой желудка и раком желудка. Высокая распространенность инфекции H. pylori в регионах с плохой медицинской инфраструктурой и неадекватными санитарными условиями остается серьезной проблемой общественного здравоохранения. Следовательно, разработка быстрых, простых и экономически эффективных методов скрининга для обнаружения H. pylori в условиях ограниченных ресурсов имеет первостепенное значение.
В этом исследовании мы провели скрининг на уровне сообщества в деревне Шитань, провинция Гуандун, отдаленном и слаборазвитом районе, характеризующемся постоянным населением около 300 жителей с низким уровнем образования. Мы использовали двойной сэндвич-анализ антител для обнаружения фекального антигена H. pylori , метод, выбранный из-за его потенциальной применимости в условиях ограниченных ресурсов. Всего в исследование был зачислен 261 участник из села, образцы кала которых были проанализированы с помощью этой методики. Для сравнительной валидации те же образцы были подвергнуты количественному анализу полимеразной цепной реакции (кПЦР). По сравнению с результатами количественной ПЦР чувствительность и специфичность обнаружения антигена H. pylori в кале составили 60,24% и 80,08%. Результаты продемонстрировали сильную связь между методом обнаружения фекального антигена и количественной ПЦР (Kappa = 0,630). В этом исследовании систематически разъяснялись принципы, процедуры, методологии и клинические применения обнаружения фекальных антигенов при инфекции H. pylori , с целью изучения технологии двойного сэндвича антител на основе латекса и разработки новых стратегий и практических рекомендаций для его вспомогательной диагностики.
Введение
Helicobacter pylori (H. pylori, Hp) — микроаэрофильная, спиралевидная, грамотрицательная бактерия1. Благодаря своей способности колонизировать и хронически инфицировать желудок человека2, этот патоген был идентифицирован как основной этиологический фактор развития аденокарциномы желудка 3,4. В 2015 году ~4,4 миллиарда человек в мире пострадали от инфекции H. pylori 5. Распространенность инфекции H. pylori значительно варьируется в географическом диапазоне, при этом в развивающихся странах показатели значительно выше, чем в развитых странах. Примечательно, что в странах с низким уровнем дохода и среди некоторых уязвимых групп населения уровень инфицирования может достигать 75%6.
Несмотря на то, что традиционные методы обнаружения, такие как гастроскопия, являются точными, их применение в крупномасштабном скрининге и рутинном последующем наблюдении ограничено из-за их инвазивности, высокой стоимости и низкой приемлемости со стороны пациентов7. Поэтому поиск неинвазивных, простых и быстрых методов диагностики стал важным направлением исследований современной клинической медицины. Основная цель неинвазивной диагностики H. pylori заключается в том, чтобы точно, безопасно и удобно определить, инфицирован ли пациент H. pylori без эндоскопического обследования. Уреа-дыхательный тест (UBT), тест на фекальный антиген H. pylori (FAT)8 и серологическое тестирование9 являются популярными неинвазивными методами.
Среди них УБТ является наименее интрузивной и наиболее точной процедуройиз доступных 10. Чувствительность и специфичность ОБТ выше 95%11. Среди доступных неинвазивных методов диагностики UBT показал себя наиболее точным и надежным, как видно из валидационного исследования, проведенного в Ираке, UBT может быть рекомендован в качестве первого выбора из-за его более высокой эффективности по сравнению сдругими методами. Тем не менее, UBT также имеет свои недостатки, такие как высокая стоимость и необходимость масс-спектрометрического анализа, что ограничивает его применение в удаленных или ограниченных ресурсахусловиях.
Разработка быстрого, неинвазивного и экономически эффективного метода диагностики для выявления инфекции H. pylori крайне необходима, особенно в регионах с ограниченными ресурсами. В этом исследовании мы разработали технологию быстрого обнаружения фекального антигена H. pylori на основе технологии обнаружения двойного антитела, которая позволяет быстро, эффективно и с низкими затратами обнаруживать антиген H. pylori в образцах кала. Эта технология обладает значительными преимуществами, включая доступность, неинвазивность, удобство использования и адаптивность к отдаленным районам. Мы предполагаем, что метод двойного сэндвича антител для обнаружения фекального антигена H. pylori продемонстрирует чувствительность и специфичность, сопоставимые с количественной ПЦР, что позиционирует его как жизнеспособный инструмент для неинвазивной клинической диагностики.
Мы всесторонне подробно описали принципы, процедуры, методологические преимущества и клиническую применимость обнаружения фекального антигена при инфекции H. pylori . Чтобы убедиться в его практичности, мы провели эпидемиологическое расследование и скрининг в деревне Шитань, город Цинюань, провинция Гуандун, Китай, которая является отдаленным и слаборазвитым районом с постоянным населением около 400 человек и ограниченным уровнем образования. Наши результаты показывают, что разработанная здесь технология быстрого обнаружения антигена H. pylori в кале может быть завершена в течение 20 минут. Подчеркивается, что быстрое обнаружение антигена H. pylori в кале является потенциальным и перспективным инструментом для быстрой и надежной диагностики инфекции H. pylori в отдаленных и отсталых районах.
протокол
Это перекрестное исследование было одобрено Комитетом по этике Народной больницы провинции Гуандун (номер одобрения: KY2024-445-01), и личные данные всех испытуемых были строго конфиденциальными во время исследования. Перед началом экспериментов все участники подписали письменное информированное согласие. В качестве субъектов исследования в 2024 году были выбраны жители деревни Шитань города Цинъюань провинции Гуандун, при этом ограничений по возрасту и полу не было. Описанный ниже тест на двойной сэндвич антител (качественный эксперимент) проводился профессиональным медицинским и техническим персоналом в соответствии с инструкцией. Для этого исследования было отобрано все постоянное население деревни, независимо от того, были ли они здоровы или имели симптомы или какие-либо существующие заболевания, связанные с желудочно-кишечными заболеваниями.
1. Отбор пациентов
- Исключите пациентов, если они использовали ингибиторы протонной помпы или висмут, блокаторы Н2-рецепторов или антибиотики в течение предыдущего 1 месяца.
- Попросите всех участников заполнить анкету анонимно. Содержание анкеты включает в себя пять вопросов: Питаетесь ли вы три раза регулярно? Вы употребляете алкоголь? Знаете ли вы о H. pylori? Считаете ли Вы необходимым проводить обследование на H. pylori ? Понимаете ли вы неблагоприятные последствия заражения H. pylori ?
2. Методика выявления антигена фекальной инфекции H. pylori
ПРИМЕЧАНИЕ: Алгоритм тестирования кала на антиген H. pylori был разработан для обеспечения точности и надежности результатов, с учетом простоты и гигиены. Весь процесс разделен на пять этапов: сбор образцов, обработка образцов, хранение образцов, обнаружение и интерпретация результатов. Рабочая технологическая схема и принципиальная схема обнаружения образцов представлены на рисунках 1 и 2.
- Забор образцов
ПРИМЕЧАНИЕ: Для сбора образцов следует использовать контейнеры, специфичные для антигена H. pylori . Образцы не должны смешиваться с водой, мочой, дезинфицирующими средствами и сточными водами.- После завершения дефекации снимите верхнюю крышку специальной емкости, чтобы вынуть стержень для отбора проб.
- Вставьте стержень для отбора проб непрерывно в пять различных положений табурета для отбора проб, убедившись, что резьбовой конец стержня для отбора проб полностью вставлен в табурет.
- Вставьте стержень для отбора проб обратно в пробирку с реагентом после завершения отбора проб; Общий объем образца составляет ~5-50 мг.
- Обработка образцов
- Встряхните пробирку с реагентом из стороны в сторону в течение ~10 с, чтобы тщательно перемешать образец кала в разбавителе (основные ингредиенты: этилендиаминтетрауксусная кислота тетранатрия гидрат 0,018 г/мл и хлорид натрия 0,01 г/мл).
- Хранение образцов
- Протестируйте образцы как можно скорее после отбора проб; хранить их при комнатной температуре не более 6 ч и в охлажденных условиях (не более 72 ч при 2-8 °С и не более 6 месяцев в замороженном виде при температуре от -25 °С до -15 °С) при необходимости замедления деградации антигена и микробной активности.
ПРИМЕЧАНИЕ: Образцы можно многократно замораживать и размораживать до 3 раз, при этом как охлажденные, так и замороженные образцы должны быть возвращены к комнатной температуре перед тестированием.
- Протестируйте образцы как можно скорее после отбора проб; хранить их при комнатной температуре не более 6 ч и в охлажденных условиях (не более 72 ч при 2-8 °С и не более 6 месяцев в замороженном виде при температуре от -25 °С до -15 °С) при необходимости замедления деградации антигена и микробной активности.
- Обнаружение образцов
- Откройте белую крышку на крышке трубки с реагентом и держите трубку с реагентом в вертикальном положении.
- Нажмите на крышку до самой нижней точки, чтобы образец стекал по тестовой карте, проходя через зону обнаружения (T) и зону контроля качества (C), покрытую мышиным антителом anti-Hp.
- Интерпретация результатов
- Подождите 10-20 мин, чтобы любой антиген H. pylori в образце, если он связан с антителом, образовал макроскопическую хромогенную реакцию в зоне обнаружения. Обычно это выглядит как красная или фиолетовая линия, которая контрастирует с линией в области контроля качества.
- Наличие или отсутствие цветовой реакции и глубина окраски связаны с концентрацией антигена H. pylori в образце. Сравните цветовые карточки, чтобы быстро и точно интерпретировать результаты (см. рисунок 3).
3. Экстракция ДНК
- Поместите необходимое количество кала в пробирку, добавьте раствор PBS и тщательно перемешайте, встряхивая. Центрифугируйте смесь при 12 000 × г в течение 5-10 мин, затем тщательно соберите 200 мкл надосадочной жидкости для дальнейшей экстракции.
- Исходя из количества образцов, подготовьте равное количество пробирок для центрифуги объемом 1,5 мл. В каждую пробирку последовательно добавьте 20 мкл протеинады К (20 мг/мл), 10 мкл магнитных шариков, 200 мкл надосадочной жидкости образца и 200 мкл буфера для лизиса А. Тщательно перемешайте, перевернув пробирки, затем инкубируйте в металлической ванне при 55 °C в течение 10 мин.
- После завершения пиролиза поместите центрифужную трубку на магнитную раму, дайте ей постоять и дайте адсорбции на шариках в течение 1 минуты. После того как жидкость в пробирке полностью осветлится, выбросьте надосадочную жидкость и старайтесь не тревожить магнитные шарики.
- Извлеките пробирки из магнитного штатива и поместите их на штатив для центрифужных пробирок объемом 1,5 мл. С помощью пипетки добавьте в каждую пробирку 500 мкл промывочного буфера E, тщательно перемешайте в течение 1 минуты, затем верните пробирки на магнитную решетку. Дайте трубкам постоять 1 минуту, выбросьте надосадочную жидкость после осветления и избегайте аспирации магнитных шариков.
- Повторите процесс промывки, добавив 500 μL буфера для промывки W2 в каждую пробирку. Тщательно перемешайте в течение 1 минуты, поместите трубки на магнитную решетку и дайте им постоять 1 минуту. Осторожно выбросьте надосадочную жидкость после того, как раствор прояснит, убедившись, что магнитные шарики остаются нетронутыми.
- Добавьте 100 μл элюента, перемешайте и инкубируйте при 55 °C в течение 5 минут.
- Поместите трубки на магнитную решетку и дайте им постоять 2 минуты. Как только раствор прояснит, осторожно перенесите элюированную нуклеиновую кислоту в новую центрифужную трубку, избегая аспирации магнитных шариков.
- Оцените чистоту извлеченной ДНК, измерив абсорбцию при длинах волн 260 нм (А260) и 280 нм (А280). Рассчитайте соотношение A260/A280 , которое в идеале должно быть больше 1,8 для ДНК высокой чистоты.
4. Количественная ПЦР для выявления H. pylori и резистентности к антибиотикам
ПРИМЕЧАНИЕ: Мы провели кПЦР для выявления инфекции H. pylori путем амплификации гена ureA . Все продукты отрицательного контроля качества – это стерильная, очищенная вода. Положительным продуктом контроля качества в наборе для обнаружения нуклеиновых кислот H. pylori являются инактивированные стандартные гранулы H. pylori (ATCC 43504). C T ≤ 30 с типичной S-образной кривой считается положительным.
- В зависимости от количества образцов, которые необходимо испытать, достаньте лиофилизированный препарат H. pylori из набора и быстро раскрутите его, чтобы лиофилизированный порошок оставался на дне пробирки.
- Осторожно откройте крышку сублимированного препарата; взять нуклеиновую кислоту исследуемого образца; добавить 25 мкл образца нуклеиновой кислоты в лиофилизированный препарат; и плотно накройте трубку.
- Встряхните и равномерно перемешайте реагент ПЦР в течение 8-10 с, а затем быстро раскрутите его в течение 3-5 с.
- Для каждого образца на 32-луночном планшете приготовьте 25 мкл реакционной смеси ПЦР (лиофилизированный порошок [содержащий фермент Taq (5 Ед/мкл), дезоксирибонуклеозидтрифосфат (2,5 ммоль/л), фермент UNG (2 Ед/мкл), уреА прямой (5'-ACATTGCGAGCGGGACAG-3') и обратный (5'-CGCCCAATCTCACTTTATCG-3') праймеры (40 моль/л)]), а также 25 мкл (2,5 мкг) экстрагированной ДНК.
- Запустите 32-луночную планшетную плату для количественной ПЦР на машине для количественной ПЦР. Запрограммируйте термоамплификатор: 42 °C и 95 °C (оба для одного цикла) на 2 мин каждый; 95 °C в течение 10 с и 65 °C в течение 45 с (два шага равны одному циклу) в течение 10 раз; 95 °C в течение 10 с и при 58 °C в течение 45 с (два шага равны одному циклу) в течение 35 циклов.
- Проанализируйте данные с помощью специального программного обеспечения для количественной ПЦР и позвольте прибору автоматически выбирать базовые пороговые значения.
5. Статистический анализ
- Используйте критерий хи-квадрат для анализа экспериментальных данных, чтобы оценить согласованность между этим методом и результатами количественной ПЦР и сравнить положительную частоту скрининга этой технологии с положительными данными о частоте инфекции H. pylori в более широком масштабе (например, по всей стране). Рассмотрим различия, статистически значимые при P < 0,05.
Результаты
Анкетный опрос
В общей сложности в исследование был включен 261 участник, в том числе 144 женщины и 117 мужчин, в возрасте от 4 до 99 лет. Средний возраст испытуемых составил 48,30 ± 17,61 лет. В исследовании приняли участие 17 несовершеннолетних (0-17 лет), 202 взрослых (18-64 года) и 42 пожилых участника (>64 года). Результаты анкетирования приведены в таблице 1. Большинство (90,8%) испытуемых считали необходимым проведение скрининга на H. pylori .
Результаты скрининга на выявление антигена H. pylori в фекальном посёлке
Среди 261 участника, протестированного на фекальный антиген H. pylori , 52 (19,92%) были положительными, а 209 — отрицательными. Из 52 положительных случаев 32 были женщинами, что составляет 22,22% всех участников женского пола, и 20 мужчинами, что составляет 17,09% всех участников мужского пола. При стратификации по возрасту показатели положительности распределились следующим образом: у несовершеннолетних (0-17 лет) было 2 положительных случая (11,76%), у взрослых (18-64 года) — 41 положительный случай (20,30%), у пожилых людей (>64 года) — 9 положительных случаев (21,43%).
Сравнение согласованности фекального антигена H. pylori и результатов количественной ПЦР
В данном исследовании были отобраны два образца с разными результатами кПЦР-теста для характеристики надежности протокола эксперимента (рис. 4). Среди результатов исследования антигена H . pylori в фекалиях у 261 пациента 52 были положительными, а 209 — отрицательными. Среди результатов количественной ПЦР с калом 261 испытуемого 83 оказались положительными, а 178 — отрицательными (табл. 2). Чувствительность и специфичность обнаружения фекального антигена H. pylori составили 60,24% и 80,08% соответственно. Положительная прогностическая ценность (PPV) этого метода составила 96,15%, а отрицательная прогностическая ценность (NPV) — 84,21%. Тест на согласованность Каппа показывает, что результаты диагностики двух методов согласуются (Каппа = 0,630, P < 0,05).
Сравнение положительного показателя скрининга между этой природной деревней и всей страной
Положительный уровень составил 19,92%, что немного ниже общенационального положительного показателя в 42,8%14 (Таблица 3). По данным критерия хи-квадрат (P < 0,01) разница в положительных показателях была статистически значимой.

Рисунок 1: Блок-схема обнаружения проб. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
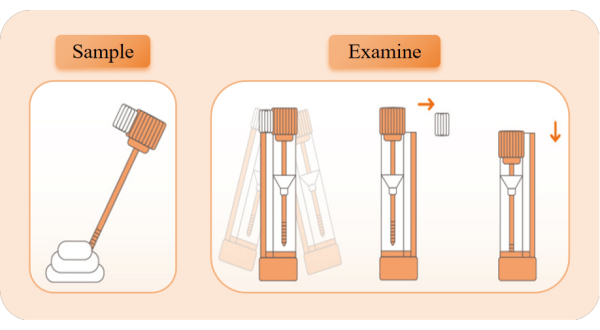
Рисунок 2: Принципиальная схема сбора и обнаружения образцов. Выньте устройство обнаружения, разорвите пакет из алюминиевой фольги и выньте пробирку с реагентом. Снимите оранжевую крышку пробирки и с помощью палочки для отбора проб 5 раз взятие проб из разных положений кала. Вставьте стержень для отбора проб обратно в пробирку с реагентом и встряхивайте его влево и вправо в течение 10 секунд для полного смешивания. Разбейте белый ограничительный блок, держите пробирку с реагентом в вертикальном положении и нажмите на крышку пробирки в самое нижнее положение, чтобы начать синхронизацию. Понаблюдайте за появлением красных полос. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Интерпретация результатов анализа антигенов. (A) Пробоотборник. (В,Э) Отрицательный (-): отрицательный результат указывает на то, что в образце не обнаружен антиген H. pylori , что свидетельствует о низком риске заражения H. pylori . Отрицательный результат не может полностью исключить возможность заражения. (К,Ж) Положительный (+): Положительный результат означает, что в образце обнаружен антиген H. pylori , подозревается инфекция H. pylori . (D) Отсутствие эффекта: Недействительные результаты могут быть проблемой в процессе сбора или обработки пробы, или реагент испортился и поврежден, и пробу следует собрать повторно или повторить этапы операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
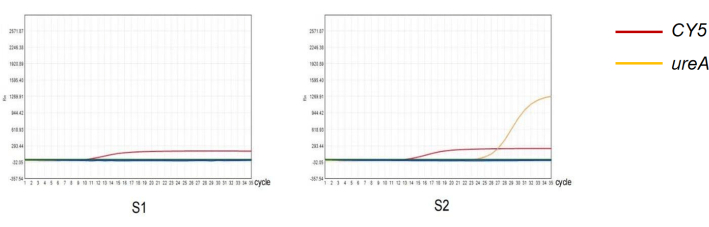
Рисунок 4: Обнаружение H. pylori в кале методом количественной ПЦР. (С1) Отрицательный результат количественной ПЦР-амплификации инфекции H. pylori . (С2) Положительный результат количественной ПЦР-амплификации инфекции H. pylori . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
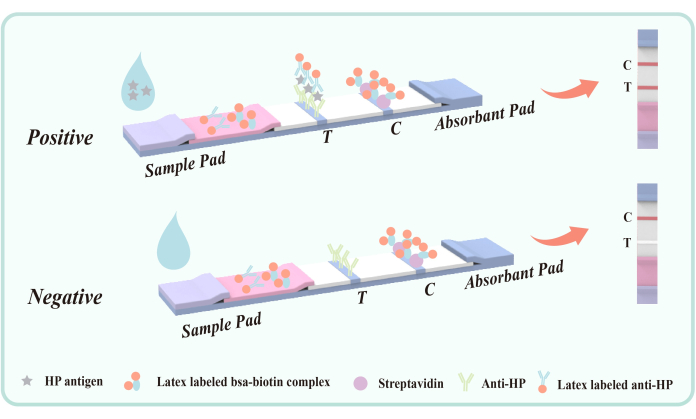
Рисунок 5: Принципиальная схема метода двойного сэндвича антител для обнаружения фекального антигена, инфицированного H. pylori. Мышиное антитело anti-Hp (эпитоп VacA) было заблаговременно зафиксировано в зоне обнаружения (Т) на мембране. В зоне контроля качества (С) заранее фиксируются козьи антимышиные IgG и стрептавидин. Полиэфирная пленка была покрыта меченым латексом мышиным антителом против HP и конъюгатом латекс-BSA-биотин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Нужно ли питаться регулярно за три приема пищи? | Стоит ли употреблять алкоголь? | Знаете ли вы H. pylori? | Нужно ли проводить обследование на H. pylori ? | Понимаете ли вы неблагоприятные последствия заражения H. pylori ? | |
| Да (тариф) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| Нет (тариф) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
Таблица 1: Результаты анкетирования.
| Антиген H. pylori | Итог | |||
| Положительные (+) | Отрицательные (-) | |||
| количественной ПЦР | Положительные (+) | 50 | 33 | 83 |
| Отрицательные (-) | 2 | 176 | 178 | |
| Итог | 52 | 209 | 261 | |
Таблица 2: Результаты диагностики двух методик.
| Положительная | Отрицательная | Положительный курс | Итог | |
| Шитаньская деревня | 52 | 209 | 19.92% | 261 |
| Китай | 314423 | 449404 | 42.80% | 763827 |
Таблица 3: Сравнение показателей положительных результатов скрининга на H. pylori между деревней Шитань и средним показателем по стране.
Обсуждение
H. pylori представляет собой одну из самых распространенных бактериальных инфекций во всем мире15. Результаты анкетирования показали, что 55,2% населения не знают о H. pylori, в то время как 90,8% считают, что скрининг H. pylori необходим. Эти результаты подчеркивают важность реализации программ скрининга H. pylori в экономически неблагополучных и отдаленных районах16. Несмотря на то, что уреавидный дыхательный тест (УБТ) является распространенным методом диагностики, его высокая стоимость и непригодность для детей и беременных женщин ограничивают его применимость17,18. Сывороточный тест на антитела к H. pylori может выявить антитела в сыворотке крови пациента19. Однако этот тест не подходит для анализа после лечения, поскольку антитела остаются еще долго после того, как бактерии были удалены. В отличие от этого, тестирование кала на антиген предлагает неинвазивный подход, который устраняет необходимость доступа к полости желудка, требуя только образцы кала для анализа. Этот метод значительно снижает дискомфорт пациента и потенциальные риски, делая его более удобным как для скрининга, так и для последующего наблюдения. Кроме того, его неинвазивный характер делает его более приемлемым для населения в отдаленных и слаборазвитых регионах.
Распространенность H. pylori-положительных пациентов в нашей исследуемой популяции составляет 19,92%, что немного ниже национального показателя положительных результатов в 42,8%14. Согласно критерию хи-квадрат (P < 0,01), между ними существовала статистическая значимость. Причиной такой разницы может быть то, что уровень инфицирования H. pylori в городском населении в семи географических регионах Китая имеет очевидную региональную дифференциацию21. Уровень заражения самый высокий в Восточном Китае, выше в Северо-Восточном Китае, Северном Китае и Северо-Западном Китае и ниже в Южном Китае и Юго-Западном Китае21. Территория, которую мы проверили, принадлежит Южному Китаю, и уровень заражения ниже, чем на национальном уровне. С другой стороны, причиной такой разницы также может быть нестандартная работа в процессе отбора проб отдельных образцов кала и длительное время отправки на анализ. Хотя ПЦР и ее производные широко используются для обнаружения различных патогенов, включая H. pylori, их полезность ограничена сложностью и стоимостью оборудования для термоамплификаторов и необходимостью в специализированныхоператорах. В данном исследовании, по сравнению с результатами количественной ПЦР, чувствительность и специфичность обнаружения антигена H. pylori в кале составили 60,24% и 80,08%. Сравнивали консистенцию антигена H. pylori в кале и результаты количественной ПЦР, и результаты показали, что они умеренно стабильны (Kappa = 0,630, P < 0,05). Причины его неудовлетворительной чувствительности могут быть связаны с нерегулярным сбором проб, температурой хранения и сроками доставки.
Метод сэндвича с двойными антителами для обнаружения фекального антигена инфекции H. pylori является эффективной и специфичной иммунологической технологией обнаружения. Суть этого метода заключается в том, чтобы воспользоваться специфической связывающей способностью антител и обеспечить точную идентификацию и количественное определение целевых антигенов с помощью оригинальной системы обнаружения. В частности, этот подход включает в себя два ключевых этапа: захват антигена и обнаружение антител. Принципиальная схема данной технологии представлена на рисунке 5.
Мышиное антитело против HP, покрытое областью обнаружения полиэфирной мембраны (T), нацелено на эпитоп H. pylori VacA для достижения специфического захвата антигена H. pylori в кале. Антиген VacA является важным экзотоксином H. pylori, тесно связанным с инфекцией. Антитела, нацеленные на VacA , могут эффективно идентифицировать антиген и связываться с ним, образуя комплекс антиген-антитело. Поэтому этот метод нелегко совместить с другими желудочно-кишечными заболеваниями или болезнями.
Во время испытания жидкий образец поступает в резервуар для обнаружения и мигрирует вверх за счет капиллярного действия. Если образец содержит антиген H. pylori , он сначала образует комплекс антиген-антитело с меченным латексом мышиным антителом против H. pylori , покрытым полиэфирной пленкой. По мере того, как комплекс протекает через зону обнаружения (Т), он захватывается иммобилизованным мышиным антителом против H. pylori , в результате чего в зоне обнаружения (Т) появляется видимая красная полоса, что указывает на положительный результат. Если в образце отсутствует антиген H. pylori , то в зоне обнаружения (Т) не образуется двойной сэндвич-комплекс антител, и, следовательно, не появляется красная полоса, что указывает на отрицательный результат. Независимо от наличия или отсутствия антигена H. pylori , конъюгат латекс-БСА-биотин будет связываться со стрептавидином, иммобилизованным на мембране во время хроматографии, образуя красную полосу в зоне контроля качества (С). Эта красная полоса служит как индикатором правильности хроматографического процесса, так и стандартом внутреннего контроля реагента.
Метод сэндвича с двойными антителами обеспечивает эффективный захват и качественное обнаружение антигена H. pylori в фекалиях с помощью тщательно разработанных антител и маркеров. Его простота, быстрота и высокая специфичность обеспечивают надежную техническую поддержку для ассистента диагностики инфекции H. pylori . Широкое применение этой технологии не только снижает медицинские расходы и повышает эффективность скрининга, но и обеспечивает пациентам более комфортный и удобный опыт тестирования. Этот прогресс имеет большое значение для глобальной профилактики и борьбы с инфекцией H. pylori .
Кроме того, критически важным фактором является гигиена тестирования кала на антиген. Для этого метода требуются свежие образцы кала, которые могут быть как сформированными, так и несформированными, без особых ограничений по времени сбора. Во время отбора проб важно избегать загрязнения водой, мочой, дезинфицирующими средствами или сточными водами. Образцы кала следует собирать в чистые, сухие контейнеры без консервантов и моющих средств. При необходимости хранения образцы могут храниться при комнатной температуре не более 6 часов или при температуре 2-8 °C до 72 часов. Для получения точных результатов охлажденные образцы необходимо довести до комнатной температуры перед тестированием. Высокая эффективность использования времени также является важной особенностью обнаружения антигена инфекции H . pylori в стуле. Сэндвич-анализ на основе латекса с двойными антителами может дать результаты в течение 10-20 минут по сравнению с традиционными методами, требующими ожидания лабораторных результатов, что важно для распознавания острой инфекции и раннего принятия решений о лечении в отдаленных и отсталых районах.
Таким образом, обнаружение антигена H. pylori в стуле имеет множество методологических преимуществ, включая неинвазивность, простоту, гигиеничность, высокую эффективность и широкую применимость. Эти особенности делают этот метод ценным инструментом для клинической практики и обеспечивают инновационные идеи для будущего развития диагностических технологий. В слаборазвитых регионах с ограниченными санитарными условиями этот подход готов сыграть ключевую роль в диагностике и лечении инфекции H. pylori .
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Никакой
Материалы
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
Ссылки
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены