Method Article
Schneller Nachweis des fäkalen Antigens einer Helicobacter pylori-Infektion basierend auf der Doppelantikörper-Sandwich-Nachweistechnologie
In diesem Artikel
Zusammenfassung
In dieser Studie wurde eine Sandwich-Detektionstechnik auf Basis von Doppelantikörpern für den schnellen Nachweis von fäkalen Antigenen, die mit Helicobacter pylori infiziert sind, entwickelt.
Zusammenfassung
Helicobacter pylori kann in der Magenschleimhaut parasitär sein, was nach einer Infektion eine Reihe von Magen-Darm-Erkrankungen verursachen kann und eng mit Gastritis, Magengeschwüren und Magenkrebs verwandt ist. Die hohe Prävalenz von H. pylori-Infektionen in Regionen mit schlechter medizinischer Infrastruktur und unzureichenden sanitären Einrichtungen stellt nach wie vor ein erhebliches Problem für die öffentliche Gesundheit dar. Daher ist die Entwicklung schneller, einfacher und kostengünstiger Screening-Methoden für den Nachweis von H. pylori in ressourcenbegrenzten Umgebungen von größter Bedeutung.
In dieser Studie führten wir ein gemeindebasiertes Screening im Dorf Shitan in der Provinz Guangdong durch, einem abgelegenen und unterentwickelten Gebiet mit einer ständigen Bevölkerung von etwa 300 Einwohnern mit allgemein niedrigem Bildungsniveau. Wir verwendeten einen Doppelantikörper-Sandwich-Assay für den Nachweis von h. pylori fäkalem Antigen, eine Methode, die aufgrund ihrer potenziellen Anwendbarkeit in ressourcenarmen Umgebungen ausgewählt wurde. Insgesamt wurden 261 Teilnehmer aus dem Dorf eingeschrieben, und ihre Stuhlproben wurden mit dieser Technik analysiert. Zur vergleichenden Validierung wurden dieselben Proben einer quantitativen Polymerase-Kettenreaktion (qPCR)-Analyse unterzogen. Verglichen mit den qPCR-Ergebnissen betrugen die Sensitivität und Spezifität des Nachweises von H. pylori-Antigen im Kot 60,24 % bzw. 80,08 %. Die Ergebnisse zeigten eine starke Übereinstimmung zwischen der Methode des fäkalen Antigen-Nachweises und der qPCR (Kappa = 0,630). In dieser Studie wurden die Prinzipien, Verfahren, Methoden und klinischen Anwendungen des fäkalen Antigennachweises bei H. pylori-Infektionen systematisch aufgeklärt, mit dem Ziel, die latexbasierte Doppelantikörper-Sandwich-Technologie zu erforschen und neue Strategien und praktische Richtlinien für ihre Hilfsdiagnose zu etablieren.
Einleitung
Helicobacter pylori (H. pylori, Hp) ist ein mikroaerophiles, spiralförmiges, gramnegatives Bakterium1. Aufgrund seiner Fähigkeit, den menschlichen Magen zu besiedeln und chronisch zu infizieren2, wurde dieser Erreger als ein wichtiger ätiologischer Faktor bei der Entwicklung des Adenokarzinoms des Magens identifiziert 3,4. Im Jahr 2015 litten ~4,4 Milliarden Menschen auf der Welt an einer H. pylori-Infektion 5. Die Prävalenz von H. pylori-Infektionen weist erhebliche geografische Unterschiede auf, wobei Entwicklungsländer im Vergleich zu Industrieländern signifikant höhere Raten aufweisen. Insbesondere in Ländern mit niedrigem Einkommen und in bestimmten gefährdeten Bevölkerungsgruppen kann die Infektionsrate bis zu 75 % erreichen6.
Obwohl traditionelle Nachweismethoden wie die Gastroskopie genau sind, ist ihre Anwendung bei groß angelegten Vorsorgeuntersuchungen und der routinemäßigen Nachsorge aufgrund ihrer Invasivität, der hohen Kosten und der geringen Patientenakzeptanz begrenzt7. Daher ist die Suche nach nicht-invasiven, einfachen und schnellen Diagnosemethoden zu einer wichtigen Richtung der modernen klinischen Medizin geworden. Der Hauptzweck einer nicht-invasiven Diagnose von H. pylori besteht darin, ohne endoskopische Untersuchung genau, sicher und bequem zu erkennen, ob der Patient mit H. pylori infiziert ist. Der Harnstoff-Atemtest (UBT), der H. pylori-Stuhlantigentest (FAT)8 und der serologische Test9 sind beliebte nicht-invasive Techniken.
Unter diesen ist die UBT das am wenigsten einschneidende und genaueste verfügbare Verfahren10. Die Sensitivität und Spezifität der UBT liegt bei über 95 %11. Unter den verfügbaren nicht-invasiven Diagnosemethoden hat sich die UBT als die genaueste und zuverlässigste erwiesen, wie eine im Irak durchgeführte Validierungsstudie zeigte, kann die UBT aufgrund ihrer höheren Leistung im Vergleich zu anderen Methoden als erste Wahl empfohlen werden12. UBT hat jedoch auch seine Nachteile, wie z. B. die hohen Kosten und den Bedarf an massenspektrometrischer Analyse, was die Anwendung in entfernten oder ressourcenbegrenzten Umgebungen einschränkt13.
Die Entwicklung einer schnellen, nicht-invasiven und kostengünstigen Diagnosemethode zum Nachweis einer H. pylori-Infektion ist dringend erforderlich, insbesondere in Regionen mit begrenzten Ressourcen. In dieser Studie haben wir eine Schnellnachweistechnologie für H. pylori-Stuhlantigen entwickelt, die auf der Doppelantikörper-Sandwich-Detektionstechnologie basiert und das H. pylori-Antigen in Stuhlproben schnell, effektiv und kostengünstig nachweisen kann. Diese Technologie bietet erhebliche Vorteile, darunter Erschwinglichkeit, Nicht-Invasivität, Benutzerfreundlichkeit und Anpassungsfähigkeit an abgelegene Gebiete. Wir gehen davon aus, dass die Doppelantikörper-Sandwich-Methode zum Nachweis des stuhlen Antigens von H. pylori eine Sensitivität und Spezifität aufweist, die mit der qPCR vergleichbar ist, was sie als brauchbares Werkzeug für die nicht-invasive klinische Diagnose positioniert.
Wir haben die Prinzipien, Verfahren, methodischen Stärken und die klinische Anwendbarkeit des fäkalen Antigennachweises bei H. pylori-Infektionen umfassend detailliert beschrieben. Um die Praktikabilität zu validieren, führten wir eine epidemiologische Untersuchung und ein Screening im Dorf Shitan in der Stadt Qingyuan in der Provinz Guangdong in China durch, einem abgelegenen und unterentwickelten Gebiet mit einer ständigen Bevölkerung von etwa 400 Einwohnern und begrenztem Bildungsniveau. Unsere Ergebnisse zeigen, dass die hier entwickelte Schnellnachweistechnologie des H. pylori-Antigens im Kot innerhalb von 20 Minuten abgeschlossen werden kann. Es wird hervorgehoben, dass der schnelle Nachweis des H. pylori-Antigens im Kot ein potenzielles und vielversprechendes Instrument für die schnelle und zuverlässige Diagnose einer H. pylori-Infektion in abgelegenen und rückständigen Gebieten ist.
Protokoll
Diese Querschnittsstudie wurde von der Ethikkommission des Volkskrankenhauses der Provinz Guangdong genehmigt (Zulassungsnummer: KY2024-445-01), und die persönlichen Daten aller Studienteilnehmer wurden während der Studie streng vertraulich behandelt. Alle Teilnehmer unterschrieben vor den Experimenten eine schriftliche Einverständniserklärung. Die Bewohner des Dorfes Shitan in der Stadt Qingyuan in der Provinz Guangdong wurden im Jahr 2024 als Versuchspersonen ausgewählt, und es gab keine Einschränkungen hinsichtlich Alter und Geschlecht. Der unten beschriebene Doppelantikörper-Sandwich-Assay (ein qualitatives Experiment) wurde von medizinischem und technischem Fachpersonal gemäß den Anweisungen durchgeführt. Für diese Studie wurde die gesamte ständige Bevölkerung des Dorfes ausgewählt, unabhängig davon, ob sie gesund war oder Symptome oder bestehende Krankheiten im Zusammenhang mit Magen-Darm-Erkrankungen hatte.
1. Auswahl des Patienten
- Patienten sind auszuschließen, wenn sie in den letzten 1 Monat Protonenpumpenhemmer oder Wismut,H2-Rezeptorblocker oder Antibiotika eingenommen haben.
- Bitten Sie alle Teilnehmer, den Fragebogen anonym auszufüllen. Der Inhalt des Fragebogens umfasst fünf Fragen: Essen Sie regelmäßig drei Mahlzeiten? Trinken Sie Alkohol? Kennen Sie H. pylori? Halten Sie es für notwendig, eine H . pylori-Inspektion durchzuführen? Verstehen Sie die nachteiligen Folgen einer H. pylori-Infektion ?
2. Verfahren zum Nachweis von Antigen-Infektionen im Stuhl
HINWEIS: Der Algorithmus für H . pylori-Stuhlantigentests wurde entwickelt, um die Genauigkeit und Zuverlässigkeit der Ergebnisse unter Berücksichtigung von Einfachheit und Hygiene zu gewährleisten. Der gesamte Prozess ist in fünf Schritte unterteilt: Probenentnahme, Probenverarbeitung, Probenlagerung, Detektion und Ergebnisinterpretation. Das Arbeitsablaufdiagramm und das schematische Diagramm der Probendetektion sind in Abbildung 1 und Abbildung 2 dargestellt.
- Musterkollektion
HINWEIS: Für die Probenentnahme sollten H . pylori-Antigen-spezifische Behälter verwendet werden. Die Proben sollten nicht mit Wasser, Urin, Desinfektionsmitteln und Abwasser vermischt werden.- Entfernen Sie nach Beendigung des Stuhlgangs den oberen Deckel des Spezialbehälters, um den Probenahmestab herauszunehmen.
- Führen Sie den Probenahmestab kontinuierlich in fünf verschiedene Positionen des Hockers für die Probenahme ein und achten Sie darauf, dass das Gewindeende des Probenahmestabs vollständig in den Hocker eingeführt ist.
- Führen Sie den Probenahmestab wieder in das Reagenzröhrchen ein, nachdem die Probenahme abgeschlossen ist. Das Probenvolumen beträgt insgesamt ~5-50 mg.
- Probenaufbereitung
- Schütteln Sie das Reagenzröhrchen ~10 s lang von einer Seite zur anderen, um die Stuhlprobe gründlich mit dem Verdünnungsmittel zu mischen (Hauptbestandteile: Ethylendiamin, Tetraessigsäure, Tetranatriumhydrat 0,018 g/ml und Natriumchlorid 0,01 g/ml).
- Lagerung von Proben
- Testen Sie die Proben so schnell wie möglich nach der Probenahme; Lagern Sie sie bei Raumtemperatur nicht länger als 6 h und unter gekühlten Bedingungen (nicht länger als 72 h bei 2-8 °C und nicht länger als 6 Monate eingefroren bei -25 °C bis -15 °C), falls erforderlich, um den Antigenabbau und die mikrobielle Aktivität zu verlangsamen.
HINWEIS: Proben können wiederholt eingefroren und bis zu 3x aufgetaut werden, und sowohl gekühlte als auch gefrorene Proben sollten vor dem Test wieder auf Raumtemperatur gebracht werden.
- Testen Sie die Proben so schnell wie möglich nach der Probenahme; Lagern Sie sie bei Raumtemperatur nicht länger als 6 h und unter gekühlten Bedingungen (nicht länger als 72 h bei 2-8 °C und nicht länger als 6 Monate eingefroren bei -25 °C bis -15 °C), falls erforderlich, um den Antigenabbau und die mikrobielle Aktivität zu verlangsamen.
- Nachweis von Proben
- Öffnen Sie die weiße Abdeckung auf der Abdeckung des Reagenzröhrchens und halten Sie das Reagenzröhrchen aufrecht.
- Drücken Sie den Deckel bis zum tiefsten Punkt nach unten, so dass die Probe auf der Testkarte durch den Nachweisbereich (T) und den Qualitätskontrollbereich (C) fließt, die mit dem Maus-Anti-Hp-Antikörper beschichtet sind.
- Interpretation der Ergebnisse
- Warten Sie 10-20 Minuten, damit jedes H. pylori-Antigen in der Probe, wenn es an den Antikörper gebunden ist, im Nachweisbereich eine makroskopische chromogene Reaktion eingeht. Diese wird in der Regel als rote oder violette Linie angezeigt, die sich von der Linie im Bereich der Qualitätskontrolle abhebt.
- Das Vorhandensein oder Fehlen der Farbreaktion und die Tiefe der Farbe hängen mit der Konzentration des H. pylori-Antigens in der Probe zusammen. Vergleichen Sie die Farbkarten, um die Ergebnisse schnell und genau zu interpretieren (siehe Abbildung 3).
3. DNA-Extraktion
- Geben Sie eine angemessene Menge Kot in ein Reagenzglas, fügen Sie PBS-Lösung hinzu und mischen Sie es gründlich durch Schütteln. Zentrifugieren Sie die Mischung bei 12.000 × g für 5-10 min und sammeln Sie dann vorsichtig 200 μl des Überstands für die weitere Extraktion.
- Bereiten Sie basierend auf der Anzahl der Proben eine gleiche Anzahl von 1,5-ml-Zentrifugenröhrchen vor. Geben Sie nacheinander 20 μl Proteinase K (20 mg/ml), 10 μl magnetische Kügelchen, 200 μl des Probenüberstands und 200 μl Lysepuffer A. Mischen Sie gründlich, indem Sie die Röhrchen umdrehen, und inkubieren Sie dann 10 Minuten lang in einem Metallbad bei 55 °C.
- Nachdem die Pyrolyse abgeschlossen ist, setzen Sie das Zentrifugenröhrchen auf den Magnetrahmen, lassen Sie es stehen und lassen Sie die Adsorption an den Kügelchen 1 Minute lang stattfinden. Nachdem die Flüssigkeit im Röhrchen vollständig geklärt ist, entsorgen Sie den Überstand und versuchen Sie, die magnetischen Kügelchen nicht zu stören.
- Nehmen Sie die Röhrchen aus dem Magnetgestell und legen Sie sie auf ein 1,5-ml-Zentrifugenröhrchengestell. Geben Sie mit einer Pipette 500 μl Waschpuffer E in jedes Röhrchen, mischen Sie es 1 Minute lang gründlich und legen Sie die Röhrchen dann wieder in das Magnetgestell. Lassen Sie die Röhrchen 1 Minute stehen, entsorgen Sie den Überstand nach der Klärung und vermeiden Sie das Ansaugen der Magnetkügelchen.
- Wiederholen Sie den Waschvorgang, indem Sie 500 μl Waschpuffer W2 in jedes Röhrchen geben. 1 Minute gründlich mischen, die Röhrchen auf das Magnetgestell legen und 1 Minute ziehen lassen. Entsorgen Sie den Überstand vorsichtig, nachdem die Lösung geklärt ist, und stellen Sie sicher, dass die magnetischen Kügelchen ungestört bleiben.
- 100 μl Eluent zugeben, mischen und 5 Minuten lang bei 55 °C inkubieren.
- Legen Sie die Röhrchen auf das Magnetgestell und lassen Sie sie 2 Minuten stehen. Sobald die Lösung geklärt ist, übertragen Sie die eluierte Nukleinsäure vorsichtig in ein neues Zentrifugenröhrchen, um ein Ansaugen der magnetischen Kügelchen zu vermeiden.
- Die Reinheit der extrahierten DNA wird durch Messung der Extinktion bei 260 nm (A260) und 280 nm (A280) bewertet. Berechnen Sie das Verhältnis A260/A280 , das idealerweise größer als 1,8 für hochreine DNA sein sollte.
4. qPCR zum Nachweis von H. pylori und Resistenz gegen Antibiotika
HINWEIS: Wir führten eine qPCR zum Nachweis einer H. pylori-Infektion durch, indem wir das Harnstoff-Gen amplifizierten. Bei allen Produkten zur negativen Qualitätskontrolle handelt es sich um steriles, gereinigtes Wasser. Das positive Qualitätskontrollprodukt im H. pylori-Nukleinsäure-Nachweiskit sind inaktivierte H. pylori-Standardkügelchen (ATCC 43504). Ein CT ≤ 30 mit einer typischen S-förmigen Kurve wird als positiv angesehen.
- Entsprechend der Anzahl der zu testenden Proben nehmen Sie das gefriergetrocknete Präparat von H. pylori aus dem Kit und drehen Sie es schnell, um das gefriergetrocknete Pulver am Boden des Röhrchens zu halten.
- Öffnen Sie vorsichtig den Deckel der gefriergetrockneten Zubereitung; Entnahme der Nukleinsäure der zu testenden Probe; 25 μl der Nukleinsäure der Probe in das gefriergetrocknete Präparat geben; und decken Sie die Tube fest ab.
- Schütteln und mischen Sie das PCR-Reagenz gleichmäßig für 8-10 s und drehen Sie es dann schnell für 3-5 s.
- Bereiten Sie für jede Probe auf einer 32-Well-Platte 25 μl des PCR-Reaktionsgemisches (gefriergetrocknetes Pulver [enthält das Taq-Enzym (5 U/μL), Desoxyribonukleosidtriphosphat (2,5 mmol/L), UNG-Enzym (2 U/μL), HarnstoffA-Vorwärts - (5'-ACATTGCGAGCGGGACAG-3') und Rückwärtsprimer (5'-CGCCCAATCTCACTTTATCG-3') (40 μmol/L)]) und 25 μL (2,5 μg) der extrahierten DNA vor.
- Führen Sie die 32-Well-Platten-qPCR-Platine auf der qPCR-Maschine aus. Programmieren Sie den Thermocycler: 42 °C und 95 °C (beide für einen Zyklus) für jeweils 2 Minuten; 95 °C für 10 s und 65 °C für 45 s (zwei Stufen sind ein Zyklus) für 10x; 95 °C für 10 s und bei 58 °C für 45 s (zwei Stufen sind ein Zyklus) für 35 Zyklen.
- Analysieren Sie die Daten mit einer speziellen Software für die qPCR und lassen Sie das Gerät automatisch Baseline-Schwellenwerte auswählen.
5. Statistische Analyse
- Verwenden Sie den Chi-Quadrat-Test, um die experimentellen Daten zu analysieren, um die Konsistenz zwischen dieser Methode und den qPCR-Ergebnissen zu bewerten und die Positivrate dieses Technologie-Screenings mit den Positivratendaten der H. pylori-Infektion auf einer breiteren Skala (z. B. landesweit) zu vergleichen. Betrachten Sie Unterschiede bei P < 0,05 als statistisch signifikant.
Ergebnisse
Fragebogen-Befragung
Insgesamt wurden 261 Teilnehmer in die Studie aufgenommen, darunter 144 Frauen und 117 Männer im Alter von 4 bis 99 Jahren. Das Durchschnittsalter der Probanden lag bei 48,30 ± 17,61 Jahren. Es nahmen 17 Minderjährige (0-17 Jahre), 202 Erwachsene (18-64 Jahre) und 42 ältere Teilnehmer (>64 Jahre) teil. Die Ergebnisse des Fragebogens sind in Tabelle 1 dargestellt. Die Mehrheit (90,8%) der Probanden hielt es für notwendig, ein H. pylori-Screening durchzuführen.
Screening-Ergebnisse des fäkalen H. pylori-Antigen-Nachweises in diesem Dorf
Von den 261 Teilnehmern, die auf fäkales H. pylori-Antigen getestet wurden, waren 52 (19,92 %) positiv, während 209 negativ waren. Von den 52 positiven Fällen waren 32 weiblich, was 22,22 % aller weiblichen Teilnehmer entspricht, und 20 männlich, was 17,09 % aller männlichen Teilnehmer entspricht. Bei der Stratifizierung nach Alter stellten sich die Positivitätsraten wie folgt dar: Bei Minderjährigen (0-17 Jahre) gab es 2 positive Fälle (11,76 %), bei Erwachsenen (18-64 Jahre) 41 positive Fälle (20,30 %) und bei älteren Menschen (>64 Jahre) 9 positive Fälle (21,43 %).
Vergleich der Konsistenz zwischen fäkalem H. pylori-Antigen und qPCR-Ergebnissen
In dieser Studie wurden zwei Proben mit unterschiedlichen qPCR-Testergebnissen ausgewählt, um die Zuverlässigkeit des experimentellen Protokolls zu charakterisieren (Abbildung 4). Von den fäkalen H. pylori-Antigen-Ergebnissen von 261 Probanden waren 52 positiv und 209 negativ. Von den Ergebnissen der qPCR mit dem Kot von 261 Probanden waren 83 positiv und 178 negativ (Tabelle 2). Die Sensitivität und Spezifität des fäkalen H. pylori-Antigen-Nachweises betrugen 60,24 % bzw. 80,08 %. Der positive prädiktive Wert (PPV) dieser Methode betrug 96,15 % und der negative prädiktive Wert (NPV) 84,21 %. Der Kappa-Konsistenztest zeigt an, dass die Diagnoseergebnisse der beiden Methoden übereinstimmen (Kappa = 0,630, P < 0,05).
Vergleich der Screening-Positivrate zwischen diesem natürlichen Dorf und dem ganzen Land
Die Positivitätsrate lag bei 19,92 % und damit leicht unter der nationalen Positivrate von 42,8 %14 (Tabelle 3). Nach dem Chi-Quadrat-Test (P < 0,01) war der Unterschied in den Positivraten statistisch signifikant.

Abbildung 1: Flussdiagramm der Probenerkennung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
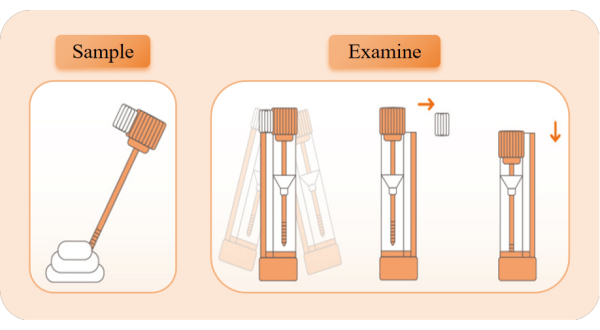
Abbildung 2: Das schematische Diagramm der Probenentnahme und -detektion. Nehmen Sie das Detektionsgerät heraus, reißen Sie den Aluminiumfolienbeutel auf und nehmen Sie das Reagenzröhrchen heraus. Ziehen Sie die orangefarbene Röhrchenabdeckung ab und verwenden Sie das Probenahmestäbchen, um 5x Proben aus verschiedenen Positionen des Stuhls zu entnehmen. Setzen Sie den Probenahmestab wieder in das Reagenzröhrchen ein und schütteln Sie ihn 10 s lang nach links und rechts, um vollständig zu mischen. Brechen Sie den weißen Begrenzungsblock, halten Sie das Reagenzröhrchen aufrecht und drücken Sie die Röhrchenabdeckung in die niedrigste Position, um mit der Zeitmessung zu beginnen. Beobachten Sie das Erscheinungsbild von roten Bändern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Interpretation der Antigenergebnisse. (A) Probenehmer. (B,E) Negativ (-): Ein negatives Ergebnis deutet darauf hin, dass in der Probe kein H. pylori-Antigen nachgewiesen wurde, was darauf hindeutet, dass das Risiko einer H. pylori-Infektion gering ist. Ein negatives Ergebnis kann die Möglichkeit einer Infektion nicht vollständig ausschließen. (C,F) Positiv (+): Ein positives Ergebnis bedeutet, dass H. pylori-Antigen in der Probe nachgewiesen wurde, es besteht der Verdacht auf eine H. pylori-Infektion . (D) Keine Wirkung: Ungültige Ergebnisse können ein Problem bei der Probenentnahme oder -handhabung sein, oder das Reagenz hat sich verschlechtert und ist beschädigt, und die Probe sollte erneut entnommen oder die Operationsschritte wiederholt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
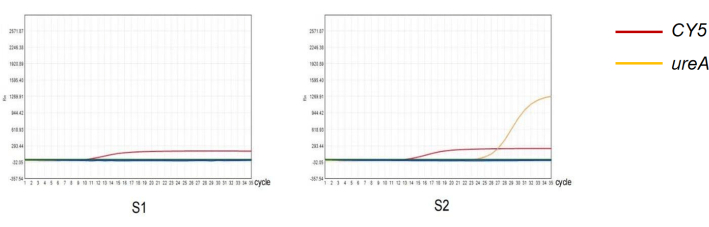
Abbildung 4: Nachweis von H. pylori im Kot mittels qPCR-Methode. (S1) Negatives Ergebnis der quantitativen PCR-Amplifikation einer H. pylori-Infektion . (S2) Positives Ergebnis der quantitativen PCR-Amplifikation der H. pylori-Infektion . Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
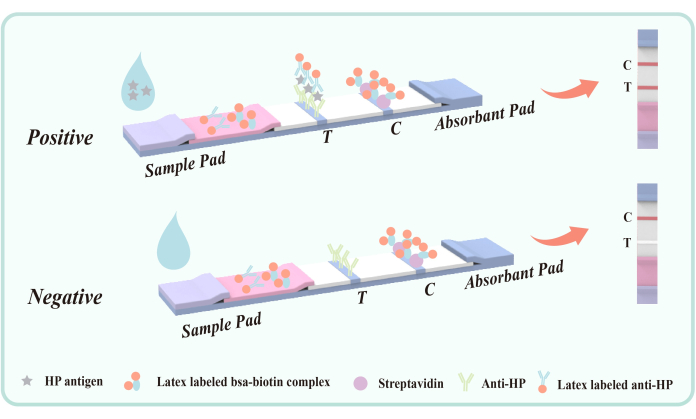
Abbildung 5: Schematische Darstellung der Doppelantikörper-Sandwich-Methode zum Nachweis von fäkalem Antigen, das mit H. pylori infiziert ist. Der Maus-Anti-Hp-Antikörper (VacA-Epitop) wurde im Vorfeld im Detektionsbereich (T) auf der Membran fixiert. Im Qualitätskontrollbereich (C) werden Anti-Maus-IgG und Streptavidin für Ziegen im Voraus fixiert. Die Polyesterfolie wurde mit latexmarkiertem Maus-Anti-Hp-Antikörper und Latex-BSA-Biotin-Konjugat beschichtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Ob Sie regelmäßig drei Mahlzeiten essen sollten? | Ob man Alkohol trinken soll? | Kennen Sie H. pylori? | Ist es notwendig, eine H . pylori-Inspektion durchzuführen? | Verstehen Sie die nachteiligen Folgen einer H. pylori-Infektion ? | |
| Ja (Tarif) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| Nein (Satz) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
Tabelle 1: Die Ergebnisse des Fragebogens.
| H. pylori-Antigen | Gesamt | |||
| Positiv (+) | Negativ (-) | |||
| qPCR | Positiv (+) | 50 | 33 | 83 |
| Negativ (-) | 2 | 176 | 178 | |
| Gesamt | 52 | 209 | 261 | |
Tabelle 2: Diagnostische Ergebnisse von zwei Techniken.
| Positiv | Negativ | Positiv-Rate | Gesamt | |
| Dorf Shitan | 52 | 209 | 19.92% | 261 |
| China | 314423 | 449404 | 42.80% | 763827 |
Tabelle 3: Vergleich der Positivitätsraten des H. pylori-Screenings zwischen Shitan Village und dem nationalen Durchschnitt.
Diskussion
H. pylori stellt eine der weltweit am weitesten verbreiteten bakteriellen Infektionen dar15. Die Ergebnisse des Fragebogens zeigten, dass 55,2 % der Bevölkerung kein Bewusstsein für H. pylori hatten, während 90,8 % der Meinung waren, dass ein H. pylori-Screening notwendig ist. Diese Ergebnisse unterstreichen die Bedeutung der Durchführung von H. pylori-Screening-Programmen in wirtschaftlich benachteiligten und abgelegenen Gebieten16. Obwohl der Harnstoff-Atemtest (UBT) eine gängige Diagnosemethode ist, schränken seine hohen Kosten und die Untauglichkeit für Kinder und Schwangere seine Anwendbarkeit ein17,18. Der Serum-H. pylori-Antikörpertest kann Antikörper im Serum eines Patienten nachweisen19. Dieser Test ist jedoch nicht für die Nachbehandlung geeignet, da die Antikörper noch lange nach der Beseitigung der Bakterien bestehenbleiben 20. Im Gegensatz dazu bietet die Stuhlantigen-Testung einen nicht-invasiven Ansatz, der einen Zugang zur Magenhöhle überflüssig macht und nur Stuhlproben für die Analyse benötigt. Diese Methode reduziert das Unbehagen der Patienten und potenzielle Risiken erheblich und macht sie sowohl für das Screening als auch für die Nachsorge bequemer. Darüber hinaus ist es aufgrund seiner nicht-invasiven Natur für die Bevölkerung in abgelegenen und unterentwickelten Regionen akzeptabler.
Die Prävalenz von H. pylori-positiven Patienten in unserer Studienpopulation liegt bei 19,92 % und damit leicht unter der nationalen Positivrate von 42,8 %14. Nach dem Chi-Quadrat-Test (P < 0,01) gab es eine statistische Signifikanz zwischen ihnen. Der Grund für diesen Unterschied könnte darin liegen, dass die Infektionsrate von H. pylori in der städtischen Bevölkerung in sieben geographischen Regionen Chinas eine deutliche regionale Differenzierung aufweist21. Die Infektionsrate ist in Ostchina am höchsten, in Nordostchina, Nordchina und Nordwestchina höher und in Südchina und Südwestchina niedriger21. Das von uns untersuchte Gebiet gehört zu Südchina, und die Infektionsrate ist niedriger als auf nationaler Ebene. Auf der anderen Seite können auch die nicht standardmäßige Vorgehensweise bei der Probenahme einzelner Stuhlproben und die lange Zeit für die Einsendung zur Untersuchung die Gründe für diesen Unterschied sein. Obwohl PCR und ihre Derivate in großem Umfang zum Nachweis verschiedener Krankheitserreger, einschließlich H. pylori, eingesetzt werden, wird ihr Nutzen durch die Komplexität und die Kosten der Thermocycler-Ausrüstung und den Bedarf an spezialisierten Bedienern begrenzt22,23. In dieser Studie betrugen die Sensitivität und Spezifität des Nachweises von H. pylori-Antigen im Kot im Vergleich zu qPCR-Ergebnissen 60,24 % und 80,08 %. Die Konsistenz des H. pylori-Antigens im Kot und die qPCR-Ergebnisse wurden verglichen, und die Ergebnisse deuteten darauf hin, dass sie mäßig konsistent waren (Kappa = 0,630, P < 0,05). Die Gründe für die unbefriedigende Empfindlichkeit können durch unregelmäßige Probenentnahme, Probenlagertemperatur und Lieferzeit beeinflusst werden.
Die Doppel-Antikörper-Sandwich-Methode zum Nachweis des fäkalen Antigens einer H . pylori-Infektion ist eine effiziente und spezifische immunologische Nachweistechnologie. Der Kern dieser Methode besteht darin, die spezifische Bindungsfähigkeit von Antikörpern zu nutzen und durch ein ausgeklügeltes Nachweissystem eine genaue Identifizierung und Quantifizierung von Zielantigenen zu gewährleisten. Konkret umfasst dieser Ansatz zwei wichtige Schritte: den Antigeneinfang und den Antikörpernachweis. Das schematische Diagramm dieser Technologie ist in Abbildung 5 dargestellt.
Der Maus-Anti-Hp-Antikörper, der auf die Polyestermembran-Detektionsregion (T) aufgetragen ist, zielt auf das H. pylori-VacA-Epitop ab, um eine spezifische Erfassung des H. pylori-Antigens im Kot zu erreichen. Das VacA-Antigen ist ein wichtiges Exotoxin von H. pylori, das eng mit Infektionen in Verbindung gebracht wird. Antikörper, die auf VacA abzielen, können das Antigen effektiv identifizieren und an es binden und einen Antigen-Antikörper-Komplex bilden. Daher ist es nicht einfach, mit dieser Methode mit anderen Magen-Darm-Erkrankungen oder -Erkrankungen zu kreuzreagieren.
Während des Tests gelangt die flüssige Probe in den Detektionsbehälter und wandert durch Kapillarwirkung nach oben. Enthält die Probe H. pylori-Antigen , bildet sie zunächst einen Antigen-Antikörper-Komplex, wobei der latexmarkierte Maus-Anti-H. pylori-Antikörper auf die Polyesterfolie aufgetragen ist. Während der Komplex durch die Detektionszone (T) fließt, wird er von dem immobilisierten Maus-Anti-H. pylori-Antikörper eingefangen, was zu einer sichtbaren roten Bande in der Detektionszone (T) führt, was auf ein positives Ergebnis hinweist. Wenn kein H. pylori-Antigen in der Probe vorhanden ist, bildet sich kein Doppelantikörper-Sandwich-Komplex in der Nachweiszone (T), und folglich erscheint keine rote Bande, die auf ein negatives Ergebnis hinweist. Unabhängig davon, ob H . pylori-Antigen vorhanden ist oder nicht, bindet das Latex-BSA-Biotin-Konjugat während der Chromatographie an das auf der Membran immobilisierte Streptavidin und erzeugt eine rote Bande in der Qualitätskontrollzone (C). Diese rote Bande dient sowohl als Indikator für den ordnungsgemäßen chromatographischen Prozess als auch als interner Kontrollstandard für das Reagenz.
Die Doppel-Antikörper-Sandwich-Methode ermöglicht die effiziente Erfassung und den qualitativen Nachweis des H. pylori-Antigens im Kot durch sorgfältig entwickelte Antikörper und Marker. Seine Einfachheit, Schnelligkeit und hohe Spezifität bieten eine zuverlässige technische Unterstützung für die Assistenzdiagnose einer H. pylori-Infektion . Die weit verbreitete Anwendung dieser Technologie senkt nicht nur die medizinischen Kosten und verbessert die Screening-Effizienz, sondern bietet den Patienten auch ein komfortableres und bequemeres Testerlebnis. Dieser Fortschritt ist von großer Bedeutung für die globale Prävention und Kontrolle der H. pylori-Infektion .
Darüber hinaus ist die Hygiene der Stuhlantigen-Tests ein kritischer Aspekt. Diese Methode erfordert frische Stuhlproben, die entweder geformt oder ungeformt sein können, ohne dass die Entnahmezeit spezifisch eingeschränkt ist. Bei der Probenentnahme ist es wichtig, eine Kontamination mit Wasser, Urin, Desinfektionsmitteln oder Abwasser zu vermeiden. Kotproben sollten in sauberen, trockenen Behältern entnommen werden, die frei von Konservierungs- und Reinigungsmitteln sind. Falls eine Lagerung erforderlich ist, können die Proben nicht länger als 6 Stunden bei Raumtemperatur oder bis zu 72 Stunden bei 2-8 °C aufbewahrt werden. Gekühlte Proben müssen vor dem Test wieder auf Raumtemperatur gebracht werden, um genaue Ergebnisse zu gewährleisten. Eine hohe Zeiteffizienz ist auch ein wesentliches Merkmal des Antigennachweises der H . pylori-Infektion im Stuhl. Der latexbasierte Doppelantikörper-Sandwich-Assay kann Ergebnisse in 10-20 Minuten liefern, verglichen mit herkömmlichen Methoden, bei denen auf Laborergebnisse gewartet werden muss, was für die Erkennung akuter Infektionen und frühzeitige Behandlungsentscheidungen in abgelegenen und rückständigen Gebieten wichtig ist.
Zusammenfassend lässt sich sagen, dass der Nachweis des H . pylori-Antigens im Stuhl zahlreiche methodische Vorteile bietet, darunter Nicht-Invasivität, Einfachheit, Hygiene, hohe Effizienz und breite Anwendbarkeit. Diese Eigenschaften machen diese Methode zu einem wertvollen Werkzeug für die klinische Praxis und liefern innovative Erkenntnisse für die zukünftige Entwicklung diagnostischer Technologien. In unterentwickelten Regionen mit eingeschränkten hygienischen Bedingungen wird dieser Ansatz eine entscheidende Rolle bei der Diagnose und Behandlung von H. pylori-Infektionen spielen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Nichts
Materialien
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
Referenzen
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten