Method Article
Détection rapide de l’antigène fécal de l’infection à Helicobacter pylori grâce à la technologie de détection à double sandwich d’anticorps
Dans cet article
Résumé
Dans cette étude, une technique de détection sandwich basée sur des anticorps doubles a été développée pour la détection rapide des antigènes fécaux infectés par Helicobacter pylori.
Résumé
Helicobacter pylori peut être parasite de la muqueuse gastrique, ce qui peut provoquer une série de maladies gastro-intestinales après l’infection et est étroitement lié à la gastrite, à l’ulcère gastrique et au cancer gastrique. La forte prévalence de l’infection à H. pylori dans les régions où les infrastructures médicales et les zones d’assainissement sont insuffisantes reste un problème de santé publique important. Par conséquent, la mise au point de méthodes de dépistage rapides, simples et rentables pour la détection de H. pylori dans les milieux à ressources limitées est d’une importance capitale.
Dans cette étude, nous avons effectué un dépistage communautaire dans le village de Shitan, dans la province du Guangdong, une zone isolée et sous-développée caractérisée par une population permanente d’environ 300 résidents avec un faible niveau d’éducation. Nous avons utilisé un test sandwich à double anticorps pour la détection de l’antigène fécal de H. pylori , une méthode choisie pour son applicabilité potentielle dans les milieux à faibles ressources. Au total, 261 participants du village ont été recrutés et leurs échantillons de matières fécales ont été analysés à l’aide de cette technique. À des fins de validation comparative, les mêmes échantillons ont été soumis à une analyse quantitative de réaction en chaîne par polymérase (qPCR). Par rapport aux résultats de la qPCR, la sensibilité et la spécificité de la détection de l’antigène de H. pylori dans les fèces étaient de 60,24 % et 80,08 %. Les résultats ont démontré une forte concordance entre la méthode de détection de l’antigène fécal et la qPCR (Kappa = 0,630). Cette étude a systématiquement élucidé les principes, les procédures, les méthodologies et les applications cliniques de la détection des antigènes fécaux pour l’infection à H. pylori , dans le but d’explorer la technologie du sandwich à double anticorps à base de latex et d’établir de nouvelles stratégies et des directives pratiques pour son diagnostic auxiliaire.
Introduction
Helicobacter pylori (H. pylori, Hp) est une bactérie microaérophile, en forme de spirale et à Gram négatif1. En raison de sa capacité à coloniser et à infecter de manière chronique l’estomac humain2, cet agent pathogène a été identifié comme un facteur étiologique majeur dans le développement de l’adénocarcinome gastrique 3,4. En 2015, ~4,4 milliards de personnes dans le monde souffraient d’une infection à H. pylori 5. La prévalence de l’infection à H. pylori présente des variations géographiques considérables, les pays en développement connaissant des taux nettement plus élevés que les pays développés. Notamment, dans les pays à faible revenu et parmi certaines populations vulnérables, le taux d’infection peut atteindre jusqu’à 75 %6.
Bien que les méthodes de détection traditionnelles telles que la gastroscopie soient précises, leur application dans le dépistage à grande échelle et le suivi de routine est limitée en raison de leur caractère invasif, de leur coût élevé et de leur faible acceptation par les patients7. Par conséquent, la recherche de méthodes de diagnostic non invasives, simples et rapides est devenue une direction importante de la recherche en médecine clinique moderne. L’objectif principal d’un diagnostic non invasif de H. pylori est de détecter avec précision, sécurité et commodité si le patient est infecté par H. pylori sans examen endoscopique. Le test respiratoire à l’urée (UBT), le test d’antigène fécal de H. pylori (FAT)8 et le test sérologique9 sont des techniques non invasives populaires.
Parmi celles-ci, l’UBT est la procédure la moins intrusive et la plus précise disponible10. La sensibilité et la spécificité de l’UBT sont supérieures à 95 %11. Parmi les méthodes de diagnostic non invasives disponibles, l’UBT s’est avérée être la plus précise et la plus fiable, comme le montre une étude de validation menée en Irak, l’UBT peut être recommandée comme premier choix en raison de ses performances supérieures à celles des autres méthodes12. Cependant, l’UBT présente également des inconvénients, tels que son coût élevé et la nécessité d’une analyse par spectrométrie de masse, ce qui limite l’application dans des environnements éloignés ou aux ressources limitées13.
La mise au point d’une méthode de diagnostic rapide, non invasive et rentable pour détecter l’infection à H. pylori est absolument nécessaire, en particulier dans les régions aux ressources limitées. Dans cette étude, nous avons développé une technologie de détection rapide de l’antigène fécal de H. pylori basée sur la technologie de détection en sandwich d’anticorps doubles, qui peut détecter l’antigène de H. pylori dans les échantillons fécaux rapidement, efficacement et à faible coût. Cette technologie offre des avantages significatifs, notamment son prix abordable, son caractère non invasif, sa facilité d’utilisation et sa capacité d’adaptation aux régions éloignées. Nous émettons l’hypothèse que la méthode sandwich à double anticorps pour détecter l’antigène fécal de H. pylori démontrera une sensibilité et une spécificité comparables à la qPCR, ce qui la positionne comme un outil viable pour le diagnostic clinique non invasif.
Nous avons détaillé en détail les principes, les procédures, les forces méthodologiques et l’applicabilité clinique de la détection des antigènes fécaux pour l’infection à H. pylori . Pour valider son caractère pratique, nous avons mené une enquête épidémiologique et un dépistage dans le village de Shitan, dans la ville de Qingyuan, dans la province du Guangdong, en Chine, qui est une région éloignée et sous-développée avec une population permanente d’environ 400 personnes et un niveau d’éducation limité. Nos résultats démontrent que la technologie de détection rapide de l’antigène de H. pylori dans les fèces conçue ici peut être réalisée en 20 min. Il est souligné que la détection rapide de l’antigène de H. pylori dans les matières fécales est un outil potentiel et prometteur pour le diagnostic rapide et fiable de l’infection à H. pylori dans les zones reculées et arriérées.
Protocole
Cette étude transversale a été approuvée par le comité d’éthique de l’hôpital populaire provincial du Guangdong (numéro d’approbation : KY2024-445-01), et les données personnelles de tous les sujets de l’étude ont été strictement confidentielles pendant l’étude. Tous les participants ont signé un consentement éclairé écrit avant les expériences. En 2024, les habitants du village de Shitan, dans la ville de Qingyuan, dans la province du Guangdong, ont été sélectionnés comme sujets de recherche, et il n’y avait aucune restriction d’âge et de sexe. Le test sandwich à double anticorps (une expérience qualitative) décrit ci-dessous a été effectué par du personnel médical et technique professionnel conformément aux instructions. L’ensemble de la population permanente du village a été sélectionnée pour cette étude, qu’elle soit en bonne santé ou qu’elle présente des symptômes ou des maladies existantes liées aux maladies gastro-intestinales.
1. Sélection des patients
- Excluez les patients s’ils ont utilisé des inhibiteurs de la pompe à protons ou du bismuth, des antagonistes des récepteursH2 ou des antibiotiques au cours du mois précédent.
- Demandez à tous les participants de remplir le questionnaire de manière anonyme. Le contenu du questionnaire comprend cinq questions : Prenez-vous trois repas régulièrement ? Buvez-vous de l’alcool ? Connaissez-vous H. pylori ? Pensez-vous qu’il est nécessaire d’effectuer une inspection de H. pylori ? Comprenez-vous les conséquences néfastes de l’infection à H. pylori ?
2. Procédure de détection de l’antigène de l’infection fécale à H. pylori
REMARQUE : L’algorithme de test de l’antigène des selles de H. pylori a été conçu pour assurer l’exactitude et la fiabilité des résultats, en tenant compte de la simplicité et de l’hygiène. L’ensemble du processus est divisé en cinq étapes : prélèvement d’échantillons, traitement des échantillons, stockage des échantillons, détection et interprétation des résultats. L’organigramme de travail et le schéma de principe de la détection d’échantillon sont illustrés aux figures 1 et 2.
- Prélèvement d’échantillons
REMARQUE : Des contenants spécifiques de l’antigène H. pylori doivent être utilisés pour le prélèvement des échantillons. Les échantillons ne doivent pas être mélangés avec de l’eau, de l’urine, des désinfectants et des eaux usées.- Une fois la défécation terminée, retirez le couvercle supérieur du récipient spécial pour retirer la tige d’échantillonnage.
- Insérez la tige d’échantillonnage en continu dans cinq positions différentes du tabouret pour l’échantillonnage, en vous assurant que l’extrémité filetée de la tige d’échantillonnage est complètement insérée dans le tabouret.
- Réinsérez la tige d’échantillonnage dans le tube à réactif une fois l’échantillonnage terminé ; Le volume de l’échantillon est de ~5-50 mg au total.
- Traitement des échantillons
- Agiter le tube de réactif d’un côté à l’autre pendant ~10 s pour bien mélanger l’échantillon de selles dans le diluant (ingrédients principaux : acide éthylènediamine tétraacétique hydraté de tétrasodium 0,018 g/mL et chlorure de sodium 0,01 g/mL).
- Stockage des échantillons
- Tester les échantillons le plus tôt possible après l’échantillonnage ; les conserver à température ambiante pendant 6 h au plus et au réfrigérateur (pas plus de 72 h à 2-8 °C et pas plus de 6 mois congelés à -25 °C à -15 °C) si nécessaire pour ralentir la dégradation de l’antigène et l’activité microbienne.
REMARQUE : Les échantillons peuvent être congelés et décongelés à plusieurs reprises jusqu’à 3 fois, et les échantillons réfrigérés et congelés doivent être remis à température ambiante avant d’être testés.
- Tester les échantillons le plus tôt possible après l’échantillonnage ; les conserver à température ambiante pendant 6 h au plus et au réfrigérateur (pas plus de 72 h à 2-8 °C et pas plus de 6 mois congelés à -25 °C à -15 °C) si nécessaire pour ralentir la dégradation de l’antigène et l’activité microbienne.
- Détection d’échantillons
- Ouvrez le couvercle blanc du couvercle du tube de réactif et maintenez le tube de réactif en érection.
- Appuyez sur le couvercle jusqu’au point le plus bas pour que l’échantillon s’écoule sur la carte de test, en passant par la zone de détection (T) et la zone de contrôle de la qualité (C) recouvertes de l’anticorps anti-Hp de souris.
- Interprétation des résultats
- Attendez 10 à 20 minutes pour que tout antigène de H. pylori dans l’échantillon, s’il est lié à l’anticorps, forme une réaction chromogène macroscopique dans la zone de détection. Il s’agit généralement d’une ligne rouge ou violette qui contraste avec la ligne dans la zone de contrôle de la qualité.
- La présence ou l’absence de la réaction de couleur et la profondeur de la couleur sont liées à la concentration de l’antigène de H. pylori dans l’échantillon. Comparez les cartes de couleurs pour interpréter rapidement et précisément les résultats (voir Figure 3).
3. Extraction de l’ADN
- Placez une quantité appropriée d’excréments dans un tube à essai, ajoutez la solution PBS et mélangez soigneusement en secouant. Centrifuger le mélange à 12 000 × g pendant 5 à 10 min, puis prélever soigneusement 200 μL de surnageant pour une extraction ultérieure.
- En fonction du nombre d’échantillons, préparer un nombre égal de tubes à centrifuger de 1,5 ml. Dans chaque tube, ajoutez séquentiellement 20 μL de protéinase K (20 mg/mL), 10 μL de billes magnétiques, 200 μL du surnageant de l’échantillon et 200 μL de tampon de lyse A. Bien mélanger en inversant les tubes, puis incuber dans un bain métallique à 55 °C pendant 10 min.
- Une fois la pyrolyse terminée, placez le tube de centrifugation sur le cadre magnétique, laissez-le reposer et laissez l’adsorption se produire pendant 1 minute sur les billes. Une fois que le liquide dans le tube est complètement clarifié, jetez le surnageant et essayez d’éviter de déranger les billes magnétiques.
- Retirez les tubes du support magnétique et placez-les sur un support de tube à centrifuger de 1,5 ml. À l’aide d’une pipette, ajoutez 500 μL de tampon de lavage E dans chaque tube, mélangez soigneusement pendant 1 min, puis remettez les tubes dans la grille magnétique. Laissez les tubes reposer pendant 1 min, jetez le surnageant après clarification et évitez d’aspirer les billes magnétiques.
- Répétez le processus de lavage en ajoutant 500 μL de tampon de lavage W2 dans chaque tube. Mélangez bien pendant 1 min, placez les tubes sur la grille magnétique et laissez-les reposer pendant 1 min. Jetez soigneusement le surnageant une fois que la solution s’est clarifiée, en veillant à ce que les billes magnétiques ne soient pas dérangées.
- Ajouter 100 μL d’éluant, mélanger et incuber à 55 °C pendant 5 min.
- Placez les tubes sur la grille magnétique et laissez-les reposer pendant 2 min. Une fois la solution clarifiée, transférez soigneusement l’acide nucléique élué dans un nouveau tube à centrifuger, en évitant l’aspiration des billes magnétiques.
- Évaluez la pureté de l’ADN extrait en mesurant l’absorbance à 260 nm (A260) et 280 nm (A280). Calculez le rapport A260/A280 , qui doit idéalement être supérieur à 1,8 pour un ADN de haute pureté.
4. qPCR pour la détection de H. pylori et de la résistance aux antibiotiques
REMARQUE : Nous avons effectué une qPCR pour la détection de l’infection à H. pylori en amplifiant le gène ureA . Tous les produits de contrôle de qualité négatif sont de l’eau stérile et purifiée. Le produit de contrôle de la qualité positif contenu dans le kit de détection des acides nucléiques de H. pylori est constitué de billes étalons de H. pylori inactivées (ATCC 43504). Un CT ≤ 30 avec une courbe typique en forme de S est considéré comme positif.
- En fonction du nombre d’échantillons à tester, sortez la préparation lyophilisée de H. pylori du kit, et essorez-la rapidement pour garder la poudre lyophilisée au fond du tube.
- Ouvrez délicatement le couvercle de la préparation lyophilisée ; prélever l’acide nucléique de l’échantillon à tester ; ajouter 25 μL d’acide nucléique de l’échantillon dans la préparation lyophilisée ; et couvrez hermétiquement le tube.
- Agitez et mélangez uniformément le réactif PCR pendant 8 à 10 s, puis faites-le tourner rapidement pendant 3 à 5 s.
- Pour chaque échantillon sur une plaque de 32 puits, préparer 25 μL du mélange réactionnel PCR (poudre lyophilisée [contenant l’enzyme Taq (5 U/μL), le désoxyribonucléoside triphosphate (2,5 mmol/L), l’enzyme UNG (2 U/μL), l’ureA avant (5'-ACATTGCGAGCGGGACAG-3') et inverse (amorces 5'-CGCCCAATCTCTCACTTTATCG-3') (40 μmol/L)]), et 25 μL (2,5 μg) de l’ADN extrait.
- Exécutez la carte qPCR à 32 puits sur la machine qPCR. Programmez le thermocycleur : 42 °C et 95 °C (tous deux pour un cycle) pendant 2 min chacun ; 95 °C pendant 10 s et 65 °C pendant 45 s (deux pas font un cycle) pendant 10x ; 95 °C pendant 10 s et à 58 °C pendant 45 s (deux pas représentent un cycle) pendant 35 cycles.
- Analysez les données à l’aide d’un logiciel spécifique pour la qPCR et laissez l’instrument sélectionner automatiquement les seuils de référence.
5. Analyse statistique
- Utilisez le test du chi carré pour analyser les données expérimentales afin d’évaluer la cohérence entre cette méthode et les résultats de la qPCR et comparez le taux positif de cette technologie de dépistage avec les données sur le taux positif d’infection à H. pylori à plus grande échelle (par exemple, à l’échelle nationale). Considérer les différences statistiquement significatives à P < 0,05.
Résultats
Enquête par questionnaire
Au total, 261 participants ont été inscrits à l’étude, dont 144 femmes et 117 hommes, âgés de 4 à 99 ans. L’âge moyen des sujets était de 48,30 ± 17,61 ans. Il y avait 17 mineurs (0-17 ans), 202 adultes (18-64 ans) et 42 participants âgés (>64 ans). Les résultats du questionnaire sont présentés dans le tableau 1. La majorité (90,8 %) des sujets pensaient qu’il était nécessaire d’effectuer un dépistage de H. pylori .
Résultats du dépistage de la détection de l’antigène fécal de H. pylori dans ce village
Parmi les 261 participants testés pour l’antigène fécal de H. pylori , 52 (19,92 %) étaient positifs, tandis que 209 étaient négatifs. Sur les 52 cas positifs, 32 étaient des femmes, soit 22,22 % de toutes les participantes, et 20 étaient des hommes, soit 17,09 % de tous les participants masculins. Lorsqu’ils sont stratifiés par âge, les taux de positivité étaient les suivants : les mineurs (0-17 ans) avaient 2 cas positifs (11,76 %), les adultes (18-64 ans) avaient 41 cas positifs (20,30 %) et les personnes âgées (>64 ans) avaient 9 cas positifs (21,43 %).
Comparaison de la cohérence entre l’antigène fécal de H. pylori et les résultats de la qPCR
Dans cette étude, deux échantillons avec des résultats de test qPCR différents ont été sélectionnés pour caractériser la fiabilité du protocole expérimental (Figure 4). Parmi les résultats de l’antigène fécal de H. pylori de 261 sujets, 52 étaient positifs et 209 étaient négatifs. Parmi les résultats de la qPCR avec les matières fécales de 261 sujets, 83 étaient positifs et 178 étaient négatifs (tableau 2). La sensibilité et la spécificité de la détection de l’antigène fécal de H. pylori étaient respectivement de 60,24 % et de 80,08 %. La valeur prédictive positive (PPV) de cette méthode était de 96,15 % et la valeur prédictive négative (VAN) était de 84,21 %. Le test de cohérence Kappa indique que les résultats diagnostiques des deux méthodes sont cohérents (Kappa = 0,630, P < 0,05).
Comparaison du taux de dépistage positif entre ce village naturel et l’ensemble du pays
Le taux positif s’est établi à 19,92 %, ce qui est légèrement inférieur au taux positif national de 42,8 %14 (tableau 3). Selon le test du khi-deux (P < 0,01), la différence dans les taux positifs était statistiquement significative.

Figure 1 : Organigramme de détection d’échantillons. Veuillez cliquer ici pour voir une version agrandie de cette figure.
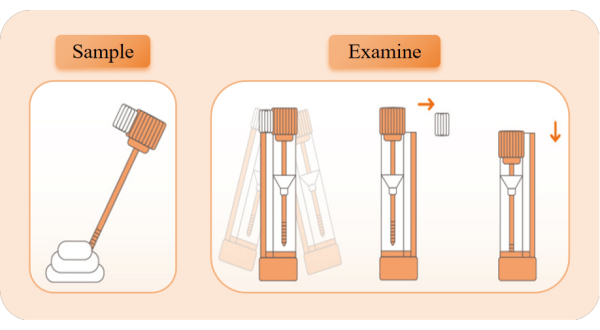
Figure 2 : Schéma de principe de la collecte et de la détection des échantillons. Sortez le dispositif de détection, déchirez le sac en papier d’aluminium et sortez le tube de réactif. Retirez le couvercle du tube orange et utilisez le bâtonnet d’échantillonnage pour prélever des échantillons 5x à partir de différentes positions des matières fécales. Réinsérez la tige d’échantillonnage dans le tube à réactif et secouez-la à gauche et à droite pendant 10 secondes pour bien mélanger. Cassez le bloc de limite blanche, maintenez le tube de réactif à la verticale et appuyez sur le couvercle du tube jusqu’à la position la plus basse pour commencer le chronométrage. Observez l’apparition de bandes rouges. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Interprétation des résultats de l’antigène. (A) Échantillonneur. (B,E) Négatif (-) : Un résultat négatif indique qu’aucun antigène de H. pylori n’a été détecté dans l’échantillon, ce qui suggère que le risque d’infection à H. pylori est faible. Un résultat négatif ne peut pas exclure complètement la possibilité d’une infection. (C, F) Positif (+) : Un résultat positif signifie que l’antigène de H. pylori est détecté dans l’échantillon, une infection à H. pylori est suspectée. (D) Aucun effet : Des résultats non valides peuvent être un problème avec le processus de collecte ou de manipulation de l’échantillon, ou le réactif s’est détérioré et endommagé, et l’échantillon doit être prélevé à nouveau ou les étapes de l’opération doivent être répétées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
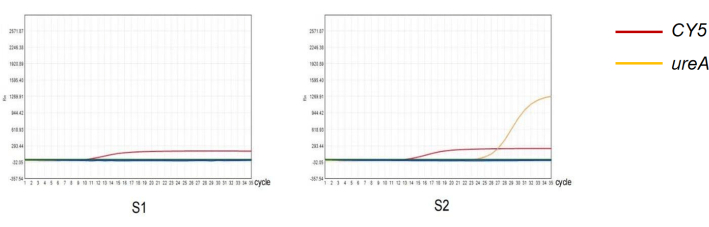
Figure 4 : Détection de H. pylori dans les matières fécales par la méthode qPCR. (S1) Résultat négatif de l’amplification quantitative par PCR de l’infection à H. pylori. (S2) Résultat positif de l’amplification quantitative par PCR de l’infection à H. pylori. Veuillez cliquer ici pour voir une version agrandie de cette figure.
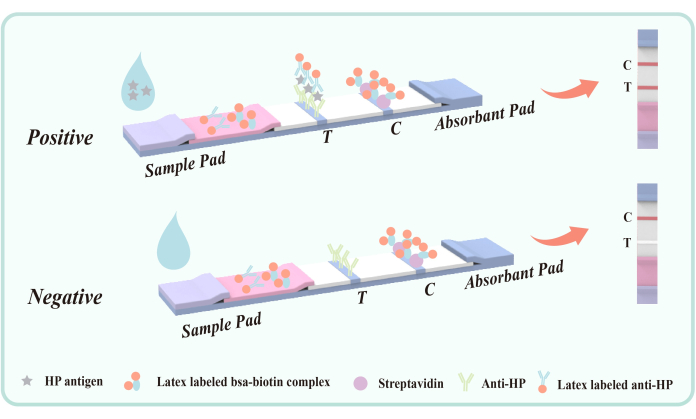
Figure 5 : Schéma de principe de la méthode sandwich à double anticorps pour la détection de l’antigène fécal infecté par H. pylori. L’anticorps anti-Hp de souris (épitope VacA) a été fixé à l’avance dans la zone de détection (T) sur la membrane. Le domaine de contrôle de la qualité (C) fixe à l’avance les IgG anti-souris et la streptavidine de chèvre. Le film polyester a été recouvert d’un anticorps anti-Hp de souris marqué au latex et d’un conjugué latex-BSA-biotine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Faut-il manger régulièrement pendant trois repas ? | Faut-il boire de l’alcool ? | Connaissez-vous H. pylori ? | Est-il nécessaire d’effectuer une inspection de H. pylori ? | Comprenez-vous les conséquences néfastes de l’infection à H. pylori ? | |
| Oui (taux) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| Non (taux) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
Tableau 1 : Résultats du questionnaire.
| Antigène de H. pylori | Total | |||
| Positif (+) | Négatif (-) | |||
| qPCR | Positif (+) | 50 | 33 | 83 |
| Négatif (-) | 2 | 176 | 178 | |
| Total | 52 | 209 | 261 | |
Tableau 2 : Résultats diagnostiques de deux techniques.
| Positif | Négatif | Taux de positivité | Total | |
| Village de Shitan | 52 | 209 | 19.92% | 261 |
| Chine | 314423 | 449404 | 42.80% | 763827 |
Tableau 3 : Comparaison des taux de positivité du dépistage de H. pylori entre le village de Shitan et la moyenne nationale.
Discussion
H. pylori représente l’une des infections bactériennes les plus répandues dans le monde15. Les résultats du questionnaire ont révélé que 55,2 % de la population ne connaissait pas H. pylori, tandis que 90,8 % pensaient que le dépistage de H. pylori était nécessaire. Ces résultats soulignent l’importance de mettre en œuvre des programmes de dépistage de H. pylori dans les zones économiquement défavorisées et éloignées16. Bien que le test respiratoire à l’urée (UBT) soit une méthode de diagnostic courante, son coût élevé et son inadéquation pour les enfants et les femmes enceintes limitent son applicabilité17,18. Le test d’anticorps sériques H. pylori peut détecter des anticorps dans le sérum19 d’un patient. Cependant, ce test ne convient pas à l’analyse post-traitement car les anticorps restent longtemps après l’élimination de la bactérie20. En revanche, le test d’antigène dans les selles offre une approche non invasive qui élimine le besoin d’accéder à la cavité gastrique, ne nécessitant que des échantillons de selles pour l’analyse. Cette méthode réduit considérablement l’inconfort du patient et les risques potentiels, ce qui la rend plus pratique pour le dépistage et le suivi. De plus, sa nature non invasive le rend plus acceptable pour les populations des régions éloignées et sous-développées.
La prévalence des patients positifs à H. pylori dans notre population d’étude est de 19,92 %, ce qui est légèrement inférieur au taux national de positivité de 42,8 %14. Selon le test du khi-deux (P < 0,01), il y avait une signification statistique entre eux. La raison de cette différence peut être que le taux d’infection à H. pylori dans les populations urbaines de sept régions géographiques de la Chine présente une différenciation régionale évidente21. Le taux d’infection est le plus élevé dans l’est de la Chine, plus élevé dans le nord-est de la Chine, le nord de la Chine et le nord-ouest de la Chine, et plus faible dans le sud et le sud-ouest de la Chine21. La zone que nous avons examinée appartient au sud de la Chine, et le taux d’infection est inférieur au niveau national. D’autre part, le fonctionnement non standard du processus d’échantillonnage des échantillons fécaux individuels et le long délai d’envoi pour les tests peuvent également être les raisons de cette différence. Bien que la PCR et ses dérivés soient largement utilisés pour détecter divers agents pathogènes, y compris H. pylori, leur utilité est limitée par la complexité et le coût de l’équipement du thermocycleur et la nécessité de faire appel à des opérateurs spécialisés22,23. Dans cette étude, par rapport aux résultats de la qPCR, la sensibilité et la spécificité de la détection de l’antigène de H. pylori dans les fèces étaient de 60,24 % et 80,08 %. La cohérence de l’antigène de H. pylori dans les fèces et les résultats de la qPCR ont été comparés, et les résultats suggèrent qu’ils étaient modérément cohérents (Kappa = 0,630, P < 0,05). Les raisons de sa sensibilité insatisfaisante peuvent être influencées par l’irrégularité de la collecte des échantillons, de la température de stockage des échantillons et du délai de livraison.
La méthode sandwich à double anticorps pour la détection de l’antigène fécal de l’infection à H. pylori est une technologie de détection immunologique efficace et spécifique. Le cœur de cette méthode est de tirer parti de la capacité de liaison spécifique des anticorps et d’assurer une identification et une quantification précises des antigènes cibles grâce à un système de détection ingénieux. Plus précisément, cette approche comporte deux étapes clés : la capture d’antigènes et la détection d’anticorps. Le schéma de cette technologie est illustré à la figure 5.
L’anticorps anti-Hp de souris enrobé sur la membrane de polyester (T) cible l’épitope VacA de H. pylori pour obtenir une capture spécifique de l’antigène de H. pylori dans les fèces. L’antigène VacA est une exotoxine importante de H. pylori, étroitement associée à l’infection. Les anticorps ciblant VacA peuvent identifier et se lier efficacement à l’antigène, formant un complexe antigène-anticorps. Par conséquent, cette méthode n’est pas facile à croiser avec d’autres maladies gastro-intestinales ou des affections gastro-intestinales.
Au cours de l’essai, l’échantillon liquide pénètre dans le réservoir de détection et migre vers le haut par capillarité. Si l’échantillon contient l’antigène de H. pylori , il forme d’abord un complexe antigène-anticorps avec l’anticorps anti-H. pylori de souris marqué au latex enduit sur le film polyester. Au fur et à mesure que le complexe traverse la zone de détection (T), il est capturé par l’anticorps anti-H. pylori de souris immobilisé, ce qui entraîne une bande rouge visible dans la zone de détection (T), ce qui indique un résultat positif. Si aucun antigène H . pylori n’est présent dans l’échantillon, aucun complexe sandwich d’anticorps doubles ne se forme dans la zone de détection (T), et par conséquent aucune bande rouge n’apparaît, indiquant un résultat négatif. Indépendamment de la présence ou de l’absence de l’antigène de H. pylori , le conjugué latex-BSA-biotine va se lier à la streptavidine immobilisée sur la membrane lors de la chromatographie, produisant une bande rouge dans la zone de contrôle de la qualité (C). Cette bande rouge sert à la fois d’indicateur du bon processus chromatographique et d’étalon de contrôle interne pour le réactif.
La méthode sandwich à double anticorps permet une capture efficace et une détection qualitative de l’antigène de H. pylori dans les fèces à l’aide d’anticorps et de marqueurs soigneusement conçus. Sa simplicité, sa rapidité et sa grande spécificité fournissent un support technique fiable pour le diagnostic adjoint de l’infection à H. pylori . L’application généralisée de cette technologie permet non seulement de réduire les coûts médicaux et d’améliorer l’efficacité du dépistage, mais aussi d’offrir aux patients une expérience de test plus confortable et plus pratique. Cette avancée revêt une importance significative pour la prévention et le contrôle de l’infection à H. pylori à l’échelle mondiale.
De plus, l’hygiène des tests antigéniques dans les selles est une considération cruciale. Cette méthode nécessite des échantillons fécaux frais, qui peuvent être formés ou non, sans restriction spécifique quant au temps de collecte. Lors du prélèvement des échantillons, il est essentiel d’éviter la contamination par l’eau, l’urine, les désinfectants ou les eaux usées. Les échantillons de matières fécales doivent être prélevés dans des contenants propres et secs, exempts de conservateurs et de détergents. Si un stockage est nécessaire, les échantillons peuvent être conservés à température ambiante pendant 6 heures au maximum ou à une température de 2 à 8 °C pendant 72 h au maximum. Les échantillons réfrigérés doivent être ramenés à la température ambiante avant les tests pour garantir des résultats précis. L’efficacité temporelle élevée est également une caractéristique majeure de la détection de l’antigène de l’infection à H. pylori dans les selles. Le test sandwich à double anticorps à base de latex peut fournir des résultats en 10 à 20 minutes par rapport aux méthodes traditionnelles qui nécessitent d’attendre les résultats de laboratoire, ce qui est important pour la reconnaissance de l’infection aiguë et les décisions de traitement précoces dans les zones éloignées et en retard.
En résumé, la détection de l’antigène H. pylori dans les selles offre de nombreux avantages méthodologiques, notamment le caractère non invasif, la simplicité, l’hygiène, la grande efficacité et une large applicabilité. Ces caractéristiques font de cette méthode un outil précieux pour la pratique clinique et fournissent des informations innovantes pour le développement futur des technologies de diagnostic. Dans les régions sous-développées où les conditions sanitaires sont limitées, cette approche est appelée à jouer un rôle central dans le diagnostic et la prise en charge de l’infection à H. pylori .
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Aucun
matériels
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
Références
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon