Method Article
الكشف السريع عن مستضد البراز لعدوى هيليكوباكتر بيلوري بناء على تقنية الكشف عن ساندويتش الأجسام المضادة المزدوجة
In This Article
Summary
في هذه الدراسة ، تم تطوير تقنية الكشف عن الساندويتشات القائمة على الأجسام المضادة المزدوجة للكشف السريع عن مستضدات البراز المصابة ب Helicobacter pylori.
Abstract
يمكن أن تكون هيليكوباكتر بيلوري طفيلية في الغشاء المخاطي في المعدة ، والتي يمكن أن تسبب سلسلة من أمراض الجهاز الهضمي بعد الإصابة وترتبط ارتباطا وثيقا بالتهاب المعدة وقرحة المعدة وسرطان المعدة. ولا يزال الانتشار المرتفع لعدوى الملوية البوابية في المناطق ذات البنية التحتية الطبية الضعيفة ومناطق الصرف الصحي غير الملائمة يشكل مصدر قلق كبير للصحة العمومية. وبالتالي، فإن تطوير طرق تحري سريعة وبسيطة وفعالة من حيث التكلفة للكشف عن بكتيريا الملوية البوابية في البيئات المحدودة الموارد أمر بالغ الأهمية.
في هذه الدراسة ، أجرينا فحصا مجتمعيا في قرية شيتان بمقاطعة قوانغدونغ ، وهي منطقة نائية ومتخلفة تتميز بسكان دائمين يبلغ حوالي 300 من السكان مع تحصيل تعليمي منخفض بشكل عام. استخدمنا مقايسة شطيرة مزدوجة للأجسام المضادة للكشف عن مستضد براز الملوية البوابية ، وهي طريقة تم اختيارها لقابليتها للتطبيق المحتمل في البيئات منخفضة الموارد. تم تسجيل ما مجموعه 261 مشاركا من القرية ، وتم تحليل عينات برازهم باستخدام هذه التقنية. للتحقق المقارن ، خضعت نفس العينات لتحليل تفاعل البوليميراز المتسلسل الكمي (qPCR). بالمقارنة مع نتائج qPCR ، كانت حساسية وخصوصية الكشف عن مستضد الملوية البوابية في البراز 60.24٪ و 80.08٪. أظهرت النتائج اتفاقا قويا بين طريقة الكشف عن مستضد البراز و qPCR (Kappa = 0.630). أوضحت هذه الدراسة بشكل منهجي المبادئ والإجراءات والمنهجيات والتطبيقات السريرية للكشف عن مستضد البراز لعدوى الملوية البوابية ، بهدف استكشاف تقنية ساندويتش الأجسام المضادة المزدوجة القائمة على اللاتكس ووضع استراتيجيات جديدة ومبادئ توجيهية عملية لتشخيصها المساعد.
Introduction
هيليكوباكتر بيلوري (H. pylori ، Hp) هي بكتيريا ميكروية ، حلزونية الشكل ، سالبة الجرام1. نظرا لقدرته على استعمار معدة الإنسان وإصابة مزمنة2 ، فقد تم تحديد هذا العامل المسبب للأمراض كعامل مسبب رئيسي في تطور سرطان المعدةالغدي 3،4. في عام 2015 ، عانى ~ 4.4 مليار شخص في العالم من عدوى الملوية البوابية 5. يظهر انتشار عدوى الملوية البوابية تباينا جغرافيا كبيرا ، حيث تشهد البلدان النامية معدلات أعلى بكثير مقارنة بالدول المتقدمة. والجدير بالذكر أنه في البلدان منخفضة الدخل وبين بعض الفئات السكانية الضعيفة، يمكن أن يصل معدل الإصابة إلى 75٪6.
على الرغم من أن طرق الكشف التقليدية مثل تنظير المعدة دقيقة ، إلا أن تطبيقها في الفحص على نطاق واسع والمتابعة الروتينية محدود بسبب غزوها وتكلفتها العالية وانخفاض قبول المريض7. لذلك ، أصبح البحث عن طرق التشخيص غير الغازية والبسيطة والسريعة اتجاها مهما لأبحاث الطب السريري الحديثة. الغرض الرئيسي من التشخيص غير الجراحي للملوية البوابية هو الكشف بدقة وأمان وسهولة عما إذا كان المريض مصابا ببكتيريا الملوية البوابية دون الفحص بالمنظار. اختبار تنفس اليوريا (UBT) ، اختبار مستضد البراز الملوية البوابية (FAT) 8 ، والاختبار المصلي9 هي تقنيات غير جراحية شائعة.
من بين هؤلاء ، يعد UBT هو الإجراء الأقل تدخلا والأكثر دقة المتاح10. حساسية وخصوصية UBT أعلى من 95٪ 11. من بين طرق التشخيص غير الغازية المتاحة ، ثبت أن UBT هو الأكثر دقة وموثوقية ، كما رأينا في دراسة التحقق التي أجريت في العراق ، قد يوصى ب UBT كخيار أول نظرا لأدائه العالي مقارنة بالطرق الأخرى12. ومع ذلك ، فإن UBT له أيضا عيوبه ، مثل تكلفته العالية وحاجته إلى تحليل طيفي الكتلة ، مما يحد من التطبيق في الإعدادات البعيدة أو محدودة الموارد13.
هناك حاجة ماسة إلى تطوير طريقة تشخيصية سريعة وغير جراحية وفعالة من حيث التكلفة للكشف عن عدوى الملوية البوابية ، لا سيما في المناطق المحدودة الموارد. في هذه الدراسة ، قمنا بتطوير تقنية الكشف السريع عن مستضد براز الملوية البوابية بناء على تقنية الكشف عن شطيرة الأجسام المضادة المزدوجة ، والتي يمكنها اكتشاف مستضد الملوية البوابية في عينات البراز بسرعة وفعالية وبتكلفة منخفضة. توفر هذه التقنية مزايا كبيرة ، بما في ذلك القدرة على تحمل التكاليف ، وعدم التدخل الجراحي ، وسهولة الاستخدام ، والقدرة على التكيف مع المناطق النائية. نفترض أن طريقة شطيرة الأجسام المضادة المزدوجة للكشف عن مستضد براز الملوية البوابية ستظهر حساسية وخصوصية مماثلة ل qPCR ، مما يضعها كأداة قابلة للتطبيق للتشخيص السريري غير الجراحي.
قمنا بتفصيل المبادئ والإجراءات ونقاط القوة المنهجية وقابلية التطبيق السريري للكشف عن مستضد البراز لعدوى الملوية البوابية . للتحقق من عمليتها ، أجرينا تحقيقا وبائيا وفحصا في قرية شيتان ، مدينة تشينغيوان ، مقاطعة قوانغدونغ ، الصين ، وهي منطقة نائية ومتخلفة يبلغ عدد سكانها الدائمين حوالي 400 نسمة وتحصيل تعليمي محدود. توضح نتائجنا أن تقنية الكشف السريع عن مستضد الملوية البوابية في البراز المصممة هنا يمكن إكمالها في غضون 20 دقيقة. ويتضح من أن الكشف السريع عن مستضد الملوية البوابية في البراز هو أداة محتملة وواعدة للتشخيص السريع والموثوق لعدوى الملوية البوابية في المناطق النائية والمتخلفة.
Protocol
تمت الموافقة على هذه الدراسة المقطعية من قبل لجنة الأخلاقيات في مستشفى الشعب بمقاطعة قوانغدونغ (رقم الموافقة: KY2024-445-01) ، وكانت البيانات الشخصية لجميع الأشخاص الخاضعين للدراسة سرية للغاية أثناء الدراسة. وقع جميع المشاركين على موافقة خطية مستنيرة قبل التجارب. تم اختيار سكان قرية شيتان في مدينة تشينغيوان بمقاطعة قوانغدونغ في عام 2024 كموضوعات بحثية ، ولم تكن هناك قيود على العمر والجنس. تم إجراء مقايسة شطيرة الأجسام المضادة المزدوجة (تجربة نوعية) الموضحة أدناه من قبل طاقم طبي وتقني محترف وفقا للتعليمات. تم اختيار جميع السكان الدائمين في القرية لهذه الدراسة ، بغض النظر عما إذا كانوا يتمتعون بصحة جيدة أو لديهم أعراض أو أي أمراض موجودة تتعلق بأمراض الجهاز الهضمي.
1. اختيار المريض
- استبعاد المرضى إذا كانوا قد استخدموا مثبطات مضخة البروتون أو البزموت أو حاصرات مستقبلات H2 أو المضادات الحيوية في الشهر السابق 1.
- اطلب من جميع المشاركين ملء الاستبيان دون الكشف عن هويتهم. تتضمن محتويات الاستبيان خمسة أسئلة: هل تأكل ثلاث وجبات بانتظام؟ هل تشرب الكحول؟ هل أنت على دراية ببكتيريا الملوية البوابية؟ هل تعتقد أنه من الضروري إجراء فحص بكتيريا الملوية البوابية ؟ هل تفهم العواقب السلبية لعدوى الملوية البوابية ؟
2. إجراء الكشف عن مستضد عدوى الملوية البوابية البرازية
ملاحظة: تم تصميم خوارزمية اختبار مستضد براز الملوية البوابية لضمان دقة وموثوقية النتائج ، مع مراعاة البساطة والنظافة. تنقسم العملية برمتها إلى خمس خطوات: جمع العينات ، ومعالجة العينات ، وتخزين العينات ، والكشف ، وتفسير النتائج. يظهر مخطط تدفق العمل والرسم التخطيطي لاكتشاف العينة في الشكل 1 والشكل 2.
- جمع العينات
ملاحظة: يجب استخدام حاويات خاصة بمستضد الملوية البوابية لجمع العينات. يجب عدم خلط العينات بالماء والبول والمطهرات والصرف الصحي.- بعد الانتهاء من التغوط ، قم بإزالة الغطاء العلوي للحاوية الخاصة لإخراج قضيب أخذ العينات.
- أدخل قضيب أخذ العينات بشكل مستمر في خمسة أوضاع مختلفة من البراز لأخذ العينات ، مع التأكد من إدخال الطرف الملولب لقضيب أخذ العينات بالكامل في البراز.
- أدخل قضيب أخذ العينات مرة أخرى في أنبوب الكاشف بعد اكتمال أخذ العينات ؛ حجم العينة ~ 5-50 مجم في المجموع.
- معالجة العينة
- هز أنبوب الكاشف من جانب إلى آخر لمدة ~ 10 ثوان لخلط عينة البراز جيدا في المخفف (المكونات الرئيسية: حمض الإيثيلين ديامين رباعي الأسيتيك ، هيدرات رباعي الصوديوم 0.018 جم / مل وكلوريد الصوديوم 0.01 جم / مل).
- تخزين العينات
- اختبار العينات في أسرع وقت ممكن بعد أخذ العينات ؛ قم بتخزينها في درجة حرارة الغرفة لمدة لا تزيد عن 6 ساعات وفي ظروف مبردة (لا تزيد عن 72 ساعة عند 2-8 درجات مئوية ولا تزيد عن 6 أشهر مجمدة عند -25 درجة مئوية إلى -15 درجة مئوية) إذا لزم الأمر لإبطاء تدهور المستضد والنشاط الميكروبي.
ملاحظة: يمكن تجميد العينات وإذابتها بشكل متكرر حتى 3 أضعاف ، ويجب إعادة العينات المبردة والمجمدة إلى درجة حرارة الغرفة قبل الاختبار.
- اختبار العينات في أسرع وقت ممكن بعد أخذ العينات ؛ قم بتخزينها في درجة حرارة الغرفة لمدة لا تزيد عن 6 ساعات وفي ظروف مبردة (لا تزيد عن 72 ساعة عند 2-8 درجات مئوية ولا تزيد عن 6 أشهر مجمدة عند -25 درجة مئوية إلى -15 درجة مئوية) إذا لزم الأمر لإبطاء تدهور المستضد والنشاط الميكروبي.
- كشف العينة
- افتح الغطاء الأبيض على غطاء أنبوب الكاشف وحافظ على أنبوب الكاشف منتصبا.
- اضغط على الغطاء لأسفل إلى أدنى نقطة بحيث تتدفق العينة على بطاقة الاختبار ، مرورا بمنطقة الكشف (T) ومنطقة مراقبة الجودة (C) المغلفة بالجسم المضاد للفأر المضاد ل Hp.
- تفسير النتائج
- انتظر لمدة 10-20 دقيقة حتى يشكل أي مستضد من الملوية البوابية في العينة ، إذا كان مرتبطا بالجسم المضاد ، تفاعلا كروموجينيا عياني في منطقة الكشف. يظهر هذا عادة على شكل خط أحمر أو أرجواني يتناقض مع الخط الموجود في منطقة مراقبة الجودة.
- يرتبط وجود أو عدم وجود تفاعل اللون وعمق اللون بتركيز مستضد الملوية البوابية في العينة. قارن بطاقات الألوان لتفسير النتائج بسرعة ودقة (انظر الشكل 3).
3. استخراج الحمض النووي
- ضع كمية مناسبة من البراز في أنبوب اختبار ، وأضف محلول PBS ، واخلطه جيدا عن طريق الرج. قم بالطرد المركزي للخليط عند 12,000 × جم لمدة 5-10 دقائق ، ثم اجمع بعناية 200 ميكرولتر من المادة الطافية لمزيد من الاستخراج.
- بناء على عدد العينات ، قم بإعداد عدد متساو من أنابيب الطرد المركزي 1.5 مل. أضف بالتتابع إلى كل أنبوب 20 ميكرولتر من البروتيناز K (20 مجم / مل) ، و 10 ميكرولتر من الخرز المغناطيسي ، و 200 ميكرولتر من العينة الطافية ، و 200 ميكرولتر من محلول التحلل A. تخلط جيدا عن طريق قلب الأنابيب ، ثم تحتضن في حمام معدني عند 55 درجة مئوية لمدة 10 دقائق.
- بعد اكتمال الانحلال الحراري ، ضع أنبوب الطرد المركزي على الإطار المغناطيسي ، واتركه يقف ، واترك الامتزاز لمدة 1 دقيقة على الخرز. بعد توضيح السائل الموجود في الأنبوب تماما ، تخلص من المادة الطافية وحاول تجنب إزعاج الخرز المغناطيسي.
- قم بإزالة الأنابيب من الرف المغناطيسي وضعها على رف أنبوب طرد مركزي سعة 1.5 مل. باستخدام ماصة ، أضف 500 ميكرولتر من محلول الغسيل E إلى كل أنبوب ، واخلطه جيدا لمدة 1 دقيقة ، ثم أعد الأنابيب إلى الرف المغناطيسي. اسمح للأنابيب بالوقوف لمدة 1 دقيقة ، وتخلص من المادة الطافية بعد التوضيح ، وتجنب شفط الخرز المغناطيسي.
- كرر عملية الغسيل بإضافة 500 ميكرولتر من محلول الغسيل W2 إلى كل أنبوب. تخلط جيدا لمدة 1 دقيقة ، ضع الأنابيب على الرف المغناطيسي ، واتركها تقف لمدة 1 دقيقة. تخلص من المادة الطافية بعناية بعد أن ينضح المحلول ، مما يضمن بقاء الخرزات المغناطيسية دون إزعاج.
- أضف 100 ميكرولتر من المادة المزيعة واخلطها واحتضانها عند 55 درجة مئوية لمدة 5 دقائق.
- ضع الأنابيب على الرف المغناطيسي واتركها تقف لمدة 2 دقيقة. بمجرد أن يتضح المحلول ، انقل الحمض النووي الملوطوف بعناية إلى أنبوب طرد مركزي جديد ، وتجنب شفط الخرز المغناطيسي.
- قم بتقييم نقاء الحمض النووي المستخرج عن طريق قياس الامتصاص عند 260 نانومتر (A260) و 280 نانومتر (A280). احسب نسبةA 260 / A280 ، والتي يجب أن تكون أكبر من 1.8 للحمض النووي عالي النقاء.
4. qPCR للكشف عن الملوية البوابية ومقاومة المضادات الحيوية
ملاحظة: أجرينا qPCR للكشف عن عدوى الملوية البوابية عن طريق تضخيم جين اليوريا . جميع منتجات مراقبة الجودة السلبية هي مياه معقمة ونقاية. منتج مراقبة الجودة الإيجابي في مجموعة الكشف عن الحمض النووي H. pylori هو حبات قياسية من H. pylori (ATCC 43504). يعتبر CT ≤ 30 مع منحنى نموذجي على شكل حرف S موجبا.
- وفقا لعدد العينات المراد اختبارها ، خذ مستحضر H. pylori المجفف بالتجميد من المجموعة ، وقم بتدويره بسرعة للحفاظ على المسحوق المجفف بالتجميد في قاع الأنبوب.
- افتح بعناية غطاء المستحضر المجفف بالتجميد ؛ خذ الحمض النووي للعينة المراد اختبارها ؛ أضف 25 ميكرولتر من عينة الحمض النووي إلى المستحضر المجفف بالتجميد ؛ وتغطية الأنبوب بإحكام.
- رج كاشف PCR واخلطه بالتساوي لمدة 8-10 ثوان ، ثم قم بتدويره بسرعة لمدة 3-5 ثوان.
- لكل عينة على صفيحة 32 بئرا ، قم بإعداد 25 ميكرولتر من خليط تفاعل تفاعل البوليميراز المتسلسل (مسحوق مجفف بالتجميد [يحتوي على إنزيم Taq (5 U / μL) ، وديوكسي ريبونوكليوزيد ثلاثي الفوسفات (2.5 مليمول / لتر) ، إنزيم UNG (2 U / μL) ، ureA للأمام (5'-ACATTGCGAGCGGGACAG-3') وعكس (5'-CGCCCAATCTCACTTTTTATCG-3') (40 ميكرولتر / لتر)]) ، و 25 ميكرولتر (2.5 ميكروغرام) من الحمض النووي المستخرج.
- قم بتشغيل لوحة qPCR ذات 32 بئرا على جهاز qPCR. برمجة التدوير الحراري: 42 درجة مئوية و 95 درجة مئوية (كلاهما لدورة واحدة) لمدة دقيقتين لكل منهما ؛ 95 درجة مئوية لمدة 10 ثوان و 65 درجة مئوية لمدة 45 ثانية (خطوتان دورة واحدة) لمدة 10x ؛ 95 درجة مئوية لمدة 10 ثوان وعند 58 درجة مئوية لمدة 45 ثانية (خطوتان دورة واحدة) لمدة 35 دورة.
- قم بتحليل البيانات باستخدام برنامج محدد ل qPCR ودع الأداة تحدد تلقائيا عتبات خط الأساس.
5. التحليل الإحصائي
- استخدم اختبار مربع كاي لتحليل البيانات التجريبية لتقييم الاتساق بين هذه الطريقة ونتائج qPCR ومقارنة المعدل الإيجابي لفحص هذه التقنية مع بيانات المعدل الإيجابي لعدوى الملوية البوابية على نطاق أوسع (على سبيل المثال ، على الصعيد الوطني). ضع في اعتبارك الفروق ذات دلالة إحصائية عند P < 0.05.
النتائج
مسح الاستبيان
تم تسجيل ما مجموعه 261 مشاركا في الدراسة ، من بينهم 144 أنثى و 117 ذكرا ، تتراوح أعمارهم بين 4 و 99 عاما. كان متوسط عمر الأشخاص 48.30 ± 17.61 سنة. كان هناك 17 قاصرا (0-17 سنة) و 202 بالغا (18-64 سنة) و 42 مشاركا مسنا (>64 عاما). نتائج الاستبيان موضحة في الجدول 1. اعتقدت غالبية الأشخاص (90.8٪) أنه من الضروري إجراء فحص بكتيريا الملوية البوابية .
نتائج فحص الكشف عن مستضد الملوية البوابية البرازية في هذه القرية
من بين 261 مشاركا تم اختبارهم بحثا عن مستضد الملوية البوابية البرازية ، كان 52 (19.92٪) إيجابيين ، بينما كان 209 سلبيا. من بين الحالات الإيجابية البالغ عددها 52 حالة ، كانت 32 من الإناث ، تمثل 22.22٪ من جميع المشاركات ، و 20 من الذكور ، وهو ما يمثل 17.09٪ من جميع المشاركين الذكور. عند التقسيم الطبقي حسب العمر ، كانت معدلات الإيجابية على النحو التالي: كان لدى القاصرين (0-17 سنة) حالتان إيجابيتان (11.76٪) ، والبالغين (18-64 عاما) لديهم 41 حالة إيجابية (20.30٪) ، وكبار السن (>64 عاما) لديهم 9 حالات إيجابية (21.43٪).
مقارنة الاتساق بين مستضد الملوية البوابية البرازية ونتائج qPCR
في هذه الدراسة ، تم اختيار عينتين بنتائج اختبار qPCR مختلفة لتوصيف موثوقية البروتوكول التجريبي (الشكل 4). من بين نتائج مستضد الملوية البوابية البرازية ل 261 شخصا ، كانت 52 إيجابية و 209 سلبية. من بين نتائج qPCR مع براز 261 شخصا ، كانت 83 إيجابية و 178 سلبية (الجدول 2). كانت حساسية وخصوصية الكشف عن مستضد الملوية البوابية البرازية 60.24٪ و 80.08٪ على التوالي. كانت القيمة التنبؤية الإيجابية (PPV) لهذه الطريقة 96.15٪ ، وكانت القيمة التنبؤية السلبية (NPV) 84.21٪. يشير اختبار اتساق كابا إلى أن نتائج التشخيص للطريقتين متسقة (كابا = 0.630 ، ص < 0.05).
مقارنة المعدل الإيجابي للفحص بين هذه القرية الطبيعية والبلد بأكمله
كان المعدل الإيجابي 19.92٪ ، وهو أقل قليلا من المعدل الإيجابي الوطني البالغ 42.8٪ 14 (الجدول 3). وفقا لاختبار مربع كاي (P < 0.01) ، كان الاختلاف في المعدلات الإيجابية ذا دلالة إحصائية.

الشكل 1: مخطط انسيابي لاكتشاف العينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
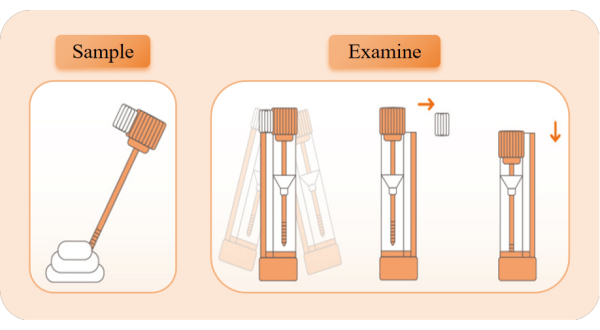
الشكل 2: الرسم التخطيطي لجمع العينات واكتشافها. أخرج جهاز الكشف ، وافتح كيس رقائق الألومنيوم ، وأخرج أنبوب الكاشف. اسحب غطاء الأنبوب البرتقالي واستخدم عصا أخذ العينات لأخذ عينات 5 مرات من مواضع مختلفة من البراز. أدخل قضيب أخذ العينات مرة أخرى في أنبوب الكاشف ورجه يمينا ويسارا لمدة 10 ثوان حتى يمتزج تماما. اكسر كتلة الحد الأبيض ، واحتفظ بأنبوب الكاشف في وضع مستقيم ، واضغط على غطاء الأنبوب إلى أدنى موضع لبدء التوقيت. راقب ظهور العصابات الحمراء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تفسير نتائج المستضد. (أ) أخذ العينات. (ب ، ه) سلبي (-): تشير النتيجة السلبية إلى عدم اكتشاف مستضد الملوية البوابية في العينة ، مما يشير إلى أن خطر الإصابة بعدوى الملوية البوابية منخفض. لا يمكن للنتيجة السلبية أن تستبعد تماما احتمال الإصابة بالعدوى. (ج ، ف) إيجابي (+): تعني النتيجة الإيجابية أنه تم اكتشاف مستضد الملوية البوابية في العينة ، ويشتبه في الإصابة بعدوى الملوية البوابية . (د) لا يوجد تأثير: قد تكون النتائج غير الصحيحة مشكلة في عملية جمع العينات أو مناولة العينات ، أو أن الكاشف قد تدهور وتلف ، ويجب جمع العينة مرة أخرى أو تكرار خطوات التشغيل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
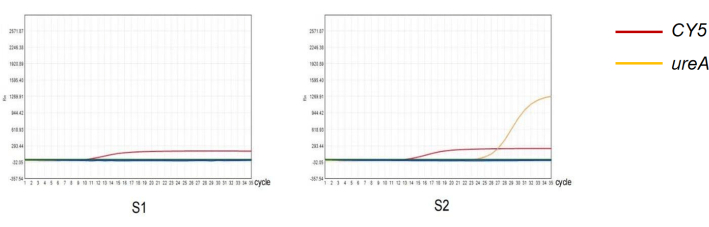
الشكل 4: الكشف عن الملوية البوابية في البراز بطريقة qPCR. (ق 1) نتيجة سلبية لتضخيم PCR الكمي لعدوى الملوية البوابية . (ق2) نتيجة إيجابية للتضخيم الكمي PCR لعدوى الملوية البوابية . الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
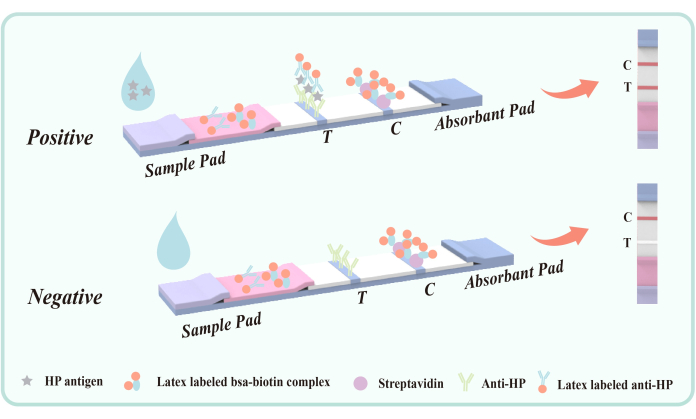
الشكل 5: رسم تخطيطي لطريقة شطيرة الأجسام المضادة المزدوجة للكشف عن مستضد البراز المصاب ببكتيريا الملوية البوابية. تم تثبيت الجسم المضاد للفأر المضاد ل Hp (VacA epitope) في منطقة الكشف (T) على الغشاء مسبقا. تعمل منطقة مراقبة الجودة (C) على إصلاح IgG وستربتافيدين مضاد للفأر مسبقا. تم طلاء فيلم البوليستر بجسم مضاد للفأر المضاد ل Hp المسمى اللاتكس والبيوتين اللاتكس-BSA. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| ما إذا كنت تأكل بانتظام لثلاث وجبات؟ | ما إذا كنت تشرب الكحول؟ | هل تعرف بكتيريا الملوية البوابية؟ | ما إذا كان من الضروري إجراء فحص الملوية البوابية ؟ | هل تفهم العواقب السلبية لعدوى الملوية البوابية ؟ | |
| نعم (السعر) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| لا (معدل) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
الجدول 1: نتائج الاستبيان.
| مستضد الملوية البوابية | مجموع | |||
| إيجابي (+) | سلبي (-) | |||
| qPCR | إيجابي (+) | 50 | 33 | 83 |
| سلبي (-) | 2 | 176 | 178 | |
| مجموع | 52 | 209 | 261 | |
الجدول 2: نتائج التشخيص لتقنيتين.
| موجب | سالب | المعدل الإيجابي | مجموع | |
| قرية الشيطان | 52 | 209 | 19.92% | 261 |
| الصين | 314423 | 449404 | 42.80% | 763827 |
الجدول 3: مقارنة معدلات إيجابية فحص الملوية البوابية بين قرية شيتان والمتوسط الوطني.
Discussion
تمثل الملوية البوابية واحدة من أكثر أنواع العدوى البكتيرية انتشارا في جميع أنحاء العالم15. كشفت نتائج الاستبيان أن 55.2٪ من السكان يفتقرون إلى الوعي بالملوية البوابية ، بينما يعتقد 90.8٪ أن فحص الملوية البوابية ضروري. تؤكد هذه النتائج على أهمية تنفيذ برامج فحص بكتيريا الملوية البوابية في المناطق المحرومة اقتصاديا والنائية16. على الرغم من أن اختبار تنفس اليوريا (UBT) هو طريقة تشخيصية شائعة ، إلا أن تكلفته العالية وعدم ملاءمته للأطفال والنساء الحوامل يحدان من قابليته للتطبيق17،18. يمكن أن يكشف اختبار الأجسام المضادة للملوية البوابية في المصل عن الأجسام المضادة في مصل المريض19. ومع ذلك ، فإن هذا الاختبار غير مناسب لتحليل ما بعد العلاج لأن الأجسام المضادة تبقى لفترة طويلة بعد إزالةالبكتيريا 20. في المقابل ، يوفر اختبار مستضد البراز نهجا غير جراحي يلغي الحاجة إلى الوصول إلى تجويف المعدة ، ولا يتطلب سوى عينات البراز للتحليل. تقلل هذه الطريقة بشكل كبير من انزعاج المريض والمخاطر المحتملة ، مما يجعلها أكثر ملاءمة لكل من الفحص والمتابعة. بالإضافة إلى ذلك ، فإن طبيعتها غير الغازية تجعلها أكثر قبولا للسكان في المناطق النائية والمتخلفة.
معدل انتشار مرضى الملوية البوابية الإيجابية في مجتمع دراستنا هو 19.92٪ ، وهو أقل قليلا من المعدل الإيجابي الوطني البالغ 42.8٪ 14. وفقا لاختبار مربع كاي (P < 0.01) ، كان هناك دلالة إحصائية بينهما. قد يكون سبب هذا الاختلاف هو معدل الإصابة بالملوية البوابية في سكان الحضر في سبع مناطق جغرافية في الصين له تمايز إقليميواضح 21. معدل الإصابة هو الأعلى في شرق الصين ، وأعلى في شمال شرق الصين وشمال الصين وشمال غرب الصين ، وأقل في جنوب الصين وجنوب غربالصين 21. تنتمي المنطقة التي فحصناها إلى جنوب الصين ، ومعدل الإصابة أقل من المستوى الوطني. من ناحية أخرى ، قد تكون العملية غير القياسية في عملية أخذ العينات من عينات البراز الفردية والوقت الطويل لإرسالها للاختبار هي أيضا أسباب هذا الاختلاف. على الرغم من أن تفاعل البوليميراز المتسلسل ومشتقاته يستخدم على نطاق واسع للكشف عن مسببات الأمراض المختلفة ، بما في ذلك الملوية البوابية ، إلا أن فائدتها محدودة بسبب تعقيد وتكلفة معدات التدوير الحراري والحاجة إلى مشغلين متخصصين22،23. في هذه الدراسة، مقارنة بنتائج qPCR، كانت حساسية ونوعية الكشف عن مستضد الملوية البوابية في البراز 60.24٪ و 80.08٪. تمت مقارنة اتساق مستضد الملوية البوابية في البراز ونتائج qPCR ، وأشارت النتائج إلى أنها كانت متسقة إلى حد ما (Kappa = 0.630 ، P < 0.05). قد تتأثر أسباب حساسيتها غير المرضية بجمع العينات غير المنتظم ودرجة حرارة تخزين العينات ووقت التسليم.
طريقة شطيرة الأجسام المضادة المزدوجة للكشف عن مستضد البراز لعدوى الملوية البوابية هي تقنية فعالة ومحددة للكشف عن المناعة. يتمثل جوهر هذه الطريقة في الاستفادة من قدرة الارتباط المحددة للأجسام المضادة وضمان التحديد الدقيق وتحديد المستضدات المستهدفة من خلال نظام كشف مبتكر. على وجه التحديد ، يتضمن هذا النهج خطوتين رئيسيتين: التقاط المستضد واكتشاف الأجسام المضادة. يظهر الرسم التخطيطي لهذه التقنية في الشكل 5.
يستهدف الجسم المضاد للفأر المضاد ل Hp المطلي على منطقة الكشف عن غشاء البوليستر (T) حاتمة H. pylori VacA لتحقيق التقاط محدد لمستضد الملوية البوابية في البراز. مستضد VacA هو سموم خارجية مهمة من الملوية البوابية ، ويرتبط ارتباطا وثيقا بالعدوى. يمكن للأجسام المضادة التي تستهدف VacA تحديد المستضد والارتباط به بشكل فعال ، مما يشكل مركبا للأجسام المضادة للمستضد. لذلك ، ليس من السهل التفاعل مع هذه الطريقة مع أمراض أو أمراض الجهاز الهضمي الأخرى.
أثناء الاختبار ، تدخل العينة السائلة إلى خزان الكشف وتنتقل لأعلى من خلال العمل الشعري. إذا كانت العينة تحتوي على مستضد الملوية البوابية ، فإنها تشكل أولا مركبا للأجسام المضادة للمستضد مع الفأر المضاد للمثوبة البوابية المسمى باللاتكس المطلي بطبقة البوليستر. عندما يتدفق المركب عبر منطقة الكشف (T) ، يتم التقاطه بواسطة الفأر الثابت المضاد ل H. البوابية الجسم المضاد ، مما ينتج عنه شريط أحمر مرئي في منطقة الكشف (T) ، مما يشير إلى نتيجة إيجابية. في حالة عدم وجود مستضد الملوية البوابية في العينة ، لا يتشكل مركب شطيرة الجسم المضاد المزدوج في منطقة الكشف (T) ، وبالتالي لا يظهر شريط أحمر ، مما يشير إلى نتيجة سلبية. بغض النظر عن وجود أو عدم وجود مستضد الملوية البوابية ، فإن مترافق اللاتكس-BSA-البيوتين سوف يرتبط بالستربتافيدين الثابت على الغشاء أثناء الكروماتوغرافيا ، مما ينتج عنه شريط أحمر في منطقة مراقبة الجودة (C). يعمل هذا الشريط الأحمر كمؤشر على العملية الكروماتوغرافية المناسبة وكمعيار التحكم الداخلي للكاشف.
تحقق طريقة شطيرة الأجسام المضادة المزدوجة الالتقاط الفعال والكشف النوعي عن مستضد الملوية البوابية في البراز من خلال الأجسام المضادة والعلامات المصممة بعناية. توفر بساطته وسرعته وخصوصيته العالية دعما فنيا موثوقا به للتشخيص المساعد لعدوى الملوية البوابية . لا يؤدي التطبيق الواسع النطاق لهذه التقنية إلى تقليل التكاليف الطبية وتعزيز كفاءة الفحص فحسب ، بل يوفر أيضا للمرضى تجربة اختبار أكثر راحة وملاءمة. ويحمل هذا التقدم أهمية كبيرة للوقاية من عدوى الملوية البوابية ومكافحتها على الصعيد العالمي.
بالإضافة إلى ذلك ، فإن نظافة اختبار مستضد البراز هي اعتبار بالغ الأهمية. تتطلب هذه الطريقة عينات براز جديدة ، والتي يمكن تشكيلها أو عدم تشكيلها ، مع عدم وجود قيود محددة على وقت التجميع. أثناء جمع العينات ، من الضروري تجنب التلوث بالماء أو البول أو المطهرات أو مياه الصرف الصحي. يجب جمع عينات البراز في حاويات نظيفة وجافة خالية من المواد الحافظة والمنظفات. إذا كان التخزين ضروريا ، يمكن الاحتفاظ بالعينات في درجة حرارة الغرفة لمدة لا تزيد عن 6 ساعات أو عند 2-8 درجات مئوية لمدة تصل إلى 72 ساعة. يجب إعادة العينات المبردة إلى درجة حرارة الغرفة قبل الاختبار لضمان نتائج دقيقة. تعد كفاءة الوقت العالية أيضا سمة رئيسية للكشف عن مستضد عدوى الملوية البوابية في البراز. يمكن أن يوفر اختبار شطيرة الأجسام المضادة المزدوجة القائمة على اللاتكس نتائج في غضون 10-20 دقيقة مقارنة بالطرق التقليدية التي تتطلب انتظار النتائج المختبرية ، وهو أمر مهم للتعرف على العدوى الحادة وقرارات العلاج المبكرة في المناطق النائية والمتخلفة.
باختصار ، يوفر اكتشاف مستضد الملوية البوابية في البراز العديد من المزايا المنهجية ، بما في ذلك عدم التوغل والبساطة والنظافة والكفاءة العالية وقابلية التطبيق على نطاق واسع. هذه الميزات تجعل هذه الطريقة أداة قيمة للممارسة السريرية وتوفر رؤى مبتكرة للتطوير المستقبلي لتقنيات التشخيص. في المناطق المتخلفة ذات الظروف الصحية المحدودة ، من المتوقع أن يلعب هذا النهج دورا محوريا في تشخيص عدوى الملوية البوابية وتدبير العلاجي.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
اي
Materials
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
References
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved