Method Article
ダブル抗体サンドイッチ検出技術による ヘリコバクター・ピロリ 菌感染の糞便抗原の迅速検出
要約
本研究では、 ヘリコバクター・ピロリ菌に感染した糞便抗原を迅速に検出するために、二重抗体に基づくサンドイッチ検出技術を開発しました。
要約
ヘリコバクター・ピロリ は胃粘膜に寄生する可能性があり、感染後に一連の胃腸疾患を引き起こす可能性があり、胃炎、胃潰瘍、胃がんと密接に関連しています。医療インフラが不十分で衛生状態が不十分な地域での ピロリ菌 感染の有病率が高いことは、依然として公衆衛生上の重大な懸念事項です。したがって、リソースが限られている環境下での ピロリ菌 検出のための迅速、簡便、かつ費用対効果の高いスクリーニング法の開発は、最も重要です。
本研究では、広東省市四潭村において、約300人の定住人口が住み、一般的に学歴が低いという僻地・低開発地域において、コミュニティベースのスクリーニングを実施した。 私たちは、ピロリ菌 の糞便抗原の検出にダブル抗体サンドイッチアッセイを採用しましたが、これは低リソース環境での適用性を考慮して選択された方法です。村から合計261人の参加者が登録され、この手法を使用して彼らの糞便サンプルが分析されました。比較検証のために、同じサンプルを定量的ポリメラーゼ連鎖反応(qPCR)分析にかけました。qPCRの結果と比較して、糞便中の ピロリ菌 抗原の検出感度と特異性は60.24%と80.08%でした。その結果、糞便抗原検出法とqPCR(Kappa = 0.630 )との間に強い一致が示されました。この研究では、 ピロリ菌 感染症に対する糞便抗原検出の原理、手順、方法論、および臨床応用を体系的に解明し、ラテックスベースの二重抗体サンドイッチ技術を探求し、その補助診断のための新しい戦略と実用的なガイドラインを確立することを目的としています。
概要
ヘリコバクター・ピロリ(H. pylori, Hp)は、微好気性のらせん状のグラム陰性菌1です。この病原体は、ヒトの胃にコロニーを形成し、慢性的に感染する能力があるため、胃腺がん3,4の発症における主要な病因として特定されています。2015年には、世界で~44億人がピロリ菌に感染しました5。ピロリ菌の感染率は地理的に大きく異なり、発展途上国は先進国に比べて感染率が著しく高くなっています。特に、低所得国や特定の脆弱な人々の間では、感染率が75%にも達することがあります6。
胃内視鏡検査などの従来の検出方法は正確ですが、その侵襲性、高コスト、および患者の受け入れの低さのために、大規模なスクリーニングや日常的なフォローアップへの適用は限られています7。したがって、非侵襲的で、シンプルで、迅速な診断方法の探求は、現代の臨床医学研究の重要な方向性となっています。 ピロリ菌 の非侵襲的診断の主な目的は、内視鏡検査なしで患者が ピロリ菌 に感染しているかどうかを正確、安全、かつ便利に検出することです。尿素呼気検査(UBT)、 ピロリ菌 糞便抗原検査(FAT)8、および血清学的検査9 は、一般的な非侵襲的手法です。
これらの中で、UBTは利用可能な最も侵入的でない最も正確な手順です10。UBTの感度と特異度は95%11より高いです。利用可能な非侵襲的診断方法の中で、UBTは最も正確で信頼性が高いことが示されており、イラクで実施された検証研究に見られるように、UBTは他の方法と比較して高い性能を発揮するため、最初の選択肢として推奨される可能性があります12。しかし、UBTには、コストが高いことや質量分析が必要であることなど、リモートまたはリソースが限られた設定でのアプリケーションを制限するなどの欠点もあります13。
ピロリ菌感染を検出するための迅速で非侵襲的で費用対効果の高い診断法の開発は、特に資源が限られている地域で非常に必要とされています。本研究では、糞便中のピロリ菌抗原を迅速、効果的、低コストで検出できるダブル抗体サンドイッチ検出技術を基盤に、ピロリ菌糞便抗原の迅速検出技術を開発しました。このテクノロジーは、手頃な価格、非侵襲性、使いやすさ、遠隔地への適応性など、大きな利点を提供します。私たちは、ピロリ菌の糞便抗原を検出するためのダブル抗体サンドイッチ法は、qPCR に匹敵する感度と特異性を示し、非侵襲的な臨床診断の実行可能なツールとして位置付けられるという仮説を立てています。
私たちは、ピロリ菌感染症に対する糞便抗原検出の原理、手順、方法論的強み、および臨床的適用性を包括的に詳細に説明しました。その実用性を検証するため、中国広東省清遠市において疫学調査とスクリーニングを実施しました。この村は、定住人口が約400人で、学歴も限られています。本研究の結果は、ここで設計された糞便中のピロリ菌抗原の迅速検出技術が20分以内に完了できることを実証しています。糞便中のピロリ菌抗原の迅速な検出は、遠隔地および後方地域におけるピロリ菌感染の迅速で信頼性の高い診断のための潜在的で有望なツールであることが強調されています。
プロトコル
この横断的研究は、広東省人民病院の倫理委員会 (承認番号: KY2024-445-01) によって承認されており、研究中、すべての被験者の個人データは厳重に機密でした。すべての参加者は、実験の前に書面によるインフォームドコンセントに署名しました。2024年に広東省清遠市の市丹村の住民が研究対象として選ばれ、年齢や性別の制限はありませんでした。以下に述べるダブル抗体サンドイッチアッセイ(定性的実験)は、専門の医療関係者および技術者が指示に従って実施しました。この研究には、健康であるか、症状があるか、胃腸疾患に関連する既存の病気があるかに関係なく、村の恒久的な人口全体が選択されました。
1. 患者様の選択
- 過去 1 か月間にプロトンポンプ阻害剤またはビスマス、H2 受容体遮断薬、または抗生物質を使用したことのある患者は除外します。
- 参加者全員に匿名でアンケートに記入してもらいます。アンケートの内容は5つの質問で構成されています:あなたは定期的に3食を食べていますか?お酒を飲みますか? ピロリ菌をご存知ですか? ピロリ菌 の検査は必要だと思いますか? ピロリ菌 感染の悪影響を理解していますか?
2. 糞便ピロリ菌 感染抗原検出の手順
注: ピロリ菌 の便抗原検査のアルゴリズムは、シンプルさと衛生性を考慮して、結果の精度と信頼性を確保するように設計されています。プロセス全体は、サンプル収集、サンプル処理、サンプル保存、検出、および結果の解釈の5つのステップに分かれています。サンプル検出の作業フローチャートと概略図を 図1 と 図2に示します。
- サンプルコレクション
注:サンプル採取には、 ピロリ菌 抗原特異的容器を使用する必要があります。サンプルを水、尿、消毒剤、下水と混合しないでください。- 排便が完了したら、専用容器の上蓋を外してサンプリングロッドを取り出します。
- サンプリングロッドをサンプリング用のスツールの5つの異なる位置に連続的に挿入し、サンプリングロッドのネジ端がスツールに完全に挿入されていることを確認します。
- サンプリングが完了したら、サンプリングロッドを試薬チューブに戻します。サンプル量は合計で~5-50mgです。
- サンプル処理
- 試薬チューブを左右に ~10 秒間振とうして、糞便サンプルを希釈液 (主成分: エチレンジアミン四酢酸四ナトリウム水和物 0.018 g/mL および 塩化ナトリウム 0.01 g/mL) で完全に混合します。
- サンプルの保存
- サンプリング後できるだけ早くサンプルをテストします。必要に応じて、室温で6時間以内、冷蔵条件(2〜8°Cで72時間以内、-25°C〜-15°Cで6か月以内の凍結)で保存して、抗原分解と微生物活動を遅らせます。
注:サンプルは冷凍と解凍を3回まで繰り返し行うことができ、冷蔵サンプルと冷凍サンプルの両方をテスト前に室温に戻す必要があります。
- サンプリング後できるだけ早くサンプルをテストします。必要に応じて、室温で6時間以内、冷蔵条件(2〜8°Cで72時間以内、-25°C〜-15°Cで6か月以内の凍結)で保存して、抗原分解と微生物活動を遅らせます。
- サンプル検出
- 試薬チューブカバーの白いカバーを開け、試薬チューブを直立させたままにします。
- 蓋を最も低い位置まで押し下げて、サンプルがテストカード上を流れ、マウス抗HP抗体でコーティングされた検出エリア(T)と品質管理エリア(C)を通過します。
- 結果の解釈
- サンプル中の ピロリ菌 抗原が抗体に結合している場合、検出領域で巨視的な発色反応を形成するまで、10〜20分待ちます。これは通常、品質管理領域の線とは対照的な赤または紫の線として表示されます。
- 色反応の有無、および色の深さは、サンプル中の ピロリ菌 抗原の濃度に関係しています。カラーカードを比較して、結果を迅速かつ正確に解釈します( 図3を参照)。
3. DNA抽出
- 試験管に適量の糞を入れ、PBS溶液を加え、振ってよく混ぜます。混合物を12,000 × g で5〜10分間遠心分離し、さらに抽出するために200 μLの上清を慎重に収集します。
- サンプル数に基づいて、同数の1.5 mL遠心分離チューブを調製します。各チューブに、20 μL のプロテイナーゼ K (20 mg/mL)、10 μL の磁気ビーズ、200 μL のサンプル上清、および 200 μL の溶解バッファー A を順次加えます。チューブを反転させて十分に混合し、55 °C の金属浴で 10 分間インキュベートします。
- 熱分解が完了したら、遠心分離管を磁気フレームに置き、放置して、ビーズに1分間吸着させます。チューブ内の液体が完全に清澄化されたら、上清を捨て、磁気ビーズを乱さないようにしてください。
- チューブをマグネットラックから取り外し、1.5 mL遠心チューブラックに置きます。ピペットを使用して、各チューブに500 μLの洗浄バッファーEを加え、1分間十分に混合した後、チューブを磁気ラックに戻します。チューブを1分間放置し、清澄化後に上清を捨て、磁気ビーズを吸引しないようにします。
- 各チューブに500μLの洗浄バッファーW2を加えて、洗浄プロセスを繰り返します。1分間十分に混合し、チューブを磁気ラックに置き、1分間放置します。溶液が明確になったら、上清を慎重に捨て、磁気ビーズが邪魔されないようにします。
- 溶離液100 μLを加えて混合し、55 °Cで5分間インキュベートします。
- チューブを磁気ラックに置き、2分間放置します。溶液が明確になったら、溶出した核酸を新しい遠心分離チューブに慎重に移し、磁気ビーズの吸引を避けます。
- 260 nm(A260)および280 nm(A280)での吸光度を測定することにより、抽出したDNAの純度を評価します。A260/A280 比を計算しますが、これは理想的には高純度DNAの場合は1.8より大きいはずです。
4. ピロリ菌 の検出と抗生物質耐性のためのqPCR
注:尿素A遺伝子を増幅することにより、ピロリ菌感染を検出するためにqPCRを実施しました。すべてのネガティブ品質管理製品は、滅菌された精製水です。H. pylori 核酸検出キットのポジティブ品質管理製品は、不活化 H. ピロリ標準ビーズ (ATCC 43504) です。典型的なS字カーブを持つCT ≤ 30は正と見なされます。
- テストするサンプルの数に応じて、 H.ピロリ 凍結乾燥製剤をキットから取り出し、凍結乾燥粉末をチューブの底に保つためにすばやく回転させます。
- 凍結乾燥製剤の蓋を慎重に開けます。テストするサンプルの核酸を取ります。サンプル核酸を凍結乾燥調製物に25μL加えます。チューブをしっかりと覆います。
- PCR試薬を8〜10秒間均等に振って混合し、その後、3〜5秒間すばやく回転させます。
- 32ウェルプレート上の各サンプルについて、PCR反応混合物(凍結乾燥粉末[Taq酵素(5 U/μL)、デオキシリボヌクレオシド三リン酸(2.5 mmol/L)、UNG酵素(2 U/μL)、 ureA フォワード(5'-ACATTGCGAGCGGGACAG-3') およびリバース(5'-CGCCCAATCTCACTTTATTTG-3') プライマー(40 μmol/L)])と抽出したDNAの25 μL(2.5 μg)を調製します。
- 32ウェルプレートqPCRボードをqPCRマシンで実行します。サーマルサイクラーをプログラムします:42°Cと95°C(どちらも1サイクル)それぞれ2分間。95 °C で 10 秒、65 °C で 45 秒 (2 ステップは 1 サイクル) で 10x;95 °C で 10 秒、58 °C で 45 秒 (2 つのステップで 1 サイクル) で 35 サイクル。
- qPCR専用のソフトウェアを使用してデータを解析し、装置がベースライン閾値を自動的に選択できるようにします。
5. 統計分析
- カイ二乗検定を使用して実験データを分析して、この方法とqPCR結果との一貫性を評価し、この技術スクリーニングの陽性率と ピロリ菌 感染の陽性率データをより広いスケール(全国など)で比較します。 P < 0.05で統計的に有意な差を考えます。
結果
アンケート調査
この研究には、4歳から99歳までの女性144人、男性117人の合計261人の参加者が登録されました。被験者の平均年齢は48.30歳±17.61歳でした。未成年者(0〜17歳)が17人、成人(18〜64歳)が202人、高齢者(>64歳)が42人でした。アンケート結果を 表1に示す。被験者の過半数(90.8%)は、 ピロリ菌 のスクリーニングを実施する必要があると考えていました。
この村における糞便ピロリ菌抗原検出のスクリーニング結果
糞便中の ピロリ 菌抗原の検査を受けた261人の参加者のうち、52人(19.92%)が陽性で、209人が陰性でした。陽性者52人のうち、32人が女性で全女性参加者の22.22%を占め、20人が男性で全男性参加者の17.09%を占めました。年齢別に見ると、陽性率は、未成年者(0-17歳)が2人(11.76%)、成人(18-64歳)が41人(20.30%)、高齢者(>64歳)が9人(21.43%)でした。
糞便中のピロリ菌抗原とqPCRの結果の一貫性の比較
この研究では、実験プロトコルの信頼性を特徴付けるために、異なるqPCRテスト結果を持つ2つのサンプルを選択しました(図4)。261人の被験者の糞便 ピロリ 菌抗原の結果のうち、52人が陽性、209人が陰性でした。261人の被験者の糞便を用いたqPCRの結果のうち、83人が陽性、178人が陰性でした(表2)。糞便 中のH.ピロリ 菌抗原検出の感度と特異度は、それぞれ60.24%と80.08%でした。この方法の陽性適中率(PPV)は96.15%、陰性適中率(NPV)は84.21%でした。Kappa 一貫性テストは、2 つの方法の診断結果が一貫していることを示しています (Kappa = 0.630、P < 0.05)。
この自然村と全国のスクリーニング陽性率の比較
陽性率は19.92%で、全国の陽性率42.8%14よりわずかに低かった14 (表3)。カイ二乗検定(P < 0.01)によると、陽性率の差は統計的に有意でした。

図1:サンプル検出のフローチャート。この図の拡大版を表示するには、ここをクリックしてください。
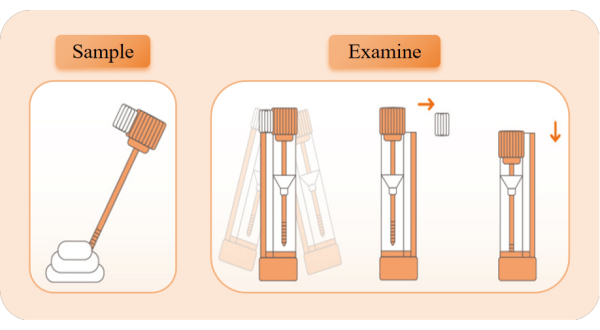
図2:サンプルの収集と検出の概略図。 検出装置を取り出し、アルミホイル袋を引き裂いて開き、試薬チューブを取り出します。オレンジ色のチューブカバーを取り外し、サンプリングスティックを使用して、糞便のさまざまな位置から5倍のサンプルを採取します。サンプリングロッドを試薬チューブに戻し、左右に10秒間振って完全に混合します。ホワイトリミットブロックを壊し、試薬チューブを直立させ、チューブカバーを最も低い位置に押してタイミングを開始します。赤い帯の外観を観察します。 この図の拡大版を表示するには、ここをクリックしてください。

図3:抗原結果の解釈(A)サンプラー。(B,E)陰性(-):陰性の結果は、サンプル中にピロリ菌抗原が検出されなかったことを示しており、ピロリ菌感染のリスクが低いことを示唆しています。陰性の結果は、感染の可能性を完全に排除することはできません。(C,F)陽性(+):陽性の結果は、サンプルからヘリコバクター・ピロリ抗原が検出され、ピロリ菌の感染が疑われることを意味します。(D)影響なし:無効な結果は、サンプルの収集または取り扱いプロセスに問題があるか、試薬が劣化して損傷している可能性があり、サンプルを再度収集するか、操作手順を繰り返す必要があります。この図の拡大版を表示するには、ここをクリックしてください。
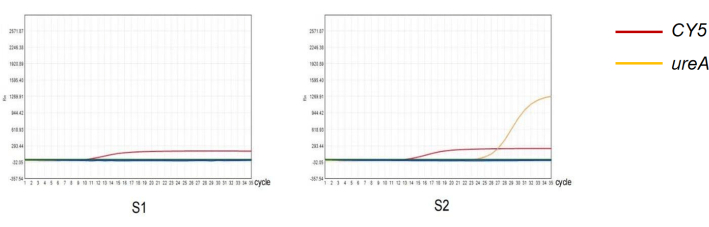
図4:qPCR法による糞便中の ピロリ菌 の検出。 (S1) H. pylori 感染の定量的 PCR 増幅の陰性結果。(S2) H.ピロリ 菌感染の定量的PCR増幅の陽性結果。 この図の拡大版を表示するには、ここをクリックしてください。
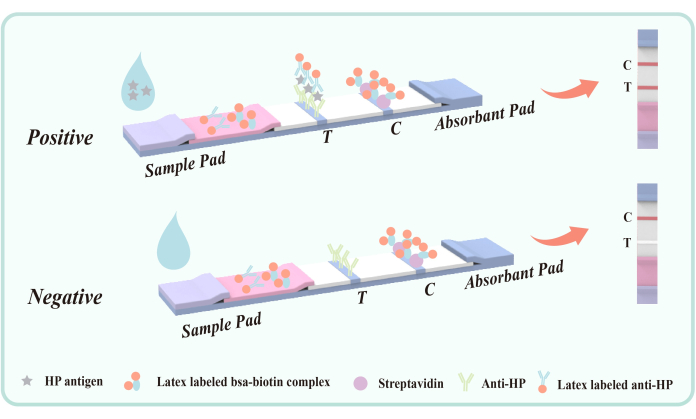
図5: ピロリ菌に感染した糞便抗原を検出するための二重抗体サンドイッチ法の模式図。 マウス抗Hp抗体(VacAエピトープ)を事前にメンブレン上の検出領域(T)に固定しておいた。品質管理エリア(C)は、ヤギの抗マウスIgGとストレプトアビジンをあらかじめ固定しています。ポリエステルフィルムは、ラテックス標識マウス抗HP抗体とラテックス-BSA-ビオチンコンジュゲートでコーティングされました。 この図の拡大版を表示するには、ここをクリックしてください。
| 3回の食事を定期的に食べるかどうか? | アルコールを飲むかどうか? | ピロリ菌をご存知ですか? | ピロリ菌の検査は必要ですか? | ピロリ菌感染の悪影響を理解していますか? | |
| はい (レート) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| いいえ (レート) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
表1:アンケート結果。
| ピロリ菌 抗原 | トータル | |||
| ポジティブ (+) | 低評価 (-) | |||
| リアルタイムqPCR | ポジティブ (+) | 50 | 33 | 83 |
| 低評価 (-) | 2 | 176 | 178 | |
| トータル | 52 | 209 | 261 | |
表2:2つの手法の診断結果。
| + | - | 陽性率 | トータル | |
| 四丹村 | 52 | 209 | 19.92% | 261 |
| 中国 | 314423 | 449404 | 42.80% | 763827 |
表3: 四丹村と全国平均のピロリ菌スクリーニング陽性率の比較。
ディスカッション
ピロリ菌は、世界中で最も蔓延している細菌感染症の1つです15。アンケート結果から、人口の55.2%がピロリ菌に対する認識が不足している一方で、90.8%がピロリ菌のスクリーニングが必要であると考えていることが明らかになりました。これらの知見は、経済的に恵まれない遠隔地でピロリ菌のスクリーニングプログラムを実施することの重要性を強調している16。尿素呼気検査(UBT)は一般的な診断方法ですが、その高額な費用と子供や妊婦には不適当であるため、その適用性は制限されています17,18。血清ピロリ菌抗体検査は、患者の血清中の抗体を検出することができます19。しかし、この検査は、細菌が除去された後も抗体が長く残るため、治療後の分析には適していません20。対照的に、糞便抗原検査は、胃腔へのアクセスを排除し、分析に必要な便サンプルのみを必要とする非侵襲的なアプローチを提供します。この方法は、患者の不快感と潜在的なリスクを大幅に軽減し、スクリーニングとフォローアップの両方でより便利になります。さらに、その非侵襲的な性質により、遠隔地や低開発地域の人々に受け入れられやすくなります。
私たちの研究集団におけるピロリ菌陽性患者の有病率は19.92%であり、これは全国の陽性率42.8%よりもわずかに低かった14。カイ二乗検定(P < 0.01)によると、それらの間には統計的有意性がありました。この違いの理由は、中国の7つの地理的地域の都市人口におけるピロリ菌の感染率が明らかな地域差を持っていることにあるのかもしれない21。感染率は中国東部で最も高く、中国東北部、華北、中国北西部で高く、華南と中国南西部で低くなっています21。私たちがスクリーニングした地域は中国南部に属しており、感染率は全国レベルよりも低くなっています。一方、個々の糞便サンプルのサンプリングプロセスにおける非標準的な操作と、テストに送るのに長い時間もこの違いの理由である可能性があります。PCRとその誘導体は、ピロリ菌を含む種々の病原体を検出するために広く採用されているが、その有用性は、サーモサイクラー機器の複雑さとコスト、および専門のオペレーターの必要性によって制限されている22,23。この研究では、qPCRの結果と比較して、糞便中のピロリ菌抗原の検出感度と特異性は60.24%と80.08%でした。糞便中のピロリ菌抗原の濃度とqPCRの結果を比較したところ、両者は中程度に一致していることが示唆されました(Kappa = 0.630、P < 0.05)。感度が不十分な理由は、不規則なサンプル収集、サンプルの保存温度、および納期の影響を受ける可能性があります。
ピロリ菌感染の糞便抗原を検出するためのダブル抗体サンドイッチ法は、効率的で特異的な免疫学的検出技術です。この方法の中核は、抗体の特異的結合能力を活用し、独創的な検出システムを通じて標的抗原の正確な同定と定量を確保することです。具体的には、このアプローチには、抗原捕捉と抗体検出という2つの主要なステップが含まれます。この技術の概略図を図5に示します。
ポリエステル膜検出領域(T)にコーティングされたマウス抗HP抗体は、 ピロリ菌VacA エピトープを標的とし、糞便中の ピロリ菌 抗原の特異的捕捉を達成します。 VacA 抗原は 、ピロリ菌の重要な外毒素であり、感染と密接に関連しています。 VacA を標的とする抗体は、抗原を効果的に同定して結合し、抗原-抗体複合体を形成することができます。したがって、この方法は他の胃腸疾患や疾患と交差反応することは容易ではありません。
試験中、液体サンプルは検出タンクに入り、毛細管現象によって上方に移動します。サンプルに ピロリ菌 抗原が含まれている場合、まず、ポリエステルフィルムにコーティングされたラテックス標識マウス 抗ピロリ 菌抗体と抗原抗体複合体を形成します。複合体が検出ゾーン(T)を流れると、固定化されたマウスの抗ピロリ 菌抗体によって捕捉され、検出ゾーン(T)に赤いバンドが見え、陽性の結果を示します。サンプル中に H.ピロリ 抗原が存在しない場合、検出ゾーン(T)にダブル抗体サンドイッチ複合体が形成されず、その結果、赤色のバンドは現れず、陰性の結果を示します。 ピロリ菌 抗原の有無にかかわらず、ラテックス-BSA-ビオチン結合体は、クロマトグラフィー中にメンブレンに固定化されたストレプトアビジンに結合し、品質管理ゾーンに赤いバンドを生成します(C)。この赤いバンドは、適切なクロマトグラフィープロセスの指標として、また試薬の内部制御標準物質として機能します。
ダブル抗体サンドイッチ法は、糞便中の ピロリ菌 抗原を慎重に設計した抗体とマーカーにより、効率的に捕捉し、定性的に検出する手法です。その簡便性、迅速性、高い特異性により、 ピロリ菌 感染症の診断補助に信頼性の高い技術サポートを提供します。この技術の広範な適用は、医療費を削減し、スクリーニング効率を向上させるだけでなく、患者により快適で便利な検査体験を提供します。この進歩は、 ピロリ菌 感染の世界的な予防と制御にとって非常に重要です。
さらに、便抗原検査の衛生面も重要な検討事項です。この方法では、採取時間に特定の制限なく、形成されたものと形成されていないもののいずれかの新鮮な糞便サンプルが必要です。サンプル採取中は、水、尿、消毒剤、または下水による汚染を避けることが不可欠です。糞便サンプルは、防腐剤や洗剤を含まない清潔で乾燥した容器に収集する必要があります。保存が必要な場合は、サンプルを室温で6時間以内、または2〜8°Cで最大72時間保持できます。正確な結果を得るためには、冷蔵サンプルを試験前に室温に戻す必要があります。また、便糞便H .ピロリ 菌感染抗原検出の大きな特徴も時間効率の良さです。ラテックスベースのダブル抗体サンドイッチアッセイは、検査結果を待つ必要がある従来の方法と比較して、10〜20分で結果を得ることができます。これは、急性感染症の認識や遠隔地や後方地域での早期治療決定に重要です。
要約すると、便 ピロリ菌 抗原検出は、非侵襲性、簡便性、衛生性、高効率、幅広い適用性など、多くの方法論的利点を提供します。これらの特徴により、この方法は臨床診療にとって貴重なツールとなり、診断技術の将来の開発に革新的な洞察を提供します。衛生条件が限られている低開発地域では、このアプローチは ピロリ菌 感染の診断と管理において極めて重要な役割を果たす準備ができています。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
何一つ
資料
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
参考文献
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved