Method Article
זיהוי מהיר של אנטיגן צואה של זיהום הליקובקטר פילורי על בסיס טכנולוגיית זיהוי סנדוויץ' נוגדנים כפולים
In This Article
Summary
במחקר זה פותחה טכניקת זיהוי כריכים המבוססת על נוגדנים כפולים לזיהוי מהיר של אנטיגנים צואתיים הנגועים בהליקובקטר פילורי.
Abstract
הליקובקטר פילורי יכול להיות טפילי ברירית הקיבה, מה שעלול לגרום לסדרה של מחלות במערכת העיכול לאחר זיהום וקשור קשר הדוק לדלקת קיבה, כיב קיבה וסרטן הקיבה. השכיחות הגבוהה של זיהום בהליקובקטר פילורי באזורים עם תשתית רפואית ירודה ואזורי תברואה לא מספקים נותרה דאגה משמעותית לבריאות הציבור. כתוצאה מכך, יש חשיבות עליונה לפיתוח שיטות סריקה מהירות, פשוטות וחסכוניות לגילוי הליקובקטר פילורי בסביבות מוגבלות במשאבים.
במחקר זה, ערכנו סקר קהילתי בכפר שיטאן, מחוז גואנגדונג, אזור מרוחק ולא מפותח המאופיין באוכלוסייה קבועה של כ-300 תושבים עם הישגים חינוכיים נמוכים בדרך כלל. השתמשנו בבדיקת סנדוויץ' נוגדנים כפולה לזיהוי אנטיגן צואה של הליקובקטר פילורי , שיטה שנבחרה בשל היישום הפוטנציאלי שלה בסביבות דלות משאבים. בסך הכל נרשמו 261 משתתפים מהכפר, ודגימות הצואה שלהם נותחו בטכניקה זו. לצורך אימות השוואתי, אותן דגימות עברו ניתוח תגובת שרשרת פולימראז כמותית (qPCR). בהשוואה לתוצאות qPCR, הרגישות והספציפיות של זיהוי אנטיגן הליקובקטר פילורי בצואה היו 60.24% ו-80.08%. התוצאות הראו התאמה חזקה בין שיטת זיהוי האנטיגן הצואתי לבין qPCR (Kappa = 0.630). מחקר זה הבהיר באופן שיטתי את העקרונות, הנהלים, המתודולוגיות והיישומים הקליניים של זיהוי אנטיגן צואתי לזיהום בהליקובקטר פילורי , במטרה לחקור את טכנולוגיית כריכי הנוגדנים הכפולים מבוססת לטקס ולבסס אסטרטגיות חדשות והנחיות מעשיות לאבחון העזר שלה.
Introduction
הליקובקטר פילורי (H. pylori, Hp) הוא חיידק מיקרואירופילי בצורת ספירלה, גרם שלילי1. בשל יכולתו להתיישב ולהדביק באופן כרוני את הקיבה האנושית2, פתוגן זה זוהה כגורם אטיולוגי עיקרי בהתפתחות אדנוקרצינומה בקיבה 3,4. בשנת 2015, ~4.4 מיליארד אנשים בעולם סבלו מזיהום בהליקובקטר פילורי 5. השכיחות של זיהום הליקובקטר פילורי מציגה שונות גיאוגרפית ניכרת, כאשר מדינות מתפתחות חוות שיעורים גבוהים משמעותית בהשוואה למדינות מפותחות. יש לציין כי במדינות בעלות הכנסה נמוכה ובקרב אוכלוסיות פגיעות מסוימות, שיעור ההדבקה יכול להגיע עד ל-75%6.
למרות ששיטות זיהוי מסורתיות כגון גסטרוסקופיה מדויקות, יישומן בהקרנה בקנה מידה גדול ובמעקב שגרתי מוגבל בשל פולשנותן, עלותן הגבוהה וקבלת המטופלים הנמוכה7. לכן, החיפוש אחר שיטות אבחון לא פולשניות, פשוטות ומהירות הפך לכיוון חשוב במחקר הרפואה הקלינית המודרנית. המטרה העיקרית של אבחנה לא פולשנית של הליקובקטר פילורי היא לזהות בצורה מדויקת, בטוחה ונוחה אם המטופל נגוע בהליקובקטר פילורי ללא בדיקה אנדוסקופית. בדיקת נשימה אוריאה (UBT ), בדיקת אנטיגן צואתי (FAT)8 ובדיקה סרולוגית9 הן טכניקות לא פולשניות פופולריות.
מבין אלה, ה-UBT הוא ההליך הכי פחות פולשני ומדויק ביותר שיש10. הרגישות והספציפיות של UBT גבוהות מ-95%11. מבין שיטות האבחון הלא פולשניות הזמינות, ה-UBT הוכח כמדויק והאמין ביותר, כפי שניתן לראות במחקר אימות שנערך בעיראק, ה-UBT עשוי להיות מומלץ כבחירה הראשונה בשל ביצועיו הגבוהים יותר בהשוואה לשיטות אחרות12. עם זאת, ל-UBT יש גם חסרונות, כגון העלות הגבוהה והצורך בניתוח ספקטרומטרי מסה, המגביל את היישום בהגדרות מרוחקות או מוגבלות במשאבים13.
יש צורך קריטי בפיתוח שיטת אבחון מהירה, לא פולשנית וחסכונית לאיתור זיהום בהליקובקטר פילורי , במיוחד באזורים מוגבלים במשאבים. במחקר זה פיתחנו טכנולוגיית זיהוי מהיר לאנטיגן צואתי של הליקובקטר פילורי המבוססת על טכנולוגיית זיהוי כריך נוגדנים כפולים, המסוגלת לזהות אנטיגן הליקובקטר פילורי בדגימות צואה במהירות, ביעילות ובעלות נמוכה. טכנולוגיה זו מציעה יתרונות משמעותיים, כולל סבירות, לא פולשנית, ידידותיות למשתמש ויכולת הסתגלות לאזורים מרוחקים. אנו משערים כי שיטת סנדוויץ' הנוגדנים הכפולים לגילוי אנטיגן צואה של הליקובקטר פילורי תפגין רגישות וסגוליות דומות ל-qPCR, ותמצב אותה ככלי בר-קיימא לאבחון קליני לא פולשני.
פירטנו באופן מקיף את העקרונות, הנהלים, החוזקות המתודולוגיות והיישום הקליני של זיהוי אנטיגן צואתי לזיהום בהליקובקטר פילורי . כדי לאמת את המעשיות שלו, ערכנו חקירה אפידמיולוגית וסינון בכפר שיטאן, העיר צ'ינגיואן, מחוז גואנגדונג, סין, שהוא אזור מרוחק ולא מפותח עם אוכלוסייה קבועה של כ-400 והישגים חינוכיים מוגבלים. התוצאות שלנו מדגימות כי ניתן להשלים את טכנולוגיית הזיהוי המהיר של אנטיגן הליקובקטר פילורי בצואה שתוכננה כאן תוך 20 דקות. מודגש כי זיהוי מהיר של אנטיגן הליקובקטר פילורי בצואה הוא כלי פוטנציאלי ומבטיח לאבחון מהיר ואמין של זיהום הליקובקטר פילורי באזורים מרוחקים ומפגרים.
Protocol
מחקר חתך זה אושר על ידי ועדת האתיקה של בית החולים העממי של מחוז גואנגדונג (מספר אישור: KY2024-445-01), והנתונים האישיים של כל נבדקי המחקר היו חסויים לחלוטין במהלך המחקר. כל המשתתפים חתמו על הסכמה מדעת בכתב לפני הניסויים. תושבי הכפר שיטאן בעיר צ'ינגיואן, מחוז גואנגדונג, נבחרו בשנת 2024 כנבדקי המחקר, ולא היו הגבלות על גיל ומין. בדיקת כריך הנוגדנים הכפול (ניסוי איכותני) המתוארת להלן בוצעה על ידי צוות רפואי וטכני מקצועי על פי ההוראות. כל האוכלוסייה הקבועה של הכפר נבחרה למחקר זה, ללא קשר אם הם בריאים או סבלו מתסמינים או מחלות קיימות הקשורות למחלות במערכת העיכול.
1. בחירת המטופל
- אל תכלול מטופלים אם הם השתמשו במעכבי משאבת פרוטון או ביסמוט, חוסמי קולטן H2 או אנטיביוטיקה בחודש האחרון.
- בקשו מכל המשתתפים למלא את השאלון באופן אנונימי. תוכן השאלון כולל חמש שאלות: האם אתה אוכל שלוש ארוחות באופן קבוע? האם אתה שותה אלכוהול? האם אתה מודע להליקובקטר פילורי? האם אתה חושב שיש צורך לבצע בדיקת הליקובקטר פילורי ? האם אתם מבינים את ההשלכות השליליות של זיהום בהליקובקטר פילורי ?
2. נוהל לזיהוי אנטיגן זיהום בהליקובקטר פילורי בצואה
הערה: האלגוריתם לבדיקת אנטיגן צואה של הליקובקטר פילורי תוכנן כדי להבטיח את הדיוק והאמינות של התוצאות, תוך התחשבות בפשטות והיגיינה. התהליך כולו מחולק לחמישה שלבים: איסוף דגימות, עיבוד דגימות, אחסון דגימות, זיהוי ופרשנות תוצאות. תרשים זרימת העבודה והתרשים הסכמטי של זיהוי הדגימה מוצגים באיור 1 ובאיור 2.
- איסוף דוגמאות
הערה: יש להשתמש במיכלים ספציפיים לאנטיגן הליקובקטר פילורי לאיסוף דגימות. אין לערבב את הדגימות עם מים, שתן, חומרי חיטוי וביוב.- לאחר השלמת עשיית הצרכים, הסר את המכסה העליון של המיכל המיוחד כדי להוציא את מוט הדגימה.
- הכנס את מוט הדגימה ברציפות לחמישה מצבים שונים של השרפרף לצורך דגימה, וודא שהקצה המושחל של מוט הדגימה מוכנס לחלוטין לתוך הצואה.
- הכנס את מוט הדגימה בחזרה לצינור המגיב לאחר השלמת הדגימה; נפח הדגימה הוא ~5-50 מ"ג בסך הכל.
- עיבוד מדגם
- נענע את צינור המגיב מצד לצד למשך ~10 שניות כדי לערבב היטב את דגימת הצואה בדילול (המרכיבים העיקריים: אתילנדיאמין חומצה טטראצטית טטרה-סודיום הידרט 0.018 גרם/מ"ל ונתרן כלורי 0.01 גרם/מ"ל).
- אחסון לדוגמה
- בדוק את הדגימות בהקדם האפשרי לאחר הדגימה; אחסן אותם בטמפרטורת החדר לא יותר מ-6 שעות ובתנאי קירור (לא יותר מ-72 שעות ב-2-8 מעלות צלזיוס ולא יותר מ-6 חודשים קפואים ב-25 מעלות צלזיוס עד -15 מעלות צלזיוס) במידת הצורך כדי להאט את פירוק האנטיגן והפעילות המיקרוביאלית.
הערה: ניתן להקפיא ולהפשיר דגימות שוב ושוב עד פי 3, ויש להחזיר דגימות מקוררות וקפואות לטמפרטורת החדר לפני הבדיקה.
- בדוק את הדגימות בהקדם האפשרי לאחר הדגימה; אחסן אותם בטמפרטורת החדר לא יותר מ-6 שעות ובתנאי קירור (לא יותר מ-72 שעות ב-2-8 מעלות צלזיוס ולא יותר מ-6 חודשים קפואים ב-25 מעלות צלזיוס עד -15 מעלות צלזיוס) במידת הצורך כדי להאט את פירוק האנטיגן והפעילות המיקרוביאלית.
- זיהוי דוגמאות
- פתח את המכסה הלבן על מכסה צינור המגיב והשאר את צינור המגיב זקוף.
- לחץ כלפי מטה על המכסה עד לנקודה הנמוכה ביותר כך שהדגימה תזרום על כרטיס הבדיקה, ותעבור דרך אזור הזיהוי (T) ואזור בקרת האיכות (C) המצופה בנוגדנים נגד HP.
- פרשנות התוצאות
- המתן 10-20 דקות כך שכל אנטיגן הליקובקטר פילורי בדגימה, אם נקשר לנוגדן, ייצור תגובה כרומוגנית מקרוסקופית באזור הזיהוי. זה מופיע בדרך כלל כקו אדום או סגול המנוגד לקו באזור בקרת האיכות.
- הנוכחות או היעדר תגובת הצבע ועומק הצבע קשורים לריכוז אנטיגן הליקובקטר פילורי בדגימה. השווה את כרטיסי הצבע כדי לפרש במהירות ובדייקנות את התוצאות (ראה איור 3).
3. מיצוי DNA
- יש להניח כמות מתאימה של צואה במבחנה, להוסיף תמיסת PBS ולערבב היטב על ידי ניעור. צנטריפוגה את התערובת בחום של 12,000 × גרם למשך 5-10 דקות, ואז אספו בזהירות 200 מיקרוליטר של הסופרנטנט למיצוי נוסף.
- בהתבסס על מספר הדגימות, הכינו מספר שווה של צינורות צנטריפוגה של 1.5 מ"ל. לכל צינור, הוסף ברצף 20 מיקרוליטר של פרוטאינאז K (20 מ"ג/מ"ל), 10 מיקרוליטר של חרוזים מגנטיים, 200 מיקרוליטר של סופרנטנט הדגימה ו-200 מיקרוליטר של מאגר ליזה A. מערבבים היטב על ידי היפוך הצינורות, ואז דוגרים באמבט מתכת ב-55 מעלות צלזיוס למשך 10 דקות.
- לאחר השלמת הפירוליזה, הנח את צינור הצנטריפוגה על המסגרת המגנטית, תן לו לעמוד ואפשר לספיחה להתרחש למשך דקה אחת על החרוזים. לאחר שהנוזל בצינור מתבהר לחלוטין, השליכו את הסופרנטנט ונסו להימנע מהפרעה לחרוזים המגנטיים.
- הסר את הצינורות מהמתלה המגנטי והנח אותם על מתלה צינור צנטריפוגה בנפח 1.5 מ"ל. בעזרת פיפטה, הוסף 500 מיקרוליטר של מאגר כביסה E לכל צינור, ערבב היטב במשך דקה אחת, ולאחר מכן החזיר את הצינורות למתלה המגנטי. הניחו לצינורות לעמוד למשך דקה אחת, השליכו את הסופרנטנט לאחר ההבהרה והימנעו משאיבת החרוזים המגנטיים.
- חזור על תהליך הכביסה על ידי הוספת 500 מיקרוליטר של מאגר כביסה W2 לכל צינור. מערבבים היטב במשך דקה, מניחים את הצינורות על המתלה המגנטי ונותנים להם לעמוד דקה אחת. השליכו את הסופרנטנט בזהירות לאחר התבהרות התמיסה, וודא שהחרוזים המגנטיים יישארו ללא הפרעה.
- מוסיפים 100 מיקרוליטר נוזל, מערבבים ודוגרים בחום של 55 מעלות צלזיוס למשך 5 דקות.
- הנח את הצינורות על המתלה המגנטי ותן להם לעמוד במשך 2 דקות. לאחר שהתמיסה מתבהרת, העבירו בזהירות את חומצת הגרעין המנופחת לתוך צינור צנטריפוגה חדש, והימנעו משאיבת החרוזים המגנטיים.
- העריכו את טוהר ה-DNA המופק על ידי מדידת הספיגה ב-260 ננומטר (A260) ו-280 ננומטר (A280). חשב את יחס A260/A280 , שבאופן אידיאלי אמור להיות גדול מ-1.8 עבור DNA בעל טוהר גבוה.
4. qPCR לגילוי הליקובקטר פילורי ועמידות לאנטיביוטיקה
הערה: ביצענו qPCR לזיהוי זיהום בהליקובקטר פילורי על ידי הגברת הגן ureA . כל מוצרי בקרת האיכות השליליים הם מים סטריליים ומטוהרים. תוצר בקרת האיכות החיובי בערכת זיהוי חומצות הגרעין של הליקובקטר פילורי הוא חרוזים סטנדרטיים של הליקובקטר פילורי מושבת (ATCC 43504). AC, T ≤ 30 עם עקומה טיפוסית בצורת S נחשבת חיובית.
- על פי מספר הדגימות שיש לבדוק, הוציאו את התכשיר המיובש בהקפאה מהערכה, וסובבו אותו במהירות כדי לשמור על האבקה המיובשת בהקפאה בתחתית הצינור.
- פתח בזהירות את מכסה התכשיר המיובש בהקפאה; קח את חומצת הגרעין של הדגימה לבדיקה; הוסף 25 מיקרוליטר את חומצת הגרעין הדגימה לתכשיר המיובש בהקפאה; וכסו את הצינור בחוזקה.
- לנער ולערבב את מגיב ה-PCR באופן שווה במשך 8-10 שניות, ולאחר מכן לסובב אותו במהירות למשך 3-5 שניות.
- עבור כל דגימה על צלחת של 32 בארות, הכינו 25 מיקרוליטר מתערובת תגובת ה-PCR (אבקה מיובשת בהקפאה [המכילה את האנזים Taq (5 U/μL), דאוקסיריבונוקלאוזיד טריפוספט (2.5 מילימול/ליטר), אנזים UNG (2 U/μL), ureA קדימה (5'-ACATTGCGAGCGGGACAG-3') והפוך (5'-CGCCCAATCTCACTTTATCG-3') (40 מיקרומול/ליטר)]), ו-25 מיקרוליטר (2.5 מיקרוגרם) של ה-DNA שחולץ.
- הפעל את לוח ה-qPCR בעל 32 הבארות במכונת ה-qPCR. תכנת את המחזור התרמי: 42 מעלות צלזיוס ו-95 מעלות צלזיוס (שניהם למחזור אחד) למשך 2 דקות כל אחד; 95 מעלות צלזיוס למשך 10 שניות ו-65 מעלות צלזיוס למשך 45 שניות (שני שלבים הם מחזור אחד) למשך 10x; 95 מעלות צלזיוס למשך 10 שניות וב-58 מעלות צלזיוס למשך 45 שניות (שני שלבים הם מחזור אחד) למשך 35 מחזורים.
- נתח את הנתונים באמצעות תוכנה ספציפית עבור qPCR ותן למכשיר לבחור באופן אוטומטי את ספי הבסיס.
5. ניתוח סטטיסטי
- השתמש בבדיקת חי בריבוע כדי לנתח את נתוני הניסוי כדי להעריך את העקביות בין שיטה זו לתוצאות ה-qPCR ולהשוות את השיעור החיובי של סקר טכנולוגיה זו עם נתוני השיעור החיוביים של זיהום בהליקובקטר פילורי בקנה מידה רחב יותר (למשל, בפריסה ארצית). קחו בחשבון הבדלים מובהקים סטטיסטית ב-P < 0.05.
תוצאות
סקר שאלונים
בסך הכל נרשמו למחקר 261 משתתפים, הכוללים 144 נשים ו-117 גברים, בגילאים שנעו בין 4 ל-99 שנים. הגיל הממוצע של הנבדקים היה 48.30 ± 17.61 שנים. בפיגוע השתתפו 17 קטינים (בני 17-0), 202 מבוגרים (64-18) ו-42 קשישים (>64 שנים). תוצאות השאלון מוצגות בטבלה 1. רוב הנבדקים (90.8%) חשבו שיש צורך לבצע בדיקת הליקובקטר פילורי .
תוצאות סינון של זיהוי אנטיגן הליקובקטר פילורי בצואה בכפר זה
מבין 261 המשתתפים שנבדקו לאנטיגן הליקובקטר פילורי בצואה, 52 (19.92%) היו חיוביים, בעוד ש-209 היו שליליים. מתוך 52 המקרים החיוביים, 32 היו נשים, המייצגות 22.22% מכלל המשתתפות, ו-20 היו גברים, המהווים 17.09% מכלל המשתתפים הגברים. בחלוקה לפי גיל, שיעורי החיוביים היו כדלקמן: לקטינים (0-17 שנים) היו 2 מקרים חיוביים (11.76%), למבוגרים (18-64 שנים) היו 41 מקרים חיוביים (20.30%), ולקשישים (>64 שנים) היו 9 מקרים חיוביים (21.43%).
השוואת עקביות בין אנטיגן הליקובקטר פילורי בצואה לתוצאות qPCR
במחקר זה, נבחרו שתי דגימות עם תוצאות שונות של בדיקת qPCR כדי לאפיין את מהימנות פרוטוקול הניסוי (איור 4). מבין תוצאות אנטיגן הליקובקטר פילורי בצואה של 261 נבדקים, 52 היו חיוביות ו-209 היו שליליות. מבין תוצאות ה-qPCR עם צואה של 261 נבדקים, 83 היו חיוביות ו-178 היו שליליות (טבלה 2). הרגישות והספציפיות של זיהוי אנטיגן הליקובקטר פילורי בצואה היו 60.24% ו-80.08%, בהתאמה. ערך הניבוי החיובי (PPV) של שיטה זו היה 96.15%, וערך הניבוי השלילי (NPV) היה 84.21%. מבחן העקביות של קאפה מצביע על כך שתוצאות האבחון של שתי השיטות עקביות (קאפה = 0.630, P < 0.05).
השוואה של שיעור הבדיקות החיוביות בין הכפר הטבעי הזה לכל הארץ
שיעור החיוביים היה 19.92%, שהיה נמוך במעט משיעור החיוביים הארצי של 42.8%14 (לוח 3). על פי מבחן חי בריבוע (P < 0.01), ההבדל בשיעורי החיוביים היה מובהק סטטיסטית.

איור 1: תרשים זרימה של גילוי דגימות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
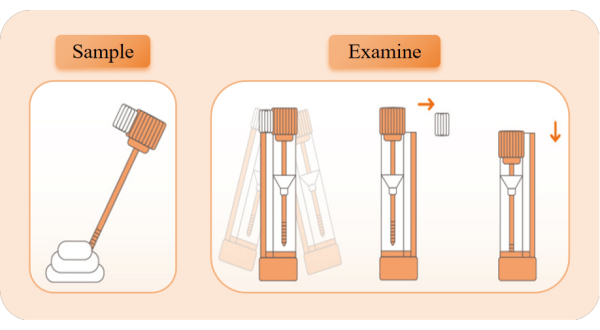
איור 2: הדיאגרמה הסכמטית של איסוף וגילוי דגימות. הוצא את מכשיר הזיהוי, קרע את שקית נייר האלומיניום והוציא את צינור המגיב. משוך את מכסה הצינור הכתום והשתמש במקל הדגימה כדי לקחת דגימות פי 5 ממיקומים שונים של צואה. הכנס את מוט הדגימה בחזרה לצינור המגיב ונער אותו שמאלה וימינה למשך 10 שניות לערבוב מלא. שברו את בלוק הגבול הלבן, שמרו על צינור המגיב זקוף ולחצו על מכסה הצינור למצב הנמוך ביותר כדי להתחיל בתזמון. שימו לב למראה של רצועות אדומות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: פירוש תוצאות האנטיגן. (A) דגימה. (ב,ה) שלילי (-): תוצאה שלילית מצביעה על כך שלא זוהה אנטיגן הליקובקטר פילורי בדגימה, מה שמרמז על כך שהסיכון לזיהום בהליקובקטר פילורי נמוך. תוצאה שלילית אינה יכולה לשלול לחלוטין את האפשרות של הדבקה. (ג,ו) חיובי (+): תוצאה חיובית פירושה שאנטיגן הליקובקטר פילורי מזוהה בדגימה, יש חשד לזיהום בהליקובקטר פילורי . (ד) אין השפעה: תוצאות לא חוקיות עלולות להוות בעיה בתהליך איסוף הדגימה או הטיפול בה, או שהמגיב התדרדר וניזוק, ויש לאסוף את הדגימה שוב או לחזור על שלבי הפעולה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
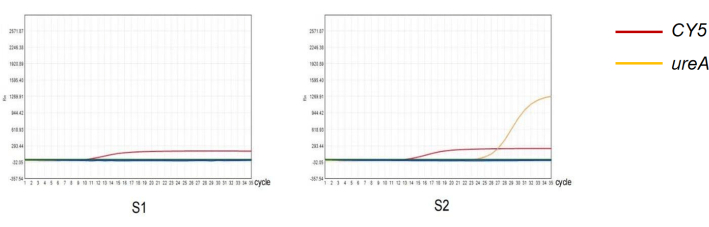
איור 4: זיהוי הליקובקטר פילורי בצואה בשיטת qPCR. (ס1) תוצאה שלילית של הגברת PCR כמותית של זיהום הליקובקטר פילורי . (ש2) תוצאה חיובית של הגברה כמותית של PCR של זיהום הליקובקטר פילורי . אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
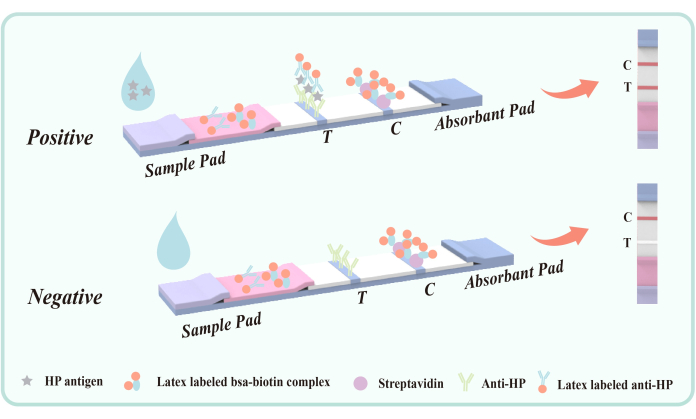
איור 5: דיאגרמה סכמטית של שיטת סנדוויץ' נוגדנים כפולים לגילוי אנטיגן צואה נגוע בהליקובקטר פילורי. נוגדן נגד HP, עכבר (VacA epitope) נקבע מראש באזור הזיהוי (T) על הממברנה. אזור בקרת האיכות (C) מתקן מראש IgG נגד עכברים וסטרפטווידין. סרט הפוליאסטר היה מצופה בנוגדנים נגד HP, עכבר, מסומן לטקס ומצומד לטקס-BSA-ביוטין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| האם לאכול באופן קבוע לשלוש ארוחות? | האם לשתות אלכוהול? | האם אתה מכיר הליקובקטר פילורי? | האם יש צורך לבצע בדיקת הליקובקטר פילורי ? | האם אתם מבינים את ההשלכות השליליות של זיהום בהליקובקטר פילורי ? | |
| כן (מחיר) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| לא (תעריף) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
טבלה 1: תוצאות השאלון.
| אנטיגן הליקובקטר פילורי | סך | |||
| חיובי (+) | שלילי (-) | |||
| qPCR | חיובי (+) | 50 | 33 | 83 |
| שלילי (-) | 2 | 176 | 178 | |
| סך | 52 | 209 | 261 | |
טבלה 2: תוצאות אבחון של שתי טכניקות.
| חיובי | שלילי | שיעור חיובי | סך | |
| כפר שטאן | 52 | 209 | 19.92% | 261 |
| סין | 314423 | 449404 | 42.80% | 763827 |
טבלה 3: השוואה בין שיעורי הבדיקות החיוביות להליקובקטר פילורי בין כפר שיטאן לממוצע הארצי.
Discussion
הליקובקטר פילורי מייצג את אחד הזיהומים החיידקיים הנפוצים ביותר בכל רחבי העולם15. תוצאות השאלון חשפו כי 55.2% מהאוכלוסייה חסרה מודעות להליקובקטר פילורי, בעוד ש-90.8% האמינו כי יש צורך בבדיקת הליקובקטר פילורי. ממצאים אלה מדגישים את החשיבות של יישום תוכניות סקר להליקובקטר פילורי באזורים מוחלשים כלכלית ומרוחקים16. למרות שבדיקת הנשיפה של אוריאה (UBT) היא שיטת אבחון נפוצה, עלותה הגבוהה וחוסר התאמתה לילדים ונשים בהריון מגבילים את תחולתה17,18. בדיקת נוגדנים להליקובקטר פילורי בסרום יכולה לזהות נוגדנים בסרום של המטופל19. עם זאת, בדיקה זו אינה מתאימה לניתוח לאחר הטיפול מכיוון שהנוגדנים נשארים זמן רב לאחר ניקוי החיידקים20. לעומת זאת, בדיקת אנטיגן צואה מציעה גישה לא פולשנית המבטלת את הצורך בגישה לחלל הקיבה, ודורשת רק דגימות צואה לניתוח. שיטה זו מפחיתה משמעותית את אי הנוחות של המטופל ואת הסיכונים הפוטנציאליים, מה שהופך אותה לנוחה יותר הן לבדיקה והן למעקב. בנוסף, אופיו הלא פולשני הופך אותו למקובל יותר על אוכלוסיות באזורים מרוחקים ולא מפותחים.
השכיחות של חולים חיוביים להליקובקטר פילורי באוכלוסיית המחקר שלנו היא 19.92%, שהיה מעט נמוך משיעור החיוביים הארצי של 42.8%14. על פי מבחן חי בריבוע (P < 0.01), הייתה מובהקות סטטיסטית ביניהם. הסיבה להבדל זה עשויה להיות ששיעור ההדבקה של הליקובקטר פילורי באוכלוסיות עירוניות בשבעה אזורים גיאוגרפיים של סין הוא בעל בידול אזורי ברור21. שיעור ההדבקה הוא הגבוה ביותר במזרח סין, גבוה יותר בצפון מזרח סין, צפון סין וצפון מערב סין, ונמוך יותר בדרום סין ובדרום מערב סין21. האזור שבדקנו שייך לדרום סין, ושיעור ההדבקה נמוך מהרמה הארצית. מצד שני, הפעולה הלא סטנדרטית בתהליך הדגימה של דגימות צואה בודדות והזמן הארוך לשליחה לבדיקה עשויים גם הם להיות הסיבות להבדל זה. למרות ש-PCR ונגזרותיו משמשים באופן נרחב לאיתור פתוגנים שונים, כולל הליקובקטר פילורי, התועלת שלהם מוגבלת על ידי המורכבות והעלות של ציוד תרמו-סייקלר והצורך במפעילים מיוחדים22,23. במחקר זה, בהשוואה לתוצאות qPCR, הרגישות והספציפיות של זיהוי אנטיגן הליקובקטר פילורי בצואה היו 60.24% ו-80.08%. הושוותה העקביות של אנטיגן הליקובקטר פילורי בצואה ובתוצאות qPCR, והתוצאות הצביעו על כך שהן עקביות במידה בינונית (Kappa = 0.630, P < 0.05). הסיבות לרגישות הלא מספקת שלו עשויות להיות מושפעות מאיסוף דגימות לא סדיר, טמפרטורת אחסון הדגימה וזמן האספקה.
שיטת סנדוויץ' הנוגדנים הכפולים לאיתור אנטיגן צואה זיהומי בהליקובקטר פילורי היא טכנולוגיית זיהוי אימונולוגית יעילה וספציפית. הליבה של שיטה זו היא לנצל את יכולת הקישור הספציפית של נוגדנים ולהבטיח זיהוי וכימות מדויקים של אנטיגנים מטרה באמצעות מערכת זיהוי גאונית. באופן ספציפי, גישה זו כוללת שני שלבים מרכזיים: לכידת אנטיגן וזיהוי נוגדנים. התרשים הסכמטי של טכנולוגיה זו מוצג באיור 5.
הנוגדן נגד HP, המצופה על אזור זיהוי קרום הפוליאסטר (T), מכוון לאפיטופ H. pylori VacA כדי להשיג לכידה ספציפית של אנטיגן הליקובקטר פילורי בצואה. אנטיגן VacA הוא אקסוטוקסין חשוב של הליקובקטר פילורי, הקשור קשר הדוק לזיהום. נוגדנים המכוונים ל-VacA יכולים לזהות ביעילות את האנטיגן ולהיקשר אליו, וליצור קומפלקס אנטיגן-נוגדנים. לכן, שיטה זו אינה קלה לתגובה צולבת עם מחלות או מחלות אחרות במערכת העיכול.
במהלך הבדיקה, דגימת הנוזל נכנסת למיכל הזיהוי ונודדת כלפי מעלה באמצעות פעולה נימית. אם הדגימה מכילה אנטיגן הליקובקטר פילורי , היא יוצרת תחילה קומפלקס אנטיגן-נוגדנים עם נוגדן נגד הליקובקטר פילורי המסומן בלטקס המצופה על סרט הפוליאסטר. כאשר הקומפלקס זורם דרך אזור הזיהוי (T), הוא נלכד על ידי נוגדן העכבר המשותק נגד הליקובקטר פילורי , וכתוצאה מכך פס אדום גלוי באזור הזיהוי (T), מה שמעיד על תוצאה חיובית. אם אין אנטיגן הליקובקטר פילורי בדגימה, לא נוצר קומפלקס סנדוויץ' נוגדנים כפול באזור הזיהוי (T), וכתוצאה מכך לא מופיע פס אדום, המעיד על תוצאה שלילית. ללא קשר לנוכחות או היעדר אנטיגן הליקובקטר פילורי , מצומד הלטקס-BSA-ביוטין ייקשר לסטרפטווידין המשותק על הממברנה במהלך הכרומטוגרפיה, וייצור פס אדום באזור בקרת האיכות (C). פס אדום זה משמש הן כאינדיקטור לתהליך כרומטוגרפי תקין והן כתקן הבקרה הפנימי של המגיב.
שיטת סנדוויץ' הנוגדנים הכפולים מממשת את הלכידה היעילה והזיהוי האיכותי של אנטיגן הליקובקטר פילורי בצואה על ידי נוגדנים וסמנים שתוכננו בקפידה. הפשטות, המהירות והספציפיות הגבוהה שלו מספקים תמיכה טכנית אמינה לאבחון עוזר של זיהום הליקובקטר פילורי . היישום הנרחב של טכנולוגיה זו לא רק מפחית את העלויות הרפואיות ומשפר את יעילות ההקרנה, אלא גם מספק למטופלים חווית בדיקה נוחה ונוחה יותר. להתקדמות זו יש חשיבות משמעותית למניעה ובקרה גלובלית של זיהום הליקובקטר פילורי .
בנוסף, ההיגיינה של בדיקת אנטיגן צואה היא שיקול קריטי. שיטה זו דורשת דגימות צואה טריות, שיכולות להיווצר או לא להיווצר, ללא הגבלות ספציפיות על זמן האיסוף. במהלך איסוף הדגימה, חיוני להימנע מזיהום במים, שתן, חומרי חיטוי או ביוב. יש לאסוף דגימות צואה במיכלים נקיים ויבשים ללא חומרים משמרים וחומרי ניקוי. אם יש צורך באחסון, ניתן לשמור דגימות בטמפרטורת החדר לא יותר מ-6 שעות או בטמפרטורה של 2-8 מעלות צלזיוס עד 72 שעות. יש להחזיר דגימות בקירור לטמפרטורת החדר לפני הבדיקה כדי להבטיח תוצאות מדויקות. יעילות זמן גבוהה היא גם מאפיין עיקרי של זיהוי אנטיגן זיהום בהליקובקטר פילורי . בדיקת כריך הנוגדנים הכפול המבוססת על לטקס יכולה לספק תוצאות תוך 10-20 דקות בהשוואה לשיטות מסורתיות הדורשות המתנה לתוצאות מעבדה, מה שחשוב לזיהוי זיהום חריף והחלטות טיפול מוקדמות באזורים מרוחקים ומפגרים.
לסיכום, זיהוי אנטיגן הליקובקטר פילורי מציע יתרונות מתודולוגיים רבים, כולל לא פולשניות, פשטות, היגיינה, יעילות גבוהה ויישום רחב. תכונות אלו הופכות שיטה זו לכלי רב ערך לתרגול קליני ומספקות תובנות חדשניות לפיתוח עתידי של טכנולוגיות אבחון. באזורים לא מפותחים עם תנאים סניטריים מוגבלים, גישה זו עומדת למלא תפקיד מרכזי באבחון וניהול זיהום הליקובקטר פילורי .
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
ללא
Materials
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
References
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved