Method Article
Detección rápida de antígeno fecal de infección por Helicobacter pylori basada en la tecnología de detección de sándwich de doble anticuerpo
En este artículo
Resumen
En este estudio se desarrolló una técnica de detección sándwich basada en anticuerpos dobles para la detección rápida de antígenos fecales infectados con Helicobacter pylori.
Resumen
Helicobacter pylori puede ser parásito en la mucosa gástrica, lo que puede causar una serie de enfermedades gastrointestinales después de la infección y está estrechamente relacionado con la gastritis, la úlcera gástrica y el cáncer gástrico. La alta prevalencia de la infección por H. pylori en regiones con infraestructura médica deficiente y zonas de saneamiento inadecuadas sigue siendo un importante problema de salud pública. En consecuencia, el desarrollo de métodos de cribado rápidos, sencillos y rentables para la detección de H. pylori en entornos con recursos limitados es de suma importancia.
En este estudio, llevamos a cabo un cribado comunitario en la aldea de Shitan, provincia de Guangdong, una zona remota y subdesarrollada caracterizada por una población permanente de aproximadamente 300 residentes con un nivel educativo generalmente bajo. Empleamos un ensayo sándwich de doble anticuerpo para la detección del antígeno fecal de H. pylori , un método elegido por su posible aplicabilidad en entornos de bajos recursos. Se inscribieron 261 participantes de la aldea y se analizaron sus muestras fecales mediante esta técnica. Para la validación comparativa, las mismas muestras se sometieron a un análisis cuantitativo de reacción en cadena de la polimerasa (qPCR). En comparación con los resultados de la qPCR, la sensibilidad y especificidad de la detección del antígeno de H. pylori en heces fue del 60,24% y del 80,08%. Los resultados demostraron una fuerte concordancia entre el método de detección de antígeno fecal y la qPCR (Kappa = 0,630). Este estudio dilucidó sistemáticamente los principios, procedimientos, metodologías y aplicaciones clínicas de la detección de antígenos fecales para la infección por H. pylori , con el objetivo de explorar la tecnología de sándwich de doble anticuerpo basada en látex y establecer nuevas estrategias y pautas prácticas para su diagnóstico auxiliar.
Introducción
Helicobacter pylori (H. pylori, Hp) es una bacteria gramnegativa microaerofílica en forma de espiral1. Debido a su capacidad para colonizar e infectar crónicamente el estómago humano2, este patógeno ha sido identificado como un factor etiológico importante en el desarrollo del adenocarcinoma gástrico 3,4. En 2015, ~4.4 mil millones de personas en el mundo sufrieron de infección por H. pylori 5. La prevalencia de la infección por H. pylori exhibe una variación geográfica considerable, con los países en desarrollo experimentando tasas significativamente más altas en comparación con las naciones desarrolladas. En particular, en los países de bajos ingresos y entre ciertas poblaciones vulnerables, la tasa de infección puede alcanzar el 75%6.
A pesar de que los métodos tradicionales de detección, como la gastroscopia, son precisos, su aplicación en el cribado a gran escala y en el seguimiento rutinario es limitada debido a su carácter invasivo, su alto coste y su baja aceptación por parte de los pacientes7. Por lo tanto, la búsqueda de métodos de diagnóstico no invasivos, simples y rápidos se ha convertido en una dirección importante de la investigación moderna en medicina clínica. El objetivo principal de un diagnóstico no invasivo de H. pylori es detectar de manera precisa, segura y conveniente si el paciente está infectado con H. pylori sin examen endoscópico. La prueba de aliento con urea (UBT), la prueba de antígeno fecal (FAT) de H. pylori8 y las pruebas serológicas9 son técnicas no invasivas populares.
Entre estos, el UBT es el procedimiento menos intrusivo y más preciso disponible10. La sensibilidad y especificidad de la UBT es superior al 95%11. Entre los métodos diagnósticos no invasivos disponibles, el UBT ha demostrado ser el más preciso y confiable, como se observó en un estudio de validación realizado en Irak, el UBT puede ser recomendado como la primera opción debido a su mayor rendimiento en comparación con otros métodos12. Sin embargo, la UBT también tiene sus inconvenientes, como su alto costo y la necesidad de análisis por espectrometría de masas, lo que limita la aplicación en entornos remotos o de recursos limitados13.
El desarrollo de un método de diagnóstico rápido, no invasivo y rentable para detectar la infección por H. pylori es muy necesario, especialmente en las regiones con recursos limitados. En este estudio, desarrollamos una tecnología de detección rápida para el antígeno fecal de H. pylori basada en la tecnología de detección de sándwich de doble anticuerpo, que puede detectar el antígeno de H. pylori en muestras fecales de manera rápida, efectiva y a bajo costo. Esta tecnología ofrece ventajas significativas, como la asequibilidad, la no invasividad, la facilidad de uso y la adaptabilidad a zonas remotas. Nuestra hipótesis es que el método de sándwich de doble anticuerpo para detectar el antígeno fecal de H. pylori demostrará una sensibilidad y especificidad comparables a la qPCR, posicionándolo como una herramienta viable para el diagnóstico clínico no invasivo.
Detallamos exhaustivamente los principios, procedimientos, fortalezas metodológicas y aplicabilidad clínica de la detección de antígenos fecales para la infección por H. pylori . Para validar su practicidad, llevamos a cabo una investigación epidemiológica y un cribado en la aldea de Shitan, ciudad de Qingyuan, provincia de Guangdong, China, que es una zona remota y subdesarrollada con una población permanente de aproximadamente 400 habitantes y un nivel educativo limitado. Nuestros resultados demuestran que la tecnología de detección rápida del antígeno de H. pylori en heces diseñada aquí puede completarse en 20 minutos. Se destaca que la detección rápida del antígeno de H. pylori en las heces es una herramienta potencial y prometedora para el diagnóstico rápido y confiable de la infección por H. pylori en áreas remotas y atrasadas.
Protocolo
Este estudio transversal ha sido aprobado por el Comité de Ética del Hospital Popular Provincial de Guangdong (Número de aprobación: KY2024-445-01), y los datos personales de todos los sujetos del estudio fueron estrictamente confidenciales durante el estudio. Todos los participantes firmaron un consentimiento informado por escrito antes de los experimentos. Los residentes de la aldea de Shitan en la ciudad de Qingyuan, provincia de Guangdong, en 2024 fueron seleccionados como sujetos de investigación, y no hubo restricciones de edad y sexo. El ensayo sándwich de doble anticuerpo (un experimento cualitativo) que se describe a continuación fue realizado por personal médico y técnico profesional de acuerdo con las instrucciones. Para este estudio se seleccionó a toda la población permanente de la aldea, independientemente de si estaban sanos o tenían síntomas o alguna enfermedad existente relacionada con enfermedades gastrointestinales.
1. Selección de pacientes
- Excluir a los pacientes que hayan usado inhibidores de la bomba de protones o bismuto, bloqueadores de los receptoresH2 o antibióticos en el último 1 mes.
- Pida a todos los participantes que rellenen el cuestionario de forma anónima. El contenido del cuestionario incluye cinco preguntas: ¿Comes tres comidas regularmente? ¿Bebes alcohol? ¿Conoces el H. pylori? ¿Cree que es necesario realizar una inspección de H. pylori ? ¿Comprende las consecuencias adversas de la infección por H. pylori ?
2. Procedimiento para la detección del antígeno de infección fecal por H. pylori
NOTA: El algoritmo para la prueba de antígeno en heces de H. pylori fue diseñado para garantizar la precisión y confiabilidad de los resultados, teniendo en cuenta la simplicidad y la higiene. Todo el proceso se divide en cinco pasos: recolección de muestras, procesamiento de muestras, almacenamiento de muestras, detección e interpretación de resultados. El diagrama de flujo de trabajo y el diagrama esquemático de detección de muestras se muestran en la Figura 1 y la Figura 2.
- Recogida de muestras
NOTA: Para la recolección de muestras se deben utilizar recipientes específicos para el antígeno de H. pylori . Las muestras no deben mezclarse con agua, orina, desinfectantes y aguas residuales.- Una vez finalizada la defecación, retire la tapa superior del recipiente especial para sacar la varilla de muestreo.
- Inserte la varilla de muestreo continuamente en cinco posiciones diferentes del taburete para el muestreo, asegurándose de que el extremo roscado de la varilla de muestreo esté completamente insertado en el taburete.
- Vuelva a insertar la varilla de muestreo en el tubo de reactivo una vez completado el muestreo; El volumen de la muestra es de ~5-50 mg en total.
- Procesamiento de muestras
- Agite el tubo de reactivo de lado a lado durante ~10 s para mezclar bien la muestra de heces en el diluyente (ingredientes principales: ácido etilendiamérico, ácido tetraacético, hidrato tetrasódico 0,018 g/mL y cloruro sódico 0,01 g/mL).
- Almacenamiento de muestras
- Analice las muestras tan pronto como sea posible después de la toma de muestras; almacenarlos a temperatura ambiente durante no más de 6 h y en condiciones refrigeradas (no más de 72 h a 2-8 °C y no más de 6 meses congelados a -25 °C a -15 °C) si es necesario para ralentizar la degradación de antígenos y la actividad microbiana.
NOTA: Las muestras se pueden congelar y descongelar repetidamente hasta 3 veces, y tanto las muestras refrigeradas como las congeladas deben devolverse a temperatura ambiente antes de la prueba.
- Analice las muestras tan pronto como sea posible después de la toma de muestras; almacenarlos a temperatura ambiente durante no más de 6 h y en condiciones refrigeradas (no más de 72 h a 2-8 °C y no más de 6 meses congelados a -25 °C a -15 °C) si es necesario para ralentizar la degradación de antígenos y la actividad microbiana.
- Detección de muestras
- Abra la tapa blanca de la tapa del tubo de reactivo y mantenga el tubo de reactivo erecto.
- Presione la tapa hasta el punto más bajo para que la muestra fluya en la tarjeta de prueba, pasando por el área de detección (T) y el área de control de calidad (C) recubierta con el anticuerpo anti-Hp del ratón.
- Interpretación de los resultados
- Espere de 10 a 20 minutos para que cualquier antígeno de H. pylori en la muestra, si se une al anticuerpo, forme una reacción cromogénica macroscópica en el área de detección. Por lo general, aparece como una línea roja o morada que contrasta con la línea en el área de control de calidad.
- La presencia o ausencia de la reacción de color y la profundidad del color están relacionadas con la concentración de antígeno de H. pylori en la muestra. Compare las tarjetas de colores para interpretar los resultados de forma rápida y precisa (consulte la Figura 3).
3. Extracción de ADN
- Coloque una cantidad adecuada de heces en un tubo de ensayo, agregue la solución de PBS y mezcle bien agitando. Centrifugar la mezcla a 12.000 × g durante 5-10 min, luego recoger cuidadosamente 200 μL del sobrenadante para su posterior extracción.
- En función del número de muestras, prepare un número igual de tubos de centrífuga de 1,5 mL. A cada tubo, añadir secuencialmente 20 μL de proteinasa K (20 mg/mL), 10 μL de perlas magnéticas, 200 μL del sobrenadante de la muestra y 200 μL de tampón de lisis A. Mezclar bien invirtiendo los tubos, luego incubar en un baño metálico a 55 °C durante 10 min.
- Una vez completada la pirólisis, coloque el tubo de centrífuga en el marco magnético, déjelo reposar y permita que se produzca la adsorción durante 1 minuto en las perlas. Después de que el líquido en el tubo esté completamente clarificado, deseche el sobrenadante y trate de evitar perturbar las perlas magnéticas.
- Retire los tubos de la gradilla magnética y colóquelos en una gradilla de tubos de centrífuga de 1,5 ml. Con una pipeta, agregue 500 μL de tampón de lavado E a cada tubo, mezcle bien durante 1 minuto y luego vuelva a colocar los tubos en la rejilla magnética. Deje reposar los tubos durante 1 minuto, deseche el sobrenadante después de la clarificación y evite aspirar las perlas magnéticas.
- Repita el proceso de lavado añadiendo 500 μL de tampón de lavado W2 a cada tubo. Mezcle bien durante 1 minuto, coloque los tubos en la rejilla magnética y déjelos reposar durante 1 minuto. Deseche el sobrenadante con cuidado después de que la solución se aclare, asegurándose de que las perlas magnéticas permanezcan intactas.
- Añadir 100 μL de eluyente, mezclar e incubar a 55 °C durante 5 min.
- Coloque los tubos en la rejilla magnética y déjelos reposar durante 2 minutos. Una vez que la solución se clarifique, transfiera cuidadosamente el ácido nucleico eluido a un nuevo tubo de centrífuga, evitando la aspiración de las perlas magnéticas.
- Evalúe la pureza del ADN extraído midiendo la absorbancia a 260 nm (A260) y 280 nm (A280). Calcule la relación A260/A280 , que idealmente debería ser superior a 1,8 para el ADN de alta pureza.
4. qPCR para la detección de H. pylori y resistencia a antibióticos
NOTA: Realizamos qPCR para la detección de infección por H. pylori mediante la amplificación del gen ureA . Todos los productos de control de calidad negativos son estériles, agua purificada. El producto de control de calidad positivo en el kit de detección de ácido nucleico de H. pylori son perlas estándar de H. pylori inactivadas (ATCC 43504). Un CT ≤ 30 con una curva típica en forma de S se considera positivo.
- De acuerdo con la cantidad de muestras a analizar, saque la preparación liofilizada de H. pylori del kit y gírela rápidamente para mantener el polvo liofilizado en el fondo del tubo.
- Abra con cuidado la tapa de la preparación liofilizada; tomar el ácido nucleico de la muestra que se va a analizar; añadir 25 μL del ácido nucleico de la muestra en el preparado liofilizado; y cubra bien el tubo.
- Agite y mezcle el reactivo de PCR de manera uniforme durante 8-10 s y, a continuación, gírelo rápidamente durante 3-5 s.
- Para cada muestra en una placa de 32 pocillos, prepare 25 μL de la mezcla de reacción de PCR (polvo liofilizado [que contiene la enzima Taq (5 U/μL), trifosfato de desoxirribonucleósido (2,5 mmol/L), enzima UNG (2 U/μL), ureA adelante (5'-ACATTGCGAGCGGGACAG-3') y reverso (5'-CGCCCAATCTCACTTTATCG-3') (40 μmol/L)]), y 25 μL (2,5 μg) del ADN extraído.
- Ejecute la placa qPCR de 32 pocillos en la máquina qPCR. Programe el termociclador: 42 °C y 95 °C (ambos para un ciclo) durante 2 min cada uno; 95 °C durante 10 s y 65 °C durante 45 s (dos pasos son un ciclo) durante 10x; 95 °C durante 10 s y a 58 °C durante 45 s (dos pasos son un ciclo) durante 35 ciclos.
- Analice los datos utilizando un software específico para qPCR y deje que el instrumento seleccione automáticamente los umbrales de referencia.
5. Análisis estadístico
- Utilice la prueba de chi-cuadrado para analizar los datos experimentales y evaluar la consistencia entre este método y los resultados de la qPCR y comparar la tasa de positividad de esta tecnología de detección con los datos de tasa positiva de la infección por H. pylori a una escala más amplia (p. ej., a nivel nacional). Considere las diferencias estadísticamente significativas a P < 0.05.
Resultados
Encuesta por cuestionario
Un total de 261 participantes se inscribieron en el estudio, de los cuales 144 eran mujeres y 117 hombres, con edades comprendidas entre los 4 y los 99 años. La edad media de los sujetos fue de 48,30 ± 17,61 años. Participaron 17 menores (0-17 años), 202 adultos (18-64 años) y 42 ancianos (>64 años). Los resultados del cuestionario se muestran en la Tabla 1. La mayoría (90,8%) de los sujetos consideró necesario realizar el cribado de H. pylori .
Resultados del cribado de la detección fecal del antígeno H. pylori en esta aldea
De los 261 participantes a los que se les realizó la prueba del antígeno fecal de H. pylori , 52 (19,92%) fueron positivos, mientras que 209 fueron negativos. De los 52 casos positivos, 32 eran mujeres, lo que representa el 22,22% de todas las mujeres, y 20 hombres, lo que representa el 17,09% de todos los hombres. Al estratificar por edad, las tasas de positividad fueron las siguientes: los menores (0-17 años) tuvieron 2 casos positivos (11,76%), los adultos (18-64 años) tuvieron 41 casos positivos (20,30%) y los ancianos (>64 años) tuvieron 9 casos positivos (21,43%).
Comparación de la consistencia entre el antígeno fecal de H. pylori y los resultados de qPCR
En este estudio, se seleccionaron dos muestras con diferentes resultados de la prueba qPCR para caracterizar la fiabilidad del protocolo experimental (Figura 4). Entre los resultados fecales de antígeno de H. pylori de 261 sujetos, 52 fueron positivos y 209 negativos. Entre los resultados de la qPCR con las heces de 261 sujetos, 83 fueron positivos y 178 negativos (Tabla 2). La sensibilidad y especificidad de la detección del antígeno fecal de H. pylori fueron de 60,24% y 80,08%, respectivamente. El valor predictivo positivo (VPP) de este método fue del 96,15% y el valor predictivo negativo (VPN) del 84,21%. La prueba de consistencia Kappa indica que los resultados del diagnóstico de los dos métodos son consistentes (Kappa = 0,630, P < 0,05).
Comparación de la tasa de positividad del cribado entre esta aldea natural y todo el país
La tasa de positividad fue de 19,92%, ligeramente inferior a la tasa nacional de positividad de 42,8%14 (Tabla 3). De acuerdo con la prueba de chi-cuadrado (P < 0,01), la diferencia en las tasas de positividad fue estadísticamente significativa.

Figura 1: Diagrama de flujo de la detección de muestras. Haga clic aquí para ver una versión más grande de esta figura.
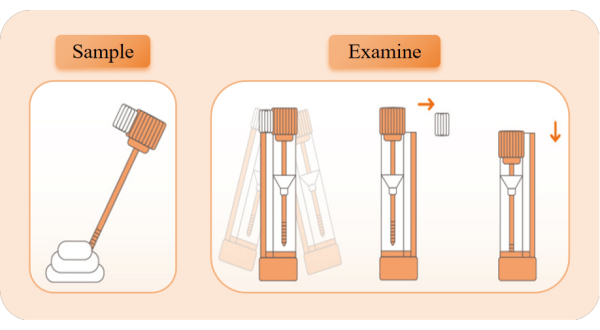
Figura 2: Diagrama esquemático de recolección y detección de muestras. Saque el dispositivo de detección, abra la bolsa de papel de aluminio y saque el tubo de reactivo. Retire la tapa del tubo naranja y use la varilla de muestreo para tomar muestras 5 veces de diferentes posiciones de las heces. Vuelva a insertar la varilla de muestreo en el tubo de reactivo y agítela de izquierda a derecha durante 10 segundos para que se mezcle completamente. Rompa el bloque de límite blanco, mantenga el tubo de reactivo en posición vertical y presione la tapa del tubo hasta la posición más baja para comenzar a cronometrar. Observa la apariencia de bandas rojas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Interpretación de los resultados de antígenos. (A) Muestreador. (B,E) Negativo (-): Un resultado negativo indica que no se ha detectado antígeno de H. pylori en la muestra, lo que sugiere que el riesgo de infección por H. pylori es bajo. Un resultado negativo no puede descartar por completo la posibilidad de infección. (C,F) Positivo (+): Un resultado positivo significa que se detecta antígeno de H. pylori en la muestra, se sospecha de infección por H. pylori . (D) Sin efecto: Los resultados no válidos pueden ser un problema con el proceso de recolección o manipulación de muestras, o el reactivo se ha deteriorado y dañado, y la muestra debe recogerse nuevamente o se deben repetir los pasos de la operación. Haga clic aquí para ver una versión más grande de esta figura.
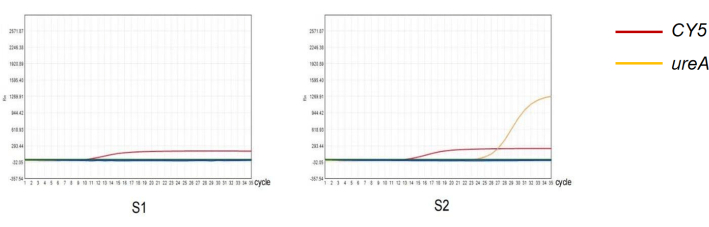
Figura 4: Detección de H. pylori en heces por el método qPCR. (S1) Resultado negativo de la amplificación cuantitativa por PCR de la infección por H. pylori . (S2) Resultado positivo de la amplificación cuantitativa por PCR de la infección por H. pylori . Haga clic aquí para ver una versión más grande de esta figura.
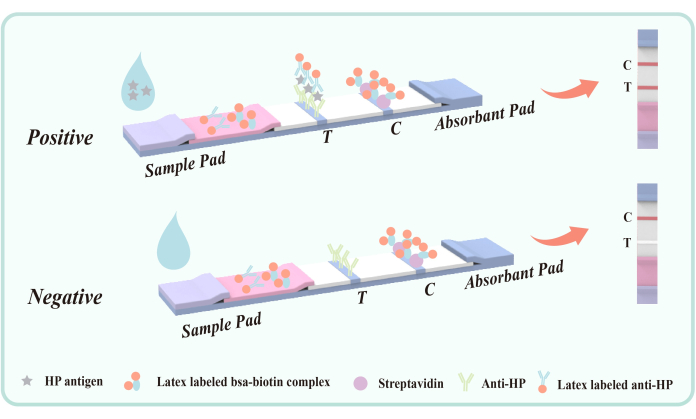
Figura 5: Diagrama esquemático del método de sándwich de doble anticuerpo para la detección de antígeno fecal infectado con H. pylori. El anticuerpo anti-Hp de ratón (epítopo VacA) se fijó de antemano en el área de detección (T) de la membrana. El área de control de calidad (C) fija de antemano la IgG anti-ratón y la estreptavidina de las cabras. La película de poliéster se recubrió con un anticuerpo anti-Hp de ratón marcado con látex y un conjugado de látex-BSA-biotina. Haga clic aquí para ver una versión más grande de esta figura.
| ¿Comer regularmente en tres comidas? | ¿Si beber alcohol? | ¿Conoces H. pylori? | ¿Es necesario realizar una inspección de H. pylori ? | ¿Comprende las consecuencias adversas de la infección por H. pylori ? | |
| Sí (tarifa) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| No (tarifa) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
Tabla 1: Resultados del cuestionario.
| Antígeno de H. pylori | Total | |||
| Positivas (+) | Negativo (-) | |||
| qPCR | Positivas (+) | 50 | 33 | 83 |
| Negativo (-) | 2 | 176 | 178 | |
| Total | 52 | 209 | 261 | |
Tabla 2: Resultados diagnósticos de dos técnicas.
| Positivo | Negativo | Tasa de positividad | Total | |
| Aldea de Shitan | 52 | 209 | 19.92% | 261 |
| China | 314423 | 449404 | 42.80% | 763827 |
Tabla 3: Comparación de las tasas de positividad de las pruebas de detección de H. pylori entre la aldea de Shitan y el promedio nacional.
Discusión
H. pylori representa una de las infecciones bacterianas más extendidas en todo el mundo15. Los resultados del cuestionario revelaron que el 55,2% de la población desconocía la existencia de H. pylori, mientras que el 90,8% creía que el cribado de H. pylori era necesario. Estos hallazgos subrayan la importancia de implementar programas de tamizaje de H. pylori en áreas económicamente desfavorecidas y remotas16. A pesar de que la prueba de aliento con urea (UBT) es un método diagnóstico común, su alto costo e inadecuación para niños y mujeres embarazadas limitan su aplicabilidad17,18. La prueba de anticuerpos séricos contra H. pylori puede detectar anticuerpos en el suero de un paciente19. Sin embargo, esta prueba no es adecuada para el análisis posterior al tratamiento, ya que los anticuerpos permanecen mucho tiempo después de que las bacterias se hayan eliminado20. Por el contrario, las pruebas de antígenos en heces ofrecen un enfoque no invasivo que elimina la necesidad de acceder a la cavidad gástrica, requiriendo solo muestras de heces para su análisis. Este método reduce significativamente la incomodidad del paciente y los riesgos potenciales, lo que lo hace más conveniente tanto para la detección como para el seguimiento. Además, su naturaleza no invasiva lo hace más aceptable para las poblaciones de regiones remotas y subdesarrolladas.
La prevalencia de pacientes positivos para H. pylori en nuestra población de estudio es del 19,92%, ligeramente inferior a la tasa nacional de positividad del 42,8%14. De acuerdo con la prueba de chi-cuadrado (P < 0,01), hubo significación estadística entre ellos. La razón de esta diferencia puede ser que la tasa de infección por H. pylori en poblaciones urbanas de siete regiones geográficas de China tiene una diferenciación regional obvia21. La tasa de infección es más alta en el este de China, más alta en el noreste de China, el norte de China y el noroeste de China, y más baja en el sur de China y el suroeste de China21. El área que examinamos pertenece al sur de China y la tasa de infección es más baja que el nivel nacional. Por otro lado, el funcionamiento no estándar en el proceso de muestreo de muestras fecales individuales y el largo tiempo para enviar para su análisis también pueden ser las razones de esta diferencia. A pesar de que la PCR y sus derivados son ampliamente empleados para la detección de diversos patógenos, incluyendo H. pylori, su utilidad está limitada por la complejidad y el costo de los equipos termocicladores y la necesidad de operadores especializados22,23. En este estudio, en comparación con los resultados de la qPCR, la sensibilidad y especificidad de la detección del antígeno de H. pylori en heces fue del 60,24% y del 80,08%. Se comparó la consistencia del antígeno de H. pylori en heces y los resultados de la qPCR, y los resultados sugirieron que fueron moderadamente consistentes (Kappa = 0,630, P < 0,05). Las razones de su sensibilidad insatisfactoria pueden estar influenciadas por la recolección irregular de la muestra, la temperatura de almacenamiento de la muestra y el tiempo de entrega.
El método de sándwich de doble anticuerpo para la detección de antígeno fecal por infección por H. pylori es una tecnología de detección inmunológica eficiente y específica. El núcleo de este método es aprovechar la capacidad de unión específica de los anticuerpos y garantizar una identificación y cuantificación precisas de los antígenos objetivo a través de un ingenioso sistema de detección. En concreto, este enfoque implica dos pasos clave: la captura de antígenos y la detección de anticuerpos. El diagrama esquemático de esta tecnología se muestra en la Figura 5.
El anticuerpo anti-Hp de ratón recubierto en la región de detección de la membrana de poliéster (T) se dirige al epítopo VacA de H. pylori para lograr la captura específica del antígeno de H. pylori en las heces. El antígeno VacA es una exotoxina importante de H. pylori, estrechamente asociada con la infección. Los anticuerpos dirigidos a VacA pueden identificar y unirse eficazmente al antígeno, formando un complejo antígeno-anticuerpo. Por lo tanto, este método no es fácil de reaccionar de forma cruzada con otras enfermedades o dolencias gastrointestinales.
Durante la prueba, la muestra líquida ingresa al tanque de detección y migra hacia arriba a través de la acción capilar. Si la muestra contiene antígeno de H. pylori , primero forma un complejo antígeno-anticuerpo con el anticuerpo anti-H. pylori de ratón marcado con látex recubierto de la película de poliéster. A medida que el complejo fluye a través de la zona de detección (T), es capturado por el anticuerpo anti-H. pylori de ratón inmovilizado, lo que da como resultado una banda roja visible en la zona de detección (T), lo que indica un resultado positivo. Si no hay antígeno de H. pylori en la muestra, no se forma un complejo sándwich de doble anticuerpo en la zona de detección (T) y, en consecuencia, no aparece una banda roja que indique un resultado negativo. Independientemente de la presencia o ausencia de antígeno de H. pylori , el conjugado látex-BSA-biotina se unirá a la estreptavidina inmovilizada en la membrana durante la cromatografía, produciendo una banda roja en la zona de control de calidad (C). Esta banda roja sirve como indicador del proceso cromatográfico adecuado y como estándar de control interno para el reactivo.
El método de sándwich de doble anticuerpo realiza la captura eficiente y la detección cualitativa del antígeno de H. pylori en las heces mediante anticuerpos y marcadores cuidadosamente diseñados. Su simplicidad, rapidez y alta especificidad proporcionan un soporte técnico fiable para el diagnóstico asistente de la infección por H. pylori . La aplicación generalizada de esta tecnología no solo reduce los costos médicos y mejora la eficiencia de las pruebas de detección, sino que también brinda a los pacientes una experiencia de prueba más cómoda y conveniente. Este avance tiene una importancia significativa para la prevención y el control mundial de la infección por H. pylori .
Además, la higiene de las pruebas de antígenos en heces es una consideración crítica. Este método requiere muestras fecales frescas, que pueden ser formadas o no formadas, sin restricciones específicas en el tiempo de recolección. Durante la recolección de muestras, es esencial evitar la contaminación con agua, orina, desinfectantes o aguas residuales. Las muestras fecales deben recogerse en recipientes limpios y secos, libres de conservantes y detergentes. Si es necesario almacenarlas, las muestras pueden conservarse a temperatura ambiente durante no más de 6 horas o a 2-8 °C durante un máximo de 72 horas. Las muestras refrigeradas deben volver a estar a temperatura ambiente antes de la prueba para garantizar resultados precisos. La alta eficiencia del tiempo también es una característica importante de la detección de antígenos de infección por H. pylori en heces. El ensayo sándwich de doble anticuerpo a base de látex puede proporcionar resultados en 10-20 minutos en comparación con los métodos tradicionales que requieren esperar los resultados de laboratorio, lo cual es importante para el reconocimiento de infecciones agudas y decisiones de tratamiento temprano en áreas remotas y atrasadas.
En resumen, la detección de antígenos de H. pylori en heces ofrece numerosas ventajas metodológicas, como la no invasividad, la simplicidad, la higiene, la alta eficiencia y la amplia aplicabilidad. Estas características hacen de este método una herramienta valiosa para la práctica clínica y proporcionan conocimientos innovadores para el desarrollo futuro de las tecnologías diagnósticas. En regiones subdesarrolladas con condiciones sanitarias limitadas, este enfoque está llamado a desempeñar un papel fundamental en el diagnóstico y tratamiento de la infección por H. pylori .
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
Referencias
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados