Method Article
Detecção rápida de antígeno fecal da infecção por Helicobacter pylori com base na tecnologia de detecção de sanduíche de anticorpo duplo
Neste Artigo
Resumo
Neste estudo, uma técnica de detecção em sanduíche baseada em anticorpos duplos foi desenvolvida para detecção rápida de antígenos fecais infectados com Helicobacter pylori.
Resumo
O Helicobacter pylori pode ser parasitário na mucosa gástrica, o que pode causar uma série de doenças gastrointestinais após a infecção e está intimamente relacionado à gastrite, úlcera gástrica e câncer gástrico. A alta prevalência da infecção por H. pylori em regiões com infraestrutura médica precária e áreas de saneamento inadequadas continua sendo uma preocupação significativa de saúde pública. Consequentemente, o desenvolvimento de métodos de triagem rápidos, simples e econômicos para a detecção de H. pylori em ambientes com recursos limitados é de suma importância.
Neste estudo, realizamos uma triagem comunitária na vila de Shitan, província de Guangdong, uma área remota e subdesenvolvida caracterizada por uma população permanente de aproximadamente 300 residentes com baixo nível educacional. Empregamos um ensaio sanduíche de anticorpos duplos para a detecção do antígeno fecal de H. pylori , um método escolhido por sua potencial aplicabilidade em ambientes de poucos recursos. Um total de 261 participantes da aldeia foram inscritos e suas amostras fecais foram analisadas usando esta técnica. Para validação comparativa, as mesmas amostras foram submetidas à análise quantitativa de reação em cadeia da polimerase (qPCR). Em comparação com os resultados da qPCR, a sensibilidade e a especificidade da detecção do antígeno H . pylori nas fezes foram de 60,24% e 80,08%. Os resultados demonstraram uma forte concordância entre o método de detecção de antígeno fecal e qPCR (Kappa = 0,630). Este estudo elucidou sistematicamente os princípios, procedimentos, metodologias e aplicações clínicas da detecção de antígenos fecais para infecção por H. pylori , com o objetivo de explorar a tecnologia de sanduíche de anticorpos duplos à base de látex e estabelecer novas estratégias e diretrizes práticas para seu diagnóstico auxiliar.
Introdução
Helicobacter pylori (H. pylori, Hp) é uma bactéria gram-negativa microaerofílica, em forma de espiral,1. Devido à sua capacidade de colonizar e infectar cronicamente o estômago humano2, esse patógeno tem sido identificado como um importante fator etiológico no desenvolvimento do adenocarcinoma gástrico 3,4. Em 2015, ~ 4,4 bilhões de pessoas no mundo sofreram de infecção por H. pylori 5. A prevalência da infecção por H. pylori exibe considerável variação geográfica, com os países em desenvolvimento experimentando taxas significativamente mais altas em comparação com as nações desenvolvidas. Notavelmente, em países de baixa renda e entre certas populações vulneráveis, a taxa de infecção pode chegar a 75%6.
Embora os métodos tradicionais de detecção, como a gastroscopia, sejam precisos, sua aplicação na triagem em larga escala e no acompanhamento de rotina é limitada devido à sua invasividade, alto custo e baixa aceitação do paciente7. Portanto, a busca por métodos diagnósticos não invasivos, simples e rápidos tornou-se uma direção importante da pesquisa em medicina clínica moderna. O principal objetivo de um diagnóstico não invasivo de H. pylori é detectar com precisão, segurança e conveniência se o paciente está infectado com H. pylori sem exame endoscópico. O teste respiratório da uréia (UBT), o teste do antígeno fecal (FAT) de H. pylori8 e o teste sorológico9 são técnicas não invasivas populares.
Dentre estes, o UBT é o procedimento menos intrusivo e mais preciso disponível10. A sensibilidade e a especificidade do UBT são superiores a 95%11. Dentre os métodos diagnósticos não invasivos disponíveis, o UBT tem se mostrado o mais preciso e confiável, como visto em um estudo de validação realizado no Iraque, o UBT pode ser recomendado como primeira escolha devido ao seu maior desempenho em comparação com outros métodos12. No entanto, a UBT também tem suas desvantagens, como seu alto custo e necessidade de análise espectrométrica de massa, o que limita a aplicação em ambientes remotos ou com recursos limitados13.
O desenvolvimento de um método de diagnóstico rápido, não invasivo e econômico para detectar a infecção por H. pylori é extremamente necessário, particularmente em regiões com recursos limitados. Neste estudo, desenvolvemos uma tecnologia de detecção rápida para antígeno fecal de H. pylori baseada na tecnologia de detecção de sanduíche de anticorpo duplo, que pode detectar o antígeno de H. pylori em amostras fecais de forma rápida, eficaz e de baixo custo. Essa tecnologia oferece vantagens significativas, incluindo acessibilidade, não invasividade, facilidade de uso e adaptabilidade a áreas remotas. Nossa hipótese é que o método sanduíche de anticorpos duplos para detectar o antígeno fecal de H. pylori demonstrará sensibilidade e especificidade comparáveis à qPCR, posicionando-o como uma ferramenta viável para o diagnóstico clínico não invasivo.
Detalhamos de forma abrangente os princípios, procedimentos, pontos fortes metodológicos e aplicabilidade clínica da detecção de antígeno fecal para infecção por H. pylori . Para validar sua praticidade, realizamos uma investigação epidemiológica e triagem na vila de Shitan, cidade de Qingyuan, província de Guangdong, China, que é uma área remota e subdesenvolvida com uma população permanente de aproximadamente 400 e escolaridade limitada. Nossos resultados demonstram que a tecnologia de detecção rápida do antígeno de H. pylori em fezes projetada aqui pode ser concluída em 20 minutos. Destaca-se que a detecção rápida do antígeno H . pylori nas fezes é uma ferramenta potencial e promissora para o diagnóstico rápido e confiável da infecção por H. pylori em áreas remotas e atrasadas.
Protocolo
Este estudo transversal foi aprovado pelo Comitê de Ética do Hospital Popular da Província de Guangdong (Número de aprovação: KY2024-445-01), e os dados pessoais de todos os sujeitos do estudo foram estritamente confidenciais durante o estudo. Todos os participantes assinaram o termo de consentimento livre e esclarecido antes dos experimentos. Os residentes da vila de Shitan na cidade de Qingyuan, província de Guangdong, em 2024, foram selecionados como sujeitos da pesquisa, e não houve restrições de idade e sexo. O ensaio sanduíche de anticorpos duplos (um experimento qualitativo) descrito abaixo foi realizado por pessoal médico e técnico profissional de acordo com as instruções. Toda a população permanente da aldeia foi selecionada para este estudo, independentemente de ser saudável ou apresentar sintomas ou quaisquer doenças existentes relacionadas a doenças gastrointestinais.
1. Seleção de pacientes
- Exclua pacientes se eles usaram inibidores da bomba de prótons ou bismuto, bloqueadores do receptor H2 ou antibióticos no 1 mês anterior.
- Peça a todos os participantes que preencham o questionário anonimamente. O conteúdo do questionário inclui cinco perguntas: Você faz três refeições regularmente? Você bebe álcool? Você conhece o H. pylori? Você acha que é necessário realizar a inspeção do H. pylori ? Você entende as consequências adversas da infecção por H. pylori ?
2. Procedimento para detecção do antígeno de infecção fecal por H. pylori
NOTA: O algoritmo para teste de antígeno fecal de H. pylori foi projetado para garantir a precisão e confiabilidade dos resultados, levando em consideração a simplicidade e a higiene. Todo o processo é dividido em cinco etapas: coleta de amostras, processamento de amostras, armazenamento de amostras, detecção e interpretação de resultados. O fluxograma de trabalho e o diagrama esquemático de detecção de amostras são mostrados na Figura 1 e na Figura 2.
- Coleta de amostras
NOTA: Recipientes específicos para antígenos de H. pylori devem ser usados para coleta de amostras. As amostras não devem ser misturadas com água, urina, desinfetantes e esgoto.- Após a conclusão da defecação, remova a tampa superior do recipiente especial para retirar a haste de amostragem.
- Insira a haste de amostragem continuamente em cinco posições diferentes do banquinho para amostragem, certificando-se de que a extremidade rosqueada do bastão de amostragem esteja completamente inserida no banquinho.
- Insira a haste de amostragem de volta no tubo reagente após a conclusão da amostragem; O volume da amostra é de ~ 5-50 mg no total.
- Processamento de amostras
- Agite o tubo reagente de um lado para o outro por ~ 10 s para misturar completamente a amostra de fezes no diluente (ingredientes principais: ácido etilenodiaminotetracético tetrassódico hidratado 0,018 g / mL e cloreto de sódio 0,01 g / mL).
- Armazenamento de amostras
- Testar as amostras o mais rapidamente possível após a amostragem; armazene-os à temperatura ambiente por no máximo 6 h e em condições refrigeradas (não mais de 72 h a 2-8 °C e não mais de 6 meses congelados a -25 °C a -15 °C), se necessário, para retardar a degradação do antígeno e a atividade microbiana.
NOTA: As amostras podem ser repetidamente congeladas e descongeladas até 3x, e as amostras refrigeradas e congeladas devem ser devolvidas à temperatura ambiente antes do teste.
- Testar as amostras o mais rapidamente possível após a amostragem; armazene-os à temperatura ambiente por no máximo 6 h e em condições refrigeradas (não mais de 72 h a 2-8 °C e não mais de 6 meses congelados a -25 °C a -15 °C), se necessário, para retardar a degradação do antígeno e a atividade microbiana.
- Detecção de amostra
- Abra a tampa branca na tampa do tubo reagente e mantenha o tubo reagente ereto.
- Pressione a tampa até o ponto mais baixo para que a amostra flua no cartão de teste, passando pela área de detecção (T) e área de controle de qualidade (C) revestida com o anticorpo anti-Hp de camundongo.
- Interpretação dos resultados
- Aguarde 10-20 minutos para que qualquer antígeno de H. pylori na amostra, se ligado ao anticorpo, forme uma reação cromogênica macroscópica na área de detecção. Isso geralmente aparece como uma linha vermelha ou roxa que contrasta com a linha na área de controle de qualidade.
- A presença ou ausência da reação de cor e a profundidade da cor estão relacionadas à concentração do antígeno de H. pylori na amostra. Compare as placas de cores para interpretar os resultados com rapidez e precisão (consulte a Figura 3).
3. Extração de DNA
- Coloque uma quantidade adequada de fezes em um tubo de ensaio, adicione a solução de PBS e misture bem agitando. Centrifugue a mistura a 12.000 × g por 5-10 min e, em seguida, colete cuidadosamente 200 μL do sobrenadante para extração posterior.
- Com base no número de amostras, prepare um número igual de tubos de centrífuga de 1,5 mL. A cada tubo, adicione sequencialmente 20 μL de proteinase K (20 mg / mL), 10 μL de esferas magnéticas, 200 μL do sobrenadante da amostra e 200 μL de tampão de lise A. Misture bem invertendo os tubos e, em seguida, incube em um banho de metal a 55 ° C por 10 min.
- Após a conclusão da pirólise, coloque o tubo da centrífuga na estrutura magnética, deixe-o repousar e deixe a adsorção ocorrer por 1 min nos grânulos. Depois que o líquido no tubo estiver completamente clarificado, descarte o sobrenadante e tente evitar perturbar as esferas magnéticas.
- Remova os tubos do rack magnético e coloque-os em um rack de tubo de centrífuga de 1.5 mL. Usando uma pipeta, adicione 500 μL de tampão de lavagem E a cada tubo, misture bem por 1 min e, em seguida, retorne os tubos ao rack magnético. Deixe os tubos repousarem por 1 min, descarte o sobrenadante após a clarificação e evite aspirar as esferas magnéticas.
- Repita o processo de lavagem adicionando 500 μL de tampão de lavagem W2 a cada tubo. Misture bem por 1 min, coloque os tubos no rack magnético e deixe-os repousar por 1 min. Descarte o sobrenadante cuidadosamente após a clarificação da solução, garantindo que as esferas magnéticas permaneçam intactas.
- Adicione 100 μL de eluente, misture e incube a 55 °C por 5 min.
- Coloque os tubos no rack magnético e deixe-os repousar por 2 min. Assim que a solução clarear, transfira cuidadosamente o ácido nucléico eluído para um novo tubo de centrífuga, evitando a aspiração dos grânulos magnéticos.
- Avaliar a pureza do ADN extraído medindo a absorvância a 260 nm (A260) e a 280 nm (A280). Calcule a proporção A260 / A280 , que idealmente deve ser maior que 1,8 para DNA de alta pureza.
4. qPCR para detecção de H. pylori e resistência a antibióticos
NOTA: Realizamos qPCR para a detecção da infecção por H. pylori por meio da amplificação do gene ureA . Todos os produtos de controle de qualidade negativa são água purificada e estéril. O produto de controle de qualidade positivo no kit de detecção de ácido nucleico de H. pylori são os grânulos padrão de H. pylori inativados (ATCC 43504). Um CT ≤ 30 com uma curva típica em forma de S é considerado positivo.
- De acordo com o número de amostras a serem testadas, retire a preparação liofilizada de H. pylori do kit e gire-a rapidamente para manter o pó liofilizado no fundo do tubo.
- Abra cuidadosamente a tampa da preparação liofilizada; Colher o ácido nucleico da amostra a ensaiar; adicionar 25 μL do ácido nucleico da amostra à preparação liofilizada; e cubra bem o tubo.
- Agite e misture o reagente de PCR uniformemente por 8-10 s e, em seguida, gire-o rapidamente por 3-5 s.
- Para cada amostra em uma placa de 32 poços, prepare 25 μL da mistura de reação de PCR (pó liofilizado [contendo a enzima Taq (5 U / μL), trifosfato de desoxirribonucleosídeo (2,5 mmol / L), enzima UNG (2 U / μL), ureA direto (5'-ACATTGCGAGCGGGACAG-3') e reverso (5'-CGCCCAATCTCACTTTATCG-3') primers (40 μmol / L)]) e 25 μL (2,5 μg) do DNA extraído.
- Execute a placa qPCR de 32 poços na máquina qPCR. Programe o termociclador: 42 °C e 95 °C (ambos para um ciclo) por 2 min cada; 95 °C por 10 s e 65 °C por 45 s (duas etapas são um ciclo) por 10x; 95 °C por 10 s e a 58 °C por 45 s (duas etapas são um ciclo) por 35 ciclos.
- Analise os dados usando um software específico para qPCR e deixe o instrumento selecionar automaticamente os limites da linha de base.
5. Análise estatística
- Use o teste qui-quadrado para analisar os dados experimentais para avaliar a consistência entre este método e os resultados de qPCR e compare a taxa positiva dessa triagem de tecnologia com os dados de taxa positiva de infecção por H. pylori em uma escala mais ampla (por exemplo, em todo o país). Considere as diferenças estatisticamente significativas em P < 0,05.
Resultados
Pesquisa por questionário
Um total de 261 participantes foram incluídos no estudo, sendo 144 do sexo feminino e 117 do sexo masculino, com idades variando de 4 a 99 anos. A média de idade dos sujeitos foi de 48,30 ± 17,61 anos. Havia 17 menores (0-17 anos), 202 adultos (18-64 anos) e 42 idosos (>64 anos). Os resultados do questionário são apresentados na Tabela 1. A maioria (90,8%) dos sujeitos achou necessário realizar a triagem de H. pylori .
Resultados da triagem da detecção do antígeno fecal de H. pylori nesta aldeia
Entre os 261 participantes testados para antígeno fecal de H. pylori , 52 (19,92%) foram positivos, enquanto 209 foram negativos. Dos 52 casos positivos, 32 eram do sexo feminino, representando 22,22% do total de participantes do sexo feminino, e 20 do sexo masculino, representando 17,09% do total de participantes do sexo masculino. Quando estratificadas por idade, as taxas de positividade foram as seguintes: menores (0-17 anos) tiveram 2 casos positivos (11,76%), adultos (18-64 anos) tiveram 41 casos positivos (20,30%) e idosos (>64 anos) tiveram 9 casos positivos (21,43%).
Comparação da consistência entre o antígeno fecal de H. pylori e os resultados de qPCR
Neste estudo, duas amostras com diferentes resultados do teste de qPCR foram selecionadas para caracterizar a confiabilidade do protocolo experimental (Figura 4). Entre os resultados do antígeno fecal de H. pylori de 261 indivíduos, 52 foram positivos e 209 foram negativos. Entre os resultados da qPCR com as fezes de 261 indivíduos, 83 foram positivos e 178 negativos (Tabela 2). A sensibilidade e especificidade da detecção do antígeno fecal de H. pylori foram de 60,24% e 80,08%, respectivamente. O valor preditivo positivo (VPP) desse método foi de 96,15% e o valor preditivo negativo (VPN) foi de 84,21%. O teste de consistência Kappa indica que os resultados diagnósticos dos dois métodos são consistentes (Kappa = 0,630, P < 0,05).
Comparação da taxa de triagem positiva entre esta aldeia natural e todo o país
A taxa positiva foi de 19,92%, ligeiramente inferior à taxa positiva nacional de 42,8%14 (Tabela 3). De acordo com o teste do qui-quadrado (P < 0,01), a diferença nas taxas de positividade foi estatisticamente significativa.

Figura 1: Fluxograma de detecção de amostra. Clique aqui para ver uma versão maior desta figura.
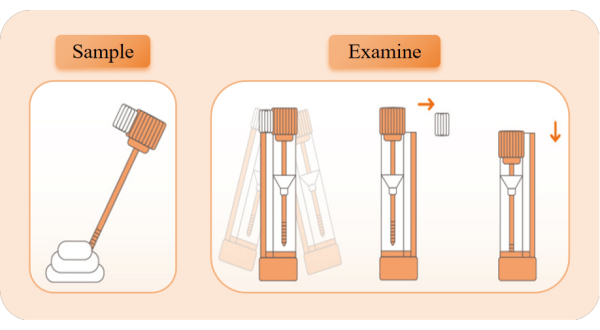
Figura 2: O diagrama esquemático de coleta e detecção de amostras. Retire o dispositivo de detecção, abra o saco de papel alumínio e retire o tubo de reagente. Retire a tampa do tubo laranja e use o bastão de amostragem para coletar amostras 5x de diferentes posições das fezes. Insira a haste de amostragem de volta no tubo de reagente e agite-a para a esquerda e para a direita por 10 s para misturar completamente. Quebre o bloco de limite branco, mantenha o tubo de reagente na posição vertical e pressione a tampa do tubo para a posição mais baixa para iniciar o tempo. Observe o aparecimento de faixas vermelhas. Clique aqui para ver uma versão maior desta figura.

Figura 3: Interpretação dos resultados do antígeno. (A) Amostrador. (B, E) Negativo (-): Um resultado negativo indica que não há antígeno de H. pylori detectado na amostra, sugerindo que o risco de infecção por H. pylori é baixo. Um resultado negativo não pode descartar completamente a possibilidade de infecção. (C, F) Positivo (+): Um resultado positivo significa que o antígeno do H. pylori foi detectado na amostra, suspeita-se de infecção por H. pylori . (D) Sem efeito: Resultados inválidos podem ser um problema com o processo de coleta ou manuseio de amostras, ou o reagente se deteriorou e danificou, e a amostra deve ser coletada novamente ou as etapas da operação devem ser repetidas. Clique aqui para ver uma versão maior desta figura.
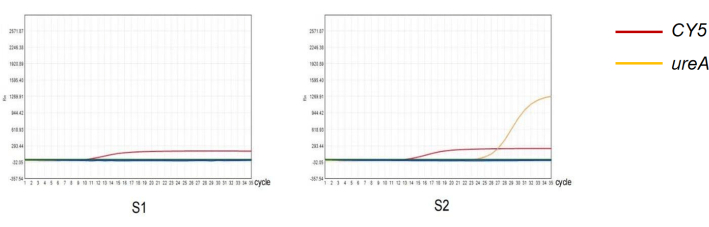
Figura 4: Detecção de H. pylori em fezes pelo método qPCR. (S1) Resultado negativo da amplificação quantitativa por PCR da infecção por H. pylori . (S2) Resultado positivo da amplificação quantitativa por PCR da infecção por H. pylori . Clique aqui para ver uma versão maior desta figura.
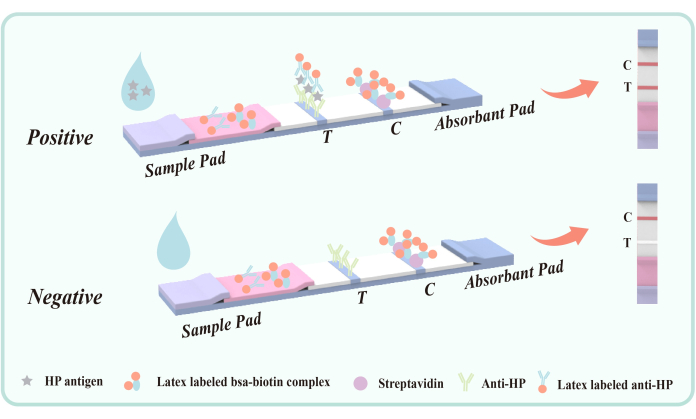
Figura 5: Diagrama esquemático do método sanduíche de anticorpos duplos para detecção de antígeno fecal infectado com H. pylori. O anticorpo anti-Hp de camundongo (epítopo VacA) foi fixado na área de detecção (T) na membrana com antecedência. A área de controle de qualidade (C) fixa antecipadamente a IgG anti-camundongo caprina e a estreptavidina. O filme de poliéster foi revestido com anticorpo anti-Hp de camundongo marcado com látex e conjugado látex-BSA-biotina. Clique aqui para ver uma versão maior desta figura.
| Se deve comer regularmente em três refeições? | Se deve beber álcool? | Você conhece H. pylori? | Se é necessário realizar a inspeção do H. pylori ? | Você entende as consequências adversas da infecção por H. pylori ? | |
| Sim (tarifa) | 236 (90.4%) | 59 (22.6%) | 117 (44.8%) | 237 (90.8%) | 104 (39.8%) |
| Não (taxa) | 25 (9.6%) | 202 (77.4%) | 144 (55.2%) | 24 (9.2%) | 157 (60.2%) |
Tabela 1: Os resultados do questionário.
| Antígeno do H. pylori | Total | |||
| Positivo (+) | Negativo (-) | |||
| qPCR | Positivo (+) | 50 | 33 | 83 |
| Negativo (-) | 2 | 176 | 178 | |
| Total | 52 | 209 | 261 | |
Tabela 2: Resultados diagnósticos de duas técnicas.
| Positivo | Negativo | Taxa positiva | Total | |
| Aldeia Shitan | 52 | 209 | 19.92% | 261 |
| China | 314423 | 449404 | 42.80% | 763827 |
Tabela 3: Comparação das taxas de positividade de triagem de H. pylori entre Shitan Village e a média nacional.
Discussão
O H. pylori representa uma das infecções bacterianas mais difundidas em todo omundo15. Os resultados do questionário revelaram que 55,2% da população não tinha conhecimento do H. pylori, enquanto 90,8% acreditavam que o rastreamento do H. pylori é necessário. Esses achados ressaltam a importância da implementação de programas de rastreamento de H. pylori em áreas economicamente desfavorecidas e remotas16. Embora o teste respiratório de ureia (UBT) seja um método diagnóstico comum, seu alto custo e inadequação para crianças e gestantes limitam sua aplicabilidade17,18. O teste de anticorpos séricos para H. pylori pode detectar anticorpos no soro de um paciente19. No entanto, este teste não é adequado para análise pós-tratamento, uma vez que os anticorpos permanecem por muito tempo após a eliminação da bactéria20. Em contraste, o teste de antígeno fecal oferece uma abordagem não invasiva que elimina a necessidade de acesso à cavidade gástrica, exigindo apenas amostras de fezes para análise. Este método reduz significativamente o desconforto do paciente e os riscos potenciais, tornando-o mais conveniente tanto para triagem quanto para acompanhamento. Além disso, sua natureza não invasiva o torna mais aceitável para populações em regiões remotas e subdesenvolvidas.
A prevalência de pacientes positivos para H. pylori em nossa população de estudo é de 19,92%, ligeiramente inferior à taxa nacional de positividade de 42,8%14. De acordo com o teste do qui-quadrado (P < 0,01), houve significância estatística entre eles. A razão para essa diferença pode ser que a taxa de infecção de H. pylori em populações urbanas em sete regiões geográficas da China tenha óbvia diferenciação regional21. A taxa de infecção é mais alta no leste da China, maior no nordeste da China, norte da China e noroeste da China e menor no sul da China e sudoeste da China21. A área que examinamos pertence ao sul da China e a taxa de infecção é menor do que o nível nacional. Por outro lado, a operação fora do padrão no processo de amostragem de amostras fecais individuais e o longo tempo para envio para teste também podem ser as razões para essa diferença. Embora a PCR e seus derivados sejam amplamente empregados para detectar vários patógenos, incluindo H. pylori, sua utilidade é limitada pela complexidade e custo do equipamento termociclador e pela necessidade de operadores especializados22,23. Neste estudo, em comparação com os resultados da qPCR, a sensibilidade e especificidade da detecção do antígeno do H. pylori nas fezes foram de 60,24% e 80,08%. A consistência do antígeno de H. pylori nas fezes e os resultados da qPCR foram comparados, e os resultados sugeriram que eles foram moderadamente consistentes (Kappa = 0,630, P < 0,05). As razões para sua sensibilidade insatisfatória podem ser influenciadas pela coleta irregular de amostras, temperatura de armazenamento da amostra e tempo de entrega.
O método sanduíche de anticorpo duplo para a detecção do antígeno fecal da infecção por H. pylori é uma tecnologia de detecção imunológica eficiente e específica. O núcleo deste método é aproveitar a capacidade de ligação específica dos anticorpos e garantir a identificação e quantificação precisas dos antígenos-alvo por meio de um sistema de detecção engenhoso. Especificamente, essa abordagem envolve duas etapas principais: captura de antígenos e detecção de anticorpos. O diagrama esquemático dessa tecnologia é mostrado na Figura 5.
O anticorpo anti-Hp de camundongo revestido na região de detecção da membrana de poliéster (T) tem como alvo o epítopo H. pylori VacA para obter a captura específica do antígeno H . pylori nas fezes. O antígeno VacA é uma importante exotoxina do H. pylori, intimamente associada à infecção. Os anticorpos direcionados ao VacA podem efetivamente identificar e se ligar ao antígeno, formando um complexo antígeno-anticorpo. Portanto, este método não é fácil de reagir de forma cruzada com outras doenças gastrointestinais ou doenças.
Durante o teste, a amostra líquida entra no tanque de detecção e migra para cima por ação capilar. Se a amostra contiver antígeno de H. pylori , ela primeiro forma um complexo antígeno-anticorpo com o anticorpo anti-H. pylori de camundongo marcado com látex revestido no filme de poliéster. À medida que o complexo flui através da zona de detecção (T), ele é capturado pelo anticorpo anti-H. pylori de camundongo imobilizado, resultando em uma faixa vermelha visível na zona de detecção (T), o que indica um resultado positivo. Se nenhum antígeno de H. pylori estiver presente na amostra, nenhum complexo sanduíche de anticorpo duplo se forma na zona de detecção (T) e, consequentemente, nenhuma faixa vermelha aparece, indicando um resultado negativo. Independentemente da presença ou ausência do antígeno H . pylori , o conjugado látex-BSA-biotina se ligará à estreptavidina imobilizada na membrana durante a cromatografia, produzindo uma faixa vermelha na zona de controle de qualidade (C). Esta faixa vermelha serve tanto como um indicador do processo cromatográfico adequado quanto como padrão de controle interno para o reagente.
O método sanduíche de anticorpo duplo realiza a captura eficiente e a detecção qualitativa do antígeno H . pylori nas fezes por anticorpos e marcadores cuidadosamente projetados. Sua simplicidade, rapidez e alta especificidade fornecem suporte técnico confiável para o diagnóstico auxiliar da infecção por H. pylori . A aplicação generalizada dessa tecnologia não apenas reduz os custos médicos e aumenta a eficiência da triagem, mas também oferece aos pacientes uma experiência de teste mais confortável e conveniente. Esse avanço tem importância significativa para a prevenção e controle global da infecção por H. pylori .
Além disso, a higiene do teste de antígeno fecal é uma consideração crítica. Este método requer amostras fecais frescas, que podem ser formadas ou não, sem restrições específicas quanto ao tempo de coleta. Durante a coleta de amostras, é essencial evitar a contaminação com água, urina, desinfetantes ou esgoto. As amostras fecais devem ser coletadas em recipientes limpos e secos, livres de conservantes e detergentes. Se o armazenamento for necessário, as amostras podem ser mantidas em temperatura ambiente por não mais de 6 horas ou a 2-8 °C por até 72 h. As amostras refrigeradas devem ser trazidas de volta à temperatura ambiente antes do teste para garantir resultados precisos. A alta eficiência de tempo também é uma característica importante da detecção do antígeno de infecção por H. pylori nas fezes. O ensaio sanduíche de anticorpo duplo à base de látex pode fornecer resultados em 10 a 20 minutos em comparação com os métodos tradicionais que exigem a espera por resultados laboratoriais, o que é importante para o reconhecimento da infecção aguda e decisões precoces de tratamento em áreas remotas e atrasadas.
Em resumo, a detecção do antígeno de H. pylori nas fezes oferece inúmeras vantagens metodológicas, incluindo não invasividade, simplicidade, higiene, alta eficiência e ampla aplicabilidade. Esses recursos tornam esse método uma ferramenta valiosa para a prática clínica e fornecem insights inovadores para o desenvolvimento futuro de tecnologias de diagnóstico. Em regiões subdesenvolvidas com condições sanitárias limitadas, essa abordagem está pronta para desempenhar um papel fundamental no diagnóstico e tratamento da infecção por H. pylori .
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Nenhum
Materiais
| Name | Company | Catalog Number | Comments |
| DNA extraction kit | Jiangsu mole biotechnology co., ltd | 20230223 | None |
| H. pylori fecal antigen detection kit | Hangzhou nuohui healthy technology co., ltd | 20213401126 | None |
| H. pylori nucleic acid detection kit | Jiangsu mole biotechnology co., ltd | 20230226 | None |
| Real-time fluorescence quantitative PCR | Shanghai Hongshi medical treatment technology co., ltd | 20183221659 | None |
| Statistical Product and Service Solutions | IBM company | None | None |
Referências
- Ali, A., AlHussaini, K. I. Helicobacter pylori: A contemporary perspective on pathogenesis, diagnosis and treatment strategies. Microorganisms. 12 (1), 222(2024).
- Kusters, J. G., van Vliet, A. H., Kuipers, E. J. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 19 (3), 449-490 (2006).
- Chen, Y. C., et al. Global prevalence of Helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterology. 166 (4), 605-619 (2024).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 66 (1), 6-30 (2017).
- Hooi, J. K. Y., et al. Global prevalence of Helicobacter pylori infection: Systematic review and meta-analysis. Gastroenterology. 153 (2), 420-429 (2017).
- Burucoa, C., Axon, A. Epidemiology of Helicobacter pylori infection. Helicobacter. 22 (Suppl 1), (2017).
- Atkinson, N. S., Braden, B. Helicobacter pylori infection: Diagnostic strategies in primary diagnosis and after therapy. Dig Dis Sci. 61 (1), 19-24 (2016).
- Owot, J. C., et al. Diagnostic performance of fecal Helicobacter pylori antigen test in Uganda. BMC Gastroenterol. 22 (1), 518(2022).
- Kornoukhova, L. A., Emanuel, V. L., Denisov, N. L., Nikonov, E. L. Helicobacter pylori infection: place of serological and cultural diagnostics in clinical guidelines. Klin Lab Diagn. 66 (8), 496-501 (2021).
- Boltin, D., et al. Correlation between quantitative 13C-urea breath test and Helicobacter pylori treatment success in a population-based cohort. Gastroenterol Res Pract. 2018, 5439539(2018).
- Gingras, B. A., Maggiore, J. A. Performance of a new molecular assay for the detection of gastrointestinal pathogens. Access Microbiol. 2 (10), acmi000160(2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Ishino, Y., Krupovic, M., Forterre, P. History of CRISPR-Cas from encounter with a mysterious repeated sequence to genome editing technology. J Bacteriol. 200 (7), e00580-e00617 (2018).
- Xie, L., et al. Prevalence of Helicobacter pylori infection in China from 2014-2023: A systematic review and meta-analysis. World J Gastroenterol. 30 (43), 4636-4656 (2024).
- Chmiela, M., Karwowska, Z., Gonciarz, W., Allushi, B., Stączek, P. Host pathogen interactions in Helicobacter pylori-related gastric cancer. World J Gastroenterol. 23 (9), 1521-1540 (2017).
- Dai, B., et al. Rapid and sensitive assay of Helicobacter pylori with one-tube RPA-CRISPR/Cas12 by portable array detector for visible analysis of thermostatic nucleic acid amplification. Front Microbiol. 13, 858247(2022).
- Zubillaga, M., et al. MIN 14C UBT: a combination of gastric basal transit and 14C-urea breath test for the detection of Helicobacter pylori infection in human beings. Nucl Med Biol. 24 (6), 565-569 (1997).
- Bentur, Y., Matsui, D., Koren, G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 55 (5), 479-480 (2009).
- Herbrink, P., van Doorn, L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication therapy. Eur J Clin Microbiol Infect Dis. 19 (3), 164-173 (2000).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Wang, L., Li, Z., Tay, C. Y., Marshall, B. J., Gu, B. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados