Method Article
Atividade convulsiva induzida por eletrochoque em larvas de Drosophila
Neste Artigo
Resumo
Este protocolo detalha o uso de larvas de Drosophila para identificar compostos anticonvulsivantes exclusivos para o tratamento da epilepsia.
Resumo
A epilepsia apresenta um fardo de saúde significativo que é exacerbado pelo alto número de indivíduos refratários a medicamentos. Embora alguns pacientes refratários a medicamentos respondam a tratamentos não medicamentosos (por exemplo, estimulação do nervo vago, dieta cetogênica, etc.), o último recurso para muitos é uma cirurgia desafiadora e cara para proporcionar alívio das convulsões. Embora seja geralmente reconhecido que são necessários medicamentos anticonvulsivantes com uma gama mais ampla de alvos, o obstáculo para conseguir isso é a identificação de novos alvos de medicamentos. Animais modelo geneticamente tratáveis são promissores a esse respeito. A mosca da fruta, Drosophila melanogaster, tornou-se um modelo poderoso para investigar a base mecanicista e os melhores tratamentos para convulsões. Muitas mutações de moscas identificadas resultam em larvas e adultos exibindo atividade semelhante a convulsões em resposta a fortes estímulos (elétricos, mecânicos e / ou térmicos). Muitas dessas mutações estão em genes homólogos àqueles que contribuem para epilepsias genéticas humanas (por exemplo, o canal de Na+ dependente de voltagem). Agora também é possível substituir um gene de mosca por seu equivalente humano que, além disso, carrega uma mutação relacionada à doença. Assim, a humilde mosca tornou-se um avatar para modelar a doença humana. Este estudo descreve um método adequado para usar larvas de Drosophila para exames de drogas de baixo a médio rendimento para identificar compostos únicos e seus alvos que têm potencial anticonvulsivante.
Introdução
A epilepsia continua sendo um fardo significativo para a saúde, afetando aproximadamente 1% da população mundial. Embora existam mais de 30 medicamentos anticonvulsivantes (ASMs) para tratamento clínico, cerca de um terço das pessoas com epilepsia permanecem refratárias a medicamentos, o que significa que não respondem bem ao tratamentomedicamentoso 1,2. Os medicamentos disponíveis também são apenas paliativos e, como tal, não previnem a epileptogênese, nem proporcionam cura3. Assim, há uma necessidade crítica de identificar melhores tratamentos para a epilepsia. Um obstáculo para o desenvolvimento de tratamentos mais eficazes é a identificação de novos alvos de medicamentos. De fato, quase todos os ASMs atuais afetam alvos semelhantes: canais iônicos, incluindo o canal de sódio dependente de voltagem (Nav), e neurotransmissão inibitória mediada por ácido γ-aminobutírico (GABA) 4 , 5 . É geralmente aceito que o uso continuado de métodos tradicionais de desenvolvimento de medicamentos provavelmente não mudará radicalmente esse cenário.
Animais modelo de laboratório, incluindo, mas não se limitando a, a mosca da fruta Drosophila melanogaster e o peixe-zebra Danio rerio, têm utilidade para a identificação de novos ASMs 6,7,8. De fato, uma pesquisa no PubMed por 'Drosophila + convulsão' retorna 342 resultados, enquanto a mesma pesquisa por peixe-zebra retorna 578 resultados (ambas as pesquisas foram realizadas em 29de janeiro de 2025). Embora ofuscado pelo número de estudos semelhantes em camundongos (~ 15.000), o número de estudos usando sistemas modelo continua a crescer. Esses estudos são possíveis devido à conservação mecanicista da função do SNC em todos os filos. Além disso, as convulsões induzidas em moscas e peixes são efetivamente tratadas com ASMs clinicamente usados, mostrando que, embora as nuances do comportamento convulsivo possam parecer externamente diferentes, os mecanismos subjacentes têm muito em comum 7,9,10.
A mosca da fruta, Drosophila, fez muitas contribuições seminais para a compreensão da biologia humana. Com relação à epilepsia, este sistema modelo fornece uma caixa de ferramentas genéticas incomparável combinada com neurônios identificáveis e experimentalmente acessíveis7. Além disso, os conectomas para o SNC larval e adulto já foram publicados, e numerosas linhagens genéticas específicas de células foram identificadas11,12. Significativamente, uma classe de mutação foi identificada por acaso em que as moscas adultas respondem a uma forte estimulação mecânica por uma perda de postura e atividade semelhante a uma convulsão (por exemplo, zumbido das asas, tremor das pernas, etc.). Esta classe de mutação foi denominada 'sensível ao bang'13,14,15,16. Desde então, foi identificada uma segunda classe de mutação convulsiva que responde ao aumento da temperatura, espelhando as convulsões febris humanas17,18. No entanto, a tratabilidade experimental de moscas adultas é um pouco reduzida em comparação com o estágio larval desse mesmo modelo de inseto. Por exemplo, pode ser difícil alimentar moscas adultas com medicamentos, e técnicas mais invasivas, como eletrofisiologia e optogenética, podem ser mais desafiadoras. Em contraste, a larva de Drosophila come constantemente para expandir seu volume corporal em ~ 100 vezes em apenas 5 dias para permitir a pupação. Portanto, podemos ter certeza de uma alimentação medicamentosa adequada nos estágios larvais. A embriogênese está bem documentada e pode ser encenada com precisão e, por sua vez, identificou marcos importantes no desenvolvimento do SNC, incluindo a primeira aquisição de propriedades elétricas neuronais até a formação do circuito19. Uma vez eclodida, uma larva passa por 3 mudas (ou instares) até que, no dia 5, torna-se 'errante', após o que deixa a comida para encontrar um lugar seguro para a pupa. Após ~ 100 h de pupação, uma mosca adulta emerge com um novo corpo e SNC (Figura 1).
As técnicas para induzir convulsões em adultos não são adequadas para os estágios larvais. As larvas não possuem pêlos sensoriais, cuja ativação sincronizada durante a estimulação mecânica pode levar a uma convulsão. Assim, para superar essas dificuldades, foi desenvolvida uma técnica de eletrochoque para induzir convulsões no estágio larval errante. A análise comparativa subsequente das técnicas de indução de convulsões em larvas e adultos revela que o eletrochoque larval é muito menos dependente do tipo de mutação (por exemplo, sensível ao estrondo vs. temperatura). Assim, sugerimos que essa técnica deve ser o método preferido para testar novas mutações onde o método ideal de indução de convulsões é desconhecido20. A técnica de eletrochoque larval é simples, rápida e requer equipamento mínimo. Essa técnica fornece um meio eficiente de rastrear novos compostos, ou terapias genéticas, para eficácia anticonvulsiva em uma variedade de mutações que refletem a diversidade genética da epilepsia humana.
Protocolo
A mosca da fruta, Drosophila melanogaster, é usada neste estudo (consulte a seção Resultados para obter detalhes). Esta técnica é mais adequada para larvas errantes de terceiro ínstar (L3). O protocolo experimental é relativamente simples, mas requer prática para ser aperfeiçoado. Em nossa experiência, os novos alunos precisam de cerca de 2 semanas para dominar o ensaio e se beneficiam muito da visualização de outros investigadores mais experientes que realizam o ensaio em tempo real usando um microscópio de dissecção habilitado para câmera ou similar. Os reagentes e os equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Seleção de larvas
- Colete larvas das laterais de frascos/garrafas de mosca contendo alimentos padrão (5 L de água, 390 g de glicose, 360 g de milho, 250 g de fermento, 40 g de ágar, 135 mL de nipagina, 15 mL de ácido propiônico).
- Use apenas larvas que estão se movendo ativamente e deixaram a comida rastejar pelas laterais do recipiente (terceiros ínstares errantes, L3). Não selecione pré-pupas, que exibem locomoção muito reduzida.
2. Procedimento de eletrochoque
- Remova um único L3 errante e transfira-o para uma pequena placa de Petri de plástico (o tamanho não importa) e lave-o suavemente com ddH2O para remover os resíduos de alimentos. Um pincel pequeno (000) é adequado para isso.
- Transfira a larva lavada sozinha, usando um pincel, para um prato de plástico vazio (novamente, o tamanho não importa). Seque a larva com um pequeno fragmento de papel toalha preso com uma pinça. Remova o excesso de ddH2O, mas não seque completamente as larvas para evitar que grudem no prato de plástico.
- Deixe a larva se recuperar por 30 s. Isso facilitará a colocação fácil da sonda de eletrochoque (veja abaixo).
- Veja as larvas sob um microscópio de dissecção de baixa potência (15-20x) e, assim que o comportamento normal de rastreamento for retomado, coloque suavemente a sonda de eletrochoque (consulte a etapa 3 para obter detalhes e a Figura 2A) na superfície dorsal anterior da larva acima da posição aproximada do SNC (consulte a Figura 2C).
NOTA: Esta etapa é crítica, pressão suficiente deve ser aplicada para fornecer boa condutividade entre o fio da sonda e a cutícula, mas tome cuidado para não danificar as larvas. Assim, esmague a larva em cerca de um terço a metade de sua profundidade. - Aplicar um pulso de 2 s de tensão constante, cuja intensidade foi pré-determinada através de uma curva de titulação (figura 3). Qualquer estimulador de tensão isolado é adequado aqui. O usado aqui é mostrado na Figura 2B.
- Após o choque elétrico, inicie um cronômetro. Em resposta ao choque, as larvas iniciam paralisia transitória seguida por espasmos ocasionais de atividade muscular da parede corporal e comportamento de rolamento, interrompendo o comportamento normal de rastejar.
- Pare o cronômetro quando a larva se afastar claramente de sua colocação original no prato. A duração da convulsão, ou tempo de recuperação (TR), é definida como o período entre o início do estímulo e a retomada do comportamento normal de rastreamento (por exemplo, uma onda peristáltica completa para frente que resulta em movimento para frente).
- No final de cada dia, limpe cuidadosamente os fios da sonda, enxaguando-os primeiro com etanol 100% e, em seguida, com ddH2O. Inspecione cuidadosamente os fios sob ampliação e, se necessário, use uma pinça para raspar suavemente qualquer resíduo dos fios. Tenha muito cuidado para não alterar a distância entre os dois fios ao fazê-lo.
3. Construção da sonda de eletrochoque
- Serão necessários 2 comprimentos de 1 m de fio elétrico (devem ser finos e flexíveis, ou seja, classificados para ~ 3 A). Na extremidade de cada fio, solde um fio de tungstênio de 5 cm de comprimento (para maximizar o contato, enrole o fio de tungstênio em torno de uma extremidade exposta do fio elétrico antes de soldar). Solde os conectores de encaixe (por exemplo, plugues banana) na outra extremidade dos fios, adequados para facilitar a conexão ao estimulador de tensão.
- Prenda os dois fios de tungstênio a um suporte de eletrodo de forma que os fios fiquem paralelos um ao outro (Figura 2). Pequenas seções de capilares de vidro (~ 2 cm de comprimento) são usadas para manter os fios no lugar sob o parafuso de trava da sonda.
- Use uma pinça para dobrar os fios de forma que eles cheguem a 1-2 mm perto de onde saem do suporte do fio. Dobrar fios de tungstênio não é fácil porque os fios retêm uma 'memória' - portanto, é necessária perseverança. Dicas para ajudar nesse processo incluem o uso de fita isolante elétrica e/ou blu-tack (ou massa de modelagem semelhante) para ajudar a manter os fios na orientação/distância correta.
4. Calibração da sonda
- Assegurar a existência de unidades populacionais de L3 errantes de tipo selvagem adequado (controlo negativo) e de mutação convulsiva (controlo positivo). ~ 100 de cada será necessário.
- Prepare as larvas, uma de cada vez, conforme descrito acima.
- Use a sonda para aplicar uma faixa de voltagens a larvas suficientes de cada genótipo para cada voltagem testada. Sugere-se que 0 V, 2 V, 4 V, 6 V, 8 V, 10 V e 12 V sejam aplicados por 2 s entre 10-15 larvas por tensão. Choque cada larva apenas uma vez.
- Meça o tempo de recuperação de cada larva e calcule a média de cada etapa de voltagem aplicada para ambos os genótipos.
- Plote as médias em um gráfico e ajuste os dados com uma linha reta.
- Selecione uma tensão com uma diferença clara e significativa entre o mutante de controle e convulsão. Tenha cuidado para não escolher uma tensão que produza um tempo de recuperação excessivamente longo; caso contrário, a produtividade será prejudicada devido ao longo tempo de espera pela recuperação.
NOTA: Este estudo freqüentemente usou uma tensão de estimulação que resulta em um tempo de recuperação de 50-100 s para o tipo selvagem e 200-300 s para o parágrafobss. As curvas de calibração exemplares são mostradas na Figura 3. É importante usar 0 V para contabilizar o ato de pressionar a sonda na superfície dorsal de uma larva. Isso causará algum grau de paralisia, que provavelmente é um mecanismo de defesa da larva.
5. Execução de experimentos
- Larva de eletrochoque do(s) genótipo(s) desejado(s) ou exposição a medicamentos e mede o tempo de recuperação da convulsão.
NOTA: Para larvas de teste, um n = 20 geralmente é suficiente, mas um cálculo de poder baseado em uma análise piloto fornecerá um número n mais definitivo. - Sempre execute um controle negativo (por exemplo, um tipo selvagem) e um positivo (por exemplo, parabss) durante cada experimento. Os n números não precisam ser altos; n = 5 é suficiente. Isso fornecerá confiança de que o ensaio funcionou conforme o esperado (por exemplo, sem problemas com a sonda ou estimulador).
- Aplique um ponto de corte (por exemplo, 300 s) para evitar tempos de recuperação excessivamente longos e considere apenas convulsões quantificáveis como aquelas com tempos de recuperação acima de 30 s.
6. Triagem de drogas
- Adicione os medicamentos, dissolvidos em um solvente apropriado, diretamente na superfície do alimento e deixe de molho (e se estiver usando etanol, tempo para a evaporação do solvente). Ou, alternativamente, pode-se adicionar um medicamento (em solvente apropriado) à comida de mosca derretida. Consulte a seção Resultados para obter detalhes.
- Para adicionar o medicamento ao alimento derretido, retire os alimentos dos frascos, derreta novamente e, à medida que o alimento esfria a 40 ° C, adicione o medicamento, misture com um misturador de vórtice e, em seguida, recoloque 5 mL de alimentos derretidos de volta em frascos e deixe esfriar antes de usar.
- Execute um gradiente de concentração para identificar a concentração ideal do medicamento.
NOTA: Um bom ponto de partida é adicionar uma solução de medicamento 3 mM diretamente na superfície do alimento (200 μL por frasco padrão de Drosophila ) ou fazer uma concentração de 3 mM em alimentos derretidos. As fêmeas adultas podem botar ovos diretamente neste alimento, ou as larvas podem ser adicionadas em estágios selecionados, conforme necessário. O(s) solvente(s) utilizado(s) deve(m) ser adicionado(s) isoladamente aos frascos selecionados como controlo(s) do veículo.
Resultados
Numerosas mutações de Drosophila exibem comportamento semelhante a convulsõesaprimorado 7,20. A base genética dessas mutações é variada, o que imita favoravelmente as causas genéticas igualmente variadas da epilepsia humana. Três das mutações de Drosophila mais estudadas são parabangsenseless (parabss), julius seizure (jus) e easily-shocked (eas). A mutação parabss resulta em um ganho de função do canal paralítico de Na+ dependente de voltagem, eas codifica etanolamina quinase e jus é uma proteína de membrana ainda não identificada (observe que jus era denominado slamdance até recentemente) 16 , 21 , 22 . Muitos desses genes têm homólogos humanos. Por exemplo, paralítico é um homólogo dos genes Nav humanos, cujas mutações são uma das principais causas de epilepsia genética23. Tal como acontece com a epilepsia humana, essas três mutações de moscas "sensíveis ao estrondo" mostram "gravidade" diferencial de convulsão em resposta ao choque elétrico (Figura 4). O tempo de recuperação mais longo (ou seja, o comportamento convulsivo mais grave) é exibido pelo parágrafobss, enquanto jus exibe o menor tempo de recuperação. Essa resposta diferencial, devido a diferentes mutações genéticas subjacentes, permite que um experimentador teste como os compostos principais podem reduzir a convulsão em uma variedade de mutações para identificar aqueles com atividade favorável de amplo espectro.
Muitos ASMs usados na clínica são igualmente eficazes em modelos de convulsões de Drosophila, indicando que os mecanismos subjacentes que produzem convulsões em Drosophila são semelhantes aos que resultam em convulsões em pessoas com epilepsia 9,24,25. A Figura 5 mostra o efeito de dois dos ASMs mais usados clinicamente, valproato de sódio (VPA) e fenitoína (PHY), contra o p.bss. As larvas foram autorizadas a se alimentar ad libitum no ASM contido no alimento (adicionado ao alimento derretido) a 3 mM durante todo o desenvolvimento larval. O tipo selvagem (Canton-S, CS) e o controleveicular alimentado com parabss (etanol e água, respectivamente) foram incluídos em cada experimento, juntamente com o parabss alimentado com o respectivo ASM. Há uma clara e significativa redução no tempo de recuperação das crises (TR) para ambos os medicamentos. Dado que tanto o tipo selvagem quanto uma mutação convulsiva conhecida (parabss), sem exposição ao ASM, exibem atividade convulsiva esperada, podemos ter certeza da validade desses dois experimentos. Quando não for esse o caso, os ensaios devem ser descartados e o experimento deve ser repetido. A causa subjacente para tal 'falha' é frequentemente danos à sonda de eletrochoque, baixa energia da bateria do estimulador e/ou inexperiência do experimentador. A manutenção de moscas a temperaturas inferiores a 25 °C também deve ser evitada (ver secção Discussão). Embora esta técnica não seja adequada para triagem de alto rendimento, recentemente, ela foi usada em uma triagem de baixo rendimento de ~ 30 compostos para identificar uma nova classe de produtos químicos que efetivamente reduz a convulsão por meio da manipulação de Pumilio - um regulador da homeostase neuronal. Uma tradução positiva desses mesmos compostos para reduzir a convulsão em modelos definidos de convulsões de camundongos mostra um potencial empolgante para o desenvolvimento dos compostos principais e do novo alvo26,27.
Ao examinar os resultados representativos mostrados aqui (Figura 4 e Figura 5), é evidente que há variabilidade na distribuição de dados. Há também uma diferença modesta no valor do tipo selvagem entre os dados apresentados nessas duas figuras. É por isso que este ensaio é qualitativo e não é adequado para identificar pequenas diferenças na gravidade das convulsões, seja entre genótipos ou em ensaios de triagem de medicamentos. No entanto, o ensaio é adequado para identificar um fenótipo convulsivo em mutações desconhecidas e / ou para testes iniciais de compostos para atividade anticonvulsiva27. Refinamentos adicionais do desenvolvimento de medicamentos, no entanto, exigiriam ensaios diferentes.

Figura 1: Ciclo de vida da Drosophila . Um esquema mostrando o ciclo de vida da Drosophila , do embrião ao adulto, via pupação. Os tempos mostrados são aproximados para o desenvolvimento a 25 °C. Clique aqui para ver uma versão maior desta figura.

Figura 2: Projeto e posicionamento da sonda de eletrochoque. (A) mostra imagens de uma sonda tanto da parte superior quanto da lateral. O Blu-tack tem sido usado para manter uma distância entre fios de ~ 2 mm, pois os fios de tungstênio se estendem da sonda. Seções curtas de capilares de vidro (seta) mantêm os fios de tungstênio no lugar. Os fios elétricos que se conectam ao estimulador são cobertos e mantidos ao longo da alça da sonda por fita isolante elétrica. (B) mostra um estimulador isolado de tensão constante recomendado usado neste estudo. (C) mostra o posicionamento aproximado da sonda estimulante na superfície dorsal anterior de uma larva de terceiro ínstar errante. Observe que os fios da sonda se estendem pelo corpo larval e a região imediatamente acima do SNC é de ~ 2 mm de distância entre os fios. Clique aqui para ver uma versão maior desta figura.
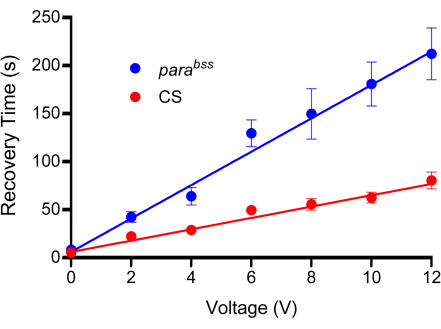
Figura 3: Curva de calibração. Antes dos experimentos, uma tensão adequada deve ser determinada para eletrochoque. Todas as sondas serão ligeiramente diferentes devido à natureza de sua fabricação. Um tipo selvagem (neste caso, Canton-S, CS) e um mutante de convulsão (recomendado, parabss) são submetidos a choques de tensão crescentes, cada um definido em uma duração fixa de 2 s. As larvas são chocadas apenas uma vez, e um mínimo de n = 10 deve ser usado para cada voltagem testada (neste caso, n = 12). É evidente a partir dos ajustes de linha que osparágrafos mostram um aumento do tempo de recuperação de convulsões em todas as tensões. A voltagem escolhida deve produzir uma diferença clara e significativa entre os controles e os mutantes de convulsão. No gráfico mostrado, as diferenças são significativas em 6 V e acima (p ≤ 0,0001, ANOVA de duas vias com comparações múltiplas de Šidák, n = 12, por genótipo e voltagem). Assim, 6 V foi escolhido como a tensão ideal para esta sonda, pois produziu uma diferença significativa, mas o tempo de recuperação é curto, reduzindo o tempo necessário para realizar choques elétricos individuais. Os dados são apresentados como média ± SEM. Clique aqui para ver uma versão maior desta figura.
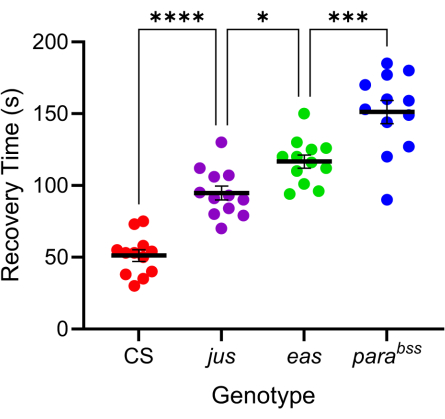
Figura 4: Diferentes mutações de Drosophila exibem níveis variados de gravidade das convulsões. Usando a sonda calibrada na Figura 3, três mutantes convulsivos de Drosophila (parabss, jus e eas), juntamente com um tipo selvagem (CS), foram submetidos a eletrochoque (6 V, 2 s). As larvas individuais foram chocadas apenas uma vez. Os tempos de recuperação de convulsões são maiores para mutantes de convulsões do que para o tipo selvagem e aumentam progressivamente de jus para para bss (p ≤ 0,0001, respectivamente, ANOVA unidirecional com comparações múltiplas de Tukey). Comparações estatisticamente significativas das comparações múltiplas de Tukey são indicadas como ****p ≤ 0,0001, *** p ≤ 0,001, **p ≤ 0,01, *p ≤ 0,05. Os dados são apresentados como média ± SEM. Clique aqui para ver uma versão maior desta figura.
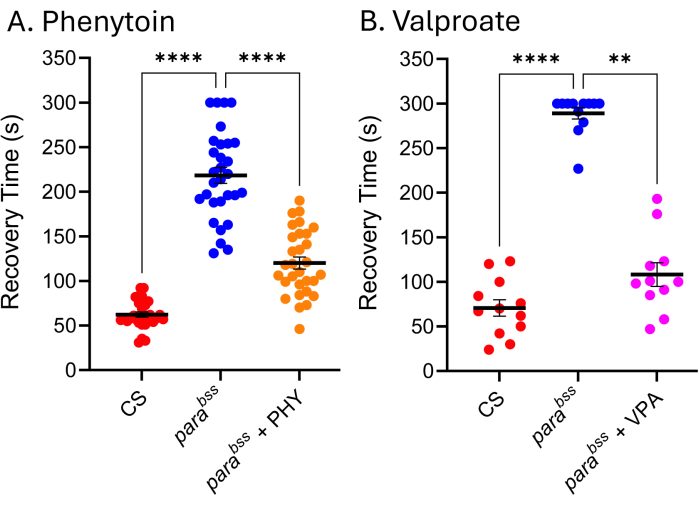
Figura 5: Os mutantes convulsivos de Drosophila respondem a ASMs usados clinicamente. A exposição a (A) fenitoína (PHY) e (B) valproato de sódio (VPA) (3 mM, respectivamente) reduziu significativamente o tempo de recuperação de convulsões de parágrafobss (p ≤ 0,01, Kruskal-Wallis com comparações múltiplas de Dunn e p ≤ 0,0001, ANOVA unidirecional com comparações múltiplas de Tukey, respectivamente). Apenas tempos de recuperação acima de 30 s foram considerados uma convulsão quantificável, e um ponto de corte de 300 s foi usado nesses ensaios. Cada ensaio de droga foi conduzido por um experimentador diferente; Assim, os tempos médios de recuperação mostrados diferem (particularmente evidente para ParaBSS sem medicamento). Isso ressalta o fato de que este ensaio é qualitativo e, portanto, um mutante de tipo selvagem e convulsão deve ser incluído em cada ensaio. Isso pode permitir que a atividade do medicamento seja normalizada entre os experimentos, se necessário. As comparações estatisticamente significativas das comparações múltiplas de Dunn e Tukey são indicadas como ****p ≤ 0,0001, *** p ≤ 0,001, ** p ≤ 0,01, * p ≤ 0,05. Os dados são apresentados como média ± SEM. Clique aqui para ver uma versão maior desta figura.
Discussão
O método de eletrochoque para induzir convulsões em larvas de Drosophila fornece uma triagem simples, mas eficiente, para identificar novos compostos anticonvulsivantes ou manipulações genéticas. No entanto, por se tratar de um ensaio qualitativo, sua principal limitação é que o método não pode identificar prontamente pequenos tamanhos de efeito. No entanto, o rendimento médio que ele permite, prestando-se à triagem de até ~ 5 compostos por semana, por investigador, fornece um ensaio de animal inteiro muito poderoso. A simplicidade da técnica também é adequada para projetos de laboratório em nível de graduação. Assim, 3-4 pesquisadores podem rastrear muitos compostos em um período de tempo relativamente curto e com muito menos despesas do que usar um ensaio de convulsão de camundongo equivalente. A automação do ensaio aumentaria ainda mais o rendimento. No entanto, este estudo não conseguiu fazer isso. Um ágar contendo lítio com dois eletrodos embutidos no ágar foi tentado para chocar várias larvas simultaneamente, mas sem sucesso. Outros métodos, possivelmente baseados em optogenética, podem ser mais adequados para automação28.
A simplicidade do ensaio, no entanto, prejudica a exigência de se tornar proficiente. O posicionamento da sonda e a pressão aplicada durante o eletrochoque são etapas críticas. A consistência em ambos reduz a variabilidade entre os tempos de recuperação das larvas chocadas. A outra questão principal é como reconhecer o desfecho da convulsão, o que torna este ensaio qualitativo porque depende de quando um investigador individual opta por parar o relógio. Quando vários experimentadores no mesmo laboratório conduzem esses experimentos, vale a pena gastar tempo visualizando os mesmos choques larvais para concordar sobre qual é o ponto final da convulsão. Isso reduz muito a variabilidade entre pessoas. No entanto, ainda é evidente a partir dos resultados exemplares mostrados neste relatório que, embora os efeitos sejam constantes, os tempos podem variar entre os experimentadores. Também é importante notar que o desenvolvimento larval em temperaturas abaixo de 25 ° C (por exemplo, 18 ° C) reduz a gravidade das convulsões devido a uma diminuição na atividade neural durante um período crítico embrionário29. Assim, sugere-se que um mínimo de 25 °C seja usado para o desenvolvimento embrionário/larval. É desejável ter uma incubadora perto da bancada, e apenas larvas suficientes são removidas conforme necessário para cada eletrochoque. As larvas restantes devem ser mantidas a 25 °C até serem necessárias. Com a prática, os experimentadores podem chocar até 4 larvas por vez, espaçando os choques em intervalos de 10 s. Essa abordagem acelera muito o progresso, e um n de 40 larvas (ou mais) pode ser alcançado em um dia. A umidade não foi medida ou controlada durante este estudo. Um ciclo claro-escuro padrão de 12:12 foi selecionado, mas isso pode ser variado conforme o experimentador desejar.
A fabricação de uma sonda é a parte mais desafiadora desse método. Assim, uma vez feito, deve-se tomar muito cuidado para não danificá-lo. Qualquer dano que ocorra à sonda de eletrochoque geralmente implicará em um reparo e, portanto, a sonda precisa ser recalibrada para determinar a tensão ideal. A tensão depende inteiramente da distância entre os dois fios e, como tal, não há duas sondas que sejam idênticas. É aconselhável recalibrar uma sonda todos os meses para garantir que a tensão ideal não tenha mudado. A força do eletrochoque depende tanto da tensão aplicada quanto da duração da tensão. Assim, durações mais curtas com tensões mais altas provavelmente produzirão a mesma resposta que durações mais longas, usando estimulação de tensão mais fraca. No entanto, este espaço não foi investigado. A preferência por 2 s de duração (neste estudo) é facilmente acomodada sem que o movimento indevido das larvas seja chocado. Isso permite uma força de tensão comparativamente mais baixa, o que evita danos à cutícula larval. O efeito da estimulação também dependerá da força da corrente (amperes), que não medimos. No entanto, diferentes estimuladores produzirão diferentes amperagens e, portanto, verificou-se que usando um estimulador Grass S8825, foi usada uma tensão de 50 V / 3 s, enquanto utilizando o estimulador usado aqui, 6-12 V / 2 s foi usado, dependendo da sonda que está sendo usada. A voltagem / duração real usada não é muito importante, desde que seja suficiente para induzir um tempo de recuperação maior do que um controle de tipo selvagem e não cause danos à larva. Como o ato de apenas colocar uma sonda em uma larva (usando 0 V como controle) causa algum grau de congelamento / paralisia (indicativo de uma tentativa de evitar a predação), não há critérios de estimulação que não induzam algum comportamento 'semelhante a uma convulsão'.
O ensaio de eletrochoque é adequado para a triagem de medicamentos para atividade anticonvulsiva. Um problema é sempre solvente. Verificou-se que o etanol ou a acetona são solventes melhores do que o DMSO. Nos experimentos atuais, o DMSO é tolerado até ~ 1%, além do qual uma letalidade inaceitável foi observada em larvas em desenvolvimento. Das duas opções para expor as larvas a drogas, seja adicionando droga (dissolvida em um solvente adequado) ao topo de um frasco de alimento ou adicionando comida de mosca derretida, verificou-se que esta última produz melhores resultados em termos de variabilidade reduzida. No entanto, a diferença é marginal e o primeiro método é mais rápido. Recomenda-se que os experimentadores comparem os dois métodos e escolham o mais adequado. As moscas podem botar ovos em alimentos que contenham drogas, de modo que todo o desenvolvimento larval seja exposto a escavações. Alternativamente, as larvas podem ser colocadas em alimentos contendo drogas em qualquer estágio desejado para identificar o momento crítico da atividade da droga. Alimentar fêmeas grávidas com drogas é um método eficaz para expor embriões em desenvolvimento a drogas25.
Um ensaio de convulsão alternativo e comumente usado é o uso de embriões de peixe-zebra expostos ao pentilenotetrazol pró-convulsivante para rastrear ASMs30. Em nossa opinião, o ensaio larval de Drosophila tem muitas vantagens. Isso inclui (1) muitos compostos são difíceis de dissolver na água do mar artificial em que os peixes nadam; (2) o ensaio do peixe-zebra depende da redução do comprimento da natação, que pode ocorrer devido à exposição a um ASM ou, contraintuitivamente, a um composto pró-convulsivante. Isso ocorre porque o aumento da atividade convulsiva no peixe-zebra também resulta em redução da natação10. Assim, quaisquer hits compostos devem ser seguidos por uma triagem secundária, que geralmente requer a medição de genes neuronais induzíveis precocemente, como c-fos; (3) Os peixes só podem ser usados sem licença de animal até o dia 5 após a eclosão. É claro que o peixe-zebra tem uma vantagem distinta sobre os insetos, pois seu principal neurotransmissor excitatório é o glutamato e não a acetilcolina31. Uma combinação dos dois ensaios, começando com Drosophila e seguida pelo peixe-zebra, pode fornecer uma tela muito poderosa antes que menos compostos atingidos sejam testados em camundongos.
Para resumir, o ensaio de eletrochoque larval de Drosophila , juntamente com a alta conservação em genética e fisiologia compartilhada entre moscas e mamíferos, fornece uma tela muito eficaz, rápida e barata para identificar novas terapias anticonvulsivantes. O aumento da adoção desse inseto para triagem de drogas também atenderá à necessidade urgente de reduzir o número de animais de ordem superior usados para pesquisas médicas.
Divulgações
Os autores declaram não haver interesses conflitantes.
Agradecimentos
Agradecemos aos muitos funcionários do laboratório Baines que desenvolveram em conjunto essa técnica ao longo de muitos anos e, em particular, a Richard Marley, que se esforçou bastante para torná-la robusta e confiável. Agradecemos a Anna Munro por desenhar as larvas, que é mostrada na Figura 2. O trabalho no laboratório de Baines que contribuiu para o desenvolvimento dessa técnica foi generosamente apoiado pelo BBSRC, MRC e Wellcome Trust. Este trabalho é atualmente apoiado por financiamento de um prêmio de investigador do Wellcome Trust para R.A.B. (Grant 217099/Z/19/Z). O desenvolvimento desta técnica também se beneficiou do Manchester Fly Facility, que foi estabelecido por meio de fundos da Universidade e do Wellcome Trust (Grant 087742 / Z / 08 / Z).
Materiais
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
Referências
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados