Method Article
פעילות התקפים הנגרמת על ידי שוק חשמלי בזחלי דרוזופילה
In This Article
Summary
פרוטוקול זה מפרט את השימוש בזחלי דרוזופילה לזיהוי תרכובות נוגדות פרכוסים ייחודיות לטיפול באפילפסיה.
Abstract
אפילפסיה מהווה נטל בריאותי משמעותי שמחמיר על ידי מספר גבוה של אנשים עמידים לתרופות. בעוד שחלק מהמטופלים העמידים לתרופות מגיבים לטיפולים שאינם תרופתיים (למשל, גירוי עצב הנרתיק, דיאטה קטוגנית וכו'), המוצא האחרון עבור רבים הוא ניתוח מאתגר ויקר כדי לספק הקלה מהתקפים. בעוד שבדרך כלל מכירים בכך שנדרשות תרופות נגד פרכוסים עם מגוון רחב יותר של מטרות, המכשול בהשגת מטרה זו הוא זיהוי מטרות תרופתיות חדשות. חיות מודל הניתנות למעקב גנטי מציעות הבטחה בהקשר זה. זבוב הפירות, Drosophila melanogaster, הפך למודל רב עוצמה לחקירת הבסיס המכניסטי של התקפים וטיפולים טובים יותר בהם. מוטציות זבובים רבות שזוהו גורמות לזחלים ולמבוגרים להפגין פעילות דמוית התקף בתגובה לגירוי חזק (חשמלי, מכני ו/או תרמי). רבות מהמוטציות הללו הן בגנים הומולוגיים לאלה התורמים לאפילפסיה גנטית אנושית (למשל, ערוץ Na+ מגודר מתח). כעת ניתן גם להחליף גן זבוב במקבילו האנושי הנושא בנוסף מוטציה הקשורה למחלה. לפיכך, הזבוב הצנוע הפך לאווטאר למודל מחלות אנושיות. מחקר זה מתאר שיטה מתאימה לשימוש בזחלי דרוזופילה עבור מסכי תרופות בתפוקה נמוכה עד בינונית כדי לזהות תרכובות ייחודיות, ואת המטרות שלהן, בעלות פוטנציאל נגד פרכוסים.
Introduction
אפילפסיה נותרה נטל בריאותי משמעותי, המשפיע על כ-1% מהאוכלוסייה ברחבי העולם. למרות שקיימות כיום למעלה מ-30 תרופות נגד פרכוסים (ASMs) לטיפול קליני, כשליש מהאנשים עם אפילפסיה נשארים עמידים לתרופות, כלומר הם אינם מגיבים היטבלטיפול תרופתי. התרופות הזמינות הן גם פליאטיביות בלבד, וככאלה, אינן מונעות אפילפטוגנזה, ואינן מספקות תרופה3. לפיכך, יש צורך קריטי לזהות טיפולים טובים יותר באפילפסיה. מחסום לפיתוח טיפולים יעילים יותר הוא זיהוי מטרות תרופתיות חדשות. ואכן, כמעט כל ה-ASMs הנוכחיים משפיעים על מטרות דומות: תעלות יונים, כולל תעלת הנתרן מגודרת המתח (Nav), והעברה עצבית מעכבת המתווכת על ידי חומצה γ-אמינו-בוטירית (GABA)4,5. מקובל כי המשך השימוש בשיטות מסורתיות לפיתוח תרופות לא צפוי לשנות תרחיש זה באופן קיצוני.
לחיות מודל מעבדה, כולל, אך לא רק, זבוב הפירות Drosophila melanogaster, ודג הזברה Danio rerio, יש תועלת לזיהוי ASMs חדשים 6,7,8. ואכן, חיפוש PubMed עבור 'דרוזופילה + התקף' מחזיר 342 תוצאות, בעוד שאותו חיפוש אחר דג הזברה מחזיר 578 תוצאות (שני החיפושים נערכו ב-29בינואר 2025). בעוד שמתגמד לעומת מספר המחקרים הדומים בעכברים (~15,000), מספר המחקרים המשתמשים במערכות מודל ממשיך לגדול. מחקרים אלה אפשריים בשל השימור המכניסטי של תפקוד מערכת העצבים המרכזית על פני פילה. יתר על כן, התקפים מושרים בזבובים ובדגים מטופלים ביעילות באמצעות ASMs בשימוש קליני, מה שמראה שבעוד שהניואנסים של התנהגות ההתקפים עשויים להיראות שונים כלפי חוץ, למנגנונים הבסיסיים יש הרבה במשותף 7,9,10.
זבוב הפירות, דרוזופילה, תרם תרומות מכוננות רבות להבנת הביולוגיה האנושית. ביחס לאפילפסיה, מערכת מודל זו מספקת ארגז כלים גנטי שאין שני לו בשילוב עם נוירונים ניתנים לזיהוי ונגישים לניסוי7. יתר על כן, החיבורים הן למערכת העצבים המרכזית של הזחל והן למערכת העצבים המרכזית הבוגרת פורסמו כעת, וזוהו קווי מניע גנטיים ספציפיים לתאיםרבים 11,12. באופן משמעותי, סוג של מוטציה זוהה באופן אקראי לפיו זבובים בוגרים מגיבים לגירוי מכני חזק על ידי אובדן יציבה ופעילות דמוית התקף (למשל, זמזום כנפיים, רעידות רגליים וכו'). סוג זה של מוטציות נקרא 'רגיש למפץ'13,14,15,16. מאז זוהתה סוג שני של מוטציה בהתקפים המגיבה לעלייה בטמפרטורה, המשקפת פרכוסי חום אנושיים17,18. עם זאת, יכולת המשיכה הניסיונית של זבובים בוגרים מופחתת במקצת בהשוואה לשלב הזחל של אותו מודל חרקים. לדוגמה, זה יכול להיות קשה להאכיל זבובים בוגרים באמצעות תרופות, וטכניקות פולשניות יותר כמו אלקטרופיזיולוגיה ואופטוגנטיקה יכולות להיות מאתגרות יותר. לעומת זאת, זחל הדרוזופילה אוכל כל הזמן כדי להגדיל את נפח גופו פי ~100 תוך 5 ימים בלבד כדי לאפשר התגלמות. לכן, אנו יכולים להיות בטוחים בהזנה תרופתית מספקת בשלבי הזחל. אמבריוגנזה מתועדת היטב וניתנת לבימוי מדויק, והיא זיהתה אבני דרך מרכזיות בהתפתחות מערכת העצבים המרכזית, כולל הרכישה הראשונה של תכונות חשמליות עצביות עד להיווצרות מעגלים19. לאחר הבקיעה, הזחל עובר 3 נמסים (או אינסטארים) עד שביום החמישי הוא הופך ל'נודד', ואז הוא עוזב את המזון כדי למצוא מקום בטוח להתגלם. אחרי ~100 שעות של התגלמות, זבוב בוגר מגיח עם גוף חדש ומערכת העצבים המרכזית (איור 1).
טכניקות לגרימת התקפים אצל מבוגרים אינן מתאימות היטב לשלבי הזחל. לזחלים חסרות שערות חושיות, שהפעלתן המסונכרנת במהלך גירוי מכני עלולה להוביל להתקף. לפיכך, כדי להתגבר על קשיים אלה, פותחה טכניקת הלם חשמלי כדי לגרום להתקפים בשלב הזחל הנודד. הניתוח ההשוואתי הבא של טכניקות אינדוקציה של התקפים הן בקרב זחלים והן בקרב מבוגרים מגלה כי הלם חשמלי של זחלים תלוי הרבה פחות בסוג המוטציה (למשל, רגישות למפץ לעומת טמפרטורה). לפיכך, אנו מציעים שטכניקה זו צריכה להיות השיטה המועדפת לבדיקת מוטציות חדשות שבהן שיטת השראת ההתקפים האופטימלית אינה ידועה20. טכניקת ההלם החשמלי של הזחלים היא פשוטה, מהירה ודורשת ציוד מינימלי. טכניקה זו מספקת אמצעי יעיל לסינון תרכובות חדשות, או טיפולים גנטיים, ליעילות נגד פרכוסים על פני מגוון מוטציות המשקפות את המגוון הגנטי של אפילפסיה אנושית.
Protocol
במחקר זה נעשה שימוש בזבוב הפירות, Drosophila melanogaster. טכניקה זו מתאימה ביותר לזחלי כוכב שלישי נודדים (L3). פרוטוקול הניסוי פשוט יחסית אך דורש תרגול כדי לשכלל אותו. מניסיוננו, סטודנטים חדשים דורשים כשבועיים כדי לשלוט בבדיקה ולהפיק תועלת רבה מצפייה בחוקרים אחרים, מנוסים יותר, מבצעים את הבדיקה בזמן אמת באמצעות מיקרוסקופ דיסקציה המופעל על ידי מצלמה או דומה. הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים.
1. בחירת זחלים
- יש לאסוף זחלים מדפנות בקבוקונים/בקבוקים המכילים מזון סטנדרטי (5 ליטר מים, 390 גרם גלוקוז, 360 גרם תירס, 250 גרם שמרים, 40 גרם אגר, 135 מ"ל ניפגין, 15 מ"ל חומצה פרופיונית).
- השתמש רק בזחלים שנעים באופן פעיל והשאירו את המזון לזחול במעלה דפנות המיכל (כוכב שלישי נודד, L3). אין לבחור טרום-גלמים, המציגים תנועה מופחתת מאוד.
2. הליך הלם חשמלי
- הסר L3 נודד בודד והעביר אותו לצלחת פטרי קטנה מפלסטיק (הגודל לא משנה), ושטוף אותו בעדינות עם ddH2O כדי להסיר שאריות מזון. מברשת קטנה (000) מתאימה לכך.
- העבירו את הזחל שנשטף יחיד, בעזרת מברשת, לכלי פלסטיק ריק (שוב, הגודל לא משנה). יבש את הזחל עם שבר קטן של מגבת נייר המוחזק במלקחיים. הסר עודפי ddH2O, אך אל תייבש לחלוטין את הזחלים כדי למנוע מהם להידבק לצלחת הפלסטיק.
- אפשר לזחל להתאושש במשך 30 שניות. זה יקל על מיקום קל של בדיקת ההלם החשמלי (ראה להלן).
- צפו בזחלים תחת מיקרוסקופ דיסקציה בעל הספק נמוך (15-20x), וברגע שהתנהגות הזחילה הרגילה מתחדשת, הניחו בעדינות את בדיקת ההלם החשמלי (ראו שלב 3 לפרטים ואיור 2A) על פני השטח הגביים הקדמיים של הזחל מעל המיקום המשוער של מערכת העצבים המרכזית (ראו איור 2C).
הערה: שלב זה הוא קריטי, יש להפעיל מספיק לחץ כדי לספק מוליכות טובה בין חוט הבדיקה לציפורן אך יש להקפיד לא לפגוע בזחלים. לפיכך, מועכים את הזחל בכשליש עד מחצית מעומקו. - הפעילו פולס של 2 שניות של מתח קבוע, שעוצמתו נקבעה מראש באמצעות עקומת טיטרציה (איור 3). כל ממריץ מתח מבודד מתאים כאן. זה שמשמש כאן מוצג באיור 2B.
- לאחר ההתחשמלות, הפעל טיימר. בתגובה להלם, הזחלים יוזמים שיתוק חולף ואחריו עוויתות מזדמנות של פעילות שרירי דופן הגוף והתנהגות גלגול, ועוצרים התנהגות זחילה רגילה.
- עצור את הטיימר כאשר הזחל התרחק בבירור ממיקומו המקורי על הצלחת. משך ההתקף, או זמן ההתאוששות (RT), מוגדר כתקופה שבין תחילת הגירוי לחידוש התנהגות הזחילה הרגילה (למשל, גל פריסטלטי מלא קדימה המביא לתנועה קדימה).
- בסוף כל יום, נקו בזהירות את חוטי הבדיקה על ידי שטיפתם תחילה ב-100% אתנול ואחריו ddH2O. בדוק בזהירות את החוטים בהגדלה ובמידת הצורך השתמש במלקחיים כדי לגרד בעדינות שאריות מהחוטים. היזהר מאוד לא לשנות את המרחק בין שני החוטים בעת ביצוע פעולה זו.
3. בניית בדיקת הלם חשמלי
- יידרשו אורכי חוט חשמל בגודל 2 x 1 מ' (צריכים להיות דקים וגמישים, כלומר מדורגים ל-~3 A). עד לקצה כל חוט, הלחמו חוט טונגסטן באורך 5 ס"מ (כדי למקסם את המגע, סובבו את חוט הטונגסטן סביב קצה חשוף של חוט החשמל לפני ההלחמה). מחברי הלחמה בדחיפה (למשל, תקעי בננה) לקצה השני של החוטים, מתאימים לחיבור קל לממריץ המתח.
- אבטח את שני חוטי הטונגסטן למחזיק אלקטרודה כך שהחוטים יהיו מקבילים זה לזה (איור 2). חלקים קטנים של נימי זכוכית (באורך ~2 ס"מ) משמשים להחזקת החוטים במקומם מתחת לבורג נעילת הבדיקה.
- השתמש במלקחיים כדי לכופף את החוטים כך שהם יגיעו לטווח של 1-2 מ"מ קרוב למקום שבו הם יוצאים ממחזיק החוט. כיפוף חוטי טונגסטן אינו קל מכיוון שהחוטים שומרים על 'זיכרון' - ולכן נדרשת התמדה. טיפים שיעזרו לתהליך זה כוללים שימוש בסרט בידוד חשמלי ו/או בלו-טאק (או שפכטל דוגמנות דומה) כדי לסייע בשמירה על החוטים בכיוון/מרחק הנכונים.
4. כיול בדיקה
- ודא שיש מלאי של L3 נודד מסוג בר מתאים (שליטה שלילית) ומוטציה של התקף (שליטה חיובית). יהיה צורך ב~100 מכל אחד.
- הכן זחלים, אחד בכל פעם, כמתואר לעיל.
- השתמש בבדיקה כדי להפעיל טווח מתחים על מספיק זחלים מכל גנוטיפ עבור כל מתח שנבדק. מוצע להחיל 0 וולט, 2 וולט, 4 וולט, 6 וולט, 8 וולט, 10 וולט ו-12 וולט למשך 2 שניות בין 10-15 זחלים למתח. חשמלו כל זחל פעם אחת בלבד.
- מדוד את זמן ההתאוששות עבור כל זחל וחשב את הממוצע עבור כל שלב מתח המופעל על שני הגנוטיפים.
- התווה את הממוצעים בגרף והתאם את הנתונים בקו ישר.
- בחר מתח עם הבדל ברור ומשמעותי בין מוטנט הבקרה לתפיסה. היזהר לא לבחור מתח המייצר זמן התאוששות ארוך מדי; אחרת, הפרודוקטיביות תיפגע בגלל זמן ההמתנה הארוך להתאוששות.
הערה: מחקר זה השתמש לעתים קרובות במתח גירוי המביא לזמן התאוששות של 50-100 שניות עבור סוג פרא ו-200-300 שניות עבור parabss. עקומות כיול לדוגמה מוצגות באיור 3. חשוב להשתמש ב-0 וולט כדי להסביר את פעולת לחיצת הגשושית על פני הגב של הזחל. זה יגרום למידה מסוימת של שיתוק, שהוא ככל הנראה מנגנון הגנה של הזחל.
5. ביצוע ניסויים
- זחל הלם חשמלי של הגנוטיפ הרצוי או חשיפה לתרופות ומדידת זמן ההחלמה מהתקף.
הערה: עבור זחלי בדיקה, n = 20 בדרך כלל מספיק, אך חישוב הספק המבוסס על ניתוח פיילוט יספק מספר n סופי יותר. - הפעל תמיד בקרה שלילית (למשל, סוג פראי) וחיובי (למשל, parabss) במהלך כל ניסוי. מספרי n לא צריכים להיות גבוהים; n = 5 מספיק. זה יספק ביטחון שהבדיקה עבדה כצפוי (למשל, אין בעיות עם הבדיקה או הממריץ).
- החל חתך (למשל, 300 שניות) כדי להימנע מזמני החלמה ארוכים מדי והתייחס רק להתקפים הניתנים לכימות כאלו עם זמני החלמה מעל 30 שניות.
6. בדיקת סמים
- מוסיפים תרופות, מומסות בממס מתאים, ישירות למשטח המזון ומניחים להיספג פנימה (ואם משתמשים באתנול, זמן לאידוי ממס). לחלופין, אפשר להוסיף תרופה (בממס מתאים) למזון זבובים מומס. עיין בסעיף התוצאות לפרטים.
- כדי להוסיף את התרופה למזון המומס, מוציאים מזון מבקבוקונים, ממיסים מחדש, וכשהמזון מתקרר ל-40 מעלות צלזיוס, מוסיפים את התרופה, מערבבים במיקסר מערבולת, ולאחר מכן מחזירים 5 מ"ל של מזון מומס בחזרה לבקבוקונים ומניחים להתקרר לפני השימוש.
- הפעל שיפוע ריכוז כדי לזהות את ריכוז התרופה האופטימלי.
הערה: נקודת התחלה טובה היא להוסיף תמיסת תרופות של 3 מ"מ ישירות למשטח המזון (200 מיקרוליטר לבקבוקון דרוזופילה סטנדרטי) או ליצור ריכוז של 3 מ"מ במזון מומס. ניתן לאפשר לנקבות בוגרות להטיל ביצים ישירות במזון זה, או להוסיף זחלים בשלבים נבחרים לפי הצורך. יש להוסיף את הממס/ים המשמשים לבד לבקבוקונים נבחרים כבקרות רכב.
תוצאות
מוטציות רבות של דרוזופילה מציגות התנהגות דמוית התקף מוגברת 7,20. הבסיס הגנטי של מוטציות אלה מגוון, מה שמחקה לטובה את הגורמים הגנטיים המגוונים באופן דומה לאפילפסיה אנושית. שלוש מהמוטציות הנחקרות ביותר בדרוזופילה הן parabangsenseless (parabss), התקף יוליוס (jus) ו-cal-shocked (eas). מוטציית parabss מביאה לעלייה בתפקוד של ערוץ Na+ משותק עם שער מתח, eas מקודד אתנולאמין קינאז, ו-jus הוא חלבון ממברנה שעדיין לא זוהה (שימו לב ש-jus נקרא slamdance עד לאחרונה)16,21,22. לרבים מהגנים הללו יש הומולוגים אנושיים. לדוגמה, שיתוק הוא הומולוג של גנים אנושיים Nav, שמוטציות שלהם מהוות גורם מוביל לאפילפסיה גנטית23. בדומה לאפילפסיה אנושית, שלוש המוטציות הללו של זבובים 'רגישים למפץ' מראות 'חומרה' דיפרנציאלית של התקפים בתגובה להלם חשמלי (איור 4). זמן ההחלמה הארוך ביותר (כלומר, התנהגות ההתקפים החמורה ביותר) מוצג על ידי parabss, בעוד ש-jus מציג את זמן ההחלמה הקצר ביותר. תגובה דיפרנציאלית זו, הנובעת ממוטציות גנטיות בסיסיות שונות, מאפשרת לנסיין לבדוק כיצד תרכובות עופרת עשויות להפחית התקפים על פני מגוון מוטציות כדי לזהות את אלה עם פעילות חיובית בספקטרום רחב.
ASMs רבים המשמשים במרפאה יעילים באותה מידה במודלים של התקפי דרוזופילה, ומכאן שמצביעים על כך שהמנגנונים הבסיסיים המייצרים התקפים בדרוזופילה דומים לאלה הגורמים להתקפים אצל אנשים עם אפילפסיה 9,24,25. איור 5 מציג את ההשפעה של שניים מ-ASMs הנפוצים ביותר מבחינה קלינית, נתרן ולפרואט (VPA) ופניטואין (PHY), כנגד parabss. הזחלים הורשו להאכיל אד ליביטום מה-ASM הכלול במזון (נוסף למזון מומס) ב-3 מ"מ במהלך כל התפתחות הזחל שלהם. בקרת רכב מסוג פרא (Canton-S, CS) ו-parabss (אתנול ומים, בהתאמה) נכללו בכל ניסוי, יחד עם parabss שהוזנו ב-ASM המתאים. ישנה ירידה ברורה ומשמעותית בזמן ההחלמה מהתקפים (RT) עבור שתי התרופות. בהתחשב בכך שגם סוג פרא וגם מוטציה ידועה בהתקף (parabss), ללא חשיפה ל-ASM, מציגים פעילות התקפים צפויה, אנו יכולים להיות בטוחים בתוקפם של שני הניסויים הללו. כאשר זה לא המקרה, יש להשליך את הבדיקות ולחזור על הניסוי. הסיבה הבסיסית ל'כישלון' כזה היא לעתים קרובות נזק לבדיקת ההלם החשמלי, עוצמת סוללה נמוכה של ממריץ ו/או חוסר ניסיון של הנסיין. יש להימנע גם מתחזוקת זבובים בטמפרטורות מתחת ל-25 מעלות צלזיוס (ראה סעיף דיון). בעוד שטכניקה זו אינה מתאימה להקרנה בתפוקה גבוהה, לאחרונה, נעשה בה שימוש במסך בעל תפוקה נמוכה של ~30 תרכובות כדי לזהות סוג חדש של כימיקלים המפחית ביעילות את ההתקפים באמצעות מניפולציה של Pumilio - מווסת של הומאוסטזיס עצבי. תרגום חיובי של אותן תרכובות להפחתת התקפים במודלים מוגדרים של התקפים בעכברים מראה פוטנציאל מרגש להמשך פיתוח הן של תרכובות העופרת והן של היעד החדש26,27.
בבחינת התוצאות המייצגות המוצגות כאן (איור 4 ואיור 5), ניכר כי קיימת שונות בהתפשטות הנתונים. יש גם הבדל צנוע בערך ה-wildtype בין הנתונים המוצגים בשני האיורים הללו. זו הסיבה שבדיקה זו היא איכותית ואינה מתאימה לזיהוי הבדלים קטנים בחומרת ההתקף, בין גנוטיפים או במבחני סינון תרופות. עם זאת, הבדיקה מתאימה היטב לזיהוי פנוטיפ התקף במוטציות לא ידועות ו/או לבדיקה ראשונית של תרכובות לפעילות נוגדת פרכוסים27. עם זאת, חידודים נוספים של פיתוח תרופות ידרשו בדיקות שונות.

איור 1: מחזור החיים של דרוזופילה . סכמטי המציג את מחזור החיים של דרוזופילה , מהעובר ועד הבוגר, דרך ההתגלמות. התזמונים המוצגים הם משוערים לפיתוח ב-25 מעלות צלזיוס. אנא לחץ כאן לצפייה בגרסה גדולה יותר של נתון זה.

איור 2: תכנון ומיקום של בדיקת ההלם החשמלי. (A) מציג תמונות של בדיקה מלמעלה ומהצד. Blu-tack שימש לשמירה על מרחק בין חוטים של ~2 מ"מ כאשר חוטי הטונגסטן נמשכים מהבדיקה. קטעים קצרים של נימי זכוכית (חץ) מחזיקים את חוטי הטונגסטן במקומם. חוטי החשמל המתחברים לממריץ מכוסים ומוחזקים לאורך ידית הבדיקה על ידי סרט בידוד חשמלי. (B) מציג ממריץ מבודד במתח קבוע מומלץ ששימש במחקר זה. (C) מראה את המיקום המשוער של הגשושית המגרה על פני השטח הגבי הקדמי של זחל כוכב שלישי נודד. שימו לב שחוטי הבדיקה משתרעים על פני גוף הזחל, והאזור שמעל למערכת העצבים המרכזית הוא ~2 מ"מ מרחק בין חוטים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
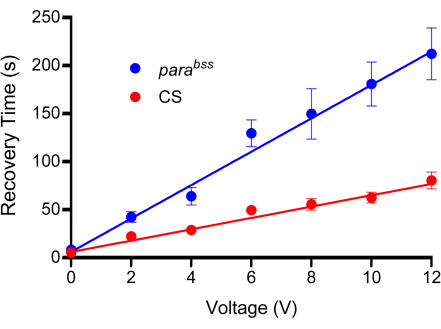
איור 3: עקומת כיול. לפני הניסויים, יש לקבוע מתח מתאים להלם חשמלי. כל הבדיקות יהיו שונות במקצת בשל אופי ייצורן. סוג פרא (במקרה זה Canton-S, CS) ומוטציה התקפית (מומלץ, parabss) נתונים לזעזועי מתח הולכים וגדלים, כל אחד מהם מוגדר למשך קבוע של 2 שניות. הזחלים מזדעזעים רק פעם אחת, ויש להשתמש במינימום של n = 10 עבור כל מתח שנבדק (במקרה זה, n = 12). ניכר מהתאמות הקו כי parabss מראים זמן התאוששות התקפים מוגבר בכל המתחים. המתח שנבחר אמור לייצר הבדל ברור ומשמעותי בין בקרות למוטציות התקף. בתרשים המוצג, ההבדלים מובהקים ב-6 וולט ומעלה (p ≤ 0.0001, ANOVA דו-כיווני עם ההשוואות המרובות של שידאק, n = 12, לכל גנוטיפ ומתח). לפיכך, 6 וולט נבחר כמתח האופטימלי עבור בדיקה זו, מכיוון שהוא ייצר הבדל משמעותי, אך זמן ההתאוששות נשמר קצר, מה שמפחית את הזמן שלוקח לבצע מכות חשמל בודדות. הנתונים מוצגים כממוצע ± SEM. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
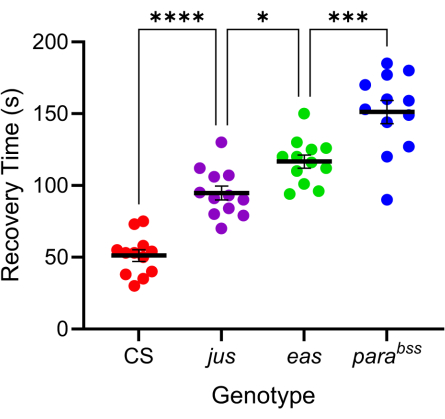
איור 4: מוטציות שונות של דרוזופילה מציגות רמות שונות של חומרת התקפים. באמצעות הגשושית המכוילת באיור 3, שלושה מוטציות של התקפי דרוזופילה (parabss, jus ו-eas), יחד עם סוג פרא (CS), היו נתונים להלם חשמלי (6 V, 2 שניות). זחלים בודדים נדהמו רק פעם אחת. זמני ההתאוששות מהתקפים גדולים יותר עבור מוטציות התקפים מאשר מסוג פרא וגדלים בהדרגה מ-jus ל-parabss (p ≤ 0.0001, בהתאמה, ANOVA חד-כיווני עם ההשוואות המרובות של Tukey). השוואות מובהקות סטטיסטית מההשוואות המרובות של טוקי מסומנות כ-****p ≤-0.0001, ***p ≤-0.001, **p ≤-0.01, *p ≤-0.05. הנתונים מוצגים כממוצע ± SEM. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
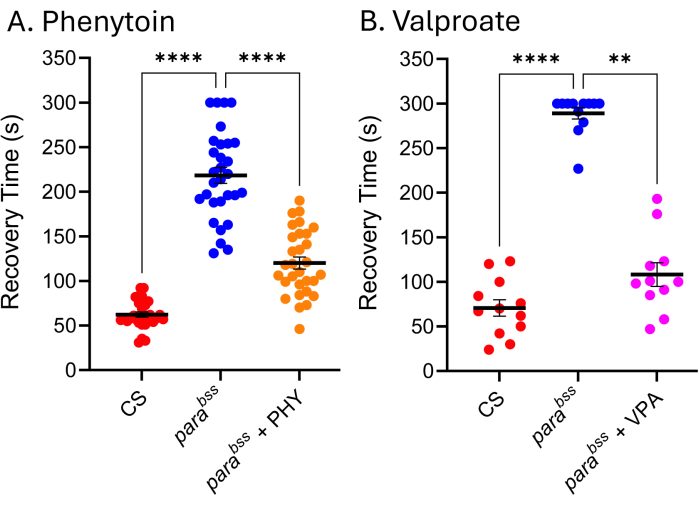
איור 5: מוטציות של התקפי דרוזופילה מגיבות ל-ASMs בשימוש קליני. חשיפה ל-(A) פניטואין (PHY) ו-(B) נתרן ולפרואט (VPA) (3 מ"מ, בהתאמה) הפחיתה משמעותית את זמן ההתאוששות מהתקפים של parabss (p ≤ .01, Kruskal-Wallis עם השוואות מרובות של דאן, ו-p ≤.0001, ANOVA חד-כיווני עם ההשוואות המרובות של Tukey, בהתאמה). רק זמני התאוששות מעל 30 שניות נחשבו לתפיסה ניתנת לכימות, ונעשה שימוש בחתך של 300 שניות במבחנים אלה. כל בדיקת תרופה נערכה על ידי נסיין אחר; לפיכך, זמני ההחלמה הממוצעים המוצגים שונים (ניכר במיוחד עבור ParaBSS ללא תרופה). זה מדגיש את העובדה שבדיקה זו היא איכותית, ולכן יש לכלול מוטציה מסוג בר והתקף בכל בדיקה. זה יכול לאפשר לנרמל את פעילות התרופות בין ניסויים במידת הצורך. השוואות מובהקות סטטיסטית מההשוואות המרובות של דאן וטוקי מסומנות כ-****p ≤-0.0001, ***p ≤-0.001, **p ≤-0.01, *p ≤-0.05. הנתונים מוצגים כממוצע ± SEM. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
שיטת ההלם החשמלי לגרימת התקף בזחלי דרוזופילה מספקת מסך פשוט אך יעיל לזיהוי תרכובות נוגדות פרכוסים חדשות או מניפולציות גנטיות. עם זאת, מכיוון שמדובר בבדיקה איכותית, המגבלה העיקרית שלה היא שהשיטה אינה יכולה לזהות בקלות גדלי אפקט קטנים. עם זאת, התפוקה הבינונית שהיא מאפשרת, המתאימה לסינון של עד ~5 תרכובות בשבוע, לכל חוקר, מספקת בדיקה חזקה מאוד של בעלי חיים שלמים. הפשטות של הטכניקה מתאימה גם לפרויקטי מעבדה ברמת תואר ראשון. לפיכך, 3-4 חוקרים יכולים לסנן תרכובות רבות בפרק זמן קצר יחסית, ובהוצאה נמוכה בהרבה משימוש בבדיקת התקפים מקבילה בעכברים. אוטומציה של הבדיקה תגדיל עוד יותר את התפוקה. עם זאת, מחקר זה לא הצליח לעשות זאת. אגר המכיל ליתיום עם שתי אלקטרודות משובצות בתוך האגר ניסה לחשמל מספר זחלים בו זמנית, אך ללא הצלחה. שיטות אחרות, אולי מבוססות על אופטוגנטיקה, עשויות להתאים יותר לאוטומציה28.
עם זאת, פשטות הבדיקה מערערת את הדרישה להיות מיומן. מיקום הגשושית והלחץ המופעל במהלך ההלם החשמלי הם שלבים קריטיים. עקביות בשניהם מפחיתה את השונות בין זמני ההחלמה של זחלים בהלם. הנושא העיקרי השני הוא כיצד לזהות את נקודת הקצה של ההתקף, מה שהופך את הבדיקה הזו לאיכותית מכיוון שהיא תלויה מתי חוקר בודד בוחר לעצור את השעון. כאשר מספר נסיינים באותה מעבדה עורכים את הניסויים הללו, כדאי להקדיש זמן לצפייה באותם זעזועים של זחלים כדי להסכים מהי נקודת הקצה של ההתקף. פעולה זו מפחיתה מאוד את השונות בין אנשים. עם זאת, עדיין ברור מהתוצאות המופתיים המוצגות בדוח זה כי בעוד שההשפעות קבועות, התזמונים יכולים להשתנות בין הנסיינים. חשוב גם לציין שהתפתחות הזחלים בטמפרטורות מתחת ל-25 מעלות צלזיוס (למשל, 18 מעלות צלזיוס) מפחיתה את חומרת ההתקפים עקב ירידה בפעילות העצבית במהלך תקופה קריטית עוברית29. לפיכך, מוצע להשתמש במינימום של 25 מעלות צלזיוס להתפתחות עוברית/זחל. רצוי שתהיה חממה קרוב לשולחן העבודה, ורק מספיק זחלים מוסרים כנדרש לכל שוק חשמלי. יש לשמור את הזחלים הנותרים בטמפרטורה של 25 מעלות צלזיוס עד הצורך. בעזרת תרגול, הנסיינים יכולים לזעזע עד 4 זחלים בכל פעם, תוך ריווח הזעזועים במרווחים של 10 שניות. גישה זו מזרזת מאוד את ההתקדמות, וניתן להשיג n של 40 זחלים (או יותר) ביום אחד. הלחות לא נמדדה או נשלטה במהלך מחקר זה. נבחר מחזור אור-חושך סטנדרטי של 12:12, אך ניתן לשנות אותו לפי רצון הנסיין.
ייצור בדיקה הוא החלק המאתגר ביותר בשיטה זו. לפיכך, לאחר שנעשה, יש להקפיד מאוד לא לפגוע בו. כל נזק שייגרם לבדיקת ההלם החשמלי יגרור לרוב תיקון, ולכן, יש לכייל מחדש את הגשושית כדי לקבוע את המתח האופטימלי. המתח תלוי לחלוטין במרחק בין שני החוטים, וככזה, סביר להניח ששני בדיקות לא יהיו זהים. רצוי לכייל מחדש בדיקה מדי חודש כדי להבטיח שהמתח האופטימלי לא השתנה. עוצמת ההלם החשמלי תלויה הן במתח המופעל והן במשך המתח. לפיכך, משכי זמן קצרים יותר עם מתחים גבוהים יותר ככל הנראה ייצרו את אותה תגובה כמו משכי זמן ארוכים יותר, תוך שימוש בגירוי מתח חלש יותר. עם זאת, מרחב זה לא נחקר. ההעדפה למשך 2 שניות (במחקר זה) מותאמת בקלות ללא תנועה מיותרת של הזחלים בהלם. זה מאפשר חוזק מתח נמוך יחסית, המונע נזק לקוטיקולה של הזחל. השפעת הגירוי תהיה תלויה גם בעוצמת הזרם (אמפר), שאיננו מודדים. עם זאת, ממריצים שונים ייצרו אמפרים שונים, וכך, נמצא כי באמצעות ממריץ Grass S8825, נעשה שימוש במתח של 50 וולט/3 שניות, תוך שימוש בסטימולטור המשמש כאן, נעשה שימוש ב-6-12 וולט / 2 שניות, תלוי בבדיקה בה נעשה שימוש. המתח/משך הזמן בפועל בשימוש אינו חשוב מדי כל עוד הוא מספיק כדי לגרום לזמן התאוששות ארוך יותר מבקרת טבע ואינו גורם נזק לזחל. מכיוון שהפעולה של הנחת בדיקה על זחל (תוך שימוש ב-0 V כבקרה) גורמת למידה מסוימת של הקפאה/שיתוק (המעיד על ניסיון להימנע מטריפה), אין קריטריונים לגירוי שלא יגרמו להתנהגות "דמוית התקף" כלשהי.
בדיקת ההלם החשמלי מתאימה לסריקת תרופות לפעילות נוגדת פרכוסים. בעיה היא תמיד סולבנטית. נמצא כי אתנול או אצטון הם ממיסים טובים יותר מ-DMSO. בניסויים הנוכחיים, DMSO נסבל עד ~1%, מעבר לכך נצפתה קטלניות בלתי מקובלת בזחלים מתפתחים. מבין שתי האפשרויות לחשוף את הזחל לתרופות, או להוסיף תרופה (מומסת בממס מתאים) לחלק העליון של בקבוקון מזון או להוסיף למזון זבובים מומס, נמצא כי האחרונה מניבה תוצאות טובות יותר מבחינת שונות מופחתת. עם זאת, ההבדל הוא שולי, והשיטה הראשונה מהירה יותר. מומלץ לנסיינים להשוות בין שתי השיטות ולבחור את המתאימה ביותר. ניתן לאפשר לזבובים להטיל ביצים על מזון המכיל תרופות, כך שכל התפתחות הזחלים נחשפת לחפירה. לחלופין, ניתן להניח זחלים על מזון המכיל תרופות בכל שלב רצוי כדי לזהות את התזמון הקריטי של פעילות התרופה. האכלת תרופות לנקבות היא שיטה יעילה לחשיפת עוברים מתפתחים לתרופות25.
בדיקת התקפים חלופית ונפוצה היא השימוש בעוברי דג זברה שנחשפו לפנטילנטטרזול הפרו-פרכוסי כדי לסנן ASMs30. לדעתנו, לבדיקת הזחל של דרוזופילה יתרונות רבים. אלה כוללים (1) תרכובות רבות קשות להמסה במי הים המלאכותיים שהדגים שוחים בהם; (2) בדיקת דג הזברה מסתמכת על הפחתת אורך השחייה, שיכולה להתרחש מחשיפה ל-ASM או, בניגוד לאינטואיציה, תרכובת פרו-פרכוסית. הסיבה לכך היא שפעילות התקפים מוגברת בדגי הזברה מביאה גם לשחייה מופחתת10. לפיכך, יש לעקוב אחר כל פגיעה מורכבת במסך משני, שלעתים קרובות דורש מדידה של גנים עצביים הניתנים להשראה מוקדמת כגון c-fos; (3) ניתן להשתמש בדגים רק ללא רישיון בעל חיים עד היום החמישי לאחר הבקיעה. כמובן, לדגי הזברה יש יתרון מובהק על פני חרקים בכך שהנוירוטרנסמיטר המעורר העיקרי שלהם הוא גלוטמט ולא אצטילכולין31. שילוב של שתי הבדיקות, החל מדרוזופילה ואחריו דג הזברה, עשוי לספק מסך חזק מאוד לפני שפחות תרכובות פגיעה ייבדקו בעכברים.
לסיכום, בדיקת ההלם החשמלי של זחלי דרוזופילה , יחד עם השימור הגבוה בגנטיקה ובפיזיולוגיה המשותפת בין זבובים ויונקים, מספקת מסך יעיל מאוד, מהיר וזול לזיהוי טיפולים חדשים נגד פרכוסים. אימוץ מוגבר של חרק זה לבדיקת תרופות יענה גם על הצורך הדחוף להפחית את מספר בעלי החיים מסדר גבוה המשמשים למחקר רפואי.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
אנו מודים לאנשי המעבדה הרבים של ביינס שפיתחו במשותף את הטכניקה הזו במשך שנים רבות, ובמיוחד לריצ'רד מארלי, שהשקיע מאמצים רבים כדי להפוך את הטכניקה הזו לחזקה ואמינה. אנו מודים ל-Anna Munro על ציור הזחלים, שמוצג באיור 2. העבודה במעבדת ביינס שתרמה לפיתוח טכניקה זו נתמכה בנדיבות על ידי BBSRC, MRC וקרן וולקאם. עבודה זו נתמכת כיום על ידי מימון מפרס החוקר של Wellcome Trust ל-R.A.B. (מענק 217099/Z/19/Z). פיתוח טכניקה זו נהנה גם ממתקן הזבוב של מנצ'סטר, שהוקם באמצעות כספים מהאוניברסיטה וקרן וולקאם (מענק 087742/Z/08/Z).
Materials
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
References
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved