Method Article
Attività convulsiva indotta dall'elettroshock nelle larve di Drosophila
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio l'uso delle larve di Drosophila per identificare composti anticonvulsivanti unici per il trattamento dell'epilessia.
Abstract
L'epilessia presenta un carico di salute significativo che è esacerbato da un numero elevato di individui refrattari ai farmaci. Mentre alcuni pazienti refrattari ai farmaci rispondono a trattamenti non farmacologici (ad esempio, stimolazione del nervo vagale, dieta chetogenica, ecc.), l'ultima risorsa per molti è un intervento chirurgico impegnativo e costoso per fornire sollievo dalle convulsioni. Sebbene sia generalmente riconosciuto che sono necessari farmaci antiepilettici con una gamma più ampia di bersagli, l'ostacolo per raggiungere questo obiettivo è l'identificazione di nuovi bersagli farmacologici. Gli animali modello geneticamente trattabili sono promettenti in questo senso. Il moscerino della frutta, Drosophila melanogaster, è diventato un potente modello per studiare le basi meccanicistiche e i migliori trattamenti per le convulsioni. Molte mutazioni identificate delle mosche provocano larve e adulti che mostrano un'attività simile a una crisi epilettica in risposta a una forte stimolazione (elettrica, meccanica e/o termica). Molte di queste mutazioni si trovano in geni omologhi a quelli che contribuiscono alle epilessie genetiche umane (ad esempio, il canale Na+ voltaggio-dipendente). Ora è anche possibile sostituire un gene di mosca con il suo equivalente umano che, inoltre, porta una mutazione correlata alla malattia. Così, l'umile mosca è diventata un avatar per modellare la malattia umana. Questo studio descrive un metodo adatto per utilizzare le larve di Drosophila per screening farmacologici a basso e medio rendimento per identificare composti unici e i loro bersagli che hanno un potenziale anticonvulsivo.
Introduzione
L'epilessia rimane un onere sanitario significativo, che colpisce circa l'1% della popolazione mondiale. Anche se ora esistono oltre 30 farmaci anticonvulsivanti (ASM) per il trattamento clinico, circa un terzo delle persone con epilessia rimane refrattario ai farmaci, il che significa che non rispondono bene al trattamento farmacologico 1,2. I farmaci disponibili sono anche solo palliativi e, come tali, non prevengono l'epilettogenesi, né forniscono una cura3. Pertanto, c'è un bisogno critico di identificare migliori trattamenti per l'epilessia. Un ostacolo allo sviluppo di trattamenti più efficaci è l'identificazione di nuovi bersagli farmacologici. Infatti, quasi tutti gli attuali ASM influenzano bersagli simili: i canali ionici, incluso il canale del sodio voltaggio-dipendente (Nav), e la neurotrasmissione inibitoria mediata dall'acido γ-aminobutirrico (GABA)4,5. È generalmente accettato che l'uso continuato di metodi tradizionali di sviluppo di farmaci è improbabile che cambi radicalmente questo scenario.
Gli animali modello di laboratorio, tra cui, ma non solo, il moscerino della frutta Drosophila melanogaster e il pesce zebra Danio rerio, sono utili per l'identificazione di nuovi ASM 6,7,8. Infatti, una ricerca su PubMed per "Drosophila + sequestro" restituisce 342 risultati, mentre la stessa ricerca per zebrafish restituisce 578 risultati (entrambe le ricerche sono state condotte il 29gennaio 2025). Sebbene sminuito dal numero di studi simili sui topi (~15.000), il numero di studi che utilizzano sistemi modello continua a crescere. Questi studi sono possibili grazie alla conservazione meccanicistica della funzione del SNC nei phyla. Inoltre, le convulsioni indotte nelle mosche e nei pesci sono trattate efficacemente con ASM clinicamente utilizzati, dimostrando che mentre le sfumature del comportamento convulsivo possono apparire esternamente diverse, i meccanismi sottostanti hanno molto in comune 7,9,10.
Il moscerino della frutta, Drosophila, ha dato molti contributi fondamentali alla comprensione della biologia umana. Per quanto riguarda l'epilessia, questo sistema modello fornisce una cassetta degli attrezzi genetica senza precedenti combinata con neuroni identificabili e accessibili sperimentalmente7. Inoltre, i connettomi sia per il SNC larvale che per quello adulto sono stati ora pubblicati e sono state identificate numerose linee driver genetiche cellulo-specifiche11,12. Significativamente, è stata identificata una classe di mutazioni in cui i moscerini adulti rispondono a una forte stimolazione meccanica con una perdita di postura e un'attività simile a una crisi epilettica (ad esempio, ronzio delle ali, scuotimento delle gambe, ecc.). Questa classe di mutazioni è stata definita "bang-sensibile"13,14,15,16. Da allora è stata identificata una seconda classe di mutazioni convulsive che risponde all'aumento della temperatura, rispecchiando le convulsioni febbrili umane17,18. Tuttavia, la trattabilità sperimentale delle mosche adulte è in qualche modo ridotta rispetto allo stadio larvale di questo stesso modello di insetto. Ad esempio, può essere difficile nutrire con i farmaci le mosche adulte e tecniche più invasive come l'elettrofisiologia e l'optogenetica possono essere più impegnative. Al contrario, la larva di Drosophila mangia costantemente per espandere il suo volume corporeo di ~100 volte in soli 5 giorni per consentire l'impupamento. Pertanto, possiamo essere sicuri di un'adeguata alimentazione farmacologica negli stadi larvali. L'embriogenesi è ben documentata e può essere accuratamente stadiata e, a sua volta, ha identificato pietre miliari chiave nello sviluppo del SNC, tra cui la prima acquisizione di proprietà elettriche neuronali fino alla formazione del circuito19. Una volta schiusa, una larva passa attraverso 3 mute (o stadi) fino a quando, il giorno 5, diventa "vagabonda", dopodiché lascia il cibo per trovare un posto sicuro dove impuparsi. Dopo ~100 h di impupamento, emerge una mosca adulta con un nuovo corpo e un nuovo SNC (Figura 1).
Le tecniche per indurre le convulsioni negli adulti non sono adatte agli stadi larvali. Le larve mancano di peli sensoriali, la cui attivazione sincronizzata durante la stimolazione meccanica può portare a un attacco. Così, per superare queste difficoltà, è stata sviluppata una tecnica di elettroshock per indurre convulsioni allo stadio larvale vagante. La successiva analisi comparativa delle tecniche di induzione delle convulsioni sia nelle larve che negli adulti rivela che l'elettroshock larvale dipende molto meno dal tipo di mutazione (ad esempio, sensibile al bang rispetto alla temperatura). Pertanto, suggeriamo che questa tecnica dovrebbe essere il metodo preferito per testare nuove mutazioni in cui il metodo di induzione ottimale delle crisi è sconosciuto20. La tecnica dell'elettroshock larvale è semplice, rapida e richiede un'attrezzatura minima. Questa tecnica fornisce un mezzo efficiente per lo screening di nuovi composti, o terapie genetiche, per l'efficacia anticonvulsiva in una serie di mutazioni che rispecchiano la diversità genetica dell'epilessia umana.
Protocollo
In questo studio viene utilizzato il moscerino della frutta, Drosophila melanogaster. Questa tecnica è più adatta alle larve vaganti del terzo stadio (L3). Il protocollo sperimentale è relativamente semplice ma richiede pratica per essere perfezionato. Nella nostra esperienza, i nuovi studenti impiegano circa 2 settimane per padroneggiare il test e traggono grandi vantaggi dalla visualizzazione di altri ricercatori più esperti che eseguono il test in tempo reale utilizzando un microscopio da dissezione abilitato a fotocamera o simili. I reagenti e le attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Selezione larvale
- Raccogliere le larve dai lati di fiale/bottiglie contenenti cibo standard (5 L di acqua, 390 g di glucosio, 360 g di mais, 250 g di lievito, 40 g di agar, 135 mL di nipagina, 15 mL di acido propionico).
- Utilizzare solo larve che si muovono attivamente e hanno lasciato che il cibo strisciasse sui lati del contenitore (terzo stadio errante, L3). Non selezionare pre-pupe, che mostrano una locomozione notevolmente ridotta.
2. Procedura di elettroshock
- Rimuovi un singolo L3 vagante e trasferiscilo in una piccola capsula di Petri di plastica (le dimensioni non contano) e lavalo delicatamente con ddH2O per rimuovere i residui di cibo. Un piccolo pennello (000) è adatto a questo.
- Trasferisci la larva lavata da una sola, usando un pennello, in un piatto di plastica vuoto (di nuovo, le dimensioni non contano). Asciugare la larva con un piccolo frammento di carta assorbente tenuto con una pinza. Rimuovere l'eccesso di ddH2O, ma non asciugare completamente le larve per evitare che si attacchino al piatto di plastica.
- Lasciare che la larva si riprenda per 30 s. Ciò faciliterà il posizionamento della sonda per elettroshock (vedi sotto).
- Osservate le larve con un microscopio da dissezione a bassa potenza (15-20x) e, una volta ripreso il normale comportamento strisciante, posizionate delicatamente la sonda per elettroshock (vedere il passaggio 3 per i dettagli e la Figura 2A) sulla superficie dorsale anteriore della larva sopra la posizione approssimativa del SNC (vedere la Figura 2C).
NOTA: Questo passaggio è fondamentale, è necessario applicare una pressione sufficiente per fornire una buona conduttività tra il filo della sonda e la cuticola, ma fare attenzione a non danneggiare le larve. Quindi, schiaccia la larva da circa un terzo alla metà della sua profondità. - Applicare un impulso di 2 s di tensione costante, la cui intensità è stata predeterminata tramite una curva di titolazione (Figura 3). Qualsiasi stimolatore di tensione isolato è adatto qui. Quello utilizzato qui è mostrato nella Figura 2B.
- Dopo la scossa elettrica, avviare un timer. In risposta allo shock, le larve iniziano una paralisi transitoria seguita da spasmi occasionali dell'attività muscolare della parete corporea e del comportamento di rotolamento, interrompendo il normale comportamento di gattonamento.
- Arrestare il timer quando la larva si è chiaramente allontanata dalla sua posizione originale sul piatto. La durata delle crisi, o tempo di recupero (RT), è definita come il periodo tra l'inizio dello stimolo e la ripresa del normale comportamento di gattonamento (ad esempio, un'onda peristaltica completa in avanti che si traduce in un movimento in avanti).
- Alla fine di ogni giornata, pulire accuratamente i fili della sonda sciacquandoli prima con etanolo al 100% seguito da ddH2O. Ispezionare attentamente i fili sotto ingrandimento e, se necessario, utilizzare una pinza per raschiare delicatamente eventuali residui dai fili. Fare molta attenzione a non alterare la distanza tra i due fili quando lo si fa.
3. Costruzione della sonda per elettroshock
- Saranno necessarie 2 lunghezze di cavo elettrico da 1 m (devono essere sottili e flessibili, cioè classificate per ~3 A). All'estremità di ciascun filo, saldare un filo di tungsteno lungo 5 cm (per massimizzare il contatto, avvolgere il filo di tungsteno attorno a un'estremità esposta del cavo elettrico prima della saldatura). Saldare i connettori a innesto (ad es. spine a banana) all'altra estremità dei fili, adatti per un facile collegamento allo stimolatore di tensione.
- Fissare entrambi i fili di tungsteno a un portaelettrodo in modo che i fili siano paralleli tra loro (Figura 2). Piccole sezioni di capillari di vetro (~2 cm di lunghezza) vengono utilizzate per tenere i fili in posizione sotto la vite di blocco della sonda.
- Utilizzare una pinza per piegare i fili in modo che arrivino a una distanza massima di 1-2 mm dal punto in cui escono dal portafilo. Piegare i fili di tungsteno non è facile perché i fili conservano una "memoria", quindi è necessaria perseveranza. I suggerimenti per aiutare questo processo includono l'uso di nastro isolante elettrico e/o blu-tack (o stucco per modellazione simile) per aiutare a mantenere i fili nel corretto orientamento/distanza.
4. Calibrazione della sonda
- Assicurarsi che vi siano scorte di L3 errante di tipo selvatico adatto (controllo negativo) e di un mutante convulsivo (controllo positivo). Saranno necessari ~100 di ciascuno.
- Prepara le larve, una alla volta, come descritto sopra.
- Utilizzare la sonda per applicare un intervallo di tensioni a larve sufficienti di ciascun genotipo per ogni voltaggio testato. Si suggerisce di applicare 0 V, 2 V, 4 V, 6 V, 8 V, 10 V e 12 V per 2 s tra 10-15 larve per tensione. Scuote ogni larva solo una volta.
- Misurare il tempo di recupero per ogni larva e calcolare la media per ogni fase di tensione applicata per entrambi i genotipi.
- Traccia le medie su un grafico e adatta i dati con una linea retta.
- Selezionare una tensione con una differenza chiara e significativa tra il mutante di controllo e quello convulsivo. Fare attenzione a non scegliere una tensione che produca un tempo di recupero troppo lungo; In caso contrario, la produttività ne risentirà a causa dei lunghi tempi di attesa per la ripresa.
NOTA: Questo studio ha spesso utilizzato una tensione di stimolazione che si traduce in un tempo di recupero di 50-100 s per il tipo selvatico e di 200-300 s per parabss. Le curve di calibrazione esemplificative sono mostrate nella Figura 3. È importante utilizzare 0 V per tenere conto dell'atto di premere la sonda sulla superficie dorsale di una larva. Ciò causerà un certo grado di paralisi, che è probabilmente un meccanismo di difesa della larva.
5. Esecuzione di esperimenti
- Larva di elettroshock del/i genotipo/i desiderato/i o dell'esposizione al farmaco e misurare il tempo di recupero dalle crisi.
NOTA: Per le larve di prova, un n = 20 è solitamente sufficiente, ma un calcolo della potenza basato su un'analisi pilota fornirà un numero n più definitivo. - Esegui sempre un controllo negativo (ad esempio, un tipo selvaggio) e uno positivo (ad esempio, parabss) durante ogni esperimento. Non è necessario che i numeri n siano alti; n = 5 è sufficiente. In questo modo si avrà la certezza che il test abbia funzionato come previsto (ad esempio, nessun problema con la sonda o lo stimolatore).
- Applicare un cut-off (ad esempio, 300 s) per evitare tempi di recupero troppo lunghi e considerare solo le crisi quantificabili come quelle con tempi di recupero superiori a 30 s.
6. Screening antidroga
- Aggiungere i farmaci, disciolti in un solvente appropriato, direttamente sulla superficie del cibo e lasciarli in ammollo (e se si utilizza l'etanolo, il tempo per l'evaporazione del solvente). O, in alternativa, si può aggiungere un farmaco (in un solvente appropriato) al cibo per mosche sciolto. Per ulteriori informazioni, vedere la sezione Risultati.
- Per aggiungere il farmaco al cibo fuso, estrarre il cibo dalle fiale, riscioglierlo e, mentre il cibo si raffredda a 40 °C, aggiungere il farmaco, mescolare con il miscelatore a vortice, quindi versare nuovamente 5 ml di cibo fuso nelle fiale e lasciare raffreddare prima dell'uso.
- Esegui un gradiente di concentrazione per identificare la concentrazione ottimale del farmaco.
NOTA: Un buon punto di partenza è aggiungere 3 mM di soluzione farmacologica direttamente sulla superficie dell'alimento (200 μl per flaconcino standard di Drosophila ) o ottenere una concentrazione di 3 mM nel cibo fuso. Le femmine adulte possono essere autorizzate a deporre le uova direttamente in questo alimento, oppure le larve possono essere aggiunte in fasi selezionate, se necessario. Il solvente o i solventi utilizzati devono essere aggiunti da soli ai flaconcini selezionati come controllo del veicolo.
Risultati
Numerose mutazioni di Drosophila mostrano un comportamento simile a un aumento delle convulsioni 7,20. La base genetica di queste mutazioni è varia, il che imita favorevolmente le cause genetiche altrettanto varie dell'epilessia umana. Tre delle mutazioni più studiate della Drosophila sono parabangsenseless (parabss), julius seizure (jus) e easy-shocked (eas). La mutazione parabss provoca un guadagno di funzione del canale paralitico del Na+ voltaggio-dipendente, eas codifica per l'etanolammina chinasi e jus è una proteina di membrana non ancora identificata (si noti che jus era chiamata slamdance fino a poco tempo fa)16,21,22. Molti di questi geni hanno omologhi umani. Ad esempio, la paralisi è un omologo dei geni Nav umani, le cui mutazioni sono una delle principali cause di epilessia genetica23. Come per l'epilessia umana, queste tre mutazioni "sensibili al bang" mostrano una "gravità" differenziale delle crisi in risposta alla scossa elettrica (Figura 4). Il tempo di recupero più lungo (cioè il comportamento convulsivo più grave) è mostrato da parabss, mentre jus mostra il tempo di recupero più breve. Questa risposta differenziale, dovuta a diverse mutazioni genetiche sottostanti, consente a uno sperimentatore di testare come i composti guida potrebbero ridurre le convulsioni in una serie di mutazioni per identificare quelle con attività ad ampio spettro favorevole.
Molti ASM utilizzati in clinica sono ugualmente efficaci nei modelli di crisi epilettiche di Drosophila, indicando quindi che i meccanismi sottostanti che producono convulsioni in Drosophila sono simili a quelli che provocano convulsioni nelle persone con epilessia 9,24,25. La Figura 5 mostra l'effetto di due degli ASM più utilizzati clinicamente, il valproato di sodio (VPA) e la fenitoina (PHY), contro i parabss. Alle larve è stato permesso di nutrirsi ad libitum con l'ASM contenuto nel cibo (aggiunto al cibo fuso) a 3 mM durante il loro intero sviluppo larvale. In ogni esperimento sono stati inclusi il controllo del veicolo alimentato con parabss (etanolo e acqua, rispettivamente) di tipo selvatico (Canton-S, CS) e il controllo del veicolo alimentato con para bss (etanolo e acqua, rispettivamente), insieme al rispettivo ASM alimentato da parabss. C'è una chiara e significativa riduzione del tempo di recupero dalle crisi (RT) per entrambi i farmaci. Dato che sia il wild type che una mutazione convulsiva nota (parabss), senza esposizione all'ASM, mostrano un'attività convulsiva attesa, possiamo essere sicuri della validità di questi due esperimenti. In caso contrario, i saggi devono essere scartati e l'esperimento deve essere ripetuto. La causa alla base di tale "guasto" è spesso il danneggiamento della sonda dell'elettroshock, la bassa carica della batteria dello stimolatore e/o l'inesperienza dello sperimentatore. Dovrebbe essere evitato anche il mantenimento di mosche a temperature inferiori a 25 °C (vedi sezione di discussione). Sebbene questa tecnica non sia adatta allo screening ad alto rendimento, recentemente è stata utilizzata in uno screening a basso rendimento di ~ 30 composti per identificare una nuova classe di sostanze chimiche che riduce efficacemente le convulsioni attraverso la manipolazione di Pumilio, un regolatore dell'omeostasi neuronale. Una traduzione positiva di questi stessi composti per ridurre il sequestro in modelli murini definiti mostra un potenziale entusiasmante per un ulteriore sviluppo sia dei composti guida che del nuovo bersaglio 26,27.
Esaminando i risultati rappresentativi qui mostrati (Figura 4 e Figura 5), è evidente che esiste variabilità all'interno della diffusione dei dati. C'è anche una modesta differenza nel valore del tipo jolly tra i dati presentati in queste due figure. Questo è il motivo per cui questo test è qualitativo e non adatto a identificare piccole differenze nella gravità delle crisi, sia tra i genotipi che nei test di screening farmacologico. Tuttavia, il test è adatto per identificare un fenotipo convulsivo in mutazioni sconosciute e/o per testare inizialmente i composti per l'attività anticonvulsiva27. Ulteriori perfezionamenti dello sviluppo di farmaci, tuttavia, richiederebbero saggi diversi.

Figura 1: Ciclo di vita della Drosophila . Uno schema che mostra il ciclo di vita della Drosophila , dall'embrione all'adulto, passando per l'impupamento. I tempi indicati sono approssimativi per lo sviluppo a 25 °C. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Progettazione e posizionamento della sonda per elettroshock. (A) mostra le immagini di una sonda sia dall'alto che dal lato. Il blu-tack è stato utilizzato per mantenere una distanza tra i fili di ~2 mm poiché i fili di tungsteno si estendono dalla sonda. Brevi sezioni di capillari di vetro (freccia) tengono in posizione i fili di tungsteno. I fili elettrici che si collegano allo stimolatore sono coperti e trattenuti lungo l'impugnatura della sonda da nastro isolante elettrico. (B) mostra uno stimolatore isolato a tensione costante raccomandato utilizzato in questo studio. (C) mostra il posizionamento approssimativo della sonda stimolante sulla superficie dorsale anteriore di una larva di terzo stadio errante. Si noti che i fili della sonda si estendono attraverso il corpo larvale e la regione immediatamente sopra il SNC è di ~2 mm di distanza tra i fili. Clicca qui per visualizzare una versione più grande di questa figura.
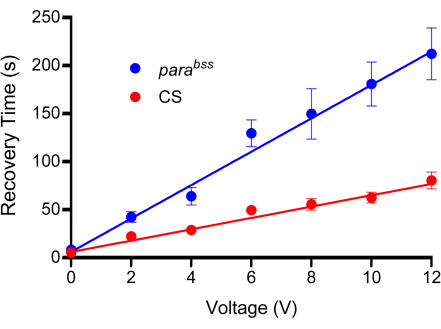
Figura 3: Curva di calibrazione. Prima degli esperimenti, è necessario determinare una tensione adeguata per l'elettroshock. Tutte le sonde saranno leggermente diverse a causa della natura della loro fabbricazione. Un tipo selvatico (in questo caso Canton-S, CS) e un mutante convulsivo (raccomandato, parabss) sono sottoposti a shock di tensione crescente, ciascuno impostato a una durata fissa di 2 s. Le larve vengono scosse una sola volta e per ogni tensione testata dovrebbe essere utilizzato un minimo di n = 10 (in questo caso, n = 12). È evidente dagli accoppiamenti di linea che i parabss mostrano un aumento del tempo di recupero del grippaggio a tutte le tensioni. La tensione scelta dovrebbe produrre una differenza chiara e significativa tra i controlli e i mutanti convulsivi. Nel grafico mostrato, le differenze sono significative a 6 V e oltre (p ≤ 0,0001, ANOVA a due vie con confronti multipli di Šidák, n = 12, per genotipo e voltaggio). Pertanto, 6 V è stata scelta come tensione ottimale per questa sonda, in quanto ha prodotto una differenza significativa, ma il tempo di recupero è stato mantenuto breve, riducendo il tempo necessario per condurre le singole scosse elettriche. I dati sono presentati come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.
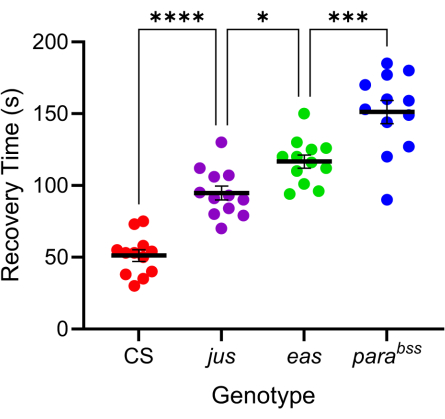
Figura 4: Diverse mutazioni di Drosophila mostrano diversi livelli di gravità delle crisi. Utilizzando la sonda calibrata in Figura 3, tre mutanti di Drosophila seizure (parabss, jus e eas), insieme a un tipo selvatico (CS), sono stati sottoposti a elettroshock (6 V, 2 s). Le singole larve sono state colpite solo una volta. I tempi di recupero delle convulsioni sono maggiori per i mutanti delle convulsioni rispetto al tipo selvatico e aumentano progressivamente da jus a parabss(p ≤ 0,0001, rispettivamente, ANOVA a una via con confronti multipli di Tukey). I confronti statisticamente significativi dai confronti multipli di Tukey sono indicati come ****p ≤ 0,0001, ***p ≤ 0,001, **p ≤ 0,01, *p ≤ 0,05. I dati sono presentati come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.
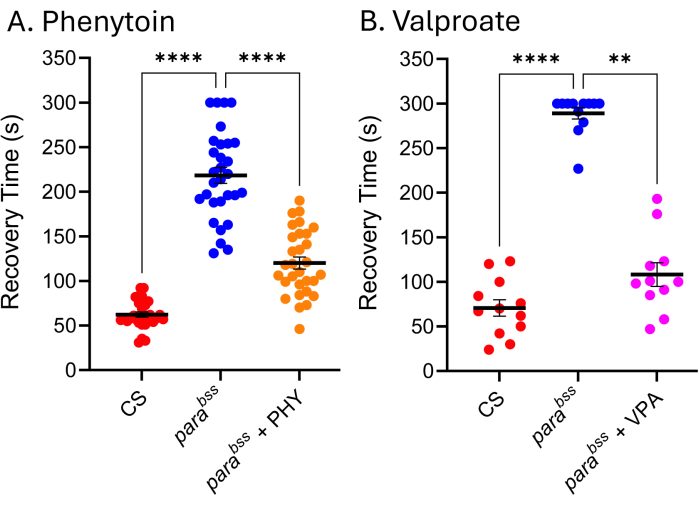
Figura 5: I mutanti delle crisi epilettiche di Drosophila rispondono agli ASM utilizzati clinicamente. L'esposizione a (A) fenitoina (PHY) e (B) valproato di sodio (VPA) (3 mM, rispettivamente) ha ridotto significativamente il tempo di recupero delle crisi di parabss (p ≤ 0,01, Kruskal-Wallis con confronti multipli di Dunn e p ≤ 0,0001, ANOVA unidirezionale con confronti multipli di Tukey, rispettivamente). Solo i tempi di recupero superiori a 30 s sono stati considerati un sequestro quantificabile e in questi test è stato utilizzato un cut-off di 300 s. Ogni test di droga è stato condotto da uno sperimentatore diverso; Pertanto, i tempi medi di recupero indicati differiscono (particolarmente evidenti per la PARABSS senza farmaco). Ciò sottolinea il fatto che questo test è qualitativo e, pertanto, un mutante wildtype e un mutante convulsivo dovrebbero essere inclusi in ogni test. Ciò può consentire di normalizzare l'attività del farmaco tra gli esperimenti, se necessario. I confronti statisticamente significativi dai confronti multipli di Dunn e Tukey sono indicati come ****p ≤ 0,0001, ***p ≤ 0,001, **p ≤ 0,01, *p ≤ 0,05. I dati sono presentati come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo dell'elettroshock per indurre le convulsioni nelle larve di Drosophila fornisce uno screening semplice ma efficiente per identificare nuovi composti anticonvulsivanti o manipolazioni genetiche. Tuttavia, poiché si tratta di un test qualitativo, il suo principale limite è che il metodo non è in grado di identificare facilmente piccole dimensioni dell'effetto. Tuttavia, la produttività media che consente, prestandosi allo screening fino a ~5 composti a settimana, per sperimentatore, fornisce un test molto potente su tutto l'animale. La semplicità della tecnica è adatta anche per progetti di laboratorio di livello universitario. Pertanto, 3-4 ricercatori possono esaminare molti composti in un lasso di tempo relativamente breve e con una spesa molto inferiore rispetto all'utilizzo di un test di crisi epilettica di topo equivalente. L'automazione del test aumenterebbe ulteriormente la produttività. Tuttavia, questo studio non è riuscito a farlo. Un agar contenente litio con due elettrodi incorporati all'interno dell'agar è stato tentato di scuotere più larve contemporaneamente, ma senza successo. Altri metodi, possibilmente basati sull'optogenetica, potrebbero essere più adatti per l'automazione28.
La semplicità del test, tuttavia, mina il requisito di diventare competenti. Il posizionamento della sonda e la pressione applicata durante l'elettroshock sono passaggi critici. La coerenza in entrambi riduce la variabilità tra i tempi di recupero per le larve scioccate. L'altro problema principale è come riconoscere l'endpoint della crisi, il che rende questo test qualitativo perché dipende da quando un singolo ricercatore sceglie di fermare l'orologio. Quando diversi sperimentatori nello stesso laboratorio conducono questi esperimenti, vale la pena dedicare del tempo a visualizzare gli stessi shock larvali per concordare su cosa sia un punto finale di crisi. In questo modo si riduce notevolmente la variabilità tra le persone. Tuttavia, è ancora evidente dai risultati esemplari mostrati in questo rapporto che, mentre gli effetti sono costanti, i tempi possono variare tra gli sperimentatori. È anche importante notare che lo sviluppo larvale a temperature inferiori a 25 °C (ad esempio, 18 °C) riduce la gravità delle crisi a causa di una diminuzione dell'attività neurale durante un periodo critico embrionale29. Pertanto, si suggerisce di utilizzare un minimo di 25 °C per lo sviluppo embrionale/larvale. È auspicabile avere un'incubatrice vicino al banco di lavoro e per ogni elettroshock viene rimosso solo un numero sufficiente di larve. Le larve rimanenti devono essere mantenute a 25 °C fino al momento del bisogno. Con la pratica, gli sperimentatori possono scuotere fino a 4 larve alla volta, distanziando le scosse di intervalli di 10 secondi. Questo approccio accelera notevolmente il progresso e si può raggiungere un n di 40 larve (o più) in un giorno. L'umidità non è stata misurata o controllata durante questo studio. È stato selezionato un ciclo standard 12:12 luce-buio, ma questo può essere variato a piacimento dello sperimentatore.
La produzione di una sonda è la parte più impegnativa di questo metodo. Pertanto, una volta realizzato, bisogna prestare molta attenzione a non danneggiarlo. Qualsiasi danno che si verifica alla sonda per elettroshock spesso comporta una riparazione e, pertanto, la sonda deve essere ricalibrata per determinare la tensione ottimale. La tensione dipende interamente dalla distanza tra i due fili e, pertanto, è probabile che non ci siano due sonde identiche. Si consiglia di ricalibrare una sonda ogni mese per assicurarsi che la tensione ottimale non sia cambiata. La forza dell'elettroshock dipende sia dalla tensione applicata che dalla durata della tensione. Pertanto, durate più brevi con tensioni più elevate produrranno probabilmente la stessa risposta di durate più lunghe, utilizzando una stimolazione di tensione più debole. Tuttavia, questo spazio non è stato indagato. La preferenza per la durata di 2 s (in questo studio) è facilmente soddisfatta senza che il movimento eccessivo delle larve venga scosso. Ciò consente un'intensità di tensione relativamente inferiore, che evita danni alla cuticola larvale. L'effetto della stimolazione dipenderà anche dall'intensità di corrente (ampere), che non misuriamo. Tuttavia, stimolatori diversi produrranno amperaggi diversi e, quindi, è stato riscontrato che utilizzando uno stimolatore Grass S8825, è stata utilizzata una tensione di 50 V/ 3 s, mentre utilizzando lo stimolatore utilizzato qui, è stato utilizzato 6-12 V / 2 s, a seconda della sonda utilizzata. Il voltaggio/durata effettiva utilizzata non è eccessivamente importante purché sia sufficiente a indurre un tempo di recupero più lungo di un controllo wildtype e non infligga danni alla larva. Poiché l'atto di posizionare semplicemente una sonda su una larva (usando 0 V come controllo) provoca un certo grado di congelamento/paralisi (indicativo di un tentativo di evitare la predazione), non ci sono criteri di stimolazione che non inducano un comportamento "simile a una crisi".
Il test dell'elettroshock è adatto per lo screening di farmaci per l'attività anticonvulsivante. Un problema è sempre solvibile. È stato riscontrato che l'etanolo o l'acetone sono solventi migliori del DMSO. Negli esperimenti attuali, il DMSO è tollerato fino a ~1%, oltre il quale è stata osservata una letalità inaccettabile nello sviluppo delle larve. Delle due opzioni per esporre le larve ai farmaci, sia l'aggiunta di farmaco (disciolto in un solvente adatto) alla parte superiore di una fiala di cibo sia l'aggiunta di cibo per mosche sciolto, è stato riscontrato che quest'ultima produce risultati migliori in termini di ridotta variabilità. Tuttavia, la differenza è marginale e il primo metodo è più veloce. Si raccomanda agli sperimentatori di confrontare entrambi i metodi e scegliere quello più adatto. Le mosche possono essere autorizzate a deporre le uova su cibo contenente farmaci, in modo tale che l'intero sviluppo larvale sia esposto allo scavato. In alternativa, le larve possono essere posizionate su alimenti contenenti farmaci in qualsiasi fase desiderata per identificare i tempi critici dell'attività del farmaco. L'alimentazione di femmine gravide con farmaci è un metodo efficace per esporre gli embrioni in via di sviluppo ai farmaci25.
Un test convulsivo alternativo e comunemente usato è l'uso di embrioni di zebrafish esposti al pentilenetrazolo proconvulsivante per lo screening degli ASM30. A nostro avviso, il test larvale di Drosophila ha molti vantaggi. Questi includono (1) molti composti sono difficili da sciogliere nell'acqua di mare artificiale in cui nuotano i pesci; (2) il test del pesce zebra si basa sulla riduzione della lunghezza del nuoto, che può verificarsi sia dall'esposizione a un ASM o, controintuitivamente, a un composto proconvulsivante. Questo perché l'aumento dell'attività convulsiva nel pesce zebra si traduce anche in una riduzione del nuoto10. Pertanto, qualsiasi composto deve essere seguito da uno screening secondario, che spesso richiede la misurazione di geni neuronali inducibili precocemente come i c-fos; (3) I pesci possono essere utilizzati solo senza una licenza animale fino al giorno 5 dopo la schiusa. Naturalmente, il pesce zebra ha un netto vantaggio rispetto agli insetti in quanto il loro principale neurotrasmettitore eccitatorio è il glutammato e non l'acetilcolina31. Una combinazione dei due test, a partire da Drosophila e seguita da zebrafish, potrebbe fornire uno screening molto potente prima che vengano testati meno composti di successo nei topi.
Per riassumere, il test di elettroshock larvale di Drosophila , insieme all'elevata conservazione in genetica e fisiologia condivisa tra mosche e mammiferi, fornisce uno screening molto efficace, rapido ed economico per identificare nuove terapie anticonvulsive. L'aumento dell'adozione di questo insetto per lo screening farmacologico affronterà anche l'urgente necessità di ridurre il numero di animali di ordine superiore utilizzati per la ricerca medica.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Ringraziamo i numerosi membri del personale del laboratorio Baines che hanno sviluppato congiuntamente questa tecnica nel corso di molti anni e, in particolare, Richard Marley, che ha fatto un grande sforzo per rendere questa tecnica robusta e affidabile. Ringraziamo Anna Munro per aver disegnato le larve, come mostrato nella Figura 2. Il lavoro nel laboratorio di Baines che ha contribuito allo sviluppo di questa tecnica è stato generosamente sostenuto da BBSRC, MRC e Wellcome Trust. Questo lavoro è attualmente supportato da un premio per ricercatori del Wellcome Trust a R.A.B. (Grant 217099/Z/19/Z). Lo sviluppo di questa tecnica ha beneficiato anche della Manchester Fly Facility, che è stata istituita attraverso i fondi dell'Università e del Wellcome Trust (Grant 087742/Z/08/Z).
Materiali
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
Riferimenti
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon