Method Article
نشاط النوبة الناجم عن الصدمات الكهربائية في يرقات ذبابة الفاكهة
In This Article
Summary
يوضح هذا البروتوكول بالتفصيل استخدام ذبابة الفاكهة يرقات لتحديد المركبات الفريدة المضادة للنوبات لعلاج الصرع.
Abstract
يمثل الصرع عبئا صحيا كبيرا يتفاقم بسبب الأعداد الكبيرة من الأفراد المصابين بمقاومة للأدوية. في حين أن بعض المرضى المصابين بمقاومة الأدوية يستجيبون للعلاجات غير الدوائية (على سبيل المثال ، تحفيز العصب المبهم ، والنظام الغذائي الكيتون ، وما إلى ذلك) ، فإن الملاذ الأخير للكثيرين هو الجراحة الصعبة والمكلفة لتوفير الراحة من النوبات. في حين أنه من المسلم به عموما أن الأدوية المضادة للصرع ذات مجموعة أوسع من الأهداف مطلوبة ، فإن العقبة في تحقيق ذلك هي تحديد أهداف الأدوية الجديدة. تقدم النموذجية القابلة للتتبع وراثيا وعدا في هذا الصدد. ذبابة الفاكهة ، ذبابة الفاكهة السوداء ، أصبحت نموذجا قويا للتحقيق في الأساس الميكانيكي للنوبات وعلاجات أفضل لها. تؤدي العديد من طفرات الذباب المحددة إلى ظهور اليرقات والبالغين نشاطا شبيها بالنوبات استجابة للتحفيز القوي (الكهربائي والميكانيكي و / أو الحراري). توجد العديد من هذه الطفرات في جينات متماثلة لتلك التي تساهم في الصرع الجيني البشري (على سبيل المثال ، قناة Na + ذات الجهد الكهربائي). أصبح من الممكن الآن أيضا استبدال جين الذبابة بمكافئه البشري الذي يحمل أيضا طفرة مرتبطة بالمرض. وهكذا ، أصبحت الذبابة المتواضعة صورة رمزية لنمذجة الأمراض البشرية. تصف هذه الدراسة طريقة مناسبة لاستخدام يرقات ذبابة الفاكهة لشاشات الأدوية منخفضة إلى متوسطة الإنتاجية لتحديد المركبات الفريدة وأهدافها التي لديها القدرة على مقاومة النوبات.
Introduction
لا يزال الصرع يشكل عبئا صحيا كبيرا، حيث يؤثر على حوالي 1٪ من السكان في جميع أنحاء العالم. على الرغم من وجود أكثر من 30 دواء مضادا للنوبات (ASMs) للعلاج السريري ، إلا أن حوالي ثلث الأشخاص المصابين بالصرع لا يزالون مقاومين للأدوية ، مما يعني أنهم لا يستجيبون بشكل جيد للعلاج الدوائي1،2. الأدوية المتاحة هي أيضا مسكنة فقط ، وبالتالي ، لا تمنع تكوين الصرع ، ولا توفرعلاجا 3. وبالتالي ، هناك حاجة ماسة لتحديد علاجات أفضل للصرع. ومن العقبات التي تحول دون تطوير علاجات أكثر فعالية تحديد أهداف جديدة للأدوية. في الواقع ، تؤثر جميع ASMs الحالية تقريبا على أهداف مماثلة: القنوات الأيونية ، بما في ذلك قناة الصوديوم ذات الجهد الكهربائي (Nav) ، والنقل العصبي المثبط بوساطة حمض γ-أمينوبوتيريك (GABA) 4،5. ومن المقبول عموما أن الاستمرار في استخدام الأساليب التقليدية لتطوير الأدوية من غير المرجح أن يغير هذا السيناريو تغييرا جذريا.
النموذجية المختبرية ، بما في ذلك ، على سبيل المثال لا الحصر ، ذبابة الفاكهة ذبابة الفاكهة السوداء ، وسمك الزرد Danio rerio ، لها فائدة في تحديد ASMs الجديدة6،7،8. في الواقع ، يعرض بحث PubMed عن "ذبابة الفاكهة + النوبة" 342 نتيجة ، بينما يعرض نفس البحث عن أسماك الزرد 578 نتيجة (تم إجراء كلا البحثين في 29يناير 2025). في حين أن عدد الدراسات المماثلة على الفئران (~ 15,000) ، فإن عدد الدراسات التي تستخدم أنظمة نموذجية يستمر في النمو. هذه الدراسات ممكنة بسبب الحفظ الميكانيكي لوظيفة الجهاز العصبي المركزي عبر شعبة. علاوة على ذلك ، يتم علاج النوبات المستحثة في الذباب والأسماك بشكل فعال باستخدام ASMs المستخدمة سريريا ، مما يدل على أنه في حين أن الفروق الدقيقة في سلوك النوبة قد تبدو مختلفة ظاهريا ، فإن الآليات الأساسية تشترك كثيرافي 7،9،10.
ذبابة الفاكهة ، ذبابة الفاكهة ، قدمت العديد من المساهمات الأساسية لفهم علم الأحياء البشري. فيما يتعلق بالصرع ، يوفر هذا النظام النموذجي صندوق أدوات وراثي لا مثيل له جنبا إلى جنب مع الخلايا العصبية التي يمكن التعرف عليها والتي يمكن الوصول إليهاتجريبيا 7. علاوة على ذلك ، تم الآن نشر الخلايا العصبية لكل من اليرقات والجهاز العصبي المركزي البالغ ، وتم تحديد العديد من خطوط المحرك الجيني الخاصةبالخلايا 11،12. بشكل ملحوظ ، تم تحديد فئة من الطفرات بالصدفة حيث يستجيب الذباب البالغ للتحفيز الميكانيكي القوي عن طريق فقدان الموقف والنشاط الشبيه بالنوبات (على سبيل المثال ، طنين الجناح ، اهتزاز الساق ، إلخ). تم تسمية هذه الفئة من الطفرات ب "حساسة للانفجار" 13،14،15،16. منذ ذلك الحين ، تم تحديد فئة ثانية من طفرة النوبات التي تستجيب لارتفاع درجة الحرارة ، مما يعكس نوبات الحمى البشرية17،18. ومع ذلك ، فإن قابلية التتبع التجريبي للذباب البالغ تقل إلى حد ما مقارنة بمرحلة اليرقات لنموذج الحشرات نفسه. على سبيل المثال ، قد يكون من الصعب إطعام الذباب البالغ بالمخدرات ، ويمكن أن تكون التقنيات الأكثر توغلا مثل الفيزيولوجيا الكهربية وعلم البصريات الوراثي أكثر صعوبة. على النقيض من ذلك ، تأكل يرقة ذبابة الفاكهة باستمرار لتوسيع حجم جسمها بمقدار ~ 100 ضعف في 5 أيام فقط لتمكين التشرنق لذلك ، يمكننا أن نكون واثقين من التغذية الدوائية الكافية في مراحل اليرقات. تم توثيق التطور الجنيني جيدا ويمكن تنظيمه بدقة ، وقد حدد بدوره المعالم الرئيسية في تطور الجهاز العصبي المركزي ، بما في ذلك الاستحواذ الأول على الخصائص الكهربائية العصبية حتى تكوينالدائرة 19. بمجرد أن تفقس اليرقة ، تمر عبر 3 تساقط (أو أطوار) حتى تصبح "متجولة" في اليوم الخامس ، وعندها تترك الطعام لتجد مكانا آمنا للتشرنق. بعد ~ 100 ساعة من التشرنق ، تظهر ذبابة بالغة بجسم جديد والجهاز العصبي المركزي (الشكل 1).
تقنيات إحداث النوبة عند البالغين ليست مناسبة تماما لمراحل اليرقات. تفتقر اليرقات إلى الشعر الحسي ، والذي يمكن أن يؤدي تنشيطه المتزامن أثناء التحفيز الميكانيكي إلى نوبة. وهكذا ، للتغلب على هذه الصعوبات ، تم تطوير تقنية الصدمات الكهربائية للحث على النوبات في مرحلة اليرقات المتجولة. يكشف التحليل المقارن اللاحق لتقنيات تحريض النوبات عبر كل من اليرقات والبالغين أن الصدمة الكهربائية لليرقات أقل اعتمادا على نوع الطفرة (على سبيل المثال ، حساسية للانفجار مقابل درجة الحرارة). وبالتالي ، نقترح أن تكون هذه التقنية هي الطريقة المفضلة لاختبار الطفرات الجديدة حيث تكون طريقة تحريض النوبات المثلى غيرمعروفة 20. تقنية الصدمات الكهربائية لليرقات بسيطة وسريعة وتتطلب الحد الأدنى من المعدات. توفر هذه التقنية وسيلة فعالة لفحص المركبات الجديدة ، أو العلاجات الجينية ، من أجل فعالية مقاومة النوبات عبر مجموعة من الطفرات التي تعكس التنوع الجيني للصرع البشري.
Protocol
ذبابة الفاكهة ، ذبابة الفاكهة السوداء ، تستخدم في هذه الدراسة (انظر قسم النتائج للحصول على التفاصيل). هذه التقنية هي الأنسب لليرقات المتجولة من الطور الثالث (L3). البروتوكول التجريبي بسيط نسبيا ولكنه يتطلب ممارسة لإتقانه. في تجربتنا ، يحتاج الطلاب الجدد إلى حوالي أسبوعين لإتقان الفحص والاستفادة بشكل كبير من عرض محققين آخرين أكثر خبرة يقومون بالفحص في الوقت الفعلي باستخدام مجهر تشريح يدعم الكاميرا أو ما شابه ذلك. الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. اختيار اليرقات
- اجمع اليرقات من جوانب قوارير الذباب / الزجاجات التي تحتوي على طعام قياسي (5 لتر من الماء ، 390 جم من الجلوكوز ، 360 جم من الذرة ، 250 جم من الخميرة ، 40 جم أجار ، 135 مل من النيباجين ، 15 مل من حمض البروبيونيك).
- استخدم فقط اليرقات التي تتحرك بنشاط وتركت الطعام للزحف إلى جوانب الحاوية (الأطوار الثالثة المتجولة ، L3). لا تختار الشرانق المسبقة ، والتي تظهر انخفاضا كبيرا في الحركة.
2. إجراء الصدمات الكهربائية
- قم بإزالة L3 متجول واحد وانقله إلى طبق بتري بلاستيكي صغير (الحجم لا يهم) ، واغسله برفق باستخدام ddH2O لإزالة بقايا الطعام. فرشاة رسم صغيرة (000) مناسبة لهذا الغرض.
- انقل اليرقة المغسولة بمفردها ، باستخدام فرشاة الرسم ، إلى طبق بلاستيكي فارغ (مرة أخرى ، لا يهم الحجم). جفف اليرقة بجزء صغير من منشفة ورقية مثبتة بالملقط. قم بإزالة ddH2O الزائد ، لكن لا تجفف اليرقات تماما لتجنب التصاق الطبق البلاستيكي.
- اسمح لليرقة بالتعافي لمدة 30 ثانية. سيسهل ذلك وضع مسبار الصدمات الكهربائية بسهولة (انظر أدناه).
- اعرض اليرقات تحت مجهر تشريح منخفض الطاقة (15-20x) ، وبمجرد استئناف سلوك الزحف الطبيعي ، ضع مسبار الصدمات الكهربائية برفق (انظر الخطوة 3 للحصول على التفاصيل والشكل 2 أ) على السطح الظهري الأمامي لليرقة فوق الموضع التقريبي للجهاز العصبي المركزي (انظر الشكل 2 ج).
ملاحظة: هذه الخطوة مهمة ، يجب تطبيق ضغط كاف لتوفير موصلية جيدة بين سلك المسبار والبشرة ولكن احرص على عدم إتلاف اليرقات. وبالتالي ، اسحق اليرقة بحوالي ثلث إلى نصف عمقها. - قم بتطبيق نبضة 2 ثانية من الجهد الثابت، والتي تم تحديد قوتها مسبقا عبر منحنى المعايرة بالتحليل الحجمي (الشكل 3). أي محفز جهد معزول مناسب هنا. يظهر الشكل 2 ب.
- بعد الصدمة الكهربائية ، ابدأ مؤقتا. استجابة للصدمة ، تبدأ اليرقات في شلل عابر متبوعا بتشنجات عرضية لنشاط عضلات جدار الجسم وسلوك التدحرج ، مما يوقف سلوك الزحف الطبيعي.
- أوقف المؤقت عندما تبتعد اليرقة بوضوح عن موضعها الأصلي على الطبق. تعرف مدة النوبة ، أو وقت التعافي (RT) ، على أنها الفترة بين بداية التحفيز واستئناف سلوك الزحف الطبيعي (على سبيل المثال ، موجة تمعجية أمامية كاملة تؤدي إلى حركة إلى الأمام).
- في نهاية كل يوم ، قم بتنظيف أسلاك المسبار بعناية عن طريق شطفها أولا بالإيثانول بنسبة 100٪ متبوعا ب ddH2O. افحص الأسلاك بعناية تحت التكبير ، وإذا لزم الأمر ، استخدم الملقط لكشط أي بقايا من الأسلاك برفق. احرص على عدم تغيير المسافة بين السلكين عند القيام بذلك.
3. بناء مسبار الصدمات الكهربائية
- ستكون هناك حاجة إلى أطوال 2 × 1 متر من الأسلاك الكهربائية (يجب أن تكون رقيقة ومرنة ، أي مصنفة ~ 3 أمبير). في نهاية كل سلك ، قم بلحام سلك التنغستن بطول 5 سم (لزيادة الاتصال إلى أقصى حد ، قم بلف سلك التنغستن حول الطرف المكشوف للسلك الكهربائي قبل اللحام). موصلات لحام بالدفع (على سبيل المثال ، سدادات الموز) إلى الطرف الآخر من الأسلاك ، وهي مناسبة لسهولة الاتصال بمحفز الجهد.
- قم بتأمين كلا أسلاك التنغستن بحامل قطب كهربائي بحيث تكون الأسلاك متوازية مع بعضها البعض (الشكل 2). يتم استخدام أجزاء صغيرة من الشعيرات الدموية الزجاجية (~ 2 سم في الطول) لتثبيت الأسلاك في مكانها أسفل برغي قفل المسبار.
- استخدم الملقط لثني الأسلاك بحيث تصل إلى مسافة 1-2 مم بالقرب من مكان خروجها من حامل السلك. ثني أسلاك التنغستن ليس بالأمر السهل لأن الأسلاك تحتفظ ب "ذاكرة" - وبالتالي ، فإن المثابرة مطلوبة. تتضمن النصائح للمساعدة في هذه العملية استخدام شريط عازل كهربائي و / أو بلو تاك (أو معجون نمذجة مماثل) للمساعدة في الحفاظ على الأسلاك في الاتجاه / المسافة الصحيحة.
4. معايرة المسبار
- تأكد من وجود مخزونات من L3 المتجول من النوع البري المناسب (التحكم السلبي) ومتحور النوبة (التحكم الإيجابي). ~ 100 من كل منهما.
- تحضير اليرقات ، واحدة تلو الأخرى ، كما هو موضح أعلاه.
- استخدم المسبار لتطبيق مجموعة من الفولتية على يرقات كافية من كل نمط وراثي لكل جهد تم اختباره. يقترح أن يتم تطبيق 0 فولت ، 2 فولت ، 4 فولت ، 6 فولت ، 8 فولت ، 10 فولت ، و 12 فولت لمدة 2 ثانية بين 10-15 يرقة لكل جهد. صدمة كل يرقة مرة واحدة فقط.
- قم بقياس وقت الاسترداد لكل يرقة واحسب متوسط كل خطوة جهد مطبقة على كلا النمطين الجينيين.
- ارسم المتوسطات على الرسم البياني وقم بملاءمة البيانات بخط مستقيم.
- حدد جهدا باختلاف واضح وكبير بين التحكم وطفرة النوبة. احرص على عدم اختيار الجهد الذي ينتج عنه وقت استرداد طويل جدا ؛ خلاف ذلك ، ستعاني الإنتاجية بسبب وقت الانتظار الطويل للتعافي.
ملاحظة: غالبا ما استخدمت هذه الدراسة جهد تحفيز ينتج عنه وقت استرداد من 50-100 ثانية للنوع البري و 200-300 ثانية للفقرةالبكالوريوس. يتم عرض منحنيات المعايرة النموذجية في الشكل 3. من المهم استخدام 0 فولت لحساب فعل الضغط على المسبار على السطح الظهري لليرقة. سيؤدي ذلك إلى درجة معينة من الشلل ، والتي من المحتمل أن تكون آلية دفاع لليرقة.
5. تنفيذ التجارب
- يرقة الصدمات الكهربائية من النمط (الأنماط الجينية المطلوبة) أو التعرض للأدوية وقياس وقت التعافي من النوبات.
ملاحظة: بالنسبة ليرقات الاختبار ، عادة ما يكون n = 20 كافيا ، لكن حساب الطاقة المستند إلى التحليل التجريبي سيوفر رقم n أكثر تحديدا. - قم دائما بتشغيل عنصر تحكم سلبي (على سبيل المثال ، نوع بري) وإيجابي (على سبيل المثال ، الفقرةbss) أثناء كل تجربة. لا يلزم أن تكون الأرقام n عالية. ن = 5 يكفي. سيوفر هذا الثقة في أن الفحص قد نجح كما هو متوقع (على سبيل المثال ، لا توجد مشاكل في المسبار أو المحفز).
- ضع قطعا (على سبيل المثال ، 300 ثانية) لتجنب أوقات التعافي الطويلة جدا وفكر فقط في النوبات القابلة للقياس الكمي مثل تلك التي تزيد أوقات التعافي فيها عن 30 ثانية.
6. فحص المخدرات
- أضف الأدوية المذابة في مذيب مناسب مباشرة إلى سطح الطعام واتركها تنقع (وفي حالة استخدام الإيثانول ، حان الوقت لتبخر المذيبات). أو ، بدلا من ذلك ، يمكن للمرء إضافة دواء (في مذيب مناسب) إلى طعام الذباب المذاب. راجع قسم النتائج للحصول على التفاصيل.
- لإضافة الدواء إلى الطعام المذاب ، استخرج الطعام من القوارير ، وأعد الذوبان ، وعندما يبرد الطعام إلى 40 درجة مئوية ، أضف الدواء ، واخلطه بخلاط دوامة ، ثم أعد 5 مل من الطعام المذاب مرة أخرى في قوارير واتركه ليبرد قبل الاستخدام.
- قم بتشغيل تدرج تركيز لتحديد التركيز الأمثل للدواء.
ملاحظة: تتمثل نقطة البداية الجيدة في إضافة محلول دواء 3 ملي مولار إما مباشرة إلى سطح الطعام (200 ميكرولتر لكل قارورة ذبابة الفاكهة القياسية) أو لعمل تركيز 3 ملي مولار في الطعام المذاب. يمكن السماح للإناث البالغات بوضع البيض مباشرة في هذا الطعام ، أو يمكن إضافة اليرقات في مراحل محددة حسب الحاجة. يجب إضافة المذيب (المذيبات) المستخدمة بمفرده إلى قوارير مختارة كعنصر تحكم (قوارير) السيارة.
النتائج
تظهر العديد من طفرات ذبابة الفاكهة سلوكا شبيها بالنوبات7،20. يتنوع الأساس الجيني لهذه الطفرات ، والذي يحاكي بشكل إيجابي الأسباب الجينية المتنوعة للصرع البشري. ثلاثة من أكثر طفرات ذبابة الفاكهة التي تمت دراستها هي شبهbangsenseless (parabss) ، ونوبة julius (jus) ، وسهلة الصدمة (eas). تؤدي طفرة parabss إلى اكتساب وظيفة قناة Na + المشلولة ذات الجهد الكهربائي ، وتشفير eas إيثانول أمين كيناز ، و jus هو بروتين غشائي غير معروف حتى الآن (لاحظ أن jus كان يطلق عليه slamdance حتى وقت قريب) 16،21،22. العديد من هذه الجينات لها متماثلات بشرية. على سبيل المثال ، الشلل هو متماثل لجينات Nav البشرية ، والتي تعد الطفرات فيها سببا رئيسيا للصرعالوراثي 23. كما هو الحال مع الصرع البشري ، تظهر طفرات الذباب الثلاث "الحساسة" هذه "شدة" النوبات التفاضلية استجابة للصدمة الكهربائية (الشكل 4). تظهر أطول فترة نقاهة (أي سلوك النوبات الأكثر شدة) بواسطة الفقرةBSS ، بينما تظهر الآمرة أقصر وقت للشفاء. تسمح هذه الاستجابة التفاضلية ، بسبب الطفرات الجينية الأساسية المختلفة ، للمجرب باختبار كيف يمكن لمركبات الرصاص أن تقلل من النوبات عبر مجموعة من الطفرات لتحديد تلك التي لها نشاط واسع الطيف.
العديد من ASMs المستخدمة في العيادة فعالة بنفس القدر في نماذج نوبات ذبابة الفاكهة ، مما يشير إلى أن الآليات الأساسية التي تنتج النوبات في ذبابة الفاكهة مماثلة لتلك التي تؤدي إلى نوبات صرع لدى الأشخاص المصابين بالصرع9 ، 24 ، 25. يوضح الشكل 5 تأثير اثنين من أكثر ASMs استخداما سريريا ، فالبروات الصوديوم (VPA) والفينيتوين (PHY) ، ضد الفقرةbss. سمح لليرقات بالتغذية على ASM الموجود في الطعام (يضاف إلى الطعام المذاب) عند 3 ملي مولار أثناء نمو اليرقات بالكامل. تم تضمين النوع البري (Canton-S ، CS) والتحكم في المركبات التي تغذيها الفقرة bss (الإيثانول والماء ، على التوالي) في كل تجربة ، جنبا إلى جنب مع الفقرةbss التي تغذى على ASM المعنية. هناك انخفاض واضح وكبير في وقت التعافي من النوبات (RT) لكلا الدواءين. بالنظر إلى أن كلا من النوع البري وطفرة النوبة المعروفة (الفقرةBSS) ، دون التعرض ل ASM ، يظهران نشاطا متوقعا للنوبة ، يمكننا أن نكون واثقين من صحة هاتين التجربتين. عندما لا يكون الأمر كذلك ، يجب التخلص من المقايسات ، ويجب تكرار التجربة. غالبا ما يكون السبب الكامن وراء هذا "الفشل" هو تلف مسبار الصدمات الكهربائية ، و / أو انخفاض طاقة بطارية المحفز ، و / أو قلة خبرة المجرب. يجب أيضا تجنب الحفاظ على الذباب في درجات حرارة أقل من 25 درجة مئوية (انظر قسم المناقشة). في حين أن هذه التقنية غير مناسبة للفحص عالي الإنتاجية ، فقد تم استخدامها مؤخرا في شاشة منخفضة الإنتاجية من ~ 30 مركبا لتحديد فئة جديدة من المواد الكيميائية التي تقلل بشكل فعال من النوبات من خلال التلاعب ب Pumilio - منظم التوازن العصبي. تظهر الترجمة الإيجابية لهذه المركبات نفسها لتقليل النوبات في نماذج نوبات الفئران المحددة إمكانات مثيرة لمزيد من التطوير لكل من مركبات الرصاص والهدف الجديد26،27.
عند فحص النتائج التمثيلية الموضحة هنا (الشكل 4 والشكل 5) ، من الواضح أن هناك تباينا في انتشار البيانات. هناك أيضا اختلاف متواضع في قيمة الحرف المتبادل بين البيانات المعروضة في هذين الشكلين. هذا هو السبب في أن هذا الاختبار نوعي وغير مناسب لتحديد الاختلافات الصغيرة في شدة النوبات ، إما بين الأنماط الجينية أو في فحوصات فحص الأدوية. ومع ذلك ، فإن الاختبار مناسب تماما لتحديد النمط الظاهري للنوبات في طفرات غير معروفة و / أو للاختبار الأولي للمركبات للنشاط المضادللنوبات 27. ومع ذلك ، فإن المزيد من التحسينات لتطوير الأدوية تتطلب فحصا (فحصات) مختلفة.

الشكل 1: ذبابة الفاكهة دورة الحياة. رسم تخطيطي يوضح دورة حياة ذبابة الفاكهة ، من الجنين إلى البالغين ، عن طريق التشرنق. التوقيت المعروض تقريبي للتطوير عند 25 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تصميم ووضع مسبار الصدمات الكهربائية. (أ) يعرض صورا لمسبار من الأعلى والجانب. تم استخدام Blu-tack للحفاظ على مسافة بين الأسلاك تبلغ ~ 2 مم حيث تمتد أسلاك التنغستن من المسبار. تثبت الأجزاء القصيرة من الشعيرات الدموية الزجاجية (السهم) أسلاك التنغستن في مكانها. يتم تغطية الأسلاك الكهربائية التي تتصل بالمحفز وتثبيتها على طول مقبض المسبار بواسطة شريط عازل كهربائي. (ب) يظهر محفز معزول موصى به بجهد ثابت يستخدم في هذه الدراسة. (ج) يوضح الوضع التقريبي للمسبار المحفز عبر السطح الظهري الأمامي ليرقة الطور الثالث المتجولة. لاحظ أن أسلاك المسبار تمتد عبر جسم اليرقات ، والمنطقة الموجودة فوق الجهاز العصبي المركزي مباشرة هي ~ 2 مم مسافة بين الأسلاك. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
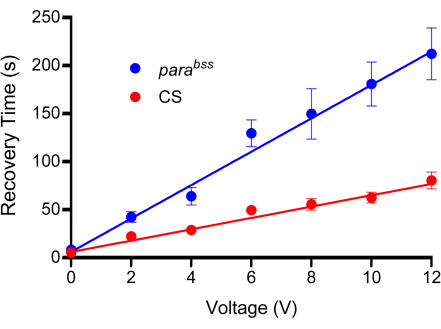
الشكل 3: منحنى المعايرة. قبل التجارب ، يجب تحديد جهد مناسب للصدمات الكهربائية. ستكون جميع المجسات مختلفة قليلا بسبب طبيعة تصنيعها. يتعرض النوع البري (في هذه الحالة Canton-S ، CS) وطفرة النوبة (الموصى بها ، الفقرةbss) لصدمات الجهد المتزايدة ، كل مجموعة في مدة ثابتة قدرها 2 ثانية. يتم صدمة اليرقات مرة واحدة فقط ، ويجب استخدام ما لا يقل عن n = 10 لكل جهد تم اختباره (في هذه الحالة ، ن = 12). يتضح من نوبات الخط أن parabss تظهر زيادة في وقت التعافي من النوبات في جميع الفولتية. يجب أن ينتج عن الجهد المختار فرقا واضحا وكبيرا بين الضوابط والطفرات النوبات. في المؤامرة الموضحة ، تكون الاختلافات كبيرة عند 6 فولت وما فوق (ص ≤ 0.0001 ، ANOVA ثنائي الاتجاه مع مقارنات Šidák المتعددة ، ن = 12 ، لكل النمط الجيني والجهد). وبالتالي ، تم اختيار 6 فولت كجهد مثالي لهذا المسبار ، حيث أنتج فرقا كبيرا ، ومع ذلك يظل وقت الاسترداد قصيرا ، مما يقلل من الوقت المستغرق لإجراء الصدمات الكهربائية الفردية. يتم تقديم البيانات كمتوسط ± SEM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
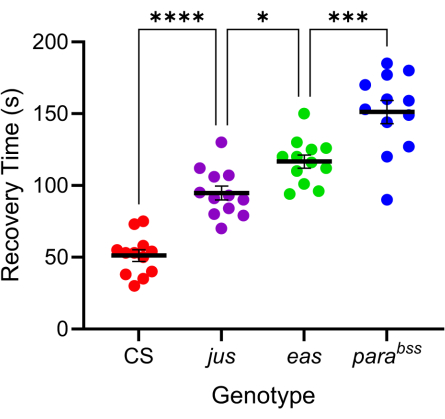
الشكل 4: تظهر طفرات ذبابة الفاكهة المختلفة مستويات متفاوتة من شدة النوبات. باستخدام المسبار الذي تمت معايرته في الشكل 3 ، تعرضت ثلاث طفرات صربة الفاكهة (parabss و jus و eas) ، جنبا إلى جنب مع نوع بري (CS) ، لصدمة كهربائية (6 فولت ، 2 ثانية). صدمت اليرقات الفردية مرة واحدة فقط. أوقات التعافي من النوبات أكبر بالنسبة للطفرات النوبة من النوع البري وتزداد تدريجيا من jus إلى parabss (p ≤ 0.0001 ، على التوالي ، ANOVA أحادي الاتجاه مع مقارنات Tukey المتعددة). يشار إلى المقارنات ذات الدلالة الإحصائية من مقارنات Tukey المتعددة على أنها ****p ≤ 0.0001 ، ***p ≤ 0.001 ، ** p ≤ 0.01 ، * p ≤ 0.05. يتم تقديم البيانات كمتوسط ± SEM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
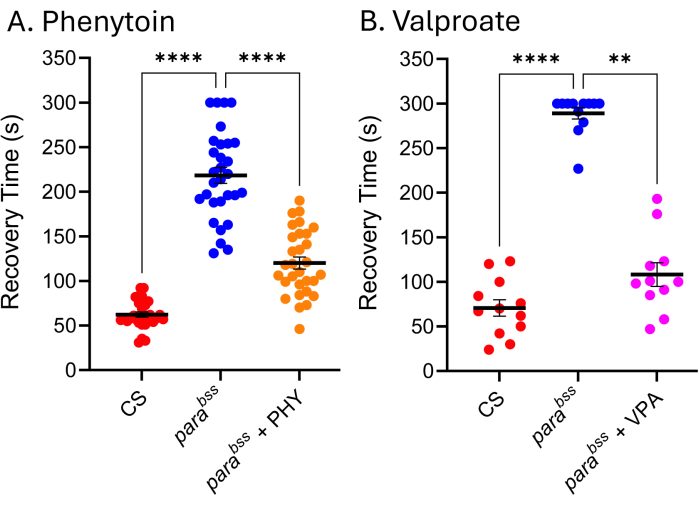
الشكل 5: ذبابة الفاكهة تستجيب طفرات صرع الفاكهة ل ASMs المستخدمة سريريا. التعرض ل (أ) الفينيتوين (PHY) و (ب) فالبروات الصوديوم (VPA) (3 ملي مولار ، على التوالي) قلل بشكل كبير من وقت التعافي من النوبة من الفقرةbss (ص ≤ .01 ، Kruskal-Wallis مع مقارنات دن المتعددة ، و p ≤ .0001 ، ANOVA أحادي الاتجاه مع مقارنات Tukey المتعددة ، على التوالي). تم اعتبار أوقات الاسترداد التي تزيد عن 30 ثانية فقط نوبة قابلة للقياس الكمي ، وتم استخدام قطع 300 ثانية في هذه المقايسات. تم إجراء كل فحص دوائي من قبل مجرب مختلف. وبالتالي ، يختلف متوسط أوقات التعافي الموضحة (واضح بشكل خاص بالنسبة لمتلازمة البكالوريوس بدون دواء). هذا يؤكد حقيقة أن هذا الاختبار نوعي ، وبالتالي ، يجب تضمين النوع البري وطفرة النوبات في كل فحص. يمكن أن يسمح ذلك بتطبيع نشاط الدواء بين التجارب إذا لزم الأمر. يشار إلى المقارنات ذات الدلالة الإحصائية من مقارنات Dunn و Tukey المتعددة على أنها ****p ≤ 0.0001 ، ***p ≤ 0.001 ، ** p ≤ 0.01 ، * p ≤ 0.05. يتم تقديم البيانات كمتوسط ± SEM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توفر طريقة الصدمات الكهربائية للحث على النوبة في يرقات ذبابة الفاكهة شاشة بسيطة ولكنها فعالة لتحديد المركبات المضادة للنوبات الجديدة أو التلاعب الجيني. ومع ذلك ، نظرا لأن هذا اختبار نوعي ، فإن قيده الرئيسي هو أن الطريقة لا يمكنها تحديد أحجام التأثير الصغيرة بسهولة. ومع ذلك ، فإن الإنتاجية المتوسطة التي تسمح بها ، والتي تفسح المجال لفحص ما يصل إلى ~ 5 مركبات في الأسبوع ، لكل محقق ، توفر اختبارا قويا جدا للحيوان بأكمله. بساطة التقنية مناسبة أيضا لمشاريع المختبرات على مستوى البكالوريوس. وبالتالي ، يمكن ل 3-4 باحثين فحص العديد من المركبات في فترة زمنية قصيرة نسبيا ، وبإنفاق أقل بكثير من استخدام مقايسة مصادرة الفئران المكافئة. ستؤدي أتمتة الفحص إلى زيادة الإنتاجية. ومع ذلك ، لم تنجح هذه الدراسة في القيام بذلك. تمت محاولة أجار يحتوي على الليثيوم مع قطبين مدمجين داخل الأجار لصدمة يرقات متعددة في وقت واحد ، ولكن دون جدوى. قد تكون الطرق الأخرى ، التي ربما تعتمد على علم البصريات الوراثي ، أكثر ملاءمة للأتمتة28.
ومع ذلك ، فإن بساطة الفحص تقوض شرط أن تصبح بارعا. يعد وضع المسبار والضغط المطبق أثناء الصدمة الكهربائية خطوات حاسمة. يقلل الاتساق في كليهما من التباين بين أوقات التعافي لليرقات المصدومة. القضية الرئيسية الأخرى هي كيفية التعرف على نقطة نهاية النوبة ، مما يجعل هذا الاختبار نوعيا لأنه يعتمد على الوقت الذي يختار فيه المحقق الفردي إيقاف الساعة. عندما يقوم العديد من المجربين في نفس المختبر بإجراء هذه التجارب ، فمن المفيد قضاء بعض الوقت في عرض صدمات اليرقات نفسها للاتفاق على ماهية نقطة نهاية النوبة. القيام بذلك يقلل بشكل كبير من التباين بين الأشخاص. ومع ذلك ، لا يزال من الواضح من النتائج النموذجية الموضحة في هذا التقرير أنه في حين أن التأثيرات ثابتة ، يمكن أن تختلف التوقيت بين المجربين. من المهم أيضا ملاحظة أن نمو اليرقات في درجات حرارة أقل من 25 درجة مئوية (على سبيل المثال ، 18 درجة مئوية) يقلل من شدة النوبات بسبب انخفاض النشاط العصبي خلال فترة حرجة جنينية29. وبالتالي ، يقترح استخدام ما لا يقل عن 25 درجة مئوية للنمو الجنيني / اليرقات. من المستحسن وجود حاضنة قريبة من طاولة العمل ، ويتم إزالة اليرقات الكافية فقط كما هو مطلوب لكل صدمة كهربائية. يجب حفظ اليرقات المتبقية عند 25 درجة مئوية لحين الحاجة. من خلال الممارسة ، يمكن للمجربين صدمة ما يصل إلى 4 يرقات في المرة الواحدة ، مع تباعد الصدمات بفواصل زمنية 10 ثوان. يعمل هذا النهج على تسريع التقدم بشكل كبير ، ويمكن تحقيق n من 40 يرقة (أو أكثر) في يوم واحد. لم يتم قياس الرطوبة أو التحكم فيها خلال هذه الدراسة. تم اختيار دورة قياسية من 12:12 إلى الظلام الفاتح ، ولكن يمكن أن تتنوع حسب رغبة المترجم.
يعد تصنيع المسبار هو الجزء الأكثر تحديا في هذه الطريقة. وبالتالي ، بمجرد صنعه ، يجب توخي الحذر الشديد لعدم إتلافه. غالبا ما يستلزم أي ضرر يحدث لمسبار الصدمات الكهربائية إصلاحا ، وبالتالي ، يحتاج المسبار إلى إعادة معايرة لتحديد الجهد الأمثل. يعتمد الجهد كليا على المسافة بين السلكين ، وعلى هذا النحو ، من غير المحتمل أن يكون هناك مجسان متطابقان. ينصح بإعادة معايرة المسبار كل شهر للتأكد من عدم تغيير الجهد الأمثل. تعتمد قوة الصدمة الكهربائية على كل من الجهد المطبق ومدة الجهد. وبالتالي ، من المحتمل أن تنتج الفترات الأقصر ذات الفولتية العالية نفس الاستجابة مثل الفترات الأطول ، باستخدام تحفيز جهد أضعف. ومع ذلك ، لم يتم التحقيق في هذا المجال. يمكن استيعاب تفضيل مدة 2 ثانية (في هذه الدراسة) بسهولة دون صدمة الحركة غير الضرورية لليرقات. يتيح ذلك قوة جهد أقل نسبيا ، مما يتجنب تلف بشرة اليرقات. يعتمد تأثير التحفيز أيضا على القوة الحالية (الأمبير) ، والتي لا نقيسها. ومع ذلك ، فإن المحفزات المختلفة ستنتج تيارات مختلفة ، وبالتالي ، وجد أنه باستخدام محفز Grass S8825 ، تم استخدام جهد 50 فولت / 3 ثانية ، أثناء استخدام المحفز المستخدم هنا ، تم استخدام 6-12 فولت / 2 ثانية ، اعتمادا على المسبار المستخدم. الجهد / المدة الفعلية المستخدمة ليست مهمة للغاية طالما أنها كافية للحث على وقت استرداد أطول من التحكم في النوع البري ولا تلحق الضرر باليرقة. نظرا لأن مجرد وضع مسبار على يرقة (باستخدام 0 فولت كعنصر تحكم) يسبب درجة معينة من التجميد / الشلل (يدل على محاولة تجنب الافتراس) ، فلا توجد معايير تحفيز لن تحفز بعض السلوك "الشبيه بالنوبات".
اختبار الصدمات الكهربائية مناسب لفحص الأدوية بحثا عن نشاط مضاد للنوبات. القضية دائما مذيبة. وجد أن الإيثانول أو الأسيتون مذيبات أفضل من DMSO. في التجارب الحالية ، يتم تحمل DMSO بنسبة تصل إلى ~ 1٪ ، وبعد ذلك لوحظ فتاك غير مقبول في تطور اليرقات. من بين الخيارين لتعريض اليرقة للأدوية ، إما إضافة الدواء (المذاب في مذيب مناسب) إلى الجزء العلوي من قارورة الطعام أو الإضافة إلى طعام الذباب الذائب ، وجد أن الأخير ينتج نتائج أفضل من حيث تقليل التباين. ومع ذلك ، فإن الفرق هامشي ، والطريقة الأولى أسرع. يوصى بأن يقارن المجربون كلتا الطريقتين ويختارون الطريقة الأنسب. يمكن السماح للذباب بوضع البيض على طعام يحتوي على المخدرات ، بحيث يتعرض نمو اليرقات بالكامل للحفر. بدلا من ذلك ، يمكن وضع اليرقات على الأغذية المحتوية على الأدوية في أي مرحلة مرغوبة لتحديد التوقيت الحرج لنشاط الدواء. يعد إطعام الأدوية للإناث الحاملة طريقة فعالة لتعريض الأجنة النامية للأدوية25.
مقايسة النوبات البديلة والشائعة الاستخدام هي استخدام أجنة الزرد المعرضة للبنتيلين تترازول المسببة للاختلاج للكشف عنASMs 30. في رأينا ، فإن اختبار ذبابة الفاكهة له العديد من المزايا. وتشمل هذه (1) يصعب إذابة العديد من المركبات في مياه البحر الاصطناعية التي تسبح فيها الأسماك ؛ (2) يعتمد اختبار أسماك الزرد على تقليل طول السباحة ، والذي يمكن أن يحدث إما من التعرض للطفولة الزجاجية الصينية أو ، على عكس ما هو متوقع ، مركب مسبب للاختلاج. وذلك لأن زيادة نشاط النوبات في أسماك الزرد تؤدي أيضا إلى انخفاض السباحة10. وبالتالي ، يجب متابعة أي ضربات مركبة بشاشة ثانوية ، والتي غالبا ما تتطلب قياس الجينات العصبية المبكرة مثل c-fos. (3) لا يمكن استخدام الأسماك إلا بدون ترخيص حتى اليوم 5 بعد الفقس. بالطبع ، تتمتع أسماك الزرد بميزة واضحة على الحشرات من حيث أن الناقل العصبي المثير الأساسي هو الغلوتامات وليس الأسيتيلكولين 31. قد يوفر الجمع بين المقياسين ، بدءا من ذبابة الفاكهة ويتبعه أسماك الزرد ، شاشة قوية جدا قبل اختبار عدد أقل من المركبات الضاربة على الفئران.
للتلخيص ، يوفر اختبار الصدمات الكهربائية ذبابة الفاكهة ، إلى جانب الحفظ العالي في علم الوراثة وعلم وظائف الأعضاء المشترك بين الذباب والثدييات ، شاشة فعالة للغاية وسريعة وغير مكلفة لتحديد العلاجات الجديدة المضادة للنوبات. سيؤدي الاعتماد المتزايد لهذه الحشرة لفحص الأدوية أيضا إلى تلبية الحاجة الملحة لتقليل عدد ذات الدرجة العالية المستخدمة في البحث الطبي.
Disclosures
ويعلن أصحاب البلاغ عدم وجود مصالح متضاربة.
Acknowledgements
نشكر العديد من موظفي مختبر بينز الذين طوروا هذه التقنية بشكل مشترك على مدى سنوات عديدة ، وعلى وجه الخصوص ، ريتشارد مارلي ، الذي بذل قدرا كبيرا من الجهد لجعل هذه التقنية قوية وموثوقة. نشكر آنا مونرو على رسم اليرقات ، كما هو موضح في الشكل 2. تم دعم العمل في مختبر Baines الذي ساهم في تطوير هذه التقنية بسخاء من قبل BBSRC و MRC و Wellcome Trust. يتم دعم هذا العمل حاليا بتمويل من جائزة محقق Wellcome Trust إلى R.A.B. (المنحة 217099/Z/19/Z). استفاد تطوير هذه التقنية أيضا من مرفق مانشستر فلاي ، الذي تم إنشاؤه من خلال أموال من الجامعة وصندوق ويلكوم (Grant 087742 / Z / 08 / Z).
Materials
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
References
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved