Method Article
ショウジョウバエの幼虫における電気ショックによる発作活動
要約
このプロトコルでは、てんかんの治療のためのユニークな抗てんかん化合物を特定するための ショウジョウバエ の幼虫の使用について詳しく説明します。
要約
てんかんは、薬物抵抗性の人の数が多いために悪化する重大な健康負担を呈しています。薬剤抵抗性の患者の中には、非薬物治療(迷走神経刺激療法、ケトン食療法など)に反応する人もいますが、多くの人にとって最後の手段は、発作を緩和するための困難で高価な手術です。一般に、より幅広い標的を持つ抗てんかん薬が必要であると認識されていますが、それを実現するためのハードルは、新規薬剤の標的の特定です。遺伝的に扱いやすいモデル動物は、この点で有望です。ショウジョウバエ( Drosophila melanogaster)は、発作のメカニズムとより良い治療法を調査するための強力なモデルとなっています。多くの同定されたハエの突然変異は、幼虫と成虫が強い刺激(電気的、機械的、および/または熱的)に反応して発作のような活動を示す結果となります。これらの突然変異の多くは、ヒトの遺伝的てんかんの原因となる遺伝子と相同な遺伝子(電位依存性Na+ チャネルなど)に存在します。また、ハエの遺伝子を、さらに疾患関連の突然変異を持つヒトの遺伝子に置き換えることも可能になりました。このように、謙虚なハエは人間の病気をモデル化するためのアバターになりました。この研究では、 ショウジョウバエ の幼虫を低から中程度のスループットの薬物スクリーニングに使用して、抗発作性を持つユニークな化合物とその標的を特定するための適切な方法について説明します。
概要
てんかんは依然として大きな健康上の負担であり、世界の人口の約1%が罹患しています。現在、臨床治療のために30種類以上の抗てんかん薬(ASM)が存在しますが、てんかん患者の約3分の1は依然として薬剤抵抗性であり、薬物治療にうまく反応しないことを意味します1,2。また、利用可能な薬物は緩和薬に過ぎず、そのため、てんかんの発生を予防することも、治療法を提供することもできません3。したがって、より良いてんかん治療を特定することが非常に重要です。より効果的な治療法の開発を阻むのは、新規薬剤の標的の特定です。実際、現在のASMのほとんどすべてが、電位依存性ナトリウムチャネル(Nav)を含むイオンチャネルや、γ-アミノ酪酸(GABA)4,5によって媒介される抑制性神経伝達など、同様の標的に影響を与えています。従来の医薬品開発方法を継続的に使用しても、このシナリオが根本的を変える可能性は低いと一般に認められています。
ショウジョウバエDrosophila melanogaster、およびゼブラフィッシュDanio rerioを含むがこれらに限定されない実験モデル動物は、新規ASMの同定に有用性を有する6,7,8。実際、PubMedで「ショウジョウバエ+発作」を検索すると342件、ゼブラフィッシュを検索すると578件が返されます(どちらの検索も2025年1月29日に実施されました)。マウスでの同様の研究の数(~15,000)には及ばないものの、モデルシステムを使用した研究の数は増え続けています。これらの研究は、門全体のCNS機能の機構的保存により可能になります。さらに、ハエや魚の誘発性発作は、臨床的に使用されたASMで効果的に治療されており、発作行動のニュアンスが外見上は異なるように見えるかもしれないが、根本的なメカニズムには多くの共通点があることを示しています7,9,10。
ショウジョウバエ(ショウジョウバエ)は、人間の生物学の理解に多くの重要な貢献をしてきました。てんかんに関しては、このモデルシステムは、識別可能で実験的にアクセス可能なニューロンと組み合わせた比類のない遺伝的ツールボックスを提供します7。さらに、幼虫と成体の両方のCNSのコネクトームが現在公開されており、多数の細胞特異的な遺伝的ドライバー系統が同定されています11,12。重要なことに、成虫のハエが姿勢の喪失や発作のような活動(例えば、翼のブーンという音、脚の震えなど)によって強い機械的刺激に反応するという突然変異のクラスが偶然に特定されました。このクラスの突然変異は、「強打感受性」と呼ばれています13,14,15,16。その後、体温上昇に反応する第2のクラスの発作変異が同定されており、これはヒトの熱性けいれんを反映している17,18。しかし、成虫のハエの実験的な扱いやすさは、この同じ昆虫モデルの幼虫期と比較してやや低下しています。例えば、成虫のハエに薬剤を与えることは困難であり、電気生理学や光遺伝学などのより侵襲的な技術はより困難になる可能性があります。対照的に、ショウジョウバエの幼虫は、蛹化を可能にするために、わずか5日間で体の体積を~100倍に拡大するために絶えず食べます。したがって、幼虫期における適切な薬物摂食に自信を持つことができます。胚形成は十分に文書化されており、正確に病期分類することができ、その結果、ニューロンの電気的特性の最初の獲得から回路形成まで、CNS発生における重要なマイルストーンが特定されている19。孵化すると、幼虫は3回の脱皮(またはインスター)を経て、5日目に「さまよう」になり、その後、蛹になる安全な場所を見つけるために餌を離れます。蛹化~100時間後、新しい体と中枢神経系を持つ成虫のハエが出現します(図1)。
成虫の発作を誘発する技術は、幼虫期にはあまり適していません。幼虫には感覚毛がないため、機械的刺激中に感覚毛が同期して活性化すると発作を引き起こす可能性があります。そこで、これらの困難を克服するために、徘徊する幼虫の段階で発作を誘発する電気ショック法が開発されました。その後、幼虫と成虫の両方にわたる発作誘発技術の比較分析により、幼虫の電気ショックは突然変異タイプ(例えば、強打感受 性と温度)にはるかに依存しないことが明らかになりました。したがって、この手法は、最適な発作誘発方法が不明な新規変異をテストするための好ましい方法であるべきであることを示唆しています20。幼虫の電気ショック技術はシンプルで迅速で、必要な機器は最小限です。この技術は、ヒトてんかんの遺伝的多様性を反映したさまざまな変異に対して、新規化合物や遺伝子治療薬の抗てんかん効果をスクリーニングするための効率的な手段を提供します。
プロトコル
この研究では、ショウジョウバエ( Drosophila melanogaster)が使用されています(詳細については、結果のセクションを参照)。この手法は、徘徊するサードインスター幼虫(L3)に最適です。実験プロトコルは比較的単純ですが、完璧にするには練習が必要です。私たちの経験では、新入生はアッセイを習得するのに約2週間かかり、他の経験豊富な研究者がカメラ対応の解剖顕微鏡などを使用してリアルタイムでアッセイを実行するのを見ることで大きなメリットが得られます。この研究で使用した試薬と機器は、 材料表に記載されています。
1.幼虫の選択
- 標準的な食品(5 Lの水、390 gのブドウ糖、360 gのトウモロコシ、250 gの酵母、40 gの寒天、135 mLのニパギン、15 mLのプロピオン酸)が入ったハエのバイアル/ボトルの側面から幼虫を採取します。.
- 活発に動いていて、餌を離れて容器の側面を這い上がった幼虫のみを使用してください(さまよう3番目のインスター、L3)。移動が大幅に減少する前蛹を選択しないでください。
2.電気ショックの手順
- 1つのさまようL3を取り出し、小さなプラスチック製のペトリ皿(サイズは関係ありません)に移し、ddH2Oで優しく洗って食品の残留物を取り除きます。これには、小さな(000)絵筆が適しています。
- 絵筆を使用して、1回洗った幼虫を空のプラスチック皿に移します(これもサイズは関係ありません)。鉗子で保持されたペーパータオルの小さな断片で幼虫を乾かします。余分なddH2Oを取り除きますが、プラスチック皿に付着しないように、幼虫を完全に乾燥させないでください。
- 幼虫が30秒間回復するのを待ちます。これにより、電気ショックプローブを簡単に配置できます(以下を参照)。
- 低倍率の解剖顕微鏡(15-20x)で幼虫を観察し、正常な這う行動が再開したら、電気ショックプローブを静かに置きます(詳細についてはステップ3と 図2Aを参照)中枢神経系のおおよその位置より上の幼虫の前面背面( 図2Cを参照)。
注:このステップは重要であり、プローブワイヤーとキューティクルの間に良好な導電性を提供するために十分な圧力をかける必要がありますが、幼虫を傷つけないように注意してください。したがって、幼虫をその深さの約3分の1から2分の1で押しつぶします。 - 定電圧の2秒パルスを印加し、その強度は滴定曲線 によって 事前に決定されています(図3)。ここでは、絶縁型電圧刺激装置が適しています。ここで使用されているものを 図 2B に示します。
- 感電後、タイマーを始動します。ショックに反応して、幼虫は一時的な麻痺を開始し、その後、体壁の筋肉活動と転がり行動の時折けいれんを起こし、正常な這う行動を停止します。
- 幼虫が皿の上の元の位置から明らかに離れたら、タイマーを停止します。発作持続時間、または回復時間(RT)は、刺激の開始から正常なクロール行動の再開までの期間として定義されます(例:前方への蠕動波が前方に広がるため、前方への動きが促進されます)。
- 毎日の終わりに、まず100%エタノールですすいでプローブワイヤーを慎重に洗浄し、続いてddH2O.拡大下でワイヤーを慎重に検査し、必要に応じて、鉗子を使用してワイヤーから残留物を穏やかにこすり落とします。その際、2本のワイヤ間の距離を変更しないように十分注意してください。
3.電気ショックプローブの構造
- 2 x 1 m の長さの電線 (細くて柔軟性があり、定格が ~3 A であること) が必要になります。各ワイヤの端に、長さ5cmのタングステンワイヤをはんだ付けします(接触を最大化するには、はんだ付けする前に、電線の露出した端にタングステンワイヤを巻き付けます)。プッシュフィットコネクタ(バナナプラグなど)をワイヤのもう一方の端にはんだ付けし、電圧刺激装置に簡単に接続するのに適しています。
- 両方のタングステンワイヤを電極ホルダーに固定し、ワイヤが互いに平行になるようにします(図2)。ガラスキャピラリーの小さな部分(長さ~2cm)を使用して、プローブロックネジの下にワイヤーを所定の位置に保持します。
- 鉗子を使用して、ワイヤーホルダーを出る場所の近くで1〜2mm以内に来るようにワイヤーを曲げます。タングステンワイヤーを曲げることは、ワイヤーが「記憶」を保持しているため、簡単ではありません-したがって、忍耐力が必要です。このプロセスを支援するためのヒントには、電気絶縁テープやブルータック(または同様のモデリングパテ)を使用して、ワイヤを正しい向き/距離に維持することが含まれます。
4.プローブのキャリブレーション
- 適切な野生型(ネガティブコントロール)と発作変異体(ポジティブコントロール)のワンダリングL3のストックがあることを確認してください。それぞれ~100個必要になります。
- 上記のように、幼虫を一度に1匹ずつ準備します。
- プローブを使用して、テストする各電圧について、各遺伝子型の十分な幼虫に電圧の範囲を印加します。0 V、2 V、4 V、6 V、8 V、10 V、および12 Vを、電圧あたり10〜15匹の幼虫の2秒間印加することをお勧めします。各幼虫に一度だけショックを与えます。
- 各幼虫の回復時間を測定し、両方の遺伝子型に適用される各電圧ステップの平均を計算します。
- 平均をグラフにプロットし、データを直線で近似します。
- コントロール変異体と発作変異体との間に明確で有意な差がある電圧を選択します。回復時間が長すぎる電圧を選択しないように注意してください。そうしないと、回復の待ち時間が長くなるため、生産性が低下します。
注:この研究では、野生型で50〜100秒、 パラbssで200〜300秒の回復時間をもたらす刺激電圧をよく使用しました。模範的な検量線を 図3に示します。プローブを幼虫の背側表面に押し付ける行為を説明するために、0 Vを使用することが重要です。これにより、ある程度の麻痺が引き起こされますが、これは幼虫の防御メカニズムである可能性があります。
5. 実験の実施
- 目的の遺伝子型の電気ショック幼虫または薬物曝露を行い、発作の回復時間を測定します。
注:テスト幼虫の場合、通常はn = 20で十分ですが、パイロット分析に基づく検出力の計算により、より明確なn数が得られます。 - 各実験では、常にネガティブコントロール(野生型など)とポジティブコントロール( parabssなど)を実行します。n の数値は大きくする必要はありません。n = 5で十分です。これにより、アッセイが期待どおりに機能したという確信が得られます(プローブや刺激装置に問題がないなど)。
- 回復時間が長くなりすぎないようにカットオフ(例:300秒)を適用し、回復時間が30秒を超える発作として定量化可能な発作のみを考慮します。
6. 薬物スクリーニング
- 適切な溶媒に溶解した薬剤を食品表面に直接加え、浸漬させます(エタノールを使用する場合は溶媒蒸発の時間)。あるいは、あるいは、溶かしたハエの餌に(適切な溶媒で)薬物を加えることができる。詳細については、「結果」セクションを参照してください。
- 溶かした食品に薬剤を添加するには、バイアルから食品をすくい取り、再度溶かし、食品が40°Cに冷えたら薬剤を加え、ボルテックスミキサーで混合し、溶かした食品5mLをバイアルに戻し、冷ましてから使用してください。
- 濃度勾配を実行して、最適な薬物濃度を特定します。
注:良い出発点は、3 mMの薬物溶液を食品表面に直接添加するか(標準的な ショウジョウバエ バイアルあたり200 μL)、または溶融食品中に3 mMの濃度を作ることです。成虫の雌は、この食品に直接卵を産むことを許可することも、必要に応じて選択した段階で幼虫を追加することもできます。使用する溶媒は、ビヒクル制御として選択したバイアルに単独で追加する必要があります。
結果
多数のショウジョウバエの突然変異は、発作様の振る舞いを増強する7,20。これらの突然変異の遺伝的基盤はさまざまであり、これはヒトてんかんの同様に多様な遺伝的原因を好意的に模倣しています。最も研究されているショウジョウバエの突然変異の3つは、parabangsenseless(parabss)、julius seizure(jus)、およびeasy-shocked(eas)です。パラbss変異は、麻痺性電位依存性Na+チャネルの機能獲得をもたらし、easはエタノールアミンキナーゼをコードし、jusはまだ同定されていない膜タンパク質である(jusは最近までスラムダンスと呼ばれていたことに注意)16,21,22。これらの遺伝子の多くはヒトの相同体を持っています。例えば、麻痺はヒトのNav遺伝子の相同体であり、その突然変異が遺伝性てんかんの主な原因である23。ヒトのてんかんと同様に、これら3つの「強打感受性」ハエの突然変異は、電気ショックに反応して異なる発作の「重症度」を示します(図4)。最も長い回復時間(すなわち、最も深刻な発作行動)はparabssで示され、jusは最も短い回復時間を示します。この異なる反応は、根底にある遺伝子変異の違いによるもので、実験者は、リード化合物がさまざまな変異で発作をどのように減少させるかをテストし、良好な広域スペクトル活性を持つものを特定することができます。
クリニックで使用されている多くのASMは、ショウジョウバエの発作モデルでも同様に効果的であり、したがって、ショウジョウバエの発作を引き起こす根本的なメカニズムは、てんかん患者の発作を引き起こすメカニズムと類似していることを示しています9,24,25。図5は、最も臨床的に使用されている2つのASM、バルプロ酸ナトリウム(VPA)とフェニトイン(PHY)のパラbssに対する効果を示しています。幼虫は、幼虫の発育全体を通じて、食物に含まれるASM(溶融食品に加えられたASM)を3 mMで自由に摂食することが許可されました。野生型(Canton-S、CS)とparabss供給車両制御(それぞれエタノールと水)を各実験に含め、それぞれのASMをpar bss供給しました。両薬剤とも、発作回復時間(RT)が明確かつ大幅に短縮されています。野生型と既知の発作変異(parabss)の両方が、ASMに曝露されていないと予想される発作活性を示すことを考えると、これら2つの実験の妥当性に自信を持つことができます。そうでない場合は、アッセイを破棄し、実験を繰り返す必要があります。このような「失敗」の根本的な原因は、多くの場合、電気ショックプローブの損傷、刺激装置のバッテリー残量が少ない、および/または実験者の経験不足です。25°C未満の温度でのフライのメンテナンスも避けるべきです(ディスカッションセクションを参照)。この手法はハイスループットスクリーニングには適していませんが、最近、~30種類の化合物のロースループットスクリーニングで使用され、ニューロンの恒常性の調節因子であるPumilioの操作により発作を効果的に低減する新しいクラスの化学物質が同定されました。定義されたマウス発作モデルにおけるこれらの同じ化合物の発作を減らすための正の翻訳は、リード化合物と新規標的26,27の両方のさらなる開発のためのエキサイティングな可能性を示しています。
ここに示されている代表的な結果(図4 と 図5)を調べると、データの広がりにばらつきがあることが明らかです。また、これら 2 つの図に示されているデータ間の野生型値にもわずかな違いがあります。そのため、このアッセイは定性的であり、遺伝子型間や薬物スクリーニングアッセイにおける発作の重症度のわずかな差を特定するのには適していません。しかし、このアッセイは、未知の変異における発作表現型の同定、および/または抗発作活性のための化合物の初期試験によく適している27。しかし、医薬品開発をさらに洗練させるには、異なるアッセイが必要になります。

図1:ショウジョウバエのライフサイクル。蛹化による胚から成虫までのショウジョウバエのライフサイクルを示す模式図。示されているタイミングは、25°Cでの発達の概算です。この図の拡大版を表示するには、ここをクリックしてください。

図2:電気ショックプローブの設計と配置。 (A)は、プローブを上面と側面の両方から見た画像です。ブルータックは、タングステンワイヤがプローブから伸びるため、ワイヤ間距離を~2mmに維持するために使用されています。ガラスキャピラリーの短い部分(矢印)は、タングステンワイヤーを所定の位置に保持します。刺激装置に接続する電線は、電気絶縁テープでプローブハンドルに沿って覆われ、保持されています。(B)は、この研究で使用した推奨定電圧絶縁刺激装置を示しています。(C)は、さまようサードインスター幼虫の前面背側表面を横切る刺激プローブのおおよその位置を示しています。プローブワイヤーは幼虫の体を横切って伸びており、CNSのすぐ上の領域はワイヤー間距離が~2mmであることに注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
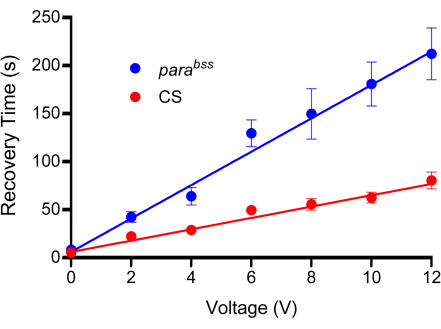
図3:検量線。 実験の前に、電気ショックに適した電圧を決定する必要があります。すべてのプローブは、その製造の性質上、わずかに異なります。野生型(この場合はCanton-S、CS)と発作変異体(推奨、 parabss)は、それぞれ2秒の固定持続時間で設定された電圧ショックの増加を受けます。幼虫は一度だけショックを受けるため、テストされる電圧ごとに最小n = 10を使用する必要があります(この場合はn = 12)。ラインフィットから、 パラbss はすべての電圧で焼付き回復時間の増加を示していることは明らかです。選択された電圧は、対照群と発作変異体との間に明確で有意な違いを生じさせるはずです。示されているプロットでは、6 V 以上で差が大きくなります (p ≤ 0.0001、Šidák の多重比較による二元配置分散分析、n = 12、遺伝子型と電圧ごと)。したがって、このプローブの最適な電圧として6Vが選択されましたが、これは大きな違いを生じさせながらも回復時間が短く保たれ、個々の電気ショックの伝導にかかる時間が短縮されるためです。データは平均±SEMとして示されています。 この図の拡大版を表示するには、ここをクリックしてください。
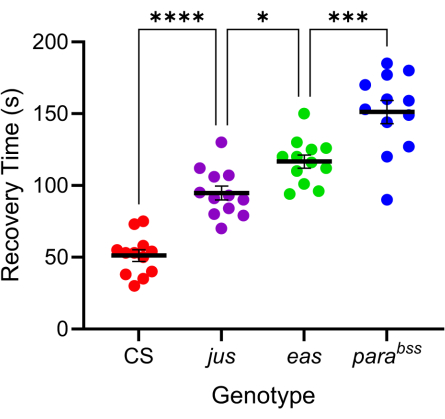
図4:ショウジョウバエの突然変異が異なれば、発作の重症度も異なる。 図3で較正したプローブを用いて、3つのショウジョウバエ発作変異体(parabss、jus、eas)と野生型(CS)を電気ショック(6V、2秒)にかけました。個々の幼虫がショックを受けたのは一度だけでした。発作の回復時間は、野生型よりも発作変異体の方が長く、jusからparabss(それぞれp≤0.0001、テューキーの多重比較による一元配置ANOVA)に漸進的に増加します。Tukey の多重比較による統計的に有意な比較は、****p ≤ 0.0001、******p ≤ 0.001、**p ≤ 0.01、*p ≤ 0.05 として示されます。データは平均±SEMとして示されています。この図の拡大版を表示するには、ここをクリックしてください。
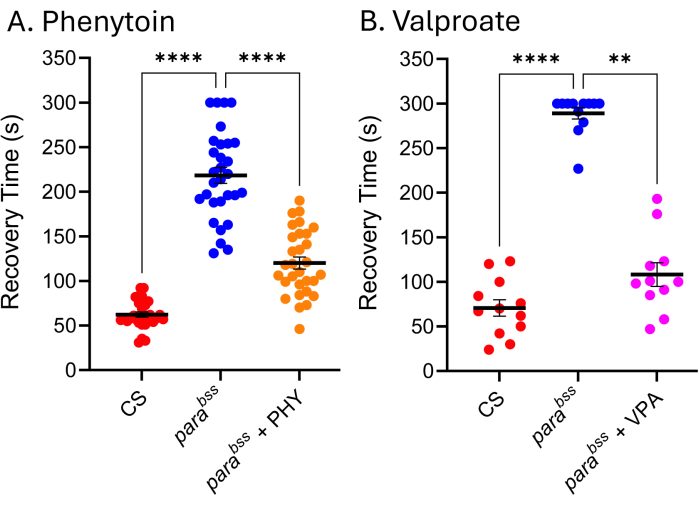
図5: ショウジョウバエ 発作変異体は、臨床的に使用されたASMに反応します。 (A)フェニトイン(PHY)および(B)バルプロ酸ナトリウム(VPA)(それぞれ3mM)へのばく露は、 パラbss の発作回復時間を有意に短縮した(p≤.01、Kruskal-WallisとDunnの多重比較、 およびp ≤.0001、Tukeyの多重比較による一元配置ANOVA)。30 秒を超える回復時間のみが定量化可能な発作と見なされ、これらのアッセイでは 300 秒のカットオフ値が使用されました。各薬物アッセイは、異なる実験者によって実施されました。したがって、示される平均回復時間は異なります(特に薬物を使用しない パラBSS で顕著です)。このことは、このアッセイが定性的であり、したがって、野生型と発作変異体を各アッセイに含めるべきであるという事実を強調しています。これにより、必要に応じて実験間で薬物活性を正常化することができます。Dunn と Tukey の多重比較による統計的に有意な比較は、****p ≤ 0.0001、***p ≤ 0.001、**p ≤ 0.01、*p ≤ 0.05 として示されます。データは平均±SEMとして示されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ショウジョウバエの幼虫に発作を誘発する電気ショック法は、新規の抗てんかん化合物や遺伝子操作を特定するためのシンプルでありながら効率的なスクリーニングを提供します。しかし、これは定性的なアッセイであるため、その主な制限は、この方法では小さな効果サイズを容易に特定できないことです。それにもかかわらず、研究者1人あたり週に最大~5種類の化合物をスクリーニングできる中程度のスループットにより、非常に強力な全動物アッセイが得られます。この手法のシンプルさは、学部レベルの研究室プロジェクトにも適しています。したがって、3〜4人の研究者は、比較的短時間で多くの化合物をスクリーニングでき、同等のマウス発作アッセイを使用するよりもはるかに少ない費用でスクリーニングできます。アッセイの自動化により、スループットがさらに向上します。しかし、この研究ではこれに成功しませんでした。寒天内に2つの電極が埋め込まれたリチウム含有寒天培地は、複数の幼虫に同時に衝撃を与える試みられましたが、成功しませんでした。他の方法、おそらく光遺伝学に基づく方法は、自動化により適しているかもしれない28。
しかし、アッセイの単純さは、熟練者になるための要件を損ないます。プローブの位置と電気ショック中に加えられる圧力は重要なステップです。両方の一貫性により、ショックを受けた幼虫の回復時間間のばらつきが減少します。もう一つの主要な問題は、発作エンドポイントをどのように認識するかであり、これは個々の研究者が時計を止めることをいつ選択するかに依存するため、このアッセイを定性的なものにします。同じ研究室の複数の実験者がこれらの実験を行う場合、発作のエンドポイントが何であるかについて合意するために、同じ幼虫のショックを見るのに時間を費やす価値があります。これにより、人物間のばらつきが大幅に減少します。しかし、このレポートで示された例示的な結果から、効果は一定である一方で、タイミングは実験者によって異なる可能性があることは依然として明らかです。また、25°C未満(例えば、18°C)の温度での幼虫の発育は、胚の臨界期における神経活動の低下による発作の重症度を低下させることに注意することも重要である29。したがって、胚/幼虫の発育には最低25°Cを使用することが推奨されます。作業台の近くにインキュベーターを置くことが望ましく、各電気ショックに必要な量の幼虫のみが除去されます。残りの幼虫は、必要になるまで25°Cに保つ必要があります。練習を重ねることで、実験者は一度に最大4匹の幼虫にショックを与えることができ、ショックの間隔を10秒ずつ空けることができます。このアプローチは進行を大幅にスピードアップし、1日で40匹(またはそれ以上)のnを達成できます。この研究では、湿度は測定または制御されませんでした。標準的な12:12の明暗サイクルが選択されましたが、これは実験者が望むように変更することができます。
プローブの製造は、この方法の最も困難な部分です。したがって、一度作成したら、それを損傷しないように細心の注意を払う必要があります。電気ショックプローブに損傷が発生すると、多くの場合、修理が必要になるため、最適な電圧を決定するためにプローブを再校正する必要があります。電圧は2本のワイヤ間の距離に完全に依存するため、2つのプローブが同じになる可能性は低いです。最適な電圧が変更されていないことを確認するために、プローブを毎月再校正することをお勧めします。電気ショックの強度は、印加される電圧と電圧の持続時間の両方に依存します。したがって、電圧が高い短い持続時間は、弱い電圧刺激を使用して、より長い持続時間と同じ応答を生成する可能性があります。しかし、この空間は調査されていません。2秒の持続時間の好み(この研究では)は、幼虫が過度に動くことなく簡単に適応できます。これにより、比較的低い電圧強度が可能になり、幼虫のキューティクルへの損傷を回避できます。刺激の影響は、電流強度(アンペア)にも依存しますが、これは測定しません。しかし、異なる刺激装置は異なるアンペア数を生成するため、Grass S88刺激装置25を使用すると、50 V / 3秒の電圧が使用され、ここで使用される刺激装置を使用すると、使用されるプローブに応じて6〜12 V / 2秒が使用されることがわかりました。実際に使用される電圧/持続時間は、野生型コントロールよりも長い回復時間を誘発するのに十分であり、幼虫に損傷を与えない限り、過度に重要ではありません。プローブを幼虫に装着するだけの行為(0Vをコントロールとして使用)は、ある程度の凍結/麻痺を引き起こすため(捕食を避ける試みを示す)、何らかの「発作のような」行動を誘発しない刺激基準はありません。
電気ショックアッセイは、抗てんかん活性のための薬物のスクリーニングに適しています。問題は常に解決力があります。エタノールまたはアセトンはDMSOよりも優れた溶媒であることがわかりました。現在の実験では、DMSOは最大~1%まで許容され、それを超えると、発育中の幼虫では許容できない致死性が観察されました。幼虫を薬物に曝露する2つの選択肢のうち、食品バイアルの上部に薬物(適切な溶媒に溶解)を追加するか、溶融したフライフードに追加するかのいずれかで、後者の方が変動性の減少という点でより良い結果をもたらすことがわかりました。ただし、その差はわずかであり、前者の方法の方が迅速です。実験者は両方の方法を比較し、最も適したものを選択することをお勧めします。ハエは、幼虫の発育全体が掘られたものにさらされるように、薬物を含む食品に卵を産むことを許可することができます。あるいは、幼虫を任意の所望の段階で薬物含有食品に載せて、薬物活性の重要なタイミングを特定することができます。妊娠した女性に薬物を与えることは、発生中の胚を薬物にさらす効果的な方法です25。
代替の一般的に使用される発作アッセイは、ゼブラフィッシュの胚をプロコンブルサントペンチレンテトラゾールに曝露してASMs30をスクリーニングすることです。私たちの意見では、 ショウジョウバエ の幼虫アッセイには多くの利点があります。これらには、(1)多くの化合物は、魚が泳ぐ人工海水に溶解するのが困難です。(2)ゼブラフィッシュアッセイは、ASMへの曝露または直感に反して、痙攣誘発性化合物への曝露によって発生する可能性のある遊泳距離の短縮に依存しています。これは、ゼブラフィッシュの発作活動が増加すると、遊泳も減少するためです10。したがって、化合物のヒットは二次スクリーニングで追跡する必要があり、これには多くの場合、c-fosなどの早期誘導性ニューロン遺伝子の測定が必要になります。(3)魚は、孵化後5日目まで動物免許がなくても使用できます。もちろん、ゼブラフィッシュは、主要な興奮性神経伝達物質がアセチルコリン31ではなくグルタミン酸であるという点で、昆虫よりも明確な利点があります。 ショウジョウバエ から始まり、ゼブラフィッシュに続く2つのアッセイの組み合わせは、マウスでテストされるヒット化合物が少なくなる前に、非常に強力なスクリーニングを提供する可能性があります。
要約すると、 ショウジョウバエ 幼虫の電気ショックアッセイは、ハエと哺乳類の間で共有される遺伝学および生理学の高い保存性と相まって、新しい抗てんかん療法を特定するための非常に効果的で迅速かつ安価なスクリーニングを提供します。この昆虫を薬物スクリーニングに採用するケースが増えれば、医学研究に使用される高次動物の数を減らすという緊急の必要性にも対処できるでしょう。
開示事項
著者は、競合する利益を宣言しません。
謝辞
この技術を長年にわたって共同開発してきた多くのベインズ研究所のスタッフ、特にこの技術を堅牢で信頼性の高いものにするために多大な努力を払ったリチャード・マーリーに感謝します。 図2に示す幼虫を描いたAnna Munroに感謝します。この技術の開発に貢献したベインズ研究室での研究は、BBSRC、MRC、およびウェルカムトラストから寛大な支援を受けています。この研究は現在、R.A.B. (Grant 217099/Z/19/Z) への Wellcome Trust 研究者賞からの資金提供によってサポートされています。この技術の開発は、大学とウェルカム・トラスト(Grant 087742/Z/08/Z)からの資金提供によって設立されたマンチェスター・フライ・ファシリティ(Manchester Fly Facility)からも恩恵を受けた。
資料
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
参考文献
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved