Method Article
Durch Elektroschock induzierte Anfallsaktivität bei Drosophila-Larven
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verwendung von Drosophila-Larven zur Identifizierung einzigartiger Antiepileptika zur Behandlung von Epilepsie.
Zusammenfassung
Epilepsie stellt eine erhebliche gesundheitliche Belastung dar, die durch eine hohe Anzahl von Personen, die medikamentenrefraktär sind, noch verschärft wird. Während einige medikamentenrefraktäre Patienten auf nicht-medikamentöse Behandlungen ansprechen (z. B. Vagusnervstimulation, ketogene Diät usw.), ist der letzte Ausweg für viele eine schwierige und teure Operation zur Linderung von Anfällen. Es ist zwar allgemein anerkannt, dass Medikamente gegen Krampfanfälle mit einem breiteren Spektrum an Zielmolekülen erforderlich sind, aber die Hürde auf dem Weg dorthin ist die Identifizierung neuartiger Wirkstoffziele. Genetisch manipulierbare Modelltiere sind in dieser Hinsicht vielversprechend. Die Fruchtfliege, Drosophila melanogaster, ist zu einem leistungsfähigen Modell geworden, um die mechanistischen Grundlagen von Anfällen zu untersuchen und sie besser behandeln zu können. Viele identifizierte Fliegenmutationen führen dazu, dass Larven und adulte Tiere als Reaktion auf starke Stimulation (elektrisch, mechanisch und/oder thermisch) eine anfallsähnliche Aktivität zeigen. Viele dieser Mutationen befinden sich in Genen, die homolog zu denen sind, die zu genetischen Epilepsien beim Menschen beitragen (z. B. der spannungsgesteuerte Na+ -Kanal). Es ist nun auch möglich, ein Fliegen-Gen durch ein humanes Äquivalent zu ersetzen, das zusätzlich eine krankheitsbedingte Mutation trägt. So ist die bescheidene Fliege zu einem Avatar geworden, um menschliche Krankheiten zu modellieren. Diese Studie beschreibt eine geeignete Methode, um Drosophila-Larven für Wirkstoff-Screenings mit niedrigem bis mittlerem Durchsatz zu verwenden, um einzigartige Verbindungen und ihre Ziele zu identifizieren, die ein Antiepileptikum haben.
Einleitung
Epilepsie ist nach wie vor eine erhebliche gesundheitliche Belastung, von der weltweit etwa 1 % der Bevölkerung betroffen ist. Obwohl es mittlerweile über 30 Antiepileptika (ASMs) für die klinische Behandlung gibt, bleibt etwa ein Drittel der Menschen mit Epilepsie medikamentenrefraktär, was bedeutet, dass sie nicht gut auf eine medikamentöse Behandlung ansprechen 1,2. Die verfügbaren Medikamente sind ebenfalls nur palliativ und verhindern als solche weder die Epileptogenese noch bieten sie eine Heilung3. Daher besteht ein dringender Bedarf, bessere Epilepsiebehandlungen zu identifizieren. Ein Hindernis auf dem Weg zur Entwicklung wirksamerer Behandlungen ist die Identifizierung neuartiger Wirkstoffziele. In der Tat wirken sich fast alle aktuellen ASMs auf ähnliche Ziele aus: Ionenkanäle, einschließlich des spannungsgesteuerten Natriumkanals (Nav), und inhibitorische Neurotransmission, die durch γ-Aminobuttersäure (GABA) vermittelt wird4,5. Es ist allgemein anerkannt, dass die weitere Anwendung traditioneller Methoden der Arzneimittelentwicklung dieses Szenario wahrscheinlich nicht radikal ändern wird.
Labormodelltiere, einschließlich, aber nicht beschränkt auf die Fruchtfliege Drosophila melanogaster und der Zebrafisch Danio rerio, sind nützlich für die Identifizierung neuartiger ASMs 6,7,8. Tatsächlich liefert eine PubMed-Suche nach "Drosophila + Anfall" 342 Ergebnisse, während die gleiche Suche nach Zebrafischen 578 Ergebnisse liefert (beide Suchen wurden am 29. Januar 2025 durchgeführt). Obwohl die Anzahl ähnlicher Studien an Mäusen (~15.000) in den Schatten gestellt wird, wächst die Zahl der Studien mit Modellsystemen weiter. Diese Studien sind aufgrund der mechanistischen Konservierung der ZNS-Funktion über Stämme hinweg möglich. Darüber hinaus werden induzierte Anfälle bei Fliegen und Fischen effektiv mit klinisch eingesetzten ASMs behandelt, was zeigt, dass die Nuancen des Anfallsverhaltens zwar äußerlich unterschiedlich erscheinen mögen, die zugrunde liegenden Mechanismen jedoch viel gemeinsam haben 7,9,10.
Die Fruchtfliege, Drosophila, hat viele bahnbrechende Beiträge zum Verständnis der menschlichen Biologie geleistet. In Bezug auf Epilepsie bietet dieses Modellsystem einen beispiellosen genetischen Werkzeugkasten in Kombination mit identifizierbaren und experimentell zugänglichen Neuronen7. Darüber hinaus wurden nun die Konnektome sowohl für das larvale als auch für das adulte ZNS veröffentlicht und zahlreiche zellspezifische genetische Treiberlinien identifiziert 11,12. Bezeichnenderweise wurde eine Klasse von Mutationen identifiziert, bei der erwachsene Fliegen auf starke mechanische Stimulation mit einem Verlust der Haltung und anfallsähnlicher Aktivität (z. B. Flügelsummen, Zittern der Beine usw.) reagieren. Diese Klasse von Mutationen wurde als "bang-sensitiv" bezeichnet13,14,15,16. Seitdem wurde eine zweite Klasse von Anfallsmutationen identifiziert, die auf erhöhte Temperatur reagiert und die Fieberkrämpfe beim Menschen widerspiegelt17,18. Allerdings ist die experimentelle Lenkbarkeit adulter Fliegen im Vergleich zum Larvenstadium desselben Insektenmodells etwas reduziert. Zum Beispiel kann es schwierig sein, erwachsene Fliegen mit Medikamenten zu füttern, und invasivere Techniken wie Elektrophysiologie und Optogenetik können eine größere Herausforderung darstellen. Im Gegensatz dazu frisst die Drosophila-Larve ständig, um ihr Körpervolumen in nur 5 Tagen um das ~100-fache zu vergrößern und so die Verpuppung zu ermöglichen. Daher können wir uns auf eine adäquate Medikamentenfütterung im Larvenstadium verlassen. Die Embryogenese ist gut dokumentiert und kann genau inszeniert werden, was wiederum wichtige Meilensteine in der ZNS-Entwicklung identifiziert hat, einschließlich der ersten Erfassung neuronaler elektrischer Eigenschaften bis hin zur Schaltkreisbildung19. Nach dem Schlüpfen durchläuft eine Larve 3 Häutungen (oder Instars), bis sie am 5. Tag zum "Wandern" wird, woraufhin sie das Futter verlässt, um einen sicheren Ort zum Verpuppen zu finden. Nach ~100 h Verpuppung schlüpft eine adulte Fliege mit einem neuen Körper und ZNS (Abbildung 1).
Techniken zur Induktion von Anfällen bei Erwachsenen sind für Larvenstadien nicht gut geeignet. Den Larven fehlen sensorische Haare, deren synchronisierte Aktivierung bei mechanischer Stimulation zu einem Anfall führen kann. Um diese Schwierigkeiten zu überwinden, wurde daher eine Elektroschocktechnik entwickelt, um Anfälle im Wanderlarvenstadium auszulösen. Die anschließende vergleichende Analyse von Anfallsinduktionstechniken sowohl bei Larven als auch bei Erwachsenen zeigt, dass der Elektroschock der Larven weitaus weniger vom Mutationstyp abhängt (z. B. bang-sensitiv vs. Temperatur). Daher schlagen wir vor, dass diese Technik die bevorzugte Methode zum Testen neuartiger Mutationen sein sollte, bei denen die optimale Methode zur Anfallsinduktion unbekannt ist20. Die Elektroschocktechnik der Larven ist einfach, schnell und erfordert nur minimale Ausrüstung. Diese Technik bietet ein effizientes Mittel, um neuartige Verbindungen oder genetische Therapien auf die Wirksamkeit von Krampfanfällen bei einer Reihe von Mutationen zu untersuchen, die die genetische Vielfalt der menschlichen Epilepsie widerspiegeln.
Protokoll
Die Fruchtfliege, Drosophila melanogaster, wird in dieser Studie verwendet (siehe Abschnitt "Ergebnisse" für Details). Diese Technik eignet sich am besten für wandernde Larven des dritten Stadiums (L3). Das Versuchsprotokoll ist relativ einfach, erfordert aber Übung, um es zu perfektionieren. Unserer Erfahrung nach benötigen neue Studenten etwa 2 Wochen, um den Assay zu beherrschen, und profitieren stark davon, andere, erfahrenere Untersucher zu beobachten, die den Assay in Echtzeit mit einem kameragestützten Dissektionsmikroskop oder ähnlichem durchführen. Die in dieser Studie verwendeten Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. Auswahl der Larven
- Entnehmen Sie die Larven von den Seiten von Fliegenfläschchen/-flaschen, die Standardfutter enthalten (5 l Wasser, 390 g Glukose, 360 g Mais, 250 g Hefe, 40 g Agar, 135 ml Nipagin, 15 ml Propionsäure).
- Verwenden Sie nur Larven, die sich aktiv bewegen und das Futter an den Seiten des Behälters hochgekrochen sind (wanderndes drittes Stadium, L3). Wählen Sie keine Vorpuppen, die eine stark verminderte Fortbewegung aufweisen.
2. Elektroschock-Verfahren
- Entfernen Sie eine einzelne wandernde L3 und geben Sie sie in eine kleine Petrischale aus Kunststoff (die Größe spielt keine Rolle) und waschen Sie sie vorsichtig mit ddH2O, um Speisereste zu entfernen. Hierfür eignet sich ein kleiner (000) Pinsel.
- Übertragen Sie die einzeln gewaschene Larve mit einem Pinsel in eine leere Plastikschale (auch hier spielt die Größe keine Rolle). Trocknen Sie die Larve mit einem kleinen Stück Papiertuch, das mit einer Pinzette gehalten wird. Entfernen Sie überschüssiges ddH2O, trocknen Sie die Larven jedoch nicht vollständig ab, um ein Anhaften an der Kunststoffschale zu vermeiden.
- Lassen Sie die Larve 30 s lang sich erholen. Dies erleichtert das Platzieren der Elektroschocksonde (siehe unten).
- Betrachten Sie die Larven unter einem Dissektionsmikroskop mit geringer Leistung (15-20x), und sobald das normale Krabbelverhalten wieder aufgenommen wird, platzieren Sie die Elektroschocksonde (siehe Schritt 3 für Details und Abbildung 2A) vorsichtig auf der vorderen dorsalen Oberfläche der Larve über der ungefähren Position des ZNS (siehe Abbildung 2C).
HINWEIS: Dieser Schritt ist kritisch, es muss genügend Druck ausgeübt werden, um eine gute Leitfähigkeit zwischen Sondendraht und Nagelhaut zu gewährleisten, aber achten Sie darauf, die Larven nicht zu beschädigen. Zerquetschen Sie die Larve also um etwa ein Drittel bis die Hälfte ihrer Tiefe. - Legen Sie einen 2 s langen Impuls mit konstanter Spannung an, dessen Stärke über eine Titrationskurve vorbestimmt wurde (Abbildung 3). Hier eignet sich jeder isolierte Spannungsstimulator. Die hier verwendete ist in Abbildung 2B dargestellt.
- Starten Sie nach dem Stromschlag einen Timer. Als Reaktion auf den Schock beginnen die Larven eine vorübergehende Lähmung, gefolgt von gelegentlichen Krämpfen der Körperwandmuskelaktivität und des Rollverhaltens, die das normale Krabbelverhalten zum Erliegen bringen.
- Stoppen Sie den Timer, wenn sich die Larve deutlich von ihrer ursprünglichen Position auf der Schale entfernt hat. Die Anfallsdauer oder Erholungszeit (RT) ist definiert als der Zeitraum zwischen dem Einsetzen des Stimulus und der Wiederaufnahme des normalen Krabbelverhaltens (z. B. eine vollständige peristaltische Vorwärtswelle, die zu einer Vorwärtsbewegung führt).
- Reinigen Sie die Sondendrähte am Ende eines jeden Tages sorgfältig, indem Sie sie zuerst mit 100 % Ethanol und dann mit ddH2O abspülen. Untersuchen Sie die Drähte sorgfältig unter Vergrößerung und kratzen Sie bei Bedarf mit einer Pinzette vorsichtig Rückstände von den Drähten ab. Achten Sie dabei sehr darauf, den Abstand zwischen den beiden Drähten nicht zu verändern.
3. Bau der Elektroschocksonde
- Es werden 2 x 1 m lange elektrische Drähte benötigt (sollte dünn und flexibel sein, d.h. für ~3 A ausgelegt) sind erforderlich. Lötzen Sie an das Ende jedes Drahtes einen 5 cm langen Wolframdraht (um den Kontakt zu maximieren, wickeln Sie den Wolframdraht vor dem Löten um ein freiliegendes Ende des elektrischen Drahtes). Löten Sie Steckverbindungen (z. B. Bananenstecker) an das andere Ende der Drähte, die für den einfachen Anschluss an den Spannungsstimulator geeignet sind.
- Befestigen Sie beide Wolframdrähte so an einem Elektrodenhalter, dass die Drähte parallel zueinander sind (Abbildung 2). Kleine Abschnitte von Glaskapillaren (~2 cm lang) werden verwendet, um die Drähte unter der Sondenverriegelungsschraube an Ort und Stelle zu halten.
- Biegen Sie die Drähte mit einer Pinzette so, dass sie bis auf 1-2 mm an der Stelle, an der sie aus dem Drahthalter austreten, herankommen. Das Biegen von Wolframdrähten ist nicht einfach, da die Drähte ein "Gedächtnis" behalten - daher ist Ausdauer erforderlich. Zu den Tipps, die diesen Prozess unterstützen, gehört die Verwendung von elektrischem Isolierband und/oder Blu-Tack (oder ähnlichem Modellierkitt), um die Drähte in der richtigen Ausrichtung/Entfernung zu halten.
4. Kalibrierung der Sonde
- Es ist sicherzustellen, dass Bestände an wanderndem L3 eines geeigneten Wildtyps (Negativkontrolle) und einer Anfallsmutante (Positivkontrolle) vorhanden sind. ~100 von jedem werden benötigt.
- Bereiten Sie die Larven einzeln vor, wie oben beschrieben.
- Verwenden Sie die Sonde, um für jede getestete Spannung eine Reihe von Spannungen an eine ausreichende Anzahl von Larven jedes Genotyps anzulegen. Es wird empfohlen, 0 V, 2 V, 4 V, 6 V, 8 V, 10 V und 12 V für 2 s zwischen 10 und 15 Larven pro Spannung anzulegen. Schocken Sie jede Larve nur einmal.
- Messen Sie die Erholungszeit für jede Larve und berechnen Sie den Durchschnitt für jeden Spannungsschritt, der für beide Genotypen angewendet wird.
- Zeichnen Sie die Durchschnittswerte in einem Diagramm und passen Sie die Daten mit einer geraden Linie an.
- Wählen Sie eine Spannung mit einem deutlichen und signifikanten Unterschied zwischen der Kontroll- und der Anfallsmutante. Achten Sie darauf, keine Spannung zu wählen, die eine zu lange Wiederherstellungszeit erzeugt. Andernfalls leidet die Produktivität aufgrund der langen Wartezeit auf die Wiederherstellung.
HINWEIS: In dieser Studie wurde häufig eine Stimulationsspannung verwendet, die zu einer Erholungszeit von 50-100 s für Wildtyp und 200-300 s für parabss führt. Beispiele für Kalibrierungskurven sind in Abbildung 3 dargestellt. Es ist wichtig, 0 V zu verwenden, um den Akt des Drückens der Sonde auf die Rückenfläche einer Larve zu berücksichtigen. Dies führt zu einer gewissen Lähmung, die wahrscheinlich ein Abwehrmechanismus der Larve ist.
5. Durchführung von Versuchen
- Elektroschocklarve des/der gewünschten Genotyp(en) oder Arzneimittelexposition und Messung der Genesungszeit der Anfälle.
HINWEIS: Für Testlarven ist ein n = 20 in der Regel ausreichend, aber eine Leistungsberechnung auf der Grundlage einer Pilotanalyse liefert eine genauere n-Zahl. - Führen Sie während jedes Experiments immer eine negative (z. B. einen Wildtyp) und eine positive (z. B. parabss) Kontrolle durch. Die n Zahlen müssen nicht hoch sein; n = 5 ist ausreichend. Dies gibt die Gewissheit, dass der Assay wie erwartet funktioniert hat (z. B. keine Probleme mit der Sonde oder dem Stimulator).
- Wenden Sie einen Cut-off (z. B. 300 s) an, um zu lange Erholungszeiten zu vermeiden, und berücksichtigen Sie nur quantifizierbare Anfälle mit Erholungszeiten über 30 s.
6. Drogenscreening
- Geben Sie die in einem geeigneten Lösungsmittel gelösten Arzneimittel direkt auf die Lebensmitteloberfläche und lassen Sie sie einwirken (und bei Verwendung von Ethanol Zeit für die Verdunstung des Lösungsmittels). Alternativ kann man ein Medikament (in einem geeigneten Lösungsmittel) zu geschmolzenem Fliegenfutter hinzufügen. Weitere Informationen finden Sie im Abschnitt Ergebnisse.
- Um das Arzneimittel zu den geschmolzenen Lebensmitteln hinzuzufügen, schöpfen Sie Lebensmittel aus den Fläschchen, schmelzen Sie sie erneut und fügen Sie beim Abkühlen auf 40 °C das Arzneimittel hinzu, mischen Sie mit einem Vortex-Mixer und geben Sie dann 5 ml geschmolzene Lebensmittel zurück in die Fläschchen und lassen Sie sie vor der Verwendung abkühlen.
- Führen Sie einen Konzentrationsgradienten durch, um die optimale Wirkstoffkonzentration zu ermitteln.
HINWEIS: Ein guter Ausgangspunkt ist die Zugabe von 3 mM Arzneimittellösung entweder direkt auf die Lebensmitteloberfläche (200 μl pro Standard-Drosophila-Fläschchen ) oder die Herstellung einer Konzentration von 3 mM in geschmolzenen Lebensmitteln. Ausgewachsene Weibchen können direkt in dieses Futter Eier legen, oder es können bei Bedarf in ausgewählten Stadien Larven hinzugefügt werden. Das (die) verwendete(n) Lösungsmittel muss (müssen) allein in ausgewählte Durchstechflaschen als Vehikelkontrolle gegeben werden.
Ergebnisse
Zahlreiche Drosophila-Mutationen zeigen ein verstärktes anfallsähnliches Verhalten 7,20. Die genetische Basis dieser Mutationen ist vielfältig, was die ähnlich unterschiedlichen genetischen Ursachen der menschlichen Epilepsie günstig nachahmt. Drei der am besten untersuchten Drosophila-Mutationen sind parabangsenseless (parabss), julius seizure (jus) und easy-shocked (eas). Die para-bss-Mutation führt zu einem Funktionsgewinn des paralytischen spannungsgesteuerten Na+-Kanals, der für die Ethanolaminkinase kodiert, und jus ist ein noch nicht identifiziertes Membranprotein (beachten Sie, dass jus bis vor kurzem als Slamdance bezeichnet wurde)16,21,22. Viele dieser Gene haben menschliche Homologe. Zum Beispiel ist Paralytikum ein Homolog menschlicher Nav-Gene, deren Mutationen eine der Hauptursachen für genetische Epilepsie sind23. Wie bei der menschlichen Epilepsie zeigen diese drei "knallempfindlichen" Fliegenmutationen eine unterschiedliche "Schwere" der Anfälle als Reaktion auf einen Elektroschock (Abbildung 4). Die längste Erholungszeit (d. h. das schwerste Anfallsverhalten) weist die parabss auf, während die jus die kürzeste Erholungszeit aufweist. Diese unterschiedliche Reaktion, die auf verschiedene zugrunde liegende genetische Mutationen zurückzuführen ist, ermöglicht es einem Experimentator, zu testen, wie Leitverbindungen die Anfälle bei einer Reihe von Mutationen reduzieren können, um diejenigen mit günstiger Breitbandaktivität zu identifizieren.
Viele ASMs, die in der Klinik verwendet werden, sind in Drosophila-Anfallsmodellen gleich wirksam, was darauf hindeutet, dass die zugrunde liegenden Mechanismen, die Anfälle bei Drosophila erzeugen, denen ähneln, die bei Menschen mit Epilepsie zu Anfällen führen 9,24,25. Abbildung 5 zeigt die Wirkung von zwei der klinisch am häufigsten verwendeten ASMs, Natriumvalproat (VPA) und Phenytoin (PHY), gegen parabss. Die Larven durften sich während ihrer gesamten Larvenentwicklung mit 3 mM ad libitum von dem in der Nahrung enthaltenen ASM ernähren (dem geschmolzenen Futter zugesetzt). Wildtyp- (Canton-S, CS) und para bss-gefütterte Vehikel (Ethanol bzw. Wasser) wurden in jedes Experiment einbezogen, zusammen mit parabss, die mit dem jeweiligen ASM gefüttert wurden. Es gibt eine klare und signifikante Verkürzung der Anfallserholungszeit (RT) für beide Medikamente. Angesichts der Tatsache, dass sowohl der Wildtyp als auch eine bekannte Anfallsmutation (parabss) ohne Exposition gegenüber ASM die erwartete Anfallsaktivität aufweisen, können wir von der Validität dieser beiden Experimente überzeugt sein. Ist dies nicht der Fall, sollten die Assays verworfen und das Experiment wiederholt werden. Die zugrunde liegende Ursache für ein solches "Versagen" ist oft eine Beschädigung der Elektroschocksonde, eine geringe Leistung der Stimulatorbatterie und/oder die Unerfahrenheit des Experimentators. Auch die Haltung von Fliegen bei Temperaturen unter 25 °C sollte vermieden werden (siehe Abschnitt Diskussion). Obwohl diese Technik nicht für das Hochdurchsatz-Screening geeignet ist, wurde sie kürzlich in einem Niedrigdurchsatz-Screening von ~30 Verbindungen verwendet, um eine neuartige Klasse von Chemikalien zu identifizieren, die die Beschlagnahmung durch Manipulation von Pumilio - einem Regulator der neuronalen Homöostase - effektiv reduziert. Eine positive Translation dieser Verbindungen zur Reduzierung von Anfällen in definierten Maus-Anfallsmodellen zeigt ein aufregendes Potenzial für die weitere Entwicklung sowohl der Leitsubstanzen als auch des neuen Ziels26,27.
Bei der Betrachtung der hier gezeigten repräsentativen Ergebnisse (Abbildung 4 und Abbildung 5) wird deutlich, dass es eine Variabilität innerhalb der Datenstreuung gibt. Es gibt auch einen geringfügigen Unterschied im Wildtypwert zwischen den in diesen beiden Abbildungen dargestellten Daten. Aus diesem Grund ist dieser Assay qualitativ und nicht geeignet, kleine Unterschiede in der Schwere der Anfälle zu identifizieren, weder zwischen Genotypen noch in Wirkstoff-Screening-Assays. Der Assay eignet sich jedoch gut zur Identifizierung eines Anfallsphänotyps bei unbekannten Mutationen und/oder zur ersten Testung von Verbindungen auf die Antiepileptigkeit27. Weitere Verfeinerungen der Arzneimittelentwicklung würden jedoch andere Assays erfordern.

Abbildung 1: Lebenszyklus von Drosophila . Ein Schema, das den Lebenszyklus von Drosophila vom Embryo bis zum Erwachsenen über die Verpuppung zeigt. Die angegebenen Zeitpläne sind ungefähre Angaben für die Entwicklung bei 25 °C. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Aufbau und Platzierung der Elektroschocksonde. (A) zeigt Bilder einer Sonde sowohl von oben als auch von der Seite. Blu-tack wurde verwendet, um einen Drahtabstand von ~2 mm einzuhalten, wenn die Wolframdrähte von der Sonde ausgehen. Kurze Abschnitte von Glaskapillaren (Pfeil) halten die Wolframdrähte an Ort und Stelle. Die elektrischen Drähte, die mit dem Stimulator verbunden sind, werden mit elektrischem Isolierband abgedeckt und entlang des Sondengriffs gehalten. (B) zeigt einen empfohlenen isolierten Stimulator mit konstanter Spannung, der in dieser Studie verwendet wurde. (C) zeigt die ungefähre Positionierung der stimulierenden Sonde über der vorderen dorsalen Oberfläche einer wandernden Larve des dritten Stadiums. Beachten Sie, dass sich die Sondendrähte über den Larvenkörper erstrecken und der Bereich unmittelbar über dem ZNS ~2 mm Abstand zwischen den Drähten beträgt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
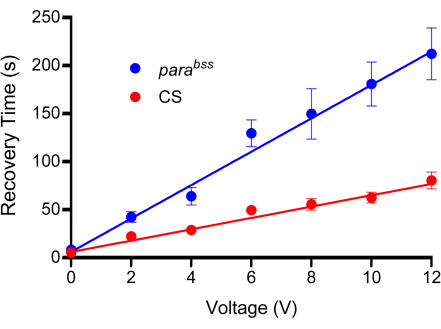
Abbildung 3: Kalibrierkurve. Vor den Experimenten muss eine geeignete Spannung für den Elektroschock bestimmt werden. Alle Sonden unterscheiden sich aufgrund der Art ihrer Herstellung geringfügig. Ein Wildtyp (in diesem Fall Canton-S, CS) und eine Anfallsmutante (empfohlen, parabss) werden zunehmenden Spannungsschocks ausgesetzt, die jeweils auf eine feste Dauer von 2 s eingestellt sind. Die Larven werden nur einmal geschockt, und für jede geprüfte Spannung sollte mindestens n = 10 verwendet werden (in diesem Fall n = 12). Aus den Leitungsanpassungen geht hervor, dass parabss bei allen Spannungen eine erhöhte Anfallswiederherstellungszeit aufweisen. Die gewählte Spannung sollte einen deutlichen und signifikanten Unterschied zwischen Kontroll- und Anfallsmutanten erzeugen. In der gezeigten Grafik sind die Unterschiede bei 6 V und darüber signifikant (p ≤ 0,0001, bidirektionale ANOVA mit Šidáks Mehrfachvergleichen, n = 12, pro Genotyp und Spannung). Daher wurde 6 V als optimale Spannung für diese Sonde gewählt, da sie einen signifikanten Unterschied erzeugte, aber die Wiederherstellungszeit kurz gehalten wurde, wodurch die Zeit für die Durchführung einzelner elektrischer Schocks reduziert wurde. Die Daten sind als mittlere ± SEM dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
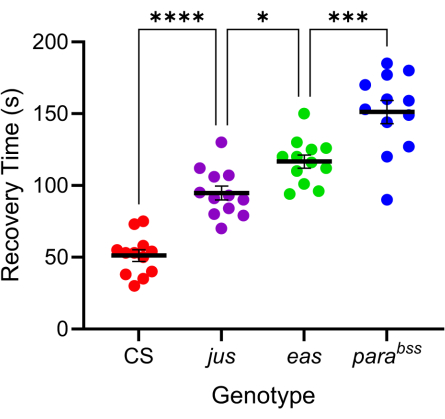
Abbildung 4: Verschiedene Drosophila-Mutationen weisen unterschiedliche Schweregrade der Anfälle auf. Mit der in Abbildung 3 kalibrierten Sonde wurden drei Drosophila-Anfallsmutanten (parabss, jus und eas) zusammen mit einem Wildtyp (CS) einem Elektroschock (6 V, 2 s) ausgesetzt. Einzelne Larven wurden nur einmal geschockt. Die Erholungszeiten für Anfälle sind für Anfallsmutanten länger als für Wildtypen und nehmen progressiv von jus zu parabss zu (p ≤ 0,0001 bzw. unidirektionale ANOVA mit Tukeys mehrfachen Vergleichen). Statistisch signifikante Vergleiche aus Tukeys Mehrfachvergleichen werden mit ****p ≤ 0,0001, ***p ≤ 0,001, **p ≤ 0,01, *p ≤ 0,05 angegeben. Die Daten sind als Mittelwert ± SEM dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
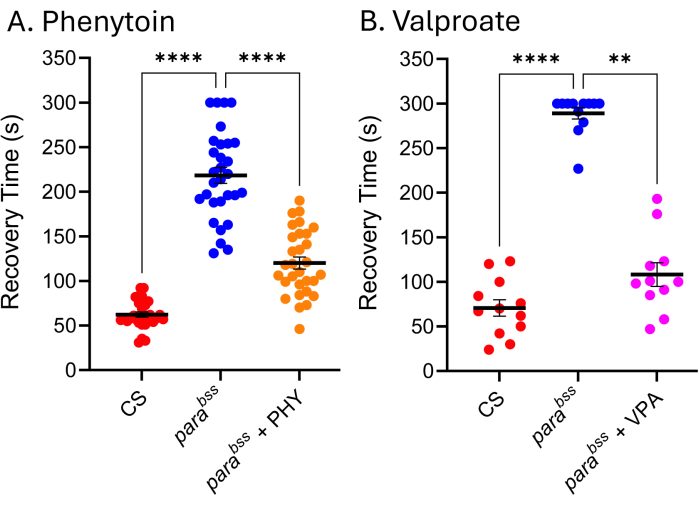
Abbildung 5: Drosophila-Anfallsmutanten sprechen auf klinisch verwendete ASMs an. Die Exposition gegenüber (A) Phenytoin (PHY) und (B) Natriumvalproat (VPA) (jeweils 3 mM) reduzierte die Erholungszeit von parabss signifikant (p ≤ 0,01, Kruskal-Wallis mit Dunns Mehrfachvergleichen bzw. p ≤ 0,0001, unidirektionale ANOVA mit Tukeys Mehrfachvergleichen). Nur Erholungszeiten über 30 s wurden als quantifizierbare Anfälle angesehen, und in diesen Assays wurde ein Cut-off von 300 s verwendet. Jeder Wirkstofftest wurde von einem anderen Experimentator durchgeführt; Daher unterscheiden sich die gezeigten durchschnittlichen Erholungszeiten (besonders deutlich bei paraBSS ohne Medikament). Dies unterstreicht die Tatsache, dass dieser Assay qualitativ ist und daher in jedem Assay eine Wildtyp- und Anfallsmutante enthalten sein sollte. Dies kann es ermöglichen, die Wirkstoffaktivität zwischen den Experimenten bei Bedarf zu normalisieren. Statistisch signifikante Vergleiche aus den Mehrfachvergleichen von Dunn und Tukey werden als ****p ≤ 0,0001, ***p ≤ 0,001, **p ≤ 0,01, *p ≤ 0,05 angegeben. Die Daten sind als mittlere ± SEM dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Elektroschockmethode zur Induktion von Anfällen bei Drosophila-Larven bietet ein einfaches, aber effizientes Screening zur Identifizierung neuartiger Antiepileptika oder genetischer Manipulationen. Da es sich jedoch um einen qualitativen Assay handelt, besteht die Haupteinschränkung darin, dass die Methode kleine Effektgrößen nicht ohne weiteres identifizieren kann. Nichtsdestotrotz bietet der mittlere Durchsatz, der sich für das Screening von bis zu ~5 Verbindungen pro Woche und Untersucher eignet, einen sehr leistungsstarken Ganztierassay. Die Einfachheit der Technik eignet sich auch für Laborprojekte auf Bachelor-Niveau. Auf diese Weise können 3-4 Forscher viele Verbindungen in relativ kurzer Zeit und mit viel weniger Aufwand als mit einem gleichwertigen Maus-Anfallsassay untersuchen. Eine Automatisierung des Assays würde den Durchsatz weiter erhöhen. Dies ist dieser Studie jedoch nicht gelungen. Es wurde versucht, einen lithiumhaltigen Agar mit zwei im Agar eingebetteten Elektroden mehrere Larven gleichzeitig zu schocken, jedoch ohne Erfolg. Andere Methoden, möglicherweise auf der Grundlage der Optogenetik, könnten für die Automatisierung besser geeignet sein28.
Die Einfachheit des Assays untergräbt jedoch die Anforderung, kompetent zu werden. Die Positionierung der Sonde und der während des Elektroschocks ausgeübte Druck sind kritische Schritte. Die Konsistenz in beiden reduziert die Variabilität zwischen den Erholungszeiten für geschockte Larven. Das andere Hauptproblem ist, wie man den Anfallsendpunkt erkennt, was diesen Assay qualitativ macht, da er davon abhängt, wann ein einzelner Untersucher sich entscheidet, die Uhr anzuhalten. Wenn mehrere Experimentatoren im selben Labor diese Experimente durchführen, lohnt es sich, Zeit damit zu verbringen, dieselben Larvenschocks zu betrachten, um sich darauf zu einigen, was ein Anfallsendpunkt ist. Auf diese Weise wird die Variabilität zwischen den Personen erheblich reduziert. Aus den beispielhaften Ergebnissen in diesem Bericht geht jedoch hervor, dass die Effekte zwar konstant sind, die Zeitpunkte jedoch zwischen den Experimentatoren variieren können. Es ist auch wichtig zu beachten, dass die Larvenentwicklung bei Temperaturen unter 25 °C (z. B. 18 °C) die Schwere der Anfälle aufgrund einer Abnahme der neuronalen Aktivität während einer embryonalen kritischen Periode verringert29. Es wird daher empfohlen, dass für die Embryonal-/Larvenentwicklung mindestens 25 °C verwendet werden. Ein Brutkasten in der Nähe der Werkbank ist wünschenswert, und es werden nur so viele Larven entnommen, wie für jeden Elektroschock erforderlich sind. Die verbleibenden Larven sollten bis zur Verwendung bei 25 °C gehalten werden. Mit etwas Übung können die Experimentatoren bis zu 4 Larven gleichzeitig schocken, wobei die Schocks in Abständen von 10 s abgeschaltet werden. Dieser Ansatz beschleunigt den Fortschritt erheblich, und es kann eine Anzahl von n von 40 Larven (oder mehr) an einem Tag erreicht werden. Die Luftfeuchtigkeit wurde in dieser Studie nicht gemessen oder kontrolliert. Es wurde ein Standard-Hell-Dunkel-Zyklus von 12:12 gewählt, der jedoch nach Belieben des Experimentators variiert werden kann.
Die Herstellung einer Sonde ist der anspruchsvollste Teil dieses Verfahrens. Daher sollte nach der Herstellung sehr darauf geachtet werden, dass es nicht beschädigt wird. Jeder Schaden, der an der Elektroschocksonde auftritt, zieht oft eine Reparatur nach sich, und daher muss die Sonde neu kalibriert werden, um die optimale Spannung zu bestimmen. Die Spannung hängt vollständig vom Abstand zwischen den beiden Drähten ab, so dass wahrscheinlich keine zwei Sonden identisch sind. Es ist ratsam, eine Sonde jeden Monat neu zu kalibrieren, um sicherzustellen, dass sich die optimale Spannung nicht geändert hat. Die Stärke des Elektroschocks hängt sowohl von der angelegten Spannung als auch von der Dauer der Spannung ab. Daher erzeugen kürzere Laufzeiten mit höheren Spannungen wahrscheinlich die gleiche Reaktion wie längere Dauern bei schwächerer Spannungsstimulation. Dieser Bereich wurde jedoch nicht untersucht. Die Präferenz für eine Dauer von 2 s (in dieser Studie) ist leicht zu berücksichtigen, ohne dass die Larven durch übermäßige Bewegungen geschockt werden. Dies ermöglicht eine vergleichsweise geringere Spannungsstärke, wodurch eine Schädigung der Larvenkutikula vermieden wird. Die Wirkung der Stimulation hängt auch von der Stromstärke (Ampere) ab, die wir nicht messen. Unterschiedliche Stimulatoren erzeugen jedoch unterschiedliche Stromstärken, und so wurde festgestellt, dass unter Verwendung eines Grass S88-Stimulators25 eine Spannung von 50 V/3 s verwendet wurde, während bei Verwendung des hier verwendeten Stimulators 6-12 V/2 s verwendet wurde, abhängig von der verwendeten Sonde. Die tatsächlich verwendete Spannung/Dauer ist nicht übermäßig wichtig, solange sie ausreicht, um eine längere Erholungszeit als eine Wildtyp-Kontrolle zu induzieren und die Larve nicht schädigt. Da das bloße Platzieren einer Sonde auf einer Larve (mit 0 V als Kontrolle) ein gewisses Maß an Einfrieren/Lähmung verursacht (was auf einen Versuch hinweist, Raubtiere zu vermeiden), gibt es keine Stimulationskriterien, die nicht ein gewisses "anfallsähnliches" Verhalten hervorrufen.
Der Elektroschock-Assay eignet sich zum Screening von Medikamenten auf Antiepileptiker. Ein Problem ist immer solvent. Es wurde festgestellt, dass Ethanol oder Aceton bessere Lösungsmittel sind als DMSO. In den aktuellen Experimenten wird DMSO bis zu ~1% toleriert, darüber hinaus wurde eine inakzeptable Letalität bei sich entwickelnden Larven beobachtet. Von den beiden Möglichkeiten, Larven Medikamenten auszusetzen, entweder durch Zugabe von Arzneimitteln (gelöst in einem geeigneten Lösungsmittel) auf die Oberseite eines Lebensmittelfläschchens oder durch Zugabe zu geschmolzenem Fliegenfutter, wurde festgestellt, dass letzteres bessere Ergebnisse in Bezug auf eine verringerte Variabilität liefert. Der Unterschied ist jedoch marginal, und die erste Methode ist schneller. Es wird empfohlen, dass die Experimentatoren beide Methoden vergleichen und diejenige auswählen, die am besten geeignet ist. Fliegen kann erlaubt werden, Eier auf arzneimittelhaltige Lebensmittel zu legen, so dass die gesamte Larvenentwicklung ausgegraben wird. Alternativ können Larven in jedem gewünschten Stadium auf arzneimittelhaltige Lebensmittel gelegt werden, um den kritischen Zeitpunkt der Arzneimittelaktivität zu identifizieren. Die Fütterung von trächtigen Weibchen mit Medikamenten ist eine wirksame Methode, um sich entwickelnde Embryonen Medikamenten auszusetzen25.
Ein alternativer und häufig verwendeter Anfallsassay ist die Verwendung von Zebrafischembryonen, die dem Prokonvulsivum Pentylentetrazol ausgesetzt wurden, um auf ASMszu untersuchen 30. Unserer Meinung nach hat der Drosophila-Larventest viele Vorteile. Dazu gehören (1) viele Verbindungen sind im künstlichen Meerwasser, in dem die Fische schwimmen, schwer löslich; (2) Der Zebrafisch-Assay beruht auf der Verringerung der Schwimmlänge, die entweder durch die Exposition gegenüber einem ASM oder, entgegen der Intuition, einer prokonvulsiven Verbindung auftreten kann. Dies liegt daran, dass eine erhöhte Anfallsaktivität beim Zebrafisch auch zu einem verminderten Schwimmen führt10. Daher müssen alle Treffer einer Verbindung mit einem sekundären Screening verfolgt werden, was oft die Messung von früh induzierbaren neuronalen Genen wie c-fos erfordert; (3) Fische dürfen ohne Tierschein nur bis zum 5. Tag nach dem Schlupf verwendet werden. Natürlich haben Zebrafische gegenüber Insekten einen deutlichen Vorteil, da ihr primärer exzitatorischer Neurotransmitter Glutamat und nicht Acetylcholin31 ist. Eine Kombination der beiden Assays, beginnend mit Drosophila und gefolgt von Zebrafischen, könnte ein sehr aussagekräftiges Screening bieten, bevor weniger getroffene Verbindungen an Mäusen getestet werden.
Zusammenfassend lässt sich sagen, dass der Drosophila-Larven-Elektroschock-Assay in Verbindung mit der hohen Konservierung in Genetik und Physiologie, die zwischen Fliegen und Säugetieren geteilt wird, ein sehr effektives, schnelles und kostengünstiges Screening zur Identifizierung neuartiger Antiepileptiken bietet. Die zunehmende Einführung dieses Insekts für das Wirkstoffscreening wird auch der dringenden Notwendigkeit gerecht, die Anzahl der für die medizinische Forschung verwendeten Tiere höherer Ordnung zu reduzieren.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden Interessen bestehen.
Danksagungen
Wir danken den vielen Mitarbeitern des Baines-Labors, die diese Technik über viele Jahre hinweg gemeinsam entwickelt haben, und insbesondere Richard Marley, der sich sehr bemüht hat, diese Technik robust und zuverlässig zu machen. Wir danken Anna Munro für das Zeichnen der Larven, das in Abbildung 2 zu sehen ist. Die Arbeit im Baines-Labor, die zur Entwicklung dieser Technik beigetragen hat, wurde großzügig von BBSRC, MRC und dem Wellcome Trust unterstützt. Diese Arbeit wird derzeit durch eine Finanzierung durch einen Wellcome Trust Investigator Award an R.A.B. (Grant 217099/Z/19/Z) unterstützt. Die Entwicklung dieser Technik profitierte auch von der Manchester Fly Facility, die mit Mitteln der Universität und des Wellcome Trust (Grant 087742/Z/08/Z) eingerichtet wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
Referenzen
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten