Method Article
电击诱导 果蝇 幼虫癫痫发作的活动
摘要
该方案详细介绍了使用 果蝇 幼虫来识别用于治疗癫痫的独特抗癫痫化合物。
摘要
癫痫会带来巨大的健康负担,而大量药物难治性个体会加剧这种负担。虽然一些药物难治性患者确实对非药物治疗(例如迷走神经刺激、生酮饮食等)有反应,但对许多人来说,最后的手段是具有挑战性和昂贵的手术来缓解癫痫发作。虽然人们普遍认为需要具有更广泛靶点的抗癫痫药物,但实现这一目标的障碍是确定新的药物靶点。遗传易处理的模式动物在这方面提供了希望。果 蝇 (Drosophila melanogaster) 已成为研究癫痫发作的机制基础和更好治疗方法的有力模型。许多已确定的苍蝇突变导致幼虫和成虫在强烈刺激(电、机械和/或热)下表现出类似癫痫发作的活动。其中许多突变与导致人类遗传性癫痫的基因(例如,电压门控 Na + 通道)同源。现在也可以用人类等效基因替换果蝇基因,该基因还携带与疾病相关的突变。因此,不起眼的苍蝇已成为模拟人类疾病的化身。本研究描述了一种使用 果蝇 幼虫进行中低通量药物筛选的合适方法,以识别具有抗癫痫潜力的独特化合物及其靶标。
引言
癫痫仍然是一个重大的健康负担,影响着全球约 1% 的人口。尽管现在有 30 多种抗癫痫药物 (ASM) 可用于临床治疗,但大约 1/3 的癫痫患者仍然难以治疗,这意味着他们对药物治疗反应不佳 1,2。可用的药物也只是姑息性的,因此不能预防癫痫发生,也不能治愈3。因此,迫切需要确定更好的癫痫治疗方法。开发更有效治疗方法的一个障碍是确定新的药物靶点。事实上,几乎所有当前的 ASM 都影响类似的靶标:离子通道,包括电压门控钠通道 (Nav) 和γ-氨基丁酸 (GABA) 介导的抑制性神经传递4,5。人们普遍认为,继续使用传统的药物开发方法不太可能从根本上改变这种情况。
实验室模式动物,包括但不限于果蝇 Drosophila melanogaster 和斑马鱼 Danio rerio,可用于鉴定新型 ASM 6,7,8。事实上,在 PubMed 上搜索“果蝇 + 癫痫发作”会返回 342 个结果,而同样搜索斑马鱼会返回 578 个结果(两次搜索均于 2025年 1 月 29 日进行)。虽然与小鼠的类似研究数量 (~15,000) 相比相形见绌,但使用模型系统的研究数量仍在继续增长。由于 CNS 功能跨门的机制守恒,这些研究是可能的。此外,临床使用的 ASM 可以有效地治疗苍蝇和鱼类的诱发癫痫发作,这表明虽然癫痫发作行为的细微差别可能看起来不同,但潜在机制有很多共同点 7,9,10。
果蝇果蝇为理解人类生物学做出了许多开创性的贡献。在癫痫方面,该模型系统提供了一个无与伦比的遗传工具箱,结合了可识别和实验可访问的神经元7。此外,幼虫和成虫 CNS 的连接组现已发表,并且已经确定了许多细胞特异性遗传驱动系11,12。值得注意的是,偶然发现了一类突变,其中成年果蝇通过姿势丧失和癫痫样活动(例如,翅膀嗡嗡作响、腿部颤抖等)对强烈的机械刺激做出反应。这类突变被称为“刘海敏感”13,14,15,16。此后已确定第二类癫痫发作突变,它们对温度升高有反应,反映了人类热性惊厥17,18。然而,与这种相同昆虫模型的幼虫阶段相比,成年苍蝇的实验可处理性有所降低。例如,对成年果蝇进行药物喂养可能很困难,而更具侵入性的技术(如电生理学和光遗传学)可能更具挑战性。相比之下,果蝇幼虫不断进食,在短短 100 天内将其体容量扩大了 ~5 倍,从而能够化蛹。因此,我们可以确信在幼虫阶段进行充分的药物喂养。胚胎发生有据可查,可以准确分期,反过来,它又确定了 CNS 发育的关键里程碑,包括首次获得神经元电特性直至电路形成19。一旦孵化,幼虫会经历 3 次蜕皮(或龄期),直到第 5 天,它变得“流浪”,然后离开食物寻找安全的地方化蛹。化蛹 ~100 小时后,一只成年果蝇出现,具有新的身体和 CNS(图 1)。
诱发成人癫痫发作的技术不太适合幼虫阶段。幼虫缺乏感觉毛,在机械刺激过程中感觉毛的同步激活会导致癫痫发作。因此,为了克服这些困难,开发了一种电击技术来诱导游荡幼虫阶段的癫痫发作。随后对幼虫和成虫的癫痫发作诱导技术的比较分析表明,幼虫电击对突变类型的依赖性要小得多(例如,砰砰声敏感 与温度)。因此,我们建议该技术应该是在最佳癫痫发作诱导方法未知的情况下测试新突变的首选方法20。幼虫电击技术简单、快速,并且需要最少的设备。该技术提供了一种有效的方法来筛选新型化合物或遗传疗法,以对抗反映人类癫痫遗传多样性的一系列突变的抗癫痫功效。
研究方案
本研究中使用了果 蝇 Drosophila melanogaster (详见结果部分)。这种技术最适合游荡的三龄幼虫 (L3)。实验方案相对简单,但需要实践才能完善。根据我们的经验,新学生需要大约 2 周的时间来掌握检测,并从观看其他更有经验的研究人员使用支持摄像头的解剖显微镜或类似设备实时进行检测中受益匪浅。本研究中使用的试剂和设备列在 材料表中。
1. 幼虫选择
- 从装有标准食品(5 L 水、390 g 葡萄糖、360 g 玉米、250 g 酵母、40 g 琼脂、135 mL 尼帕金、15 mL 丙酸)的苍蝇小瓶/瓶子的侧面收集幼虫。
- 只使用正在积极移动并离开食物爬上容器侧面的幼虫(徘徊的第三龄,L3)。不要选择前蛹,它们的运动大大减少。
2. 电击程序
- 取出一个游荡的 L3 并将其转移到一个小塑料培养皿中(大小无关紧要),然后用 ddH2O 轻轻清洗以去除食物残渣。小 (000) 画笔适合此目的。
- 使用画笔将单次清洗的幼虫转移到空塑料盘中(同样,大小无关紧要)。用镊子夹住一小块纸巾擦干幼虫。去除多余的 ddH2O,但不要完全干燥幼虫,以免其粘在塑料盘上。
- 让幼虫恢复 30 秒。这将有助于轻松放置电击探头(见下文)。
- 在低倍解剖显微镜 (15-20x) 下观察幼虫,一旦恢复正常的爬行行为,轻轻地将电击探针(有关详细信息,请参见步骤 3 和 图 2A)放在幼虫的前背表面上,高于 CNS 的大致位置(参见 图 2C)。
注意:此步骤很关键,必须施加足够的压力以在探针丝和角质层之间提供良好的导电性,但要注意不要损坏幼虫。因此,将幼虫压扁其深度的大约三分之一到二分之一。 - 施加 2 s 的恒定电压脉冲,其强度已 通过 滴定曲线预先确定(图 3)。任何隔离式电压刺激器都适用于此。此处使用的 ID 如图 2B 所示。
- 触电后,启动计时器。作为对冲击的反应,幼虫开始短暂的麻痹,然后偶尔出现体壁肌肉活动和滚动行为的痉挛,停止正常的爬行行为。
- 当幼虫明显远离其在培养皿上的原始位置时,停止计时器。癫痫发作持续时间或恢复时间 (RT) 定义为刺激开始和恢复正常爬行行为(例如,导致向前运动的完全向前蠕动波)之间的时间。
- 每天结束时,首先用 100% 乙醇冲洗探针丝,然后用 ddH2O 仔细清洁探针丝。在放大镜下仔细检查探针丝,如果需要,使用镊子轻轻刮掉探针丝上的任何残留物。执行此作时要非常小心,不要改变两根电线之间的距离。
3. 电击探头构造
- 需要 2 x 1 m 长的电线(应细而柔韧,即额定电流为 ~3 A)。在每根电线的末端焊接一根 5 厘米长的钨丝(为了最大限度地提高接触效果,在焊接前将钨丝缠绕在电线的外露端上)。将推入式连接器(例如香蕉插头)焊接到电线的另一端,适合轻松连接到电压刺激器。
- 将两根钨丝固定到电极支架上,使导线彼此平行(图 2)。小段玻璃毛细管(~2 cm 长)用于将导线固定在探头锁定螺钉下。
- 使用镊子弯曲电线,使它们靠近电线支架出口位置 1-2 毫米以内。弯曲钨丝并不容易,因为钨丝保留了“记忆”——因此,需要毅力。帮助此过程的提示包括使用电气绝缘胶带和/或 blu-tack(或类似的造型腻子)来帮助将电线保持在正确的方向/距离。
4. 探头校准
- 确保有合适的野生型(阴性对照)和癫痫发作突变体(阳性对照)的游荡 L3 库存。每个都需要 ~100 个。
- 如上所述,准备幼虫,一次一只。
- 使用探针对每种基因型的足够幼虫施加一系列电压,以测试每种电压。建议在每个电压 10-15 只幼虫之间施加 0 V、2 V、4 V、6 V、8 V、10 V 和 12 V,持续 2 秒。每只幼虫只电击一次。
- 测量每个幼虫的恢复时间,并计算应用于两种基因型的每个电压步长的平均值。
- 在图形上绘制平均值,并用直线拟合数据。
- 选择在对照突变体和癫痫发作突变体之间具有明显显著差异的电压。注意不要选择产生过长恢复时间的电压;否则,由于恢复等待时间长,生产力将受到影响。
注意:本研究通常使用刺激电压,导致野生型恢复时间为 50-100 秒, parabss 的恢复时间为 200-300 秒。示例 校准曲线如图 3 所示。使用 0 V 来解释将探针压在幼虫背表面的行为是很重要的。这将导致一定程度的麻痹,这可能是幼虫的一种防御机制。
5. 实验的执行
- 所需基因型的电击幼虫或药物暴露,并测量癫痫发作恢复时间。
注意:对于测试幼虫,n = 20 通常就足够了,但基于飞行员分析的功率计算将提供更明确的 n 数字。 - 在每次实验期间,始终运行阴性(例如,野生型)和阳性(例如, parabss)对照。n 个数字不需要很高;n = 5 就足够了。这将提供检测按预期工作的信心(例如,探针或刺激器没有问题)。
- 应用临界值(例如,300 秒)以避免恢复时间过长,并且仅将可量化的癫痫发作视为恢复时间超过 30 秒的癫痫发作。
6. 药物筛选
- 将溶解在适当溶剂中的药物直接添加到食物表面并浸泡(如果使用乙醇,则为溶剂蒸发)。或者,可以将药物(在适当的溶剂中)添加到融化的苍蝇食品中。有关详细信息,请参阅 Results 部分。
- 要将药物添加到融化的食物中,从小瓶中舀出食物,重新融化,当食物冷却至 40 °C 时,加入药物,通过涡旋混合器混合,然后将 5 mL 融化的食物倒回小瓶中,并在使用前冷却。
- 运行浓度梯度以确定最佳药物浓度。
注意:一个好的起点是将 3 mM 药物溶液直接添加到食品表面(每个标准 果蝇 小瓶 200 μL)或在融化的食物中使 3 mM 浓度。可以让成年雌性直接在这种食物中产卵,或者可以根据需要在选定的阶段添加幼虫。所用溶剂必须单独添加到选定的样品瓶中作为载体对照。
结果
许多果蝇突变表现出增强的癫痫样行为 7,20。这些突变的遗传基础是多种多样的,这有利于模仿人类癫痫的类似不同的遗传原因。研究最多的三种果蝇突变是 parabangsenseless (parabss)、julius seizure (jus) 和易电击 (eas)。parabss 突变导致麻痹性电压门控 Na+ 通道的功能获得,eas 编码乙醇胺激酶,而 jus 是一种尚未确定的膜蛋白(请注意,直到最近 jus 才被称为 slamdance)16,21,22。其中许多基因具有人类同源物。例如,麻痹是人类 Nav 基因的同源物,其突变是遗传性癫痫的主要原因23。与人类癫痫一样,这三种“砰砰声敏感”的果蝇突变在电击后显示出不同的癫痫发作“严重程度”(图 4)。parabss 表现出最长的恢复时间(即最严重的癫痫发作行为),而 jus 表现出最短的恢复时间。由于潜在的基因突变不同,这种差异反应使实验者能够测试先导化合物如何减少一系列突变的癫痫发作,以识别具有良好广谱活性的突变。
临床上使用的许多 ASM 在果蝇癫痫发作模型中同样有效,因此表明在果蝇中产生癫痫发作的潜在机制与导致癫痫患者癫痫发作的机制相似 9,24,25。图 5 显示了两种临床最常用的 ASM,丙戊酸钠 (VPA) 和苯妥英钠 (PHY) 对 para bss 的影响。幼虫在整个幼虫发育过程中以 3 mM 的 ASM 随意摄食食物(添加到融化的食物中)。每个实验包括野生型 (Canton-S, CS) 和 parabss 喂养的载体对照 (分别为乙醇和水),以及 parabss 喂养各自的 ASM。两种药物的癫痫发作恢复时间 (RT) 明显且显着缩短。鉴于野生型和已知的癫痫发作突变 (parabss) 在没有暴露于 ASM 的情况下,都表现出预期的癫痫发作活动,我们可以对这两个实验的有效性充满信心。当不是这种情况时,应丢弃检测,并应重复实验。这种 “失败 ”的根本原因通常是电击探针损坏、刺激器电池电量低和/或实验者缺乏经验。还应避免在低于 25 °C 的温度下维持果蝇(参见讨论部分)。虽然该技术不适合高通量筛选,但最近,它被用于 ~30 种化合物的低通量筛选,以鉴定一类新型化学物质,这些化学物质通过纵 Pumilio - 神经元稳态的调节剂来有效减少癫痫发作。在确定的小鼠癫痫发作模型中,这些相同化合物的阳性翻译以减少癫痫发作,表明先导化合物和新靶标的进一步开发具有令人兴奋的潜力26,27。
通过检查此处显示的代表性结果(图 4 和 图 5),很明显数据分布中存在可变性。这两个图中显示的数据之间的通配符值也存在适度的差异。这就是为什么该测定是定性的,不适合识别癫痫发作严重程度的微小差异,无论是在基因型之间还是在药物筛选测定中。然而,该测定非常适合鉴定未知突变中的癫痫发作表型和/或用于化合物抗癫痫活性的初始检测27。然而,药物开发的进一步改进将需要不同的分析方法。

图 1: 果蝇 生命周期。 显示 果蝇 生命周期的示意图,从胚胎到成虫, 通过 化蛹。所示时间是在 25 °C 下显影的近似值。 请单击此处查看此图的较大版本。

图 2:电击探头的设计和放置。 (A) 从顶部和侧面显示探针的图像。Blu-tack 用于保持 ~2 mm 的线间距离,因为钨丝从探针伸出。玻璃毛细管的短段(箭头)将钨丝固定到位。连接到刺激器的电线被电绝缘胶带覆盖并沿探头手柄固定。(B) 显示了本研究中使用的推荐恒压隔离刺激器。(C) 显示了刺激探针在游荡的第三龄幼虫前背表面的大致位置。请注意,探针丝延伸到幼虫身体上,CNS 正上方的区域是 ~2 mm 的线间距离。 请单击此处查看此图的较大版本。
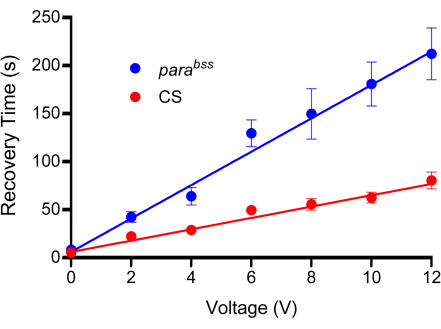
图 3:校准曲线。 在实验之前,必须确定适合电击的电压。由于制造性质的不同,所有探针都会略有不同。野生型(在本例中为 Canton-S,CS)和癫痫发作突变体(推荐, parabss)受到增加的电压冲击,每个冲击的固定持续时间为 2 秒。幼虫只被电击一次,并且每个测试的电压至少应使用 n = 10(在这种情况下,n = 12)。从线路拟合中可以明显看出, parabss 在所有电压下都显示出增加的癫痫发作恢复时间。选择的电压应在对照和癫痫发作突变体之间产生明显而显着的差异。在所示的曲线中,在 6 V 及以上时差异显著(p ≤ 0.0001,Šidák 多重比较的双向方差分析,n = 12,每个基因型和电压)。因此,选择 6 V 作为该探头的最佳电压,因为它会产生显着差异,但恢复时间很短,减少了进行单个电击所需的时间。数据以均值 ± SEM 表示。 请单击此处查看此图的较大版本。
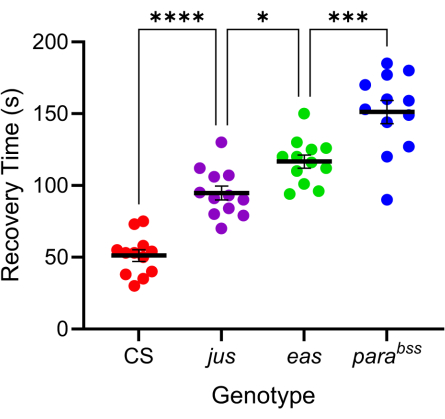
图 4:不同的 果蝇 突变表现出不同程度的癫痫发作严重程度。 使用 图 3 中校准的探针,对三种 果蝇 癫痫发作突变体 (parabss、 jus 和 eas) 以及野生型 (CS) 进行电击 (6 V, 2 s)。单个幼虫只被电击过一次。癫痫发作突变体的癫痫发作恢复时间比野生型长,并且从 jus 到 parabss 逐渐增加(≤p 分别为 0.0001,与 Tukey 多重比较的单向方差分析)。Tukey 多重比较的统计显著性比较表示为 ****p ≤ 0.0001、***p ≤ 0.001、**p ≤ 0.01、*p ≤ 0.05。数据以平均 ± SEM 表示。 请单击此处查看此图的较大版本。
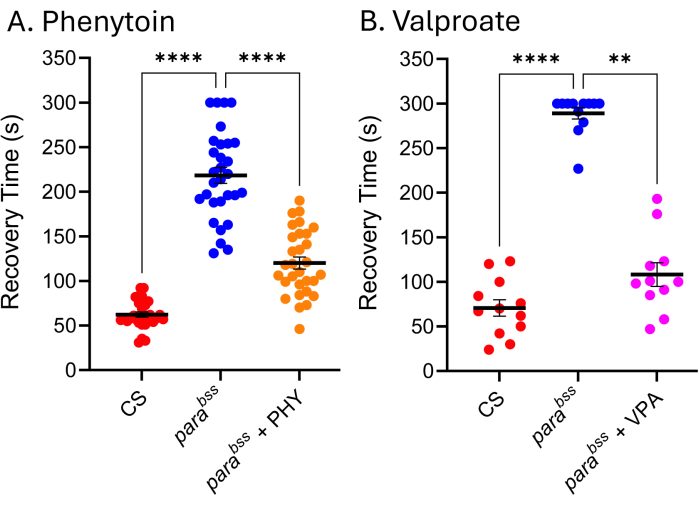
图 5: 果蝇 癫痫发作突变体对临床使用的 ASM 有反应。 暴露于 (A) 苯妥英钠 (PHY) 和 (B) 丙戊酸钠 (VPA) (分别为 3 mM) 显着降低了 parabss 的癫痫发作恢复时间 (p ≤ .01,Kruskal-Wallis 与 Dunn 的多重比较,以及 p ≤ .0001,单向方差分析与 Tukey 的多重比较,分别为)。只有超过 30 秒的恢复时间被认为是可量化的癫痫发作,并且在这些测定中使用了 300 秒的临界值。每种药物测定由不同的实验者进行;因此,显示的平均恢复时间不同(对于无药物的 ParaBSS 尤其明显)。这强调了该测定是定性的这一事实,因此,每个测定中应包括野生型和癫痫发作突变体。如果需要,这可以允许在实验之间使药物活性标准化。Dunn 和 Tukey 多重比较的统计显著性比较表示为 ****p ≤ 0.0001、***p ≤ 0.001、**p ≤ 0.01、*p ≤ 0.05。数据以 ± SEM 的平均值表示。 请单击此处查看此图的较大版本。
讨论
电击法在 果蝇 幼虫中诱导癫痫发作提供了一种简单而有效的筛选,以识别新的抗癫痫化合物或遗传作。然而,由于这是一种定性测定,其主要局限性是该方法不能轻易识别小效应量。尽管如此,它允许的中等通量,根据研究人员的说法,每周可以筛选多达 ~5 种化合物,提供了非常强大的全动物检测。该技术的简单性也适用于本科阶段的实验室项目。因此,3-4 名研究人员可以在相对较短的时间内筛选出许多化合物,并且比使用等效的小鼠癫痫发作测定法花费少得多。检测的自动化将进一步提高通量。然而,这项研究并没有成功做到这一点。尝试在琼脂中嵌入两个电极的含锂琼脂同时电击多个幼虫,但没有成功。其他方法,可能基于光遗传学,可能更适合自动化28。
然而,该检测的简单性削弱了精通的要求。探头的定位和电击过程中施加的压力是关键步骤。两者的一致性减少了休克幼虫恢复时间之间的差异。另一个主要问题是如何识别癫痫发作终点,这使得这种检测具有定性,因为它取决于个体研究者何时选择停止时钟。当同一实验室的几个实验者进行这些实验时,花时间观察相同的幼虫休克以就癫痫发作终点达成一致是值得的。这样做可以大大减少人际差异。然而,从本报告所示的示范性结果中可以明显看出,虽然效果是恒定的,但实验者之间的时间可能会有所不同。同样重要的是要注意,由于胚胎关键期神经活动减少,幼虫在低于 25 °C(例如 18 °C)的温度下发育会降低癫痫发作的严重程度29。因此,建议至少使用 25 °C 用于胚胎/幼虫发育。在靠近工作台的地方放置一个培养箱是可取的,并且每次电击仅根据需要去除足够的幼虫。剩余的幼虫应保持在 25 °C 直至需要。通过练习,实验者一次最多可以电击 4 只幼虫,间隔 10 秒进行电击。这种方法大大加快了进展速度,一天内可以达到 40 只幼虫(或更多)。在这项研究期间没有测量或控制湿度。选择了标准的 12:12 明暗循环,但这可以根据实验者的意愿进行更改。
探针的制造是该方法中最具挑战性的部分。因此,一旦制作完成,应非常小心不要损坏它。电击探头发生的任何损坏通常需要维修,因此,需要重新校准探头以确定最佳电压。电压完全取决于两根电线之间的距离,因此,没有两个探头可能是相同的。建议每月重新校准探头,以确保最佳电压没有变化。电击的强度取决于施加的电压和电压的持续时间。因此,使用较弱的电压刺激,较短的持续时间和较高的电压可能会产生与较长持续时间相同的响应。但是,这个领域尚未得到调查。对 2 s 持续时间的偏好(在本研究中)很容易适应,而不会使幼虫受到电击的过度移动。这使得电压强度相对较低,从而避免了对幼虫角质层的损伤。刺激的效果也将取决于电流强度 (amps),我们不测量电流强度。然而,不同的刺激器会产生不同的安培数,因此,发现使用 Grass S88 刺激器25,使用了 50 V/3 s 的电压,而使用此处使用的刺激器,使用了 6-12 V/2 s,具体取决于所使用的探头。实际使用的电压/持续时间并不太重要,只要它足以诱导比野生型对照更长的恢复时间并且不会对幼虫造成损害。因为仅仅将探针放在幼虫上的行为(使用 0 V 作为对照)会导致一定程度的冻结/麻痹(表明试图避免捕食),所以没有刺激标准不会诱发一些“类似癫痫发作”的行为。
电击试验适用于筛选药物的抗惊厥活性。问题总是有偿付能力的。发现乙醇或丙酮是比 DMSO 更好的溶剂。在目前的实验中,DMSO 的耐受性高达 ~1%,超过该水平,在发育中的幼虫中观察到不可接受的致死性。在将幼虫暴露于药物的两种选择中,要么将药物(溶解在合适的溶剂中)添加到食品瓶的顶部,要么添加到融化的苍蝇食物中,发现后者在减少变异性方面产生更好的结果。但是,差异很小,前一种方法更快。建议实验者比较这两种方法并选择最适合的方法。可以让苍蝇在含药物的食物上产卵,这样整个幼虫发育都暴露在挖掘中。或者,可以在任何所需阶段将幼虫放在含药物的食物上,以确定药物活性的关键时间。给怀孕的雌性喂食药物是使发育中的胚胎接触药物的有效方法25。
另一种常用的癫痫发作试验是使用暴露于促惊厥戊烯四唑的斑马鱼胚胎来筛查 ASMs30。在我们看来, 果蝇 幼虫测定具有许多优点。这些包括:(1) 许多化合物难以溶解在鱼游泳的人工海水中;(2) 斑马鱼测定依赖于减少游泳长度,这可能是由于暴露于 ASM 或违反直觉的促惊厥化合物而发生的。这是因为斑马鱼癫痫发作活动的增加也会导致游泳减少10。因此,任何化合物命中都必须进行二次筛选,这通常需要测量早期可诱导的神经元基因,例如 c-fos;(3) 鱼类只能在没有动物许可证的情况下使用,直到孵化后第 5 天。当然,斑马鱼比昆虫有一个明显的优势,因为它们的主要兴奋性神经递质是谷氨酸而不是乙酰胆碱31。将这两种检测方法结合起来,从 果蝇 开始,然后是斑马鱼,可能会在小鼠中测试较少的命中化合物之前提供非常强大的筛选。
总而言之, 果蝇 幼虫电击测定,加上果蝇和哺乳动物之间共享的遗传学和生理学的高度保守性,为识别新的抗癫痫疗法提供了一种非常有效、快速且廉价的筛选。增加采用这种昆虫进行药物筛选也将解决减少用于医学研究的高等动物数量的迫切需求。
披露声明
作者声明没有利益冲突。
致谢
我们感谢多年来共同开发这项技术的许多 Baines 实验室人员,特别是 Richard Marley,他为使这项技术稳健可靠付出了大量努力。我们感谢 Anna Munro 绘制幼虫,如图 2 所示。贝恩斯实验室的工作为开发这项技术做出了贡献,得到了 BBSRC、MRC 和 Wellcome Trust 的慷慨支持。这项工作目前得到了 RAB 的 Wellcome Trust 调查员奖 (Grant 217099/Z/19/Z) 的资助。这项技术的发展也受益于曼彻斯特苍蝇设施,该设施是通过大学和惠康信托基金 (Grant 087742/Z/08/Z) 的资金建立的。
材料
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
参考文献
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。