Method Article
Drosophila 유충에서 전기 충격에 의해 유도된 발작 활동
요약
이 프로토콜은 간질 치료를 위한 고유한 항경련 화합물을 식별하기 위해 Drosophila 유충을 사용하는 방법을 자세히 설명합니다.
초록
간질은 상당한 건강 부담을 안겨주며, 약물 불응성 환자의 수가 많을수록 악화됩니다. 일부 약물 불응성 환자는 비약물 치료(예: 미주신경 자극, 케톤 생성 식이요법 등)에 반응하지만, 많은 환자에게 최후의 수단은 발작을 완화하기 위해 까다롭고 비용이 많이 드는 수술입니다. 더 넓은 범위의 표적을 가진 항경련 약물이 필요하다는 것은 일반적으로 인정되고 있지만, 이를 달성하는 데 있어 장애물은 새로운 약물 표적을 식별하는 것입니다. 유전적으로 다루기 쉬운 모델 동물은 이와 관련하여 가능성을 제공합니다. 초파리( Drosophila melanogaster)는 발작의 기계론적 기초와 더 나은 치료법을 조사하는 강력한 모델이 되었습니다. 확인된 많은 파리 돌연변이는 유충과 성충이 강한 자극(전기적, 기계적 및/또는 열적)에 반응하여 발작과 같은 활동을 보이는 결과를 낳습니다. 이러한 돌연변이의 대부분은 인간의 유전적 간질에 기여하는 유전자와 상동하는 유전자(예: 전위의존성 Na+ 채널)에 있습니다. 또한 이제 파리 유전자를 질병 관련 돌연변이를 가지고 있는 인간 유전자로 대체하는 것도 가능합니다. 그리하여 이 보잘것없는 파리는 인간의 질병을 모델로 하는 아바타가 되었다. 이 연구는 항발작 가능성이 있는 고유한 화합물과 그 표적을 식별하기 위해 저처리량 및 중소 처리량의 약물 스크리닝에 초파리 유충을 사용하는 적절한 방법을 설명합니다.
서문
간질은 여전히 심각한 건강 부담으로 남아 있으며 전 세계 인구의 약 1%에 영향을 미칩니다. 현재 30가지 이상의 항경련제(ASM)가 임상 치료를 위해 존재하지만, 간질 환자의 약 1/3은 약물 불응성 상태로 남아 있으며, 이는 약물 치료에 잘 반응하지 않는다는 것을 의미합니다 1,2. 또한 시판되는 약물은 완화 효과에 그치므로 간질 발생을 예방하거나 치료제를 제공하지 않는다3. 따라서 더 나은 간질 치료법을 찾는 것이 매우 중요합니다. 보다 효과적인 치료법 개발을 가로막는 장애물은 새로운 약물 표적을 식별하는 것입니다. 실제로, 거의 모든 현재 ASM은 전압 의존성 나트륨 채널 (Nav)을 포함한 이온 채널과 γ-aminobutyric acid (GABA) 4 , 5에 의해 매개되는 억제성 신경 전달과 같은 유사한 표적에 영향을 미칩니다. 전통적인 약물 개발 방법을 계속 사용한다고 해서 이 시나리오가 근본적으로 바뀔 가능성은 거의 없다는 것이 일반적으로 받아들여지고 있습니다.
초파리 Drosophila melanogaster 및 제브라피시 Danio rerio를 포함하되 이에 국한되지 않는 실험실 모델 동물은 새로운 ASM 6,7,8을 식별하는 데 유용합니다. 실제로, PubMed에서 'Drosophila + seizure'를 검색하면 342개의 결과가 반환되는 반면, 제브라피쉬를 동일하게 검색하면 578개의 결과가 반환됩니다(두 검색 모두 2025년 1월 29일에 수행됨). 생쥐를 대상으로 한 유사한 연구의 수(~15,000건)에 비하면 왜소하지만, 모델 시스템을 사용한 연구의 수는 계속 증가하고 있습니다. 이러한 연구는 문(phyla) 전반에 걸쳐 CNS 기능의 기계론적 보존으로 인해 가능합니다. 더욱이, 파리와 어류의 유도 발작은 임상적으로 사용되는 ASM으로 효과적으로 치료되며, 이는 발작 행동의 뉘앙스가 겉으로 보기에는 다르게 보일 수 있지만 근본적인 메커니즘은 공통점이 많다는 것을 보여줍니다 7,9,10.
초파리(Drosophila)는 인간 생물학을 이해하는 데 많은 중대한 기여를 했습니다. 간질과 관련하여, 이 모델 시스템은 식별 가능하고 실험적으로 접근 가능한 뉴런과 결합된 비교할 수 없는 유전 도구 상자를 제공합니다7. 더욱이, 유충 및 성체 CNS에 대한 커넥톰이 현재 발표되었으며, 수많은 세포 특이적 유전적 드라이버 라인이 확인되었습니다11,12. 의미심장하게도, 성충 파리가 자세를 잃고 발작과 같은 활동(예: 날개 윙윙거림, 다리 흔들기 등)으로 강한 기계적 자극에 반응하는 돌연변이의 한 종류가 우연히 확인되었습니다. 이 종류의 돌연변이는 '뱅에 민감한(bang-sensitive)'13,14,15,16이라고 불린다. 이후 인간의 열성 발작을 반영하는 온도 상승에 반응하는 두 번째 종류의 발작 돌연변이가 확인되었습니다17,18. 그러나 성충 파리의 실험적 다루기 쉬움은 이 동일한 곤충 모델의 유충 단계에 비해 다소 감소합니다. 예를 들어, 성충 파리에게 약물을 먹이는 것은 어려울 수 있으며 전기 생리학 및 광유전학과 같은 보다 침습적인 기술은 더 어려울 수 있습니다. 대조적으로, 초파리 유충은 번데기를 가능하게 하기 위해 단 5일 만에 몸부피를 ~100배까지 확장하기 위해 끊임없이 먹습니다. 따라서 우리는 유충 단계에서 적절한 약물 공급을 확신할 수 있습니다. 배발생(embryogenesis)은 잘 문서화되어 있고 정확하게 단계화될 수 있으며, 그 결과 회로 형성에 이르기까지 신경세포의 전기적 특성의 첫 번째 획득을 포함하여 중추신경계 발달의 주요 이정표를 식별했습니다19. 일단 부화하면 유충은 5일째가 되면 '방황'이 될 때까지 3번의 탈피(또는 instars)를 거쳐 번데기가 될 안전한 장소를 찾기 위해 먹이를 떠납니다. 번데기가 ~100시간 지나면 성충 파리가 새로운 몸과 중추신경계로 나타납니다(그림 1).
성충의 발작을 유발하는 기술은 유충 단계에 적합하지 않습니다. 유충은 감각 털이 부족하며, 기계적 자극 중에 동기화된 활성화로 인해 발작이 발생할 수 있습니다. 따라서 이러한 어려움을 극복하기 위해 방황하는 유충 단계에서 발작을 유도하는 전기 충격 기술이 개발되었습니다. 유충과 성충 모두에 걸친 발작 유도 기술에 대한 후속 비교 분석은 유충 전기 충격이 돌연변이 유형(예: 강타 민감성 대 온도)에 훨씬 덜 의존한다는 것을 보여줍니다. 따라서, 우리는 이 기술이 최적의 발작 유도 방법이 알려지지 않은 경우 새로운 돌연변이를 테스트하는 데 선호되는 방법이어야 한다고 제안합니다20. 유충 전기 충격 기술은 간단하고 빠르며 최소한의 장비만 필요합니다. 이 기술은 인간 간질의 유전적 다양성을 반영하는 다양한 돌연변이에서 항발작 효능을 위해 새로운 화합물 또는 유전자 요법을 스크리닝하는 효율적인 수단을 제공합니다.
프로토콜
이 연구에는 초파리( Drosophila melanogaster)가 사용되었다(자세한 내용은 결과 섹션 참조). 이 기술은 방황하는 세 번째 instar 유충(L3)에 가장 적합합니다. 실험 프로토콜은 비교적 간단하지만 완벽하려면 연습이 필요합니다. 우리의 경험에 비추어 볼 때, 신입생은 분석을 마스터하는 데 약 2주가 소요되며, 경험이 많은 다른 조사자가 카메라 지원 해부 현미경 또는 이와 유사한 것을 사용하여 실시간으로 분석을 수행하는 것을 보는 것이 큰 이점이 있습니다. 이 연구에 사용된 시약과 장비는 재료 표에 나열되어 있습니다.
1. 애벌레 선택
- 표준 식품(물 5L, 포도당 390g, 옥수수 360g, 효모 250g, 한천 40g, 니파진 135mL, 프로피온산 15mL)이 들어 있는 파리 바이알/병의 측면에서 유충을 수집합니다.
- 활발하게 움직이고 음식을 남겨두고 용기 측면을 기어 올라간 유충만 사용하십시오(방황하는 세 번째 instars, L3). 운동이 크게 감소하는 번데기 이전을 선택하지 마십시오.
2. 감전 절차
- 떠돌이 L3 하나를 제거하고 작은 플라스틱 페트리 접시(크기는 상관없음)에 옮기고 ddH2O로 부드럽게 씻어 음식물 찌꺼기를 제거합니다. 여기에는 작은(000) 붓이 적합합니다.
- 페인트 브러시를 사용하여 한 번 씻은 유충을 빈 플라스틱 접시에 옮깁니다(다시 말하지만 크기는 중요하지 않습니다). 집게로 잡은 작은 종이 타월 조각으로 유충을 말리십시오. 과도한 ddH2O를 제거하되 플라스틱 접시에 달라붙지 않도록 유충을 완전히 건조시키지 마십시오.
- 유충이 30초 동안 회복할 때까지 기다립니다. 이렇게 하면 전기 충격 프로브를 쉽게 배치할 수 있습니다(아래 참조).
- View 저전력 해부 현미경(15-20x)으로 유충을 관찰하고 정상적인 크롤링 행동이 재개되면 전기 충격 프로브(자세한 내용은 3단계 참조, 그림 2A 참조)를 CNS의 대략적인 위치 위에 있는 유충의 앞쪽 등쪽 표면에 부드럽게 놓습니다( 그림 2C 참조).
알림: 이 단계는 매우 중요하며 프로브 와이어와 큐티클 사이에 우수한 전도성을 제공하기 위해 충분한 압력을 가해야 하지만 유충이 손상되지 않도록 주의하십시오. 따라서 유충을 깊이의 약 1/3에서 1/2만큼 짓밟으십시오. - 2s 펄스의 정전압을 적용하며, 그 강도는 적정 곡선을 통해 미리 결정되었습니다(그림 3). 모든 절연 전압 자극기가 여기에 적합합니다. 여기에 사용된 것은 그림 2B에 나와 있습니다.
- 감전 후 타이머를 시작하십시오. 충격에 대한 반응으로 유충은 일시적인 마비를 일으킨 후 때때로 체벽 근육 활동과 구르는 행동의 경련을 일으켜 정상적인 기어 다니는 행동을 중단시킵니다.
- 유충이 접시의 원래 위치에서 명확하게 멀어지면 타이머를 중지하십시오. 발작 지속 시간 또는 회복 시간(RT)은 자극 시작과 정상적인 크롤링 행동(예: 전진 이동을 초래하는 완전한 전방 연동파)의 재개 사이의 기간으로 정의됩니다.
- 하루가 끝나면 먼저 100% 에탄올로 헹군 다음 ddH2O로 프로브 와이어를 조심스럽게 청소합니다. 확대하여 와이어를 주의 깊게 검사하고 필요한 경우 집게를 사용하여 와이어의 잔여물을 부드럽게 긁어냅니다. 그렇게 할 때 두 전선 사이의 거리를 변경하지 않도록 각별히 주의하십시오.
3. 전기 충격 프로브 구조
- 2 x 1m 길이의 전선(가늘고 유연해야 함, 즉 ~3A 정격)이 필요합니다. 각 와이어의 끝에 5cm 길이의 텅스텐 와이어를 납땜합니다(접촉을 최대화하려면 납땜하기 전에 노출된 전선 끝 부분에 텅스텐 와이어를 감습니다). 푸시핏 커넥터(예: 바나나 플러그)를 전선의 다른 쪽 끝에 납땜하여 전압 자극기에 쉽게 연결할 수 있습니다.
- 두 텅스텐 와이어를 전극 홀더에 고정하여 와이어가 서로 평행이 되도록 합니다(그림 2). 유리 모세관의 작은 부분(길이 ~2cm)은 프로브 잠금 나사 아래에 와이어를 제자리에 고정하는 데 사용됩니다.
- 집게를 사용하여 와이어 홀더에서 나오는 위치에서 1-2mm 이내로 오도록 와이어를 구부립니다. 텅스텐 와이어를 구부리는 것은 와이어가 '메모리'를 유지하기 때문에 쉽지 않으므로 인내가 필요합니다. 이 프로세스에 도움이 되는 팁에는 전기 절연 테이프 및/또는 블루택(또는 유사한 모델링 퍼티)을 사용하여 와이어를 올바른 방향/거리로 유지하는 데 도움이 되는 것이 포함됩니다.
4. 프로브 교정
- 적절한 야생형(음성 대조군)과 발작 돌연변이(양성 대조군)의 떠돌이 L3의 재고가 있는지 확인합니다. 각각 ~100개가 필요합니다.
- 위에서 설명한 대로 한 번에 하나씩 유충을 준비합니다.
- 프로브를 사용하여 테스트된 각 전압에 대해 각 유전자형의 충분한 유충에 전압 범위를 적용합니다. 0 V, 2 V, 4 V, 6 V, 8 V, 10 V 및 12 V는 전압 당 10-15 마리의 유충 사이의 2 초 동안 적용되는 것이 좋습니다. 각 유충에게 한 번만 충격을 가하십시오.
- 각 유충의 회복 시간을 측정하고 두 유전자형에 적용된 각 전압 단계의 평균을 계산합니다.
- 그래프에 평균을 플로팅하고 데이터를 직선으로 피팅합니다.
- control과 seizure mutant 사이에 명확하고 중요한 차이가 있는 전압을 선택하십시오. 회복 시간이 지나치게 긴 전압을 선택하지 않도록 주의하십시오. 그렇지 않으면 복구를 위한 긴 대기 시간으로 인해 생산성이 저하됩니다.
참고: 이 연구는 종종 야생형의 경우 50-100초, 파라bss의 경우 200-300초의 회복 시간을 초래하는 자극 전압을 사용했습니다. 예시적인 검량선은 그림 3에 나와 있습니다. 유충의 등쪽 표면에 프로브를 누르는 행위를 설명하기 위해 0V를 사용하는 것이 중요합니다. 이것은 어느 정도의 마비를 일으키는데, 이는 유충의 방어 기제일 가능성이 높습니다.
5. 실험 실행
- 원하는 유전자형 또는 약물 노출의 전기 충격 유충을 측정하고 발작 회복 시간을 측정합니다.
참고: 테스트 유충의 경우 일반적으로 n = 20으로 충분하지만 파일럿 분석을 기반으로 한 전력 계산은 보다 명확한 n 숫자를 제공합니다. - 각 실험 중에 항상 negative(예: wild type) 및 positive( 예: parabss) 대조군을 실행합니다. n 숫자는 높을 필요가 없습니다. n = 5이면 충분합니다. 이를 통해 분석이 예상대로 작동했다는 확신을 얻을 수 있습니다(예: 프로브 또는 자극기에 문제가 없음).
- 회복 시간이 지나치게 길어지는 것을 피하기 위해 컷오프(예: 300초)를 적용하고 회복 시간이 30초 이상인 발작만 정량화할 수 있는 발작으로 간주합니다.
6. 약물 스크리닝
- 적절한 용매에 용해된 약물을 식품 표면에 직접 첨가하고 담그십시오(에탄올을 사용하는 경우 용매 증발 시간). 또는 녹은 파리 음식에 약물(적절한 용매)을 첨가할 수 있습니다. 자세한 내용은 결과 섹션을 참조하십시오.
- 녹은 음식에 약물을 첨가하려면 바이알에서 음식을 퍼내고 다시 녹인 다음 음식이 40 °C로 냉각되면 약물을 넣고 와류 믹서로 혼합 한 다음 녹은 음식 5mL를 바이알에 다시 넣고 사용하기 전에 식히십시오.
- 농도 구배를 실행하여 최적의 약물 농도를 식별합니다.
참고: 좋은 시작점은 식품 표면에 직접 3mM 약물 용액을 첨가하거나(표준 초파리 바이알당 200μL) 용융된 식품에 3mM 농도를 만드는 것입니다. 성인 암컷은 이 음식에 직접 알을 낳을 수 있거나 필요에 따라 선택한 단계에서 유충을 추가할 수 있습니다. 사용된 용매는 차량 제어로 선택한 바이알에 단독으로 첨가해야 합니다.
결과
수많은 초파리 돌연변이가 향상된 발작과 유사한 행동을 보인다 7,20. 이러한 돌연변이의 유전적 기초는 다양하며, 이는 인간 간질의 유사하게 다양한 유전적 원인을 유리하게 모방합니다. 가장 많이 연구된 초파리 돌연변이 중 세 가지는 parabangsenseless(parabss), julius seizure(jus) 및 easily-shocked(eas)입니다. parabss 돌연변이는 마비성 전압 개폐 Na+ 채널의 기능 이득을 초래하고, eas는 에탄올아민 키나아제를 인코딩하며, jus는 아직 확인되지 않은 막 단백질입니다(jus는 최근까지 슬램댄스라고 불렸습니다)16,21,22. 이러한 유전자 중 다수는 인간 상동체를 가지고 있습니다. 예를 들어, 마비는 인간 Nav 유전자의 상동체이며, 돌연변이는 유전적 간질의 주요 원인이다23. 인간의 간질과 마찬가지로, 이 세 가지 '강타에 민감한' 파리 돌연변이는 전기 충격에 대한 반응으로 차등 발작 '중증도'를 보여줍니다(그림 4). 가장 긴 회복 시간(즉, 가장 심한 발작 행동)은 parabss에 의해 나타나는 반면, jus는 가장 짧은 회복 시간을 나타냅니다. 서로 다른 근본적인 유전적 돌연변이로 인한 이러한 차등 반응을 통해 실험자는 선도 화합물이 다양한 돌연변이에서 발작을 감소시킬 수 있는 방법을 테스트하여 유리한 광역 스펙트럼 활성을 가진 돌연변이를 식별할 수 있습니다.
임상에서 사용되는 많은 ASM은 초파리 발작 모델에서도 동일하게 효과적이며, 따라서 초파리에서 발작을 일으키는 기본 메커니즘이 간질 환자에서 발작을 일으키는 메커니즘과 유사하다는 것을 나타냅니다 9,24,25. 그림 5는 임상적으로 가장 많이 사용되는 두 가지 ASM인 발프로산나트륨(VPA)과 페니토인(PHY)이 파라BSS에 미치는 영향을 보여줍니다. 유충은 전체 유충 발달 동안 3mM에서 음식(녹은 음식에 추가됨)에 포함된 ASM을 임시로 먹일 수 있었습니다. 야생형(Canton-S, CS) 및 parabss 공급 차량 제어(각각 에탄올 및 물)가 각 ASM에 공급되는 parabss와 함께 각 실험에 포함되었습니다. 두 약물 모두 발작 회복 시간(RT)이 분명하고 유의하게 감소합니다. ASM에 노출되지 않은 야생형과 알려진 발작 돌연변이(parabss) 모두 예상되는 발작 활성을 보인다는 점을 감안할 때, 우리는 이 두 실험의 타당성을 확신할 수 있습니다. 그렇지 않은 경우 분석을 폐기하고 실험을 반복해야 합니다. 이러한 '고장'의 근본 원인은 종종 전기 충격 프로브의 손상, 낮은 자극기 배터리 전력 및/또는 실험자의 경험 부족입니다. 25°C 미만의 온도에서 파리를 유지하는 것도 피해야 합니다(토론 섹션 참조). 이 기술은 고처리량 스크리닝에는 적합하지 않지만, 최근에는 ~30개 화합물의 저처리량 스크리닝에 사용되어 뉴런 항상성의 조절자인 Pumilio의 조작을 통해 발작을 효과적으로 줄이는 새로운 종류의 화학 물질을 식별했습니다. 정의된 마우스 발작 모델에서 발작을 줄이기 위한 이러한 동일한 화합물의 긍정적인 번역은 선도 화합물과 새로운 표적26,27 모두의 추가 개발을 위한 흥미로운 잠재력을 보여줍니다.
여기에 표시된 대표적인 결과(그림 4 및 그림 5)를 살펴보면 데이터 스프레드 내에 변동성이 있음이 분명합니다. 또한 이 두 그림에 표시된 데이터 간의 야생형 값에는 약간의 차이가 있습니다. 이것이 바로 이 분석이 정성적 분석이며 유전자형 간 또는 약물 스크리닝 분석에서 발작 중증도의 작은 차이를 식별하는 데 적합하지 않은 이유입니다. 그러나 이 분석은 알려지지 않은 돌연변이에서 발작 표현형을 식별하거나 항발작 활성에 대한 화합물의 초기 테스트에 매우 적합합니다27. 그러나 약물 개발을 더욱 개선하려면 다른 분석이 필요합니다.

그림 1: 초파리의 수명 주기. 배아에서 번데기를 거쳐 성체가 될 때까지의 초파리 생활 주기를 보여주는 개략도. 표시된 타이밍은 25°C에서 발달하기 위한 대략적인 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 전기 충격 프로브의 설계 및 배치. (A)는 상단과 측면 모두에서 프로브의 이미지를 보여줍니다. Blu-tack은 텅스텐 와이어가 프로브에서 확장됨에 따라 ~ 2mm의 와이어 간 거리를 유지하는 데 사용되었습니다. 유리 모세관의 짧은 부분 (화살표)은 텅스텐 와이어를 제자리에 고정합니다. 자극기에 연결되는 전선은 전기 절연 테이프로 프로브 핸들을 따라 덮여 고정됩니다. (B)는 이 연구에 사용된 권장 정전압 절연 자극기를 보여줍니다. (C)는 방황하는 제3-instar 유충의 앞쪽 등쪽 표면을 가로지르는 자극 프로브의 대략적인 위치를 보여줍니다. 프로브 와이어는 유충 몸을 가로질러 확장되며 CNS 바로 위의 영역은 ~2mm 와이어 간 거리입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
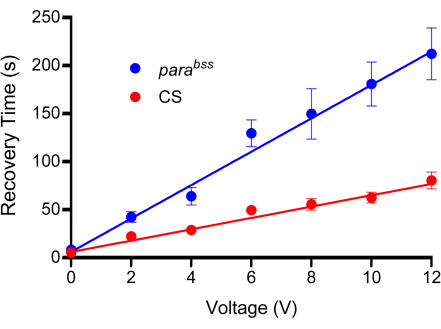
그림 3: 검량선. 실험하기 전에 전기 충격에 적합한 전압을 결정해야 합니다. 모든 프로브는 제조 특성으로 인해 약간 다를 수 있습니다. 야생형(이 경우 Canton-S, CS)과 발작 돌연변이체( 권장, parabss)는 각각 2초의 고정 지속 시간으로 설정되는 증가하는 전압 충격을 받습니다. 유충은 한 번만 충격을 가하며 테스트된 각 전압에 대해 최소 n = 10을 사용해야 합니다(이 경우 n = 12). 라인 맞춤에서 parabss가 모든 전압에서 증가된 발작 회복 시간을 보여준다는 것이 분명합니다. 선택한 전압은 대조군과 발작 돌연변이 사이에 명확하고 중요한 차이를 생성해야 합니다. 표시된 플롯에서 차이는 6V 이상에서 유의합니다(p ≤ 0.0001, Šidák의 다중 비교를 통한 양방향 ANOVA, n = 12, 유전자형 및 전압당). 따라서 6V는 상당한 차이를 생성했기 때문에 이 프로브의 최적 전압으로 선택되었지만 복구 시간이 짧게 유지되어 개별 감전을 수행하는 데 걸리는 시간이 단축되었습니다. 데이터는 SEM± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
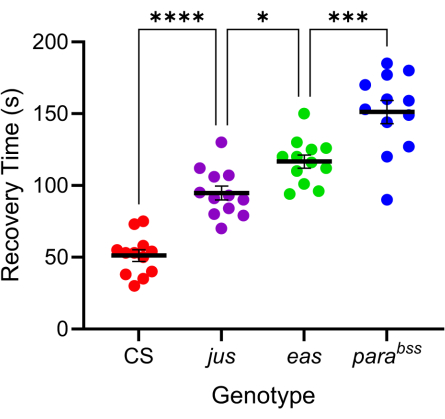
그림 4: 초파리 돌연변이마다 발작 중증도의 정도가 다릅니다. 그림 3에서 보정된 프로브를 사용하여 3개의 초파리 발작 돌연변이체(parabss, jus 및 eas)를 야생형(CS)과 함께 전기 충격(6 V, 2 s)을 가했습니다. 개별 유충은 한 번만 충격을 받았습니다. 발작 회복 시간은 야생형보다 발작 돌연변이의 경우 더 길며, jus에서 parabss로 점진적으로 증가한다(p ≤ 0.0001, Tukey의 다중 비교를 통한 단방향 ANOVA). Tukey의 다중 비교에서 통계적으로 유의한 비교는 ****p ≤ 0.0001, ***p ≤ 0.001, **p ≤ 0.01, *p ≤ 0.05로 표시됩니다. 데이터는 SEM± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
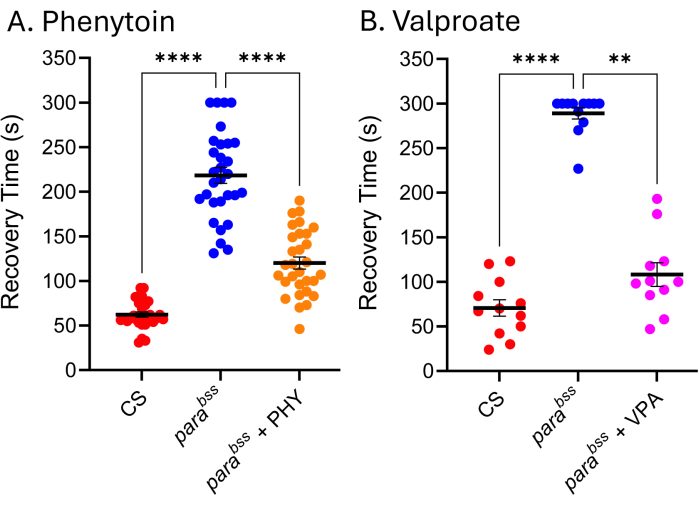
그림 5: 초파리 발작 돌연변이는 임상적으로 사용된 ASM에 반응합니다. (A) 페니토인(PHY) 및 (B) 발프로산나트륨(VPA)(각각 3mM)에 노출되면 parabss 의 발작 회복 시간이 유의하게 감소했다(p ≤ .01, Dunn의 다중 비교를 사용한 Kruskal-Wallis, 그리고 각각 p ≤ .0001, Tukey의 다중 비교를 사용한 일원 분산 분석). 30초 이상의 회복 시간만이 정량화 가능한 발작으로 간주되었으며 이러한 분석에는 300초의 컷오프가 사용되었습니다. 각 약물 분석은 다른 실험자에 의해 수행되었습니다. 따라서, 나타난 평균 회복 시간은 서로 다릅니다(특히 약물이 없는 ParaBSS 에서 뚜렷함). 이는 이 분석이 정성적 분석이라는 사실을 강조하며, 따라서 야생형 및 발작 돌연변이가 각 분석에 포함되어야 합니다. 이를 통해 필요한 경우 실험 간에 약물 활성을 정규화할 수 있습니다. Dunn's와 Tukey의 다중 비교에서 통계적으로 유의한 비교는 ****p ≤ 0.0001, ***p ≤ 0.001, **p ≤ 0.01, *p ≤ 0.05로 표시됩니다. 데이터는 SEM± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
초파리 유충에서 발작을 유도하는 전기 충격 방법은 새로운 항발작 화합물 또는 유전자 조작을 식별하기 위한 간단하면서도 효율적인 스크리닝을 제공합니다. 그러나 이것은 정성적 분석이기 때문에 주요 한계는 이 방법이 작은 효과 크기를 쉽게 식별할 수 없다는 것입니다. 그럼에도 불구하고, 연구자당 주당 최대 ~5개의 화합물을 스크리닝할 수 있는 중간 처리량은 매우 강력한 전체 동물 분석을 제공합니다. 이 기술의 단순성은 학부 수준의 실험실 프로젝트에도 적합합니다. 따라서 3-4명의 연구원은 비교적 짧은 시간에 많은 화합물을 스크리닝할 수 있으며 동등한 마우스 발작 분석을 사용하는 것보다 훨씬 적은 비용으로 스크리닝할 수 있습니다. 분석의 자동화는 처리량을 더욱 증가시킬 것입니다. 그러나 이 연구는 이를 수행하는 데 성공하지 못했습니다. 한천 내에 두 개의 전극이 내장된 리튬 함유 한천을 여러 유충에게 동시에 충격을 가하려고 시도했지만 성공하지 못했습니다. 아마도 광유전학에 기초한 다른 방법들이 자동화에 더 적합할 수 있다28.
그러나 분석의 단순성은 숙련되어야 하는 요구 사항을 약화시킵니다. 프로브의 위치와 전기 충격 중에 가해지는 압력은 중요한 단계입니다. 두 가지 모두의 일관성은 충격을 받은 유충의 회복 시간 사이의 변동성을 줄여줍니다. 또 다른 주요 문제는 발작 종점을 인식하는 방법인데, 이는 개별 조사자가 시계를 멈추기로 선택한 시기에 따라 달라지기 때문에 이 분석을 정성적으로 만듭니다. 같은 실험실의 여러 실험자가 이러한 실험을 수행할 때 발작 종점이 무엇인지에 동의하기 위해 동일한 유충 쇼크를 보는 데 시간을 할애하는 것이 좋습니다. 이렇게 하면 사람 간의 변동성이 크게 줄어듭니다. 그러나 이 보고서에 나타난 모범적인 결과에서 효과는 일정하지만 타이밍은 실험자마다 다를 수 있음이 여전히 분명합니다. 또한 25°C(예: 18°C) 미만의 온도에서 유충 발달은 배아 임계 기간 동안 신경 활동의 감소로 인해 발작의 중증도를 감소시킨다는 점에 유의하는 것이 중요합니다29. 따라서 배아/유충 발달을 위해 최소 25°C가 사용되는 것이 좋습니다. 작업대 가까이에 인큐베이터를 두는 것이 바람직하며 각 전기 충격에 필요한 만큼만 충분한 유충만 제거됩니다. 나머지 유충은 필요할 때까지 25 °C에서 보관해야 합니다. 연습을 통해 실험자는 한 번에 최대 4마리의 유충에게 충격을 가할 수 있으며 10초 간격으로 충격을 줄 수 있습니다. 이 접근 방식은 진행 속도를 크게 높이며 하루에 40마리(또는 그 이상)의 유충을 얻을 수 있습니다. 이 연구 중에 습도는 측정되거나 제어되지 않았습니다. 표준 12:12 명암 주기가 선택되었지만 실험자가 원하는 대로 변경할 수 있습니다.
프로브 제조는 이 방법에서 가장 어려운 부분입니다. 따라서 일단 만들어지면 손상시키지 않도록 세심한주의를 기울여야합니다. 전기 충격 프로브에 발생하는 모든 손상은 종종 수리를 수반하므로 최적의 전압을 결정하기 위해 프로브를 다시 보정해야 합니다. 전압은 전적으로 두 와이어 사이의 거리에 따라 달라지므로 두 프로브가 동일하지 않을 수 있습니다. 최적의 전압이 변경되지 않았는지 확인하기 위해 매월 프로브를 재보정하는 것이 좋습니다. 감전의 강도는 인가된 전압과 전압 지속 시간에 따라 달라집니다. 따라서 더 높은 전압에서 더 짧은 지속 시간은 더 약한 전압 자극을 사용하여 더 긴 지속 시간과 동일한 응답을 생성할 가능성이 높습니다. 그러나 이 분야는 조사되지 않았습니다. (이 연구에서) 2초 지속 시간에 대한 선호는 유충이 충격을 받지 않고 과도하게 움직이지 않고 쉽게 수용됩니다. 이것은 비교적 낮은 전압 강도를 가능하게 하여 유충 표피의 손상을 방지합니다. 자극의 효과는 또한 우리가 측정하지 않는 전류 강도(암페어)에 따라 달라집니다. 그러나, 상이한 자극기는 상이한 암페어를 생성하게 될 것이며, 따라서, Grass S88 자극기(25)를 사용하여, 50 V/3 s의 전압이 사용되었고, 여기에 사용된 자극기를 이용하면서, 사용되는 프로브에 따라 6-12 V/2 s가 사용되었음이 밝혀졌다. 사용된 실제 전압/지속 시간은 야생형 대조군보다 더 긴 회복 시간을 유도하기에 충분하고 유충에 피해를 입히지 않는 한 지나치게 중요하지 않습니다. 유충에 탐침을 놓는 행위(0V를 대조군으로 사용)는 어느 정도의 동결/마비(포식을 피하려는 시도를 나타냄)를 유발하기 때문에 '발작과 같은' 행동을 유발하지 않는 자극 기준은 없습니다.
전기 충격 분석은 항 발작 활성에 대한 약물을 스크리닝하는 데 적합합니다. 문제는 항상 해결될 수 있습니다. 에탄올 또는 아세톤이 DMSO보다 더 나은 용매인 것으로 밝혀졌습니다. 현재 실험에서 DMSO는 최대 ~1%까지 허용되며, 이를 초과하면 발달 중인 유충에서 허용할 수 없는 치사율이 관찰되었습니다. 유충을 약물에 노출시키는 두 가지 옵션, 즉 식품 바이알 상단에 약물(적절한 용매에 용해된 약물)을 첨가하거나 녹은 파리 사료에 첨가하는 두 가지 옵션 중 후자가 변동성 감소 측면에서 더 나은 결과를 제공하는 것으로 나타났습니다. 그러나 그 차이는 미미하고 전자의 방법이 더 빠릅니다. 실험자는 두 방법을 모두 비교하고 가장 적합한 방법을 선택하는 것이 좋습니다. 파리는 약물이 함유된 음식에 알을 낳을 수 있으며, 따라서 유충 발달 전체가 파낸 곳에 노출될 수 있습니다. 또는 약물 활성의 중요한 타이밍을 식별하기 위해 원하는 단계에서 유충을 약물 함유 식품에 배치할 수 있습니다. 임신한 암컷에게 약물을 먹이는 것은 발달 중인 배아를 약물에 노출시키는 효과적인 방법이다25.
일반적으로 사용되는 대안적인 발작 분석법은 경련제인 펜틸렌테트라졸에 노출된 제브라피시 배아를 사용하여 ASM을 스크리닝하는 것입니다30. 우리의 의견으로는 Drosophila 유충 분석법에는 많은 장점이 있습니다. 여기에는 다음이 포함됩니다 : (1) 많은 화합물이 물고기가 수영하는 인공 바닷물에 용해되기 어렵습니다. (2) 제브라피시 분석은 수영 시간을 줄이는 데 의존하며, 이는 ASM에 노출되거나 직관적이지 않게 경련 화합물에 노출되어 발생할 수 있습니다. 이는 제브라피시의 발작 활동이 증가하면 수영도 감소하기 때문입니다10. 그러므로, 모든 화합물 적중은 2차 스크리닝으로 후속 조치를 취해야 하며, 이는 종종 c-fos와 같은 조기 유도 신경 유전자의 측정을 필요로 합니다. (3) 물고기는 부화 후 5일째까지만 동물 허가 없이 사용할 수 있습니다. 물론, 제브라피쉬는 주요 흥분성 신경전달물질이 아세틸콜린이 아닌 글루타메이트라는 점에서 곤충에 비해 뚜렷한 이점이 있습니다31. 초파리(Drosophila )로 시작하여 제브라피시(zebrafish)로 이어지는 두 분석법의 조합은 마우스에서 더 적은 수의 유효 화합물을 테스트하기 전에 매우 강력한 스크린을 제공할 수 있습니다.
요약하자면, Drosophila 유충 전기 충격 분석법은 파리와 포유류 간에 공유되는 유전학 및 생리학의 높은 보존력과 결합되어 새로운 항발작 요법을 식별할 수 있는 매우 효과적이고 빠르며 저렴한 스크리닝을 제공합니다. 약물 검사를 위한 이 곤충의 채택이 증가하면 의료 연구에 사용되는 고차원 동물의 수를 줄여야 하는 시급한 필요성도 해결될 것입니다.
공개
저자는 경쟁 이익이 없음을 선언합니다.
감사의 말
우리는 수년에 걸쳐 이 기술을 공동으로 개발한 많은 Baines 연구소 직원, 특히 이 기술을 견고하고 신뢰할 수 있도록 많은 노력을 기울인 Richard Marley에게 감사드립니다. 그림 2에 표시된 유충을 그려 준 Anna Munro에게 감사드립니다. 이 기술을 개발하는 데 기여한 Baines 실험실의 연구는 BBSRC, MRC 및 Wellcome Trust의 아낌없는 지원을 받았습니다. 이 작업은 현재 R.A.B.(Grant 217099/Z/19/Z)에 대한 Wellcome Trust 조사자 상의 자금 지원으로 지원됩니다. 이 기술의 개발은 대학과 웰컴 트러스트(Wellcome Trust, Grant 087742/Z/08/Z)의 기금을 통해 설립된 맨체스터 플라이 시설(Manchester Fly Facility)의 도움도 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
참고문헌
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유