Method Article
Actividad convulsiva inducida por electrochoque en larvas de Drosophila
En este artículo
Resumen
Este protocolo detalla el uso de larvas de Drosophila para identificar compuestos anticonvulsivos únicos para el tratamiento de la epilepsia.
Resumen
La epilepsia presenta una importante carga para la salud que se ve agravada por el elevado número de individuos refractarios a los fármacos. Si bien algunos pacientes refractarios a los medicamentos responden a tratamientos no farmacológicos (por ejemplo, estimulación del nervio vago, dieta cetogénica, etc.), el último recurso para muchos es la cirugía desafiante y costosa para aliviar las convulsiones. Si bien en general se reconoce que se requieren medicamentos anticonvulsivos con una gama más amplia de objetivos, el obstáculo para lograrlo es la identificación de nuevos objetivos farmacológicos. Los modelos de animales genéticamente manejables son prometedores en este sentido. La mosca de la fruta, Drosophila melanogaster, se ha convertido en un poderoso modelo para investigar las bases mecanicistas de las convulsiones y mejores tratamientos para ellas. Muchas mutaciones identificadas en moscas dan lugar a que las larvas y los adultos presenten una actividad similar a la de las convulsiones en respuesta a una fuerte estimulación (eléctrica, mecánica y/o térmica). Muchas de estas mutaciones se encuentran en genes homólogos a los que contribuyen a las epilepsias genéticas humanas (por ejemplo, el canal Na+ dependiente de voltaje). Ahora también es posible reemplazar un gen de mosca con su equivalente humano que, además, porta una mutación relacionada con la enfermedad. Así, la humilde mosca se ha convertido en un avatar para modelar la enfermedad humana. Este estudio describe un método adecuado para utilizar larvas de Drosophila para el cribado de fármacos de bajo a medio rendimiento con el fin de identificar compuestos únicos, y sus objetivos, que tienen potencial anticonvulsivo.
Introducción
La epilepsia sigue siendo una carga importante para la salud, que afecta aproximadamente al 1% de la población mundial. A pesar de que ahora existen más de 30 medicamentos anticonvulsivos (ASM) para el tratamiento clínico, alrededor de un tercio de las personas con epilepsia siguen siendo refractarias a los medicamentos, lo que significa que no responden bien al tratamiento farmacológico 1,2. Además, los fármacos disponibles son solo paliativos y, como tales, no previenen la epileptogénesis ni proporcionan una cura3. Por lo tanto, existe una necesidad crítica de identificar mejores tratamientos para la epilepsia. Un obstáculo para el desarrollo de tratamientos más eficaces es la identificación de nuevas dianas farmacológicas. De hecho, casi todos los ASMs actuales afectan a objetivos similares: canales iónicos, incluido el canal de sodio dependiente de voltaje (Nav), y neurotransmisión inhibitoria mediada por ácido γ-aminobutírico (GABA)4,5. Es generalmente aceptado que es poco probable que el uso continuado de los métodos tradicionales de desarrollo de fármacos cambie radicalmente este escenario.
Los animales modelo de laboratorio, incluyendo, pero no limitado a, la mosca de la fruta Drosophila melanogaster y el pez cebra Danio rerio, tienen utilidad para la identificación de nuevas ASMs 6,7,8. De hecho, una búsqueda en PubMed de 'Drosophila + seizure' arroja 342 resultados, mientras que la misma búsqueda de pez cebra devuelve 578 resultados (ambas búsquedas se realizaron el 29de enero de 2025). Aunque se ve empequeñecido por el número de estudios similares en ratones (~15.000), el número de estudios que utilizan sistemas modelo sigue creciendo. Estos estudios son posibles debido a la conservación mecanicista de la función del SNC en todos los filos. Además, las convulsiones inducidas en moscas y peces se tratan eficazmente con ASMs utilizados clínicamente, lo que demuestra que, si bien los matices del comportamiento convulsivo pueden parecer externamente diferentes, los mecanismos subyacentes tienen mucho en común 7,9,10.
La mosca de la fruta, Drosophila, ha hecho muchas contribuciones fundamentales para comprender la biología humana. Con respecto a la epilepsia, este sistema modelo proporciona una caja de herramientas genéticas sin precedentes combinada con neuronas identificables y experimentalmente accesibles7. Además, ya se han publicado los conectomas tanto para el SNC larvario como para el adulto, y se han identificado numerosas líneas de impulsores genéticos específicos de la célula11,12. Significativamente, se identificó fortuitamente una clase de mutación en la que las moscas adultas responden a una fuerte estimulación mecánica mediante una pérdida de postura y una actividad similar a las convulsiones (por ejemplo, zumbido de las alas, sacudidas de las patas, etc.). Esta clase de mutación se ha denominado "sensible al bang"13,14,15,16. Desde entonces, se ha identificado una segunda clase de mutación convulsiva que responde al aumento de la temperatura, reflejando las convulsiones febriles humanas17,18. Sin embargo, la manejabilidad experimental de las moscas adultas es algo reducida en comparación con la etapa larvaria de este mismo modelo de insecto. Por ejemplo, puede ser difícil alimentar con medicamentos a las moscas adultas, y las técnicas más invasivas, como la electrofisiología y la optogenética, pueden ser más desafiantes. Por el contrario, la larva de Drosophila come constantemente para expandir su volumen corporal ~ 100 veces en solo 5 días para permitir la pupa. Por lo tanto, podemos estar seguros de una alimentación farmacológica adecuada en las etapas larvarias. La embriogénesis está bien documentada y puede ser estadificada con precisión, y a su vez ha identificado hitos clave en el desarrollo del SNC, incluyendo la primera adquisición de propiedades eléctricas neuronales hastala formación de circuitos. Una vez eclosionada, una larva pasa por 3 mudas (o estadios) hasta que, en el día 5, se convierte en "vagabunda", momento en el que deja la comida para encontrar un lugar seguro para pupar. Después de ~100 h de pupa, una mosca adulta emerge con un nuevo cuerpo y SNC (Figura 1).
Las técnicas para inducir convulsiones en adultos no son adecuadas para las etapas larvarias. Las larvas carecen de pelos sensoriales, cuya activación sincronizada durante la estimulación mecánica puede provocar una convulsión. Por lo tanto, para superar estas dificultades, se desarrolló una técnica de electrochoque para inducir convulsiones en la etapa larvaria errante. El análisis comparativo posterior de las técnicas de inducción de convulsiones tanto en larvas como en adultos revela que el electrochoque larvario depende mucho menos del tipo de mutación (por ejemplo, sensible a la explosión frente a la temperatura). Por lo tanto, sugerimos que esta técnica debería ser el método preferido para probar nuevas mutaciones en las que se desconoce el método óptimo de inducción de convulsiones20. La técnica de electrochoque larvario es sencilla, rápida y requiere un equipo mínimo. Esta técnica proporciona un medio eficiente para detectar nuevos compuestos, o terapias genéticas, para determinar la eficacia anticonvulsiva en una variedad de mutaciones que reflejan la diversidad genética de la epilepsia humana.
Protocolo
La mosca de la fruta, Drosophila melanogaster, se utiliza en este estudio (consulte la sección de Resultados para obtener más detalles). Esta técnica es la más adecuada para las larvas errantes de tercer estadio (L3). El protocolo experimental es relativamente simple, pero requiere práctica para perfeccionarlo. En nuestra experiencia, los nuevos estudiantes necesitan alrededor de 2 semanas para dominar el ensayo y se benefician enormemente de ver a otros investigadores más experimentados realizar el ensayo en tiempo real utilizando un microscopio de disección con cámara o similar. Los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Selección de larvas
- Recoja las larvas de los lados de los viales/frascos para moscas que contengan alimento estándar (5 L de agua, 390 g de glucosa, 360 g de maíz, 250 g de levadura, 40 g de agar, 135 mL de nipagina, 15 mL de ácido propiónico).
- Utilice únicamente larvas que se estén moviendo activamente y que hayan dejado que la comida se arrastre por los lados del recipiente (tercer estadio errante, L3). No seleccione pre-pupas, que exhiben una locomoción muy reducida.
2. Procedimiento de electrochoque
- Retire un solo L3 errante y transfiéralo a una pequeña placa de Petri de plástico (el tamaño no importa) y lávelo suavemente con ddH2O para eliminar los residuos de comida. Un pincel pequeño (000) es adecuado para esto.
- Transfiera la larva lavada individualmente, con un pincel, a un plato de plástico vacío (nuevamente, el tamaño no importa). Seque la larva con un pequeño fragmento de toalla de papel sostenido con pinzas. Retire el exceso de ddH2O, pero no seque completamente las larvas para evitar que se peguen al plato de plástico.
- Deje que la larva se recupere durante 30 s. Esto facilitará la colocación de la sonda de electrochoque (ver más abajo).
- Observe las larvas bajo un microscopio de disección de baja potencia (15-20x) y, una vez que se reanude el comportamiento normal de gateo, coloque suavemente la sonda de electrochoque (consulte el paso 3 para obtener detalles y la Figura 2A) en la superficie dorsal anterior de la larva por encima de la posición aproximada del SNC (consulte la Figura 2C).
NOTA: Este paso es crítico, se debe aplicar suficiente presión para proporcionar una buena conductividad entre el alambre de la sonda y la cutícula, pero tenga cuidado de no dañar las larvas. Por lo tanto, aplaste la larva entre un tercio y la mitad de su profundidad. - Aplique un pulso de 2 s de voltaje constante, cuya intensidad se ha predeterminado a través de una curva de valoración (Figura 3). Cualquier estimulador de voltaje aislado es adecuado aquí. El que se usa aquí se muestra en la Figura 2B.
- Después de la descarga eléctrica, inicie un temporizador. En respuesta al choque, las larvas inician una parálisis transitoria seguida de espasmos ocasionales de la actividad muscular de la pared corporal y el comportamiento de balanceo, deteniendo el comportamiento normal de gateo.
- Detenga el temporizador cuando la larva se haya alejado claramente de su ubicación original en el plato. La duración de la convulsión, o tiempo de recuperación (RT), se define como el período entre el inicio del estímulo y la reanudación del comportamiento normal de gateo (p. ej., una onda peristáltica completa hacia adelante que resulta en un movimiento hacia adelante).
- Al final de cada día, limpie cuidadosamente los cables de la sonda enjuagándolos primero con etanol al 100% seguido de ddH2O. Inspeccione cuidadosamente los cables con aumento y, si es necesario, use pinzas para raspar suavemente cualquier residuo de los cables. Tenga mucho cuidado de no alterar la distancia entre los dos cables al hacerlo.
3. Construcción de la sonda de electrochoque
- Se requerirán 2 x 1 m de longitud de cable eléctrico (debe ser delgado y flexible, es decir, con una capacidad nominal de ~ 3 A). Hasta el extremo de cada cable, suelde un alambre de tungsteno de 5 cm de longitud (para maximizar el contacto, enrolle el alambre de tungsteno alrededor de un extremo expuesto del cable eléctrico antes de soldar). Suelde conectores de ajuste a presión (por ejemplo, enchufes tipo banana) al otro extremo de los cables, adecuados para una fácil conexión al estimulador de voltaje.
- Asegure ambos cables de tungsteno a un portaelectrodos de manera que los cables queden paralelos entre sí (Figura 2). Se utilizan pequeñas secciones de capilares de vidrio (~2 cm de longitud) para mantener los cables en su lugar debajo del tornillo de bloqueo de la sonda.
- Use pinzas para doblar los alambres de manera que lleguen a una distancia de 1 a 2 mm cerca de donde salen del soporte del cable. Doblar los alambres de tungsteno no es fácil porque los alambres conservan una "memoria", por lo que se requiere perseverancia. Los consejos para ayudar en este proceso incluyen el uso de cinta aislante eléctrica y/o blu-tack (o masilla de modelar similar) para ayudar a mantener los cables en la orientación/distancia correcta.
4. Calibración de la sonda
- Asegúrese de que haya poblaciones de L3 errante de un tipo silvestre adecuado (control negativo) y de un mutante convulsivo (control positivo). Se necesitarán ~ 100 de cada uno.
- Prepare las larvas, una a la vez, como se describió anteriormente.
- Utilice la sonda para aplicar un rango de voltajes a suficientes larvas de cada genotipo para cada voltaje probado. Se sugiere aplicar 0 V, 2 V, 4 V, 6 V, 8 V, 10 V y 12 V durante 2 s entre 10-15 larvas por voltaje. Electrocuta a cada larva solo una vez.
- Mida el tiempo de recuperación de cada larva y calcule el promedio de cada paso de voltaje aplicado para ambos genotipos.
- Traza los promedios en un gráfico y ajusta los datos con una línea recta.
- Seleccione un voltaje con una diferencia clara y significativa entre el mutante de control y el mutante de convulsión. Tenga cuidado de no elegir un voltaje que produzca un tiempo de recuperación demasiado largo; De lo contrario, la productividad se verá afectada debido al largo tiempo de espera para la recuperación.
NOTA: Este estudio utilizó a menudo un voltaje de estimulación que da como resultado un tiempo de recuperación de 50-100 s para el tipo salvaje y de 200-300 s para el tipo salvaje. En la Figura 3 se muestran ejemplos de curvas de calibración. Es importante usar 0 V para tener en cuenta el acto de presionar la sonda sobre la superficie dorsal de una larva. Esto causará cierto grado de parálisis, que probablemente sea un mecanismo de defensa de la larva.
5. Ejecución de experimentos
- Larva de electroshock del genotipo(s) deseado(s) o exposición al fármaco y medir el tiempo de recuperación de las convulsiones.
NOTA: Para las larvas de prueba, un n = 20 suele ser suficiente, pero un cálculo de potencia basado en un análisis piloto proporcionará un número n más definitivo. - Ejecute siempre un control negativo (p. ej., de tipo salvaje) y uno positivo (p. ej., parabss) durante cada experimento. No es necesario que los números n sean altos; n = 5 es suficiente. Esto proporcionará la confianza de que el ensayo ha funcionado como se esperaba (por ejemplo, sin problemas con la sonda o el estimulador).
- Aplique un punto de corte (por ejemplo, 300 s) para evitar tiempos de recuperación demasiado largos y considere solo las convulsiones cuantificables como aquellas con tiempos de recuperación superiores a 30 s.
6. Detección de drogas
- Agregue medicamentos, disueltos en un solvente apropiado, directamente a la superficie del alimento y deje que se absorban (y si usa etanol, tiempo para la evaporación del solvente). O, alternativamente, se puede agregar un medicamento (en el solvente apropiado) a la comida para moscas derretida. Consulte la sección Resultados para obtener más información.
- Para agregar el medicamento a los alimentos derretidos, saque los alimentos de los viales, vuelva a derretirlos y, a medida que los alimentos se enfríen a 40 °C, agregue el medicamento, mezcle con un mezclador de vórtice y luego vuelva a verter 5 ml de alimentos derretidos en viales y deje enfriar antes de usar.
- Ejecute un gradiente de concentración para identificar la concentración óptima del fármaco.
NOTA: Un buen punto de partida es añadir 3 mM de solución de fármaco, ya sea directamente sobre la superficie del alimento (200 μL por vial estándar de Drosophila ) o para hacer una concentración de 3 mM en el alimento derretido. Se puede permitir que las hembras adultas pongan huevos directamente en este alimento, o se pueden agregar larvas en etapas seleccionadas según sea necesario. El disolvente o disolventes utilizados deben añadirse solos a los viales seleccionados como control del vehículo.
Resultados
Numerosas mutaciones de Drosophila exhiben un comportamiento similar a las convulsiones 7,20. La base genética de estas mutaciones es variada, lo que imita favorablemente las causas genéticas igualmente variadas de la epilepsia humana. Tres de las mutaciones de Drosophila más estudiadas son parabangsenseless (parabss), julius seizure (jus) y easy-shock (eas). La mutación parabss da lugar a una ganancia de función del canal paralizante de Na+ dependiente de voltaje, que codifica la etanolamina quinasa, y el jus es una proteína de membrana aún no identificada (nótese que el jus se denominaba slamdance hasta hace poco)16,21,22. Muchos de estos genes tienen homólogos humanos. Por ejemplo, el paralítico es un homólogo de los genes Nav humanos, cuyas mutaciones son una de las principales causas de epilepsia genética23. Al igual que con la epilepsia humana, estas tres mutaciones de la mosca "sensibles a la explosión" muestran una "gravedad" diferencial de las convulsiones en respuesta a una descarga eléctrica (Figura 4). El tiempo de recuperación más largo (es decir, el comportamiento convulsivo más severo) se exhibe en los parabss, mientras que el jus exhibe el tiempo de recuperación más corto. Esta respuesta diferencial, debida a diferentes mutaciones genéticas subyacentes, permite a un experimentador probar cómo los compuestos principales podrían reducir las convulsiones en una variedad de mutaciones para identificar aquellas con actividad favorable de amplio espectro.
Muchos ASMs utilizados en la clínica son igualmente efectivos en modelos de convulsiones de Drosophila, lo que indica que los mecanismos subyacentes que producen convulsiones en Drosophila son similares a los que resultan en convulsiones en personas con epilepsia 9,24,25. La Figura 5 muestra el efecto de dos de los ASM más utilizados clínicamente, el valproato de sodio (VPA) y la fenitoína (PHY), contra elparabss. Se permitió que las larvas se alimentaran ad libitum de la MAPE contenida en el alimento (añadida al alimento derretido) a 3 mM durante todo su desarrollo larvario. En cada experimento se incluyeron vehículos de control alimentados por parabss (etanol y agua, respectivamente), junto con parabss alimentados por el respectivo ASM. Hay una reducción clara y significativa en el tiempo de recuperación de las convulsiones (RT) para ambos fármacos. Dado que tanto el tipo salvaje como una mutación convulsiva conocida (parabss), sin exposición a la ASM, exhiben la actividad convulsiva esperada, podemos estar seguros de la validez de estos dos experimentos. Cuando este no es el caso, los ensayos deben descartarse y el experimento debe repetirse. La causa subyacente de este tipo de "fallo" suele ser el daño de la sonda de electrochoque, la baja potencia de la batería del estimulador y/o la inexperiencia del experimentador. También debe evitarse el mantenimiento de las moscas a temperaturas inferiores a 25 °C (véase la sección Discusión). Si bien esta técnica no es adecuada para el cribado de alto rendimiento, recientemente se utilizó en un cribado de bajo rendimiento de ~30 compuestos para identificar una nueva clase de productos químicos que reducen eficazmente las convulsiones mediante la manipulación de Pumilio, un regulador de la homeostasis neuronal. Una traducción positiva de estos mismos compuestos para reducir las convulsiones en modelos definidos de convulsiones en ratones muestra un potencial emocionante para un mayor desarrollo tanto de los compuestos principales como de la nueva diana26,27.
Al examinar los resultados representativos que se muestran aquí (Figura 4 y Figura 5), es evidente que existe variabilidad dentro de la dispersión de los datos. También hay una diferencia modesta en el valor de tipo salvaje entre los datos presentados en estas dos figuras. Esta es la razón por la que este ensayo es cualitativo y no es adecuado para identificar pequeñas diferencias en la gravedad de las convulsiones, ya sea entre genotipos o en ensayos de detección de fármacos. Sin embargo, el ensayo es muy adecuado para identificar un fenotipo de convulsiones en mutaciones desconocidas y/o para las pruebas iniciales de compuestos para la actividad anticonvulsiva27. Sin embargo, nuevos refinamientos en el desarrollo de fármacos requerirían ensayos diferentes.

Figura 1: Ciclo de vida de Drosophila . Un esquema que muestra el ciclo de vida de Drosophila , desde el embrión hasta el adulto, pasando por la pupa. Los tiempos que se muestran son aproximados para el desarrollo a 25 °C. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diseño y colocación de la sonda de electrochoque. (A) muestra imágenes de una sonda tanto desde la parte superior como desde el costado. Blu-tack se ha utilizado para mantener una distancia entre cables de ~ 2 mm a medida que los cables de tungsteno se extienden desde la sonda. Secciones cortas de capilares de vidrio (flecha) mantienen los alambres de tungsteno en su lugar. Los cables eléctricos que se conectan al estimulador están cubiertos y sostenidos a lo largo del mango de la sonda por cinta aislante eléctrica. (B) muestra un estimulador aislado de voltaje constante recomendado utilizado en este estudio. (C) muestra la posición aproximada de la sonda estimulante a través de la superficie dorsal anterior de una larva errante de tercer estadio. Tenga en cuenta que los cables de la sonda se extienden a través del cuerpo de la larva, y la región inmediatamente por encima del SNC es de ~ 2 mm de distancia entre cables. Haga clic aquí para ver una versión más grande de esta figura.
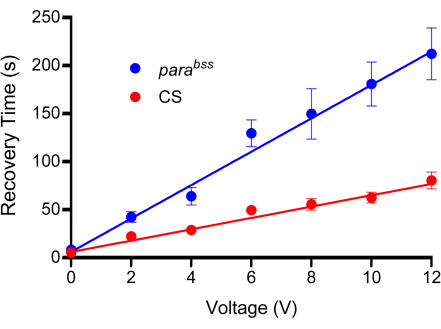
Figura 3: Curva de calibración. Antes de los experimentos, se debe determinar un voltaje adecuado para el electrochoque. Todas las sondas serán ligeramente diferentes debido a la naturaleza de su fabricación. Un tipo salvaje (en este caso Canton-S, CS) y un mutante convulsivo (recomendado, parabss) se someten a descargas de tensión crecientes, cada una de ellas con una duración fija de 2 s. Las larvas solo se electrocutan una vez, y se debe usar un mínimo de n = 10 para cada voltaje probado (en este caso, n = 12). Es evidente a partir de los ajustes de línea que los parabs muestran un mayor tiempo de recuperación de agarrotamiento en todos los voltajes. El voltaje elegido debe producir una diferencia clara y significativa entre los controles y los mutantes de convulsión. En el gráfico mostrado, las diferencias son significativas a 6 V y más (p ≤ 0.0001, ANOVA de dos vías con comparaciones múltiples de Šidák, n = 12, por genotipo y voltaje). Por lo tanto, se eligió 6 V como el voltaje óptimo para esta sonda, ya que produjo una diferencia significativa, sin embargo, el tiempo de recuperación se mantiene corto, reduciendo el tiempo necesario para realizar descargas eléctricas individuales. Los datos se presentan como media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
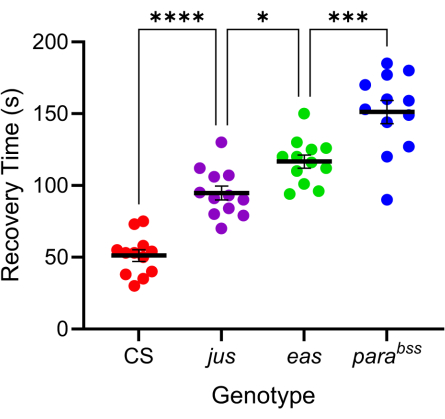
Figura 4: Diferentes mutaciones de Drosophila exhiben diferentes niveles de gravedad de las convulsiones. Utilizando la sonda calibrada en la Figura 3, tres mutantes convulsivos de Drosophila (parabss, jus y eas), junto con un tipo salvaje (CS), fueron sometidos a electroshock (6 V, 2 s). Las larvas individuales solo fueron electrocutadas una vez. Los tiempos de recuperación de las convulsiones son mayores para los mutantes convulsivos que para los de tipo salvaje y aumentan progresivamente de jus a para bss(p ≤ 0,0001, respectivamente, ANOVA de un factor con las comparaciones múltiples de Tukey). Las comparaciones estadísticamente significativas de las comparaciones múltiples de Tukey se indican como ****p ≤ 0,0001, ***p ≤ 0,001, **p ≤ 0,01, *p ≤ 0,05. Los datos se presentan como media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
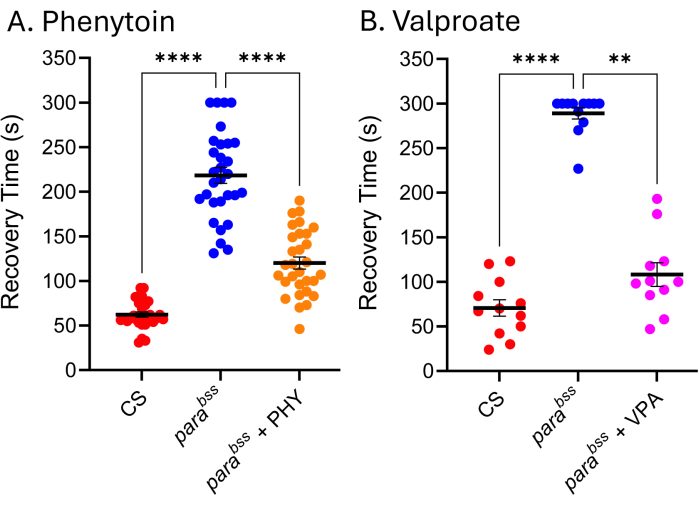
Figura 5: Los mutantes convulsivos de Drosophila responden a los ASM utilizados clínicamente. La exposición a (A) fenitoína (PHY) y (B) valproato de sodio (VPA) (3 mM, respectivamente) redujo significativamente el tiempo de recuperación de las convulsiones de para bss (p ≤ 0,01, Kruskal-Wallis con las comparaciones múltiples de Dunn, y p ≤ 0,0001, ANOVA de un factor con las comparaciones múltiples de Tukey, respectivamente). Solo los tiempos de recuperación por encima de 30 s se consideraron una convulsión cuantificable, y se utilizó un punto de corte de 300 s en estos ensayos. Cada ensayo de fármaco fue realizado por un experimentador diferente; Por lo tanto, los tiempos promedio de recuperación mostrados difieren (particularmente evidente para los ParaBSS sin un medicamento). Esto subraya el hecho de que este ensayo es cualitativo y, por lo tanto, se debe incluir un mutante de tipo salvaje y convulsivo en cada ensayo. Esto puede permitir que la actividad del fármaco se normalice entre experimentos, si es necesario. Las comparaciones estadísticamente significativas de las comparaciones múltiples de Dunn y Tukey se indican como ****p ≤ 0,0001, ***p ≤ 0,001, **p ≤ 0,01, *p ≤ 0,05. Los datos se presentan como media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método de electrochoque para inducir convulsiones en larvas de Drosophila proporciona un cribado simple pero eficiente para identificar nuevos compuestos anticonvulsivos o manipulaciones genéticas. Sin embargo, debido a que se trata de un ensayo cualitativo, su principal limitación es que el método no puede identificar fácilmente tamaños de efecto pequeños. Sin embargo, el rendimiento medio que permite, que se presta para cribar hasta ~5 compuestos por semana, por investigador, proporciona un ensayo de animal entero muy potente. La simplicidad de la técnica también es adecuada para proyectos de laboratorio de nivel universitario. Por lo tanto, 3-4 investigadores pueden analizar muchos compuestos en un período de tiempo relativamente corto y por mucho menos gasto que el uso de un ensayo equivalente de convulsiones en ratones. La automatización del ensayo aumentaría aún más el rendimiento. Sin embargo, este estudio no lo logró. Un agar que contenía litio con dos electrodos incrustados dentro del agar intentó electrocutar a múltiples larvas simultáneamente, pero sin éxito. Otros métodos, posiblemente basados en la optogenética, podrían ser más adecuados para la automatización28.
Sin embargo, la simplicidad del ensayo socava el requisito de llegar a ser competente. El posicionamiento de la sonda y la presión aplicada durante el electrochoque son pasos críticos. La consistencia en ambos reduce la variabilidad entre los tiempos de recuperación de las larvas impactadas. El otro problema principal es cómo reconocer el punto final de las convulsiones, lo que hace que este ensayo sea cualitativo porque depende de cuándo un investigador individual elija detener el reloj. Cuando varios experimentadores en el mismo laboratorio realizan estos experimentos, vale la pena dedicar tiempo a ver los mismos choques larvarios para ponerse de acuerdo sobre cuál es el punto final de una convulsión. Hacerlo reduce en gran medida la variabilidad interpersonal. Sin embargo, a partir de los resultados ejemplares mostrados en este informe, sigue siendo evidente que, si bien los efectos son constantes, los tiempos pueden variar entre los experimentadores. También es importante tener en cuenta que el desarrollo larvario a temperaturas inferiores a 25 °C (por ejemplo, 18 °C) reduce la gravedad de las convulsiones debido a una disminución de la actividad neuronal durante un período crítico embrionario29. Por lo tanto, se sugiere que se utilice un mínimo de 25 °C para el desarrollo embrionario/larvario. Es deseable tener una incubadora cerca del banco de trabajo, y solo se eliminan las larvas suficientes según sea necesario para cada electrochoque. Las larvas restantes deben mantenerse a 25 °C hasta que se necesiten. Con la práctica, los experimentadores pueden electrocutar hasta 4 larvas a la vez, espaciando los choques en intervalos de 10 s. Este enfoque acelera enormemente el progreso, y se puede lograr un n de 40 larvas (o más) en un día. La humedad no se midió ni se controló durante este estudio. Se seleccionó un ciclo estándar de luz-oscuridad de 12:12, pero esto puede variar según lo desee el experimentador.
La fabricación de una sonda es la parte más desafiante de este método. Por lo tanto, una vez hecho, se debe tener mucho cuidado de no dañarlo. Cualquier daño que ocurra en la sonda de electrochoque a menudo implicará una reparación y, por lo tanto, la sonda debe recalibrarse para determinar el voltaje óptimo. El voltaje depende completamente de la distancia entre los dos cables y, como tal, es probable que no haya dos sondas idénticas. Es aconsejable recalibrar una sonda cada mes para asegurarse de que el voltaje óptimo no haya cambiado. La fuerza del electrochoque depende tanto del voltaje aplicado como de la duración del voltaje. Por lo tanto, es probable que las duraciones más cortas con voltajes más altos produzcan la misma respuesta que las duraciones más largas, utilizando una estimulación de voltaje más débil. Sin embargo, este espacio no ha sido investigado. La preferencia por una duración de 2 s (en este estudio) se acomoda fácilmente sin que se produzca un movimiento excesivo de las larvas. Esto permite una fuerza de voltaje comparativamente más baja, lo que evita daños en la cutícula de la larva. El efecto de la estimulación también dependerá de la intensidad de corriente (amperios), que no medimos. Sin embargo, diferentes estimuladores producirán diferentes amperajes, por lo que se encontró que utilizando un estimulador Grass S8825, se utilizó un voltaje de 50 V / 3 s, mientras que utilizando el estimulador utilizado aquí, se utilizaron 6-12 V / 2 s, dependiendo de la sonda que se utilizara. El voltaje/duración real utilizado no es demasiado importante siempre que sea suficiente para inducir un tiempo de recuperación más largo que un control de tipo salvaje y no cause daño a la larva. Debido a que el simple hecho de colocar una sonda en una larva (usando 0 V como control) causa cierto grado de congelación/parálisis (indicativo de un intento de evitar la depredación), no hay criterios de estimulación que no induzcan algún comportamiento "similar a una convulsión".
El ensayo de electrochoque es adecuado para detectar la actividad anticonvulsiva de los fármacos. Un asunto siempre es solvente. Se descubrió que el etanol o la acetona son mejores solventes que el DMSO. En los experimentos actuales, el DMSO se tolera hasta ~1%, más allá del cual se observó una letalidad inaceptable en las larvas en desarrollo. De las dos opciones para exponer la larva a los medicamentos, ya sea agregando medicamento (disuelto en un solvente adecuado) a la parte superior de un vial de alimento o agregándolo al alimento derretido para moscas, se encontró que este último produce mejores resultados en términos de menor variabilidad. Sin embargo, la diferencia es marginal y el primer método es más rápido. Se recomienda que los experimentadores comparen ambos métodos y elijan el que mejor se adapte. Se puede permitir que las moscas pongan huevos en alimentos que contienen medicamentos, de modo que la totalidad del desarrollo larvario quede expuesta a la excavación. Alternativamente, las larvas se pueden colocar en alimentos que contienen medicamentos en cualquier etapa deseada para identificar el momento crítico de la actividad del medicamento. La alimentación con fármacos a las hembras grávidas es un método eficaz para exponer a los embriones en desarrollo a los fármacos25.
Un ensayo convulsivo alternativo y comúnmente utilizado es el uso de embriones de pez cebra expuestos al pentilenetetrazol proconvulsivo para detectar ASMs30. En nuestra opinión, el ensayo de larvas de Drosophila tiene muchas ventajas. Estos incluyen (1) muchos compuestos son difíciles de disolver en el agua de mar artificial en la que nadan los peces; (2) el ensayo del pez cebra se basa en la reducción de la longitud de nado, que puede ocurrir por la exposición a un ASM o, contrariamente a la intuición, a un compuesto proconvulsivo. Esto se debe a que el aumento de la actividad convulsiva en el pez cebra también resulta en una reducción de la natación10. Por lo tanto, cualquier golpe compuesto debe ser seguido con un cribado secundario, que a menudo requiere la medición de genes neuronales inducibles tempranos como c-fos; (3) Los peces solo se pueden usar sin una licencia de animal hasta el día 5 después de la eclosión. Por supuesto, el pez cebra tiene una clara ventaja sobre los insectos en que su principal neurotransmisor excitador es el glutamato y no la acetilcolina31. Una combinación de los dos ensayos, comenzando con Drosophila y seguido por el pez cebra, podría proporcionar una pantalla muy poderosa antes de que se prueben menos compuestos exitosos en ratones.
En resumen, el ensayo de electrochoque para larvas de Drosophila , junto con la alta conservación en genética y fisiología compartida entre moscas y mamíferos, proporciona un cribado muy eficaz, rápido y económico para identificar nuevas terapias anticonvulsivas. El aumento de la adopción de este insecto para la detección de drogas también abordará la necesidad urgente de reducir el número de animales de orden superior utilizados para la investigación médica.
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Agradecemos a todo el personal del laboratorio Baines que ha desarrollado conjuntamente esta técnica durante muchos años y, en particular, a Richard Marley, que se ha esforzado mucho para que esta técnica sea robusta y fiable. Agradecemos a Anna Munro por dibujar las larvas, que se muestran en la Figura 2. El trabajo en el laboratorio de Baines que ha contribuido al desarrollo de esta técnica ha sido generosamente apoyado por BBSRC, MRC y Wellcome Trust. Este trabajo cuenta actualmente con el apoyo financiero de una beca de investigación del Wellcome Trust a R.A.B. (Grant 217099/Z/19/Z). El desarrollo de esta técnica también se benefició del Manchester Fly Facility, que se estableció con fondos de la Universidad y el Wellcome Trust (Subvención 087742/Z/08/Z).
Materiales
| Name | Company | Catalog Number | Comments |
| Electrode holder | World Precision Instruments | M3301 | |
| Glass capillaries | Harvard Instruments | GC100F-10 | |
| Tungsten wire (99.95%) | Goodfellow Cambridge, UK | 0.1 mm diameter | |
| Voltage stimulator | Digitimer Ltd, UK | DS2A mkII | Constant Voltage Isolated Stimulator |
Referencias
- Fiest, K. M., et al. Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology. 88 (3), 296-303 (2017).
- Knezevic, C. E., Marzinke, M. A. Clinical use and monitoring of antiepileptic drugs. J Appl Lab Med. 3 (1), 115-127 (2018).
- Denton, A., et al. Definitions and risk factors for drug-resistant epilepsy in an adult cohort. Front Neurol. 12, 777888(2021).
- Meldrum, B. S., Rogawski, M. A. Molecular targets for antiepileptic drug development. Neurotherapeutics. 4 (1), 18-61 (2007).
- Sanchez, J. D., Gomez-Carpintero, J., Gonzalez, J. F., Menendez, J. C. Twenty-first century antiepileptic drugs: An overview of their targets and synthetic approaches. Eur J Med Chem. 272, 116476(2024).
- Cunliffe, V. T., et al. Epilepsy research methods update: Understanding the causes of epileptic seizures and identifying new treatments using non-mammalian model organisms. Seizure. 24, 44-51 (2015).
- Baines, R. A., Giachello, C. N. G., Lin, W. H. Drosophila. In Models of seizures and epilepsy. (2nd ed.). , 345-358 (2017).
- Burrows, D. R. W., et al. Imaging epilepsy in larval zebrafish. Eur J Paediatr Neurol. 24, 70-80 (2020).
- Reynolds, E. R., et al. Treatment with the antiepileptic drugs phenytoin and gabapentin ameliorates seizure and paralysis of Drosophila bang-sensitive mutants. J Neurobiol. 58 (4), 503-513 (2004).
- Baraban, S. C., Dinday, M. T., Hortopan, G. A. Drug screening in SCN1A zebrafish mutant identifies clemizole as a potential Dravet syndrome treatment. Nat Commun. 4, 2410(2013).
- Scheffer, L. K., et al. A connectome and analysis of the adult Drosophila central brain. Elife. 9, e57443(2020).
- Winding, M., et al. The connectome of an insect brain. Science. 379 (6636), eadd9330(2023).
- Ganetzky, B., Wu, C. F. Drosophila mutants with opposing effects on nerve excitability: Genetic and spatial interactions in repetitive firing. J Neurophysiol. 47 (3), 501-514 (1982).
- Song, J., Tanouye, M. A. From bench to drug: Human seizure modeling using Drosophila. Prog Neurobiol. 84 (2), 182-191 (2008).
- Parker, L., Howlett, I. C., Rusan, Z. M., Tanouye, M. A. Seizure and epilepsy: Studies of seizure disorders in Drosophila. Int Rev Neurobiol. 99, 1-21 (2011).
- Parker, L., Padilla, M., Du, Y., Dong, K., Tanouye, M. A. Drosophila as a model for epilepsy: BSS is a gain-of-function mutation in the para sodium channel gene that leads to seizures. Genetics. 187 (2), 523-534 (2011).
- Schutte, R. J., et al. Knock-in model of Dravet syndrome reveals a constitutive and conditional reduction in sodium current. J Neurophysiol. 112 (4), 903-912 (2014).
- Das, A., Smith, M. A., O'Dowd, D. K. A behavioral screen for heat-induced seizures in mouse models of epilepsy. J Vis Exp. (173), e62846(2021).
- Baines, R. A., Bate, M. Electrophysiological development of central neurons in the Drosophila embryo. J Neurosci. 18 (12), 4673-4683 (1998).
- Mituzaite, J., Petersen, R., Claridge-Chang, A., Baines, R. A. Characterization of seizure induction methods in Drosophila. eNeuro. 8 (4), (2021).
- Pavlidis, P., Ramaswami, M., Tanouye, M. A. The Drosophila easily shocked gene: A mutation in a phospholipid synthetic pathway causes seizure, neuronal failure, and paralysis. Cell. 79 (1), 23-33 (1994).
- Horne, M., et al. julius seizure, a Drosophila mutant, defines a neuronal population underlying epileptogenesis. Genetics. 205 (3), 1261-1269 (2017).
- Menezes, L. F. S., Sabia Junior, E. F., Tibery, D. V., Carneiro, L. D. A., Schwartz, E. F. Epilepsy-related voltage-gated sodium channelopathies: A review. Front Pharmacol. 11, 1276(2020).
- Kuebler, D., Tanouye, M. Anticonvulsant valproate reduces seizure-susceptibility in mutant Drosophila. Brain Res. 958 (1), 3642(2002).
- Marley, R., Baines, R. A. Increased persistent Na+ current contributes to seizure in the slamdance bang-sensitive Drosophila mutant. J Neurophysiol. 106 (1), 18-29 (2011).
- Lin, W. H., Giachello, C. N., Baines, R. A. Seizure control through genetic and pharmacological manipulation of Pumilio in Drosophila: A key component of neuronal homeostasis. Dis Model Mech. 10 (2), 141-150 (2017).
- Mulroe, F., et al. Targeting firing rate neuronal homeostasis can prevent seizures. Dis Model Mech. 15 (10), dmm049703(2022).
- Saras, A., Wu, V. V., Brawer, H. J., Tanouye, M. A. Investigation of seizure-susceptibility in a Drosophila melanogaster model of human epilepsy with optogenetic stimulation. Genetics. 206 (4), 1739-1746 (2017).
- Giachello, C. N., Baines, R. A. Inappropriate neural activity during a sensitive period in embryogenesis results in persistent seizure-like behavior. Curr Biol. 25, 1-5 (2015).
- Baraban, S. C., Taylor, M. R., Castro, P. A., Baier, H. Pentylenetetrazole-induced changes in zebrafish behavior, neural activity and c-fos expression. Neuroscience. 131 (3), 759-768 (2005).
- Gauthier, M. State of the art on insect nicotinic acetylcholine receptor function in learning and memory. Adv Exp Med Biol. 683, 97-115 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados