Case Report
Uniportal Endoscopique Complète Postéro-Latérale Transforaminale Lombaire Fusion Intersomatique
Dans cet article
Résumé
Le protocole offre une méthode précieuse détaillant chaque étape de la procédure FE-TLIF. Avec une formation appropriée, FE-TLIF peut être appris efficacement, ce qui conduit à des résultats cliniques favorables.
Résumé
La fusion intersomatique postérolatérale postérolatérale lombaire uniportale (FE-TLIF) a récemment montré des résultats prometteurs. Cependant, les débutants peuvent rencontrer des difficultés pour maîtriser les compétences techniques requises pour surmonter la courbe d’apprentissage d’une procédure plus efficace et plus sûre. Les objectifs de cette étude sont de fournir une procédure FE-TLIF détaillée et de fournir une explication étape par étape de toutes les méthodes, ainsi que d’utiliser un texte écrit pour décrire les principales techniques et précautions visant à assurer une procédure plus sûre et plus efficace. Nous présentons un cas de spondylolisthésis dégénératif L4-L5 avec syndrome de sténose spinale et sciatique droite. L’étude propose de précieuses séquences vidéo éducatives détaillant chaque étape de la procédure FE-TLIF. Le protocole intègre l’utilisation de plusieurs instruments communs aux procédures TLIF conventionnelles, une technique efficace de l’extérieur vers l’intérieur avec un trépan pour la résection de l’IAP, la visualisation endoscopique pour la préparation de la plaque d’extrémité et la protection nerveuse. Avec une formation appropriée, le FE-TLIF peut être appris efficacement, ce qui permet d’obtenir des résultats cliniques favorables tout en minimisant les complications.
Introduction
La fusion lombaire est considérée comme le traitement standard pour diverses affections lombaires dégénératives1. Avec la prévalence croissante de la chirurgie mini-invasive de la colonne vertébrale, les progrès des techniques et des instruments endoscopiques ont élargi les indications de la chirurgie endoscopique de la colonne vertébrale2. La fusion assistée par endoscopie a récemment démontré des résultats prometteurs, notamment une récupération plus rapide, une réduction de la perte de sang et une minimisation des lésions musculaires du dos 3,4,5. Par rapport à la fusion endoscopique trans-Kambin préservant les facettes, la fusion intersomatique transforaminale lombaire postérolatérale sacrifiant les facettes (TLIF) présente l’avantage d’un couloir relativement familier en tant qu’approche tubulaire mini-invasive TLIF (MIS-TLIF), d’une visualisation directe pendant la décompression vertébrale et d’une diminution des lésions des racines nerveuses sortantes6.
La fusion intersomatique lombaire postérolatérale postérolatérale endoportale complète (FE-TLIF) diffère considérablement en termes de technique chirurgicale et d’instrument par rapport à la TLIF unilatérale biportale assistée par endoscopie (UBE-TLIF)3,6,7. Bien que les deux techniques de fusion endoscopique aient montré des résultats postopératoires précoces et à moyen terme tout aussi favorables 5,8, la courbe d’apprentissage de FE-TLIF est plus raide. Les débutants peuvent rencontrer des difficultés pour maîtriser les compétences techniques requises pour surmonter la courbe d’apprentissage d’une procédure plus efficace et plus sûre4.
Le protocole de FE-TLIF décrit ci-dessous intègre des techniques décrites par le groupe 6,7,9,10,11 de Kim et Wu avec quelques modifications. En plus de l’utilisation d’un équipement endoscopique plus petit avec un bras de levier plus long7, la procédure présente des défis tels que les limites de l’équipement, en particulier les instruments pour la discectomie et la préparation de la plaque d’extrémité du cartilage12, ainsi que le manque de protection nerveuse visualisée lors de l’utilisation de planeurs à cage spécialisés pendant les procédures adjacentes, augmentant le risque de lésions des racines nerveuses13. Wu et al.11 ont signalé un taux de complications de 6 % impliquant des lésions à la racine transversale chez 35 patients subissant une FE-TLIF, même entre les mains de chirurgiens expérimentés. À l’inverse, Zhao et coll.14 ont observé un taux de révision de 9,6 % dans le premier tiers des patients traités, ainsi qu’une augmentation significative du temps d’exposition aux rayons X pendant la courbe d’apprentissage.
Pour surmonter ces défis, nous intégrons dans le protocole l’utilisation de plusieurs instruments communs aux procédures TLIF conventionnelles, la visualisation endoscopique pour la protection nerveuse lors de la préparation de la plaque d’extrémité et l’insertion de la cage. Les avantages par rapport aux références applicables mentionnées ci-dessus 7,11,14 étaient doubles : premièrement, la familiarité avec des instruments tels qu’un rasoir à plaque d’extrémité, un entonnoir et une cage non extensible TLIF standard améliore la sécurité des procédures ; et deuxièmement, la protection nerveuse visualisée garantit que les structures neuronales sont correctement protégées.
Les objectifs de cette étude sont d’enregistrer sur vidéo la procédure FE-TLIF et de fournir une explication étape par étape accompagnée de clips vidéo, et d’utiliser un texte écrit pour décrire les techniques clés et les précautions permettant d’assurer une procédure plus sûre et plus efficace.
PRÉSENTATION DE CAS :
Nous présentons un homme de 68 ans souffrant de douleurs au bas du dos, au mollet droit et de difficultés à marcher. Les symptômes associés comprenaient un engourdissement du territoire L5 droit et une claudication intermittente. L’imagerie a révélé un spondylolisthésis dégénératif L4-L5 avec syndrome de sténose spinale (Figure 1). Après une discussion approfondie, le patient a été programmé pour une fusion intersomatique endoscopique postérolatérale transforaminale lombaire complète uniportale droite (FE-TLIF).
Protocole
Cette étude (n° de référence 202500125B0) a été approuvée par le comité d’examen institutionnel de la Fondation médicale Chang Gung, Taïwan, et un consentement éclairé approprié a été obtenu.
1. Positionnement, marquage cutané et préparation du patient
- Position du patient : Après une anesthésie générale, placez le patient allongé sur un cadre Wilson avec une légère flexion pour une meilleure efficacité de décompression.
- Effectuez un marquage cutané guidé par fluoroscopie comme décrit ci-dessous.
- Marquez le point d’entrée de la vis transpédiculaire L4 droite voisin de l’isthme droit dans la vue AP comme un portail de travail endoscopique.
REMARQUE : Le point d’entrée de la vis transpédiculaire traditionnelle est généralement situé près de l’œil pédiculaire L4 dans la vue fluoroscopique antéropostérieure. L’entrée modifiée, positionnée plus médialement et caudale, permet un meilleur accès à la décompression controlatérale et à la préparation discale, respectivement. - Marquez les trois autres points d’entrée de la vis transpédiculaire comme d’habitude, à côté de l’œil pédiculaire bilatéral L4 et L5 dans la vue de fluoroscopie antéropostérieure.
- Marquez le point d’entrée de la vis transpédiculaire L4 droite voisin de l’isthme droit dans la vue AP comme un portail de travail endoscopique.
- Effectuez la préparation de la chirurgie comme décrit ci-dessous.
- Effectuez une désinfection à la povidone iodée du milieu du dos vers la fesse.
- Drapez le champ opératoire de manière aseptique. Préparez le champ opératoire avec une digue et un sac d’eau, qui sont nécessaires pour l’écoulement de l’eau de la chirurgie endoscopique. Positionnez la poche à eau comme une poche d’irrigation sur le côté du champ opératoire de forme carrée le plus proche du chirurgien. Surélevez les trois autres côtés à l’aide d’un drap chirurgical pour créer un barrage, permettant à l’eau de s’écouler dans le sac. Enfin, fixez l’installation avec un rideau à inciser antimicrobien étanche.
- Placez les instruments et le sac salin normal suspendus à environ 2 m au-dessus pour permettre l’écoulement par gravité. Les instruments comprennent : Un endoscope connecté à un système de caméra, un câble à fibre optique et un tube d’irrigation, une meule endoscopique, un ablateur endoscopique par radiofréquence. Fixez solidement ces instruments au champ à l’aide de pinces, ce qui permet une bonne amplitude de mouvement.
2. Création d’un espace de travail et identification des points de repère
- Configurez le portique de travail endoscopique comme décrit ci-dessous.
- Créez un portail endoscopique en faisant une incision longitudinale de 1,2 cm de long à l’aide d’un scalpel au premier repère de l’étape 1.2 et une incision plus large du fascia en dessous. Le fascia est la première couche ferme située juste sous le tissu sous-cutané. Faites une incision crânienne et caudale dans le fascia à l’aide d’un scalpel d’une longueur totale de 2,5 à 3,0 cm.
- Ancrez l’obturateur sur la région droite de l’isthme L4 en vérifiant la fluoroscopie. Utilisez l’obturateur pour entrer en contact avec l’os et confirmer sa position à l’aide d’une imagerie fluoroscopique.
- Mettez les dilatateurs en série et, enfin, le tube de travail à biseau ouvert (diamètre extérieur de 11,2 mm / diamètre intérieur de 10,2 mm ; Figure 2A). Insérez les dilatateurs tout en utilisant l’obturateur maintenu fermement comme guide. En cas de doute, repositionnez l’obturateur pour qu’il entre à nouveau en contact avec l’os et vérifiez la position à l’aide de la fluoroscopie.
- Pour trouver des points de repère, introduisez un endoscope incliné de 15° (diamètre extérieur de 10 mm). Disséquez les tissus mous à l’aide d’un ablateur par radiofréquence pour dégager l’espace autour de la facette L4/L5 droite et identifiez les points7 de Wu et de Kim à l’aide d’images fluoroscopiques (Figure 2B-C). Utilisez des meules pour créer une surface osseuse comme points de repère après vérification de la position par fluoroscopie pour éviter la désorientation.
3. Décompression ipsilatérale
- Élimination de l’apophyse articulaire inférieure (IAP) : Utilisez la technique de l’extérieur vers l’intérieur10 pour éliminer efficacement l’IAP du point de Wu au point de Kim avec un trépan et un ostéotome. Lorsque le morceau d’os IAP dans le trépan ou de l’ostéotome est fracturé, conservez le morceau sous forme d’autogreffe.
- Remplacez le tube de travail par un tube plus grand pour l’alésoir (diamètre extérieur de 12,5 mm / intérieur de 11,5 mm) et avancez la gaine du tube de travail dans l’espace articulaire pour la stabilisation lors de l’utilisation du trépan pour éliminer le processus articulaire inférieur. Faites pivoter doucement le trépan tout en maintenant le tube de travail stable avec l’autre main. Lorsque le morceau d’os IAP dans le trépan est fracturé, l’os tourne pendant la rotation du trépan.
- Retirez l’IAP résiduel à l’aide d’un ostéotome endoscopique. Conservez le morceau d’os sous forme d’autogreffe.
- Effectuez la décompression de la dure-mère et la flavectomie ipsilatérale comme décrit ci-dessous.
- Identifiez l’origine et l’insertion du ligamentum flavum ipsilatéral en enlevant la lame caudale de la L4 droite, la lame crânienne de la L5 droite et la base médiale de l’apophyse articulaire supérieure (PAS). Utilisez soit une fraise diamantée à grande vitesse de 4 mm, soit un Kerrison Rongeur.
REMARQUE : Plutôt qu’une technique de l’extérieur vers l’intérieur dans la décompression15, nous utilisons une technique de l’intérieur vers l’extérieur et utilisons la structure neurale comme référence anatomique pour la décompression. - Retirer le ligamentum flavum ipsilatéral morceau par morceau pour exposer la racine traversante L5 droite et le disque foraminal avec une hypophyse endoscopique ou un Kerrison Rongeur.
- Identifiez l’origine et l’insertion du ligamentum flavum ipsilatéral en enlevant la lame caudale de la L4 droite, la lame crânienne de la L5 droite et la base médiale de l’apophyse articulaire supérieure (PAS). Utilisez soit une fraise diamantée à grande vitesse de 4 mm, soit un Kerrison Rongeur.
4. Décompression controlatérale
- Technique exagérée : Retirez la base de l’apophyse épineuse jusqu’à ce que la lame crânienne controlatérale, la lame caudale et la facette controlatérale soient visibles.
- Décompression de la dure-mère et flavectomie controlatérale : Enlever l’origine et l’insertion du ligamentum flavum controlatéral. Retirez la base médiale controlatérale du SAP pour libérer la racine transversale L5 gauche.
- L’identification de ces structures est l’étape la plus critique. Retirez les lames crânienne et caudale jusqu’à ce que l’origine et l’insertion du ligamentum flavum controlatéral soient clairement visibles. Extrayez soigneusement le ligamentum flavum libéré morceau par morceau à l’aide d’un rongeur hypophysaire endoscopique ou d’un rongeur Kerrison jusqu’à ce que la dure-mère soit exposée.
- La partie latérale du ligamentum flavum s’étend sous la base médiale du SAP. Retirez la base médiale du SAP tout en préservant la partie la plus externe du ligamentum flavum pour protéger la racine transversale controlatérale, qui se trouve latéralement à la dure-mère. Enfin, retirez tout le ligamentum flavum controlatéral. Veuillez vous référer à la vidéo pour plus de détails anatomiques.
5. Dégagement de l’espace disque et préparation de la plaque d’extrémité
- Assurez-vous qu’il y a suffisamment d’espace d’entrée dans la cage craniocaudale en retirant l’extrémité crânienne de l’apophyse articulaire supérieure par ostéotome jusqu’au bord crânien du pédicule. Assurez-vous qu’il y a suffisamment d’espace médiolatéral en dégageant l’espace épidural près de la racine traversante L5 droite.
- Effectuez une discectomie endoscopique en traversant la protection des racines comme décrit ci-dessous.
- Retirez le tube de travail d’origine et passez à un tube de travail plus grand avec une poignée et une longue lèvre (diamètre extérieur de 16 mm / diamètre intérieur de 15 mm). Utilisez le dissecteur pour protéger la racine transversale L5 droite et tournez doucement la pointe longue pour rétracter la racine nerveuse traversante.
- Effectuer une annulotomie à l’aide de ciseaux à crochet au site d’entrée de la cage prévu. Insérez les rasoirs d’extrémité en série en suivant la procédure conventionnelle de fusion intersomatique lombaire transforaminale. Passez le fluoroscope à projection latérale pour surveiller la position du rasoir à plaque d’extrémité (Figure 3A).
- Tenez fermement le tube de travail pour vous assurer que les structures neurales sont protégées en toute sécurité lors de la visualisation endoscopique. Retirez l’endoscope pour permettre au rasoir de plaque d’extrémité de passer. Lorsque vous récupérez chaque rasoir à plaque d’extrémité, relâchez la racine nerveuse en tournant la lèvre longue. Utilisez l’endoscope pour inspecter le matériau du disque et évaluer l’état du nerf.
- Retirez le matériau du disque et le cartilage à l’aide d’une pince hypophysaire par visualisation directe.
- Effectuez l’insertion de la cage d’essai comme décrit ci-dessous.
- Après avoir préparé la plaque d’extrémité souhaitée avec un saignement ponctué de l’os sous-chondral, insérez l’essai de cage en série pour déterminer la taille de la cage tout en protégeant la racine traversante L5.
- Déterminez la hauteur idéale de la cage à l’aide d’essais en série de cage par incréments de 1 mm à partir de 8 mm (Figure 3B). La taille idéale de la cage peut être déterminée en fonction de la tension requise pour déplacer l’essai de la cage, de la qualité de l’os et de la hauteur du disque des niveaux adjacents. Lors du retrait de chaque essai de cage, utilisez un marteau frappé pour appliquer une force axiale d’une main tout en évitant soigneusement tout impact sur le tube de travail, qui doit être maintenu fermement avec l’autre main.
6. Fusion intersomatique avec greffe osseuse et cage
- Greffe osseuse : Tenez fermement le tube de travail et retirez l’endoscope pour permettre le passage de l’entonnoir de greffe osseuse dans l’espace discale. À l’aide d’un dispositif de greffe osseuse en forme d’entonnoir, confirmez son placement idéal dans l’espace discale par fluoroscopie (Figure 3C). Insérer une greffe osseuse autologue suivie d’un substitut osseux artificiel dans l’ordre.
- Tenez fermement le tube de travail pour vous assurer que les structures neurales sont protégées en toute sécurité lors de la visualisation endoscopique. Retirez l’endoscope pour permettre au dispositif de greffe osseuse en forme d’entonnoir de passer à travers et positionnez-le dans l’espace discal. La profondeur optimale se situe entre le tiers antérieur et la moitié du corps vertébral L5.
REMARQUE : Le matériel de greffe osseuse peut être livré à travers l’entonnoir et placé dans l’espace du disque antérieur à l’aide d’un impacteur de greffe osseuse. Dans cette procédure, 2,5 cc de substitut d’os artificiel en mastic de matrice osseuse déminéralisée ont été utilisés. Le volume des copeaux de lamina autologues n’est pas mesuré régulièrement. Cependant, plusieurs cycles d’impaction en entonnoir sont généralement nécessaires pour insérer la quantité totale de greffe osseuse.
- Tenez fermement le tube de travail pour vous assurer que les structures neurales sont protégées en toute sécurité lors de la visualisation endoscopique. Retirez l’endoscope pour permettre au dispositif de greffe osseuse en forme d’entonnoir de passer à travers et positionnez-le dans l’espace discal. La profondeur optimale se situe entre le tiers antérieur et la moitié du corps vertébral L5.
- Insérez la cage TLIF comme décrit ci-dessous.
- Insérez une cage de fusion intervertébrale classique (cage TLIF, en forme de balle, 26 mm de longueur, PEEK). Tenez fermement le tube de travail pour vous assurer que les structures neurales sont protégées en toute sécurité lors de la visualisation endoscopique. Retirez l’endoscope pour permettre au passage de la cage. Lorsque vous engagez la cage dans l’espace discal postérieur, vérifiez la position et l’axe par image fluoroscopique latérale, afin d’éviter tout danger pour la structure neurale et la plaque d’extrémité.
- Vérifiez la position de la cage par fluoroscopie (Figure 3D). La position optimale est centrée dans l’espace du disque. Sur la vue latérale, assurez-vous que le marqueur postérieur de la cage est positionné en avant de la ligne vertébrale postérieure du corps, tandis que sur la vue antéropostérieure, le marqueur antérieur est aligné avec l’apophyse épineuse.
7. Vérification finale
- Utilisez à nouveau l’endoscopie après l’insertion de la cage pour une décompression adéquate de la dure-mère et des racines (Figure 4A-C). Inspectez et retirez tout tissu discal ou caillot sanguin libéré. Fermez l’entrée d’eau pour vérifier l’expansion et la pulsation de la dure-mère et des racines.
- Arrêtez l’hémorragie par l’os spongieux et les vaisseaux épiduraux. Inspectez tout point de saignement et arrêtez-le avec un ablateur à radiofréquence. Fermez l’entrée d’eau pour vérifier s’il y a un saignement excessif. Un agent hémostatique peut être utilisé si nécessaire.
8. Application des vis et des tiges pédiculaires
- Insérer les vis pédiculaires percutanées sous fluoroscopie. Réduire la flexion du cadre Wilson pour restaurer la lordose du patient par l’infirmière circulante. Insérez des vis pédiculaires percutanées bilatérales L4 et L5 avec une technique typique (Figure 5A-B).
- Utilisez l’aiguille canulée pour insérer un fil K. Laissez le fil K en place une fois l’aiguille canulée retirée. Placez la vis pédiculaire canulée sur le fil k une fois que les tissus mous se sont dilatés. Pour surmonter la tension cutanée dans l’incision cutanée caudale et médiale relative ou l’entrée L4 droite, créez un tunnel sous-cutané et une autre entrée de fascia à partir de l’incision cutanée d’origine.
- Serrez la tige et réduisez le spondylolisthésis. Appliquez la tige par voie percutanée et ajustez d’abord les vis distales. Lors de l’application d’une compression à vis ipsilatérale, serrer d’abord les vis distales, puis les vis proximales pour la réduction de la tige du spondylolisthésis (Figure 5C-D). Effectuez la compression de vis manuellement. Des instruments spécialisés relatifs au système de vis percutanées pourraient également être utilisés.
9. Fermeture de la peau en couches avec drain inséré
- Insérez un tube de drainage Hemovac avec l’extrémité dans la région de la cage (Figure 4D). Fermez la peau en couches. Suturez le fascia avec du Vicryl n° 1 et la couche sous-cutanée avec du Vicryl 2-0 et 3-0. Fixez le tube de drainage sur la peau avec une suture Vicryl 2-0.
Résultats
De septembre 2024 à mars 2025, un total de 10 patients de notre hôpital ont été diagnostiqués avec un spondylolisthésis dégénératif L4-L5 avec sténose spinale et ont subi une intervention chirurgicale. La cohorte comprenait cinq hommes et cinq femmes, avec un âge moyen de 67,0 ± 9,27 ans (extrême : 52-82). La durée chirurgicale moyenne était de 333,2 ± 47,25 min (plage : 274-424). En postopératoire, les patients ont signalé une amélioration significative du score de douleur au dos et à la jambe sur une échelle visuelle analogique (0-10) de 7,2 ± 1,14 à 1,3 ± 1,34. Ils ont été capables de s’asseoir et de se tenir debout dans le service le jour postopératoire 1,4 ± 0,52 et ont commencé à marcher de manière indépendante avec une attelle Taylor le jour 2,3 ± 0,82. Le tube de drainage a été retiré le jour 2,6 ± 0,52, et les patients ont été libérés le jour 4,1 ± 1,60. Selon les critères de MacNab16, six patients (60 %) ont obtenu d’excellents résultats, un troisième (30 %) a obtenu de bons résultats et un (10 %) a obtenu un résultat passable. Il n’y avait aucune complication telle qu’une lésion nerveuse, un hématome épidural et un mauvais positionnement de la vis (tableau 1). La figure 6 montre les radiographies postopératoires du cas présenté prises 2 jours après l’intervention et les images IRM à 6 semaines, démontrant l’efficacité du protocole décrit.

Figure 1 : Images opératoires du patient. (A) Rétrécissement asymétrique de l’espace discal de L4-L5. (B, C) Spondylolisthésis dégénératif L4-L5 à glissement dynamique. (D, E, F) L’IRM T2WI a montré un spondylolisthésis L4-L5 avec sténose spinale, Schizas grade C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
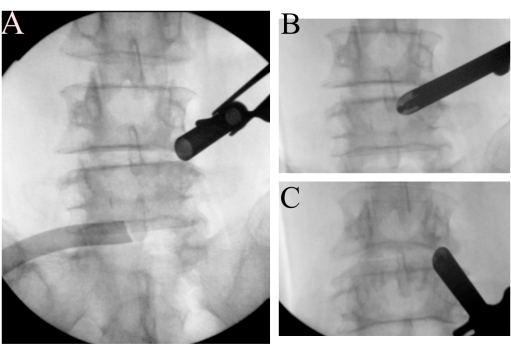
Figure 2 : Identification d’un point de repère. (A) Le tube de travail à biseau ouvert s’amarre sur la région droite de l’isthme L4. (B) Identification du point de Wu et (C) Point de Kim. Veuillez cliquer ici pour voir une version agrandie de cette figure.
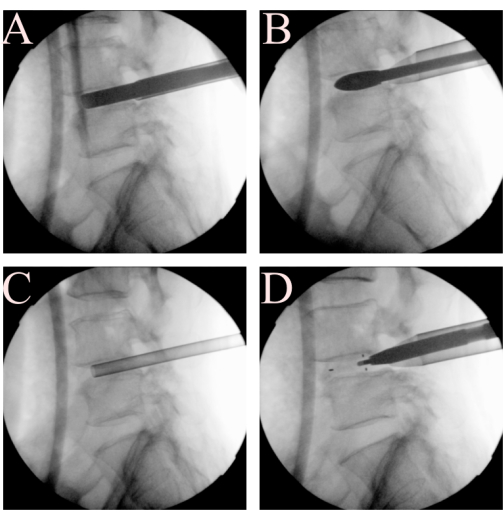
Figure 3 : Procédures du disque et de la plaque d’extrémité. Au cours de l’étape de dégagement de l’espace disque, de la préparation de la plaque d’extrémité, de l’utilisation (A) d’un rasoir à plaque d’extrémité, (B) d’un essai en cage, (C) d’un entonnoir pour la greffe d’os et (D) d’une cage TLIF. Veuillez cliquer ici pour voir une version agrandie de cette figure.
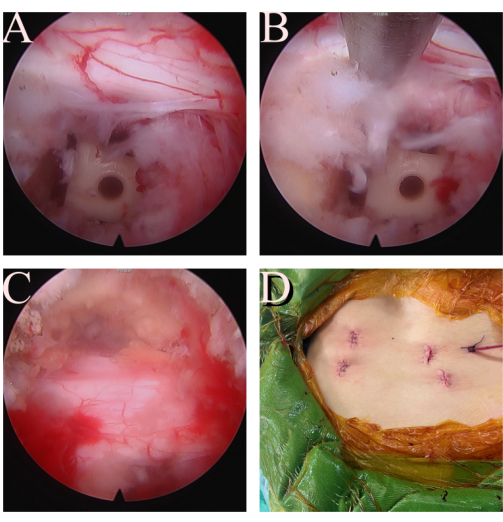
Figure 4 : Vérification finale. (A, B) La racine transversale ipsilatérale L5 est intacte et bien décompressée. (C) La dure-mère et la racine traversante L5 controlatérale sont également libérées. (D) Incision et plaie de la procédure FE-TLIF. Veuillez cliquer ici pour voir une version agrandie de cette figure.
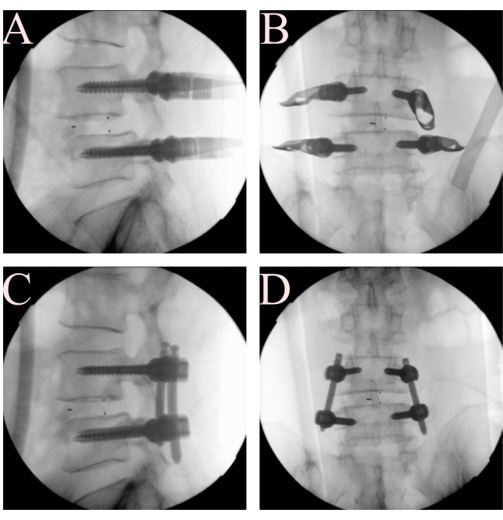
Graphique 5. Insertion de vis pédiculaires percutanées et réduction de la tige. (A, B) Appliquez des vis et des tiges pédiculaires, et (C, D) utilisez la tige pour réduire le spondylolisthésis. Veuillez cliquer ici pour voir une version agrandie de cette figure.
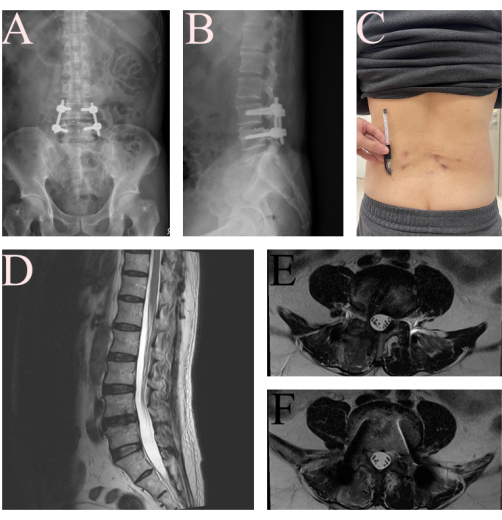
Figure 6 : Images postopératoires du patient après FE-TLIF. (A) Radiographie antéropostérieure et (B) radiographie latérale du patient montrant une bonne position de l’implant et une réduction du spondylolisthésis à 2 jours. (C) Photographie des plaies lombaires du FE-TLIF. (D, E, F) L’IRM de suivi T2WI à 6 semaines a montré une bonne décompression de la structure neurale L4-L5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Paramètres | Valeur |
| Nombre de patients | 10 |
| Âge (année) | 67,0 ± 9,27 (52 à 82) |
| Score de douleur préopératoire sur une échelle analogique visualisée | 7,2 ± 1,14 |
| Score de douleur postopératoire sur une échelle analogique visualisée | 1,3 ± 1,34 |
| Activité hors lit | Jour 1.4 ± 0.52 |
| Déambulation indépendante | Jour 2.3 ± 0.82 |
| Retrait du tube de drainage | Jour 2.6 ± 0.52 |
| Congé de l’hôpital | Jour 4.1 ± 1.60 |
| Durée de l’opération (minute) | 333.2 ± 47.25 (274 à 465) |
| Besoin de transfusion (n, %) | 1 (10%) |
| Résultat de l’exploitation selon les critères MacNab (n, %) | |
| Excellente | 6 (60%) |
| Bon | 3 (30%) |
| Juste | 1 (10%) |
| Pauvre | 0 |
| Complication | |
| Hématome épidural | 0 |
| Durotomie | 0 |
| Dommages aux racines | 0 |
| Défaut de placement de la vis | 0 |
Tableau 1 : Résultat représentatif de la bonne récupération de FE-TLIF.
Discussion
La procédure FE-TLIF n’a jamais été simple, même si les tendances actuelles en chirurgie de la colonne vertébrale continuent d’évoluer vers des approches mini-invasives17. Cette étude est parmi les premières à fournir une démonstration vidéo détaillée de la technique FE-TLIF. Zhao et coll.14 ont rapporté qu’il a fallu 25 cas pour réduire le temps d’opération et la durée du séjour à l’hôpital. Entre-temps, Ali et coll.18 ont constaté que la courbe d’apprentissage affectait principalement certaines mesures chirurgicales, mais n’avait pas d’impact sur les résultats cliniques de la discectomie endoscopique. Ces résultats démontrent que le FE-TLIF peut être appris efficacement et produire des résultats cliniques favorables avec une formation appropriée. L’auteur s’est formé auprès de plusieurs experts internationaux, a participé à de nombreux cours sur des cadavres et sur des cadavres, et a effectué plus de 500 chirurgies endoscopiques de la colonne vertébrale. Dans cette étude, nous partageons le protocole idéal pour le FE-TLIF à un seul niveau afin d’aider les débutants à surmonter la courbe d’apprentissage.
Les débutants ont souvent du mal à maîtriser la réalisation de FE-TLIF en raison des limitations de l’équipement, car les instruments chirurgicaux standard couramment utilisés dans la chirurgie de fusion traditionnelle et l’UBE-TLIF ne peuvent pas être utilisés 3,19. Plus précisément, la conception des instruments de discectomie et de préparation de la plaque d’extrémité du cartilage varie considérablement d’une marque à l’autre et dépend des préférences du chirurgien12. Pour relever ce défi, nous avons utilisé plusieurs instruments typiques des procédures TLIF conventionnelles, notamment un rasoir à plaque d’extrémité, un entonnoir et une cage non extensible en polyétheréthercétone (PEEK). Du et coll.19 ont également signalé que l’utilisation d’instruments chirurgicaux familiers peut réduire les coûts et améliorer l’efficacité opérationnelle. Certains critiques affirment que les rasoirs à disque et les grattoirs pourraient être trop agressifs et risquer de causer des blessures à la plaque d’extrémité3. L’approche présentée met l’accent sur deux points clés : premièrement, la familiarité avec les instruments renforce la sécurité procédurale ; Deuxièmement, la force manuelle et l’état de la plaque d’extrémité peuvent être soigneusement surveillés grâce à la visualisation endoscopique après chaque utilisation.
La technique de l’extérieur vers l’intérieur avec un trépan s’est avérée efficace pour la résection de l’IAP tout en préservant les os autologues. Kim et coll.10 ont comparé les techniques de l’extérieur vers l’intérieur et de l’intérieur vers l’extérieur pour l’élimination de la PAI et ont constaté que la première était plus efficace. De même, Du et al.19 ont rapporté que la tréphine visuelle permet une facetectomie partielle efficace et pratique. Bien que l’utilisation d’une perceuse endoscopique ou d’une fraise diamantée pour cette étape soit également efficace 4,6,9,10,11, ces méthodes peuvent produire moins d’os autologue pour la greffe, ce qui est un facteur critique pour réaliser la fusion radiographique 20,21. Pour cette raison, nous préconisons l’utilisation de la tréphine visuelle et de la technique de l’extérieur vers l’intérieur pour maximiser la préservation de l’os autologues. Assurez-vous qu’il n’y a pas de confusion concernant le terme technique de l’extérieur vers l’intérieur en décompression15, qui fait référence à la décompression osseuse effectuée avant l’ablation en bloc du ligamentum flavum.
La visualisation de la protection nerveuse pendant les procédures adjacentes représente une avancée critique dans le protocole FE-TLIF. Dans la technique décrite par Kim et Wu et al.7, un planeur à cage spécialisé a été utilisé après la préparation de la plaque d’extrémité, suivie d’une greffe osseuse et d’une insertion de cage guidée par fluoroscopie. Les auteurs ont affirmé que les structures neuronales étaient complètement protégées lorsqu’elles étaient correctement protégées par l’instrument spécialisé. Néanmoins, le même groupe d’étude a signalé un taux de complications de 6 % impliquant des lésions radiculaires traversantes chez 35 patients subissant une FE-TLIF. Le risque de blessure augmente dans les cas d’affaissement plus grave de l’espace discal9. Chang et al.13 ont signalé une distance moyenne de 3,3 mm entre le point d’entrée de la cage et l’emplanture transversale dans les procédures FE-TLIF, recommandant des variations dans les stratégies de planeur à cage pour relever ce défi. Dans ce protocole, un tube fonctionnel avec une longue lèvre a été utilisé pour rétracter la racine transversale ipsilatérale, maintenue fermement à la main, permettant une protection nerveuse sûre et visualisée avant l’insertion en cage.
Néanmoins, la limitation de l’équipement chirurgical existait, car certains instruments, y compris le trépan et le tube de travail pour alésoir à l’étape 3.1, ne sont disponibles que sur demande. Cependant, la plupart des autres instruments sont familiers aux chirurgiens qui ont suivi une formation postdoctorale sur la colonne vertébrale ou des cours de base sur la chirurgie endoscopique de la colonne vertébrale. De plus, il peut y avoir un biais dans l’étude, car notre série de cas, avec un nombre limité de cas, n’a pas rencontré de complications telles qu’un hématome, une lésion de la racine nerveuse, un mauvais positionnement de la vis ou un descellement. De plus, dans certains cas de laminotomie unilatérale pour décompression bilatérale, la réduction anatomique du spondylolisthésis n’est pas toujours nécessaire. La signification clinique repose sur la réussite de la décompression nerveuse, mais pas sur la réduction radiographique. Le taux de fusion lombaire radiographique pour la FE-TLIF varie de 97,5 % à 100 % lors de l’utilisation d’une combinaison de greffes osseuses autogènes et allogènes19,22. À l’instar de notre approche avec la greffe osseuse autogène et le substitut osseux artificiel, Tsai et Liu et al.23 ont rapporté un taux de fusion de 100 % pour le FE-LIF. Cependant, dans notre petite série de cas avec un nombre limité de patients, le taux de fusion n’est pas encore disponible.
En conclusion, cette étude offre de précieuses séquences vidéo éducatives détaillant chaque étape de la procédure FE-TLIF. Le protocole intègre l’utilisation de plusieurs instruments communs aux procédures TLIF conventionnelles, une technique efficace de l’extérieur vers l’intérieur avec un trépan pour la résection de l’IAP, la visualisation endoscopique pour la préparation de la plaque d’extrémité et la protection nerveuse. Avec une formation appropriée, FE-TLIF peut être appris efficacement, ce qui conduit à des résultats cliniques favorables.
Déclarations de divulgation
Tous les auteurs n’ont divulgué aucun conflit d’intérêts.
Remerciements
Un merci spécial à Louis Lai pour avoir enregistré la procédure à l’aide de son smartphone et d’un trépied. Cette étude n’a reçu aucun financement externe.
matériels
| Name | Company | Catalog Number | Comments |
| 10mm shaver | REBORN | 420-0710 | |
| 10mm trial | REBORN | 420-0610A | |
| 11mm shaver | REBORN | 420-0711 | |
| 11mm trial | REBORN | 420-0611A | |
| 12mm shaver | REBORN | 420-0712 | |
| 12mm trial | REBORN | 420-0612A | |
| 13mm shaver | REBORN | 420-0713 | |
| 13mm trial | REBORN | 420-0613A | |
| 14mm shaver | REBORN | 420-0714 | |
| 14mm trial | REBORN | 420-0614A | |
| 8mm shaver | REBORN | 420-0708 | |
| 8mm trial | REBORN | 420-0608A | |
| 9mm shaver | REBORN | 420-0709 | |
| 9mm trial | REBORN | 420-0609A | |
| Biopsy Forceps, Blakesley | JOIMAX | BFS323061 | WL 320 mm / OD 3.5 mm / JL 6.0 mm |
| Biopsy Forceps, Spoon | JOIMAX | THF322541 | WL 320 mm / OD 2.5 mm / JL 4.0 mm |
| Biopsy Forceps, Spoon, angled | JOIMAX | THF322041 | WL 320 mm / OD 2.0 mm / JL 4.0 mm / 45° |
| Bone graft impactor | REBORN | 410-1216 | |
| Dissector | JOIMAX | JDA273515 | WL 275 mm / OD 3.5 mm |
| Dissector, angled | JOIMAX | ON REQUEST | WL 280 mm / OD 3.5 mm / 40° |
| Distractor 10mm | REBORN | 420-1610 | |
| Distractor 11mm | REBORN | 420-1611 | |
| Distractor 12mm | REBORN | 420-1612 | |
| Distractor 13mm | REBORN | 420-1613 | |
| Distractor 14mm | REBORN | 420-1614 | |
| Distractor 8mm | REBORN | 420-1608 | |
| Distractor 9mm | REBORN | 420-1609 | |
| Endo-Flexprobe | JOIMAX | TEFP32020 | L 320 mm / OD 2.0 mm |
| Endo-Flexprobe Handle | JOIMAX | TEFH45025 | L 450 mm / OD 2.5 mm |
| Endo-Kerrison-Pistol Handle | JOIMAX | EKH550000 | OD 5.5 mm |
| Endo-Kerrison-Shaft | JOIMAX | EKS24551540 | WL 240 mm / OD 5.5 mm / F 1.5 mm / 40° |
| Endo-Kerrison-Shaft | JOIMAX | EKS24553040 | WL 240 mm / OD 5.5 mm / F 3.0 mm / 40° |
| Funnel for bone graft | REBORN | 410-1215 | |
| Grasper Forceps | JOIMAX | THG323555 | WL 320 mm / OD 3.5 mm / JL 5.5 mm |
| Guiding Rod, conical | JOIMAX | GRD226315 | L 225 mm / OD 6.3 mm |
| Guiding Tube, conical, red | JOIMAX | GTC177010 | L 165 mm / ID 7 mm / OD 10 mm |
| Guiding Tube, conical, violet | JOIMAX | GTC151510 | L 175 mm / ID 10 mm / OD 15 mm |
| Hook Scissor | JOIMAX | JHS243545 | WL 240 mm / OD 3.5 mm / JL 4.5 mm |
| Laminoscope | JOIMAX | LS1006125O | WL 125 mm / OD 10.0 mm / 15° / WChD 6.0 mm / 2x IC 2.0 mm |
| Lumbar implant impactor | REBORN | 420-3303 | |
| Nerve Hook | JOIMAX | TNH322533 | L 320 mm / OD 2.5 mm / JL 3.3 mm |
| Osteotome | JOIMAX | ON REQUEST | WL 260 mm / OD 5.5 mm |
| Peek lumbar 11#-14# implant driver | REBORN | 420-1715 | |
| Peek lumbar 8#-10# implant driver | REBORN | 420-1714 | |
| Reamer Push-Ejector | JOIMAX | RPE280600 | L 280 mm / OD 6.0 mm |
| Semi-Flexible Grasper Forceps, curved, up-biting | JOIMAX | TFG322522U | WL 320 mm / OD 2.5 mm / Helix |
| Slap hammer | REBORN | 420-0401B | |
| T-handle | REBORN | 460-0101A | |
| Working Reamer Tube, put endoscope into for trephining | JOIMAX | ON REQUEST | L 125 mm / ID 10.2 mm / OD 11.2 mm |
| Working Tube with Handle | JOIMAX | ON REQUEST | L 125 mm / ID 10.2 mm / OD 11.2 mm |
| Working Tube with Handle, long Lip | JOIMAX | WTS121602 | L 132 mm / ID 15 mm / OD 16 mm |
| Working Tube, use with reamer | JOIMAX | ON REQUEST | L 120 mm / ID 11.5 mm / OD 12.5 mm |
Références
- Ricart, P. H., Gandhi, S. D., Geisinger, J., Baker, K., Park, D. K. Clinical and ct analysis of lumbar spine arthrodesis: Beta-tricalcium phosphate versus demineralized bone matrix. J Am Acad Orthop Surg Glob Res Rev. 2 (9), e024(2018).
- Pholprajug, P., Kotheeranurak, V., Liu, Y., Kim, J. S. The endoscopic lumbar interbody fusion: A narrative review, and future perspective. Neurospine. 20 (4), 1224-1245 (2023).
- Pao, J. L. Biportal endoscopic transforaminal lumbar interbody fusion using double cages: Surgical techniques and treatment outcomes. Neurospine. 20 (1), 80-91 (2023).
- Nakajima, Y., Dezawa, A., Lim, K. T., Wu, P. H. Full-endoscopic posterior lumbar interbody fusion: A review and technical note. World Neurosurg. 189, 418-427.e3 (2024).
- Heo, D. H., Lee, D. C., Kim, H. S., Park, C. K., Chung, H. Clinical results and complications of endoscopic lumbar interbody fusion for lumbar degenerative disease: A meta-analysis. World Neurosurg. 145, 396-404 (2021).
- Kim, H. S., Wu, P. H., Sairyo, K., Jang, I. T. A narrative review of uniportal endoscopic lumbar interbody fusion: Comparison of uniportal facet-preserving trans-kambin endoscopic fusion and uniportal facet-sacrificing posterolateral transforaminal lumbar interbody fusion. Int J Spine Surg. 15 (suppl 3), S72-S83 (2021).
- Kim, H. S., Wu, P. H., Jang, I. T. Technical note on uniportal full endoscopic posterolateral approach transforaminal lumbar interbody fusion with reduction for grade 2 spondylolisthesis. Interdiscipl Neurosurg. 21, 100712(2020).
- Park, M. K., Park, S. A., Son, S. K., Park, W. W., Choi, S. H. Clinical and radiological outcomes of unilateral biportal endoscopic lumbar interbody fusion (ulif) compared with conventional posterior lumbar interbody fusion (plif): 1-year follow-up. Neurosurg Rev. 42 (3), 753-761 (2019).
- Wu, P. H., et al. Uniportal full endoscopic posterolateral transforaminal lumbar interbody fusion with endoscopic disc drilling preparation technique for symptomatic foraminal stenosis secondary to severe collapsed disc space: A clinical and computer tomographic study with technical note. Brain Sci. 10 (6), 373(2020).
- Kim, H. S., et al. Evaluation of two methods (inside-out/outside-in) inferior articular process resection for uniportal full endoscopic posterolateral transforaminal lumbar interbody fusion: Technical note. Brain Sci. 11 (9), 1169(2021).
- Wu, P. H., et al. Prospective cohort study with a 2-year follow-up of clinical results, fusion rate, and muscle bulk for uniportal full endoscopic posterolateral transforaminal lumbar interbody fusion. Asian Spine J. 17 (2), 373-381 (2023).
- Chien, K. T., et al. Optimizing disc and cartilage endplate preparation in full-endoscopic lumbar interbody fusion: An in-depth exploration of surgical instruments with a technique note and narrative review. World Neurosurg. 189, 228-247 (2024).
- Hsu, Y. C., et al. How to prevent nerve root injury in uniportal full endoscopic lumbar fusion surgery? Insights from a cadaveric anatomic study with simulation surgery. Spine. 49 (18), 1301-1310 (2024).
- Zhao, T., Dai, Z., Zhang, J., Huang, Y., Shao, H. Determining the learning curve for percutaneous endoscopic lumbar interbody fusion for lumbar degenerative diseases. J Ortho Surg Res. 18 (1), 193(2023).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar endoscopic unilateral laminotomy for bilateral decompression outside-in approach: A proctorship guideline with 12 steps of effectiveness and safety. Neurospine. 17 (Suppl 1), S99-S109 (2020).
- Macnab, I. Negative disc exploration. An analysis of the causes of nerve-root involvement in sixty-eight patients. J Bone Joint Surg Am. 53 (5), 891-903 (1971).
- Antonacci, C. L., et al. A narrative review of endoscopic spine surgery: History, indications, uses, and future directions. J Spine Surg. 10 (2), 295-304 (2024).
- Ali, R., et al. Impact of the learning curve of percutaneous endoscopic lumbar discectomy on clinical outcomes: A systematic review. Interdiscip Neurosurg. 32, 101738(2023).
- Du, Y., et al. Full endoscopic posterolateral transarticular lumbar interbody fusion using transparent plastic working tubes: Technical note and preliminary clinical results. Front Surg. 9, 884794(2022).
- Ito, Z., et al. Bone union rate with autologous iliac bone versus local bone graft in posterior lumbar interbody fusion (plif): A multicenter study. Eur Spine J. 22 (5), 1158-1163 (2013).
- Yoo, J. S., Min, S. H., Yoon, S. H. Fusion rate according to mixture ratio and volumes of bone graft in minimally invasive transforaminal lumbar interbody fusion: Minimum 2-year follow-up. Eur J Orthop Surg Traumatol. 25 (Suppl 1), S183-S189 (2015).
- Wang, J. C., Cao, Z., Li, Z. Z., Zhao, H. L., Hou, S. X. Full-endoscopic lumbar interbody fusion versus minimally invasive transforaminal lumbar interbody fusion with a tubular retractor system: A retrospective controlled study. World Neurosurg. 165, e457-e468 (2022).
- Tsai, P. C., et al. The novel kambin torpedo full-endoscopic lumbar interbody fusion technique: A case series. Eur Spine J. 33 (2), 417-428 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon