Case Report
Uniportale vollendoskopische posterolaterale transforaminale lumbale interkorporelle Fusion
In diesem Artikel
Zusammenfassung
Das Protokoll bietet eine wertvolle Methode, die jeden Schritt des FE-TLIF-Verfahrens detailliert beschreibt. Mit der richtigen Ausbildung kann FE-TLIF effektiv erlernt werden, was zu günstigen klinischen Ergebnissen führt.
Zusammenfassung
Die uniportale vollendoskopische posterolaterale lumbale interkorporelle Fusion (FE-TLIF) hat kürzlich vielversprechende Ergebnisse gezeigt. Anfänger können jedoch vor Herausforderungen stehen, wenn es darum geht, die technischen Fähigkeiten zu beherrschen, die erforderlich sind, um die Lernkurve für ein effizienteres und sichereres Verfahren zu überwinden. Das Ziel dieser Studie ist es, ein detailliertes FE-TLIF-Verfahren bereitzustellen und eine Schritt-für-Schritt-Erklärung aller Methoden zu liefern sowie in schriftlichem Text die wichtigsten Techniken und Vorsichtsmaßnahmen zu beschreiben, um ein sichereres und effizienteres Verfahren zu gewährleisten. Wir stellen einen Fall von degenerativer Spondylolisthesis L4-L5 mit Spinalkanalstenose-Syndrom und rechtem Ischias vor. Die Studie bietet wertvolles Lehrvideomaterial, das jeden Schritt des FE-TLIF-Verfahrens detailliert beschreibt. Das Protokoll beinhaltet die Verwendung mehrerer Instrumente, die für herkömmliche TLIF-Verfahren üblich sind, eine effiziente Outside-In-Technik mit einem Trepan für die IAP-Resektion, eine endoskopische Visualisierung für die Endplattenvorbereitung und einen Nervenschutz. Mit der richtigen Ausbildung kann FE-TLIF effektiv erlernt werden, was zu günstigen klinischen Ergebnissen führt und gleichzeitig Komplikationen minimiert.
Einleitung
Die lumbale Fusion gilt als Standardbehandlung für verschiedene degenerative Erkrankungen der Lendenwirbelsäule1. Mit der zunehmenden Prävalenz der minimal-invasiven Wirbelsäulenchirurgie haben Fortschritte bei endoskopischen Techniken und Instrumenten die Indikationen für die endoskopische Wirbelsäulenchirurgie erweitert2. Die endoskopisch-assistierte Fusion hat in jüngster Zeit vielversprechende Ergebnisse gezeigt, darunter eine schnellere Genesung, einen geringeren Blutverlust und eine Minimierung von Rückenmuskelverletzungen 3,4,5. Im Vergleich zur facettenerhaltenden endoskopischen trans-Kambin-Fusion hat die facettenopfernde posterolaterale transforaminale lumbale interkorporelle Fusion (TLIF) den Vorteil eines relativ vertrauten Korridors als minimal-invasiver tubulärer Zugangs-TLIF (MIS-TLIF), einer direkten Visualisierung während der spinalen Dekompression und weniger austretender Nervenwurzelverletzungen6.
Die uniportale vollendoskopische posterolaterale transforaminale lumbale interkorporelle Fusion (FE-TLIF) unterscheidet sich in Operationstechnik und Instrument signifikant von der unilateralen biportalen endoskopiegestützten TLIF (UBE-TLIF)3,6,7. Obwohl beide endoskopischen Fusionstechniken ähnlich günstige früh- und mittelfristige postoperative Ergebnisse gezeigt haben 5,8, ist die Lernkurve für FE-TLIF steiler. Anfänger können vor Herausforderungen stehen, wenn es darum geht, die technischen Fähigkeiten zu beherrschen, die erforderlich sind, um die Lernkurve für ein effizienteres und sichereres Verfahren zu überwinden4.
Das unten skizzierte Protokoll von FE-TLIF enthält Techniken, die von der Kim- und Wu-Gruppe 6,7,9,10,11 mit einigen Modifikationen beschrieben wurden. Neben der Verwendung kleinerer endoskopischer Geräte mit einem längeren Hebelarm7 stellt das Verfahren Herausforderungen dar, wie z. B. Einschränkungen der Ausrüstung, insbesondere bei Instrumenten für die Diskektomie und die Knorpelendplattenpräparation12, sowie das Fehlen eines sichtbaren Nervenschutzes bei der Verwendung spezieller Käfiggleiter bei benachbarten Eingriffen, was das Risiko einer Nervenwurzelverletzungerhöht 13. Wu et al.11 berichteten über eine Komplikationsrate von 6% bei 35 Patienten, die sich einer FE-TLIF unterzogen, selbst in den Händen erfahrener Chirurgen. Umgekehrt beobachteten Zhao et al.14 eine Revisionsrate von 9,6 % im ersten Drittel der behandelten Patienten, zusammen mit einer signifikant erhöhten Röntgenexpositionszeit während der Lernkurve.
Um diese Herausforderungen zu meistern, haben wir in das Protokoll die Verwendung mehrerer Instrumente aufgenommen, die für herkömmliche TLIF-Verfahren üblich sind: die endoskopische Visualisierung zum Nervenschutz während der Endplattenvorbereitung und das Einsetzen des Käfigs. Die Vorteile gegenüberden oben genannten anwendbaren Referenzen 7,11,14 waren zweifach: Erstens erhöht die Vertrautheit mit Instrumenten wie einem Endplattenrasierer, einem Trichter und einem nicht erweiterbaren Standard-TLIF-Käfig die Verfahrenssicherheit; Und zweitens sorgt ein visualisierter Nervenschutz dafür, dass neuronale Strukturen richtig abgeschirmt werden.
Der Zweck dieser Studie besteht darin, das FE-TLIF-Verfahren auf Video aufzuzeichnen und eine Schritt-für-Schritt-Erklärung mit Videoclips zu liefern sowie in schriftlichem Text die wichtigsten Techniken und Vorsichtsmaßnahmen zu beschreiben, um ein sichereres und effizienteres Verfahren zu gewährleisten.
FALL-PRÄSENTATION:
Wir stellen einen 68-jährigen Mann mit Schmerzen im unteren Rückenbereich, Schmerzen in der rechten Wade und Schwierigkeiten beim Gehen vor. Zu den assoziierten Symptomen gehörten Taubheit des rechten L5-Territoriums und Claudicatio intermittens. Die Bildgebung ergab eine degenerative Spondylolisthesis L4-L5 mit Spinalkanalstenose-Syndrom (Abbildung 1). Nach einer ausführlichen Diskussion wurde der Patient für eine rechtsseitige transforaminale lumbale interkorporale interkorporale Fusion (FE-TLIF) mit einem uniportalen L4-L5 geplant.
Protokoll
Diese Studie (Ref.-Nr. 202500125B0) wurde vom institutionellen Prüfungsausschuss der Chang Gung Medical Foundation, Taiwan, genehmigt und eine entsprechende Einwilligungserklärung eingeholt.
1. Lagerung, Hautmarkierung und Patientenvorbereitung
- Patientenposition: Nach der Vollnarkose legen Sie den Patienten bauch auf einen Wilson-Rahmen mit leichter Beugung, um eine bessere Dekompressionseffizienz zu erzielen.
- Führen Sie eine fluoroskopiegesteuerte Hautmarkierung wie unten beschrieben durch.
- Markieren Sie den rechten transpedikulären Schraubeneintrittspunkt L4 neben dem rechten Isthmus in der AP-Ansicht als endoskopisches Arbeitsportal.
HINWEIS: Der traditionelle transpedikuläre Schraubeneintritt befindet sich in der anteroposterioren fluoroskopischen Ansicht normalerweise in der Nähe des L4-Pedikelauges. Der modifizierte, stärker medial und kaudal positionierte Einstieg ermöglicht einen besseren Zugang zur kontralateralen Dekompression bzw. Bandscheibenpräparation. - Markieren Sie die anderen drei transpedikulären Schraubeneintrittspunkte als übliche Region, die in der anteroposterioren Fluoroskopieansicht neben dem bilateralen Pedikelauge L4 und L5 liegen.
- Markieren Sie den rechten transpedikulären Schraubeneintrittspunkt L4 neben dem rechten Isthmus in der AP-Ansicht als endoskopisches Arbeitsportal.
- Führen Sie die Operationsvorbereitung wie unten beschrieben durch.
- Führen Sie eine Desinfektion mit Povidon-Jod von der hinteren Mitte bis zum Gesäß durch.
- Drapieren Sie das Operationsfeld aseptisch. Bereiten Sie das Operationsfeld mit einem Damm und einem Wasserbeutel vor, die für den Wasserabfluss in der endoskopischen Operation benötigt werden. Positionieren Sie den Wasserbeutel als Spülbeutel auf der Seite des quadratischen Operationsfeldes, die dem Chirurgen am nächsten ist. Heben Sie die anderen drei Seiten mit einem chirurgischen Tuch an, um einen Damm zu schaffen, damit Wasser in den Beutel fließen kann. Sichern Sie abschließend das Setup mit einem wasserdichten antimikrobiellen Inzisionstuch.
- Stellen Sie die Instrumente und den normalen Kochsalzbeutel etwa 2 m über dem Kopf auf, um den Schwerkraftfluss zu ermöglichen. Zu den Instrumenten gehören: Ein Endoskop, das mit einem Kamerasystem verbunden ist, ein Glasfaserkabel und ein Spülschlauch, ein endoskopischer Fräser, ein endoskopischer Radiofrequenz-Ablator. Befestigen Sie diese Instrumente mit Klammern sicher am Abdecktuch, um eine gute Bewegungsfreiheit zu ermöglichen.
2. Schaffung von Arbeitsplätzen und Identifizierung von Orientierungspunkten
- Richten Sie das endoskopische Arbeitsportal wie unten beschrieben ein.
- Schaffen Sie ein endoskopisches Portal, indem Sie an der ersten Markierung in Schritt 1.2 einen 1,2 cm langen Längsschnitt mit dem Skalpell und darunter einen breiteren Faszienschnitt vornehmen. Die Faszie ist die erste feste Schicht, die sich direkt unter dem Unterhautgewebe befindet. Machen Sie mit einem Skalpell mit einer Gesamtlänge von 2,5-3,0 cm einen kranialen und kaudalen Schnitt in die Faszie.
- Docken Sie den Obturator an der rechten L4-Isthmusregion an, indem Sie die Durchleuchtung überprüfen. Verwenden Sie den Obturator, um den Knochen zu berühren und seine Position mit fluoroskopischer Bildgebung zu bestätigen.
- Setzen Sie serielle Dilatatoren und schließlich das offene Schrägarbeitsrohr (11,2 mm Außendurchmesser / 10,2 mm Innendurchmesser; Abbildung 2A). Führen Sie die Dilatatoren ein, während Sie den ruhig gehaltenen Obturator als Führung verwenden. Im Zweifelsfall positionieren Sie den Obturator neu, um den Knochen wieder zu berühren, und überprüfen Sie die Position durch Durchleuchtung.
- Um Orientierungspunkte zu finden, führen Sie ein 15° abgewinkeltes Endoskop (10 mm Außendurchmesser) ein. Präparieren Sie Weichgewebe mit einem Radiofrequenz-Ablator, um den Raum um die rechte L4/L5-Facette freizugeben, und identifizieren Sie die Punkte7 von Wu und Kim mit fluoroskopischen Bildern (Abbildung 2B-C). Verwenden Sie Grat, um eine knöcherne Oberfläche als Orientierungspunkt zu erzeugen, nachdem Sie die Position durch Fluoroskopie überprüft haben, um Orientierungslosigkeit zu vermeiden.
3. Ipsilaterale Dekompression
- Entfernung des inferioren Gelenkprozesses (IAP): Verwenden Sie die Outside-In-Technik10 , um IAP effizient von Wus Punkt zu Kims Punkt mit einem Trephin und Osteotom zu entfernen. Wenn das IAP-Knochenstück im Trepan oder aus dem Osteotom gebrochen ist, bewahren Sie das Stück als Autotransplantat auf.
- Tauschen Sie das Arbeitsrohr gegen ein größeres für die Reibahle aus (12,5 mm Außendurchmesser / 11,5 mm Innendurchmesser) und schieben Sie den Mantel des Arbeitsrohrs zur Stabilisierung in den Gelenkspalt vor, wenn Sie das Trephin verwenden, um den unteren Gelenkfortsatz zu entfernen. Drehen Sie den Trepan vorsichtig, während Sie mit der anderen Hand das Arbeitsrohr ruhig halten. Wenn das IAP-Knochenstück im Trepan gebrochen ist, dreht sich der Knochen während der Trepanrotation.
- Entfernen Sie die verbleibende IAP mit einem endoskopischen Osteotom. Bewahren Sie das Knochenstück als Autotransplantat auf.
- Führen Sie eine Dura-Dekompression und eine ipsilaterale Flavonektomie wie unten beschrieben durch.
- Identifizieren Sie den Ursprung und die Insertion des ipsilateralen Ligamentum flavum, indem Sie die kaudale Lamina des rechten L4, die kraniale Lamina des rechten L5 und die mediale Basis des oberen Gelenkfortsatzes (SAP) entfernen. Verwenden Sie entweder einen 4-mm-Hochgeschwindigkeits-Diamantfräser oder Kerrison Rongeur.
HINWEIS: Anstelle einer Outside-In-Technik verwenden wir bei der Dekompression15 eine Inside-Out-Technik und verwenden die neuronale Struktur als anatomische Referenz für die Dekompression. - Das ipsilaterale Ligamentum flavum Stück für Stück entfernen, um die rechte L5-Querwurzel und die Foraminalscheibe mit endoskopischer Hypophyse oder Kerrison-Rongeur freizulegen.
- Identifizieren Sie den Ursprung und die Insertion des ipsilateralen Ligamentum flavum, indem Sie die kaudale Lamina des rechten L4, die kraniale Lamina des rechten L5 und die mediale Basis des oberen Gelenkfortsatzes (SAP) entfernen. Verwenden Sie entweder einen 4-mm-Hochgeschwindigkeits-Diamantfräser oder Kerrison Rongeur.
4. Kontralaterale Dekompression
- Over-the-Top-Technik: Entfernen Sie die dornige Prozessbasis, bis die kontralaterale Schädellamina, die Schwanzlamina und die kontralaterale Facette sichtbar sind.
- Dura-Dekompression und kontralaterale Lavektomie: Entfernen Sie den Ursprung und die Insertion des kontralateralen Ligamentum flavum. Entfernen Sie die kontralaterale mediale Basis des SAP, um die linke L5-Querwurzel freizugeben.
- Die Identifizierung dieser Strukturen ist der wichtigste Schritt. Entfernen Sie die kraniale und kaudale Lamina, bis der Ursprung und der Ansatz des kontralateralen Ligamentum flavum deutlich sichtbar sind. Extrahieren Sie das befreite Ligamentum flavum vorsichtig Stück für Stück entweder mit einem endoskopischen Hypophysenrongeur oder einem Kerrison-Rongeur, bis die Dura freigelegt ist.
- Der laterale Teil des Ligamentum flavum erstreckt sich unterhalb der medialen Basis des SAP. Entfernen Sie die mediale Basis des SAP, während der äußerste Teil des Ligamentum flavum erhalten bleibt, um die kontralaterale traversierende Wurzel zu schützen, die lateral der Dura liegt. Zum Schluss wird das gesamte kontralaterale Ligamentum flavum entfernt. Weitere anatomische Details finden Sie im Video.
5. Scheibenplatzfreigabe und Vorbereitung der Endplatte
- Stellen Sie sicher, dass genügend Platz für den kraniokaudalen Käfig vorhanden ist, indem Sie die Schädelspitze des oberen Gelenkfortsatzes mit einem Osteotom bis zum Schädelrand des Stiels entfernen. Stellen Sie sicher, dass genügend mediolateraler Raum vorhanden ist, indem Sie den Epiduralraum in der Nähe der rechten L5-Querwurzel freigeben.
- Führen Sie eine endoskopische Diskektomie durch, indem Sie den Wurzelschutz wie unten beschrieben durchlaufen.
- Ziehen Sie das Original-Arbeitsrohr heraus und wechseln Sie zu einem größeren Arbeitsrohr mit Griff und langer Lippe (16 mm Außendurchmesser/ 15 mm Innendurchmesser). Verwenden Sie den Dissektor, um die rechte L5-Querwurzel zu schützen, und drehen Sie die lange Spitze vorsichtig, um die traversierende Nervenwurzel zurückzuziehen.
- Führen Sie die Anulotomie mit einer Hakenschere an der geplanten Käfigeintrittsstelle durch. Setzen Sie Endplattenrasierer in Reihe nach dem herkömmlichen transforaminalen lumbalen interkorporellen Fusionsverfahren ein. Stellen Sie das Fluoroskop auf laterale Projektion um, um die Position des Endplattenrasierers zu überwachen (Abbildung 3A).
- Halten Sie den Arbeitsschlauch ruhig, um sicherzustellen, dass die neuronalen Strukturen unter endoskopischer Visualisierung sicher geschützt sind. Ziehen Sie das Endoskop heraus, um den Endplattenrasierer passieren zu lassen. Wenn Sie jeden Endplattenrasierer herausnehmen, lösen Sie die Nervenwurzel, indem Sie die lange Lippe drehen. Verwenden Sie das Endoskop, um das Bandscheibenmaterial zu untersuchen und den Zustand des Nervs zu beurteilen.
- Entfernen von Bandscheibenmaterial und Knorpel durch Hypophysenklemme durch direkte Visualisierung.
- Führen Sie das Einsetzen des Versuchskäfigs wie unten beschrieben durch.
- Nach der Präparation der gewünschten Endplatte mit punktueller Blutung des subchondralen Knochens wird der Cage trial seriell eingesetzt, um die Cagegröße zu bestimmen und gleichzeitig die L5-traversierende Wurzel zu schützen.
- Bestimmen Sie die ideale Käfighöhe mit seriellen Käfigversuchen in Schritten von 1 mm ab 8 mm (Abbildung 3B). Die ideale Käfiggröße kann basierend auf der Spannung, die zum Bewegen des Käfigversuchs erforderlich ist, der Knochenqualität und der Scheibenhöhe der angrenzenden Ebenen bestimmt werden. Verwenden Sie beim Entfernen jedes Käfigversuchs einen Schlaghammer, um mit einer Hand eine Axialkraft auszuüben, wobei Sie vorsichtig Stöße auf das Arbeitsrohr vermeiden sollten, das mit der anderen Hand ruhig gehalten werden sollte.
6. Interkorporale Fusion mit Knochentransplantat und -käfig
- Knochentransplantation: Halten Sie den Arbeitsschlauch ruhig und ziehen Sie das Endoskop heraus, um den Durchgang des Knochentransplantiertrichters in den Bandscheibenraum zu ermöglichen. Bestätigen Sie mit einem trichterförmigen Knochentransplantationsgerät die ideale Platzierung im Bandscheibenraum fluoroskopisch (Abbildung 3C). Setzen Sie ein autologe Knochentransplantat ein, gefolgt von einem künstlichen Knochenersatz in der Folge.
- Halten Sie den Arbeitsschlauch ruhig, um sicherzustellen, dass die neuronalen Strukturen unter endoskopischer Visualisierung sicher geschützt sind. Ziehen Sie das Endoskop heraus, um das trichterförmige Knochentransplantatgerät passieren zu lassen, und positionieren Sie es im Bandscheibenraum. Die optimale Tiefe liegt zwischen dem vorderen Drittel und der Hälfte des L5-Wirbelkörpers.
HINWEIS: Knochentransplantatmaterial kann durch den Trichter eingeführt und mit einem Knochentransplantatimpaktor in den vorderen Bandscheibenraum eingebracht werden. Bei diesem Verfahren wurden 2,5 cm³ künstliches Knochenersatzmaterial aus demineralisiertem Knochenmatrixspachtel verwendet. Das Volumen autologer Lamina-Späne wird nicht routinemäßig gemessen. In der Regel sind jedoch mehrere Runden der Trichterimpaktion erforderlich, um die volle Menge an Knochentransplantat einzusetzen.
- Halten Sie den Arbeitsschlauch ruhig, um sicherzustellen, dass die neuronalen Strukturen unter endoskopischer Visualisierung sicher geschützt sind. Ziehen Sie das Endoskop heraus, um das trichterförmige Knochentransplantatgerät passieren zu lassen, und positionieren Sie es im Bandscheibenraum. Die optimale Tiefe liegt zwischen dem vorderen Drittel und der Hälfte des L5-Wirbelkörpers.
- Setzen Sie den TLIF-Käfig wie unten beschrieben ein.
- Setzen Sie einen konventionellen Zwischenwirbel-Fusionskäfig (TLIF-Käfig, kugelförmig, 26 mm lang, PEEK) ein. Halten Sie den Arbeitsschlauch ruhig, um sicherzustellen, dass die neuronalen Strukturen unter endoskopischer Visualisierung sicher geschützt sind. Ziehen Sie das Endoskop heraus, um den Käfig passieren zu lassen. Wenn der Cage in den hinteren Bandscheibenraum eingerastet wird, überprüfen Sie die Position und Achse durch ein laterales Durchleuchtungsbild, um eine Gefährdung der neuralen Struktur und der Endplatte zu vermeiden.
- Überprüfen Sie die Position des Käfigs durch Durchleuchtung (Abbildung 3D). Die optimale Position befindet sich zentriert innerhalb des Disc-Raums. Stellen Sie in der Seitenansicht sicher, dass der hintere Marker des Käfigs vor der hinteren Wirbelkörperlinie positioniert ist, während in der anteroposterioren Ansicht der vordere Marker mit dem Dornfortsatz ausgerichtet ist.
7. Abschließende Kontrolle
- Verwenden Sie die Endoskopie nach dem Einsetzen des Käfigs erneut, um eine adäquate Dura- und Wurzeldekompression zu erzielen (Abbildung 4A-C). Untersuchen und entfernen Sie befreites Bandscheibengewebe oder Blutgerinnsel. Schließen Sie den Wasserzufluss, um die Ausdehnung und Pulsation der Dura und der Wurzel zu überprüfen.
- Stoppen Sie die Blutung durch spongiöse Knochen- und Epiduralgefäße. Untersuchen Sie jeden Blutungspunkt und stoppen Sie ihn mit einem Radiofrequenz-Ablator. Schließen Sie den Wasserzulauf, um nach übermäßigen Blutungen zu suchen. Bei Bedarf kann ein Blutstillungsmittel verwendet werden.
8. Anwendung von Pedikelschrauben und -stäben
- Führen Sie perkutane Pedikelschrauben unter Durchleuchtung ein. Reduzieren Sie die Beugung des Wilson-Rahmens, um die Lordose des Patienten durch zirkulierende Krankenschwester wiederherzustellen. Setzen Sie bilaterale perkutane Pedikelschrauben L4 und L5 mit einer typischen Technik ein (Abbildung 5A-B).
- Verwenden Sie die kanülierte Nadel, um einen K-Draht einzuführen. Lassen Sie den K-Draht an Ort und Stelle, sobald die kanülierte Nadel entfernt wurde. Platzieren Sie die kanülierte Pedikelschraube über dem k-Draht, sobald sich das Weichgewebe erweitert hat. Um die Hautspannung im relativen kaudalen und medialen Hautschnitt oder rechten L4-Zugang zu überwinden, legen Sie einen subkutanen Tunnel und einen weiteren Faszienzugang aus dem ursprünglichen Hautschnitt an.
- Ziehen Sie den Stab fest und reduzieren Sie die Spondylolisthesis. Legen Sie den Stab perkutan an an und setzen Sie zuerst die distalen Schrauben ein. Bei der ipsilateralen Schraubenkompression ziehen Sie zuerst die distalen Schrauben und dann die proximalen Schrauben zur Stabreduktion der Spondylolisthesis fest (Abbildung 5C-D). Führen Sie die Schraubenkompression manuell durch. Es können auch spezielle Instrumente für das perkutane Schraubensystem verwendet werden.
9. Verschließen Sie die Haut in Schichten mit eingelegtem Abfluss
- Führen Sie einen Hämovac-Drainageschlauch mit der Spitze in den Käfigbereich ein (Abbildung 4D). Verschließen Sie die Haut in Schichten. Vernähen Sie die Faszie mit Nr. 1 Vicryl und die Unterhautschicht mit 2-0 und 3-0 Vicryl. Fixieren Sie den Drainageschlauch mit einer 2-0 Vicryl-Naht auf der Haut.
Ergebnisse
Von September 2024 bis März 2025 wurde bei insgesamt 10 Patienten in unserer Klinik eine degenerative Spondylolisthesis L4-L5 mit Spinalkanalstenose diagnostiziert und operiert. Die Kohorte umfasste fünf Männer und fünf Frauen mit einem Durchschnittsalter von 67,0 ± 9,27 Jahren (Spanne: 52–82). Die durchschnittliche Operationszeit betrug 333,2 ± 47,25 min (Bereich: 274–424). Postoperativ berichteten die Patienten über eine signifikante Verbesserung sowohl der Rücken- als auch der Beinschmerzen auf einer visuellen Analogskala (0-10) von 7,2 ± 1,14 auf 1,3 ± 1,34. Sie waren in der Lage, am postoperativen Tag 1,4 ± 0,52 auf der Station zu sitzen und zu stehen und begannen an Tag 2,3 ± 0,82 mit einer Taylor-Orthese selbstständig zu gehen. Der Drainageschlauch wurde an Tag 2,6 ± 0,52 entfernt, und die Patienten wurden an Tag 4,1 ± 1,60 entlassen. Nach den MacNab-Kriterien16 hatten sechs Patienten (60 %) hervorragende Ergebnisse, der dritte (30 %) ein gutes Ergebnis und einer (10 %) ein faires Ergebnis. Es gab keine Komplikationen wie Nervenverletzungen, epidurale Hämatome und Schraubenfehlstellungen (Tabelle 1). Abbildung 6 zeigt die postoperativen Röntgenaufnahmen des vorgestellten Falles, die 2 Tage nach der Operation aufgenommen wurden, und MRT-Bilder nach 6 Wochen, die die Wirksamkeit des beschriebenen Protokolls demonstrieren.

Abbildung 1: Operative Bilder des Patienten. (A) Asymmetrische Bandscheibenraumverengung von L4-L5. (B, C) L4-L5 degenerative Spondylolisthesis mit dynamischem Gleiten. (D, E, F) MRT T2WI zeigte eine Spondylolisthesis L4-L5 mit Spinalkanalstenose, Schizas Grad C. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
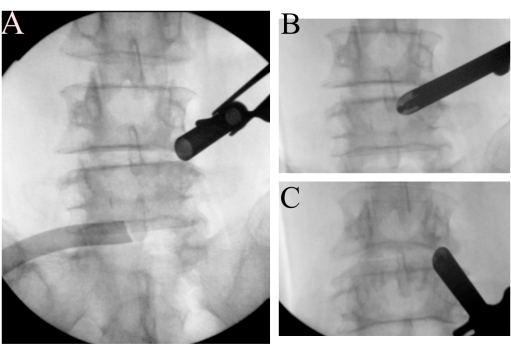
Abbildung 2: Identifizierung von Landmarken. (A) Das offene abgeschrägte Arbeitsrohr dockt an der rechten L4-Isthmusregion an. (B) Identifizierung von Wus Standpunkt und (C) Kims Standpunkt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
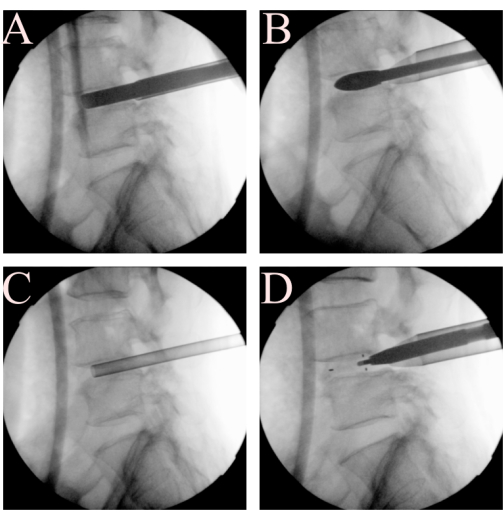
Abbildung 3: Verfahren für Scheibe und Endplatte. Während des Schritts der Freigabe des Bandscheibenraums, der Vorbereitung der Endplatte, der Verwendung von (A) Endplattenrasierer, (B) dem Käfigversuch, (C) dem Trichter für die Knochentransplantation und (D) dem TLIF-Käfig. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
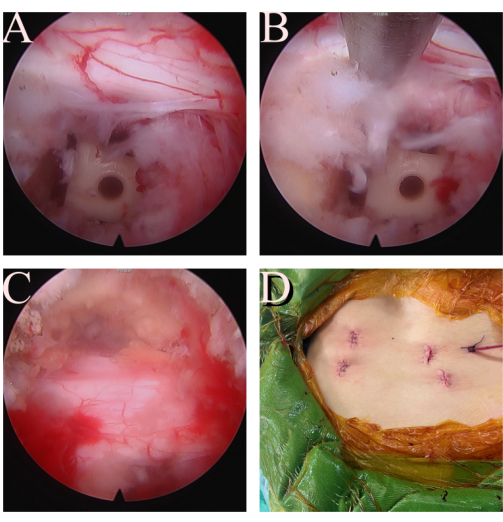
Abbildung 4: Abschließende Kontrolle. (A, B) Die ipsilaterale Querwurzel L5 ist intakt und gut dekomprimiert. (C) Die Dura und die kontralaterale L5-Querwurzel werden ebenfalls befreit. (D) Inzision und Wunde des FE-TLIF-Verfahrens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
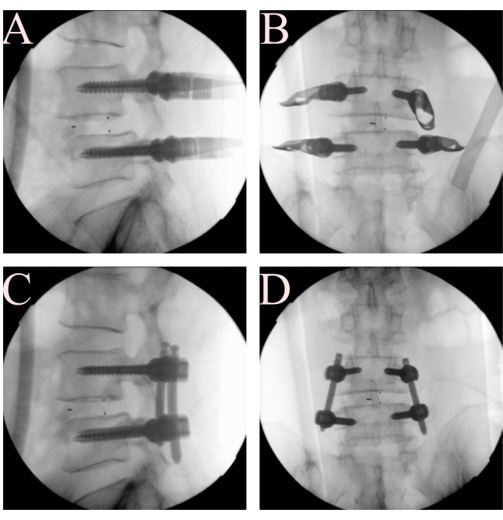
Abbildung 5. Perkutane Pedikelschraubeninsertion und Stabreduktion. (A, B) Setzen Sie Pedikelschrauben und -stäbe ein und (C, D) verwenden Sie den Stab, um die Spondylolisthesis zu reduzieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
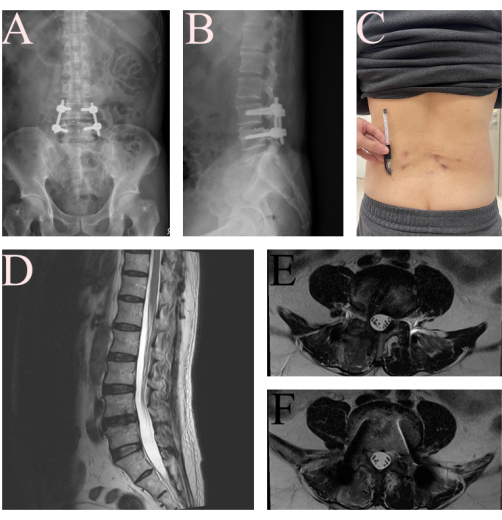
Abbildung 6: Postoperative Bilder des Patienten nach FE-TLIF. (A) Anteroposteriores und (B) laterales Röntgenbild des Patienten, das eine gute Implantatposition und eine Spondylolisthesis-Reduktion nach 2 Tagen zeigt. (C) Foto der Wunden des unteren Rückens von FE-TLIF. (D, E, F) Die Nachsorge-MRT T2WI nach 6 Wochen zeigte eine gute Dekompression der L4-L5-Nervenstruktur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Parameter | Wert |
| Anzahl der Patienten | 10 |
| Alter (Jahr) | 67,0 ± 9,27 (52–82) |
| Präoperativer Schmerz-Score auf einer visualisierten analogen Skala | 7,2 ± 1,14 |
| Postoperativer Schmerz-Score auf einer visualisierten analogen Skala | 1,3 ± 1,34 |
| Aktivitäten außerhalb des Bettes | Tag 1.4 ± 0.52 |
| Selbstständiges Gehen | Tag 2.3 ± 0.82 |
| Entfernung des Drainageschlauchs | Tag 2.6 ± 0.52 |
| Entlassung aus dem Krankenhaus | Tag 4.1 ± 1.60 |
| Betriebsdauer (Minute) | 333,2 ± 47,25 (274–465) |
| Transfusionsbedarf (n, %) | 1 (10%) |
| Ergebnis der operationellen MacNab-Kriterien (n, %) | |
| Ausgezeichnet | 6 (60%) |
| Gut | 3 (30%) |
| Gerecht | 1 (10%) |
| Arm | 0 |
| Komplikation | |
| Epidurales Hämatom | 0 |
| Durotomie | 0 |
| Verletzung der Wurzel | 0 |
| Fehlplatzierung der Schraube | 0 |
Tabelle 1: Repräsentatives Ergebnis der guten Wiederfindung von FE-TLIF.
Diskussion
Das FE-TLIF-Verfahren war noch nie einfach, auch wenn sich die aktuellen Trends in der Wirbelsäulenchirurgie weiter in Richtung minimal-invasiver Ansätze verschieben17. Diese Studie ist eine der ersten, die eine detaillierte Videodemonstration der FE-TLIF-Technik bietet. Zhao et al.14 berichteten, dass es 25 Fälle brauchte, um die Operationszeit und die Dauer des Krankenhausaufenthalts zu reduzieren. In der Zwischenzeit fanden Ali et al.18 heraus, dass die Lernkurve in erster Linie bestimmte chirurgische Metriken beeinflusste, aber keinen Einfluss auf die klinischen Ergebnisse bei der endoskopischen Diskektomie. Diese Ergebnisse zeigen, dass FE-TLIF effektiv erlernt werden kann und mit dem richtigen Training zu günstigen klinischen Ergebnissen führt. Der Autor hat mit mehreren internationalen Experten trainiert, an mehreren Live- und Leichenkursen teilgenommen und über 500 endoskopische Wirbelsäulenoperationen durchgeführt. In dieser Studie stellen wir das ideale Protokoll für einstufige FE-TLIF vor, um Anfängern zu helfen, die Lernkurve zu überwinden.
Anfänger haben aufgrund von Geräteeinschränkungen oft Schwierigkeiten, die Durchführung von FE-TLIF zu beherrschen, da chirurgische Standardinstrumente, die üblicherweise in der traditionellen Fusionschirurgie und UBE-TLIF verwendet werden, nicht verwendet werdenkönnen 3,19. Insbesondere das Design von Instrumenten für die Diskektomie und die Vorbereitung der Knorpelendplatte variiert erheblich zwischen den Marken und hängt von den Präferenzen des Chirurgen ab12. Um diese Herausforderung zu bewältigen, verwendeten wir mehrere Instrumente, die für herkömmliche TLIF-Verfahren typisch sind, darunter einen Endplattenrasierer, einen Trichter und einen nicht expandierbaren Käfig aus Polyetheretherketon (PEEK). Du et al.19 berichteten auch, dass die Verwendung vertrauter chirurgischer Instrumente die Kosten senken und die betriebliche Effizienz verbessern kann. Einige Kritiker argumentieren, dass Disc-Rasierer und -Schaber zu aggressiv sein könnten und die Gefahr einer Verletzung der Endplatte bergenkönnten 3. Der vorgestellte Ansatz betont zwei wesentliche Punkte: Erstens erhöht die Vertrautheit mit den Instrumenten die Verfahrenssicherheit; Zweitens können die manuelle Kraft und der Zustand der Endplatte nach jedem Gebrauch durch endoskopische Visualisierung sorgfältig überwacht werden.
Die Outside-in-Technik mit einem Trepan erwies sich bei der IAP-Resektion als wirksam bei gleichzeitiger Erhaltung der autologen Knochen. Kim et al.10 verglichen die Outside-In- und Inside-Out-Techniken zur IAP-Entfernung und stellten fest, dass erstere effizienter sind. In ähnlicher Weise berichteten Du et al.19, dass das visuelle Trepan eine effiziente und bequeme partielle Facetektomie ermöglicht. Während die Verwendung eines endoskopischen Bohrers oder Diamantfräsers für diesen Schritt ebenfalls wirksam ist 4,6,9,10,11, können diese Verfahren weniger autologen Knochen für die Transplantation liefern, was ein kritischer Faktor für das Erreichen der Röntgenfusion ist 20,21. Aus diesem Grund plädieren wir für den Einsatz des visuellen Trepans und der Outside-In-Technik, um den Erhalt des autologen Knochens zu maximieren. Stellen Sie sicher, dass es keine Verwechslungen bezüglich des Begriffs Outside-In-Technik in der Dekompression15 gibt, die sich auf die knöcherne Dekompression bezieht, die vor der en-bloc-Entfernung des Ligamentum flavum durchgeführt wird.
Der visualisierte Nervenschutz während benachbarter Eingriffe stellt einen entscheidenden Fortschritt im FE-TLIF-Protokoll dar. Bei der von Kim und Wu et al.7 berichteten Technik wurde nach der Präparation der Endplatte ein spezieller Käfiggleiter verwendet, mit anschließender Knochentransplantation und Käfigeinfügung, die durch Fluoroskopie geführt wurde. Die Autoren behaupteten, dass neuronale Strukturen vollständig geschützt seien, wenn sie durch das spezialisierte Instrument angemessen abgeschirmt würden. Nichtsdestotrotz berichtete dieselbe Studiengruppe über eine Komplikationsrate von 6 % bei 35 Patienten, die sich einer FE-TLIF unterzogen. Das Verletzungsrisiko steigt bei einem schwereren Bandscheibenkollaps9. Chang et al.13 berichteten über einen durchschnittlichen Abstand von 3,3 mm zwischen dem Käfigeintrittspunkt und der traversierenden Wurzel in FE-TLIF-Verfahren und empfahlen Variationen in den Käfiggleiterstrategien, um dieser Herausforderung zu begegnen. In diesem Protokoll wurde ein Arbeitsschlauch mit einer langen Lippe verwendet, um die ipsilateral verlaufende Wurzel zurückzuziehen, die ruhig mit der Hand gehalten wurde, um einen sicheren und sichtbaren Nervenschutz vor dem Einsetzen des Käfigs zu ermöglichen.
Dennoch bestand die Einschränkung der chirurgischen Geräte, da einige der Instrumente, einschließlich des Trepans und des Arbeitsrohrs für die Reibahle in Schritt 3.1, nur auf Anfrage erhältlich sind. Die meisten anderen Instrumente sind jedoch Chirurgen bekannt, die eine Wirbelsäulenausbildung oder grundlegende Kurse in endoskopischer Wirbelsäulenchirurgie absolviert haben. Darüber hinaus kann es zu Verzerrungen in der Studie kommen, da in unserer Fallserie mit einer begrenzten Anzahl von Fällen keine Komplikationen wie Hämatome, Nervenwurzelverletzungen, Schraubenfehlplatzierung oder Lockerung aufgetreten sind. Auch in einigen Fällen der einseitigen Laminotomie zur bilateralen Dekompression ist eine anatomische Reposition der Spondylolisthesis nicht immer erforderlich. Die klinische Bedeutung beruht auf einer erfolgreichen Nervendekompression, nicht aber auf einer röntgenologischen Reduktion. Es wurde berichtet, dass die röntgenologische lumbale Fusionsrate für FE-TLIF zwischen 97,5 % und 100 % liegt, wenn eine Kombination aus autogenen und allogenen Knochentransplantaten verwendetwird 19,22. Ähnlich wie bei unserem Ansatz mit autogenem Knochentransplantat und künstlichem Knochenersatz berichteten Tsai und Liu et al.23 über eine 100%ige Fusionsrate für FE-LIF. In unserer kleinen Fallserie mit einer begrenzten Anzahl von Patienten steht die Fusionsrate jedoch noch nicht zur Verfügung.
Zusammenfassend lässt sich sagen, dass diese Studie wertvolles Lehrvideomaterial bietet, das jeden Schritt des FE-TLIF-Verfahrens detailliert beschreibt. Das Protokoll beinhaltet die Verwendung mehrerer Instrumente, die für herkömmliche TLIF-Verfahren üblich sind, eine effiziente Outside-In-Technik mit einem Trepan für die IAP-Resektion, eine endoskopische Visualisierung für die Endplattenvorbereitung und einen Nervenschutz. Mit der richtigen Ausbildung kann FE-TLIF effektiv erlernt werden, was zu günstigen klinischen Ergebnissen führt.
Offenlegungen
Alle Autoren gaben keinen Interessenkonflikt an.
Danksagungen
Besonderer Dank geht an Louis Lai, der die Prozedur mit seinem Smartphone und einem Stativ aufgezeichnet hat. Diese Studie erhielt keine externe Finanzierung.
Materialien
| Name | Company | Catalog Number | Comments |
| 10mm shaver | REBORN | 420-0710 | |
| 10mm trial | REBORN | 420-0610A | |
| 11mm shaver | REBORN | 420-0711 | |
| 11mm trial | REBORN | 420-0611A | |
| 12mm shaver | REBORN | 420-0712 | |
| 12mm trial | REBORN | 420-0612A | |
| 13mm shaver | REBORN | 420-0713 | |
| 13mm trial | REBORN | 420-0613A | |
| 14mm shaver | REBORN | 420-0714 | |
| 14mm trial | REBORN | 420-0614A | |
| 8mm shaver | REBORN | 420-0708 | |
| 8mm trial | REBORN | 420-0608A | |
| 9mm shaver | REBORN | 420-0709 | |
| 9mm trial | REBORN | 420-0609A | |
| Biopsy Forceps, Blakesley | JOIMAX | BFS323061 | WL 320 mm / OD 3.5 mm / JL 6.0 mm |
| Biopsy Forceps, Spoon | JOIMAX | THF322541 | WL 320 mm / OD 2.5 mm / JL 4.0 mm |
| Biopsy Forceps, Spoon, angled | JOIMAX | THF322041 | WL 320 mm / OD 2.0 mm / JL 4.0 mm / 45° |
| Bone graft impactor | REBORN | 410-1216 | |
| Dissector | JOIMAX | JDA273515 | WL 275 mm / OD 3.5 mm |
| Dissector, angled | JOIMAX | ON REQUEST | WL 280 mm / OD 3.5 mm / 40° |
| Distractor 10mm | REBORN | 420-1610 | |
| Distractor 11mm | REBORN | 420-1611 | |
| Distractor 12mm | REBORN | 420-1612 | |
| Distractor 13mm | REBORN | 420-1613 | |
| Distractor 14mm | REBORN | 420-1614 | |
| Distractor 8mm | REBORN | 420-1608 | |
| Distractor 9mm | REBORN | 420-1609 | |
| Endo-Flexprobe | JOIMAX | TEFP32020 | L 320 mm / OD 2.0 mm |
| Endo-Flexprobe Handle | JOIMAX | TEFH45025 | L 450 mm / OD 2.5 mm |
| Endo-Kerrison-Pistol Handle | JOIMAX | EKH550000 | OD 5.5 mm |
| Endo-Kerrison-Shaft | JOIMAX | EKS24551540 | WL 240 mm / OD 5.5 mm / F 1.5 mm / 40° |
| Endo-Kerrison-Shaft | JOIMAX | EKS24553040 | WL 240 mm / OD 5.5 mm / F 3.0 mm / 40° |
| Funnel for bone graft | REBORN | 410-1215 | |
| Grasper Forceps | JOIMAX | THG323555 | WL 320 mm / OD 3.5 mm / JL 5.5 mm |
| Guiding Rod, conical | JOIMAX | GRD226315 | L 225 mm / OD 6.3 mm |
| Guiding Tube, conical, red | JOIMAX | GTC177010 | L 165 mm / ID 7 mm / OD 10 mm |
| Guiding Tube, conical, violet | JOIMAX | GTC151510 | L 175 mm / ID 10 mm / OD 15 mm |
| Hook Scissor | JOIMAX | JHS243545 | WL 240 mm / OD 3.5 mm / JL 4.5 mm |
| Laminoscope | JOIMAX | LS1006125O | WL 125 mm / OD 10.0 mm / 15° / WChD 6.0 mm / 2x IC 2.0 mm |
| Lumbar implant impactor | REBORN | 420-3303 | |
| Nerve Hook | JOIMAX | TNH322533 | L 320 mm / OD 2.5 mm / JL 3.3 mm |
| Osteotome | JOIMAX | ON REQUEST | WL 260 mm / OD 5.5 mm |
| Peek lumbar 11#-14# implant driver | REBORN | 420-1715 | |
| Peek lumbar 8#-10# implant driver | REBORN | 420-1714 | |
| Reamer Push-Ejector | JOIMAX | RPE280600 | L 280 mm / OD 6.0 mm |
| Semi-Flexible Grasper Forceps, curved, up-biting | JOIMAX | TFG322522U | WL 320 mm / OD 2.5 mm / Helix |
| Slap hammer | REBORN | 420-0401B | |
| T-handle | REBORN | 460-0101A | |
| Working Reamer Tube, put endoscope into for trephining | JOIMAX | ON REQUEST | L 125 mm / ID 10.2 mm / OD 11.2 mm |
| Working Tube with Handle | JOIMAX | ON REQUEST | L 125 mm / ID 10.2 mm / OD 11.2 mm |
| Working Tube with Handle, long Lip | JOIMAX | WTS121602 | L 132 mm / ID 15 mm / OD 16 mm |
| Working Tube, use with reamer | JOIMAX | ON REQUEST | L 120 mm / ID 11.5 mm / OD 12.5 mm |
Referenzen
- Ricart, P. H., Gandhi, S. D., Geisinger, J., Baker, K., Park, D. K. Clinical and ct analysis of lumbar spine arthrodesis: Beta-tricalcium phosphate versus demineralized bone matrix. J Am Acad Orthop Surg Glob Res Rev. 2 (9), e024(2018).
- Pholprajug, P., Kotheeranurak, V., Liu, Y., Kim, J. S. The endoscopic lumbar interbody fusion: A narrative review, and future perspective. Neurospine. 20 (4), 1224-1245 (2023).
- Pao, J. L. Biportal endoscopic transforaminal lumbar interbody fusion using double cages: Surgical techniques and treatment outcomes. Neurospine. 20 (1), 80-91 (2023).
- Nakajima, Y., Dezawa, A., Lim, K. T., Wu, P. H. Full-endoscopic posterior lumbar interbody fusion: A review and technical note. World Neurosurg. 189, 418-427.e3 (2024).
- Heo, D. H., Lee, D. C., Kim, H. S., Park, C. K., Chung, H. Clinical results and complications of endoscopic lumbar interbody fusion for lumbar degenerative disease: A meta-analysis. World Neurosurg. 145, 396-404 (2021).
- Kim, H. S., Wu, P. H., Sairyo, K., Jang, I. T. A narrative review of uniportal endoscopic lumbar interbody fusion: Comparison of uniportal facet-preserving trans-kambin endoscopic fusion and uniportal facet-sacrificing posterolateral transforaminal lumbar interbody fusion. Int J Spine Surg. 15 (suppl 3), S72-S83 (2021).
- Kim, H. S., Wu, P. H., Jang, I. T. Technical note on uniportal full endoscopic posterolateral approach transforaminal lumbar interbody fusion with reduction for grade 2 spondylolisthesis. Interdiscipl Neurosurg. 21, 100712(2020).
- Park, M. K., Park, S. A., Son, S. K., Park, W. W., Choi, S. H. Clinical and radiological outcomes of unilateral biportal endoscopic lumbar interbody fusion (ulif) compared with conventional posterior lumbar interbody fusion (plif): 1-year follow-up. Neurosurg Rev. 42 (3), 753-761 (2019).
- Wu, P. H., et al. Uniportal full endoscopic posterolateral transforaminal lumbar interbody fusion with endoscopic disc drilling preparation technique for symptomatic foraminal stenosis secondary to severe collapsed disc space: A clinical and computer tomographic study with technical note. Brain Sci. 10 (6), 373(2020).
- Kim, H. S., et al. Evaluation of two methods (inside-out/outside-in) inferior articular process resection for uniportal full endoscopic posterolateral transforaminal lumbar interbody fusion: Technical note. Brain Sci. 11 (9), 1169(2021).
- Wu, P. H., et al. Prospective cohort study with a 2-year follow-up of clinical results, fusion rate, and muscle bulk for uniportal full endoscopic posterolateral transforaminal lumbar interbody fusion. Asian Spine J. 17 (2), 373-381 (2023).
- Chien, K. T., et al. Optimizing disc and cartilage endplate preparation in full-endoscopic lumbar interbody fusion: An in-depth exploration of surgical instruments with a technique note and narrative review. World Neurosurg. 189, 228-247 (2024).
- Hsu, Y. C., et al. How to prevent nerve root injury in uniportal full endoscopic lumbar fusion surgery? Insights from a cadaveric anatomic study with simulation surgery. Spine. 49 (18), 1301-1310 (2024).
- Zhao, T., Dai, Z., Zhang, J., Huang, Y., Shao, H. Determining the learning curve for percutaneous endoscopic lumbar interbody fusion for lumbar degenerative diseases. J Ortho Surg Res. 18 (1), 193(2023).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar endoscopic unilateral laminotomy for bilateral decompression outside-in approach: A proctorship guideline with 12 steps of effectiveness and safety. Neurospine. 17 (Suppl 1), S99-S109 (2020).
- Macnab, I. Negative disc exploration. An analysis of the causes of nerve-root involvement in sixty-eight patients. J Bone Joint Surg Am. 53 (5), 891-903 (1971).
- Antonacci, C. L., et al. A narrative review of endoscopic spine surgery: History, indications, uses, and future directions. J Spine Surg. 10 (2), 295-304 (2024).
- Ali, R., et al. Impact of the learning curve of percutaneous endoscopic lumbar discectomy on clinical outcomes: A systematic review. Interdiscip Neurosurg. 32, 101738(2023).
- Du, Y., et al. Full endoscopic posterolateral transarticular lumbar interbody fusion using transparent plastic working tubes: Technical note and preliminary clinical results. Front Surg. 9, 884794(2022).
- Ito, Z., et al. Bone union rate with autologous iliac bone versus local bone graft in posterior lumbar interbody fusion (plif): A multicenter study. Eur Spine J. 22 (5), 1158-1163 (2013).
- Yoo, J. S., Min, S. H., Yoon, S. H. Fusion rate according to mixture ratio and volumes of bone graft in minimally invasive transforaminal lumbar interbody fusion: Minimum 2-year follow-up. Eur J Orthop Surg Traumatol. 25 (Suppl 1), S183-S189 (2015).
- Wang, J. C., Cao, Z., Li, Z. Z., Zhao, H. L., Hou, S. X. Full-endoscopic lumbar interbody fusion versus minimally invasive transforaminal lumbar interbody fusion with a tubular retractor system: A retrospective controlled study. World Neurosurg. 165, e457-e468 (2022).
- Tsai, P. C., et al. The novel kambin torpedo full-endoscopic lumbar interbody fusion technique: A case series. Eur Spine J. 33 (2), 417-428 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten