Method Article
Nekroz, Apoptoz ve Trombosit Aktivasyonu Özellikleri Sergileyen Prokoagülan Trombositlerin Kapsamlı Analizi
Bu Makalede
Özet
Mevcut protokol, nekroz, apoptoz ve trombosit aktivasyonunun örtüşen özelliklerini sergileyen prokoagülan trombositleri analiz etmek için gerekli olan kapsamlı bir dizi prosedür sağlar.
Özet
Kan dolaşımında dolaşan trombositler nispeten hareketsizdir, ancak kan damarı yaralanması bölgesinde uyarıcılar veya "agonistler" ile karşılaşıldığında "aktive olur". Proagregatör ve prokoagülan trombositler, aktive edilmiş trombositlerin iki farklı popülasyonunu temsil eder. Proagregatör trombositler, fibrinojen köprüleri yoluyla bir araya toplanmış bir trombosit tıkaç oluşturarak kanamanın veya "hemostazın" durmasını kolaylaştırırken, prokoagülan trombositler pıhtılaşma kaskadını önemli ölçüde hızlandırır ve fibrin pıhtısı oluşumu ile sonuçlanır. Prokoagülan trombositlerin ilginç bir yönü, morfolojilerinin "nekroz" ve "apoptoz" un belirli özelliklerini sergilemesidir. Bu nedenle, tromboz ve hemostazda önemli bir role sahip olsalar da, trombositlerde bir hücre ölümü şeklini temsil edebilirler. Bu makale, prokoagülan trombositler kavramını, bunların sağlık ve hastalıkla olan ilişkisini ve analizleri için mevcut yöntemlerin karşılaştırılmasını tanıtmaktadır. Daha sonra prokoagülan trombositleri analiz etmek, oluşum mekanizmalarını araştırmak ve pıhtılaşmayı kolaylaştırmadaki protrombotik rollerini değerlendirmek için kapsamlı protokoller sağlar. Makale, açıklanan yöntemler için temel adımların, sınırlamaların ve sorun giderme ilkelerinin tartışılmasıyla sona ermektedir.
Giriş
En az iki farklı aktive edilmiş trombosit popülasyonu vardır 1,2. Proagregatör trombositler, yüksek integrin aktivasyonu ve varsa düşük PS maruziyeti ile karakterizedir. Öte yandan, prokoagülan trombositler, düşük integrin aktivitesi ve yüksek PS maruziyeti 1,2 ile karakterize edilir, bu da tenaz ve protrombinaz komplekslerinin montajı için bir yüzey sağlar3, bu da sırasıyla 105-10 6 kat ve 300000 kat daha aktiftir,sırasıyla çözünür faz faktörü IXa ve Xa'dan 4. Prokoagülan trombositler böylece pıhtılaşmayı önemli ölçüde hızlandırır. Prokoagülan trombositlerin ilginç bir yönü, morfolojilerinin mikrovezikülasyon, hücre iskeleti bozulması ile hücrenin balonlaşması ve zar bütünlüğünün kaybı gibi "nekroz" özelliklerinin yanı sıra dış broşürde fosfatidilserin maruziyeti ile membran fosfolipid asimetrisi kaybı gibi "apoptoz" özelliklerine benzemesidir 5,6. Başka bir deyişle, prokoagülan trombosit oluşumu, hemostazda önemli bir fizyolojik işleve sahip olmasına rağmen, trombositlerde bir hücre ölümü şeklini temsil edebilir.
Prokoagülan trombositler trombotik bozukluklarla önemli ölçüde ilişkilidir. Sağlıklı bireylerin çoğunda dolaşımdaki prokoagülan trombositler bulunmamakla birlikte, normal donör trombositlerinin ~% 30'u, trombin ve kollajen7 gibi güçlü agonistlere maruz kaldıktan sonra ex vivo bir prokoagülan fenotipi benimser. Dolaşımdaki prokoagülan trombositler, oluşumlarının histon H4 8,9 tarafından aktivasyonu yansıtabileceği travmada bildirilmiştir. Bununla birlikte, çoğu protrombotik bozuklukta, artmış prokoagülan trombosit seviyeleri sadece ex vivo stimülasyondan sonra tespit edilir10. Örneğin, trombositlerinin %>51.1'inin kollajen ve trombin tarafından prokoagülan trombositlere (COATed trombositler olarak da bilinir) dönüştürüldüğü akut inmeli hastalar, daha az prokoagülan trombosit oluşumu olan hastalara kıyasla 30 gün içinde tekrarlayan inme için 10.72'lik bir tehlike oranına sahipti11. Geçici iskemik ataklar ve karotis ateroskleroz12 olan hastalarda da benzer sonuçlar bildirilmiştir. Buna karşılık, kanama bozukluğu Scott sendromu, fosfolipid scramblase TMEM-16F'yi kodlayan ve yetersiz trombosit PS maruziyetine yol açan bir ANO6 mutasyonundan kaynaklanır13. İdiyopatik kanama bozuklukları ve intrakraniyal kanama, prokoagülan trombosit üretme yeteneğinin azalmasıyla ilişkili olabilir14.
Bu nedenle, prokoagülan trombositlerin değerlendirilmesi, yalnızca trombosit aktivasyon mekanizmalarına ve buna bağlı tromboz ve hemostaz mekanizmalarına ilişkin temel araştırmalar sırasında değil, aynı zamanda çeşitli patolojik durumlar sırasında hastalarda tromboz veya kanama riskine yönelik klinik analiz sırasında da trombosit fonksiyonunun herhangi bir analizinin bir parçasıdır. Uluslararası Tromboz ve Hemostaz Derneği (ISTH) paneli, prokoagülanları diğer trombosit alt popülasyonlarından ayırt etmek için akış sitometrisi ile Ek V bağlanması ve P-selektin ekspresyonunun kullanılmasını önermiştir15. Makale ayrıca prokoagülan ve apoptotik trombositleri analiz etmek için kullanılabilecek çeşitli yöntemleri tartışmaktadır, ancak süreçleri ayrıntılı olarak açıklamakta yetersiz kalmaktadır. Bu yöntemler arasında (1) PAC1/JonA veya fibrinojen bağlanması (akış sitometrisi) ile trombosit aktivasyonunun saptanması; (2) P-selektin ekspresyonu (akış sitometrisi) ile alfa-granül sekresyonu; (3) Annexin V / laktadherin bağlanması (akış sitometrisi) ile PS maruziyeti; (4) GSAO etiketlemesi (akış sitometrisi) ile membran bütünlüğünün kaybı; (5) balonlaşma (mikroskopi) gibi morfolojik değişiklikler; (6) kaspaz testi (immünoblotlama/luminometri/akış sitometrisi) ile kaspaz aktivasyonunun saptanması veya hücre iskeleti substratı jelsolinin bozunması (immünoblotlama); (7) JC-1 / Mitotracker (akış sitometrisi) gibi mitokondriyal potansiyele duyarlı boyalar tarafından mitokondriyal membran potansiyelinin kaybı; (8) mitokondriyal intrinsik apoptotik belirteçler Bax, Bak ve sitokrom c salınımı (immünoblotlama); (9) trombin oluşturma testi ve pıhtılaşma faktörü Xa / Va bağlanması (akış sitometrisi, mikroskopi) ile prokoagülan fonksiyon; (10) sitozolik ve mitokondriyal kalsiyum, floresan kalsiyuma duyarlı boyalarla (akış sitometrisi, florometri, mikroskopi) yükselir.
Bu çalışma, prokoagülan trombositlerin analizi için kapsamlı protokollerin yanı sıra bunları proagregatör ve apoptotik trombositlerden ayırt etmeyi de amaçlamaktadır. Açıklanan prosedürlerin çoğu, (1) kolayca bulunabilmesi ve kullanımının kolay olması, (2) düşük numune hacmi gerektirmesi ve (3) birden fazla trombosit alt popülasyonunun (proagregatör, prokoagülan ve apoptotik) aynı anda saptanmasına izin vermesi gibi avantajlara sahip akış sitometrisine dayanır15. Bu akış sitometrisi tabanlı protokoller, pıhtılaşma faktörü bağlanmasına ve pıhtı bazlı trombin oluşturma testlerine dayalı prokoagülan aktivitenin fonksiyonel testleri ile desteklenir.
Protokol
İnsan katılımcılar, yazılı bilgilendirilmiş onam alındıktan sonra, Cleveland Clinic Lerner Araştırma Enstitüsü Kurumsal İnceleme Kurulu'nun tavsiyelerine ve onayına sıkı sıkıya bağlı kalarak ve tüm çalışma metodolojileri Helsinki Bildirgesi tarafından belirlenen standartlara uygun olarak periferik venöz kan örneklemesi için çalışmaya dahil edildi. 18 yaşından büyük sağlıklı yetişkin katılımcılar dahil edilirken, 18 yaşından küçükler, son altı ay içinde yakın zamanda trombotik olay öyküsü olan kişiler, alkolizm veya uyuşturucu bağımlılığı öyküsü olanlar ve son dört hafta içinde anti-trombosit veya anti-koagülan ilaçlar kullanan katılımcılar hariç tutuldu. Protokollerde kullanılan malzemelerin ve reaktiflerin ayrıntılı bir açıklaması Malzeme Tablosunda bulunabilir.
1. Trombosit hazırlama
- Kurumsal İnceleme Kurulu tarafından onaylanan tavsiyelere sıkı sıkıya bağlı kalarak, yazılı bilgilendirilmiş onam aldıktan sonra insan katılımcılardan periferik venöz kan örneklerini ACD antikoagülanına (1:9 v/v) alın.
- Süpernatan olarak trombositten zengin plazma (PRP) elde etmek için ACD'de toplanan kanı 100 x g'da 22 ° C'de 20 dakika santrifüjleyin.
- 3 μM PGE1 ve 2 mM EDTA ekledikten sonra PRP'yi 800 x g'da 22 ° C'de 7 dakika santrifüjleyin.
- Süpernatanı atın ve trombosit peletini nazik pipetleme ile tampon A'da (Malzeme Tablosuna bakınız) yeniden süspanse edin.
- Tampon A'da 800 x g'da yeniden süspanse edilen trombositleri 22 ° C'de 7 dakika boyunca santrifüjleyin.
- Trombosit peletini tampon B'de (bkz . Malzeme Tablosu) nazik pipetleme ile yeniden süspanse edin.
- Otomatik bir hücre sayacı kullanarak son trombosit sayısını 1 × 107 / mL'ye ayarlayın.
NOT: Tüm adımları steril koşullar altında gerçekleştirin ve pipetleme sırasında aşırı kesmeye maruz kalmaktan kaçınarak trombositleri dinlenme durumunda tutmak için önlemler alın.
2. Prokoagülan trombositlerin akış sitometrisi ile analizi
- Yıkanmış insan trombositlerini 2.5 mM kalsiyum (100 μL trombosit süspansiyonunda 0.5 μL stok CaCl2 0.5 M solüsyon) ile destekleyin.
- Trombositlerin bir fraksiyonunu uyarılmamış halde tutun ve kalan fraksiyonları trombin (0.1 U/mL, 0.25 U/mL, 0.5 U/mL), konvülksin (20 ng/mL, 50 ng/mL, 100 ng/mL) veya bunların kombinasyonu ile oda sıcaklığında 15 dakika boyunca uyarın.
- Stimülasyondan sonra, 100 μL uyarılmış trombosit süspansiyonuna 1 μL PE-Annexin V, FITC-PAC1 ve APC-anti-insan CD62P antikoru ekleyin.
- Trombositleri karanlıkta oda sıcaklığında 30 dakika inkübe edin.
- Eşit hacimde (1: 1)% 2 formalin ekleyerek trombositleri sabitleyin.
- Prokoagülan trombositleri ölçmek için numuneleri akış sitometrisi ile analiz edin15,16.
- Trombositleri kapsayacak şekilde amorf bir kapı çizin, onları gürültüden ve çoklu trombosit parçacıklarından ayırın.
- Her numuneden trombosit kapısındaki 10.000 olay için dört kadranlı logaritmik amplifikasyon kullanarak tüm floresan verilerini toplayın.
- Fosfatidilserin (PS) maruziyeti (Ek V bağlanması), P-selektin (CD62P) ekspresyonu ve integrin αIIbβ3 aktivasyonu (PAC1 bağlanması) için floresan pozitifliğine veya negatifliğine dayalı olarak trombositler için bölgeleri tanımlayın.
- Hem PS maruziyeti (Ek V bağlanması) hem de P-selektin (CD62P) ekspresyonu için pozitif, ancak prokoagülan trombositler olarak integrin αIIbβ3 aktivasyonu (PAC1 bağlanması) için negatif olan trombositleri düşünün (Şekil 1) (Tablo 1).
- Benzer şekilde, trombositleri hem integrin αIIbβ3 aktivasyonu (PAC1 bağlanması) hem de P-selektin (CD62P) ekspresyonu için pozitif, ancak PS maruziyeti (Ek V bağlanması) için negatif olan trombositleri proagregatör trombositler olarak düşünün.
NOT: Hem integrin αIIbβ3 aktivasyonu (PAC1 bağlanması) hem de P-selektin (CD62P) ekspresyonu için negatif, ancak PS maruziyeti (Annexin V bağlanması) için pozitif olan trombositler muhtemelen apoptotik trombositlerdir15,16.
3. Mitokondriyal kalsiyumun akış sitometrisi ile analizi
- Yıkanmış insan trombositlerini 1 × 106 / mL'ye seyreltin ve 2.5 mM kalsiyum (100 μL trombosit süspansiyonunda 0.5 μL stok CaCl2 0.5 M solüsyon) ile takviye edin.
- Trombositleri karanlıkta 30 dakika boyunca 5 μM Rhod-2 (mitokondriyal kalsiyum için) ile etiketleyin.
- Trombositleri 2. adımda açıklandığı gibi uygun şekilde kapatın.
- Zamana karşı PE floresan (Rhod-2 için) yoğunluk dağılım grafiği kullanarak 5 dakika boyunca edinilen olayların ortalama floresansındaki zamana bağlı değişiklikler için trombosit kapısındaki olayları analiz edin.
- İlk 1 dakika boyunca temel kalsiyum seviyelerini kaydedin.
- Trombin (0.1 U/mL, 0.25 U/mL veya 0.5 U/mL), konvülksin (20 ng/mL, 50 ng/mL veya 100 ng/mL) veya bunların kombinasyonlarını ekleyin ve 4 dakika daha veri toplamaya devam edin17.
4. Mitokondriyal membran potansiyelinin akış sitometrisi ile analizi
- Yıkanmış insan trombositlerini 2.5 mM kalsiyum (100 μL trombosit süspansiyonunda 0.5 μL stok CaCl2 0.5 M solüsyon) ile destekleyin.
- Trombositlerin bir fraksiyonunu uyarılmamış halde tutun ve kalan fraksiyonları trombin (0.1 U/mL, 0.25 U/mL veya 0.5 U/mL), konvülksin (20 ng/mL, 50 ng/mL veya 100 ng/mL) veya bunların kombinasyonu ile oda sıcaklığında 15 dakika boyunca uyarın.
- Stimülasyondan sonra, uyarılan trombosit süspansiyonlarına 500 nM'lik bir nihai konsantrasyonda mitokondri etiketleme boyası (Malzeme Tablosuna bakınız) ekleyin.
- Trombositleri karanlıkta 30 dakika inkübe edin.
- Eşit hacimde% 2 formalin ekleyerek trombositleri sabitleyin.
- Numuneleri akış sitometrisi17 ile analiz edin.
- Trombositleri 2. adımda açıklandığı gibi uygun şekilde kapatın.
- Akış sitometresinin PE kanalındaki (mitokondri etiketleme boyası için) floresan düşüşü için trombosit kapısındaki olayları analiz edin.
5. Kaspazat 3 ve kaspaz 8 aktivitesinin akış sitometrisi ile analizi
- Yıkanmış insan trombositlerini 2.5 mM kalsiyum (100 μL trombosit süspansiyonunda 0.5 μL stok CaCl2 0.5 M solüsyon) ile destekleyin.
- Trombositlerin bir fraksiyonunu uyarılmamış halde tutun ve kalan fraksiyonları trombin (0.1 U/mL, 0.25 U/mL veya 0.5 U/mL), konvülksin (20 ng/mL, 50 ng/mL veya 100 ng/mL) veya bunların kombinasyonu ile oda sıcaklığında 15 dakika boyunca uyarın.
- Stimülasyondan sonra, 1:1000 (h/v) apoptoz tespit reaktifi (Malzeme Tablosuna bakınız) (hem içsel hem de dışsal apoptoz yolları için) veya 1:300 (h/v) FITC-IETD-FMK (ekstrinsik apoptoz yolunun kaspaz 8'i için) uyarılmış trombosit süspansiyonlarına ekleyin.
- Trombositleri karanlıkta 30 dakika inkübe edin.
- Eşit hacimde% 2 formalin ekleyerek trombositleri sabitleyin.
- Numuneleri akış sitometrisi17 ile analiz edin.
- Trombositleri 2. adımda açıklandığı gibi uygun şekilde kapatın.
- Akış sitometresinin FITC kanalındaki (kaspaz 3/7 veya kaspaz 8 için) floresan için trombosit kapısındaki olayları analiz edin.
6. Akış sitometrisi ile protrombin bağlanmasının analizi
- Sığır protrombinini Alexa Fluor 488 boyası ile bir protein etiketleme kiti kullanarak birleştirin (üreticinin talimatlarını izleyerek Malzeme Tablosuna bakınız).
- Yıkanmış insan trombositlerini 2.5 mM kalsiyum (100 μL trombosit süspansiyonunda 0.5 μL stok CaCl2 0.5 M solüsyonu) ile destekleyin.
- Trombositlerin bir fraksiyonunu uyarılmamış halde tutun ve kalan fraksiyonları trombin (0.1 U/mL, 0.25 U/mL veya 0.5 U/mL), konvülksin (20 ng/mL, 50 ng/mL veya 100 ng/mL) veya bunların kombinasyonu ile oda sıcaklığında 15 dakika boyunca uyarın.
- Stimülasyondan sonra, 100 μL uyarılmış trombosit süspansiyonuna AF488 konjuge sığır protrombini (100 μg / mL) ve 1 μL PE-Annexin V ve APC anti-insan CD62P antikoru ekleyin.
- Eşit hacimde% 2 formalin ekleyerek trombositleri sabitleyin.
- Protrombinin trombositlere bağlanmasının miktar tayini için numuneleri akış sitometrisi17 ile analiz edin.
- Gürültüden ve çoklu trombosit parçacıklarından ayrı trombositleri kapsayacak şekilde amorf bir kapı çizin.
- Her numuneden trombosit kapısındaki 10.000 olay için dört kadranlı logaritmik amplifikasyon kullanarak tüm floresan verilerini toplayın.
- PS maruziyeti (Annexin V bağlanması), P-selektin (CD62P) ekspresyonu ve AF488-protrombin (protrombin bağlanması) için floresan pozitif veya negatif olan trombositler için bölgeler çizin.
- Protrombin bağlanması için pozitif olan tüm trombosit olaylarının oranını ve hem PS maruziyeti (Ek V bağlanması) hem de P-selektin (CD62P) ekspresyonu (prokoagülan trombositler) için pozitif trombositlerin oranını belirleyin.
7. Konfokal mikroskopi ile protrombin bağlanmasının analizi
- Sığır protrombinini Alexa Fluor 488 boyası ile bir protein etiketleme kiti kullanarak birleştirin (üreticinin talimatlarını izleyerek Malzeme Tablosuna bakınız).
- Yıkanmış insan trombositlerini 2.5 mM kalsiyum (100 μL trombosit süspansiyonunda 0.5 μL stok CaCl2 0.5 M solüsyonu) ile destekleyin.
- Trombositlerin bir fraksiyonunu uyarılmamış halde tutun ve kalan fraksiyonları trombin (0.1 U/mL, 0.25 U/mL veya 0.5 U/mL), konvülksin (20 ng/mL, 50 ng/mL veya 100 ng/mL) veya bunların kombinasyonu ile oda sıcaklığında 15 dakika boyunca uyarın.
- Stimülasyondan sonra, 100 μL uyarılmış trombosit süspansiyonuna AF488 konjuge sığır protrombini (100 μg / mL) ve 1 μL PE-Annexin V ve APC anti-insan CD62P antikoru ekleyin.
- Eşit hacimde% 2 formalin ekleyerek trombositleri sabitleyin.
- Sabit trombositleri poli-D-lizin kaplı lameller üzerine peletleyin.
- Lameller, solmaya karşı koruma solüsyonu kullanarak mikroskopi slaytlarına monte edin.
- Alternatif olarak, lamelleri nemli bir odada 1 saat boyunca kollajen (100 μg/mL) ile kaplayın.
- Kaplanmış lamellerin PBS'de %0,5 BSA ile 1 saat süreyle bloke edilmesi.
- Trombositleri AF488 konjuge sığır protrombini (100 μg / mL) ve her biri 1 μL PE-Annexin V ve APC anti-insan CD62P antikoru ile işaretleyin.
- Etiketli trombositlerin kollajen kaplı lameller üzerine 20 dakika yapışmasına izin verin.
- Yapışık trombositli lamelleri PBS ile üç kez yıkayın.
- Lamelleri 1 saat boyunca% 2 paraformaldehit ile sabitleyin.
- Lameller, solmaya karşı koruma solüsyonu kullanarak mikroskopi slaytlarına monte edin.
- Slaytları konfokal mikroskop altında 63× objektif büyütmede gözlemleyin.
- Floresan ölçümü için Fiji yazılımını kullanarak görüntüleri analiz edin.
8. Pıhtı bazlı trombosit fosfolipid bağımlı trombin oluşturma testi
- Yıkanmış insan trombositlerini 2.5 mM kalsiyum (100 μL trombosit süspansiyonunda 0.5 μL stok CaCl2 0.5 M solüsyon) ile destekleyin.
- Trombositlerin bir fraksiyonunu uyarılmamış halde tutun ve kalan fraksiyonları trombin (0.1 U/mL, 0.25 U/mL veya 0.5 U/mL), konvülksin (20 ng/mL, 50 ng/mL veya 100 ng/mL) veya bunların kombinasyonu ile oda sıcaklığında 15 dakika boyunca uyarın.
- 37 ° C'de 5 dakika önceden inkübe edilmiş 50 μL havuzlanmış normal plazma ve 50 μL düşük bulanıklıklı kaolin çözeltisi (20 mg / mL) karışımına 100 μL tedavi edilmiş trombosit ekleyin.
- Karışıma 5 mMCaCl2 ekleyin.
- Pıhtı oluşumunu bir mikroplaka okuyucuda türbidimetri ile izleyin, 1 saat boyunca her 60 saniyede bir 660 nm'de absorbansı ölçün.
Sonuçlar
Aktive edilmiş trombositlerin bir kısmı, hem fosfatidilserin (PS) hem de P-selektin'in yüzey ekspresyonunda karakteristik bir artışla "prokoagülan" hale gelir, bu da onları sadece PS maruziyeti için pozitif olan "apoptotik" trombositlerden ve P-selektin ekspresyonu için pozitif olan "proagregatör" trombositlerden ayırır. Trombinin, sırasıyla FITC-anti-CD62P antikoru ve PE-Annexin V'nin bağlanmasıyla tespit edildiği gibi, hem P-selektin hem de PS ekspresyonu için pozitif olan prokoagülan trombositlerin oranında doza bağlı bir artışa neden olduğunu bulduk (Şekil 2). Prokoagülan trombositlerin üretimi, agonist kaynaklı sitozolik kalsiyum yükselmeleri üzerine iç mitokondriyal membran boyunca elektrokimyasal gradyan boyunca mitokondriyal kalsiyum akışına18,19 ve bunun sonucunda siklofilin D (CypD) bağımlı mitokondriyal geçirgenlik geçiş gözeneği (mPTP) oluşumunabağlıdır 20. Tutarlı olarak, prokoagülan aktivitede trombinin neden olduğu artış, sırasıyla Rhod-2 ve Mitotracker Red boyaları kullanılarak ölçüldüğü gibi mitokondriyal kalsiyumda bir artış (Şekil 3) ve mitokondriyal membran potansiyelinde bir düşüş (Şekil 4) ile ilişkilendirilmiştir. Uyarılmış trombositler, Bax/Bak birikimi21,22; bunun kaspaz23,24'ü aktive edip etmediği ve PS maruziyetine25 katkıda bulunup bulunmadığı tartışmalıdır. Trombositlerin trombin stimülasyonu, sırasıyla FITC-IETD-FMK ve apoptoz saptama reaktifi ile analiz edildiği gibi, kaspaz 8'in aktivasyonu ile ilişkiliydi, ancak terminal kaspazlar 3 ve 7'nin aktivasyonu ile ilişkili değildi (Şekil 5).

Şekil 1: Prokoagülan trombositlerin analizi. Sırasıyla integrin aktivasyonunu, P-selektin ekspresyonunu ve PS maruziyetini tespit etmek için floresan problar olarak FITC-PAC1, APC-anti-CD62P antikorları ve PE-Annexin V kullanılarak akış sitometrisi ile prokoagülan trombositlerin analizini gösteren şematik diyagram. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
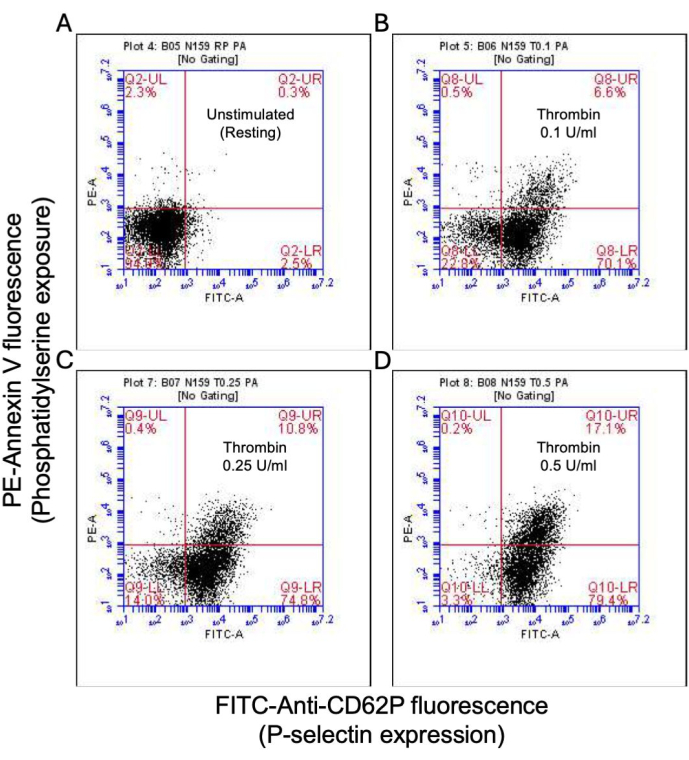
Şekil 2: Trombin stimülasyonu üzerine trombositlerde P-selektin ekspresyonu ve fosfatidilserin maruziyeti. (A) uyarılmamış trombositlerde P-selektin ekspresyonu ve / veya PS maruziyeti için pozitif trombositleri ve (B) 0.1 U / mL, (C) 0.25 U / mL ve (D) 0.5 U / mL dozlarında trombine maruz kalındığında gösteren temsili nokta grafikleri FITC-anti-CD62P ve akış sitometrisi kullanılarak PE-Annexin V floresan ile tespit edildiği gibi. Parantez içindeki şekiller, grafiğin her çeyreğindeki toplam trombositlerin oranını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
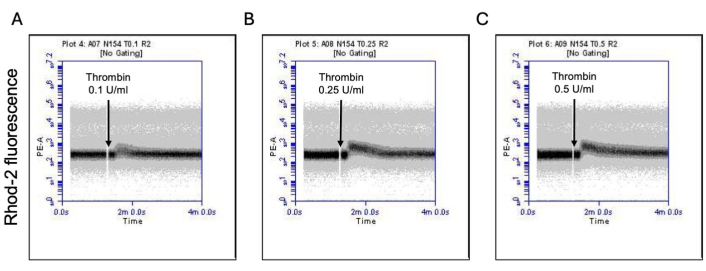
Şekil 3: Trombin maruziyeti üzerine trombositlerdeki mitokondriyal kalsiyum seviyelerinde zamana bağlı değişiklikler. Akış sitometrisi ile tespit edildiği gibi (A) 0.1 U / mL, (B) 0.25 U / mL ve (C) 0.5 U / mL dozlarında trombine maruz kaldıklarında trombositlerde mitokondriyal kalsiyum seviyelerini gösteren Rhod-2 boyasına bağlı floresansta zamana bağlı değişiklikleri gösteren temsili yoğunluk grafikleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
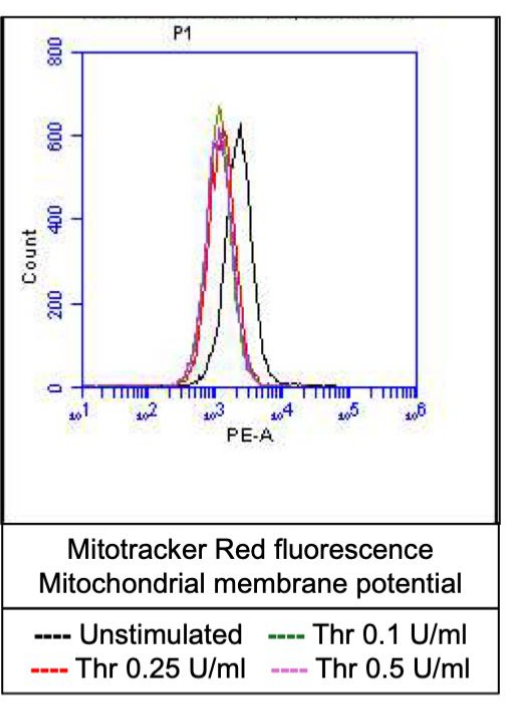
Şekil 4: Trombin stimülasyonu üzerine trombositlerde mitokondriyal membran potansiyeli. Bu şekil, akış sitometrisi ile tespit edildiği gibi, farklı trombin dozlarına maruz kalındığında trombositlerde mitokondriyal membran potansiyelini gösteren, mitokondri etiketleme boyasına bağlı floresanı gösteren temsili histogram kaplamalarını göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
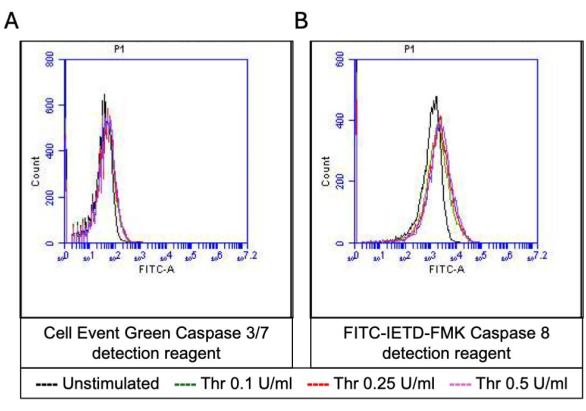
Şekil 5: Trombin stimülasyonu üzerine trombositlerde kaspaz 3/7 ve kaspaz 8 aktiviteleri. Akış sitometrisi ile tespit edildiği gibi farklı trombin dozlarına maruz kalındığında trombositlerde kaspaz 3/7 ve kaspaz 8 aktivitelerini gösteren, sırasıyla (A) apoptoz tespit reaktifi ve (B) FITC-IETD-FMK'ya bağlı floresan gösteren temsili histogram kaplamaları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Işaretleyici | Prokoagülan Trombositler | Proagregatör trombositler | Apoptotik trombositler |
| Integrin aktivasyonu (PAC1 bağlama) | Hayır | Evet | Hayır |
| Granül salgısı | Evet | Evet | Hayır |
| (P-selektin ifadesi) | |||
| PS maruziyeti | Evet | Hayır | Evet |
| (Ek V ciltli) |
Tablo 1: Stimülasyondan sonra trombosit popülasyonlarını tanımlamak için akış sitometrisi belirteçleri. Bu tablo, trombin ve konvülksin gibi güçlü agonistlerle trombositlerin uyarılmasından sonra ortaya çıkan farklı trombosit popülasyonlarını tespit etmek için kullanılan akış sitometrisi belirteçlerini göstermektedir.
Tartışmalar
Prokoagülan trombositler, stimülasyon26 üzerine hücre içi kalsiyumda belirgin ve sürekli artışlar gösterir, ancak farklı mekanizmalar yoluyla türetilebilir. Agonist kaynaklı sitozolik kalsiyum yükselmeleri üzerine iç mitokondriyal membran boyunca elektrokimyasal gradyan boyunca en belirgin mitokondriyal kalsiyum akışı18,19 dahil olmak üzere farklı aracılar yoluyla kollajen ve trombin ile güçlü agonist stimülasyonu üzerine üretilirler. Mitokondriyal kalsiyum belirli bir eşiğe ulaştığında, siklofilin D (CypD) bağımlı bir şekilde mitokondriyal geçirgenlik geçiş gözeneği (mPTP) oluşumunu aktive eder20. Mitokondri kalsiyuma geçirgen hale geldiğinde ve artık sitozolik kalsiyum için lavabo görevi göremediğinde, mPTP oluşumundan sonra supramaksimal kalsiyum sinyali gözlenir26. Sürekli yüksek sitozolik kalsiyum seviyeleri, sırayla, kalsiyuma bağımlı fosfolipid scramblase TMEM16F aktivasyonunu aktive ederek PS maruziyetineyol açar 27,28. PS maruziyetine, integrin αIIbβ3'ün, integrin β3 sitoplazmik kuyruğunun kalpain'e bağlı bölünmesinin yanı sıra TMEM16F bağımlı fosfolipidin kendini karıştırmasını içeren ikili bir mekanizma ile inaktivasyonu eşlik eder29,30. Bu nedenle, prokoagülan trombositler, proagregatör trombositlerin aksine, aktif olmayan bir integrine sahiptir. Ek olarak, PS maruziyeti, pıhtılaşma faktörlerinin bağlanması için bir yüzey sağlar, tenaz ve protrombinaz komplekslerinin3 montajını kolaylaştırır. Prokoagülan trombositler böylece pıhtılaşmayı önemli ölçüde hızlandırır4.
PS maruziyeti ve bunun sonucunda ortaya çıkan prokoagülan aktivite, aktivasyondan bağımsız olarak intrinsik apoptoz geçiren trombositlerde kaspaza bağlı scramblase XKR8'in bölünmesi ile de indüklenebilir25,31. Uyarılmış trombositler, Bax/Bak birikimi21,22 dahil olmak üzere intrinsik apoptoz özellikleri sergilese de, bunun kaspaz 23,24'ü aktive edip etmediği ve PS maruziyetine25 katkıda bulunup bulunmadığı tartışmalıdır. Çoğu bileşenin varlığına ve kaspaz 8 aktivasyonu için bazı kanıtlara rağmen trombositlerde TNFα veya FasL ile ekstrinsik apoptozbildirilmemiştir 32. Uzun süreli stimülasyon üzerine trombositler, CypD veya kaspaz33'ten bağımsız olarak PS maruziyetini indüklediği bilinen MLKL aracılı nekrotoz17'ye tabi tutulur.
Bu çalışma, belirteç olarak PS maruziyeti (Annexin V bağlanması), P-selektin (CD62P) ekspresyonu ve integrin αIIbβ3 aktivasyonu (PAC1 bağlanması) kullanılarak prokoagülan trombositleri tespit etmek için bir yöntem sağlamıştır. Bu belirteçler, prokoagülan trombositleri apoptotik ve proagregatör trombositlerden etkili bir şekilde ayırt etmeye yardımcı olabilir15. Bununla birlikte, annexin V bağlanması, ortamda yüksek kalsiyum seviyelerinin varlığını gerektirir. Bu nedenle, trombositten zengin plazma veya tam kan örnekleri kullanılırken heparin veya diğer trombin inhibitörleri kullanılmalıdır. Ayrıca, fibrin polimerizasyon inhibitörü GPRP, bu örneklerle agonistlerden biri olarak trombin kullanılması gerektiğinde kullanılır34,35. Laktaherin veya GSAO, Annexin V'e alternatif belirteçler olarak kullanılabilir, ancak kendi sınırlamaları vardır. Laktadherin PS'ye özgü değildir ve integrinleri36,37 bağlarken, GSAO ticari olarak mevcut değildir ve yalnızca araştırma işbirliği38 yoluyla elde edilebilir.
Bu makale ayrıca mitokondriyal kalsiyum akışı ve mitokondriyal geçirgenlik geçiş gözeneği oluşumu (mitokondriyal membran potansiyeli kaybı) dahil olmak üzere PS'ye maruz kalma mekanizmalarını araştırmak için ek yöntemler sağlamıştır. Burada, bu yöntemlerin Fluo-4 ve Fluo-5N boyaları kullanılarak sitozolik kalsiyum ölçümleri ile tamamlanabileceğine dikkat edilmelidir. Kaspaz aktivasyonunun uyarılmış trombositlerde PS maruziyetine katkıda bulunup bulunmadığı belirsizliğini koruduğundan, kaspaz 8 ve kaspaz 3/7 aktivasyon testleri için protokolleri de numaralandırıyoruz. Trombositlerin gerçek "prokoagülan" doğası ancak pıhtılaşma faktörlerini bağlama ve trombin oluşumunu teşvik etme yetenekleri ile doğrulanabilir. Bu nedenle, PS maruziyeti (Ek V bağlanması), P-selektin (CD62P) ekspresyonu ve integrin αIIbβ3 aktivasyonu (PAC1 bağlanması), mitokondriyal kalsiyum akışı, mitokondriyal membran potansiyeli, kaspaz aktivitesi ile birlikte pıhtılaşma faktörü (protrombin) bağlanması ve bu makalede açıklandığı gibi trombosit fosfolipidine bağımlı trombin üretimi/pıhtılaşması için trombositlerin kapsamlı bir çalışması, prokoagülan trombositlerin kapsamlı bir analizi için gerekli ve yeterli olacaktır.
Açıklamalar
Yazarların ifşa etmek için rekabet eden çıkarları yoktur.
Teşekkürler
Paresh P. Kulkarni ve Keith R. McCrae, sırasıyla, VeloSano, Cleveland Clinic Foundation tarafından finanse edilen Fellow ve Pilot hibe ödüllerini kabul etti.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
Referanslar
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır