Method Article
Análise abrangente de plaquetas pró-coagulantes exibindo características de necrose, apoptose e ativação plaquetária
Neste Artigo
Resumo
O presente protocolo fornece um conjunto abrangente de procedimentos necessários para analisar plaquetas pró-coagulantes, que exibem características sobrepostas de necrose, apoptose e ativação plaquetária.
Resumo
As plaquetas que circulam na corrente sanguínea são relativamente quiescentes, mas tornam-se "ativadas" ao encontrar estimulantes ou "agonistas" no local da lesão do vaso sanguíneo. As plaquetas pró-agregatórias e pró-coagulantes representam duas populações distintas de plaquetas ativadas. Enquanto as plaquetas pró-agregatórias facilitam a cessação do sangramento, ou "hemostasia", formando um tampão de plaquetas agrupadas através de pontes de fibrinogênio, as plaquetas pró-coagulantes aceleram drasticamente a cascata de coagulação, culminando na formação de coágulos de fibrina. Um aspecto interessante das plaquetas pró-coagulantes é que sua morfologia exibe certas características de "necrose" e "apoptose". Podem, portanto, representar uma forma de morte celular nas plaquetas, embora com um papel importante na trombose e hemostasia. Este artigo apresenta o conceito de plaquetas pró-coagulantes, sua relevância para a saúde e a doença e uma comparação dos métodos existentes para sua análise. Em seguida, fornece protocolos abrangentes para analisar plaquetas pró-coagulantes, investigar os mecanismos de sua formação e avaliar seu papel pró-trombótico na facilitação da coagulação. O artigo termina com uma discussão das principais etapas, limitações e princípios de solução de problemas para os métodos descritos.
Introdução
Existem pelo menos duas populações distintas de plaquetas ativadas 1,2. As plaquetas pró-agregatórias são caracterizadas por alta ativação de integrina e baixa, se houver, exposição ao PS. Por outro lado, as plaquetas pró-coagulantes são caracterizadas por baixa atividade de integrina e alta exposição ao PS 1,2, fornecendo uma superfície para a montagem de complexos tenase e protrombinase3, que é 105-10 6 vezes e 300000 vezes mais ativo do que os fatores IXa e Xa da fase solúvel individual, respectivamente4. As plaquetas pró-coagulantes, portanto, aceleram drasticamente a coagulação. Um aspecto interessante das plaquetas pró-coagulantes é que sua morfologia se assemelha a certas características de "necrose", como microvesiculação, balonamento da célula com ruptura do citoesqueleto e perda da integridade da membrana, bem como as de "apoptose", como perda de assimetria de fosfolipídios de membrana com exposição de fosfatidilserina no folheto externo 5,6. Em outras palavras, a formação de plaquetas pró-coagulantes pode representar uma forma de morte celular nas plaquetas, embora com uma função fisiológica importante na hemostasia.
As plaquetas pró-coagulantes estão significativamente associadas a distúrbios trombóticos. Embora a maioria dos indivíduos saudáveis não tenha plaquetas pró-coagulantes circulantes, ~ 30% das plaquetas normais de doadores adotam um fenótipo pró-coagulante ex vivo após a exposição a agonistas fortes, como trombina e colágeno7. Plaquetas pró-coagulantes circulantes têm sido relatadas em traumas, onde sua formação pode refletir a ativação pela histona H4 8,9. Na maioria dos distúrbios pró-trombóticos, no entanto, níveis aumentados de plaquetas pró-coagulantes só são detectados após estimulação ex vivo 10. Por exemplo, pacientes com AVC agudo nos quais >51,1% de suas plaquetas foram convertidas em plaquetas pró-coagulantes (também conhecidas como plaquetas COATed) por colágeno e trombina tiveram uma taxa de risco de 10,72 para AVC recorrente em 30 dias em comparação com pacientes com menor formação de plaquetas pró-coagulantes11. Resultados semelhantes foram relatados em pacientes com ataques isquêmicos transitórios e aterosclerose carotídea12. Em contraste, o distúrbio hemorrágico da síndrome de Scott resulta de uma mutação do ANO6, que codifica o fosfolipídio scramblase TMEM-16F, levando à exposição deficiente à PS plaquetária13. Distúrbios hemorrágicos idiopáticos e sangramento intracraniano podem estar associados a uma diminuição da capacidade de gerar plaquetas pró-coagulantes14.
Assim, a avaliação de plaquetas pró-coagulantes faz parte de qualquer análise da função plaquetária, não apenas durante investigações básicas sobre mecanismos de ativação plaquetária e consequente trombose e hemostasia, mas também durante a análise clínica de risco de trombose ou sangramento em pacientes durante vários estados patológicos. Um painel da Sociedade Internacional de Trombose e Hemostasia (ISTH) recomendou o uso da ligação da anexina V e da expressão da P-selectina por citometria de fluxo para distinguir pró-coagulantes de outras subpopulações plaquetárias15. O artigo também discute os vários métodos que podem ser usados para analisar plaquetas pró-coagulantes e apoptóticas, mas fica aquém de descrever os processos em detalhes. Esses métodos incluem a detecção de (1) ativação plaquetária por PAC1 / JonA ou ligação ao fibrinogênio (citometria de fluxo); (2) secreção de grânulos alfa pela expressão de P-selectina (citometria de fluxo); (3) Exposição ao PS por ligação de anexina V/lactaderina (citometria de fluxo); (4) perda da integridade da membrana por marcação GSAO (citometria de fluxo); (5) alterações morfológicas como balonismo (microscopia); (6) detecção de ativação de caspase por ensaio de caspase (immunoblotting/luminometria/citometria de fluxo) ou degradação do substrato do citoesqueleto gelsolin (immunoblotting); (7) perda do potencial da membrana mitocondrial por corantes sensíveis ao potencial mitocondrial, como JC-1 / Mitotracker (citometria de fluxo); (8) marcadores apoptóticos intrínsecos mitocondriais Bax, Bak e liberação do citocromo c (immunoblotting); (9) função pró-coagulante por ensaio de geração de trombina e ligação do fator de coagulação Xa/Va (citometria de fluxo, microscopia); (10) aumento de cálcio citosólico e mitocondrial por corantes fluorescentes sensíveis ao cálcio (citometria de fluxo, fluorometria, microscopia).
O presente estudo investiga protocolos abrangentes para a análise de plaquetas pró-coagulantes, bem como as distingue das plaquetas pró-agregatórias e apoptóticas. A maioria dos procedimentos descritos depende da citometria de fluxo que tem as vantagens de (1) estar prontamente disponível e fácil de usar, (2) exigir baixo volume de amostra e (3) permitir a detecção simultânea de múltiplas subpopulações de plaquetas (pró-agregatória, pró-coagulante e apoptótica)15. Esses protocolos baseados em citometria de fluxo são complementados com ensaios funcionais de atividade pró-coagulante baseados na ligação do fator de coagulação e ensaios de geração de trombina baseados em coágulos.
Protocolo
Os participantes humanos foram recrutados no estudo para amostragem de sangue venoso periférico após obter o consentimento informado por escrito, seguindo rigorosamente as recomendações e aprovação do Conselho de Revisão Institucional do Cleveland Clinic Lerner Research Institute, com todas as metodologias de estudo em conformidade com os padrões estabelecidos pela Declaração de Helsinque. Foram incluídos participantes adultos saudáveis acima de 18 anos, enquanto aqueles com menos de 18 anos, indivíduos com história recente de eventos trombóticos nos últimos seis meses, aqueles com história de alcoolismo ou abuso de drogas e participantes que usaram medicamentos antiplaquetários ou anticoagulantes nas últimas quatro semanas foram excluídos. Uma descrição detalhada dos materiais e reagentes usados nos protocolos pode ser encontrada na Tabela de Materiais.
1. Preparação de plaquetas
- Coletar amostras de sangue venoso periférico em anticoagulante ACD (1:9 v/v) de participantes humanos após obter o consentimento informado por escrito, seguindo rigorosamente as recomendações aprovadas pelo Conselho de Revisão Institucional.
- Centrifugue o sangue coletado na ACD a 100 x g por 20 min a 22 ° C para obter plasma rico em plaquetas (PRP) como sobrenadante.
- Centrifugar o PRP a 800 x g durante 7 min a 22 °C após adicionar 3 μM de PGE1 e 2 mM de EDTA.
- Rejeitar o sobrenadante e ressuspender o sedimento de plaquetas no tampão A (ver Tabela de Materiais) pipetando suavemente.
- Centrifugue as plaquetas ressuspensas no tampão A a 800 x g durante 7 min a 22 °C.
- Ressuspenda o sedimento de plaquetas no tampão B (consulte a Tabela de Materiais) pipetando suavemente.
- Ajuste a contagem final de plaquetas para 1 × 107/mL usando um contador de células automatizado.
NOTA: Execute todas as etapas em condições estéreis e tome precauções para manter as plaquetas em estado de repouso, evitando a exposição a cisalhamento excessivo durante a pipetagem.
2. Análise de plaquetas pró-coagulantes por citometria de fluxo
- Suplemente as plaquetas humanas lavadas com 2,5 mM de cálcio (0,5 μL de solução estoque de CaCl2 0,5 M em 100 μL de suspensão plaquetária).
- Mantenha uma fração de plaquetas não estimulada e estimule as frações restantes com trombina (0,1 U / mL, 0,25 U / mL, 0,5 U / mL), convulxina (20 ng / mL, 50 ng / mL, 100 ng / mL) ou sua combinação por 15 min à temperatura ambiente.
- Após a estimulação, adicione 1 μL de PE-anexina V, FITC-PAC1 e anticorpo APC-anti-CD62P humano a 100 μL de suspensões plaquetárias estimuladas.
- Incube as plaquetas no escuro em temperatura ambiente por 30 min.
- Fixe as plaquetas adicionando um volume igual (1:1) de formalina a 2%.
- Analisar as amostras por citometria de fluxo para quantificar as plaquetas pró-coagulantes15,16.
- Desenhe uma porta amorfa para abranger as plaquetas, separando-as do ruído e das partículas de múltiplas plaquetas.
- Colete todos os dados de fluorescência usando amplificação logarítmica de quatro quadrantes para 10.000 eventos na porta de plaquetas de cada amostra.
- Defina regiões para plaquetas com base na positividade ou negatividade de fluorescência para exposição à fosfatidilserina (PS) (ligação da Anexina V), expressão de P-selectina (CD62P) e ativação da integrina αIIbβ3 (ligação de PAC1).
- Considere as plaquetas positivas para a exposição ao PS (ligação da anexina V) e expressão da P-selectina (CD62P), mas negativas para a ativação da integrina αIIbβ3 (ligação do PAC1) como plaquetas pró-coagulantes (Figura 1) (Tabela 1).
- Da mesma forma, considere as plaquetas positivas para a ativação da integrina αIIbβ3 (ligação de PAC1) e expressão de P-selectina (CD62P), mas negativas para exposição a PS (ligação de anexina V) como plaquetas pró-agregatórias.
NOTA: Plaquetas negativas para ativação da integrina αIIbβ3 (ligação de PAC1) e expressão de P-selectina (CD62P), mas positivas para exposição a PS (ligação de anexina V) são provavelmente plaquetas apoptóticas15,16.
3. Análise do cálcio mitocondrial por citometria de fluxo
- Diluir as plaquetas humanas lavadas a 1 × 106 / mL e suplementar com 2,5 mM de cálcio (0,5 μL de solução estoque de CaCl2 0,5 M em suspensão plaquetária de 100 μL).
- Rotule as plaquetas com 5 μM de Rhod-2 AM (para cálcio mitocondrial) por 30 min no escuro.
- Plaquetas de porta adequadamente, conforme descrito na etapa 2.
- Analise eventos na porta plaquetária para alterações dependentes do tempo na fluorescência média de eventos adquiridos ao longo de 5 minutos usando um gráfico de dispersão de densidade de fluorescência PE (para Rhod-2 AM) versus tempo.
- Registre os níveis basais de cálcio nos primeiros 1 min.
- Adicione trombina (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), convulxina (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou sua combinação e continue adquirindo dados por mais 4 min17.
4. Análise do potencial de membrana mitocondrial por citometria de fluxo
- Suplemente as plaquetas humanas lavadas com 2,5 mM de cálcio (0,5 μL de solução estoque de CaCl2 0,5 M em 100 μL de suspensão plaquetária).
- Mantenha uma fração de plaquetas não estimulada e estimule as frações restantes com trombina (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), convulxina (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou sua combinação por 15 min em temperatura ambiente.
- Após a estimulação, adicione corante de marcação de mitocôndrias (ver Tabela de Materiais) a uma concentração final de 500 nM às suspensões de plaquetas estimuladas.
- Incube as plaquetas por 30 min no escuro.
- Fixe as plaquetas adicionando um volume igual de 2% de formalina.
- Analisar amostras por citometria de fluxo17.
- Plaquetas de porta apropriadamente, conforme descrito na etapa 2.
- Analise eventos na porta plaquetária para uma queda na fluorescência no canal PE (para o corante de marcação das mitocôndrias) do citômetro de fluxo.
5. Análise da atividade da caspase 3 e caspase 8 por citometria de fluxo
- Suplemente as plaquetas humanas lavadas com 2,5 mM de cálcio (0,5 μL de solução estoque de CaCl2 0,5 M em 100 μL de suspensão plaquetária).
- Mantenha uma fração de plaquetas não estimulada e estimule as frações restantes com trombina (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), convulxina (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou sua combinação por 15 min em temperatura ambiente.
- Após a estimulação, adicione o reagente de detecção de apoptose 1:1000 (v/v) (ver Tabela de Materiais) (para as vias de apoptose intrínseca e extrínseca) ou 1:300 (v/v) FITC-IETD-FMK (para caspase 8 da via de apoptose extrínseca) às suspensões plaquetárias estimuladas.
- Incube as plaquetas por 30 min no escuro.
- Fixe as plaquetas adicionando um volume igual de 2% de formalina.
- Analisar amostras por citometria de fluxo17.
- Plaquetas de porta adequadamente, conforme descrito na etapa 2.
- Analise os eventos na porta plaquetária quanto à fluorescência no canal FITC (para caspase 3/7 ou caspase 8) do citômetro de fluxo.
6. Análise da ligação à protrombina por citometria de fluxo
- Conjugue a protrombina bovina com o corante Alexa Fluor 488 usando um kit de rotulagem de proteínas (consulte a Tabela de Materiais), seguindo as instruções do fabricante.
- Suplemente as plaquetas humanas lavadas com 2,5 mM de cálcio (0,5 μL de solução estoque de CaCl2 0,5 M em suspensão plaquetária de 100 μL).
- Mantenha uma fração de plaquetas não estimulada e estimule as frações restantes com trombina (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), convulxina (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou sua combinação por 15 min em temperatura ambiente.
- Após a estimulação, adicione protrombina bovina conjugada com AF488 (100 μg / mL) e 1 μL de anticorpo anti-CD62P humano PE-Anexina V e APC a 100 μL de suspensões plaquetárias estimuladas.
- Fixe as plaquetas adicionando um volume igual de 2% de formalina.
- Analisar amostras por citometria de fluxo17 para a quantificação da ligação da protrombina às plaquetas.
- Desenhe uma porta amorfa para abranger plaquetas separadas do ruído e partículas multiplaquetárias.
- Colete todos os dados de fluorescência usando amplificação logarítmica de quatro quadrantes para 10.000 eventos na porta de plaquetas de cada amostra.
- Desenhe regiões para plaquetas com fluorescência positiva ou negativa para exposição PS (ligação da Anexina V), expressão de P-selectina (CD62P) e AF488-protrombina (ligação da protrombina).
- Determine a proporção de todos os eventos plaquetários, bem como a proporção de plaquetas positivas para a exposição ao PS (ligação da anexina V) e expressão da P-selectina (CD62P) (plaquetas pró-coagulantes), que são positivas para ligação à protrombina.
7. Análise da ligação à protrombina por microscopia confocal
- Conjugue a protrombina bovina com o corante Alexa Fluor 488 usando um kit de rotulagem de proteínas (consulte a Tabela de Materiais), seguindo as instruções do fabricante.
- Suplemente as plaquetas humanas lavadas com 2,5 mM de cálcio (0,5 μL de solução estoque de CaCl2 0,5 M em suspensão plaquetária de 100 μL).
- Mantenha uma fração de plaquetas não estimulada e estimule as frações restantes com trombina (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), convulxina (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou sua combinação por 15 min em temperatura ambiente.
- Após a estimulação, adicione protrombina bovina conjugada com AF488 (100 μg / mL) e 1 μL de anticorpo anti-CD62P humano PE-Anexina V e APC a 100 μL de suspensões plaquetárias estimuladas.
- Fixe as plaquetas adicionando um volume igual de 2% de formalina.
- Pulverize as plaquetas fixas em lamínulas revestidas com poli-D-lisina.
- Monte lamínulas em lâminas de microscopia usando uma solução anti-desbotamento.
- Alternativamente, cubra lamínulas com colágeno (100 μg / mL) por 1 h em uma câmara úmida.
- Bloqueie as lamínulas revestidas com 0,5% de BSA em PBS por 1 h.
- Rotule as plaquetas com protrombina bovina conjugada com AF488 (100 μg/mL) e 1 μL de PE-Anexina V e anticorpo anti-CD62P humano APC.
- Deixe as plaquetas marcadas aderirem por 20 min em lamínulas revestidas de colágeno.
- Lave as lamínulas com plaquetas aderentes três vezes com PBS.
- Fixe as lamínulas com paraformaldeído a 2% por 1 h.
- Monte lamínulas em lâminas de microscopia usando uma solução anti-desbotamento.
- Observe as lâminas sob um microscópio confocal com ampliação objetiva de 63×.
- Analise as imagens usando o software Fiji para quantificação de fluorescência.
8. Ensaio de geração de trombina dependente de fosfolipídios plaquetários à base de coágulos
- Suplemente as plaquetas humanas lavadas com 2,5 mM de cálcio (0,5 μL de solução estoque de CaCl2 0,5 M em 100 μL de suspensão plaquetária).
- Mantenha uma fração de plaquetas não estimulada e estimule as frações restantes com trombina (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), convulxina (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou sua combinação por 15 min em temperatura ambiente.
- Adicione 100 μL de plaquetas tratadas a uma mistura de 50 μL de plasma normal combinado e 50 μL de solução de caulim de baixa turbidez (20 mg / mL), pré-incubada a 37 ° C por 5 min.
- Adicione 5 mM de CaCl2 à mistura.
- Monitore a formação de coágulos por turbidimetria em um leitor de microplacas, medindo a absorbância a 660 nm a cada 60 s por 1 h.
Resultados
Uma proporção de plaquetas ativadas torna-se "pró-coagulante" com um aumento característico na expressão superficial de fosfatidilserina (PS) e P-selectina, o que as distingue de plaquetas "apoptóticas" que são positivas apenas para exposição a PS, bem como plaquetas "pró-agregatórias" que são positivas para expressão de P-selectina. Descobrimos que a trombina induz um aumento dose-dependente na proporção de plaquetas pró-coagulantes positivas para a expressão de P-selectina e PS, conforme detectado pela ligação do anticorpo FITC-anti-CD62P e PE-Anexina V, respectivamente (Figura 2). A geração de plaquetas pró-coagulantes depende do influxo de cálcio mitocondrial18,19 ao longo do gradiente eletroquímico através da membrana mitocondrial interna após elevações de cálcio citosólico induzidas por agonistas, bem como a consequente formação de poros de transição de permeabilidade mitocondrial dependente de ciclofilina D (CypD) (mPTP)20. Em consistência, o aumento induzido pela trombina na atividade pró-coagulante foi associado a um aumento no cálcio mitocondrial (Figura 3) e uma queda no potencial da membrana mitocondrial (Figura 4), conforme medido usando os corantes Rhod-2 e Mitotracker Red, respectivamente. As plaquetas estimuladas exibem características de apoptose, incluindo acúmulo de Bax / Bak21,22; se isso ativa a caspase23,24 e contribui para a exposição ao PS25 permanece controverso. A estimulação plaquetária da trombina foi associada à ativação da caspase 8, mas não das caspases terminais 3 e 7 (Figura 5), conforme analisado pelo FITC-IETD-FMK e pelo reagente de detecção de apoptose, respectivamente.

Figura 1: Análise de plaquetas pró-coagulantes. Diagrama esquemático que descreve a análise de plaquetas pró-coagulantes por citometria de fluxo usando anticorpos FITC-PAC1, APC-anti-CD62P e PE-Anexina V como sondas fluorescentes para detectar ativação de integrina, expressão de P-selectina e exposição a PS, respectivamente. Clique aqui para ver uma versão maior desta figura.
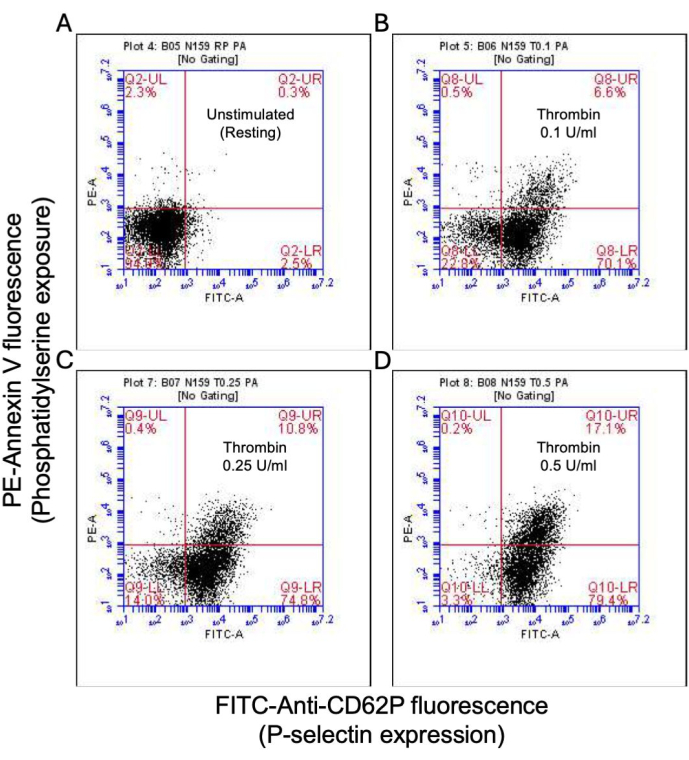
Figura 2: Expressão de P-selectina e exposição à fosfatidilserina em plaquetas após estimulação com trombina. Gráficos de pontos representativos mostrando plaquetas positivas para expressão de P-selectina e/ou exposição a PS em (A) plaquetas não estimuladas e após exposição à trombina em doses de (B) 0,1 U/mL, (C) 0,25 U/mL e (D) 0,5 U/mL conforme detectado por fluorescência FITC-anti-CD62P e PE-Anexina V usando citometria de fluxo. Os números entre parênteses indicam a proporção de plaquetas totais em cada quadrante do gráfico. Clique aqui para ver uma versão maior desta figura.
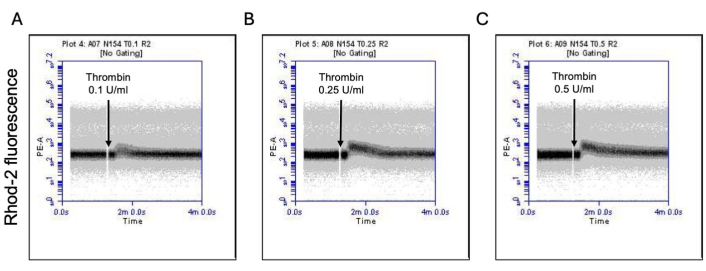
Figura 3: Alterações dependentes do tempo nos níveis de cálcio mitocondrial nas plaquetas após a exposição à trombina. Gráficos de densidade representativos mostrando mudanças dependentes do tempo na fluorescência devido ao corante Rhod-2 indicando os níveis de cálcio mitocondrial nas plaquetas após a exposição à trombina em doses de (A) 0,1 U / mL, (B) 0,25 U / mL e (C) 0,5 U / mL conforme detectado por citometria de fluxo. Clique aqui para ver uma versão maior desta figura.
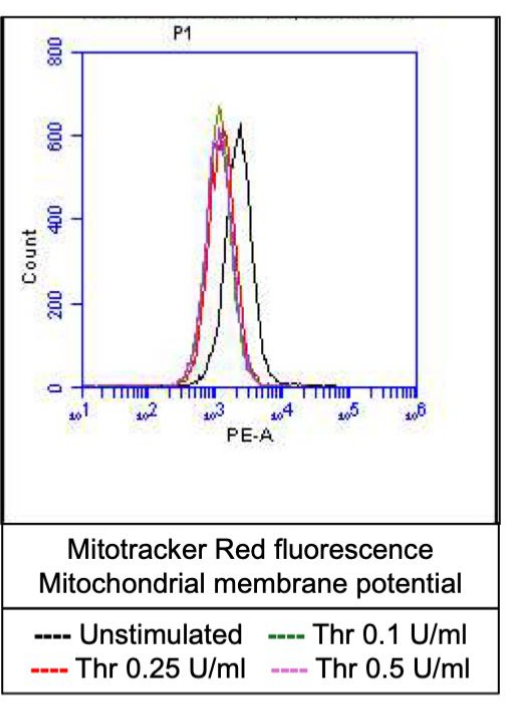
Figura 4: Potencial de membrana mitocondrial em plaquetas após estimulação de trombina. Esta figura mostra sobreposições de histograma representativas representando fluorescência devido ao corante de marcação das mitocôndrias, indicando potencial de membrana mitocondrial nas plaquetas após exposição a diferentes doses de trombina, conforme detectado por citometria de fluxo. Clique aqui para ver uma versão maior desta figura.
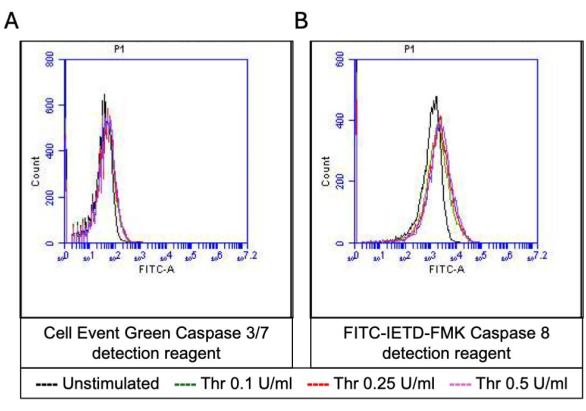
Figura 5: Atividades da caspase 3/7 e da caspase 8 nas plaquetas após a estimulação da trombina. Sobreposições de histograma representativas mostrando fluorescência devido a (A) reagente de detecção de apoptose e (B) FITC-IETD-FMK, respectivamente, indicando atividades de caspase 3/7 e caspase 8 em plaquetas após exposição a diferentes doses de trombina detectadas por citometria de fluxo. Clique aqui para ver uma versão maior desta figura.
| Marcador | Plaquetas Pró-Coagulantes | Plaquetas pró-agregatórias | Plaquetas apoptóticas |
| Ativação da integrina (ligação PAC1) | Não | Sim | Não |
| Secreção de grânulos | Sim | Sim | Não |
| (Expressão P-selectin) | |||
| Exposição PS | Sim | Não | Sim |
| (Anexo V vinculativo) |
Tabela 1: Marcadores de citometria de fluxo para identificação de populações de plaquetas após estimulação. Esta tabela mostra os marcadores de citometria de fluxo usados para detectar populações distintas de plaquetas que emergem após a estimulação de plaquetas com agonistas fortes, como trombina e convulxina.
Discussão
As plaquetas pró-coagulantes demonstram aumentos acentuados e sustentados de cálcio intracelular após a estimulação26, mas podem ser derivados por diferentes mecanismos. Eles são gerados após forte estimulação agonista com colágeno e trombina por meio de mediadores distintos, incluindo o influxo de cálcio mitocondrial mais proeminente18,19 ao longo do gradiente eletroquímico através da membrana mitocondrial interna após elevações de cálcio citosólico induzidas por agonistas. Uma vez que o cálcio mitocondrial atinge um certo limite, ele ativa a formação de poros de transição de permeabilidade mitocondrial (mPTP) de maneira dependente da ciclofilina D (CypD)20. Quando as mitocôndrias são permeabilizadas ao cálcio e não podem mais servir como sumidouros para o cálcio citosólico, a sinalização supramáxima de cálcio é observada após a formação de mPTP26. Os altos níveis sustentados de cálcio citosólico, por sua vez, ativam a ativação do TMEM16F fosfolipídico dependente de cálcio, levando à exposição ao PS 27,28. A exposição ao PS é acompanhada pela inativação da integrina αIIbβ3 por um mecanismo duplo envolvendo clivagem dependente de calpaína da cauda citoplasmática da integrina β3, bem como o próprio embaralhamento de fosfolipídios dependente de TMEM16F 29,30. Assim, as plaquetas pró-coagulantes, ao contrário das plaquetas pró-agregatórias, têm uma integrina inativa. Além disso, a exposição ao PS fornece uma superfície para a ligação dos fatores de coagulação, facilitando a montagem de complexos de tenase e protrombinase3. As plaquetas pró-coagulantes, portanto, aceleram drasticamente a coagulação4.
A exposição ao PS e a consequente atividade pró-coagulante também podem ser induzidas pela clivagem dependente de caspase de scramblase XKR8 em plaquetas submetidas a apoptose intrínseca, independente da ativação25,31. Embora as plaquetas estimuladas exibam características de apoptose intrínseca, incluindo acúmulo de Bax / Bak21,22, se isso ativa a caspase23,24 e contribui para a exposição ao PS25 permanece controverso. A apoptose extrínseca por TNFα ou FasL não foi relatada em plaquetas, apesar da presença da maioria dos componentes e de algumas evidências de ativação da caspase 832. As plaquetas, após estimulação prolongada, sofrem necroptose mediada por MLKL17, que é conhecida por induzir a exposição ao PS independente de CypD ou caspase33.
Este estudo forneceu um método para detectar plaquetas pró-coagulantes usando a exposição ao PS (ligação da Anexina V), a expressão da P-selectina (CD62P) e a ativação da integrina αIIbβ3 (ligação do PAC1) como marcadores. Esses marcadores podem ajudar a distinguir efetivamente as plaquetas pró-coagulantes das plaquetas apoptóticas e pró-agregatórias15. No entanto, a ligação da anexina V requer a presença de altos níveis de cálcio no meio. Portanto, heparina ou outros inibidores da trombina devem ser usados ao usar plasma rico em plaquetas ou amostras de sangue total. Além disso, o inibidor da polimerização da fibrina GPRP é empregado quando a trombina deve ser usada como um dos agonistas com essas amostras34,35. A lactaderina ou o GSAO podem ser usados como marcadores alternativos à anexina V, mas têm suas próprias limitações. Embora a lactaderina não seja específica para PS e se ligue às integrinas36,37, o GSAO não está disponível comercialmente e só pode ser obtido por meio de colaboração em pesquisa38.
Este artigo também forneceu métodos suplementares para investigar os mecanismos de exposição ao PS, incluindo o influxo de cálcio mitocondrial e a formação de poros de transição de permeabilidade mitocondrial (perda do potencial de membrana mitocondrial). Deve-se notar aqui que esses métodos podem ser complementados por medições de cálcio citosólico usando os corantes Fluo-4 e Fluo-5N. Como ainda não está claro se a ativação da caspase contribui para a exposição ao PS em plaquetas estimuladas, também enumeramos protocolos para ensaios de ativação da caspase 8 e caspase 3/7. A verdadeira natureza "pró-coagulante" das plaquetas só pode ser afirmada por sua capacidade de se ligar aos fatores de coagulação e promover a geração de trombina. Assim, um estudo aprofundado das plaquetas para exposição ao PS (ligação à anexina V), expressão de P-selectina (CD62P) e ativação da integrina αIIbβ3 (ligação de PAC1), influxo de cálcio mitocondrial, potencial de membrana mitocondrial, atividade de caspase juntamente com ligação ao fator de coagulação (protrombina) e geração/coagulação de trombina dependente de fosfolipídios plaquetários, conforme descrito no presente artigo, seria necessário e suficiente para uma análise abrangente das plaquetas pró-coagulantes.
Divulgações
Os autores não têm interesses conflitantes a divulgar.
Agradecimentos
Paresh P. Kulkarni e Keith R. McCrae, respectivamente, reconhecem os prêmios de bolsas Fellow e Pilot financiados pela VeloSano, Cleveland Clinic Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
Referências
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados