Method Article
全面分析表现出坏死、细胞凋亡和血小板活化特征的促凝血小板
摘要
本方案提供了一套分析促凝血小板所需的综合程序,这些血小板表现出坏死、细胞凋亡和血小板活化的重叠特征。
摘要
在血液中循环的血小板相对静止,但在血管损伤部位遇到兴奋剂或“激动剂”时被“激活”。促凝血小板和促凝血小板代表活化血小板的两个不同群体。虽然促凝血小板通过纤维蛋白原桥形成聚集在一起的血小板栓子,从而促进出血的停止或“止血”,而促凝血小板会显著加速凝血级联反应,最终形成纤维蛋白凝块。促凝血小板的一个有趣方面是它们的形态表现出“坏死”和“细胞凋亡”的某些特征。因此,它们可能代表血小板中细胞死亡的一种形式,尽管在血栓形成和止血中起重要作用。本文介绍了促凝血小板的概念、它们与健康和疾病的相关性,以及现有分析方法的比较。然后,它提供了分析促凝血小板、研究其形成机制以及评估它们在促进凝血中的促血栓形成作用的综合方案。本文最后讨论了所描述方法的关键步骤、限制和故障排除原则。
引言
活化血小板至少有两种不同的群体 1,2。促聚集血小板的特征是整合素活化率高,PS 暴露量低(如果有)。另一方面,促凝血小板的特征是低整合素活性和高 PS 暴露 1,2,为 tenase 和凝血酶原酶复合物的组装提供了一个表面3,其活性分别比单个可溶期因子 IXa 和 Xa 高 105-10 6 倍和 300000 倍4.因此,促凝血小板会显着加速凝血。促凝血小板的一个有趣方面是,它们的形态类似于“坏死”的某些特征,例如微泡形成、细胞骨架破坏导致细胞气球样变和膜完整性丧失,以及“细胞凋亡”的特征,例如膜磷脂不对称性丧失与外小叶中磷脂酰丝氨酸暴露 5,6.换句话说,促凝血小板的形成可能代表了血小板中细胞死亡的一种形式,尽管在止血中具有重要的生理功能。
促凝血小板与血栓性疾病显著相关。虽然大多数健康个体没有循环促凝血小板,但 ~30% 的正常供体血小板在暴露于凝血酶和胶原蛋白7 等强激动剂后在体外采用促凝表型。在创伤中已有循环促凝血小板的报道,它们的形成可能反映了组蛋白 H4 的激活 8,9。然而,在大多数促血栓形成性疾病中,促凝血小板水平升高仅在离体刺激后检测到10。例如,急性中风患者 >51.1% 的血小板被胶原蛋白和凝血酶转化为促凝血小板(也称为 COATed 血小板),与促凝血小板形成较少的患者相比,30 天内复发性中风的风险比为10.72 11。在短暂性脑缺血发作和颈动脉粥样硬化患者中也报告了类似的结果12。相比之下,出血性疾病 Scott 综合征是由 ANO6 突变引起的,ANO6 编码磷脂扰乱酶 TMEM-16F,导致血小板 PS 暴露不足13。特发性出血性疾病和颅内出血可能与促凝血小板生成能力下降有关14。
因此,评估促凝血小板是血小板功能分析的一部分,不仅在对血小板活化机制和随之而来的血栓形成和止血进行基础调查时,而且在临床分析各种病理状态下患者的血栓形成或出血风险时。国际血栓形成和止血学会 (ISTH) 小组建议通过流式细胞术使用 Annexin V 结合和 P-选择素表达来区分促凝物与其他血小板亚群15。本文还讨论了可用于分析促凝血小板和凋亡血小板的各种方法,但未详细描述这些过程。这些方法包括检测 (1) 通过 PAC1/JonA 或纤维蛋白原结合(流式细胞术)检测血小板活化;(2) 通过 P-选择素表达(流式细胞术)分泌 α 颗粒;(3) Annexin V/乳粘蛋白结合的 PS 暴露(流式细胞术);(4) GSAO 标记(流式细胞术)导致膜完整性丧失;(5) 形态变化,如气球状变(显微镜检查);(6) 通过 caspase 测定(免疫印迹/发光/流式细胞术)检测 caspase 活化或细胞骨架底物凝溶胶蛋白的降解(免疫印迹);(7) 线粒体电位敏感染料(如 JC-1/Mitotracker(流式细胞术))导致线粒体膜电位的丧失;(8) 线粒体内源性凋亡标志物 Bax、Bak 和细胞色素 c 释放(免疫印迹);(9) 凝血酶生成试验和凝血因子 Xa/Va 结合的促凝功能(流式细胞术、显微镜检查);(10) 通过荧光钙敏感染料(流式细胞术、荧光测定、显微镜检查)升高的胞质和线粒体钙。
本研究深入探讨了分析促凝血小板以及将它们与促聚集和凋亡血小板区分开来的综合方案。所描述的大多数程序都依赖于流式细胞术,其优点是 (1) 容易获得且易于使用,(2) 需要低样品量,以及 (3) 允许同时检测多个血小板亚群(促聚集、促凝和凋亡)15。这些基于流式细胞术的方案辅以基于凝血因子结合的促凝血活性功能测定和基于凝块的凝血酶生成测定。
研究方案
在获得书面知情同意后,严格遵循克利夫兰诊所勒纳研究所机构审查委员会的建议和批准,在获得书面知情同意后,招募人类参与者进行外周静脉采血,所有研究方法均符合赫尔辛基宣言设定的标准。包括 18 岁以上的健康成年参与者,而 18 岁以下的参与者、过去六个月内近期有血栓事件史的个体、有酗酒或药物滥用史的个体以及在过去 4 周内使用过抗血小板或抗凝药物的参与者被排除在外。实验步骤中使用的材料和试剂的详细说明可在 材料表中找到。
1. 血小板制备
- 在获得书面知情同意后,严格遵循机构审查委员会批准的建议,将人类参与者的外周静脉血样抽取到 ACD 抗凝剂 (1:9 v/v) 中。
- 将 ACD 中收集的血液在 22 °C 下以 100 x g 离心 20 分钟,以获得富血小板血浆 (PRP) 作为上清液。
- 加入 3 μM PGE1 和 2 mM EDTA 后,在 22 °C 下以 800 x g 离心 PRP 7 分钟。
- 弃去上清液,通过轻轻移液将血小板沉淀重悬于缓冲液 A 中(参见 材料表)。
- 将重悬于缓冲液 A 中的血小板在 22 °C 下以 800 x g 离心 7 分钟。
- 通过轻轻移液将血小板沉淀重悬于缓冲液 B 中(参见 材料表)。
- 使用自动细胞计数器将最终血小板计数调整为 1 × 107/mL。
注:在无菌条件下执行所有步骤,并采取预防措施,避免在移液过程中受到过度剪切,使血小板保持静止状态。
2. 流式细胞术分析促凝血小板
- 用 2.5 mM 钙(0.5 μL CaCl2 储备液,100 μL 血小板悬液中的 0.5 M 溶液)补充洗涤过的人血小板。
- 保持一部分血小板不刺激,并用凝血酶(0.1 U/mL、0.25 U/mL、0.5 U/mL)、混乳素(20 ng/mL、50 ng/mL、100 ng/mL)或它们的组合刺激剩余的部分在室温下 15 分钟。
- 刺激后,将 1 μL PE-Annexin V、FITC-PAC1 和 APC 抗人 CD62P 抗体添加到 100 μL 刺激的血小板悬液中。
- 将血小板在室温下避光孵育 30 分钟。
- 通过添加等体积 (1:1) 的 2% 福尔马林来固定血小板。
- 通过流式细胞术分析样品以定量促凝血小板15,16。
- 绘制一个无定形门以包含血小板,将它们与噪声和多血小板颗粒分开。
- 使用四象限对数扩增收集每个样品血小板门中 10,000 个事件的所有荧光数据。
- 根据磷脂酰丝氨酸 (PS) 暴露(膜联蛋白 V 结合)、P-选择素 (CD62P) 表达和整合素 αIIbβ3 激活(PAC1 结合)的荧光阳性或阴性定义血小板区域。
- 将 PS 暴露(膜联蛋白 V 结合)和 P-选择素 (CD62P) 表达阳性但整合素 αIIbβ3 激活阴性(PAC1 结合)的血小板视为促凝血小板(图 1)(表 1)。
- 同样,将整合素 αIIbβ3 激活(PAC1 结合)和 P-选择素 (CD62P) 表达阳性但 PS 暴露(膜联蛋白 V 结合)阴性的血小板视为促聚集血小板。
注:整合素 αIIbβ3 激活(PAC1 结合)和 P-选择素 (CD62P) 表达阴性但 PS 暴露阳性(膜联蛋白 V 结合)的血小板可能是凋亡血小板15,16。
3. 流式细胞术分析线粒体钙
- 将洗涤过的人血小板稀释至 1 × 106/mL,并补充 2.5 mM 钙(0.5 μL CaCl2 0.5 M 原液,溶于 100 μL 血小板悬液中)。
- 在黑暗中用 5 μM Rhod-2 AM(用于线粒体钙)标记血小板 30 分钟。
- 适当地限制血小板,如步骤 2 中所述。
- 使用 PE 荧光(对于 Rhod-2 AM)与时间的密度散点图,分析血小板门中事件在 5 分钟内获得事件的平均荧光的时间依赖性变化。
- 记录前 1 分钟的基线钙水平。
- 加入凝血酶(0.1 U/mL、0.25 U/mL 或 0.5 U/mL)、凝乳酶(20 ng/mL、50 ng/mL 或 100 ng/mL)或它们的组合,并继续采集数据 4 分钟17。
4. 通过流式细胞术分析线粒体膜电位
- 用 2.5 mM 钙(0.5 μL CaCl2 储备液,100 μL 血小板悬液中的 0.5 M 溶液)补充洗涤过的人血小板。
- 保持一部分血小板不刺激,并用凝血酶(0.1 U/mL、0.25 U/mL 或 0.5 U/mL)、惊厥素(20 ng/mL、50 ng/mL 或 100 ng/mL)或它们的组合刺激剩余的部分在室温下 15 分钟。
- 刺激后,向刺激的血小板悬液中加入终浓度为 500 nM 的线粒体标记染料(参见 材料表)。
- 将血小板在黑暗中孵育 30 分钟。
- 通过加入等体积的 2% 福尔马林来固定血小板。
- 通过流式细胞术分析样品17.
- 如步骤 2 中所述适当地限制血小板。
- 分析血小板门中的事件,了解流式细胞仪的 PE 通道(用于线粒体标记染料)中的荧光下降。
5. 流式细胞术分析 caspase 3 和 caspase 8 活性
- 用 2.5 mM 钙(0.5 μL CaCl2 储备液,100 μL 血小板悬液中的 0.5 M 溶液)补充洗涤过的人血小板。
- 保持一部分血小板不刺激,并用凝血酶(0.1 U/mL、0.25 U/mL 或 0.5 U/mL)、惊厥素(20 ng/mL、50 ng/mL 或 100 ng/mL)或它们的组合刺激剩余的部分在室温下 15 分钟。
- 刺激后,将 1:1000 (v/v) 细胞凋亡检测试剂(参见 材料表)(用于内源性和外源性细胞凋亡途径)或 1:300 (v/v) FITC-IETD-FMK(用于外源性细胞凋亡途径的 caspase 8)添加到刺激的血小板悬液中。
- 将血小板在黑暗中孵育 30 分钟。
- 通过加入等体积的 2% 福尔马林来固定血小板。
- 通过流式细胞术分析样品17.
- 适当地限制血小板,如步骤 2 中所述。
- 分析血小板门中的事件,以检测流式细胞仪的 FITC 通道(对于 caspase 3/7 或 caspase 8)中的荧光。
6. 流式细胞术分析凝血酶原结合
- 按照制造商的说明,使用蛋白质标记试剂盒(参见 材料表)将牛凝血酶原与 Alexa Fluor 488 染料偶联。
- 用 2.5 mM 钙(0.5 μL CaCl2 0.5 M 原液,溶于 100 μL 血小板悬液中)补充洗涤过的人血小板。
- 保持一部分血小板不刺激,并用凝血酶(0.1 U/mL、0.25 U/mL 或 0.5 U/mL)、惊厥素(20 ng/mL、50 ng/mL 或 100 ng/mL)或它们的组合刺激剩余的部分在室温下 15 分钟。
- 刺激后,将 AF488 偶联的牛凝血酶原 (100 μg/mL) 和 1 μL PE-Annexin V 和 APC 抗人 CD62P 抗体添加到 100 μL 刺激的血小板悬液中。
- 通过加入等体积的 2% 福尔马林来固定血小板。
- 通过流式细胞术17 分析样品,以定量凝血酶原与血小板的结合。
- 绘制一个无定形门以包含与噪声和多血小板颗粒分离的血小板。
- 使用四象限对数扩增收集每个样品血小板门中 10,000 个事件的所有荧光数据。
- 绘制 PS 暴露(膜联蛋白 V 结合)、P-选择素 (CD62P) 表达和 AF488-凝血酶原(凝血酶原结合)荧光阳性或阴性的血小板区域。
- 确定所有血小板事件的比例,以及凝血酶原结合呈阳性的 PS 暴露(膜联蛋白 V 结合)和 P-选择素 (CD62P) 表达(促凝血小板)阳性的血小板比例。
7. 通过共聚焦显微镜分析凝血酶原结合
- 按照制造商的说明,使用蛋白质标记试剂盒(参见 材料表)将牛凝血酶原与 Alexa Fluor 488 染料偶联。
- 用 2.5 mM 钙(0.5 μL CaCl2 0.5 M 原液,溶于 100 μL 血小板悬液中)补充洗涤过的人血小板。
- 保持一部分血小板不刺激,并用凝血酶(0.1 U/mL、0.25 U/mL 或 0.5 U/mL)、惊厥素(20 ng/mL、50 ng/mL 或 100 ng/mL)或它们的组合刺激剩余的部分在室温下 15 分钟。
- 刺激后,将 AF488 偶联的牛凝血酶原 (100 μg/mL) 和 1 μL PE-Annexin V 和 APC 抗人 CD62P 抗体添加到 100 μL 刺激的血小板悬液中。
- 通过加入等体积的 2% 福尔马林来固定血小板。
- 将固定的血小板沉淀到聚-D-赖氨酸包被的盖玻片上。
- 使用抗褪色溶液将盖玻片安装在显微镜载玻片上。
- 或者,在潮湿的房间里用胶原蛋白 (100 μg/mL) 涂覆盖玻片 1 小时。
- 用 0.5% BSA 的 PBS 溶液封闭包被的盖玻片 1 小时。
- 用 AF488 偶联的牛凝血酶原 (100 μg/mL) 和 1 μL PE-Annexin V 和 APC 抗人 CD62P 抗体标记血小板。
- 让标记的血小板粘附在胶原包被的盖玻片上 20 分钟。
- 用 PBS 洗涤带有粘附血小板的盖玻片 3 次。
- 用 2% 多聚甲醛固定盖玻片 1 小时。
- 使用抗褪色溶液将盖玻片安装在显微镜载玻片上。
- 在共聚焦显微镜下以 63× 物镜放大倍率观察载玻片。
- 使用 Fiji 软件分析图像以进行荧光定量。
8. 基于凝块的血小板磷脂依赖性凝血酶生成测定
- 用 2.5 mM 钙(0.5 μL CaCl2 储备液,100 μL 血小板悬液中的 0.5 M 溶液)补充洗涤过的人血小板。
- 保持一部分血小板不刺激,并用凝血酶(0.1 U/mL、0.25 U/mL 或 0.5 U/mL)、惊厥素(20 ng/mL、50 ng/mL 或 100 ng/mL)或它们的组合刺激剩余的部分在室温下 15 分钟。
- 将 100 μL 处理过的血小板加入 50 μL 混合正常血浆和 50 μL 低浊度高岭土溶液 (20 mg/mL) 的混合物中,在 37 °C 下预孵育 5 分钟。
- 向混合物中加入 5 mM 的 CaCl2 。
- 通过在酶标仪上进行比浊法监测凝块形成,每 60 秒测量 660 nm 处的吸光度,持续 1 小时。
结果
一部分活化血小板转变为“促凝血”,磷脂酰丝氨酸 (PS) 和 P-选择素的表面表达特征性增加,这使它们与仅 PS 暴露阳性的“凋亡”血小板以及 P-选择素表达阳性的“促聚集”血小板区分开来。我们发现凝血酶诱导促凝血小板的 P-选择素和 PS 表达阳性比例的剂量依赖性增加,分别通过 FITC 抗 CD62P 抗体和 PE-Annexin V 的结合来检测(图 2)。促凝血小板的产生取决于激动剂诱导的胞质溶质钙升高时线粒体钙内流18,19 沿线粒体内膜的电化学梯度,以及随之而来的亲环素 D (CypD) 依赖性线粒体通透性转换孔 (mPTP) 形成20。一致地,凝血酶诱导的促凝血活性增加与线粒体钙的增加(图 3)和线粒体膜电位的下降(图 4)相关,分别使用 Rhod-2 和 Mitotracker Red 染料测量。刺激的血小板表现出细胞凋亡的特征,包括 Bax/Bak 积累21,22;这是否会激活 Caspase23,24 并导致 PS 暴露25 仍存在争议。凝血酶刺激血小板与 caspase 8 的激活相关,但与末端 caspase 3 和 7 无关(图 5),分别通过 FITC-IETD-FMK 和细胞凋亡检测试剂分析。

图 1:促凝血小板分析。 使用 FITC-PAC1、APC 抗 CD62P 抗体和 PE-Annexin V 作为荧光探针,通过流式细胞术分析促凝血小板,分别检测整合素激活、P-选择素表达和 PS 暴露的示意图。 请单击此处查看此图的较大版本。
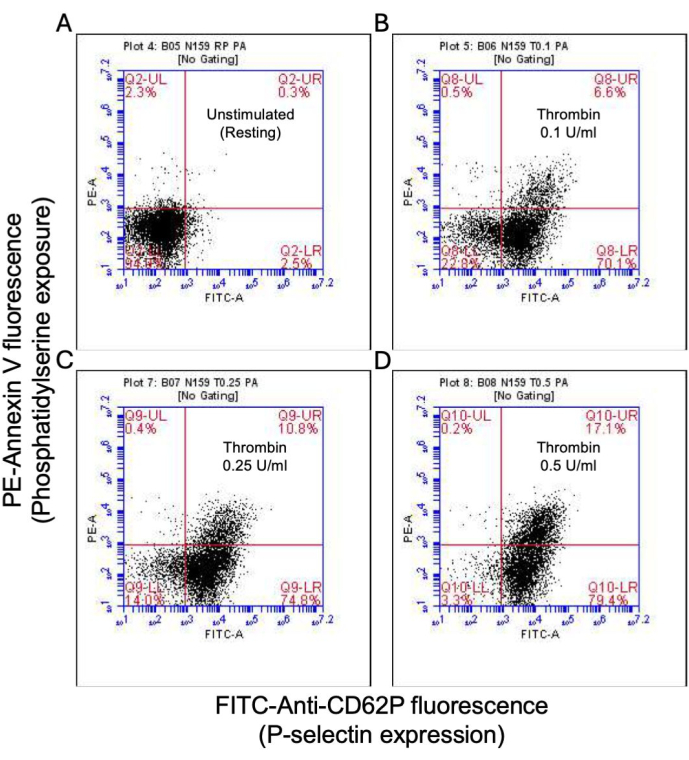
图 2:凝血酶刺激后血小板中的 P-选择素表达和磷脂酰丝氨酸暴露。 代表性点图显示了 (A) 未刺激血小板中 P-选择素表达阳性和/或 PS 暴露,以及暴露于剂量为 (B) 0.1 U/mL、(C) 0.25 U/mL 和 (D) 0.5 U/mL 的凝血酶时血小板,使用 FITC-抗 CD62P 和 PE-Annexin V 荧光检测流式细胞术。括号中的数字表示图的每个象限中总血小板的比例。 请单击此处查看此图的较大版本。
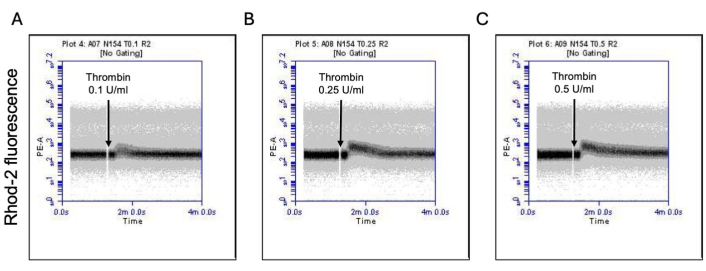
图 3:凝血酶暴露后血小板中线粒体钙水平的时间依赖性变化。 代表性密度图显示了 Rhod-2 染料引起的荧光时间依赖性变化,表明在通过流式细胞术检测到的 (A) 0.1 U/mL、(B) 0.25 U/mL 和 (C) 0.5 U/mL 剂量的凝血酶暴露于血小板中的线粒体钙水平。 请单击此处查看此图的较大版本。
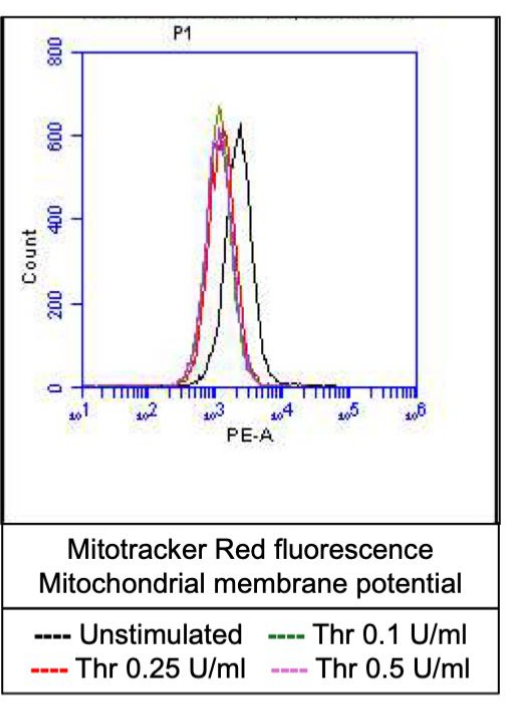
图 4:凝血酶刺激后血小板中的线粒体膜电位。 该图显示了描述线粒体标记染料引起的荧光的代表性直方图叠加,表明通过流式细胞术检测的不同剂量凝血酶暴露时血小板中的线粒体膜电位。 请单击此处查看此图的较大版本。
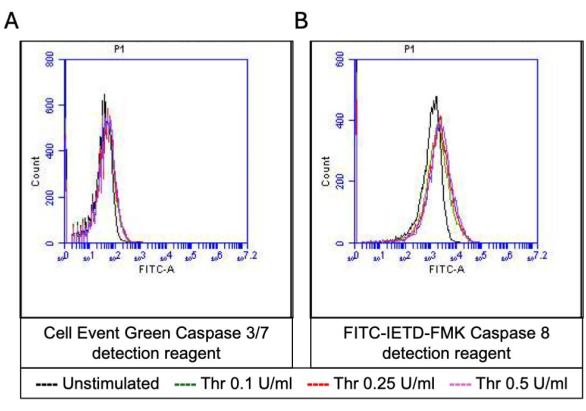
图 5:凝血酶刺激后血小板中的 Caspase 3/7 和 Caspase 8 活性。 代表性直方图叠加显示 (A) 细胞凋亡检测试剂和 (B) FITC-IETD-FMK 引起的荧光,分别表明流式细胞术检测到的不同剂量凝血酶暴露时血小板中的半胱天冬酶 3/7 和半胱天冬酶 8 活性。 请单击此处查看此图的较大版本。
| 标记 | 促凝血小板 | 促聚集血小板 | 凋亡血小板 |
| 整合素激活(PAC1 结合) | 不 | 是的 | 不 |
| 颗粒分泌 | 是的 | 是的 | 不 |
| (P-选择素表达) | |||
| PS 暴露 | 是的 | 不 | 是的 |
| (Annexin V 结合) |
表 1:用于识别刺激后血小板群的流式细胞术标志物。 下表显示了流式细胞术标志物,用于检测用强激动剂(如凝血酶和凝乳酶)刺激血小板后出现的不同血小板群。
讨论
促凝血小板在刺激后表现出细胞内钙的显着和持续增加26,但可能通过不同的机制获得。它们是在胶原蛋白和凝血酶通过不同的介质强烈刺激激动剂后产生的,包括在激动剂诱导的胞质钙升高时,线粒体钙沿线粒体内膜的电化学梯度流入18,19。一旦线粒体钙达到某个阈值,它就会以亲环蛋白 D (CypD) 依赖性方式激活线粒体通透性转换孔 (mPTP) 的形成20。当线粒体透化为钙并且不能再作为胞质钙的汇时,在 mPTP 形成后观察到超最大钙信号传导26。持续高水平的胞质钙反过来会激活钙依赖性磷脂加扰酶TMEM16F激活,导致 PS 暴露27,28。PS 暴露伴随着整合素IIbβ3 α失活,其双重机制涉及整合素 β3 细胞质尾部的钙蛋白酶依赖性裂解以及 TMEM16F 依赖性磷脂扰乱自身29,30。因此,与促凝血小板不同,促凝血小板具有无活性的整合素。此外,PS 暴露为凝血因子的结合提供了一个表面,促进了 tenase 和凝血酶原复合物的组装3。因此,促凝血小板会显着加速凝血4。
PS 暴露和随之而来的促凝血活性也可由经历内源性细胞凋亡的血小板中 caspase 依赖性裂解酶 XKR8 诱导,与激活无关25,31。尽管刺激的血小板表现出内源性细胞凋亡的特征,包括 Bax/Bak 积累21,22,但这是否激活 caspase23,24 并导致 PS 暴露25 仍然存在争议。尽管存在大多数成分并且有一些证据表明 caspase 8 激活,但血小板中尚未报道 TNFα 或 FasL 引起的外源性细胞凋亡32。长时间刺激后的血小板经历 MLKL 介导的坏死性凋亡17,已知这会诱导独立于 CypD 或 caspase33 的 PS 暴露。
本研究提供了一种使用 PS 暴露 (Annexin V 结合)、P-选择素 (CD62P) 表达和整合素α IIbβ3 激活 (PAC1 结合) 作为标志物检测促凝血小板的方法。这些标志物有助于有效区分促凝血小板与凋亡和促聚集血小板15。然而,膜联蛋白 V 结合需要培养基中存在高钙水平。因此,在使用富含血小板的血浆或全血样本时,必须使用肝素或其他凝血酶抑制剂。此外,当凝血酶必须用作这些样品的激动剂之一时,采用纤维蛋白聚合抑制剂 GPRP34,35。乳粘附素或 GSAO 可用作膜联蛋白 V 的替代标志物,但它们有其自身的局限性。虽然乳粘蛋白对 PS 不具有特异性并且与整合素结合36,37,但 GSAO 无法在市场上买到,只能通过研究合作获得38。
本文还提供了研究 PS 暴露机制的补充方法,包括线粒体钙内流和线粒体通透性转换孔形成 (线粒体膜电位的丧失)。这里应该注意的是,这些方法可以通过使用 Fluo-4 和 Fluo-5N 染料的胞质钙测量来补充。由于尚不清楚 caspase 激活是否会导致刺激血小板中的 PS 暴露,我们还列举了 caspase 8 和 caspase 3/7 激活测定的方案。血小板真正的“促凝血”性质只能通过它们结合凝血因子和促进凝血酶生成的能力来证实。因此,对血小板的 PS 暴露(膜联蛋白 V 结合)、P-选择素 (CD62P) 表达和整合素αIIbβ3 激活(PAC1 结合)、线粒体钙内流、线粒体膜电位、半胱天冬酶活性以及凝血因子(凝血酶原)结合和血小板磷脂依赖性凝血酶生成/凝血的血小板进行深入研究对于促凝血小板的全面分析将是必要且足够的。
披露声明
作者没有需要披露的利益冲突。
致谢
Paresh P. Kulkarni 和 Keith R. McCrae 分别感谢由克利夫兰诊所基金会 VeloSano 资助的研究员和飞行员赠款。
材料
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
参考文献
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。