Method Article
괴사, 세포사멸 및 혈소판 활성화의 특징을 보이는 Procoagulant Platelets의 포괄적인 분석
요약
본 프로토콜은 괴사, 세포사멸 및 혈소판 활성화의 중복된 특징을 나타내는 procoagulant 혈소판을 분석하는 데 필요한 포괄적인 절차를 제공합니다.
초록
혈류를 순환하는 혈소판은 상대적으로 정지 상태이지만 혈관 손상 부위에서 각성제 또는 "작용제"를 만나면 "활성화"됩니다. Proaggregatory and procoagulant platelets는 활성화된 혈소판의 두 가지 뚜렷한 집단을 나타냅니다. 응집 혈소판은 피브리노겐 다리를 통해 뭉쳐진 혈소판 마개를 형성하여 출혈 또는 "지혈"의 중단을 촉진하는 반면, 응고 혈소판은 응고 폭포를 극적으로 가속화하여 피브린 혈전 형성을 절정에 이릅니다. procoagulant platelets의 흥미로운 측면은 그 형태가 "괴사"와 "apoptosis"의 특정 특징을 나타낸다는 것입니다. 따라서 그들은 혈전증과 지혈에 중요한 역할을 하기는 하지만 혈소판에서 세포 사멸의 한 형태를 나타낼 수 있습니다. 이 기사에서는 procoagulant platelets의 개념, 건강 및 질병과의 관련성, 분석을 위한 기존 방법의 비교를 소개합니다. 그런 다음 응고 혈소판을 분석하고, 형성 메커니즘을 조사하고, 응고를 촉진하는 혈전적 역할을 평가하기 위한 포괄적인 프로토콜을 제공합니다. 이 문서는 설명된 방법에 대한 주요 단계, 제한 사항 및 문제 해결 원칙에 대한 설명으로 마무리됩니다.
서문
활성화된 혈소판에는 적어도 두 개의 뚜렷한 집단이 있습니다 1,2. pro-aggregatory platelets는 높은 인테그린 활성화와 낮은 PS 노출(있는 경우)을 특징으로 합니다. 반면에, procoagulant platelets는 낮은 integrin 활성과 높은 PS 노출 1,2을 특징으로 하며, 개별 용해성 위상 인자 IXa 및 Xa보다 각각 105-10 6배 및 300000배 더 활동적인 tenase 및 prothrombinase 복합체3의 조립을 위한 표면을 제공합니다4. 따라서 Procoagulant 혈소판은 응고를 극적으로 가속화합니다. 응고성 혈소판의 흥미로운 측면은 그 형태가 미세소포화(microvesiculation), 세포골격 파괴로 인한 세포 팽창, 막 무결성 상실과 같은 "괴사(necrosis)"의 특정 특징뿐만 아니라 외부 소엽에 포스파티딜세린(phosphatidylserine)이 노출됨에 따라 막 인지질 비대칭 손실과 같은 "세포사멸(apoptosis)"의 특징과 유사하다는 것입니다 5,6. 즉, procoagulant platelet formation은 지혈에서 중요한 생리적 기능을 가지고 있음에도 불구하고 혈소판에서 세포 사멸의 한 형태를 나타낼 수 있습니다.
Procoagulant 혈소판은 혈전 장애와 유의한 관련이 있습니다. 대부분의 건강한 개인은 순환하는 procoagulant 혈소판을 가지고 있지 않지만, 정상 기증자 혈소판의 ~30%는 트롬빈 및 콜라겐과 같은 강력한 작용제에 노출된 후 생체 내에서 procoagulant 표현형을 채택합니다7. 순환하는 procoagulant 혈소판은 외상에서 보고되었으며, 이들의 형성은 히스톤 H4 8,9에 의한 활성화를 반영할 수 있습니다. 그러나 대부분의 프로혈전성 질환에서 프로응고 혈소판의 수치 증가는 체외 자극 후에만 감지됩니다10. 예를 들어, 콜라겐과 트롬빈에 의해 혈소판의 >51.1%가 응고혈소판(COATed 혈소판이라고도 함)으로 전환된 급성 뇌졸중 환자는 혈소판 형성이 적은 환자에 비해 30일 이내에 뇌졸중이 재발할 위험비가 10.72였다11. 일과성 허혈 발작과 경동맥 죽상동맥경화증 환자에서도 유사한 결과가 보고되었다12. 이와 대조적으로, 출혈 질환인 스콧 증후군(Scott syndrome)은 인지질 스크램블라제 TMEM-16F를 암호화하는 ANO6의 돌연변이로 인해 발생하며, 이로 인해 혈소판 PS 노출이 결핍됩니다13. 특발성 출혈 장애 및 두개내 출혈은 응고성 혈소판 생성 능력 저하와 관련이 있을 수 있다14.
따라서 응고제 혈소판 평가는 혈소판 활성화 및 그에 따른 혈전증 및 지혈의 메커니즘에 대한 기본 조사뿐만 아니라 다양한 병리학적 상태에서 환자의 혈전증 또는 출혈 위험에 대한 임상 분석 중에도 혈소판 기능 분석의 일부입니다. 국제혈전증 및 지혈학회(International Society on Thrombosis and Haemostasis, ISTH) 패널은 다른 혈소판 하위집단과 응고체를 구별하기 위해 유세포분석에 의한 Annexin V binding 및 P-selectin 발현의 사용을 권장했다15. 이 기사는 또한 procoagulant 및 apoptotic 혈소판을 분석하는 데 사용할 수 있는 다양한 방법에 대해 논의하지만 그 과정을 자세히 설명하기에는 부족합니다. 이러한 방법에는 (1) PAC1/JonA 또는 피브리노겐 결합(유세포 분석)에 의한 혈소판 활성화 검출; (2) P-selectin 발현에 의한 알파 과립 분비 (유세포 분석); (3) Annexin V/lactadherin 결합에 의한 PS 노출(유세포 분석); (4) GSAO 라벨링에 의한 멤브레인 무결성 손실(유세포 분석); (5) 풍선 (현미경)과 같은 형태 학적 변화; (6) Caspase Assay(Immunoblotting/Luminometry/Flow Cytometry)에 의한 Caspase 활성화 검출 또는 세포골격 기질 Gelsolin의 분해(Immunoblotting); (7) JC-1/Mitotracker와 같은 미토콘드리아 전위에 민감한 염료에 의한 미토콘드리아 막 전위의 손실(유세포 분석); (8) 미토콘드리아 고유 세포사멸 마커 Bax, Bak 및 시토크롬 c 방출(면역블로팅); (9) 트롬빈 생성 분석 및 응고 인자 Xa/Va 결합에 의한 procoagulant function (유세포 분석, 현미경 검사); (10) 형광 칼슘에 민감한 염료 (유세포 분석, 형광 측정, 현미경 검사)에 의한 세포질 및 미토콘드리아 칼슘 상승.
본 연구는 procoagulant platelets의 분석을 위한 포괄적인 프로토콜과 proaggregatory 및 apoptotic platelets와 구별하기 위한 포괄적인 프로토콜을 탐구합니다. 설명된 대부분의 절차는 (1) 쉽게 구할 수 있고 사용하기 쉽고, (2) 적은 시료 부피가 필요하며, (3) 혈소판의 여러 하위 모집단(proaggregatory, procoagulant 및 apoptotic)을 동시에 검출할 수 있는 이점이 있는 유세포 분석에 의존합니다15. 이러한 유세포 분석 기반 프로토콜은 응고 인자 결합 및 응고 기반 트롬빈 생성 분석을 기반으로 하는 procoagulant 활성의 기능적 분석으로 보완됩니다.
프로토콜
인간 참가자는 헬싱키 선언에서 정한 표준을 준수하는 모든 연구 방법론을 사용하여 Cleveland Clinic Lerner Research Institute의 기관 검토 위원회의 권장 사항 및 승인에 따라 서면 동의서를 얻은 후 말초 정맥혈 샘플링을 위해 연구에 모집되었습니다. 18세 이상의 건강한 성인 참가자가 포함되었으며, 18세 미만, 지난 6개월 동안 혈전증 발병 병력이 있는 개인, 알코올 중독 또는 약물 남용 병력이 있는 사람, 지난 4주 동안 항혈소판제 또는 항응고제를 사용한 참가자는 제외되었습니다. 프로토콜에 사용된 재료 및 시약에 대한 자세한 설명은 Table of Materials에서 확인할 수 있습니다.
1. 혈소판 준비
- 기관 검토 위원회(Institutional Review Board)에서 승인한 권장 사항에 따라 서면 정보에 입각한 동의를 얻은 후 인간 참가자로부터 말초 정맥혈 샘플을 ACD 항응고제(1:9 v/v)로 채취합니다.
- ACD에 수집된 혈액을 100 x g 에서 22°C에서 20분 동안 원심분리하여 상층액으로 혈소판이 풍부한 혈장(PRP)을 얻습니다.
- 3μM의 PGE1과 2mM의 EDTA를 첨가한 후 800 x g에서 22°C에서 7분 동안 PRP를 원심분리합니다.
- 상등액을 버리고 부드러운 피펫팅으로 혈소판 펠릿을 완충액 A( Table of Materials(재료표 참조))에 재현탁합니다.
- 혈소판을 800 x g 의 버퍼 A에 22°C에서 7분 동안 재현탁액으로 원심분리합니다.
- 부드러운 피펫팅으로 혈소판 펠릿을 완충액 B( 재료 표 참조)에 재현탁합니다.
- 자동 세포 계수기를 사용하여 최종 혈소판 수를 1 × 107/mL로 조정합니다.
참고: 멸균 상태에서 모든 단계를 수행하고 피펫팅 중 과도한 전단에 노출되지 않도록 하여 혈소판을 휴지 상태로 유지하기 위한 예방 조치를 취하십시오.
2. 유세포 분석에 의한 procoagulant platelets 분석
- 세척된 인간 혈소판에 2.5mM 칼슘(100μL의 혈소판 현탁액 중 0.5μL의 스톡 CaCl2 0.5M 용액)을 보충합니다.
- 혈소판의 한 분획을 자극하지 않고 나머지 분획을 트롬빈(0.1 U/mL, 0.25 U/mL, 0.5 U/mL), 경련(20 ng/mL, 50 ng/mL, 100 ng/mL) 또는 이들의 조합으로 실온에서 15분 동안 자극합니다.
- 자극 후 100μL의 자극된 혈소판 현탁액에 PE-Annexin V, FITC-PAC1 및 APC-anti-human CD62P 항체를 각각 1μL씩 추가합니다.
- 혈소판을 실온의 어두운 곳에서 30분 동안 배양합니다.
- 2% 포르말린을 동일한 부피(1:1)로 첨가하여 혈소판을 고정합니다.
- procoagulant platelets15,16을 정량화하기 위해 유세포 분석으로 샘플을 분석합니다.
- 혈소판을 둘러싸는 비정질 게이트를 그려 소음과 다중 혈소판 입자로부터 혈소판을 분리합니다.
- 각 샘플의 혈소판 게이트에서 10,000개의 이벤트에 대한 4사분면 로그 증폭을 사용하여 모든 형광 데이터를 수집합니다.
- 포스파티딜세린(PS) 노출(Annexin V 결합), P-selectin(CD62P) 발현 및 integrin αIIbβ3 활성화(PAC1 결합)에 대한 형광 양성 또는 음성성을 기반으로 혈소판 영역을 정의합니다.
- 혈소판은 PS 노출(Annexin V 결합) 및 P-selectin(CD62P) 발현에 모두 양성이지만 procoagulant 혈소판으로 integrin αIIbβ3 활성화(PAC1 결합)에 대해 음성인 경우를 고려하십시오(그림 1)(표 1).
- 마찬가지로, 혈소판은 integrin αIIbβ3 활성화(PAC1 결합) 및 P-selectin(CD62P) 발현에 모두 양성이지만 PS 노출(Annexin V 결합)에 대해서는 음성인 혈소판을 응집 혈소판으로 간주합니다.
참고: integrin αIIbβ3 활성화(PAC1 결합) 및 P-selectin(CD62P) 발현에 대해 음성이지만 PS 노출(Annexin V 결합)에 대해 양성인 혈소판은 세포사멸 혈소판일 가능성이 높습니다15,16.
3. 유세포 분석에 의한 미토콘드리아 칼슘 분석
- 세척된 인간 혈소판을 1 × 106/mL로 희석하고 2.5mM 칼슘(100μL 혈소판 현탁액 중 0.5μL의 원료 CaCl2 0.5M 용액)을 보충합니다.
- 어둠 속에서 30분 동안 혈소판에 5μM Rhod-2 AM(미토콘드리아 칼슘의 경우)을 표시합니다.
- 2단계에서 설명한 대로 혈소판을 적절하게 게이트합니다.
- PE 형광(Rhod-2 AM의 경우) 대 시간의 밀도 산점도를 사용하여 5분 동안 획득된 이벤트의 평균 형광의 시간에 따른 변화에 대한 혈소판 게이트의 이벤트를 분석합니다.
- 처음 1분 동안 기준선 칼슘 수치를 기록합니다.
- 트롬빈(0.1 U/mL, 0.25 U/mL 또는 0.5 U/mL), 콘텅신(20 ng/mL, 50 ng/mL 또는 100 ng/mL) 또는 그 조합을 추가하고 4분 동안 데이터를 계속 수집한다17.
4. 유세포 분석에 의한 미토콘드리아 막 전위 분석
- 세척된 인간 혈소판에 2.5mM 칼슘(100μL의 혈소판 현탁액 중 0.5μL의 스톡 CaCl2 0.5M 용액)을 보충합니다.
- 혈소판의 한 분획을 자극하지 않고 나머지 분획을 트롬빈(0.1 U/mL, 0.25 U/mL 또는 0.5 U/mL), 경련(20 ng/mL, 50 ng/mL 또는 100 ng/mL) 또는 이들의 조합으로 실온에서 15분 동안 자극합니다.
- 자극 후, 미토콘드리아 표지 염료( 재료 표 참조)를 최종 농도 500nM로 자극된 혈소판 현탁액에 추가합니다.
- 어둠 속에서 30분 동안 혈소판을 배양합니다.
- 2% 포르말린을 같은 부피로 첨가하여 혈소판을 고정합니다.
- 유세포 분석법으로 시료 분석17.
- 2단계에서 설명한 대로 혈소판을 적절하게 게이트합니다.
- 유세포분석기의 PE 채널(미토콘드리아 라벨링 염료의 경우)에서 형광 저하에 대한 혈소판 게이트의 이벤트를 분석합니다.
5. 유세포 분석에 의한 caspase 3 및 caspase 8 활성 분석
- 세척된 인간 혈소판에 2.5mM 칼슘(100μL의 혈소판 현탁액 중 0.5μL의 스톡 CaCl2 0.5M 용액)을 보충합니다.
- 혈소판의 한 분획을 자극하지 않고 나머지 분획을 트롬빈(0.1 U/mL, 0.25 U/mL 또는 0.5 U/mL), 경련(20 ng/mL, 50 ng/mL 또는 100 ng/mL) 또는 이들의 조합으로 실온에서 15분 동안 자극합니다.
- 자극 후, 1:1000 (v/v) 세포사멸 검출 시약( Table of Materials) (내인성 및 외인성 세포사멸 경로 모두) 또는 1:300 (v/v) FITC-IETD-FMK (외인성 세포사멸 경로의 caspase 8)을 자극된 혈소판 현탁액에 첨가합니다.
- 어둠 속에서 30분 동안 혈소판을 배양합니다.
- 2% 포르말린을 같은 부피로 첨가하여 혈소판을 고정합니다.
- 유세포 분석법으로 시료 분석17.
- 2단계에서 설명한 대로 혈소판을 적절하게 게이트합니다.
- 유세포분석기의 FITC 채널(caspase 3/7 또는 caspase 8의 경우)에서 형광에 대한 혈소판 게이트의 이벤트를 분석합니다.
6. 유세포 분석에 의한 프로트롬빈 결합 분석
- 제조업체의 지침에 따라 단백질 라벨링 키트( 재료 표 참조)를 사용하여 소 프로트롬빈을 Alexa Fluor 488 염료와 접합합니다.
- 세척된 인간 혈소판에 2.5mM 칼슘(100μL 혈소판 현탁액에 0.5μL의 원료 CaCl2 0.5M 용액)을 보충합니다.
- 혈소판의 한 분획을 자극하지 않고 나머지 분획을 트롬빈(0.1 U/mL, 0.25 U/mL 또는 0.5 U/mL), 경련(20 ng/mL, 50 ng/mL 또는 100 ng/mL) 또는 이들의 조합으로 실온에서 15분 동안 자극합니다.
- 자극 후 100μL의 자극된 혈소판 현탁액에 AF488-conjugated bovine prothrombin(100μg/mL) 및 PE-Annexin V 및 APC anti-human CD62P 항체 각각 1μL를 추가합니다.
- 2% 포르말린을 같은 부피로 첨가하여 혈소판을 고정합니다.
- 혈소판에 대한 프로트롬빈 결합의 정량화를 위해 유세포 분석17 로 샘플을 분석합니다.
- 비정질 게이트를 그려 노이즈 및 다중 혈소판 입자와 분리된 혈소판을 둘러쌉니다.
- 각 샘플의 혈소판 게이트에서 10,000개의 이벤트에 대한 4사분면 로그 증폭을 사용하여 모든 형광 데이터를 수집합니다.
- PS 노출(Annexin V 결합), P-selectin(CD62P) 발현 및 AF488-프로트롬빈(프로트롬빈 결합)에 대한 형광 양성 또는 음성인 혈소판 영역을 그립니다.
- 모든 혈소판 사건의 비율과 프로트롬빈 결합에 대해 양성인 PS 노출(Annexin V 결합) 및 P-selectin(CD62P) 발현(procoagulant 혈소판) 모두에 대해 양성인 혈소판의 비율을 결정합니다.
7. 컨포칼 현미경에 의한 프로트롬빈 결합 분석
- 제조업체의 지침에 따라 단백질 라벨링 키트( 재료 표 참조)를 사용하여 소 프로트롬빈을 Alexa Fluor 488 염료와 접합합니다.
- 세척된 인간 혈소판에 2.5mM 칼슘(100μL 혈소판 현탁액에 0.5μL의 원료 CaCl2 0.5M 용액)을 보충합니다.
- 혈소판의 한 분획을 자극하지 않고 나머지 분획을 트롬빈(0.1 U/mL, 0.25 U/mL 또는 0.5 U/mL), 경련(20 ng/mL, 50 ng/mL 또는 100 ng/mL) 또는 이들의 조합으로 실온에서 15분 동안 자극합니다.
- 자극 후 100μL의 자극된 혈소판 현탁액에 AF488-conjugated bovine prothrombin(100μg/mL) 및 PE-Annexin V 및 APC anti-human CD62P 항체 각각 1μL를 추가합니다.
- 2% 포르말린을 같은 부피로 첨가하여 혈소판을 고정합니다.
- 고정된 혈소판을 폴리-D-라이신으로 코팅된 커버슬립에 펠릿화합니다.
- 페이드 방지 솔루션을 사용하여 현미경 슬라이드에 커버슬립을 장착합니다.
- 또는 습한 챔버에서 1시간 동안 콜라겐(100μg/mL)으로 커버슬립을 코팅합니다.
- PBS에서 0.5% BSA로 코팅된 커버슬립을 1시간 동안 차단합니다.
- 혈소판에 AF488-conjugated bovine prothrombin(100μg/mL) 및 PE-Annexin V 및 APC anti-human CD62P 항체 각각 1μL를 표시합니다.
- 라벨이 붙은 혈소판이 콜라겐으로 코팅된 커버슬립에 20분 동안 부착되도록 합니다.
- 부착 혈소판이 있는 커버슬립을 PBS로 세 번 세척합니다.
- 2% 파라포름알데히드로 커버슬립을 1시간 동안 고정합니다.
- 페이드 방지 솔루션을 사용하여 현미경 슬라이드에 커버슬립을 장착합니다.
- 컨포칼 현미경으로 63× 대물렌즈 배율로 슬라이드를 관찰합니다.
- 형광 정량화를 위해 피지 소프트웨어를 사용하여 이미지를 분석합니다.
8. 혈전 기반 혈소판 인지질 의존성 트롬빈 생성 분석
- 세척된 인간 혈소판에 2.5mM 칼슘(100μL의 혈소판 현탁액 중 0.5μL의 스톡 CaCl2 0.5M 용액)을 보충합니다.
- 혈소판의 한 분획을 자극하지 않고 나머지 분획을 트롬빈(0.1 U/mL, 0.25 U/mL 또는 0.5 U/mL), 경련(20 ng/mL, 50 ng/mL 또는 100 ng/mL) 또는 이들의 조합으로 실온에서 15분 동안 자극합니다.
- 처리된 혈소판 100μL를 37°C에서 5분 동안 사전 배양한 50μL의 통합 정상 혈장과 50μL의 저탁도 카올린 용액(20mg/mL)의 혼합물에 추가합니다.
- 혼합물에 5mM의 CaCl2 를 첨가합니다.
- 마이크로플레이트 리더의 탁도 측정으로 응고 형성을 모니터링하고 660nm에서 1시간 동안 60초마다 흡광도를 측정합니다.
결과
활성화된 혈소판의 일부는 포스파티딜세린(PS)과 P-셀렉틴의 표면 발현이 특징적으로 증가하면서 "응고제"로 변하는데, 이는 PS 노출에만 양성인 "자가사멸" 혈소판 및 P-셀렉틴 발현에 대해 양성인 "증식" 혈소판과 구별됩니다. 우리는 트롬빈이 FITC-anti-CD62P 항체 및 PE-Annexin V의 결합에 의해 검출된 P-selectin 및 PS 발현 모두에 대해 양성인 procoagulant 혈소판의 비율을 용량 의존적 증가를 유도한다는 것을 발견했습니다(그림 2). procoagulant platelets의 생성은 작용제에 의해 유도된 cytosolic calcium 상승에 따라 내부 미토콘드리아 막을 가로지르는 전기화학적 구배를 따라 미토콘드리아 칼슘 유입18,19 및 그에 따른 cyclophilin D (CypD) 의존성 미토콘드리아 투과성 전이 공극 (mPTP) 형성20에 의존합니다. 일관성으로, 트롬빈에 의한 프로응고제 활성의 증가는 각각 Rhod-2 및 Mitotracker Red 염료를 사용하여 측정한 바와 같이 미토콘드리아 칼슘의 증가(그림 3) 및 미토콘드리아 막 전위의 감소(그림 4)와 관련이 있었습니다. 자극된 혈소판은 Bax/Bak 축적을 포함한 세포사멸의 특징을 보인다21,22; 이것이 카스파제23,24를 활성화하고 PS 노출25에 기여하는지 여부는 여전히 논란의 여지가 있습니다. 혈소판의 트롬빈 자극은 caspase 8의 활성화와 관련이 있었지만 말단 caspases 3 및 7은 그렇지 않았으며(그림 5), 각각 FITC-IETD-FMK 및 apoptosis 검출 시약으로 분석했습니다.

그림 1: procoagulant 혈소판 분석. FITC-PAC1, APC-anti-CD62P 항체 및 PE-Annexin V를 각각 인테그린 활성화, P-셀렉틴 발현 및 PS 노출을 검출하기 위한 형광 프로브로 사용하여 유세포 분석을 통한 procoagulant 혈소판 분석을 보여주는 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
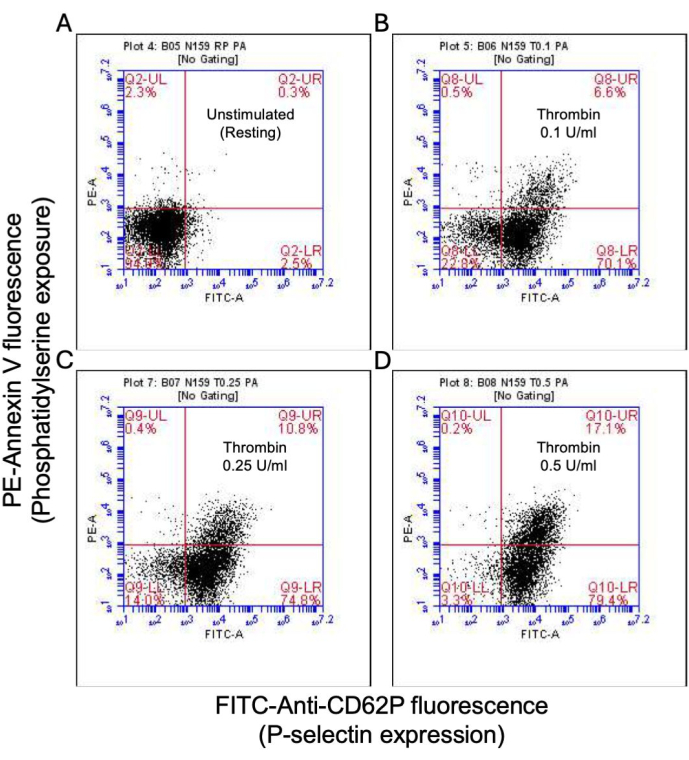
그림 2: 트롬빈 자극 시 혈소판에서 P-셀렉틴 발현 및 포스파티딜세린 노출. 유세포분석을 사용한 FITC-anti-CD62P 및 PE-Annexin V 형광에 의해 검출된 (B) 0.1 U/mL, (C) 0.25 U/mL 및 (D) 0.5 U/mL의 용량으로 트롬빈에 노출된 경우 (A) 자극되지 않은 혈소판에서 P-selectin 발현 및/또는 PS 노출에 대해 양성인 혈소판을 보여주는 대표적인 점도표. 괄호 안의 그림은 그림의 각 사분면에 있는 총 혈소판의 비율을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
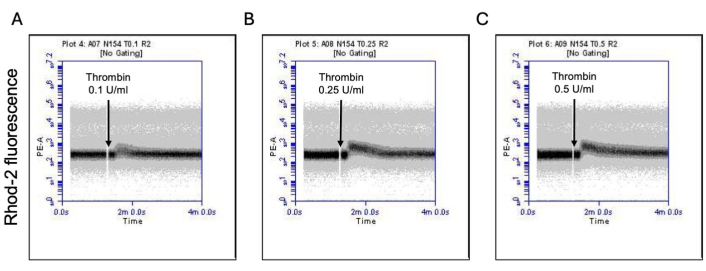
그림 3: 트롬빈 노출 시 혈소판 내 미토콘드리아 칼슘 수치의 시간에 따른 변화. 유세포 분석으로 검출된 (A) 0.1 U/mL, (B) 0.25 U/mL 및 (C) 0.5 U/mL의 용량으로 트롬빈에 노출되었을 때 혈소판의 미토콘드리아 칼슘 수치를 나타내는 Rhod-2 염료로 인한 형광의 시간에 따른 형광 변화를 보여주는 대표적인 밀도 플롯. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
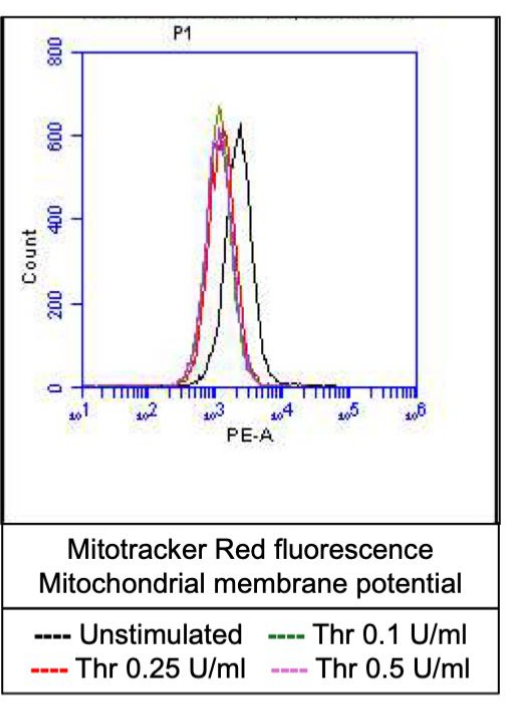
그림 4: 트롬빈 자극에 대한 혈소판의 미토콘드리아 막 전위. 이 그림은 미토콘드리아 표지 염료로 인한 형광을 나타내는 대표적인 히스토그램 오버레이를 보여주며, 유세포 분석으로 검출된 다양한 용량의 트롬빈에 노출되었을 때 혈소판의 미토콘드리아 막 전위를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
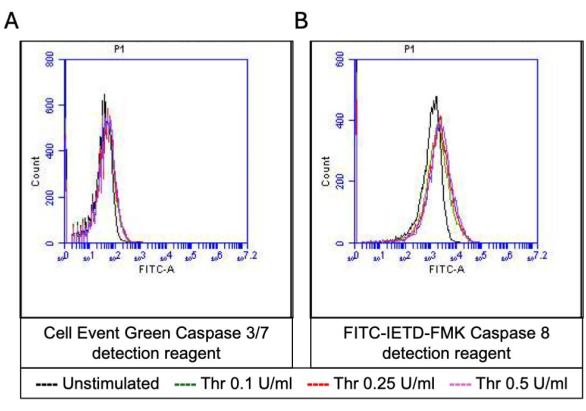
그림 5: 트롬빈 자극 시 혈소판에서 Caspase 3/7 및 Caspase 8 활성. (A) 세포사멸 검출 시약 및 (B) FITC-IETD-FMK로 인한 형광을 보여주는 대표적인 히스토그램 오버레이로, 유세포 분석으로 검출된 다양한 용량의 트롬빈에 노출되었을 때 혈소판에서 caspase 3/7 및 caspase 8 활성을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 마커 | Procoagulant 혈소판 | proaggregatory platelets (proaggregatory platelets) | 세포사멸 혈소판 |
| 인테그린 활성화(PAC1 바인딩) | 아니요 | 예 | 아니요 |
| 과립 분비 | 예 | 예 | 아니요 |
| (P-selectin 식) | |||
| PS 노출 | 예 | 아니요 | 예 |
| (부속서 V 바인딩) |
표 1: 자극 후 혈소판 집단을 식별하기 위한 유세포 분석 마커. 이 표는 트롬빈(thrombin) 및 콘경련신(convulxin)과 같은 강력한 작용제(agonist)로 혈소판을 자극한 후 나타나는 혈소판의 뚜렷한 집단을 검출하는 데 사용되는 유세포 분석 마커를 보여줍니다.
토론
응고혈소판은 자극 시 세포내 칼슘의 현저하고 지속적인 증가를 보여주지만(26), 이는 다른 기전을 통해 유도될 수 있다. 그들은 작용제에 의해 유도된 세포질 칼슘 상승에 따라 내부 미토콘드리아 막을 가로지르는 전기화학적 구배를 따라 가장 두드러지게 미토콘드리아 칼슘 유입18,19를 포함하여 별개의 매개체를 통해 콜라겐과 트롬빈을 사용한 강력한 작용제 자극에 의해 생성됩니다. 미토콘드리아 칼슘이 특정 임계값에 도달하면 cyclophilin D(CypD) 의존적 방식으로 미토콘드리아 투과성 전이 공극(mPTP) 형성을 활성화합니다20. 미토콘드리아가 칼슘으로 투과되어 더 이상 세포질 칼슘의 흡수원 역할을 할 수 없을 때, mPTP 형성 후 초극대 칼슘 신호가 관찰됩니다26. 지속적으로 높은 수준의 세포질 칼슘은 칼슘 의존성 인지질 스크램블라제 TMEM16F 활성화를 활성화하여 PS 노출을 유발합니다27,28. PS 노출은 인테그린 αIIbβ 3 의 불활성화를 동반하며, 인테그린 β3 세포질 꼬리의 칼파인 의존성 절단과 TMEM16F 의존성 인지질 스크램블링 자체를 포함하는 이중 메커니즘에 의해29,30. 따라서, procoagulant platelets는 proaggregatory platelets와 달리 비활성 integrin을 가지고 있습니다. 또한, PS 노출은 응고 인자의 결합을 위한 표면을 제공하여 테나아제(tenase) 및 프로트롬비나제 복합체(prothrombinase complex)의 조립을 촉진합니다3. 따라서 Procoagulant 혈소판은 응고를 극적으로 가속화합니다4.
PS 노출 및 그에 따른 procoagulant 활성은 활성화와 무관하게 내인성 세포사멸을 겪는 혈소판에서 scramblase XKR8의 카스파제 의존성 절단에 의해 유도될 수도 있습니다25,31. 자극된 혈소판은 Bax/Bak 축적21,22을 포함한 내인성 세포사멸의 특징을 나타내지만, 이것이 카스파제23,24를 활성화하고 PS 노출에 기여하는지 여부25 는 여전히 논란의 여지가 있습니다. TNFα 또는 FasL에 의한 외인성 세포사멸은 대부분의 성분이 존재하고 카스파제 8 활성화에 대한 일부 증거가 있음에도 불구하고 혈소판에서 보고되지 않았다32. 장기간의 자극에 따른 혈소판은 MLKL 매개 괴사증17을 거치며, 이는 CypD 또는 caspase33과 무관하게 PS 노출을 유도하는 것으로 알려져 있습니다.
본 연구는 PS 노출(Annexin V 결합), P-selectin(CD62P) 발현 및 integrin αIIbβ3 활성화(PAC1 결합)를 마커로 사용하여 procoagulant 혈소판을 검출하는 방법을 제공했습니다. 이러한 마커는 procoagulant platelets와 apoptotic 및 proaggregatory platelets를 효과적으로 구별하는 데 도움이 될 수 있습니다15. 그러나 annexin V 결합은 배지에 높은 칼슘 수치가 존재해야 합니다. 따라서 헤파린 또는 기타 트롬빈 억제제는 혈소판이 풍부한 혈장 또는 전혈 샘플을 사용할 때 사용해야 합니다. 또한, 피브린 중합 억제제 GPRP는 트롬빈이 이러한 샘플과 함께 작용제 중 하나로 사용되어야 할 때 사용됩니다34,35. 락타데린(Lactadherin) 또는 GSAO는 Annexin V의 대체 마커로 사용할 수 있지만 고유한 제한 사항이 있습니다. 락타데린은 PS에 특이적이지 않고 인테그린과 결합하지만36,37, GSAO는 상업적으로 이용 가능하지 않으며 연구 협력을 통해서만 공급될 수 있습니다38.
이 논문은 또한 미토콘드리아 칼슘 유입 및 미토콘드리아 투과성 전이 기공 형성(미토콘드리아 막 전위 손실)을 포함하여 PS 노출의 메커니즘을 조사하기 위한 보충 방법을 제공했습니다. 여기서 이러한 방법은 Fluo-4 및 Fluo-5N 염료를 사용한 세포질 칼슘 측정으로 보완될 수 있다는 점에 유의해야 합니다. 카스파제 활성화가 자극된 혈소판에서 PS 노출에 기여하는지 여부는 불분명하기 때문에 카스파제 8 및 카스파제 3/7 활성화 분석에 대한 프로토콜도 열거합니다. 혈소판의 진정한 "응고제" 특성은 응고 인자를 결합하고 트롬빈 생성을 촉진하는 능력에 의해서만 확인될 수 있습니다. 따라서, 본 논문에서 설명한 바와 같이 PS 노출(Annexin V 결합), P-selectin(CD62P) 발현 및 인테그린 αIIbβ3 활성화(PAC1 결합), 미토콘드리아 칼슘 유입, 미토콘드리아 막 전위, 응고 인자(prothrombin) 결합 및 혈소판 인지질 의존성 트롬빈 생성/응고와 함께 카스파아제 활성에 대한 철저한 연구가 procoagulant 혈소판의 포괄적인 분석을 위해 필요하고 충분할 것입니다.
공개
저자는 공개할 경쟁 이해관계가 없습니다.
감사의 말
Paresh P. Kulkarni와 Keith R. McCrae는 각각 VeloSano, Cleveland Clinic Foundation에서 자금을 지원하는 펠로우 및 파일럿 보조금 상을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
참고문헌
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유